N-炔丙胺衍生物的药物组合物的制作方法
本申请要求于2016年3月26日提交的印度临时申请案第in201641006786号的优先权,该案全部公开的内容援引加入本文。
本申请涉及用于治疗帕金森病的方法和组合物。该方法涉及向需要其的个体口服给药n-炔丙胺衍生物的口溶(mouth-dissolving)组合物。该方法和组合物提供n-炔丙胺衍生物的给药的方便和快速吸收,用于改善患者的依从性。
背景技术:
帕金森病(pd)是进行性疾病,起初可为轻度肢体僵硬和偶尔的震颤,在十年或更长时间段内发展为频繁震颤和记忆损伤,最终发展成无法控制的震颤和痴呆。帕金森病在世界范围影响约一千万人。该疾病导致缓慢增加的目的性运动的障碍。帕金森病被认为的病理生理学原因是基底神经节中产生多巴胺的细胞的进行性破坏,其包括黑质致密部(位于脑干中的基底核)。多巴胺神经元的损失导致乙酰胆碱的相对过量。
认为帕金森综合征是多巴胺缺乏的症状以及发现左旋多巴作为该疾病的治疗的重要药物是一系列相关基础和临床观察的合理结果,其作为药物治疗的基本原理。对pd患者在治疗的最初5到7年内可能进行适当的管理,在此之后,会出现一系列常见的衰弱并发症,统称为晚期运动波动(lmf)发生。因此,考虑到帕金森病的病因和进展的复杂性,有效治疗帕金森病会非常困难。
当前对pd的治疗包括药物、消融手术干预和/或神经刺激。药物治疗或疗法可包括左旋多巴;卡比多巴;羟苄丝肼;恩他卡朋;多巴胺激动剂,如罗替戈汀、普拉克索、罗匹尼罗、阿扑吗啡;单胺氧化酶-b(mao-b)抑制剂,如司来吉兰、雷沙吉兰、沙芬酰胺、反苯环丙胺;comt抑制剂,如恩他卡朋、托卡朋;和谷氨酸拮抗剂,如金刚烷胺。令人遗憾的是,这样的药物治疗常常随时间效力下降或变无效。pd患者可能需要组合多种药物,以延长药物治疗效果的时间。
据信,用左旋多巴这种最有效的抗帕金森病的药物治疗会有助于或甚至促进lmf的出现。多巴胺激动剂用作治疗的替代,但其不能给患者提供与左旋多巴相同程度的症状缓解。另外药物治疗极有可能引起不期望的身体副作用。例如,运动功能并发症是特别常见的副作用,如不可控无意运动(运动障碍)。
全身给药的抗胆碱药(如苯海索和邻甲苯海拉明)也已用于治疗帕金森病,且其通过减少脑中产生的乙酰胆碱的量起作用,从而纠正帕金森病中存在的多巴胺/乙酰胆碱的失衡。不幸的是,服用全身给药的抗胆碱药的患者约有70%产生严重的神经精神性副作用,包括幻觉、运动障碍的运动,以及由于广泛的抗胆碱药分布造成的其他影响,包括视觉影响、吞咽困难、口干及尿液潴留。此外,药物治疗会引起不期望的认知副作用,如意识错乱和/或幻觉。
在可行的治疗选择中,mao-b抑制剂延长了源自内源性与外源性两者的多巴胺的活性,这使得它们无论作为早期帕金森病的单一治疗还是作为正经历运动并发症的使用左旋多巴治疗的患者的辅助治疗,都成为选择。推荐选择性不可逆mao-b抑制剂是由于它们的安全性、耐受性及更易于临床操作。除了症状的益处外,实验数据表明mao-b抑制剂可通过mao-b抑制以及其他还未明确定义的机制保护神经。在美国批准使用的两种可用的mao-b抑制剂为n-炔丙胺衍生物:司来吉兰(甲基-(1-甲基-2-苯基-乙基)-丙-2-炔基-胺)和雷沙吉兰(n-炔丙基-1-(r)氨基茚满)。司来吉兰与雷沙吉兰都可以各种形式用于治疗帕金森病。司来吉兰可用作常规片剂、胶囊-
需要用于帕金森病的改进治疗,通过更方便的给药以及易于给药的剂型提供更佳的患者依从性。此外,临床研究已显示,多达82%的帕金森病患者吞咽困难,且许多这样的患者容易流口水。因此,如快速分散制剂的剂型是特别优选的,因为其会在口中快速崩解,从而使按剂量给药的困难最小化,使患者更易服用,且更便于护理人员给药。已报道了使用不同剂型治疗帕金森病。例如,us2015/031774、us2008/107729、us2004/091525、wo2009/02084和us2012/122993涉及口腔崩解或快速起作用的剂型。
对于帕金森病的治疗,在给药的前几个月中提供了最大的效果。然而,长时间服用抗帕金森病药物的患者易于产生“疗效减退(wearing-off)”效应(药物的效力倾向于随时间丧失)。因此,经常会必须随时间增加药物剂量。此外,随着药物剂量的增加,一些患者开始经历副作用,包括焦虑、激动、运动障碍、呕吐、低血压、幻觉和恶心,这进一步限制了治疗的选择。有时,还会经历“开关效应(on-offeffect)”,其中在一段时间症状变得断断续续且不可预测。此外,帕金森病状本身由于无意运动,导致握持和/或吞咽剂型的不适,这会严重损害患者的依从性。考虑到这样的因素,期望一种包含mao-b抑制剂(如n-炔丙胺衍生物)的制剂,其增加生物利用度且在具有相似的临床效益下能以比常规剂型低的剂量给药。这样的制剂会增加在用常规制剂初始治疗后报告有不良事件或是患有运动障碍或相关的吞咽困难的那些患者的依从性。
对于包含n-炔丙胺衍生物(如雷沙吉兰)的剂型,其为患者提供方便的给药且使得药物可靠且快速吸收,在本领域中仍然存在明显未被满足的临床需要。
因此,本申请涉及给药用于帕金森病的治疗的n-炔丙胺衍生物的方法,以及用于帕金森病的治疗的组合物,其提供在患者口腔中溶解/崩解的方便的口服剂型,且对需要口服药物但吞咽困难的患者尤其有用。
技术实现要素:
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比较低剂量的雷沙吉兰。
在又一实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约60%的剂量的雷沙吉兰。
在上述实施方案的一方面中,本发明的治疗患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的另一方面中,本发明的治疗患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰碱。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物具有不超过约6分钟的tlag。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物具有约5分钟的tlag。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约130pg.hr/ml的auc0-5分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约510pg.hr/ml的auc0-10分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约1530pg.hr/ml的auc0-20分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物表现出不超过约18分钟的tmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在向所述患者给药时表现出至少一种下列药代动力学参数:
(a)不超过约7900pg/ml的cmax;
(b)不超过约6300pg.hr/ml的auc0-t;或
(c)不超过约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约18分钟的tmax;
(c)不超过约7900pg/ml的cmax;
(d)不超过约130pg.hr/ml的auc0-5分钟;
(e)不超过约510pg.hr/ml的auc0-10分钟;
(f)不超过约1530pg.hr/ml的auc0-20分钟;
(g)不超过约6300pg.hr/ml的auc0-t;
(h)不超过约6400pg.hr/ml的auc0-∞;或
(i)不超过约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物当作为口服崩解剂型向所述患者给药时表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物口服给药。
在一个实施方案中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在口腔中在少于约60秒内溶解/崩解。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在口腔中在约2分钟内释放至少约70%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中当在20rpm和37℃下在5ml的ph6.75的模拟唾液中测量时,所述组合物在约2分钟内释放至少约70%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中当在20rpm和37℃下在5ml的ph6.75的模拟唾液中测量时,所述组合物在约5分钟内释放至少约90%的雷沙吉兰。
在上述实施方案的一方面中,本发明的雷沙吉兰或其药学上可接受的盐的口溶组合物包含低于或等于约1mg的雷沙吉兰。
在上述实施方案的一方面中,本申请的口溶组合物包含至少一种糖醇和至少一种水可溶胀的聚合物。
与本申请相关使用的糖醇的实例包括但不限于具有通式cnhn+2(oh)n的化合物,诸如甘露糖醇、麦芽糖醇、山梨糖醇、木糖醇、乳糖醇、赤藓糖醇、异麦芽酮糖醇(isomalt)、苏糖醇等及其混合物。可于本申请中使用的糖醇的量为组合物的约50重量%至约80重量%。
为了在口腔中溶解制剂,本申请的口溶组合物的一些实施方案包括水可溶胀的聚合物。与本申请相关使用的聚合物的实例包括但不限于水可溶胀的乙烯类聚合物,包括n-乙烯吡咯烷酮的聚合物,如交联聚维酮和共聚维酮;n-乙烯醇,如聚乙烯醇;n-乙酸乙烯酯,如聚乙酸乙烯酯等;或其共聚物或混合物。可于本申请中使用的水可溶胀的乙烯类聚合物的量为组合物的约0.2重量%至约5.0重量%。
在上述实施方案的一方面中,本申请的口溶组合物包含至少一种糖醇和至少一种水可溶胀的聚合物。
在上述实施方案的另一方面中,本申请的口溶组合物包含至少一种糖醇和两种水可溶胀的聚合物。
在上述实施方案的一方面中,本申请的口溶组合物包含重量比为约2:1至约49:1的糖醇和水可溶胀的聚合物。
本申请的口溶组合物任选地包含至少一种ph调节剂,如酸性ph调节剂。合适的ph调节剂的实例包括但不限于柠檬酸、酒石酸、马来酸、富马酸和琥珀酸等或其混合物;碱化剂,诸如葡甲胺、氢氧化钠、氢氧化钾、碳酸氢钠等或其混合物;以及缓冲剂,诸如磷酸盐缓冲液、乙酸盐缓冲液、硼酸盐缓冲液等或其混合物。这样的ph调节剂可以组合物的约5重量%至约7重量%的量存在。
在上述实施方案的一方面中,本申请的口溶组合物为包含n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐的组合物提供化学和物理稳定性,其不会改变初始形状、颜色、分析值或组合物特征,如本文中公开的杂质、药物浓度、外观等,其中,在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月,药物的存在量为初始规定量的至少约95%至约100%,且总杂质不超过约1.5%。
附图简述
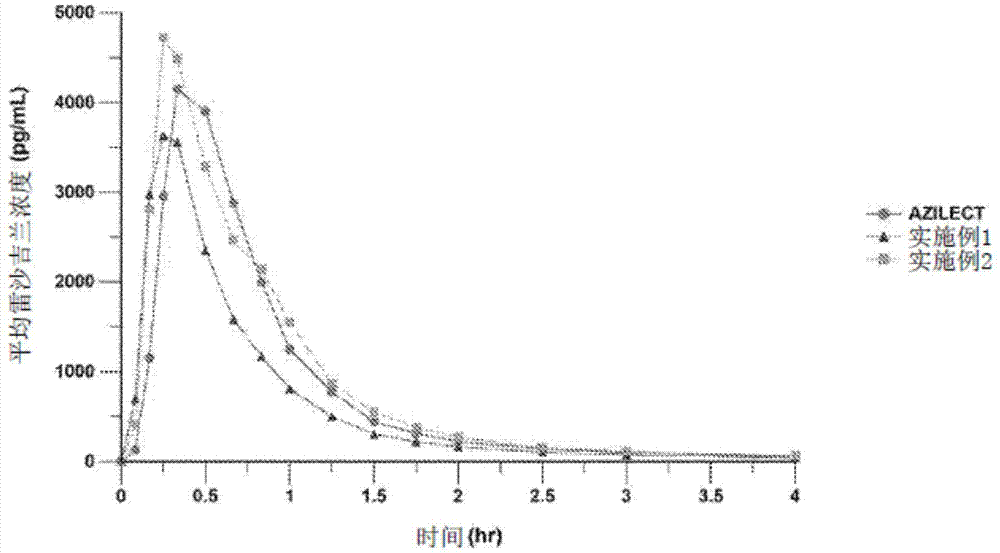
图1示出了将如实施例1-2中所述的本申请的示例性组合物相对于1mg
图2示出了将如实施例3中所述的本申请的示例性组合物相对于1mg
图3示出了将如实施例4中所述的本申请的示例性组合物相对于1mg
具体实施方式
在本文件中描述了本发明的一个或多个实施方案的具体内容。在研究本文件中提供的信息之后,对本文件中描述的实施方案以及其他实施方案的改进对于本领域普通技术人员而言是明显的。本文件中提供的信息,特别是示例性实施方案的具体细节,主要是用于清楚的理解,而不应被理解为任何不必要的限制。在有冲突的情况下,本文件的说明书(包括定义)会予以控制。
定义:本文所用术语具有以下含义:
术语“包含”意指所述的元件、或其在结构或功能上的等效物,以及未描述的任何其他一种或多种元件。术语“具有”和“包括”也应被解释为开放式的,除非本文另有说明。所用本文引用的范围都包括端点,包括引用两个值“之间”的范围的端点。
本文所用术语“一个”和“所述(该)”应被理解为包括复数以及单数,或除非在需要时另有清楚地提到。例如,提及“一种赋形剂”包括提及一种或多种这样的赋形剂。
如“约”、“至多”等的术语应解释为对术语或数值进行修饰以使其不是绝对的。这样的术语会由情形和它们所修饰的术语来限定,如同那些术语为本领域技术人员所理解的那样。这至少包括给定的用于测量数值的实验、技术或仪器的预期的实验误差、技术误差和仪器误差的程度。术语“约”用于通过规定给定的值可以“稍微高于”或“稍微低于”端值来提供数值范围端值的灵活性。作为例示,“约1至约5”的数值范围应解释为不仅包括约1至约5的明确指定的值,而且还包括所指出的范围内的各个值和子范围。因此,该数值范围包括各个值如2、3和4,以及子范围如1-3、2-4和3-5等,以及独立地包括1、2、3、4和5。这种相同的原则适用于仅引用一个数值作为最小值或最大值的范围。
如本文所用的,术语“至少”是指组合物中引用的物质存在所引用的最少量。
如本文所用的,术语“组合物”和“制剂”可互换使用且是指两个或更多个化合物、元件或分子的混合物。同样,术语“组合物”和“制剂”可用于指一种或多种活性剂与赋形剂或其他载体的混合物。
如本文所用,术语“口溶组合物”可包括以口服给药形式提供的一种或多种组合物或制剂,其中将所述组合物置于个体或患者的口腔中,所述组合物在口腔中溶解或崩解,便于剂量给药。这样的“口溶组合物”包括舌下片剂、快速崩解片剂、含服片剂、锭剂、囊形片剂、丸剂、薄片剂(wafer)、膜剂、散剂、颗粒剂、小袋剂等。
术语“崩解”在本领域中公知,且当组合物可完全崩解时,术语崩解不一定指组合物的完全溶解,但溶解的组合物(例如片剂、锭剂等)通常完全崩解。
术语“溶解”在本领域中也公知。组合物可完全溶解,其中存在从固体状态向其中组合物完全呈溶液的转变。术语溶解并不一定指完全溶解的组合物,且可指其中组合物部分溶解的状态。
术语“药”和“药物”可互换使用以指药理学活性的物质或组合物。这些专门术语在药学和医学领域中是公知的。
本文中所用的术语药物的“治疗有效量”或“有效量”是指无毒但足够量的药物,以在治疗已知该药物有效的病况中达到治疗结果。在此情形下,有效量为n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐的量大约小于或等于约1mg,其足以治疗患帕金森病或其相关病况的患者,但在合理的医学判断范围内足够低,从而避免了严重的副作用(在合理的益处/风险比下)。n-炔丙胺衍生物的有效量会随以下条件而改变:要治疗的特定症况、被治疗的患者的年龄和身体状况、病况的严重性、治疗持续时间、同时治疗的性质以及主治医师的知识和专长范围内的类似因素。
如本文所用的,术语“患者”是指给药对象。患者可以是人类或非人类,因此本文中所公开的组合物和方法可用于人类治疗和兽医治疗用途两者。如本文所用的,术语“给药”是指向患者提供组合物的行为,例如口服给药。
如本文所用的术语“赋形剂”或“载体”是指适用于制备本文所公开的组合物或制剂的任何药学上可接受的物质,其无毒并且不以有害方式与组合物的其它组分相互作用。
如本文所用的术语“帕金森病”是指包括但不限于震颤、运动徐缓、肌强直或姿势障碍。该术语还指类似帕金森病的综合征,但其可能是或可能不是由帕金森病引起,诸如由某些抗精神病药引起的类似帕金森病的副作用,以及其他这样的综合征。
如本文所用的术语“n-炔丙胺衍生物”意在包括但不限于司来吉兰(甲基-(1-甲基-2-苯基-乙基)-丙-2-炔基-胺)、雷沙吉兰(n-炔丙基-1-(r)氨基茚满)以及n-炔丙胺衍生物的药理学活性衍生物,包括基本上纯形式的n-炔丙胺的单一对映异构体(右旋和左旋对映异构体)和其药学上可接受的盐两者、n-炔丙胺的对映异构体与其药学上可接受的盐的混合物(以任意比率)以及n-炔丙胺与其药学上可接受的盐的活性代谢物。用于组合物中的n-炔丙胺的固态形式并不是关键的。例如,n-炔丙胺可以是无定形或结晶的。
如本文所用的术语“药学上可接受的盐”包括在合理医学判断范围内,适用于与人和低等动物的组织接触而没有不适当毒性、刺激、变态反应等的盐,其在本领域中公知。盐可以在最终分离和纯化本发明化合物期间原位制备,或者通过使具有游离碱官能团的药学活性物质与合适的有机酸或无机酸反应单独地制备。药学上可接受的盐的实例包括但不限于任何选自以下的n-炔丙胺的盐或共结晶:甲磺酸盐、柠檬酸盐、酒石酸盐、富马酸盐、苯磺酸盐、乙基磺酸盐、硫酸盐、盐酸盐等。盐可以为溶剂合物、水合物、半水合物或无水形式。
如本文所用的术语“tlag”是指给药组合物与首次观察到血浆药物浓度之间的时间延迟,其在定量限度内。
如本文所用的术语“d(90)”是指组合物中存在的90%颗粒具有小于约250μm的直径。
如本文所用的术语“d(50)”是指组合物中存在的50%颗粒具有小于约75μm的直径。
术语“cmax”在本领域中公知,其指药代动力学参数观察到的最高浓度,出现在tmax。术语“tmax”也在本领域中公知,其指在给药后观察到最高浓度的时间。
如本文所用的术语“auc0-t”是指从给药时间(0)至观察时间(t)的曲线下面积(auc),为本领域普通技术人员公知的药代动力学参数。相应地,术语“auc0-reftmax”是指从给药时间至观察到最高浓度的时间的auc。
如本文所用的术语“稳定的”是指包括n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐的本发明的药物组合物的化学和物理稳定性,其不会改变初始形状、颜色、分析值和组合物特征,如本文中公开的杂质、药物浓度、外观等,其中,在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月,药物的存在量为初始规定量的至少约95%至约100%,且总杂质不超过约1.5%。
如本文所用的术语“市售的雷沙吉兰组合物”是指
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药n-炔丙胺衍生物或其药学上可接受的盐的口溶组合物。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药n-炔丙胺衍生物或其药学上可接受的盐的口溶组合物,其中所述组合物与市售的n-炔丙胺衍生物组合物相比包含较低剂量的n-炔丙胺衍生物。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比较低剂量的雷沙吉兰。
在上述实施方案的一方面中,本发明的治疗患者帕金森病的方法包括给药较低剂量的雷沙吉兰,其中所述较低剂量为与市售的雷沙吉兰组合物相比低约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%或60%的雷沙吉兰。
在一个实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约10%的剂量的雷沙吉兰。
在另一实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约20%的剂量的雷沙吉兰。
在另一实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约30%的剂量的雷沙吉兰。
在另一实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约40%的剂量的雷沙吉兰。
在另一实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约50%的剂量的雷沙吉兰。
在另一实施方案中,本申请涉及治疗患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含与市售的雷沙吉兰组合物相比低约60%的剂量的雷沙吉兰。
在上述实施方案的一方面中,本发明的治疗患者帕金森病的方法包括向患者给药n-炔丙胺衍生物或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的n-炔丙胺衍生物或其药学上可接受的盐。
在上述实施方案的一方面中,本发明的治疗患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的另一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于约1mg的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的又一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约1.0mg、0.9mg、0.8mg、0.7mg、0.6mg、0.5mg、0.4mg或0.3mg的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的又一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约0.9mg、0.8mg、0.7mg、0.6mg、0.5mg、0.4mg或0.3mg的雷沙吉兰碱。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药n-炔丙胺衍生物或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约6分钟的tlag。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约6分钟的tlag。
在上述实施方案的另一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药n-炔丙胺衍生物或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约5分钟的tlag。
在上述实施方案的另一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约5分钟的tlag。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约18分钟的tmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约12分钟至约18分钟的tmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约7900pg/ml的cmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约3420pg/ml至约7900pg/ml的cmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约130pg.hr/ml的auc0-5分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约60pg.hr/ml至约130pg.hr/ml的auc0-5分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约510pg.hr/ml的auc0-10分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物表现出约175pg.hr/ml至约510pg.hr/ml的auc0-10分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约1530pg.hr/ml的auc0-20分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约1000pg.hr/ml至约1530pg.hr/ml的auc0-20分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约6300pg.hr/ml的auc0-t。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约3200pg.hr/ml至约6300pg.hr/ml的auc0-t。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约6400pg.hr/ml的auc0-∞。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约2200pg.hr/ml至约6400pg.hr/ml的auc0-∞。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出不超过约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出至少一种下列药代动力学参数:
(a)不超过约7900pg/ml的cmax;
(b)不超过约6300pg.hr/ml的auc0-t;或
(c)不超过约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出至少一种下列药代动力学参数:
(a)约3420pg/ml至约7900pg/ml的cmax;
(b)约3200pg.hr/ml至约6300pg.hr/ml的auc0-t;或
(c)约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约18分钟的tmax;
(c)不超过约7900pg/ml的cmax;
(d)不超过约130pg.hr/ml的auc0-5分钟;
(e)不超过约510pg.hr/ml的auc0-10分钟;
(f)不超过约1530pg.hr/ml的auc0-20分钟;
(g)不超过约6300pg.hr/ml的auc0-t;
(h)不超过约6400pg.hr/ml的auc0-∞;或
(i)不超过约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约18分钟的tmax;
(c)约3420pg/ml至约7900pg/ml的cmax;
(d)约60pg.hr/ml至约130pg.hr/ml的auc0-5分钟;
(e)约175pg.hr/ml至约510pg.hr/ml的auc0-10分钟;
(f)约1000pg.hr/ml至约1530pg.hr/ml的auc0-20分钟;
(g)约3200pg.hr/ml至约6300pg.hr/ml的auc0-t;
(h)约2200pg.hr/ml至约6400pg.hr/ml的auc0-∞;或
(i)约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出至少一种下列药代动力学参数:
(a)约3420pg/ml至约7900pg/ml的cmax;
(b)约3200pg.hr/ml至约6300pg.hr/ml的auc0-t;或
(c)约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约18分钟的tmax;
(c)约3420pg/ml至约7900pg/ml的cmax;
(d)约60pg.hr/ml至约130pg.hr/ml的auc0-5分钟;
(e)约175pg.hr/ml至约510pg.hr/ml的auc0-10分钟;
(f)约1000pg.hr/ml至约1530pg.hr/ml的auc0-20分钟;
(g)约3200pg.hr/ml至约6300pg.hr/ml的auc0-t;
(h)约2200pg.hr/ml至约6400pg.hr/ml的auc0-∞;或
(i)约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约18分钟的tmax;
(c)不超过约6600pg/ml的cmax;
(d)不超过约80pg.hr/ml的auc0-5分钟;
(e)不超过约410pg.hr/ml的auc0-10分钟;
(f)不超过约1370pg.hr/ml的auc0-20分钟;
(g)不超过约5010pg.hr/ml的auc0-t;
(h)不超过约5090pg.hr/ml的auc0-∞;或
(i)不超过约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约18分钟的tmax;
(c)约3420pg/ml至约6600pg/ml的cmax;
(d)约60pg.hr/ml至约80pg.hr/ml的auc0-5分钟;
(e)约130pg.hr/ml至约410pg.hr/ml的auc0-10分钟;
(f)约1000pg.hr/ml至约1370pg.hr/ml的auc0-20分钟;
(g)约2220pg.hr/ml至约5010pg.hr/ml的auc0-t;
(h)约2140pg.hr/ml至约5090pg.hr/ml的auc0-∞;或
(i)约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且经舌下给药表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约18分钟的tmax;
(c)约3420pg/ml至约7900pg/ml的cmax;
(d)约60pg.hr/ml至约130pg.hr/ml的auc0-5分钟;
(e)约175pg.hr/ml至约510pg.hr/ml的auc0-10分钟;
(f)约1000pg.hr/ml至约1530pg.hr/ml的auc0-20分钟;
(g)约3200pg.hr/ml至约6300pg.hr/ml的auc0-t;
(h)约2200pg.hr/ml至约6400pg.hr/ml的auc0-∞;或
(i)约770pg.hr/ml至约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于1mg的雷沙吉兰或其药学上可接受的盐,且经舌下给药表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约18分钟的tmax;
(c)不超过约6600pg/ml的cmax;
(d)不超过约80pg.hr/ml的auc0-5分钟;
(e)不超过约410pg.hr/ml的auc0-10分钟;
(f)不超过约1370pg.hr/ml的auc0-20分钟;
(g)不超过约5010pg.hr/ml的auc0-t;
(h)不超过约5090pg.hr/ml的auc0-∞;或
(i)不超过约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约0.6mg的雷沙吉兰碱,且经舌下给药表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约18分钟的tmax;
(c)不超过约6600pg/ml的cmax;
(d)不超过约80pg.hr/ml的auc0-5分钟;
(e)不超过约410pg.hr/ml的auc0-10分钟;
(f)不超过约1370pg.hr/ml的auc0-20分钟;
(g)不超过约5010pg.hr/ml的auc0-t;
(h)不超过约5090pg.hr/ml的auc0-∞;或
(i)不超过约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约0.6mg的雷沙吉兰碱,且经舌下给药表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约15分钟的tmax;
(c)不超过约6600pg/ml的cmax;
(d)不超过约80pg.hr/ml的auc0-5分钟;
(e)不超过约410pg.hr/ml的auc0-10分钟;
(f)不超过约1370pg.hr/ml的auc0-20分钟;
(g)不超过约5010pg.hr/ml的auc0-t;
(h)不超过约5090pg.hr/ml的auc0-∞;或
(i)不超过约1370pg.hr/ml的auc0-reftmax。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约1mg的雷沙吉兰或其药学上可接受的盐,且当作为口服崩解剂型给药时表现出至少一种下列药代动力学参数:
(a)不超过约6分钟的tlag;
(b)不超过约18分钟的tmax;
(c)不超过约7900pg/ml的cmax;
(d)不超过约130pg.hr/ml的auc0-5分钟;
(e)不超过约510pg.hr/ml的auc0-10分钟;
(f)不超过约1530pg.hr/ml的auc0-20分钟;
(g)不超过约6300pg.hr/ml的auc0-t;或
(h)不超过约6390pg.hr/ml的auc0-∞。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约1mg的雷沙吉兰或其药学上可接受的盐,且当作为口服崩解剂型给药时表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约18分钟的tmax;
(c)约5840pg/ml至约7900pg/ml的cmax;
(d)约95pg.hr/ml至约130pg.hr/ml的auc0-5分钟;
(e)约380pg.hr/ml至约510pg.hr/ml的auc0-10分钟;
(f)约1130pg.hr/ml至约1530pg.hr/ml的auc0-20分钟;
(g)约4650pg.hr/ml至约6300pg.hr/ml的auc0-t;或
(h)约4720pg.hr/ml至约6390pg.hr/ml的auc0-∞。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约1mg的雷沙吉兰碱,且当作为口服崩解剂型给药时表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约18分钟的tmax;
(c)约5840pg/ml至约7900pg/ml的cmax;
(d)约95pg.hr/ml至约130pg.hr/ml的auc0-5分钟;
(e)约380pg.hr/ml至约510pg.hr/ml的auc0-10分钟;
(f)约1130pg.hr/ml至约1530pg.hr/ml的auc0-20分钟;
(g)约4650pg.hr/ml至约6300pg.hr/ml的auc0-t;或
(h)约4720pg.hr/ml至约6390pg.hr/ml的auc0-∞。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约1mg的雷沙吉兰碱,且当作为口服崩解剂型给药时表现出至少一种下列药代动力学参数:
(a)约2分钟至约6分钟的tlag;
(b)约12分钟至约15分钟的tmax;
(c)约5840pg/ml至约7900pg/ml的cmax;
(d)约95pg.hr/ml至约130pg.hr/ml的auc0-5分钟;
(e)约380pg.hr/ml至约510pg.hr/ml的auc0-10分钟;
(f)约1130pg.hr/ml至约1530pg.hr/ml的auc0-20分钟;
(g)约4650pg.hr/ml至约6300pg.hr/ml的auc0-t;或
(h)约4720pg.hr/ml至约6390pg.hr/ml的auc0-∞。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出与市售的雷沙吉兰组合物相比约3.0倍更高的auc0-5分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出与市售的雷沙吉兰组合物相比约3.0倍更高的auc0-5分钟。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出与市售的雷沙吉兰组合物相比约3.0至约7.0倍更高的auc0-10分钟。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出与市售的雷沙吉兰组合物相比约3.0至约7.0倍更高的auc0-10分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出与市售的雷沙吉兰组合物相比约3.0倍更高的auc0-10分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出与市售的雷沙吉兰组合物相比约3.0倍更高的auc0-10分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物当作为口服崩解剂型给药时表现出与市售的雷沙吉兰组合物相比约7.0倍更高的auc0-10分钟。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且当作为口服崩解剂型给药时表现出与市售的雷沙吉兰组合物相比约7.0倍更高的auc0-10分钟。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,经给药表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物经给药表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于1mg的雷沙吉兰或其药学上可接受的盐,且经给药表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者舌下给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含0.6mg的雷沙吉兰碱,且经给药表现出与包含1.0mg的雷沙吉兰碱的市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物当作为口服崩解剂型给药时表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于1mg的雷沙吉兰或其药学上可接受的盐,且当作为口服崩解剂型给药时表现出与市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含约1mg的雷沙吉兰碱,且当作为口服崩解剂型给药时表现出与包含1.0mg的雷沙吉兰碱的市售的雷沙吉兰组合物的生物等效性,且所述生物等效性由以下建立:(a)平均cmax的90%的置信区间为80%至125%,(b)平均auc0-t的90%的置信区间为80%至125%,且(c)平均auc0-∞的90%的置信区间为80%至125%。
在上述实施方案的一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药n-炔丙胺衍生物或其药学上可接受的盐的口溶组合物,其中所述组合物口服给药。
在上述实施方案的另一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药包含n-炔丙胺衍生物如雷沙吉兰或司来吉兰或者其药学上可接受的盐的口溶组合物,其中所述组合物口服给药。
在上述实施方案的一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物口服给药。
在上述实施方案的一方面中,本申请中使用的雷沙吉兰或其药学上可接受的盐包括但不限于利扎曲普坦的药学上可接受的、药理学活性衍生物,包括基本上纯形式的雷沙吉兰的单一对映异构体(右旋和左旋对映异构体)和其药学上可接受的盐两者、雷沙吉兰的对映异构体与其药学上可接受的盐的混合物(以任意比率)以及雷沙吉兰与其药学上可接受的盐的活性代谢物。组合物中使用的雷沙吉兰的固态形式并不是关键的。例如,雷沙吉兰可以是无定形或结晶的。药学上可接受的盐的实例包括但不限于任何选自以下的雷沙吉兰的盐或共结晶:甲磺酸盐、盐酸盐、氢溴酸盐、柠檬酸盐、苯甲酸盐、硫酸盐、磷酸盐、马来酸盐、甲酸盐、乙酸盐、硝酸盐、琥珀酸盐等。盐可以为溶剂合物、水合物、半水合物或无水形式。本发明的组合物中使用的药学上可接受的雷沙吉兰盐的量等效于或少于约1mg的雷沙吉兰碱。例如,0.6mg的雷沙吉兰碱等效于0.936mg雷沙吉兰甲磺酸盐。
在一个实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物与市售的雷沙吉兰组合物相比具有提高的生物利用度。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物与市售的雷沙吉兰组合物相比具有提高的生物利用度。
在上述实施方案的一方面中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在口腔中在少于约60秒、50秒、40秒、30秒或20秒内溶解/崩解。
在一个实施方案中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在口腔中在少于约60秒内溶解/崩解。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在口腔中在约2分钟内释放至少约70%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物在口腔中在约5分钟内释放至少约90%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中当在20rpm和37℃下在5ml的ph6.75的模拟唾液中测量时,所述组合物在约2分钟内释放至少约70%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中当在20rpm和37℃下在5ml的ph6.75的模拟唾液中测量时,所述组合物在约5分钟内释放至少约90%的雷沙吉兰。
在上述实施方案的一方面中,本发明的雷沙吉兰或其药学上可接受的盐的口溶组合物包含低于或等于约1mg的雷沙吉兰碱。
在上述实施方案的一方面中,本发明的雷沙吉兰或其药学上可接受的盐的口溶组合物包含低于约1.0mg、0.9mg、0.8mg、0.7mg、0.6mg、0.5mg、0.4mg或0.3mg的雷沙吉兰。
在上述实施方案的一方面中,本发明的雷沙吉兰或其药学上可接受的盐的口溶组合物包含约0.8mg、0.6mg或0.4mg的雷沙吉兰碱。
在上述实施方案的一方面中,本发明的雷沙吉兰或其药学上可接受的盐的口溶组合物包含约1mg的雷沙吉兰。
在一个实施方案中,本发明的治疗需要其的患者帕金森病的方法包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且在口腔中在少于约60秒内溶解/崩解。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且在口腔中在约2分钟内释放至少约70%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且在口腔中在约5分钟内释放至少约90%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且当在20rpm和37℃下在5ml的ph6.75的模拟唾液中测量时在约2分钟内释放至少约70%的雷沙吉兰。
在另一实施方案中,本申请涉及雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐,且当在20rpm和37℃下在5ml的ph6.75的模拟唾液中测量时在约5分钟内释放至少约90%的雷沙吉兰。
为了在口腔中溶解制剂,本申请的口溶组合物包含至少一种糖醇。本申请中使用的一些糖醇的实例包括但不限于具有通式cnhn+2(oh)n的化合物,诸如甘露糖醇、麦芽糖醇、山梨糖醇、木糖醇、乳糖醇、赤藓糖醇、异麦芽酮糖醇、苏糖醇等及其混合物。可于本申请中使用的糖醇的量为组合物的约50重量%至约80重量%。
为了在口腔中溶解制剂,本申请的口溶组合物包含水可溶胀的聚合物。于本申请中使用的这样的聚合物的一些实例包括但不限于水可溶胀的乙烯类聚合物,如n-乙烯吡咯烷酮的聚合物,诸如交联聚维酮和共聚维酮;n-乙烯醇,如聚乙烯醇;n-乙酸乙烯酯,如聚乙酸乙烯酯等或其共聚物或混合物。这样的水可溶胀的乙烯类聚合物的存在量为组合物的约0.2重量%至约5.0重量%。
在上述实施方案的一方面中,本申请的口溶组合物包含至少一种糖醇和至少一种水可溶胀的聚合物。
在上述实施方案的另一方面中,本申请的口溶组合物包含至少一种糖醇和两种水可溶胀的聚合物。
在上述实施方案的一方面中,本申请的口溶组合物包含以约2:1至约49:1的重量比存在的糖醇和水可溶胀的聚合物。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含治疗有效量的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少一种水可溶胀的聚合物。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含治疗有效量的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少两种水可溶胀的聚合物。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含治疗有效量的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少一种水可溶胀的聚合物,且所述糖醇和水可溶胀的聚合物以约2:1至约49:1的重量比存在。
在一个实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少一种水可溶胀的聚合物。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少两种水可溶胀的聚合物。
在上述实施方案的一方面中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少一种水可溶胀的聚合物,且所述糖醇和水可溶胀的聚合物以约2:1至约49:1的重量比存在。
在另一实施方案中,本申请涉及治疗需要其的患者帕金森病的方法,其包括向患者给药雷沙吉兰或其药学上可接受的盐的口溶组合物,其中所述组合物包含低于或等于约1mg的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少两种水可溶胀的乙烯类聚合物。
在上述实施方案的一方面中,本申请的口溶组合物包含雷沙吉兰颗粒和一种或多种药学上可接受的赋形剂。
在上述实施方案的一方面中,其中所述雷沙吉兰颗粒具有小于约250μm的d(90)尺寸。
在上述实施方案的另一方面中,其中所述雷沙吉兰颗粒具有约100μm至约250μm的d(90)尺寸。
在上述实施方案的一方面中,其中所述雷沙吉兰颗粒具有小于约75μm的d(50)尺寸。
在上述实施方案的另一方面中,其中所述雷沙吉兰颗粒具有约10μm至约75μm的d(50)尺寸。
在上述实施方案的一方面中,本申请的口溶组合物可包含多孔颗粒,其中这样的颗粒在组合物中提供空隙或细微空间,其通常使得唾液或水能渗入组合物,并通过改善组合物经口腔崩解来加速药物的释放。当测量关于空隙空间与总体积的比率时,本发明组合物的颗粒的孔隙率为至少约30%。
如本文中所用的术语“孔隙率”以及“孔隙率%”是指组合物的颗粒中的空隙或细微空间,其不影响所述组合物的内部或外部尺寸,本文定义的孔隙率如下表示:
孔隙率=(总体积-真实体积)/总体积
口溶组合物不应非常坚硬但应具有足够的断裂强度以使得方便给药。同时,其应当便于从包装中操作/移除,而不损害剂量单位。本发明的组合物的断裂强度为约10n至约40n,且脆碎度小于1.0%。
在一个实施方案中,本申请涉及口溶组合物,其包含治疗有效量的雷沙吉兰或其药学上可接受的盐的颗粒和一种或多种药学上可接受的赋形剂,其中所述组合物具有约10n至约40n的断裂强度。
在另一实施方案中,本申请涉及口溶组合物,其包含治疗有效量的雷沙吉兰或其药学上可接受的盐的颗粒和一种或多种药学上可接受的赋形剂,其中所述组合物具有小于1.0%的脆碎度。
如本文中所用的术语“堆密度”是指置于量筒内并测量体积和重量的颗粒的称重的量的密度。堆密度可如下表达:
堆密度=颗粒重量/封装体积
本文中所用术语“振实密度”是指置于量筒内并轻叩量筒直至注意到体积不再进一步变化的称重的量的密度。振实密度可如下表达:
振实密度=颗粒重量/振实后的封装体积
在上述实施方案的另一方面中,本申请的口溶组合物包含雷沙吉兰或其药学上可接受的盐的颗粒,其中所述颗粒具有小于约0.5gm/ml的堆密度,且其中所述颗粒具有小于约0.7gm/ml的振实密度。
本申请的口溶组合物任选地包含至少一种ph调节剂,其选自以下:酸性ph调节剂,诸如柠檬酸、酒石酸、马来酸、富马酸、琥珀酸、马来酸;碱化剂,诸如葡甲胺、氢氧化钠、氢氧化钾、碳酸氢钠;或者缓冲剂,诸如磷酸盐缓冲液、乙酸盐缓冲液、硼酸盐缓冲液等或其混合物。这样的ph调节剂可以药物组合物的约5重量%至约7重量%的量存在。
本申请的口溶组合物包含至少一种ph调节剂,其选自以下:酸性ph调节剂,诸如柠檬酸、酒石酸、马来酸、富马酸、琥珀酸、马来酸;碱化剂,诸如葡甲胺、氢氧化钠、氢氧化钾、碳酸氢钠;或者缓冲剂,诸如磷酸盐缓冲液、乙酸盐缓冲液、硼酸盐缓冲液等或其混合物。这样的ph调节剂可以药物组合物的约5重量%至约7重量%的量存在。
本申请的口溶组合物还包含药学上可接受的赋形剂,其选自稀释剂、滑润剂、助流剂、甜味剂、防腐剂、抗氧化剂、溶剂诸如水等或其混合物。
可于本申请中使用的合适的稀释剂的实例包括但不限于纤维素衍生物,诸如甲基纤维素、羧甲基纤维素、微晶纤维素等或其混合物。这样的稀释剂以药物组合物的约10重量%至约20重量%的量存在。
可用于制备本发明的口溶组合物的其他合适的药学上可接受的赋形剂为本领域技术人员已知的任何赋形剂,其描述于美国药学协会的药学赋形剂手册(1986)(handbookofpharmaceuticalexcipients,americanpharmaceuticalassociation(1986))中,援引加入本文。
在一个实施方案中,本申请的口溶组合物在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月是稳定的。
在上述实施方案的一方面中,本申请的口溶组合物为包含n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐的组合物提供化学和物理稳定性,其不会改变初始形状、颜色、分析值和组合物特征,如本文中公开的杂质、药物浓度、外观等,其中,在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月,药物的存在量为初始规定量的至少约95%至约100%,且总杂质不超过约1.5%。
在一个实施方案中,本申请的口溶组合物包含治疗有效量的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少一种水可溶胀的聚合物,其中所述组合物在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月是稳定的。
在另一实施方案中,本申请的口溶组合物包含治疗有效量的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少两种水可溶胀的聚合物,其中所述组合物在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月是稳定的。
在另一实施方案中,本申请的口溶组合物包含治疗有效量的雷沙吉兰或其药学上可接受的盐、至少一种糖醇和至少两种水可溶胀的乙烯类聚合物,其中所述组合物在25℃/60%相对湿度(rh)或40℃/75%相对湿度(rh)下经储存至少约3个月是稳定的。
在上述实施方案的一方面中,本申请的口溶组合物可以本领域中已知的任何合适的包装材料包装,这样的包装材料能确保所述组合物和n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐在储存、运送和给药期间的稳定性。
在上述实施方案的一方面中,本申请的口溶组合物可使用选自以下的合适的包装材料包装:高密度聚乙烯(hdpe)容器、铝-铝(alu-alu)泡罩包装或聚氯乙烯-聚偏二氯乙烯(pvc-pvdc)泡罩包装等材料。
在一个实施方案中,本申请涉及口溶组合物,其包括制备n-炔丙胺衍生物如雷沙吉兰或其药学上可接受的盐和一种或多种药学上可接受的赋形剂的的颗粒的方法,该方法包括本领域技术人员已知的任何方法,诸如但不限于在常规包衣盘或流化床设备(诸如wurster或glatt)中将药物的悬浮液或分散液喷涂至糖醇,或者用糖醇造粒;然后当达到期望的颗粒尺寸时干燥颗粒。
在上述实施方案的一方面中,本申请的口溶组合物包括制备颗粒的方法,其包括以下步骤:(a)制备治疗有效量的n-炔丙胺衍生物或其药学上可接受的盐与所需量的糖醇和水可溶胀的乙烯类聚合物的混合物;(b)将所需量的糖醇和任选的ph调节剂与(a)的混合物造粒;(c)干燥(b)的颗粒并制成期望的组合物。
在上述实施方案的一方面中,本申请的口溶组合物包括制备颗粒的方法,其包括以下步骤:(a)制备治疗有效量的雷沙吉兰或其药学上可接受的盐与所需量的至少一种糖醇和至少一种水可溶胀的乙烯类聚合物的混合物;(b)将所需量的糖醇和任选的ph调节剂与(a)的混合物造粒;(c)干燥(b)的颗粒并制成期望的组合物。
在上述实施方案的一方面中,本申请的口溶组合物包括制备颗粒的方法,其包括以下步骤:(a)制备治疗有效量的雷沙吉兰或其药学上可接受的盐与所需量的至少一种糖醇和至少两种水可溶胀的乙烯类聚合物的混合物;(b)将所需量的糖醇和任选的ph调节剂与(a)的混合物造粒;(c)干燥(b)的颗粒并制成期望的组合物。
在上述实施方案的一方面中,本申请的口溶组合物可制成固体剂型,如(但不限于)舌下片剂、口腔崩解片剂、含服片剂、口服片剂、锭剂、囊形片剂、丸剂、散剂、颗粒剂、小袋剂、膜剂等。
在上述实施方案的一方面中,本申请涉及舌下片剂形式的口溶组合物,其包含治疗有效量的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的另一方面中,本申请涉及含服片剂形式的口溶组合物,其包含治疗有效量的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的又一方面中,本申请涉及口腔崩解片剂形式的口溶组合物,其包含治疗有效量的雷沙吉兰或其药学上可接受的盐。
在上述实施方案的一方面中,本申请的口溶组合物可与食物或不与食物一起、伴随一口液体一起给药。
在上述实施方案的另一方面中,本申请的口溶组合物可与食物或不与食物一起、且不用一口液体一起给药。
在上述实施方案的又一方面中,本申请的口溶组合物可与食物或不与食物一起、并和一口液体一起给药。其中所述液体选自水或食物分散液,如调味汁、浓汤、果酱或食物糖浆。
在上述实施方案的又一方面中,包含n-炔丙胺衍生物如雷沙吉兰的本发明的口溶组合物还可以与在治疗帕金森病或有关的病况方面有价值的一种或多种药剂共同给药(同时或按顺序)。
本申请通过实施例进一步说明,这些实施例仅提供作为上述药物组合物的示例,并不限制本申请的范围。对于本领域技术人员而言,某些修改和等效物会是显而易见的,且意在包括在本申请的范围内。
实施例
实施例1-2:
可如表1中给出的制备包含治疗有效量的雷沙吉兰或其药学上可接受的盐的口溶组合物。
表1
操作:
1.将约55%至约80%的量的甘露糖醇、硬脂酸、柠檬酸、无水或微晶纤维素按需要通过指定目筛分。
2.将雷沙吉兰甲磺酸盐、约15%的量的甘露糖醇、聚乙烯醇、乙酰舒泛钾和交联聚维酮溶解在净化水中并混合10分钟。
3.将约55%至约80%的量的甘露糖醇或者按需要将约55%至约80%的量的甘露糖醇和柠檬酸,与步骤(2)的混合物造粒并干燥,以达到干燥失重(lod)的期望限度。
4.将如步骤(3)中制备的颗粒通过指定目筛分并使用混合器按需要将其与微晶纤维素混合指定的时间,随后用硬脂酸润滑指定的时间。
5.将如步骤(4)中制备的混合的颗粒按照指定参数压缩以制成片剂并包装成合适的包装。
实施例5:
将如实施例1-4中制备的口溶组合物在37℃下在5ml的ph6.75的模拟唾液中在20rpm下进行溶解研究,结果于表2中给出。
表2
实施例6:
采用usp崩解试验装置(uspdisintegrationtestapparatus),使用37℃下的净化水将如实施例1-4中制备的口溶组合物进行崩解研究,结果于表3中给出。
表3
实施例7:
使用如下所述的单一剂量随机三交叉方法,将如实施例1-4中制备的口溶组合物与
实施例1-2:在总共18名健康人类个体中在禁食条件下进行药代动力学研究,通过舌下路径向个体给药单一剂量的实施例1-2的组合物。结果示于下表4中,且相对于
表4
实施例3:在总共15名健康人类个体中在禁食条件下进行药代动力学研究,通过舌下(t1)和含服(t2)途径向个体给药单一剂量的实施例3的组合物。结果示于下表5中,且相对于
表5
实施例4:在总共16名健康人类个体中在禁食条件下进行药代动力学研究,作为口腔崩解片剂形式向个体给药单一剂量的实施例4的组合物。结果示于下表6中,且相对于
表6
实施例8:
使用各种包装材料在25℃/65rh和40℃/75rh下研究如在实施例3-4中制备的口溶组合物的物理和化学稳定性3个月,各种包装材料选自:高密度聚乙烯(hdpe)容器、铝-铝(alu-alu)泡罩包装或聚氯乙烯-聚偏二氯乙烯(pvc-pvdc)泡罩包装,结果分别示于下表7、8和9中。
表7
(高密度聚乙烯(hdpe)容器)
表8
(铝-铝(alu-alu)泡罩包装)
表9
(聚氯乙烯-聚偏二氯乙烯(pvc-pvdc)泡罩包装)
尽管已经说明和描述了本申请的若干具体形式,但显然可以在不背离本申请的精神和范围的情况下对本文中详细描述的本申请作出各种修改和组合。
- 还没有人留言评论。精彩留言会获得点赞!