用于治疗的含有磺酰胺接头的生物缀合物的制作方法
本发明属于生物缀合领域。本发明涉及磺酰胺接头及其缀合物,以及其制备方法。更具体地,本发明涉及包含酰基磺酰氨基团和/或氨基甲酰基磺酰氨基团的接头以及包含所述接头的缀合物。本发明进一步涉及包含接头的生物缀合物的制备方法,所述接头包含酰基磺酰氨基团和/或氨基甲酰基磺酰氨基团。
背景技术:
生物缀合是连接两个或更多个分子的过程,其中至少一个是生物分子。生物分子也可以称为“感兴趣的生物分子”,其它分子也可以称为“靶分子”或“感兴趣的分子”。通常,感兴趣的生物分子(boi)将由蛋白质(或肽)、聚糖、核酸(或寡核苷酸)、脂质、激素或天然药物(或其片段或组合)组成。另一个感兴趣的分子(moi)也可以是生物分子,因此导致形成同源二聚体或异二聚体(或更高级的寡聚体),或者另一个分子可能具有通过缀合过程而赋予感兴趣的生物分子的特定特征。例如,通过用于检测和/或分离的化学探针的共价修饰而对蛋白质结构和功能进行调节已经发展成为基于蛋白质组的研究和生物医学应用中的有力工具。蛋白质的荧光或亲和标记是研究其原产地中蛋白质运输的关键。基于蛋白质-碳水化合物缀合物的疫苗在针对hiv、癌症、疟疾和致病细菌中已获得突出地位,而固定在微阵列上的碳水化合物有助于阐明糖组。合成的dna和rna寡核苷酸(on)需要引入用于诊断和治疗应用的合适功能,例如微阵列技术、反义和基因沉默疗法、纳米技术和各种材料科学应用。例如,细胞穿透配体的附着是最常应用的策略,以解决在基于寡核苷酸的治疗(反义,sirna)期间遇到的on的低内化率。类似地,基于寡核苷酸的微阵列的制备需要在合适的固体表面上选择性地固定on,例如,玻璃。
存在许多适合于共价连接两个(或更多个)分子结构的化学反应的实例。然而,生物分子的标记对可应用的反应条件(溶剂、浓度、温度)提出很高的限制,同时化学选择性标记的要求限制反应性基团的选择。出于显而易见的原因,生物系统通常在水性环境中最好地繁殖,这意味着用于生物缀合的试剂应该适合在水性体系中应用。通常,在生物缀合技术领域中可以认识到两个战略概念:(a)基于已经存在于感兴趣的生物分子中的官能团的缀合,例如硫醇、胺、醇或羟基苯酚单元;或(b)涉及在实际缀合过程之前将一个(或多个)独特的反应性基团工程化到boi中的两阶段过程。
第一种方法通常涉及蛋白质中的反应性氨基酸侧链(例如半胱氨酸、赖氨酸、丝氨酸和酪氨酸),或聚糖中的官能团(例如胺、醛)或核酸中的官能团(例如嘌呤或嘧啶官能团或醇)。如在g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013中所概述的那样,其通过引用并入,大量反应性官能团在多年内已变得可用于化学选择性靶向这些官能团之一,例如马来酰亚胺,卤代乙酰胺,活化酯,活化碳酸酯,磺酰卤,活化硫醇衍生物,烯烃,炔烃,联烯酰胺等,其中每一种都需要其自身的特定缀合条件(ph、浓度、化学计量、光等)。最突出的是,半胱氨酸-马来酰亚胺缀合由于其高反应速率和化学选择性而在蛋白质缀合中脱颖而出。然而,当没有半胱氨酸可用于缀合时,如在许多蛋白质中并且当然在其它生物分子中,通常需要其它方法,每种方法都有其自身的缺点。
生物缀合的优雅且广泛适用的解决方案涉及两阶段方法。虽然更加费力,但通过工程化功能的两阶段缀合通常导致比天然功能上的缀合更高的选择性(位点特异性)。除此之外,通过适当选择构建体可以实现完全稳定性,这可能是天然功能性的一阶段缀合的重要缺点,特别是对于半胱氨酸-马来酰亚胺缀合。可以赋予boi的官能团的典型实例包括(应变的)炔烃,(应变的)烯烃,降冰片烯,四嗪,叠氮化物,膦,氧化腈,硝酮,腈亚胺,重氮化合物,羰基化合物,(o-烷基)羟胺和肼,这可以通过化学或分子生物学方法来实现。已知上述每个官能团具有至少一个反应配偶体,在许多情况下涉及完全的相互反应性。例如,环辛炔选择性地且排他性地与1,3-偶极子(具有四嗪的应变烯烃和具有叠氮化物的膦)反应,导致完全稳定的共价键。然而,一些上述官能团具有高度亲脂性的缺点,这可能损害缀合效率,特别是与感兴趣的亲脂性分子组合(参见下文)。
在溶解度、稳定性和生物相容性方面,感兴趣的生物分子和其它分子之间的最终连接单元优选还应与水性环境完全相容。例如,高亲脂性接头可导致聚集(在缀合期间和/或之后),这可以显著增加反应时间和/或降低缀合产率,特别是当moi也具有疏水性时。类似地,高度亲脂性的接头-moi组合可导致与相同或其它生物分子上的表面或特定疏水性贴剂的非特异性结合。如果接头易受水解或其它水诱导的裂解反应的影响,则包含原始生物缀合物的组分通过扩散分离。例如,某些酯部分由于皂化而不合适,而α-羟基羰基或β-二羰基化合物可以分别导致逆醛醇或逆迈克尔反应。最后,接头应该对生物缀合物中存在的官能团或在生物缀合物的应用期间可能遇到的任何其它功能是惰性的,其中排除使用接头特征,例如酮或醛部分(可能导致亚胺形成)、α,β-不饱和羰基化合物(迈克尔加成)、硫酯或其它活化酯(形成酰胺键)。
由乙二醇的线性低聚物制成的化合物,即所谓的聚乙二醇(peg)接头,当下在生物分子缀合过程中特别受欢迎。peg接头是高度水溶性的、无毒的、非抗原性的,并且导致可忽略的聚集或无聚集。由于这个原因,多种线性双功能peg接头可从各种来源商购获得,其可以在任一端用感兴趣的(生物)分子选择性地修饰。peg接头是环氧乙烷聚合过程的产物,因此通常作为链长的随机混合物获得,其可以部分地分解成peg构建体,平均重量分布集中在约1、2、4kda或更高(至多60kda)。还已知均相的离散peg(dpeg),其分子量高达4kda,其支化形式高达15kda。有趣的是,peg单元本身赋予生物分子特定的特征。特别地,蛋白质peg化可导致体内延长的停留、通过代谢酶降低的降解和蛋白质免疫原性的降低或消除。几种聚乙二醇化蛋白已获得fda批准,目前已上市。
由于其高极性,peg接头非常适合于在水性条件下生物缀合小和/或水溶性部分。然而,在疏水的非水溶性靶分子的缀合的情况下,peg单元的极性可能不足以抵消疏水性,导致显著降低的反应速率、较低的产率和诱导的聚集问题。在这种情况下,可能需要冗长的peg接头和/或显著量的有机共溶剂来溶解试剂。例如,在抗体-药物缀合物领域中,对单克隆抗体的不同数量的有毒有效负载的受控附着是关键,有效负载通常选自由奥瑞他汀e或f,美登素,多卡霉素,刺孢霉素或吡咯并苯并二氮杂卓(pbd)组成的组,还有许多其它的正在进行中。除了奥瑞他汀f之外,所有有毒有效负载都很难到非水溶性,这需要有机共溶剂才能成功结合,例如25%二甲基乙酰胺(dma)或50%丙二醇(pg)。在疏水有效负载的情况下,尽管使用上述共溶剂,但在缀合期间可能需要大量化学计量的试剂,而由于聚集(在过程中或在产物分离后)可能显著损害效率和产率,例如由senter等.innat.biotechn.2014,24,1256-1263描述的,通过引用并入。使用长peg间隔子(12个单位或更多)可以部分地增强溶解度和/或缀合效率,但已经显示长peg间隔子可能导致更快的体内清除,因此负面影响adc的药代动力学特征。
使用常规接头(例如peg),有效缀合通常受到接头-缀合物在水性介质中相对低溶解度的阻碍,特别是当使用相对水不溶性或疏水性靶分子时。在他们寻求能够快速有效地缀合疏水部分的短的极性间隔子时,本发明人已开发了磺酰胺接头,发现其改善了接头-缀合物的溶解度,这转而显着提高了缀合的效率,并减少过程和产品聚合。这在专利申请pct/nl2015/050697(wo2016/053107)中公开,其全部内容并入本文。
接头在本领域中是已知的,并且例如在wo2008/070291中公开的,通过引用并入。wo2008/070291公开了用于将靶向剂偶联至锚定组分的接头。接头含有由聚乙二醇(peg)代表的亲水区和缺乏与靶向剂偶联的手性中心的延伸区。
通过引用并入的wo01/88535公开了用于生物缀合的表面的接头体系,特别是具有新型亲水间隔基团的接头体系。用于接头系统的亲水原子或基团选自由o,nh,c=o(酮基),oc=o(酯基)和cr3r4组成的组,其中r3和r4独立地选自由h,oh,c1-c4烷氧基和c1-c4酰氧基组成的组。
通过引用并入的wo2014/100762描述了具有亲水性自我牺牲接头的化合物,其在适当条件下可裂解并掺入亲水基团以提供化合物的更好溶解性。该化合物包含药物部分,能够靶向选定细胞群的靶向部分,以及接头,所述接头含有酰基单元,用于在药物部分和靶向部分之间提供距离的任选间隔单元,在适当条件下可以是可切割的肽接头,亲水性自我牺牲接头,以及任选的第二自我牺牲间隔子或环化自消除接头。亲水性自我牺牲接头是例如苄氧基羰基。
技术实现要素:
本发明涉及增加生物缀合物、生物分子和靶分子的缀合物的治疗指数的方法。发明人惊奇地发现,制备的生物缀合物使得其含有包含根据式(1)的基团的接头l或其盐:
与含有不存在根据式(1)的基团的接头的相同的生物缀合物,即相同的生物分子、相同的靶分子(例如活性物质)和相同的生物分子药物比率相比,其表现出更大的治疗指数。基于目前的知识,不能设想该接头能够对生物缀合物(例如抗体-药物-缀合物)的治疗指数产生影响。在本领域中,接头在处理时被认为是惰性的,并且仅由于制备生物缀合物而存在。特定接头的选择对治疗指数的影响是前所未有的,并且是生物缀合物、特别是抗体-药物-缀合物领域中的突破性发现。
根据本发明的生物缀合物一方面比含有不同接头的相同的生物缀合物、即相同的生物分子、相同的靶分子(例如活性物质)和相同的生物分子/靶分子比更有效(治疗有效),并且另一方面表现出更大的耐受性。当治疗窗扩大时,该发现对用根据本发明的生物缀合物治疗受试者具有显著意义。由于治疗窗的扩展,治疗剂量可能降低,结果是潜在的不期望副作用减少。
根据本发明的生物缀合物由式(a)表示:
b-l-d
(a),
其中:
-b是生物分子;
-l是连接b和d的接头;
-d是靶分子;以及
-每次出现的“-”独立地是键或间隔子部分。
在根据式(1)的基团中,
-a为0或1;以及
-r1选自由氢、c1-c24烷基、c3-c24环烷基、c2-c24(杂)芳基、c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基、c3-c24环烷基、c2-c24(杂)芳基、c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或者r1是另一个靶分子d,其中d任选地通过间隔子部分与n连接。
因此,本发明在第一方面涉及增加生物缀合物的治疗指数的方法,其包括制备式(a)的生物缀合物的步骤,使得如上定义的接头l包含在生物缀合物中。在一个实施方式中,根据本发明的方法还包括将生物缀合物施用于有需要的受试者。根据第一方面的本发明还可以表示为在生物缀合物中使用如上定义的接头l以增加生物缀合物的治疗指数。
在另一方面,本发明涉及对有需要的受试者的治疗,其包括施用根据本发明的生物缀合物。通常,生物缀合物以治疗有效剂量施用。鉴于增加的治疗功效,与常规生物缀合物和/或较低剂量的治疗相比,施用可能不那么频繁。可选地,鉴于增加的耐受性,施用可以更频繁地发生,如在用常规生物缀合物和/或以更高剂量的治疗中。施用可以是单剂量或可以是例如每月发生1-4次,优选每月1-2次,更优选每3或4周施用一次,最优选每4周施用一次。如本领域技术人员所理解的,根据本发明的生物缀合物的剂量可取决于许多因素,并且技术人员可以通过常规实验确定最佳剂量。生物缀合物通常以0.01-50mg/kg受试者体重的剂量施用,更准确地为0.1-25mg/kg或最准确地为0.5-10mg/kg。在一个实施方式中,根据本发明的生物缀合物的施用剂量低于相同生物缀合物(但不包含根据本发明的接头)的td50,优选剂量为相同生物缀合物(但不包含根据本发明的接头)的td50的至多99-90%,更优选至多89-60%,甚至更优选59-30%,最优选至多29-10%。可选地,根据本发明的生物缀合物的施用剂量高于相同生物缀合物(但不包含根据本发明的接头)的td50,优选剂量为相同生物缀合物(但不包含根据本发明的接头)的td50的至多10-29%,更优选至多30-59%,甚至更优选60-89%,最优选至多90-99%。
生物缀合物的制备通常包括使具有式q1-l-d的接头-缀合物与具有式b-f1的生物分子反应的步骤,其中l和d如上所定义,q1是能够与官能团f1反应的反应性基团,其中b如上所定义,f1是能够与q1反应的官能团。在本文中,q1和f1反应以形成连接基团z3,其位于b和l之间的间隔子部分中的根据式(a)的生物缀合物中。
附图说明
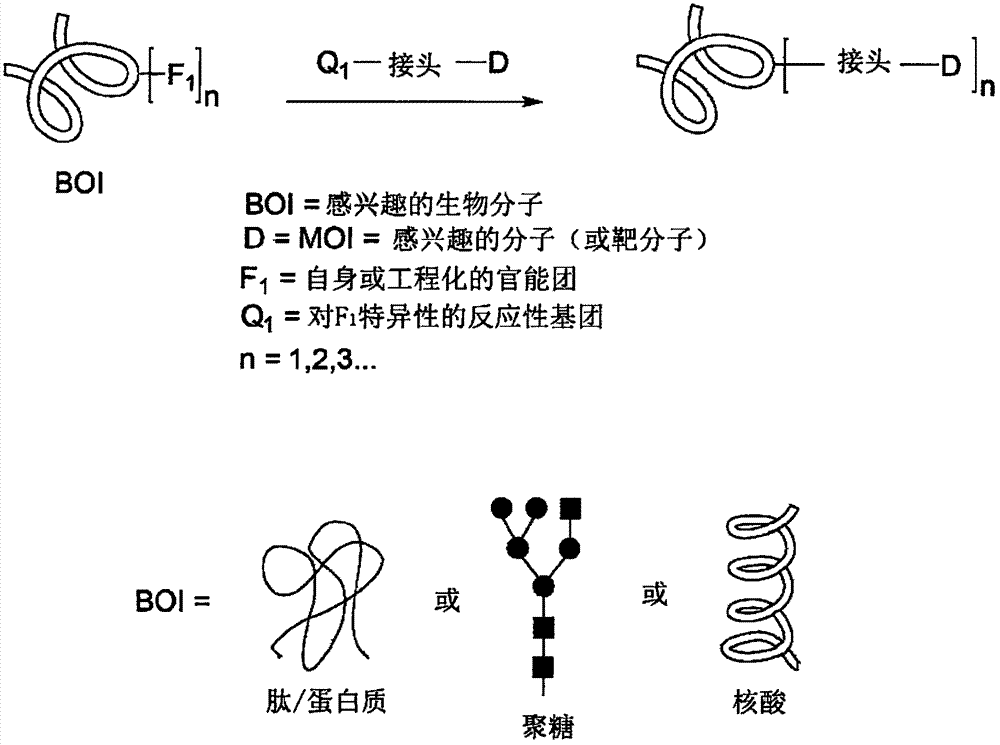
图1描述了生物分子缀合的一般概念:将含有一个或多个官能团f1的感兴趣的生物分子(boi)与(过量)通过特定接头共价连接至反应性基团q1的靶分子d(也称为感兴趣的分子或moi)一起温育。在生物缀合的过程中,发生f1和q1之间的化学反应,从而形成包含boi和moi之间的共价连接的生物缀合物。boi可以例如是肽/蛋白质、聚糖或核酸。
图2显示了半乳糖胺的udp糖衍生物的几种结构,其可以在2-位处用例如3-巯基丙酰基(11a)、叠氮基乙酰基(11b)或叠氮基二氟乙酰基(11c)修饰,或在n-乙酰基半乳糖胺(11d)的6-位处用叠氮基叠氮基乙酰基修饰。
图3示意性地显示了在半乳糖基转移酶突变体或galnac转移酶的作用下任何udp-糖11a-d可以如何与包含glcnac部分的糖蛋白12(例如,聚糖被内切糖苷酶修饰的单克隆抗体)连接,从而在galnac衍生物和glcnac之间产生β-糖苷1-4连接(分别为化合物13a-d)。
图4显示了修饰的抗体13a-d如何通过亲核加成到马来酰亚胺上以进行生物缀合过程(对于3-巯基丙酰基-半乳糖胺修饰的13a,导致硫醚缀合物14,或对于缀合到工程化的半胱氨酸残基,导致硫醚缀合物17)或在用环辛炔试剂进行应变促进的环加成时(对于13b、13c或13d,分别导致三唑15a、15b或16)。
图5显示了几种化合物的结构,其中n-马来酰亚胺基反应性基团q1通过现有技术的接头单元17或根据本发明的接头单元18与芘基团(d)连接。
图6显示了几种化合物的结构,其中双环[6.1.0]壬-4-炔-9-基]反应性基团q1(也称为bcn基团)通过现有技术的接头单元(19、22)或根据本发明的接头单元(20、21、23)与苄胺(d)连接。
图7显示了几种化合物的结构,其中双环[6.1.0]壬-4-炔-9-基]反应性基团q1(也称为bcn基团)或二苯并偶氮环辛炔反应性基团q1(也称为dibac基团或dbco基团)通过接头单元与芘连接。接头26和29是根据本发明的,接头24、25、27和28不是根据本发明的。
图8显示了接头-缀合物30和33的结构,其中双环[6.1.0]壬-4-炔-9-基]反应性基团q1(也称为bcn基团)通过接头单元与美登素连接。接头-缀合物33是根据本发明的,而接头-缀合物30不是。与曲妥珠单抗缀合的这两种接头-缀合物(即adc97和98)已用于实施例29和31的功效和安全性研究中。
图9显示了两种化合物的结构,其中双环[6.1.0]壬-4-炔-9-基]反应性基团q1(也称为bcn基团)通过接头单元与val-cit-paba-多卡霉素构建体连接。接头-缀合物35是根据本发明的,而接头-缀合物34不是。
图10显示了适合作为根据本发明的接头-缀合物的化合物36-39的结构,其中双环[6.1.0]壬-4-炔-9-基]反应性基团q1(也称为bcn)通过磺酰胺接头与val-cit-paba-ahx-美登素缀合。
图11显示了生物分子中的一组代表性官能团(f1),其天然存在或通过工程引入,其在与反应性基团q1反应时导致连接基团z3。官能团f1也可以在任何选择的位置处人工引入(工程化)到生物分子中。相同的官能团和反应性部分分别适合用作f2和q2。连接组z3也可以是f2和q2之间反应的结果。
图12显示了在实施例1-4中制备并在实施例29和31中使用的抗体-药物-缀合物95-98的制备。
图13描绘了在实施例26-28中制备并在实施例30中使用的抗体-药物-缀合物112-114的制备。对于112:r=-nh-(ch2ch2o)4-c(o)-val-cit-mmae(通过13d与111的缀合制备);对于113:r=-nh-s(o)2-nh-(ch2ch2o)2-c(o)-val-cit-mmae(通过13d与100的缀合制备);对于114:r=-nh-(ch2)3-c(o)-nh-s(o)2-nm-(ch2ch2o)2-c(o)-val-cit-mmae(通过13d与108的缀合制备)。
图14是实施例29的结果的图,其中使用根据本发明的两种生物缀合物(95和97)和仅具有本发明之外的接头的两种相同生物缀合物(96和98)随时间描绘了肿瘤体积(以mm3计)。
图15是实施例30的结果的图,其中使用根据本发明的两种生物缀合物(113和114)和仅具有在本发明之外的接头的相同生物缀合物(112)随时间描绘了中值肿瘤体积(以mm3计)。
图16显示了实施例31中对含有根据本发明的接头的生物缀合物97和含有现有技术peg接头的98的安全性结果。图16a和图16b分别显示第2天和第4天的血小板计数和体重(均以对照的%计)。
图17a和17b描绘了实施例49的结果,其中对于根据本发明的生物缀合物(116,图17b)和具有在本发明范围之外的接头的相同生物缀合物(115,图17a)随时间描绘了平均肿瘤体积(以mm3计)。图17a和17b表示在两个独立的体内功效研究中测量的平均肿瘤体积,在每个研究中使用adcetris作为阳性对照。adcetris对不同研究中肿瘤生长延迟的影响差异可以通过细胞倍增时间的差异来合理化(如在用载体处理的组的肿瘤大小中变得明显)。
图18a-c显示了实施例50的安全性结果,其中大鼠用112、113或114(具有相同抗体本妥西单抗和相同有效负载mmae的所有dar2adc)处理。图18a显示了用80、120、140或160mg/kg的112处理的组的平均体重。图18b显示了用80、120、140或160mg/kg的113处理的组的平均体重。图18c显示了用80、120、140或160mg/kg的114处理的组的平均体重。基于这些结果,对于112-114中的每一个,mtd建立为120mg/kg。
图19a-c显示实施例51的安全性结果,其中大鼠用adcetris、115或116(具有相同抗体本妥西单抗和有效负载mmae的所有dar4adc)处理。图19a显示了用15、20或40mg/kg的adcetris处理的组的平均体重。图19b显示了用40、60、70或80mg/kg的115处理的组的平均体重。图19c显示了用40、60、70或80mg/kg的116处理的组的平均体重。基于这些结果,对于adcetris(报告为18mg/kg),mtd建立为15mg/kg,对于115和116,mtd建立为60mg/kg。
图20描绘了实施例52的结果(md-mba-231中的功效研究),其中使用根据本发明的生物缀合物(118)和仅具有本发明之外的接头的相同生物缀合物(117)随时间描绘肿瘤体积(以mm3计)。
具体实施方式
在本发明的上下文中,缀合反应一方面涉及含有官能团f1的生物分子(boi),并且另一方面涉及含有反应性基团q1的靶分子(moi)或如本文定义的“接头-缀合物”,其中q1与f1反应形成连接基团,该连接基团将boi和moi连接在生物缀合物中。在本文中,反应性基团q1通过接头连接至moi,所述接头包含根据式(1)的磺酰胺部分。
反应性基团q1可以连接到式(1)部分的任一末端,在这种情况下,moi连接到式(1)部分的相对末端。在一个实施方式中,反应性基团q1通过羰基末端与式(1)部分连接,moi通过式(1)部分的磺酰胺末端连接。在一个实施方式中,反应性基团q1通过磺酰胺末端与式(1)部分连接,moi通过式(1)部分的羰基末端连接。
定义
在本说明书和权利要求中使用的动词“包括”及其变形在其非限制性意义上用于表示包括该单词之后的项目,但不排除未具体提及的项目。
另外,不定冠词“一个”或“一种”对元件的引用不排除存在多于一个元件的可能性,除非上下文明确要求存在一个且仅一个元件。因此,不定冠词“一个”或“一种”通常意味着“至少一个”。
本说明书和权利要求中公开的化合物可以包含一个或多个不对称中心,并且可以存在不同的非对映异构体和/或对映异构体。除非另有说明,否则本说明书和权利要求书中任何化合物的描述意图包括所有非对映异构体及其混合物。此外,除非另有说明,否则本说明书和权利要求中的任何化合物的描述意在包括单个对映体,以及对映体的任何混合物、外消旋体或其它物质两者。当化合物的结构描述为特定的对映异构体时,应理解本申请的发明不限于该特定的对映异构体。
化合物可以以不同的互变异构形式存在。除非另有说明,否则本发明化合物意在包括所有互变异构形式。当化合物的结构描述为特定的互变异构体时,应理解本申请的发明不限于该特定的互变异构体。
本说明书和权利要求中公开的化合物还可以作为外型和内型非对映异构体存在。除非另有说明,否则说明书和权利要求书中任何化合物的描述意图包括化合物的单个外型和单个内型非对映异构体,以及它们的混合物。当化合物的结构描述为特定的内型或外型非对映异构体时,应理解本申请的发明不限于该特定的内型或外型非对映异构体。
此外,在本说明书和权利要求中公开的化合物可以以顺式和反式异构体存在。除非另有说明,否则说明书和权利要求书中任何化合物的描述意在包括化合物的单个顺式和单个反式异构体,以及它们的混合物。例如,当化合物的结构描述为顺式异构体时,应理解相应的反式异构体或顺式和反式异构体的混合物不排除在本申请的发明之外。当化合物的结构描述为特定的顺式或反式异构体时,应理解本申请的发明不限于该特定的顺式或反式异构体。
未取代的烷基具有通式cnh2n+1,并且可以是直链或支链的。任选地,烷基被本文件中进一步指定的一个或多个取代基取代。烷基的实例包括甲基、乙基、丙基、2-丙基、叔丁基、1-己基、1-十二烷基等。
环烷基是环状烷基。未取代的环烷基包含至少三个碳原子并具有通式cnh2n-1。任选地,环烷基被本文件中进一步指定的一个或多个取代基取代。环烷基的实例包括环丙基、环丁基、环戊基和环己基。
烯基包含一个或多个碳-碳双键,并且可以是直链或支链的。包含一个c-c双键的未取代的烯基具有通式cnh2n-1。包含两个c-c双键的未取代的烯基具有通式cnh2n-3。烯基可以包含末端碳-碳双键和/或内部碳-碳双键。末端烯基是其中碳-碳双键位于碳链的末端位置的烯基。烯基也可包含两个或更多个碳-碳双键。烯基的实例包括乙烯基、丙烯基、异丙烯基、叔丁烯基、1,3-丁二烯基、1,3-戊二烯基等。除非另有说明,否则烯基可以任选地被一个或多个独立选择的如下定义的取代基取代。除非另有说明,否则烯基可以任选地被一个或多个独立地选自由o、n和s组成的组中的杂原子中断。
炔基包含一个或多个碳-碳三键,并且可以是直链或支链的。包含一个c-c三键的未取代的炔基具有通式cnh2n-3。炔基可以包含末端碳-碳三键和/或内部碳-碳三键。末端炔基是其中碳-碳三键位于碳链的末端位置的炔基。炔基还可以包含两个或更多个碳-碳三键。除非另有说明,否则炔基可以任选地被一个或多个独立选择的如下定义的取代基取代。炔基的实例包括乙炔基、丙炔基、异丙炔基、叔丁炔基等。除非另有说明,否则炔基可以任选地被一个或多个独立地选自由o、n和s组成的组中的杂原子中断。
芳基包含6至12个碳原子并且可以包括单环和双环结构。任选地,芳基可以被本文件中进一步指定的一个或多个取代基取代。芳基的实例是苯基和萘基。
芳烷基和烷基芳基包含至少7个碳原子并且可以包括单环和双环结构。任选地,芳烷基和烷基芳基可以被本文件中进一步指定的一个或多个取代基取代。芳烷基是例如苄基。烷基芳基是例如4-叔丁基苯基。
杂芳基包含至少两个碳原子(即至少c2)和一个或多个杂原子n、o、p或s。杂芳基可以具有单环或双环结构。任选地,杂芳基可以被本文件中进一步指定的一个或多个取代基取代。合适的杂芳基的实例包括吡啶基、喹啉基、嘧啶基、吡嗪基、吡唑基、咪唑基、噻唑基、吡咯基、呋喃基、三唑基、苯并呋喃基、吲哚基、嘌呤基、苯并噁唑基、噻吩基、氧膦基和噁唑基。
杂芳烷基和烷基杂芳基包含至少三个碳原子(即至少c3)并且可以包括单环和双环结构。任选地,杂芳基可以被本文件中进一步指定的一个或多个取代基取代。
当芳基表示为(杂)芳基时,注释意在包括芳基和杂芳基。类似地,烷基(杂)芳基意在包括烷芳基和烷基杂芳基,并且(杂)芳烷基意在包括芳烷基和杂芳烷基。因此,c2-c24(杂)芳基被解释为包括c2-c24杂芳基和c6-c24芳基。类似地,c3-c24烷基(杂)芳基意在包括c7-c24烷基芳基和c3-c24烷基杂芳基,并且c3-c24(杂)芳烷基意在包括c7-c24芳烷基和c3-c24杂芳烷基。
环炔基是环炔基。包含一个三键的未取代的环炔基具有通式cnh2n-5。任选地,环炔基被一个或多个本文件中进一步指定的取代基取代。环炔基的实例是环辛炔基。
杂环炔基是被选自氧、氮和硫的组中的杂原子中断的环炔基。任选地,杂环炔基被本文件中进一步指定的一个或多个取代基取代。杂环炔基的实例是氮杂环辛炔基。
(杂)芳基包括芳基和杂芳基。烷基(杂)芳基包括烷基芳基和烷基杂芳基。(杂)芳烷基包含芳烷基和杂芳烷基。(杂)炔基包含炔基和杂炔基。(杂)环炔基包含环炔基和杂环炔基。
(杂)环炔化合物在本文中定义为包含(杂)环炔基的化合物。
本说明书和权利要求中公开的几种化合物可以描述为稠合(杂)环炔化合物,即其中第二环结构与(杂)环炔基稠合(即环稠合)的(杂)环炔化合物。例如,在稠合(杂)环辛炔化合物中,环烷基(例如环丙基)或芳烃(例如苯)可以与(杂)环辛炔基环稠合。稠合(杂)环辛炔化合物中的(杂)环辛炔基的三键可以位于三个可能位置中的任一个上,即位于环辛炔部分的2、3或4位上(根据“有机化学的iupac命名法”,规则a31.2编号)。本说明书和权利要求书中的任何稠合(杂)环辛炔化合物的描述意在包括环辛炔部分的所有三种单独的区域异构体。
除非另有说明,否则烷基、环烷基、烯基、炔基、(杂)芳基、(杂)芳烷基、烷基(杂)芳基、亚烷基、亚烯基、亚炔基、亚环烷基、亚环烯基、亚环炔基、(杂)亚芳基、烷基(杂)亚芳基、(杂)芳基亚烷基、(杂)芳基亚烯基、(杂)芳基亚炔基、烯基、烷氧基、烯氧基、(杂)芳氧基、炔氧基和环烷氧基可以被一个或多个独立地选自由以下组成的组中的取代基取代:c1-c12烷基,c2-c12烯基,c2-c12炔基,c3-c12环烷基,c5-c12环烯基,c8-c12环炔基,c1-c12烷氧基,c2-c12烯氧基,c2-c12炔氧基,c3-c12环烷氧基,卤素,氨基,氧代和甲硅烷基,其中甲硅烷基可以由式(r20)3si-表示,其中r20独立地选自c1-c12烷基,c2-c12烯基,c2-c12炔基,c3-c12环烷基,c1-c12烷氧基,c2-c12烯氧基,c2-c12炔氧基和c3-c12环烷氧基,其中烷基,烯基,炔基,环烷基,烷氧基,烯氧基,炔氧基和环烷氧基任选地被一个或多个选自由o、n和s组成的组中的杂原子取代,而烷基,烷氧基,环烷基和环烷氧基任选地被一个或多个选自由o、n和s组成的组中的杂原子中断。
通用术语“糖”在本文中用于表示单糖,例如葡萄糖(glc),半乳糖(gal),甘露糖(man)和岩藻糖(fuc)。术语“糖衍生物”在本文中用于表示单糖的衍生物,即包含取代基和/或官能团的单糖。糖衍生物的实例包括氨基糖和糖酸,例如葡萄糖胺(glcnh2),半乳糖胺(galnh2),n-乙酰葡糖胺(glcnac),n-乙酰半乳糖胺(galnac),唾液酸(sia)(也称为n-乙酰神经氨酸(neunac)),和n-乙酰胞壁酸(murnac),葡萄糖醛酸(glca)和艾杜糖醛酸(idoa)。
术语“核苷酸”在本文中以其正常的科学含义使用。术语“核苷酸”是指由核碱基、五碳糖(核糖或2-脱氧核糖)以及一个、两个或三个磷酸基团组成的分子。没有磷酸基团,核碱基和糖组成核苷。因此,核苷酸也可以称为核苷一磷酸、核苷二磷酸或核苷三磷酸。核碱基可以是腺嘌呤,鸟嘌呤,胞嘧啶,尿嘧啶或胸腺嘧啶。核苷酸的实例包括尿苷二磷酸(udp),二磷酸鸟苷(gdp),二磷酸胸苷(tdp),二磷酸胞苷(cdp)和胞苷一磷酸(cmp)。
术语“蛋白质”在本文中以其正常的科学含义使用。在本文中,包含约10个或更多个氨基酸的多肽被认为是蛋白质。蛋白质可以包含天然氨基酸,但也可包含非天然氨基酸。
术语“糖蛋白”在本文中以其正常的科学含义使用,并且是指包含与蛋白质共价键合的一个或多个单糖或寡聚糖(“聚糖”)的蛋白质。聚糖可以与蛋白质上的羟基(o-连接的聚糖)连接,例如与丝氨酸,苏氨酸,酪氨酸,羟赖氨酸或羟脯氨酸的羟基连接,或与蛋白质上的酰胺官能团(n-糖蛋白)例如天冬酰胺或精氨酸连接,或与蛋白质上的碳(c-糖蛋白)例如色氨酸连接。糖蛋白可以包含一种以上的聚糖,可以包含一种或多种单糖和一种或多种寡糖聚糖的组合,并且可以包含n-连接的、o-连接的和c-连接的聚糖的组合。据估计,超过50%的蛋白质具有某些形式的糖基化,因此有资格作为糖蛋白。糖蛋白的实例包括psma(前列腺特异性膜抗原),cal(南极假丝酵母脂肪酶),gp41,gp120,epo(促红细胞生成素),抗冻蛋白和抗体。
术语“聚糖”在本文中以其正常的科学含义使用,并且是指与蛋白质连接的单糖或寡聚糖。因此,术语聚糖是指碳水化合物-糖蛋白的一部分。聚糖通过一种糖的c-1碳与蛋白质连接,其可以没有进一步取代(单糖)或可以在其一个或多个羟基上进一步取代(寡糖)。天然存在的聚糖通常包含1至约10个糖部分。然而,当较长的聚糖与蛋白质连接时,所述聚糖在本文中也被认为是聚糖。糖蛋白的聚糖可以是单糖。通常,糖蛋白的单糖聚糖由共价连接至蛋白质的单个n-乙酰葡糖胺(glcnac),葡萄糖(glc),甘露糖(man)或岩藻糖(fuc)组成。聚糖也可以是寡糖。糖蛋白的寡聚糖可以是直链或支链的。在寡聚糖中,直接与蛋白质连接的糖称为核心糖。在寡聚糖中,不直接与蛋白质连接并与至少两种其它糖连接的糖称为内糖。在寡聚糖中,不直接与蛋白质连接但与单个其它糖连接,即在其一个或多个其它羟基上不携带其它糖取代基的糖称为末端糖。为避免疑问,糖蛋白的寡糖中可能存在多个末端糖,但仅有一个核心糖。聚糖可以是o-连接的聚糖、n-连接的聚糖或c-连接的聚糖。在o-连接的聚糖中,单糖或寡糖聚糖通常通过丝氨酸(ser)或苏氨酸(thr)的羟基与蛋白质的氨基酸中的o-原子键合。在n-连接的聚糖中,单糖或寡糖聚糖通过蛋白质的氨基酸中的n-原子,通常通过天冬酰胺(asn)或精氨酸(arg)侧链中的酰胺氮与蛋白质结合。在c-连接的聚糖中,单糖或寡糖聚糖与蛋白质的氨基酸中的c-原子,通常与色氨酸的c-原子(trp)键合。
术语“抗体”在本文中以其正常的科学含义使用。抗体是由免疫系统产生的蛋白质,其能够识别并结合特定抗原。抗体是糖蛋白的一个示例。本文的术语抗体以其最广泛的含义使用,具体包括单克隆抗体,多克隆抗体,二聚体,多聚体,多特异性抗体(例如双特异性抗体),抗体片段,以及双链和单链抗体。术语“抗体”在本文中还意在包括人抗体,人源化抗体,嵌合抗体和特异性结合癌抗原的抗体。术语“抗体”意在包括完整抗体,但也包括抗体的抗原结合片段,例如来自切割抗体的抗体fab片段,f(ab′)2,fv片段或fc片段,scfv-fc片段,迷你体,双体或scfv。此外,该术语包括基因工程抗体和抗体衍生物。抗体,抗体片段和基因工程抗体可以通过本领域已知的方法获得。其中,抗体的典型实例包括阿昔单抗,利妥昔单抗,巴利昔单抗,帕利珠单抗,英夫利昔单抗,曲妥珠单抗,阿仑单抗,阿达木单抗,托西莫单抗-i131,西妥昔单抗,依普利昔单抗,奥马珠单抗,贝伐单抗,那他珠单抗,雷珠单抗,帕尼单抗,依库珠单抗,赛妥珠单抗,戈利木单抗,卡纳单抗,卡妥所单抗,尤特克单抗,托珠单抗,奥法木单抗,地诺单抗,贝利木单抗,伊匹单抗和本妥昔单抗。
接头在本文中定义为连接化合物的两种或更多种元素的部分。例如,在生物缀合物中,生物分子和靶分子通过接头彼此共价连接;在接头-缀合物中,反应性基团q1通过接头与靶分子共价连接;在接头-构建体中,反应性基团q1通过接头与反应性基团q2共价连接。接头可以包含一个或多个间隔子部分。
间隔子部分在本文中定义为间隔(即提供其间的距离)并将接头的两个(或更多个)部分共价连接在一起的部分。接头可以是例如如下定义的接头-构建体、接头-缀合物或生物缀合物的一部分。
接头-构建体在本文中定义为其中反应性基团q1通过接头与反应性基团q2共价连接的化合物。接头-构建体包含能够与存在于生物分子上的反应性基团反应的反应性基团q1,以及能够与存在于靶分子上的反应性基团反应的反应性基团q2。q1和q2可以相同或不同。接头-构建体还可以包含多于一个反应性基团q1和/或多于一个反应性基团q2。接头-构建体也可以表示为q1-sp-q2,其中q1是能够与存在于生物分子上的反应性基团f1反应的反应性基团,q2是能够与存在于靶分子上的反应性基团f2反应的反应性基团,sp是间隔子部分。当接头-构建体包含多于一个反应性基团q1和/或多于一个反应性基团q2时,接头-构建体可以表示为(q1)y-sp-(q2)z,其中y是1至10范围内的整数,z是1至10范围内的整数。优选地,y为1、2、3或4,更优选y为1或2,最优选y为1。优选地,z为1、2、3、4、5或6,更优选z为1、2、3或4,甚至更优选z为1、2或3,还甚至更优选z为1或2,最优选z为1。更优选地,y为1或2,优选为1,并且z为1、2、3或4,还甚至更优选y为1或2,优选为1,z为1、2或3,还甚至更优选为y为1或2,优选1,z为1或2,最优选y为1且z为1。
生物缀合物在本文中定义为其中生物分子经由接头共价连接至靶分子的化合物。生物缀合物包含一个或多个生物分子和/或一个或多个靶分子。接头可以包含一个或多个间隔子部分。
当化合物在本文中是指包含α-末端和ω-末端的化合物时,所述化合物包含两个(或更多个)末端,第一末端称为α-末端,第二末端称为ω-末端。所述化合物可以包含两个以上的末端,即化合物中可以存在第三个、第四个末端等。
生物分子在本文中定义为可以从自然界分离的任何分子或由较小分子构建块组成的任何分子,所述较小分子构建块是来源于自然界的大分子结构的组分,特别是核酸,蛋白质,聚糖和脂质。生物分子的实例包括酶,(非催化)蛋白质,多肽,肽,氨基酸,寡核苷酸,单糖,寡糖,多糖,聚糖,脂质和激素。
靶分子也称为感兴趣的分子(moi),在本文中定义为具有在缀合时赋予生物分子的所需特性的分子结构。
术语“其盐”是指当酸性质子(通常是酸的质子)被阳离子(例如金属阳离子或有机阳离子等)置换时形成的化合物。在适用的情况下,盐是药学上可接受的盐,但是对于不旨在施用于患者的盐而言,这不是必需的。例如,在化合物的盐中,化合物可以被无机或有机酸质子化以形成阳离子,无机或有机酸的缀合碱作为盐的阴离子组分。
术语“药学上可接受的”盐是指对患者(例如哺乳动物)施用可接受的盐(具有对于给定剂量方案具有可接受的哺乳动物安全性的抗衡离子的盐)。这些盐可以来源于药学上可接受的无机或有机碱和药学上可接受的无机或有机酸。“药学上可接受的盐”是指化合物的药学上可接受的盐,其盐来源于本领域已知的各种有机和无机抗衡离子,包括例如钠,钾,钙,镁,铵,四烷基铵等,当分子含有碱性官能团时,包括有机或无机酸的盐,如盐酸盐,氢溴酸盐,甲酸盐,酒石酸盐,苯磺酸盐,甲磺酸盐,乙酸盐,马来酸盐,草酸盐等。
在本文中,公开了磺酰胺接头和所述磺酰胺接头的缀合物。术语“磺酰胺接头”是指包含磺酰氨基团的接头,更特别是酰基磺酰氨基团[-c(o)-n(h)-s(o)2-n(r1)-]和/或氨基甲酰基磺酰氨基团[-o-c(o)-n(h)-s(o)2-n(r1)-]。
在本文中,术语“治疗指数”(ti)具有本领域技术人员公知的常规含义,并且是指对于50%群体有毒(即在发生率或严重性与目标指示不相容时引起副作用)的药物剂量(td50)除以在50%群体中产生所需药理学作用的剂量(有效剂量或ed50)的比率。因此,ti=td50/ed50。治疗指数可以通过临床试验或例如通过血浆暴露试验来确定。另外参见muller等,naturereviewsdrugdiscovery2012,11,751-761。在早期发育阶段,候选药物的临床ti通常尚不清楚。然而,尽早了解候选药物的初步ti至关重要,因为ti是药物成功开发概率的重要指标。在尽可能早的阶段识别具有潜在次优ti的候选药物有助于启动缓解或可能重新部署资源。在此早期阶段,ti通常定义为安全性(小鼠或大鼠的最大耐受剂量)与功效(小鼠异种移植物中的最小有效剂量)之间的定量比。
在本文中,术语“治疗功效”表示物质达到某种治疗效果的能力,例如减少肿瘤体积。可以测定治疗效果,确定物质可以达到所需效果的程度,通常与相同情况下的另一种物质相比较。治疗功效的合适量度是ed50值,其可以例如在临床试验期间或通过血浆暴露试验确定。在临床前治疗功效测定的情况下,生物缀合物(例如adc)的治疗效果可以通过小鼠中源自患者的肿瘤异种移植物来验证,在这种情况下,功效是指adc提供有益效果的能力。可选地,所述adc在啮齿动物安全性研究中的耐受性也可以是治疗效果的量度。
在本文中,术语“耐受性”是指特定物质在发生率或严重性与目标指示不相容时不会引起副作用的最大剂量。对特定物质的耐受性的合适量度是td50值,其可以例如在临床试验期间或通过血浆暴露试验确定。
接头
根据本发明的生物缀合物包含连接生物分子b和靶分子d的接头l。接头包含根据式(1)的基团或其盐:
其中:
-a为0或1;以及
-r1选自由氢、c1-c24烷基、c3-c24环烷基、c2-c24(杂)芳基、c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基、c3-c24环烷基、c2-c24(杂)芳基、c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或者r1是另一个靶分子d,其中d任选地通过间隔子部分与n连接。
当式(1)的基团包含盐时,该盐优选为药学上可接受的盐。
在一个优选的实施方式中,根据本发明的接头l包含根据式(1)的基团或其盐,其中a是0。在该实施方式中,接头l因此包含根据式(2)的基团或其盐:
其中r1如上所定义。
在另一个优选的实施方式中,根据本发明的接头l包含根据式(1)的基团或其盐,其中a是1。在该实施方式中,接头l因此包含根据式(3)的基团或其盐:
其中r1如上所定义。
在根据式(1)、(2)和(3)的基团中,r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或r1是另一个靶分子d,其中d任选地通过间隔子部分与n连接。
在一个优选的实施方式中,r1是氢或c1-c20烷基,更优选r1是氢或c1-c16烷基,甚至更优选r1是氢或c1-c10烷基,其中所述烷基被一个或多个选自o、s和nr3的杂原子(优选o)任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组。在一个优选的实施方式中,r1是氢。在另一个优选的实施方式中,r1是c1-c20烷基,更优选c1-c16烷基,甚至更优选c1-c10烷基,其中烷基任选地被一个或多个o原子中断,并且其中烷基任选地被-oh基团(优选末端-oh基团)取代。在该实施方式中,进一步优选r1是包含末端-oh基团的(聚)乙二醇链。在另一个优选的实施方式中,r1选自由氢,甲基,乙基,正丙基,异丙基,正丁基,仲丁基和叔丁基组成的组,更优选由氢,甲基,乙基,正丙基和异丙基组成的组,甚至更优选由氢,甲基和乙基组成的组。还甚至更优选r1是氢或甲基,最优选r1是氢。
在另一个优选的实施方式中,r1是另一个靶分子d。任选地,d通过一个或多个间隔子部分与n连接。间隔子部分(如果存在)定义为间隔,即在d和n之间提供一定距离并共价连接d和n的部分。
生物缀合领域中的靶分子是本领域技术人员已知的,并且还可以称为有效负载。靶分子d可以选自由活性物质,报告分子,聚合物,固体表面,水凝胶,纳米颗粒,微粒和生物分子组成的组。
在d的上下文中,术语“活性物质”涉及药理学和/或生物学物质,即具有生物学和/或药学活性的物质,例如药物,前药,诊断剂,蛋白质,肽,多肽,肽标签,氨基酸,聚糖,脂质,维生素,类固醇,核苷酸,核苷,多核苷酸,rna或dna。肽标签的实例包括细胞穿透肽,如人乳铁蛋白或聚精氨酸。聚糖的实例是低聚甘露糖。氨基酸的实例是赖氨酸。
当靶分子是活性物质时,活性物质优选选自由药物和前药组成的组。更优选地,活性物质选自由药物活性化合物组成的组,特别是低至中等分子量的化合物(例如约200至约2500da,优选约300至约1750da)。在进一步优选的实施方式中,活性物质选自由细胞毒素,抗病毒剂,抗细菌剂,肽和寡核苷酸组成的组。细胞毒素的实例包括秋水仙碱,长春花生物碱,蒽环类,喜树碱,多柔比星,柔红霉素,紫杉烷,刺孢霉素,微管溶素,伊立替康,抑制肽,鹅膏蕈素,debouganin,多卡霉素,美登素,奥瑞他汀或吡咯并苯并二氮杂卓(pbd)。鉴于它们的水溶性差,优选的活性物质包括长春花生物碱,蒽环类,喜树碱,紫杉烷,微管溶素,鹅膏蕈碱,多卡霉素,美登素,奥瑞他汀和吡咯并苯并二氮杂卓,特别是长春花生物碱,蒽环类,喜树碱,紫杉烷,微管溶素,鹅膏蕈碱,美登素和奥瑞他汀。
术语“报告分子”在本文中是指易于检测其存在的分子,例如诊断剂,染料,荧光团,放射性同位素标记,造影剂,磁共振成像剂或质量标记。
多种荧光团也称为荧光探针,是本领域技术人员已知的。几种荧光团在例如g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013年,第10章:“荧光探针”,第395-463页中更详细描述,其通过引用并入。荧光团的实例包括所有种类的alexafluor(例如alexafluor555),菁染料(例如cy3或cy5)和菁染料衍生物,香豆素衍生物,荧光素和荧光素衍生物,罗丹明和罗丹明衍生物,硼二吡咯甲烷衍生物,芘衍生物,萘二甲酰亚胺衍生物,藻胆蛋白衍生物(例如别藻蓝蛋白),色霉素,镧系元素螯合物和量子点纳米晶体。鉴于其水溶性差,优选的荧光团包括菁染料,香豆素衍生物,荧光素及其衍生物,芘衍生物,萘二甲酰亚胺衍生物,色霉素,镧系元素螯合物和量子点纳米晶体,特别是香豆素衍生物,荧光素,芘衍生物和色霉素。
放射性同位素标记的实例包括99mtc,111in,114min,115in,18f,14c,64cu,131i,125i,123i,212bi,88y,90y,67cu,186rh,188rh,66ga,67ga和10b,其可选地任选地通过螯合部分,例如dtpa(二亚乙基三胺五乙酸酐),dota(1,4,7,10-四氮杂环十二烷-n,n′,n″,n″′-四乙酸),nota(1,4,7-三氮杂环壬烷n,n′,n″-三乙酸),teta(1,4,8,11-四氮杂环十四烷-n,n′,n″,n″′-四乙酸),dtta(n1-(对异硫氰酸基苄基)-二乙烯三胺-n1,n2,n3,n3-四乙酸),去铁胺或dfa(n′-[5-[[4-[[5-(乙酰羟基氨基)戊基]氨基]-1,4-二氧代丁基]-羟基氨基]戊基]-n-(5-氨基戊基)-n-羟基丁二酰胺)或hynic(肼基烟酰胺)连接。同位素标记技术是本领域技术人员已知的,并且在例如g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013年,第12章:“同位素标记技术”,第507-534页中更详细描述,其通过引用并入。
适合用作本发明化合物中的靶分子d的聚合物是本领域技术人员已知的,并且几个示例在例如g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013年,第18章:“聚乙二醇化和合成聚合物改性”,第787-848页中更详细描述,其通过引用并入。当靶分子d是聚合物时,靶分子d优选独立地选自由聚乙二醇(peg),聚环氧乙烷(peo),聚丙二醇(ppg),聚环氧丙烷(ppo),1,x-二氨基烷烃聚合物(其中x是烷烃中的碳原子数,优选x是2至200范围内的整数,优选2至10),(聚)乙二醇二胺(例如1,8-二氨基-3,6-二氧杂辛烷和包含较长乙二醇链的等同物),多糖(例如葡聚糖),聚(氨基酸)(例如聚(l-赖氨酸))和聚(乙烯醇)组成的组。鉴于它们的水溶性差,优选的聚合物包括1,x-二氨基烷烃聚合物和聚(乙烯醇)。
适合用作靶分子d的固体表面是本领域技术人员已知的。固体表面是例如功能表面(例如纳米材料,碳纳米管,富勒烯或病毒衣壳的表面),金属表面(例如钛,金,银,铜,镍,锡,铑或锌表面),金属合金表面(其中合金来自例如铝,铋,铬,钴,铜,镓,金,铟,铁,铅,镁,汞,镍,钾,钚,铑,钪,银,钠,钛,锡,铀,锌和/或锆),聚合物表面(其中聚合物是例如聚苯乙烯,聚氯乙烯,聚乙烯,聚丙烯,聚(二甲基硅氧烷)或聚甲基丙烯酸甲酯,聚丙烯酰胺),玻璃表面,有机硅表面,色谱载体表面(其中色谱载体是例如二氧化硅载体,琼脂糖载体,纤维素载体或氧化铝载体)等。当靶分子d是固体表面时,优选d独立地选自由功能表面或聚合物表面组成的组。
水凝胶是本领域技术人员已知的。水凝胶是水溶胀的网络,由聚合物成分之间的交联形成。参见例如a.s.hoffman,adv.drugdeliveryrev.2012,64,18,其通过引用并入。当靶分子是水凝胶时,优选水凝胶由聚(乙烯)乙二醇(peg)作为聚合物基础组成。
适合用作靶分子d的微米和纳米颗粒是本领域技术人员已知的。多种合适的微米和纳米颗粒描述于例如g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013年,第14章:“微粒子和纳米颗粒”,第549-587页,其通过引用并入。微米或纳米颗粒可以是任何形状,例如球体,棒,管,立方体,三角形和锥体。优选地,微米或纳米颗粒为球形。微米和纳米颗粒的化学组成可以变化。当靶分子d是微米或纳米颗粒时,微米或纳米颗粒是例如聚合物微米或纳米颗粒,二氧化硅微米或纳米颗粒,或金微米或纳米颗粒。当颗粒是聚合物微米或纳米颗粒时,聚合物优选是聚苯乙烯或苯乙烯的共聚物(例如苯乙烯和二乙烯基苯、丁二烯、丙烯酸酯和/或乙烯基甲苯的共聚物),聚甲基丙烯酸甲酯(pmma),聚乙烯基甲苯,聚(甲基丙烯酸羟基乙酯(phema)或聚乙二醇二甲基丙烯酸酯/甲基丙烯酸2-羟基乙酯)[聚(edgma/hema)]。任选地,微米或纳米颗粒的表面被例如洗涤剂改性,通过二级聚合物的接枝聚合或通过另一种聚合物或间隔子部分的共价连接等。
靶分子d也可以是生物分子。以下更详细地描述生物分子及其优选实施方式。当靶分子d是生物分子时,优选生物分子选自由蛋白质(包括糖蛋白和抗体),多肽,肽,聚糖,脂质,核酸,寡核苷酸,多糖,寡糖,酶,激素,氨基酸和单糖组成的组。
为了获得式(a)的生物缀合物,可以以三种选择之一引入式(1)的基团。首先,包含根据式(1)的基团的接头l或其盐可以存在于由q1-d表示的接头-缀合物中,其中l是q1和d之间的间隔子。其次,包含根据式(1)的基团的接头l或其盐可以存在于由b-f1表示的生物分子中,其中l是b和f1之间的间隔子。第三,根据式(1)的基团或其盐可以在缀合反应本身期间形成。在后一种选择中,选择q1和f1使得它们的反应产物即连接基团z3含有或是式(1)的基团或其盐。优选地,根据上述第一或第二选择引入根据式(1)的基团或其盐,最优选根据第一选择。在根据式(1)的基团或其盐在缀合反应期间已经如此存在的情况下,如上所述,对溶解度的积极影响和过程中聚集的缺乏提高了缀合反应的效率。在根据式(1)的基团或其盐存在于接头-缀合物中的情况下,甚至疏水性药物也可以容易地进行缀合反应。
接头-缀合物
接头-缀合物由q1-d表示,优选由q1-l-d表示,其中d是靶分子,l是如上进一步定义的连接q1和d的接头,q1是能够与生物分子上的官能团f1反应的反应性基团,并且每次出现的“-”独立地是键或间隔子部分。在一个实施方式中,“-”是如本文定义的间隔子部分。在一个实施方式中,“-”是键,通常是共价键。接头-缀合物是其中靶分子与活性基团q1共价连接的化合物,优选通过接头或间隔子,最优选通过如上定义的接头l共价连接。接头-缀合物可以通过存在于接头-构建体上的反应性基团q2与存在于靶分子上的反应性基团的反应来获得。
优选地,根据式(1)的基团或其盐位于q1和d之间。换句话说,反应性基团q1与根据式(1)的基团的第一末端共价键合,并且靶分子d共价键合到根据式(1)的基团的第二末端。在本文中,“第一末端”和“第二末端”均指根据式(1)的基团的羰基或羧基末端或根据式(1)的基团的磺酰胺末端,但逻辑上是不相同的末端。
如本领域技术人员所理解的,根据本发明的接头-缀合物可以包含多于一个靶分子d,例如两个,三个,四个,五个等。因此,接头-缀合物可以因此包含多于一个“第二末端”。类似地,接头-缀合物可以包含多于一个反应性基团q1,即接头-缀合物可以包含多于一个第一末端。当存在多于一个反应性基团q1时,基团q1可以相同或不同,并且当存在多于一个靶分子d时,靶分子d可以相同或不同。
因此,根据本发明的接头-缀合物也可以表示为(q1)ysp(d)z,其中y是1至10范围内的整数,并且z是1至10范围内的整数。在此:
-y是1到10范围内的整数;
-z是1至10范围内的整数;
-q1是能够与存在于生物分子上的官能团f1反应的反应性基团;
-d是靶分子;
-sp是间隔子部分,其中间隔子部分定义为间隔(即在其间提供一定距离)并共价连接反应性基团q1和靶分子d的部分,优选其中所述间隔子部分是如上定义的接头l,并因此包括根据式(1)的基团或其盐。
优选地,y为1、2、3或4,更优选y为1或2,最优选y为1。优选地,z为1、2、3、4、5或6,更优选z为1、2、3或4,甚至更优选z为1、2或3,还甚至更优选z为1或2,最优选z为1。更优选地,y为1或2,优选为1,z为1、2、3或4,还甚至更优选y为1或2,优选为1,z为1、2或3,还甚至更优选y为1或2,优选为1,z为1或2,最优选y为1且z为1。在一个优选的实施方式中,接头-缀合物是根据式q1sp(d)4,q1sp(d)3,q1sp(d)2或q1spd。
靶分子d如上所定义。d优选为“活性物质”或“药物活性物质”,并且是指药理学和/或生物学物质,即具有生物学和/或药学活性的物质,例如药物、前药、诊断剂。优选地,活性物质选自由药物和前药组成的组。更优选地,活性物质是药物活性化合物,特别是低至中等分子量的化合物(例如约200至约2500da,优选约300至约1750da)。在进一步优选的实施方式中,活性物质选自由细胞毒素,抗病毒剂,抗细菌剂,肽和寡核苷酸组成的组。细胞毒素的实例包括秋水仙碱,长春花生物碱,蒽环类,喜树碱,多柔比星,柔红霉素,紫杉烷,刺孢霉素,微管溶素,伊立替康,抑制肽,鹅膏蕈素,debouganin,多卡霉素,美登素,奥瑞他汀或吡咯并苯并二氮杂卓(pbd)。优选的活性物质包括长春花生物碱,蒽环类,喜树碱,紫杉烷,微管溶素,鹅膏蕈碱,多卡霉素,美登素,奥瑞他汀和吡咯并苯并二氮杂卓,特别是长春花生物碱,蒽环类,喜树碱,紫杉烷,微管溶素,鹅膏蕈碱,美登素和奥瑞他汀。
接头-缀合物包含能够与存在于生物分子上的官能团f1反应的反应性基团q1。官能团是本领域技术人员已知的,并且可以定义为赋予含有它的分子特定性质的任何分子实体。例如,生物分子中的官能团可以构成氨基,硫醇基,羧酸,醇基,羰基,磷酸基或芳族基团。生物分子中的官能团可以是天然存在的,或者可以通过特定技术例如(生物)化学或遗传技术置于生物分子中。置于生物分子中的官能团可以是天然存在于自然界中的官能团,或者可以是通过化学合成制备的官能团,例如叠氮化物、末端炔烃或膦部分。在本文中,术语“反应性基团”可以指包含官能团的某个基团,也可以指官能团本身。例如,环辛炔基是包含官能团即c-c三键的反应性基团。类似地,n-马来酰亚胺基是包含c-c双键作为官能团的反应性基团。然而,官能团例如叠氮基官能团、硫醇官能团或氨基官能团在本文中也可称为反应性基团。
接头-缀合物可以包含多于一个反应性基团q1。当接头-缀合物包含两个或更多个反应性基团q1时,反应性基团q1可以彼此不同。优选地,接头-缀合物包含一个反应性基团q1。
存在于接头-缀合物中的反应性基团q1能够与存在于生物分子中的官能团f1反应以形成连接基团z3。换句话说,反应性基团q1需要与存在于生物分子中的官能团f1互补。在本文中,当反应性基团选择性地与官能团任选地在其它官能团的存在下反应以形成连接基团z3时,所述反应性基团表示为与所述官能团“互补”。互补的反应性基团和官能团是本领域技术人员已知的,并在下面更详细地描述。优选地,反应性基团q1和官能团f1能够在生物正交反应中反应,因为那些反应不会干扰在该反应期间存在的生物分子。生物正交反应和其中适合的官能团是本领域技术人员已知的,例如来自gong和pan,tetrahedronlett.2015,56,2123-2132,并且包括施陶丁格连接和无铜点击化学。因此,优选q1选自由1,3-偶极子,炔烃,(杂)环辛炔,环辛烯,四嗪,酮,醛,烷氧基胺,肼和三苯基膦组成的组。
在一个优选的实施方式中,反应性基团q1选自由任选取代的n-马来酰亚胺基,卤代n-烷基酰氨基,磺酰氧基n-烷基酰氨基,酯基,碳酸酯基,磺酰卤基,硫醇基或衍生物,烯基,炔基,(杂)环炔基,双环[6.1.0]壬-4-炔-9-基],环烯基,四嗪基,叠氮基,膦基,氧化腈基,硝酮基,腈亚胺基,重氮基,酮基,(o-烷基)羟基氨基,肼基,卤代n-马来酰亚胺基,1,1-双(磺酰基甲基)甲基羰基或其消除衍生物,碳酰卤基,联烯酰胺基,1,2-醌基或三嗪基组成的组。
在一个优选的实施方式中,q1是n-马来酰亚胺基。当q1是n-马来酰亚胺基时,q1优选是未取代的。因此,q1优选是根据如下所示的式(9a)。这种马来酰亚胺基的优选实例是2,3-二氨基丙酸(dpr)马来酰亚胺基,其可以通过羧酸部分与接头-缀合物的其余部分连接。
在另一个优选的实施方式中,q1是卤代n-烷基酰氨基。当q1是卤代n-烷基酰氨基时,优选q1是根据如下所示的式(9b),其中k是1至10范围内的整数,并且r4选自由-cl、-br和-i组成的组。优选k为1、2、3或4,更优选k为1或2,最优选k为1。优选地,r4为-i或-br。更优选地,k为1或2且r4为-i或-br,最优选k为1且r4为-i或br。
在另一个优选的实施方式中,q1是磺酰氧基n-烷基酰氨基。当q1是磺酰氧基n-烷基酰氨基时,优选q1是根据如下所示的式(9b),其中k是1至10范围内的整数,r4选自由-o-甲磺酰基,-o-苯磺酰基和-o-甲苯磺酰基组成的组。优选k为1、2、3或4,更优选k为1或2,甚至更优选k为1。最优选k为1且r4选自由-o-甲磺酰基,-o-苯磺酰基和o-甲苯磺酰基的组成的组。
在另一个优选的实施方式中,q1是酯基。当q1是酯基时,优选酯基是活化的酯基。活化的酯基是本领域技术人员已知的。活化的酯基在本文中定义为包含良好的离去基团的酯基,其中酯羰基与所述良好的离去基团键合。良好的离去基团是本领域技术人员已知的。进一步优选活化的酯根据式(9c),其中r5选自由-n-琥珀酰亚胺基(nhs),-n-磺基-琥珀酰亚胺基(磺基-nhs),-(4-硝基苯基),-五氟苯基或或-四氟苯基(tfp)组成的组。
在另一个优选的实施方式中,q1是碳酸酯基。当q1是碳酸酯基时,优选碳酸酯基是活化的碳酸酯基。活化的碳酸酯基是本领域技术人员已知的。活化的碳酸酯基在本文中定义为包含良好的离去基团的碳酸酯基,其中碳酸酯羰基与所述良好的离去基团键合。进一步优选碳酸酯基是根据式(9d),其中r7选自由-n-琥珀酰亚胺基,-n-磺基-琥珀酰亚胺基,-(4-硝基苯基),-五氟苯基或-四氟苯基组成的组。
在另一个优选的实施方式中,q1是根据如下所示的式(9e)的磺酰卤基,其中x选自由f、cl,br和i组成的组。优选x是cl或br,更优选cl。
在另一个优选的实施方式中,q1是硫醇基(9f),或硫醇基的衍生物或前体。硫醇基也可称为巯基。当q1是硫醇基的衍生物或前体时,硫醇衍生物优选是根据如下所示的式(9g)、(9h)或(9zb),其中r8是任选取代的c1-c12烷基或c1-c12(杂)芳基,v是o或s,r16是任选取代的c1-c12烷基。更优选r8是任选取代的c1-c6烷基或c2-c6(杂)芳基,甚至更优选r8是甲基,乙基,正丙基,异丙基,正丁基,仲丁基,叔丁基或苯基。甚至更优选地,r8是甲基或苯基,最优选甲基。更优选r16是任选取代的c1-c6烷基,甚至更优选r16是甲基,乙基,正丙基,异丙基,正丁基,仲丁基或叔丁基,最优选甲基。当q1是根据式(9g)或(9zb)的硫醇衍生物,并且q1与生物分子上的反应性基团f1反应时,所述硫醇衍生物在该过程期间转化为硫醇基。当q1是根据式(9h)时,q1是-sc(o)or8或-sc(s)or8,优选-sc(o)or8,其中r8及其优选实施方式如上所定义。
在另一个优选的实施方式中,q1是烯基,其中烯基是直链或支链的,并且其中烯基是任选取代的。烯基可以是末端或内部烯基。烯基可以包含多于一个c-c双键,如果是这样,优选包含两个c-c双键。当烯基是二烯基时,进一步优选两个c-c双键被一个c-c单键分开(即优选二烯基是共轭二烯基)。优选所述烯基是c2-c24烯基,更优选c2-c12烯基,甚至更优选c2-c6烯基。进一步优选烯基是末端烯基。更优选地,烯基是根据如下所示的式(9i),其中1是0至10范围内的整数,优选0至6范围内,p是0至10范围内的整数,优选0至6。更优选地,1为0、1、2、3或4,更优选1为0、1或2,最优选1为0或1。更优选地,p为0、1、2、3或4,更优选p为0、1或2,最优选p为0或1。特别优选p为0且1为0或1,或p为1且1为0或1。
在另一个优选的实施方式中,q1是炔基,其中炔基是直链或支链的,并且其中炔基是任选取代的。炔基可以是末端或内部炔基。优选所述炔基是c2-c24炔基,更优选c2-c12炔基,甚至更优选c2-c6炔基。进一步优选炔基是末端炔基。更优选地,炔基是根据如下所示的式(9j),其中1是0至10范围内的整数,优选0至6范围内。更优选地,1是0、1、2、3或4,更优选1是0、1或2,最优选1是0或1。在另一个优选的实施方式中,炔基是根据式(9j),其中1是3。
在另一个优选的实施方式中,q1是环烯基。环烯基是任选取代的。优选所述环烯基是c3-c24环烯基,更优选c3-c12环烯基,甚至更优选c3-c8环烯基。在一个优选的实施方式中,环烯基是反式-环烯基,更优选反式-环辛烯基(也称为tco基团),最优选是根据如下所示的式(9zi)或(9zj)的反式-环辛烯基。在另一个优选的实施方式中,环烯基是环丙烯基,其中环丙烯基是任选取代的。在另一个优选的实施方式中,环烯基是降冰片烯基,氧杂降冰片烯基,降冰片二烯基或氧杂降冰片二烯基,其中降冰片烯基,氧杂降冰片烯基,降冰片二烯基或氧杂降冰片二烯基是任选取代的。在进一步优选的实施方式中,环烯基是根据如下所示的式(9k)、(9l)、(9m)或(9zc),其中t是ch2或o,r9独立地选自由氢,直链或支链的c1-c12烷基或c4-c12(杂)芳基组成的组,r19选自由氢和氟化烃组成的组。优选地,r9独立地为氢或c1-c6烷基,更优选r9独立地为氢或c1-c4烷基。甚至更优选r9独立地为氢或甲基,乙基,正丙基,异丙基,正丁基,仲丁基或叔丁基。还甚至更优选r9独立地为氢或甲基。在进一步优选的实施方式中,r19选自由氢和-cf3,-c2f5,-c3f7和-c4f9组成的组,更优选氢和cf3。在进一步优选的实施方式中,环烯基是根据式(9k),其中一个r9是氢,另一个r9是甲基。在另一个进一步优选的实施方式中,环烯基是根据式(91),其中两个r9都是氢。在这些实施方式中,进一步优选1为0或1。在另一个进一步优选的实施方式中,环烯基是根据式(9m)的降冰片烯基(t为ch2)或氧杂降冰片烯基(t为o),或根据式(9zc)的降冰片二烯基(t为ch2)或氧杂降冰片二烯基(t为o),其中r9为氢且r19为氢或-cf3,优选-cf3。
在另一个优选的实施方式中,q1是(杂)环炔基。(杂)环炔基是任选取代的。优选地,(杂)环炔基是(杂)环辛炔基,即杂环辛炔基或环辛炔基,其中(杂)环辛炔基是任选取代的。在进一步优选的实施方式中,(杂)环辛炔基被一个或多个卤素原子,优选氟原子取代,更优选(杂)环辛炔基被一个氟原子取代,如在单氟-环辛炔(mcfo)中。优选地,单氟-环辛炔基是根据式(9zo)的。在进一步优选的实施方式中,(杂)环辛炔基是根据都如下所示的式(9n)(也称为dibo基团),(9o)(也称为dibac基团),或(9p)(也称为barac基团),或(9zk)(也称为combo基团),其中u是o或nr9,r9的优选实施方式如上所定义。(9n)中的芳环在一个或多个位置处任选地被o-磺酰化,而(9o)和(9p)的环可以在一个或多个位置处被卤化。对于(9n),u优选为o。
在一个特别优选的实施方式中,与化合物(4b)中的r1连接的氮原子是杂环亚烷基的环中的氮原子,例如(9o)中的氮原子。换句话说,化合物(4b)中的c、d和g为0,并且r1和q1与它们所连接的氮原子一起形成杂环亚烷基,优选杂环辛炔基,最优选根据式(9o)或(9p)的杂环辛炔基。在本文中,(9o)的羰基部分被根据式(1)的基团的磺酰基取代。或者,与r1连接的氮原子与在式(9n)中表示为u的原子相同。换句话说,当q1是根据式(9n)时,u可以是根据式(1)的基团的右氮原子,或u=nr9,并且r9是根据式(1)的基团的其余部分,并且r1是环辛炔部分。
在另一个优选的实施方式中,q1是任选取代的双环[6.1.0]壬-4-炔-9-基]基团,也称为bcn基团。优选地,双环[6.1.0]壬-4-炔-9-基]基团是根据如下所示的式(9q)。
在另一个优选的实施方式中,q1是能够在狄尔斯-阿尔德反应中反应的共轭(杂)二烯基。优选的(杂)二烯基包括任选取代的四嗪基,任选取代的1,2-醌基和任选取代的三嗪基。更优选地,所述四嗪基是根据如下所示的式(9r),其中r9选自由氢,直链或支链c1-c12烷基或c4-c12(杂)芳基组成的组。优选地,r9是氢,c1-c6烷基或c4-c10(杂)芳基,更优选r9是氢,c1-c4烷基或c4-c6(杂)芳基。甚至更优选r9是氢,甲基,乙基,正丙基,异丙基,正丁基,仲丁基,叔丁基或吡啶基。还甚至更优选r9是氢,甲基或吡啶基。更优选地,所述1,2-醌基是根据式(9z1)或(9zm)。所述三嗪基可以是任何区域异构体。更优选地,所述三嗪基是1,2,3-三嗪基或1,2,4-三嗪基,其可以经由任何可能的位置连接,例如式(9zn)中所示。1,2,3-三嗪最优选作为三嗪基。
在另一个优选的实施方式中,q1是根据如下所示的式(9s)的叠氮基。
在另一个优选的实施方式中,q1是任选取代的三芳基膦基,其适于进行施陶丁格连接反应。优选地,膦基是根据如下所示的(9t),其中r10是(硫)酯基。当r10是(硫)酯基时,优选r10是-c(o)-v-r11,其中v是o或s,r11是c1-c12烷基。优选地,r11是c1-c6烷基,更优选c1-c4烷基。最优选地,r11是甲基。
在另一个优选的实施方式中,q1是根据如下所示的式(9u)的氧化腈基。
在另一个优选的实施方式中,q1是硝酮基。优选地,硝酮基是根据如下所示的式(9v),其中r12选自由直链或支链c1-c12烷基和c6-c12芳基组成的组。优选地,r12是c1-c6烷基,更优选r12是c1-c4烷基。甚至更优选r12是甲基,乙基,正丙基,异丙基,正丁基,仲丁基或叔丁基。还甚至更优选r12是甲基。
在另一个优选的实施方式中,q1是腈亚胺基。优选地,腈亚胺基是根据如下所示的式(9w)或(9zd),其中r13选自由直链或支链c1-c12烷基和c6-c12芳基组成的组。优选地,r13是c1-c6烷基,更优选r13是c1-c4烷基。甚至更优选r13是甲基,乙基,正丙基,异丙基,正丁基,仲丁基或叔丁基。还甚至更优选r13是甲基。
在另一个优选的实施方式中,q1是重氮基。优选地,重氮基是根据如下所示的式(9x),其中r14选自氢或羰基衍生物。更优选地,r14是氢。
在另一个优选的实施方式中,q1是酮基。更优选地,酮基是如下所示的式(9y),其中r15选自由直链或支链的c1-c12烷基和c6-c12芳基组成的组。优选地,r15是c1-c6烷基,更优选r15是c1-c4烷基。甚至更优选r15是甲基,乙基,正丙基,异丙基,正丁基,仲丁基或叔丁基。还甚至更优选r15是甲基。
在另一个优选的实施方式中,q1是(o-烷基)羟基氨基。更优选地,(o-烷基)羟基氨基是根据如下所示的式(9z)。
在另一个优选的实施方式中,q1是肼基。优选地,肼基是根据如下所示的式(9za)。
在另一个优选的实施方式中,q1是卤代n-马来酰亚胺基或磺酰化n-马来酰亚胺基。当q1是卤代或磺酰化的n-马来酰亚胺基时,q1优选是根据如下所示的式(9ze),其中r6独立地选自由氢f,cl,br,i-sr18a和-os(o)2r18b组成的组,其中r18a是任选取代的c4-c12(杂)芳基,优选苯基或吡啶基,r18b选自由任选取代的c1-c12烷基和c4-c12(杂)芳基组成的组,优选甲苯基或甲基,并且前提条件是至少一个r6不是氢。当r6是卤素时(即当r6是f,cl,br或i时),优选r6是br。在一个实施方式中,卤代n-马来酰亚胺基是卤代2,3-二氨基丙酸(dpr)马来酰亚胺基,其可以通过羧酸部分与接头-缀合物的其余部分连接。
在另一个优选的实施方式中,q1是根据如下所示的式(9zf)的羰基卤基,其中x选自由f,cl,br和i组成的组。优选地,x是cl或br,并且最优选地,x是cl。
在另一个优选的实施方式中,q1是根据式(9zg)的联烯酰胺基。
在另一个优选的实施方式中,q1是根据式(9zh)的1,1-双(磺酰基甲基)甲基羰基或其消除衍生物,其中r18选自由任选取代的c1-c12烷基和c4-c12(杂)芳基组成的组。更优选地,r18是任选取代的c1-c6烷基或c4-c6(杂)芳基,最优选苯基。
其中k,l,x,t,u,v,r4,r5,r6,r7,r8,r9,r10,r11,r12,r13,r14,r15,r16,r17,r18和r19如上所定义。
在如下文所述的根据本发明的缀合方法的优选实施方式中,通过环加成实现缀合,例如狄尔斯-阿尔德反应或1,3-偶极环加成,优选1,3-偶极环加成。根据该实施方式,反应性基团q1(以及生物分子上的f1)选自在环加成反应中有反应性的基团。在本文中,反应性基团q1和f1是互补的,即它们能够在环加成反应中彼此反应,所获得的环状部分是连接基团z3。
对于狄尔斯-阿尔德反应,f1和q1中的一个是二烯,而f1和q1中的另一个是亲二烯体。如本领域技术人员所理解的,在狄尔斯-阿尔德反应的上下文中,术语“二烯”是指1,3-(杂)二烯,并且包括共轭二烯(r2c=cr-cr=cr2)、亚胺(例如r2c=cr-n=cr2或r2c=cr-cr=nr、r2c=n-n=cr2)和羰基(例如r2c=cr-cr=o或o=cr-cr=o)。与含n和o的二烯的杂-狄尔斯-阿尔德反应是本领域技术人员已知的。本领域已知适用于狄尔斯-阿尔德反应的任何二烯可用作反应性基团q1或f1。优选的二烯包括如上所述的四嗪,如上所述的1,2-醌和如上所述的三嗪。尽管本领域已知适合于狄尔斯-阿尔德反应的任何亲二烯体可用作反应性基团q1或f1,但亲二烯体优选为如上所述的烯基或炔基,最优选为炔基。对于通过狄尔斯-阿尔德反应的缀合,优选f1是二烯并且q1是亲二烯体。在此,当q1是二烯时,f1是亲二烯体,当q1是亲二烯体时,f1是二烯。最优选地,q1是亲二烯体,优选q1是或包含炔基,f1是二烯,优选四嗪、1,2-醌或三嗪基。
对于1,3-偶极环加成,f1和q1中的一个是1,3-偶极子,而f1和q1中的另一个是亲偶极体。本领域已知适用于1,3-偶极环加成的任何1,3-偶极子可用作反应性基团q1或f1。优选的1,3-偶极子包括叠氮基,硝酮基,氧化腈基,腈亚胺基和重氮基。尽管本领域已知适用于1,3-偶极环加成的任何亲偶极体可用作反应性基团q1或f1,但亲偶极体优选为烯基或炔基,最优选为炔基。对于通过1,3-偶极环加成的缀合,优选f1是1,3-偶极子,q1是亲偶极体。当q1是1,3-偶极子时,f1是亲偶极体,当q1是亲偶极体时,f1是1,3-偶极子。最优选地,q1是亲偶极体,优选q1是或包含炔基,f1是1,3-偶极子,优选叠氮基。
因此,在一个优选的实施方式中,q1选自亲偶极体和亲二烯体。优选地,q1是烯基或炔基。在一个特别优选的实施方式中,q1包含炔基,优选选自如上所述的炔基,如上所述的环烯基,如上所述的(杂)环炔基和双环[6.1.0]非4-炔-9-基],更优选q1选自如上定义和如下所述的式(9j),(9n),(9o),(9p),(9q),(9zk)和(9zo),例如选自式(9j),(9n),(9o),(9p),(9q)和(9zk),更优选选自式(9n),(9o),(9p),(9q)和(9zk)或选自式(9j),(9n),(9q)和(9zo)。最优选地,q1是双环[6.1.0]壬-4-炔-9-基],优选式(9q)。已知这些基团在与如本文所述的叠氮基官能化生物分子的缀合中非常有效,并且当根据本发明的磺酰胺接头用于这种接头-缀合物中时,任何聚集都有利地减少到最小。
如上所述,在接头-缀合物中,q1能够与存在于生物分子上的反应性基团f1反应。反应性基团q1的互补反应性基团f1是本领域技术人员已知的,并且在下面更详细地描述。f1和q1之间的反应的一些代表性实例及其包含连接基团z3的相应产物描绘于图11中。
如上所述,d和q1共价连接在根据本发明的接头-缀合物中,优选通过如上定义的接头l。d与接头的共价连接可以例如通过存在于d上的官能团f2与存在于接头上的反应性基团q2的反应而发生。用于将d连接到接头的合适的有机反应是本领域技术人员已知的,与反应性基团q2互补的官能团f2也是已知的。因此,d可以通过连接基团z连接到接头上。
本文中的术语“连接基团”是指连接化合物的一部分和相同化合物的另一部分的结构元件。如本领域技术人员所理解的,连接基团的性质取决于获得所述化合物部分之间的连接的有机反应的类型。例如,当r-c(o)-oh的羧基与h2n-r′的氨基反应以形成r-c(o)-n(h)-r′时,r通过连接基团z与r′连接,z可以由基团-c(o)-n(h)-表示。
反应性基团q1可以以类似的方式连接到接头上。因此,q1可以通过连接基团z连接到间隔子部分。
本领域已知许多反应用于将靶分子连接到接头上,以及将反应性基团q1连接到接头上。因此,多种连接基团z可以存在于接头-缀合物中。
在一个实施方式中,接头-缀合物是根据下式的化合物:
(q1)y(zw)sp(zx)(d)z,
其中:
-y是1到10范围内的整数;
-z是1至10范围内的整数;
-q1是能够与存在于生物分子上的官能团f1反应的反应性基团;
-d是靶分子;
-sp是间隔子部分,其中间隔子部分定义为间隔(即在其间提供一定距离)并共价连接q1和d的部分;
-zw是连接q1与所述间隔子部分的连接基团;
-zx是连接d与所述间隔子部分的连接基团;并且
其中所述间隔子部分是接头l,因此包含根据式(1)的基团或其盐,其中根据式(1)的基团如上所定义。
在一个优选的实施方式中,根据式(1)的基团中的a为0。在另一个优选的实施方式中,根据式(1)的基团中的a为1。
y和z的优选实施方式如上对(q1)ysp(d)z所定义。进一步优选该化合物根据式q1(zw)sp(zx)(d)4、q1(zw)sp(zx)(d)3、q1(zw)sp(zx)(d)2或q1(zw)sp(zx)d,更优选q1(zw)sp(zx)(d)2或q1(zw)sp(zx)d,最优选q1(zw)sp(zx)d,其中zw和zx如上所定义。
优选地,zw和zx独立地选自由-o-、-s-、-nr2-、-n=n-、-c(o)-、-c(o)nr2-、-oc(o)-、-oc(o)o-、-oc(o)nr2、-nr2c(o)-、-nr2c(o)o-、-nr2c(o)nr2-、-sc(o)-、-sc(o)o-、-sc(o)nr2-、-s(o)-、-s(o)2-、-os(o)2-、-os(o)2o-、-os(o)2nr2-、-os(o)-、-os(o)o-、-os(o)nr2-、-onr2c(o)-、-onr2c(o)o-、-onr2c(o)nr2-、-nr2oc(o)-、-nr2oc(o)o-、-nr2oc(o)nr2-、-onr2c(s)-、-onr2c(s)o-、-onr2c(s)nr2-、-nr2oc(s)-、-nr2oc(s)o-、-nr2oc(s)nr2-、-oc(s)-、-oc(s)o-、-oc(s)nr2-、-nr2c(s)-、-nr2c(s)o-、-nr2c(s)nr2-、-ss(o)2-、-ss(o)2o-、-ss(o)2nr2-、-nr2os(o)-、-nr2os(o)o-、-nr2os(o)nr2-、-nr2os(o)2-、-nr2os(o)2o-、-nr2os(o)2nr2-、-onr2s(o)-、-onr2s(o)o-、-onr2s(o)nr2-、-onr2s(o)2o-、-onr2s(o)2nr2-、-onr2s(o)2-、-op(o)(r2)2-、-sp(o)(r2)2-、-nr2p(o)(r2)2-及其两种或更多种的组合组成的组,其中r2独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
d和q1的优选实施方式如上所定义。
在一个实施方式中,接头-缀合物是根据式(4a)或(4b)的化合物或其盐:
其中:
-a独立地为0或1;
-b独立地为0或1;
-c为0或1;
-d为0或1;
-e为0或1;
-f是1至150范围内的整数;
-g为0或1;
-i为0或1;
-d是靶分子;
-q1是能够与存在于生物分子上的官能团f1反应的反应性基团;
-sp1是间隔子部分;
-sp2是间隔子部分;
-sp3是间隔子部分;
-sp4是间隔子部分;
-z1是将q1或sp3连接到sp2、o或c(o)或n(r1)的连接基团;
-z2是将d或sp4连接到sp1、n(r1)、o或c(o)的连接基团;以及
-r1选自由氢,c1-c24烷基,c3-c24环烷基,c1-c24(杂)芳基,c1-c24烷基(杂)芳基和c1-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选取代和任选中断,其中r3独立地选自由氢和c1-c4烷基组成的组;或
-r1是d,-[(sp1)b(z2)e(sp4)id]或-[(sp2)c(z1)d(sp3)gq1],其中d是另一个靶分子,sp1,sp2,sp3,sp4,z1,z2,q1,b,c,d,e,g和i如上所定义。
在一个优选的实施方式中,根据式(4a)或(4b)的化合物中的a为1。在另一个优选的实施方式中,根据式(4a)或(4b)的化合物中的a为0。
如上所述,z1是将q1或sp3连接到sp2,o或c(o)或n(r1)的连接基团,z2是d或sp4连接到sp1,n(r1),o或c(o)的连接基团。如上面更详细描述的,术语“连接基团”是指连接化合物的一部分和相同化合物的另一部分的结构元件。
在根据式(4a)的化合物中,当连接基团z1存在时(即当d为1时),将q1(任选地通过间隔子部分sp3)连接到根据式(4a)的化合物的o原子或c(o)基团,任选地通过间隔子部分sp2。更具体地,当z1存在时(即d为1),并且当sp3和sp2不存在时(即g为0且c为0),z1将q1连接到根据式(4a)的接头-缀合物的o原子(a为1)或c(o)基团(a为0)。当z1存在(即当d为1时),sp3(即g为1)存在且sp2不存在(即c为0)时,z1将间隔子部分sp3连接到根据式(4a)的接头-缀合物的o原子(a为1)或c(o)基团(a为0)。当z1存在时(即d为1),并且当sp3和sp2存在时(即g为1且c为1),z1将间隔子部分sp3连接到根据式(4a)的接头-缀合物的间隔子部分sp2。当z1存在(即当d为1时),sp3不存在(即g为0)且sp2存在(即c为1)时,z1将q1连接到根据式(4a)的接头-缀合物的间隔子部分sp2。
在根据式(4b)的化合物中,当连接基团z1存在时(即当d为1时),将q1(任选地通过间隔子部分sp3)连接到根据式(4b)的接头-缀合物中的n(r1)基团的n原子,任选地通过间隔子部分sp2。更具体地,当z1存在时(即d为1),并且当sp3和sp2不存在时(即g为0且c为0),z1将q1连接到根据式(4b)的接头-缀合物的n(r1)基团的n原子。当z1存在(即当d为1时),sp3存在(即g为1)且sp2不存在(即c为0)时,z1将间隔子部分sp3连接到根据式(4b)的接头-缀合物的n(r1)基团的n原子。当z1存在时(即d为1),并且当sp3和sp2存在时(即g为1且c为1),z1将间隔子部分sp3连接到根据式(4b)的接头-缀合物的间隔子部分sp2。当z1存在(即当d为1时),sp3不存在(即g为0)且sp2存在(即c为1)时,z1将q1连接到根据式(4b)的接头-缀合物的间隔子部分sp2。
在根据式(4a)的化合物中,当c、d和g均为0时,q1直接连接到根据式(4a)的接头-缀合物的o原子(当a为1时)或c(o)基团(当a为0时)。
在根据式(4b)的化合物中,当c、d和g均为0时,q1直接连接到根据式(4b)的接头-缀合物的n(r1)基团的n原子。
在根据式(4a)的化合物中,当连接基团z2存在时(即,当e为1时),将d(任选地通过间隔子部分sp4)连接到根据式(4a)的接头-缀合物中的n(r1)基团的n原子,任选地通过间隔子部分sp1。更具体地,当z2存在时(即e为1),并且当sp1和sp4不存在时(即b为0且i为0),z2将d连接到根据式(4a)的接头-缀合物的n(r1)基团的n原子。当z2存在(即当e为1时),sp4存在(即i为1)且sp1不存在(即b为0)时,z2将间隔子部分sp4连接到根据式(4a)的接头-缀合物的n(r1)基团的n原子。当z2存在时(即e为1),并且当sp1和sp4存在时(即b为1且i为1),z2将间隔子部分sp1连接到根据式(4a)的机头-缀合物的间隔子部分sp4。当z2存在(即当e为1时),sp4不存在(即i为0)且sp1存在(即b为1)时,z2将d连接到根据式(4a)的接头-缀合物的间隔子部分sp1。
在根据式(4a)的化合物中,当b、e和i均为0时,则d直接连接到根据式(4a)的接头-缀合物的n(r1)基团的n原子。
在根据式(4b)的化合物中,当b、e和i均为0时,则d直接连接到根据式(4b)的接头-缀合物的o原子(当a为1时)或c(o)基团(当a为0时)。
如本领域技术人员所理解的,连接基团的性质取决于获得所述化合物的特定部分之间的连接的有机反应的类型。大量有机反应可用于将反应性基团q1连接到间隔子部分,并用于将靶分子连接到间隔子部分。因此,存在多种连接基团z1和z2。
在根据式(4a)和(4b)的接头-缀合物的优选实施方式中,z1和z2独立地选自由-o-,-s-,-ss-,-nr2-,-n=n-,-c(o)-,-c(o)nr2-,-oc(o)-,-oc(o)o-,-oc(o)nr2-,-nr2c(o)-,-nr2c(o)o-,-nr2c(o)nr2-,-sc(o)-,-sc(o)o-,-s-c(o)nr2-,-s(o)-,-s(o)2-,-os(o)2-,-os(o)2o-,-os(o)2nr2-,-os(o)-,-os(o)o-,-os(o)nr2-,-onr2c(o)-,-onr2c(o)o-,-onr2c(o)nr2-,-nr2oc(o)-,-nr2oc(o)o-,-nr2oc(o)nr2-,-onr2c(s)-,-onr2c(s)o-,-onr2c(s)nr2-,-nr2oc(s)-,-nr2oc(s)o-,-nr2oc(s)nr2-,-oc(s)-,-oc(s)o-,-oc(s)nr2-,-nr2c(s)-,-nr2c(s)o-,-nr2c(s)nr2-,-ss(o)2-,-ss(o)2o-,-ss(o)2nr2-,-nr2os(o)-,-nr2os(o)o-,-nr2os(o)nr2-,-nr2os(o)2-,-nr2os(o)2o-,-nr2os(o)2nr2-,-onr2s(o)-,-onr2s(o)o-,-onr2s(o)nr2-,-onr2s(o)2o-,-onr2s(o)2nr2-,-onr2s(o)2-,-op(o)(r2)2-,-sp(o)(r2)2-,-nr2p(o)(r2)2-及其两种或更多种的组合组成的组,其中r2独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
如上所述,在根据式(4a)或(4b)的化合物中,sp1,sp2,sp3和sp4是间隔子部分。sp1,sp2,sp3和sp4可以独立地不存在或存在(b,c,g和i独立地为0或1)。sp1(如果存在)可以不同于sp2(如果存在),不同于sp3和/或不同于sp4(如果存在)。
间隔子部分是本领域技术人员已知的。合适的间隔子部分的实例包括(聚)乙二醇二胺(例如1,8-二氨基-3,6-二氧杂辛烷或包含较长乙二醇链的等价物),聚乙二醇链或聚环氧乙烷链,聚丙二醇链或聚环氧丙烷链和1,x-二氨基烷烃,其中x是烷烃中的碳原子数。
另一类合适的间隔子部分包含可切割间隔子部分或可切割接头。可切割接头在本领域中是众所周知的。例如,shabat等,softmatter2012,6,1073,其通过引用并入本文,公开了包含自我牺牲部分的可切割接头,所述自我牺牲部分在生物触发时释放,例如酶促裂解或氧化事件。合适的可切割接头的一些实例是在还原时被切割二硫化物-接头,在被蛋白酶(例如组织蛋白酶,纤溶酶或金属蛋白酶)特异性识别时被切割的肽接头,或在被糖苷酶(例如葡萄糖醛酸酶)特异性识别时被切割的基于糖苷的接头,或在缺氧、低氧区域中还原的硝基芳香族化合物。在本文中,合适的可切割间隔子部分还包括包含特定的可切割氨基酸序列的间隔子部分。示例包括例如包含val-ala(缬氨酸-丙氨酸)或val-cit(缬氨酸-瓜氨酸)部分的间隔子部分。
在根据式(4a)和(4b)的接头-缀合物的优选实施方式中,间隔子部分sp1,sp2,sp3和/或sp4(如果存在)包含氨基酸序列。包含氨基酸序列的间隔子部分在本领域中是已知的,并且还可以称为肽接头。实例包括包含val-cit部分的间隔子部分,例如val-cit-pabc,val-cit-pab,fmoc-val-cit-pab等。优选地,在接头-缀合物中使用val-cit-pabc部分。
在根据式(4a)和(4b)的接头-缀合物的优选实施方式中,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c200亚烷基,c2-c200亚烯基,c2-c200亚炔基,c3-c200亚环烷基,c5-c200亚环烯基,c8-c200亚环炔基,c7-c200烷基亚芳基,c7-c200芳基亚烷基,c8-c200芳基亚烯基和c9-c200芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。当亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个如上定义的杂原子中断时,优选所述基团被一个或多个o原子和/或被一个或多个s-s基团中断。
更优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c100亚烷基,c2-c100亚烯基,c2-c100亚炔基,c3-c100亚环烷基,c5-c100亚环烯基,c8-c100亚环炔基,c7-c100烷基亚芳基,c7-c100芳基亚烷基,c8-c100芳基亚烯基和c9-c100芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
甚至更优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c50亚烷基,c2-c50亚烯基,c2-c50亚炔基,c3-c50亚环烷基,c5-c50亚环烯基,c8-c50亚环炔基,c7-c50烷基亚芳基,c7-c50芳基亚烷基,c8-c50芳基亚烯基和c9-c50芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
还甚至更优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c20亚烷基,c2-c20亚烯基,c2-c20亚炔基,c3-c20亚环烷基,c5-c20亚环烯基,c8-c20亚环炔基,c7-c20烷基亚芳基,c7-c20芳基亚烷基,c8-c20芳基亚烯基和c9-c20芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,烷炔基和环烷基是任选取代的。
在这些优选的实施方式中,进一步优选亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基是未取代的和被一个或多个选自o、s和nr3的组的杂原子(优选o)任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,优选氢或甲基。
最优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c20亚烷基,所述亚烷基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。在该实施方式中,进一步优选亚烷基是未取代的和被一个或多个选自o、s和nr3的组的杂原子(优选o和/或s)任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,优选氢或甲基。
因此,优选的间隔子部分sp1,sp2,sp3和sp4包括-(ch2)n-、-(ch2ch2)n-、-(ch2ch2o)n-、-(och2ch2)n-、-(ch2ch2o)nch2ch2-、-ch2ch2(och2ch2)n-、-(ch2ch2ch2o)n-、-(och2ch2ch2)n-、-(ch2ch2ch2o)nch2ch2ch2-和-ch2ch2ch2(och2ch2ch2)n-,其中n是1至50范围内的整数,优选1至40范围内,更优选1至30范围内,甚至更优选在1至20范围内,还甚至更优选1至15范围内。更优选n为1、2、3、4、5、6、7、8、9或10,更优选1、2、3、4、5、6、7或8,甚至更优选1、2、3、4、5或6,还甚至更优选1、2、3或4。
由于sp1,sp2,sp3和sp4是独立选择的,因此sp1(如果存在)可以不同于sp2(如果存在),不同于sp3和/或sp4(如果存在)。
以上更详细地描述了反应性基团q1。在根据式(4a)和(4b)的接头-缀合物中,优选反应性基团q1选自由任选取代的n-马来酰亚胺基,卤代n-烷基酰氨基,磺酰氧基n-烷基酰氨基,酯基,碳酸酯基,磺酰卤基,硫醇基或其衍生物,烯基,炔基,(杂)环炔基,双环[6.1.0]壬-4-炔-9-基],环烯基,四嗪基,叠氮基,膦基,氧化腈基,硝酮基,腈亚胺基,重氮基,酮基,(o-烷基)羟基氨基,肼基,卤代n-马来酰亚胺基,碳酰卤基,联烯酰胺基和1,1-双(磺酰基甲基)甲基羰基或其消除衍生物。在另一个优选的实施方式中,q1是根据式(9a),(9b),(9c),(9d),(9e),(9f),(9g),(9h),(9i),(9j),(9k),(9l),(9m),(9n),(9o),(9p),(9q),(9r),(9s),(9t),(9u),(9v),(9w),(9x),(9y),(9z),(9za),(9zb),(9zc),(9zd),(9ze),(9zf),(9zg),(9zh),(9zi),(9zj)或(9zk),其中(9a),(9b),(9c),(9d),(9e),(9f),(9g),(9h),(9i),(9j),(9k),(9l),(9m),(9n),(9o),(9p),(9q),(9r),(9s),(9t),(9u),(9v),(9w),(9x),(9y),(9z),(9za),(9zb),(9zc),(9zd),(9ze),(9zf),(9zg),(9zh),(9zi),(9zj),(9zk),(9zo)及其优选实施方式如上所定义。在一个优选的实施方式中,q1是根据式(9a),(9b),(9c),(9f),(9j),(9n),(9o),(9p),(9q),(9s),(9t),(9zh),(9zo)或(9r)。在更进一步优选的实施方式中,q1是根据式(9a),(9j),(9n),(9o),(9q),(9p),(9t),(9zh),(9zo)或(9s),在一个特别优选的实施方式中,q1是根据如上所述的式(9a),(9q),(9n),(9o),(9p),(9t),(9zo)或(9zh)及其优选实施方式。
根据式(4a)和(4b)的接头-缀合物中的靶分子d和靶分子d的优选实施方式如上所定义。
如上所述,r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或r1是d,-[(sp1)b(z2)e(sp4)id]或-[(sp2)c(z1)d(sp3)gq1],其中d是另一个靶分子,sp1,sp2,sp3,sp4,z1,z2,q1,b,c,d,e,g和i如上所定义。
在一个优选的实施方式中,r1是氢或c1-c20烷基,更优选r1是氢或c1-c16烷基,甚至更优选r1是氢或c1-c10烷基,其中烷基被一个或多个选自o、s和nr3的杂原子(优选o)任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组。在进一步优选的实施方式中,r1是氢。在另一个进一步优选的实施方式中,r1是c1-c20烷基,更优选c1-c16烷基,甚至更优选c1-c10烷基,其中烷基任选地被一个或多个o原子中断,并且其中烷基任选被-oh基团取代,优选末端-oh基团。在该实施方式中,进一步优选r1是包含末端-oh基团的聚乙二醇链。在另一个进一步优选的实施方式中,r1是c1-c12烷基,更优选c1-c6烷基,甚至更优选c1-c4烷基,还甚至更优选r1选自由甲基,乙基,正丙基,异丙基,正丁基,仲丁基和叔丁基组成的组。
在另一个优选的实施方式中,r1是另一个靶分子d,-[(sp1)b(z2)e(sp4)id]或-[(sp2)c(z1)d(sp3)gq1],其中d是靶分子,sp1,sp2,sp3,sp4,z1,z2,q1,b,c,d,e,g和i如上所定义。当r1是d或-[(sp1)b(z2)e(sp4)id]时,进一步优选接头-缀合物是根据式(4a)。在该实施方式中,接头-缀合物(4a)包含两个靶分子d,它们可以相同或不同。当r1是-[(sp1)b(z2)e(sp4)id]时,-[(sp1)b(z2)e(sp4)id]中的sp1,b,z2,e,sp4,i和d可以是与连接到n(r1)的n原子的-[(sp1)b(z2)e(sp4)id]中的sp1,b,z2,e,sp4,i和d相同或不同。在优选的实施方式中,-[(sp1)b(z2)e(sp4)id]和n(r1)的n原子上的-[(sp1)b(z2)e(sp4)id]两者是相同的。
当r1是-[(sp2)c(z1)d(sp3)gq1]时,进一步优选接头-缀合物是根据式(4b)。在该实施方式中,接头-缀合物(4b)包含两个靶分子q1,它们可以相同或不同。当r1为-[(sp2)c(z1)d(sp3)gq1]时,-[(sp2)c(z1)d(sp3)gq1]中的sp2,c,z1,d,sp3,g和d可以与连接到n(r1)的n原子的其它-[(sp2)c(z1)d(sp3)gq1]中的sp1,b,z2,e,sp4,i和q1相同或不同。在优选的实施方式中,n(r1)的n原子上的-[(sp2)c(z1)d(sp3)gq1]基团是相同的。
在根据式(4a)和(4b)的接头-缀合物中,f是1至150范围内的整数。因此,接头-缀合物可以包含多于一个根据式(1)的基团,根据式(1)的基团如上所定义。当存在多于一个根据式(1)的基团时,即当f为2或更大时,则独立地选择a,b,sp1和r1。换句话说,当f为2或更大时,每个a独立地为0或1,每个b独立地为0或1,每个sp1可以相同或不同,每个r1可以相同或不同。在一个优选的实施方式中,f是1至100范围内的整数,优选1至50范围内的整数,更优选1至25范围内,甚至更优选1至15范围内。在该实施方式中,更优选地,f为1、2、3、4、5、6、7、8、9或10,甚至更优选f为1、2、3、4、5、6、7或8,还甚至更优选f为1、2、3、4、5或6,还甚至更优选f为1、2、3或4,最优选f为1。在另一个优选的实施方式中,f是2至150范围内的整数,优选2至100范围内,更优选2至50范围内,更优选2至25范围内,甚至更优选2至15范围内。在该实施方式中,更优选地,f为2、3、4、5、6、7、8、9或10,甚至更优选f为2、3、4、5、6、7或8,还甚至更优选f为2、3、4、5或6,还甚至更优选f为2、3或4,最优选f为2。
如上所述,在一个优选的实施方式中,根据式(4a)或(4b)的化合物中的a为0。因此,接头-缀合物也可以是根据式(6a)或(6b)的化合物或其盐:
其中a,b,c,d,e,f,g,i,d,q1,sp1,sp2,sp3,sp4,z1,z2和r1及其优选实施方式如上对(4a)和(4b)所定义。
如上所述,在另一个优选的实施方式中,根据式(4a)或(4b)的化合物中的a为1。因此,接头-缀合物也可以是根据式(7a)或(7b)的化合物或其盐:
其中a,b,c,d,e,f,g,i,d,q1,sp1,sp2,sp3,sp4,z1,z2和r1及其优选实施方式如上对(4a)和(4b)所定义。
当根据式(4a)的接头-缀合物中不存在sp4时,即当i为0时,d连接到z2(当e为1时),sp1(当e为0且b为1时)或n(r1)(当e为0且b为0时)。当根据式(4b)的接头-缀合物中不存在sp4时,即当i为0时,d连接到z2(当e为1时),sp1(当e为0且b为1时),o原子(当a为1且b和e为0时)或c(o)基团(当a为0且b和e为0时)。因此,接头-缀合物也可以是根据式(4c)或(4d)的化合物或其盐:
其中a,b,c,d,e,f,g,d,q1,sp1,sp2,sp3,z1,z2和r1及其优选实施方式如上对(4a)和(4b)所定义。
在一个优选的实施方式中,根据式(4c)或(4d)的接头-缀合物中的a为0。在另一个优选的实施方式中,根据式(4c)或(4d)的接头-缀合物中的a为1。
在接头-缀合物的具体实施方式中,特别是根据式(4a),(4b),(4c),(4d),(6a),(6b),(7a)或(7b)的接头-缀合物,sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c20亚烷基组成的组,所述亚烷基被一个或多个选自由o、s和nr3的组成的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,q1是根据式(9a),(9b),(9c),(9d),(9e),(9f),(9g),(9h),(9i),(9j),(9k),(9l),(9m),(9n),(9o),(9p),(9q),(9r),(9s),(9t),(9u),(9v),(9w),(9x),(9y),(9z),(9za),(9zb),(9zc),(9zd),(9ze),(9zf),(9zg),(9zh),(9zi),(9zj)或(9zk),其中(9a),(9b),(9c),(9d),(9e),(9f),(9g),(9h),(9i),(9j),(9k),(9l),(9m),(9n),(9o),(9p),(9q),(9r),(9s),(9t),(9u),(9v),(9w),(9x),(9y),(9z),(9za),(9zb),(9zc),(9zd),(9ze),(9zf),(9zg),(9zh),(9zi),(9zj),(9zk),(9zo)及其优选实施方式如上所定义。在一个优选的实施方式中,q1是根据式(9a),(9b),(9c),(9f),(9j),(9n),(9o),(9p),(9q),(9s)(9t),(9zh),(9zo)或(9r)。在更进一步优选的实施方式中,q1是根据式(9a),(9j),(9n),(9o),(9p),(9q),(9t),(9zh),(9zo)或(9s),在一个特别优选的实施方式中,q1是根据如上所述的式(9a),(9q),(9n),(9p),(9t),(9zh),(9zo)或(9o)及其优选实施方式。
优选包含在如上定义的根据式(4a),(4b),(4c),(4d),(6a),(6b),(7a)或(7b)的接头-缀合物中的接头l、如上定义的接头可以分别由式(8a)和(8b)表示:
如本领域技术人员所理解的,间隔子部分(8a)和(8b)的优选实施方式可以取决于例如接头-缀合物中反应性基团q1和d的性质,制备接头-缀合物的合成方法(例如靶分子上互补官能团f2的性质),使用接头-缀合物制备的生物缀合物的性质(例如生物分子上互补官能团f1的性质)。
例如,当q1是根据如上定义的式(9n),(9o),(9p),(9q)或(9zk)的环辛炔基时,则优选存在sp3(g为1)。
例如,当通过具有叠氮基官能团f2的根据式(9n),(9o),(9p),(9q)或(9zk)的环辛炔基的反应性基团q2反应制备接头-缀合物时,则优选存在sp4(i为1)。
此外,优选存在sp1,sp2,sp3和sp4中的至少一种,即b,c,g和i中的至少一个不为0。在另一个优选的实施方式中,存在sp1和sp4中的至少一个和sp2和sp3中的至少一个。
当f为2或更大时,优选存在sp1(b为1)。
当包含在如下文更详细描述的根据本发明的生物缀合物中时,接头部分(8a)和(8b)的这些优选实施方式也适用于接头-缀合物。
sp1,sp2,sp3和sp4的优选实施方式如上所定义。
生物分子
生物分子由b-f1表示,其中b是生物分子,f1是能够与接头-缀合物上的反应性基团q1反应的官能团,“-”是键或间隔子部分。在一个实施方式中,“-”是如本文定义的间隔子部分。在一个实施方式中,“-”是键,通常是共价键。生物分子也可称为“感兴趣的生物分子”(boi)。生物分子可以是天然存在的生物分子,其中官能团f1已经存在于感兴趣的生物分子中,例如硫醇,胺,醇或羟基酚单元。然后通过如上定义的第一种方法发生与接头-缀合物的缀合。或者,生物分子可以是修饰的生物分子,其中官能团f1特异性地掺入感兴趣的生物分子中,并且通过该工程化功能发生与接头-缀合物的缀合,即如上定义的生物缀合的两阶段方法。生物分子的这种修饰以掺入特定功能是已知的,例如,来自wo2014/065661,其全部内容通过引用并入本文。
在根据本发明的生物缀合物中,生物分子b优选选自由蛋白质(包括糖蛋白和抗体),多肽,肽,聚糖,脂质,核酸,寡核苷酸,多糖,寡糖,酶,激素,氨基酸和单糖组成的组。更优选地,生物分子b选自由蛋白质(包括糖蛋白和抗体),多肽,肽,聚糖,核酸,寡核苷酸,多糖,寡糖和酶组成的组。更优选地,生物分子b选自由蛋白质(包括糖蛋白和抗体),多肽,肽和聚糖组成的组。最优选地,生物分子b是抗体或其抗原结合片段。
官能团f1能够与接头-缀合物上的反应性基团q1反应以形成连接基团z3。对于技术人员而言,清楚哪个官能团f1能够与互补的反应性基团q1反应。与如上定义的反应性基团q1互补的且本领域技术人员已知的官能团f1在下面更详细地描述。f1和q1之间的反应的一些代表性实例及其包含连接基团z3的相应产物描绘于图11中。
在根据本发明的制备生物缀合物的方法中,存在于接头-缀合物中的反应性基团q1通常与官能团f1反应。生物分子中可以存在多于一个官能团f1。当存在两个或更多个官能团时,所述基团可以相同或不同。在另一个优选的实施方式中,生物分子包含两个或更多个官能团f,其可以相同或不同,并且两个或更多个官能团与接头-缀合物的互补反应性基团q反应。例如,包含两个官能团f(即f1和f2)的生物分子可以与包含官能团q1的两个接头-缀合物反应,其可以相同或不同,以形成生物缀合物。
生物分子中的官能团f1的实例包括氨基,硫醇基,羧酸,醇基,羰基,磷酸基或芳族基。生物分子中的官能团可以是天然存在的,或者可以通过特定技术例如(生物)化学或遗传技术置于生物分子中。置于生物分子中的官能团可以是天然存在于自然界中的官能团,或者可以是通过化学合成制备的官能团,例如叠氮化物,末端炔烃,环丙烯部分或膦部分。鉴于通过环加成缀合的优选方式,优选f1是能够在环加成中反应的基团,例如二烯,亲二烯体,1,3-偶极子或亲偶极体,优选f1选自1,3-偶极子(通常为叠氮基,硝酮基,氧化腈基,腈亚胺基或重氮基)或亲偶极体(通常为烯基或炔基)。在此,当q1是亲偶极体时f1是1,3-偶极子,当q1是1,3-偶极子时f1是亲偶极体,或者当q1是亲二烯体时f1是二烯,当q1是二烯时f1是亲二烯体。最优选地,f1是1,3-偶极子,优选f1是或包含叠氮基。
置于生物分子中的官能团的几个实例显示在图2中。图2显示了半乳糖胺的udp糖衍生物的几种结构,其可以例如在2-位置处用硫代丙酰基(11a),叠氮基乙酰基(11b)或叠氮基二氟乙酰基(11c)修饰,或在n-乙酰基半乳糖胺的6-位置处用叠氮基(11d)修饰。在一个实施方式中,官能团f1是硫代丙酰基,叠氮基乙酰基或叠氮基二氟乙酰基。
图3示意性地显示了在半乳糖基转移酶突变体或galnac-转移酶的作用下,任何udp糖11a-d可以如何与包含glcnac部分12的糖蛋白(例如,聚糖被内切糖苷酶修饰的单克隆抗体)连接,从而在galnac衍生物和glcnac之间产生β-糖苷1-4连接(分别为化合物13a-d)。
天然存在的官能团f1的优选实例包括硫醇基和氨基。通过化学合成制备用于掺入生物分子中的官能团的优选实例包括酮基,末端炔基,叠氮基,环(杂)炔基,环丙烯基或四嗪基。
如上所述,互补反应性基团q1和官能团f1是本领域技术人员已知的,并且q1和f1的几种合适的组合如上所述,且示于图11中。互补基团q1和f1的列表公开于g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013年(isbn:978-0-12-382239-0)的第3章的第230-232页的表3.1中,该表的内容通过引用明确地并入本文。
生物缀合物
生物缀合物在本文中定义为其中生物分子通过接头与靶分子d共价连接的化合物。生物缀合物包含一个或多个生物分子和/或一个或多个靶分子。接头可包含一个或多个间隔子部分。根据本发明的生物缀合物通过根据本发明的制备生物缀合物的方法方便地制备,其中包含反应性基团q1的接头-缀合物与包含官能团f1的生物分子缀合。在该缀合反应中,基团q1和f1彼此反应以形成连接基团z3,其连接靶分子d与生物分子b。本文所述的接头-缀合物和生物分子的所有优选实施方式因此同样适用于根据本发明的生物缀合物。除了对q1和f1所说的全部外,本发明的生物缀合物包含q1和f1的反应产物,即连接基团z3。
根据本发明的生物缀合物具有式(a):
b-l-d
(a),
其中:
-b是生物分子;
-l是连接b和d的接头;
-d是靶分子;以及
-每次出现的“-”独立地是键或间隔子部分,
其中,l包含根据式(1)的基团或其盐:
其中:
-a为0或1;以及
-r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或r1是另一个靶分子d,其中d任选地通过间隔子部分与n连接。
在一个实施方式中,“-”是如本文定义的间隔子部分。在一个实施方式中,“-”是键,通常是共价键。
在一个优选的实施方式中,生物缀合物由b-z3-l-d表示,其中b,l,d和“-”如上所定义,z3是可以通过q1与f1反应得到的连接基团。优选地,部分z3可通过环加成反应获得,优选1,3-偶极环加成反应,最优选z3是1,2,3-三唑环,其位于间隔子部分,优选b和l之间的间隔子部分,最优选在b与根据式(1)的基团的羰基或羧基末端之间。
当根据本发明的生物缀合物包含根据式(1)的基团的盐时,该盐优选为药学上可接受的盐。
根据本发明的生物缀合物可以包含多于一个靶分子。类似地,生物缀合物可以包含多于一个生物分子。以上更详细地描述了生物分子b和靶分子d及其优选实施方式。根据本发明的生物缀合物中d的优选实施方式对应于如上文更详细描述的根据本发明的接头-缀合物中d的优选实施方式。根据本发明的生物缀合物中接头(8a)或(8b)的优选实施方式对应于如上文更详细描述的接头-缀合物中接头的优选实施方式。根据本发明的生物缀合物中b的优选实施方式对应于如上文更详细描述的根据本发明的生物分子中b的优选实施方式。
根据本发明的生物缀合物还可以定义为其中生物分子通过间隔子部分与靶分子缀合的生物缀合物,其中间隔子部分包含根据式(1)的基团或其盐,其中根据式(1)的基团如上所定义。
根据本发明的生物缀合物还可以表示为(b)ysp(d)z,其中y是1至10范围内的整数,z是1至10范围内的整数。
因此,本发明还涉及根据下式的生物缀合物:
(b)ysp(d)z,
其中:
-y是1到10范围内的整数;
-z是1至10范围内的整数;
-b是生物分子;
-d是靶分子;
-sp是间隔子部分,其中间隔子部分定义为间隔(即提供一定距离)并共价连接生物分子b和靶分子d的部分;并且其中所述间隔子部分包含根据式(1)的基团或其盐,其中根据式(1)的基团如上所定义。
在一个优选的实施方式中,所述间隔子部分还包含可通过环加成获得的部分,优选1,3-偶极环加成反应,最优选1,2,3-三唑环,其位于b和所述根据式(1)的基团之间。
优选地,y为1、2、3或4,更优选y为1或2,最优选y为1。优选地,z为1、2、3、4、5或6,更优选z为1、2、3或4,甚至更优选z为1、2或3,还甚至更优选z为1或2,最优选z为1。更优选地,y为1或2,优选为1,z为1、2、3或4,还甚至更优选y为1或2,优选为1,z为1、2或3,还甚至更优选y为1或2,优选为1,z为1或2,最优选为y是1且z是1。在一个优选的实施方式中,生物缀合物是根据式bsp(d)4,bsp(d)3,bsp(d)2或bspd。
如上所述,根据本发明的生物缀合物包含如上定义的根据式(1)的基团或其盐。在优选的实施方式中,生物缀合物包含根据式(1)的基团或其盐,其中a是0。在该实施方式中,生物缀合物因此包含根据式(2)的基团或其盐,其中(2)如上所定义。
在另一个优选的实施方式中,生物缀合物包含根据式(1)的基团或其盐,其中a是1。在该实施方式中,生物缀合物因此包含根据式(3)的基团或其盐,其中(3)如上所定义。
在根据本发明的生物缀合物中,r1、间隔子部分sp以及r1和sp的优选实施方式如上对本发明的接头-缀合物所定义。
在一个优选的实施方式中,生物缀合物是根据式(5a)或(5b)或其盐:
其中,
-a,b,c,d,e,f,g,h,i,d,sp1,sp2,sp3,sp4,z1,z2,z3和r1及其优选实施方式如上对接头-缀合物(4a)和(4b)所定义;以及
-h为0或1;
-z3是将b连接到sp3、z1、sp2、o或c(o)的连接基团;以及
-b是生物分子。
优选地,h是1。
生物分子b的优选实施方式如上所定义。
当根据本发明的生物缀合物是(5a)或(5b)的盐时,盐优选是药学上可接受的盐。
z3是连接基团。如上所述,术语“连接基团”在本文中是指连接化合物的一部分和相同化合物的另一部分的结构元件。通常,通过存在于接头-缀合物中的反应性基团q1与存在于生物分子中的官能团f1的反应制备生物缀合物。如本领域技术人员所理解的,连接基团z3的性质取决于用于建立生物分子和接头-缀合物之间的连接的有机反应的类型。换句话说,z3的性质取决于接头-缀合物的反应性基团q1的性质和生物分子中官能团f1的性质。由于存在大量不同的化学反应可用于建立生物分子和接头-缀合物之间的连接,因此z3存在大量可能性。
当包含q1的接头-缀合物与包含互补官能团f1的生物分子缀合时,将存在于生物缀合物中的f1和q1以及连接基团z3的合适组合的几个实例如图11所示。
当f1是例如硫醇基时,互补基团q1包括n-马来酰亚胺基和烯基,相应的连接基团z3如图11所示。当f1是硫醇基时,互补基团q1也包括联烯酰胺基。
当f1是例如氨基时,互补基团q1包括酮基和活化的酯基,相应的连接基团z3如图11所示。
当f1是例如酮基时,互补基团q1包括(o-烷基)羟基氨基和肼基,相应的连接基团z3如图11所示。
当f1是例如炔基时,互补基团q1包括叠氮基,相应的连接基团z3如图11所示。
当f1是例如叠氮基时,互补基团q1包括炔基,相应的连接基团z3如图11所示。
当f1是例如环丙烯基,反式环辛烯基或环辛炔基时,互补基团q1包括四嗪基,并且相应的连接基团z3如图11所示。在这些特定情况下,z3仅是中间结构并且将排出n2,从而产生二氢哒嗪(来自与烯烃的反应)或哒嗪(来自与炔烃的反应)。
f1和q1的其它合适组合以及所得连接基团z3的性质是本领域技术人员已知的,并且例如描述于g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013(isbn:978-0-12-382239-0),特别是在第3章,第229-258页中,其通过引用并入。适用于生物缀合过程的互补反应性基团的列表公开于g.t.hermanson,“生物缀合物技术”,elsevier,第三次编辑,2013年(isbn:978-0-12-382239-0)的第3章的第230-232页的表3.1中,该表的内容通过引用明确地并入本文。
在根据(5a)和(5b)的生物缀合物中,优选存在z3,sp3,z1和sp2中的至少一种,即h,g,d和c中的至少一个不为0。也优选存在sp1,z2和sp4中的至少一个,即b,e和i中的至少一个不为0。更优选地,存在z3,sp3,z1和sp2中的至少一个且存在sp1,z2和sp4中的至少一个,即优选b,e和i中的至少一个不为0且h,g,d和c中的至少一个不为0。
用于制备生物缀合物的方法
在本发明的各个方面,根据本发明的生物缀合物通常通过如本文定义的制备生物缀合物的方法获得。由于根据式(1)的基团或其盐在生物缀合物的接头l中的存在是本发明的关键,可以使用任何制备生物缀合物的方法,只要所获得的生物缀合物包含如本文定义的接头l即可。根据式(1)的基团可以存在于b和z3之间的接头l中,即它源自生物分子,或在z3和d之间,即它源自接头-缀合物,或z3是或包含根据式(1)的基团,即在缀合时形成根据式(1)的基团。优选地,根据式(1)的基团存在于b和z3之间或z3和d之间的接头l中,最优选地,根据式(1)的基团存在于z3和d之间的接头l中。同样,在本发明的上下文中,确切的包括q1和f1的性质的缀合方法具有很大的灵活性。用于将boi与moi缀合的许多技术是本领域技术人员已知的并且可以在本发明的上下文中使用。在使反应性基团q1与生物分子的官能团f1反应以将生物分子与接头-缀合物共价连接的条件下发生缀合。
在一个实施方式中,缀合方法选自图11中描绘的任何缀合方法,即硫醇-烯烃缀合(优选半胱氨酸-烯烃缀合,优选其中烯烃是侧链烯烃(-c=ch2)或马来酰亚胺部分,最优选马来酰亚胺部分)至连接部分z3(可以表示为(10a)或(10b)),氨基-(活化的)羧酸缀合(其中(活化的)羧酸由-c(o)x表示,其中x是离去基团)至连接部分z3(可以表示为(10c)),酮-肼基缀合(优选乙酰基-肼基缀合)至连接部分z3(可以表示为(10d)其中y=nh),酮-氧基氨基缀合(优选乙酰基-氧基氨基缀合)至连接部分z3(可以表示为(10d)其中y=o);炔烃-叠氮化物缀合(优选其中炔烃是侧链炔烃(-c≡ch)或环辛炔部分,最优选环辛炔部分)至连接部分z3(可以表示为(10e),(10f),(10i),(10g),(10j)或(10k),优选(10e),(10f)或(10g)),烯烃-1,2,4,5-四嗪缀合或炔烃-1,2,4,5-四嗪缀合至连接部分z3(可以表示为(10h)),n2将消除,给予二氢哒嗪产品。特别优选的缀合方法是半胱氨酸-烯烃缀合和炔烃-叠氮化物缀合,更优选半胱氨酸-马来酰亚胺缀合和环辛炔-叠氮化物缀合。
在一个实施方式中,缀合方法是(n)(环)炔烃-叠氮化物缀合至连接部分z3,所述连接部分z3由(10e),(10i),(10g),(10j)或(10k)表示,优选(10e),(10i),(10g),最优选(10g),如下所示:
其中环a是7-10元(杂)环部分。连接部分(10e),(10j)和(10k)可以存在于可能的两种区域异构体中的任一种中。
根据本发明的生物缀合物通常通过包括使本文定义的接头-缀合物的反应性基团q1与生物分子的官能团f1(也称为生物分子)反应的步骤的方法制备。上文更详细地描述了接头-缀合物和生物分子及其优选实施方式。这种方法是本领域技术人员已知的缀合或生物缀合。图1显示了生物分子缀合的一般概念:将包含一个或多个官能团f1的感兴趣的生物分子(boi)与通过特定的接头共价连接到反应性基团q1的(过量)靶分子d(也称为感兴趣的分子或moi)一起温育。在生物缀合的过程中,发生f1和q1之间的化学反应,从而形成包含boi和moi之间的共价键的生物缀合物。boi可以是例如肽/蛋白质、聚糖或核酸。
生物缀合反应通常包括使接头-缀合物的反应性基团q1与生物分子的官能团f1反应的步骤,其中形成式(a)的生物缀合物,其中接头l包含根据式(1)的基团或其盐:
其中:
-a为0或1;以及
-r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或r1是另一个靶分子d,其中d任选地通过间隔子部分与n连接。
在一个优选的实施方式中,生物缀合物通过环加成制备,例如(4+2)-环加成(例如狄尔斯-阿尔德反应)或(3+2)-环加成(例如1,3-偶极环加成)。优选地,缀合是狄尔斯-阿尔德反应或1,3-偶极环加成。优选的狄尔斯-阿尔德反应是反电子需求的狄尔斯-阿尔德环加成反应。在另一个优选的实施方式中,使用1,3-偶极环加成,更优选使用炔烃-叠氮化物环加成,最优选其中q1是或包含炔基,f1是叠氮基。环加成例如狄尔斯-阿尔德反应和1,3-偶极环加成是本领域已知的,并且技术人员知道如何进行它们。
当q1与f1反应时,形成生物分子和源自接头-缀合物的靶分子之间的共价连接。上文和下文更详细地描述了互补反应性基团q1和官能团f1。
在制备生物缀合物的方法的一个优选实施方式中,根据式(1)的基团中的a为0。在该实施方式中,接头-缀合物因此包含如上定义的根据式(2)的基团。在制备生物缀合物的方法的另一个优选实施方式中,根据式(1)的基团中的a为1。在该实施方式中,接头-缀合物因此包含如上定义的根据式(3)的基团。
上面更详细地描述了生物分子。优选地,在根据本发明的方法中,生物分子选自由蛋白质(包括糖蛋白和抗体),多肽,肽,聚糖,脂质,核酸,寡核苷酸,多糖,寡糖,酶,激素,氨基酸和单糖组成的组。更优选地,生物分子b选自由蛋白质(包括糖蛋白和抗体),多肽,肽,聚糖,核酸,寡核苷酸,多糖,寡糖和酶组成的组。更优选地,生物分子b选自由蛋白质(包括糖蛋白和抗体),多肽,肽和聚糖组成的组。最优选地,b是抗体或其抗原结合片段。
在制备生物缀合物的方法中,优选反应性基团q1选自由任选取代的n-马来酰亚胺基,卤代n-烷基酰氨基,磺酰氧基n-烷基酰氨基,酯基,碳酸酯基,磺酰卤基,硫醇基或衍生物,烯基,炔基,(杂)环炔基,双环[6.1.0]壬-4-炔-9-基],环烯基,四嗪基,叠氮基,膦基,氧化腈基,硝酮基,腈亚胺基,重氮基,酮基,(o-烷基)羟基氨基,肼基,卤代n-马来酰亚胺基,1,1-双(磺酰基甲基)甲基羰基或其消除衍生物,碳酰卤基和联烯酰胺基组成的组。
在另一个优选的实施方式中,q1是根据式(9a),(9b),(9c),(9d),(9e),(9f),(9g),(9h),(9i),(9j),(9k),(9l),(9m),(9n),(9o),(9p),(9q),(9r),(9s),(9t),(9u),(9v),(9w),(9x),(9y),(9z),(9za),(9zb),(9zc),(9zd),(9ze),(9zf),(9zg),(9zh),(9zi),(9zj)或(9zk),其中(9a),(9b),(9c),(9d),(9e),(9f),(9g),(9h),(9i),(9j),(9k),(9l),(9m),(9n),(9o),(9p),(9q),(9r),(9s),(9t),(9u),(9v),(9w),(9x),(9y),(9z),(9za),(9zb),(9zc),(9zd),(9ze),(9zf),(9zg),(9zh),(9zi),(9zj),(9zk),(9zo)及其优选实施方式如上对根据本发明的接头-缀合物所定义。更优选地,q1是根据式(9a),(9b),(9c),(9f),(9j),(9n),(9o),(9p),(9q),(9s),(9t),(9ze),(9zh),(9zo)或(9r)。甚至更优选地,q1是根据式(9a),(9j),(9n),(9o),(9p),(9q),(9t),(9ze),(9zh),(9zo)或(9s),最优选地,q1是根据如上定义的式(9a),(9p),(9q),(9n),(9t),(9ze),(9zh),(9zo)或(9o)及其优选实施方式。
在一个特别优选的实施方式中,q1包含炔基,优选选自如上所述的炔基,如上所述的环烯基,如上所述的(杂)环炔基和双环[6.1.0]壬-4-炔-9-基],更优选q1选自如上定义的式(9j),(9n),(9o),(9p),(9q),(9zo)和(9zk)。最优选地,q1是双环[6.1.0]壬-4-炔-9-基],优选式(9q)。
在制备生物缀合物的方法的另一个优选实施方式中,接头-缀合物是式(4a)或(4b)或其盐:
其中:
-a独立地为0或1;
-b独立地为0或1;
-c为0或1;
-d为0或1;
-e为0或1;
-f是1至150范围内的整数;
-g为0或1;
-i为0或1;
-d是靶分子;
-q1是能够与存在于生物分子上的官能团f1反应的反应性基团;
-sp1是间隔子部分;
-sp2是间隔子部分;
-sp3是间隔子部分;
-sp4是间隔子部分;
-z1是将q1或sp3连接到sp2,o或c(o)或n(r1)的连接基团;
-z2是将d或sp4连接到sp1,n(r1),o或c(o)的连接基团;以及
-r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选取代和任选中断,其中r3独立地选自由氢和c1-c4烷基组成的组;或r1是d,-[(sp1)b(z2)e(sp4)id]或-[(sp2)c(z1)d(sp3)gq1],其中d是另一个靶分子,sp1,sp2,sp3,sp4,z1,z2,q1,b,c,d,e,g和i如上所定义。
sp1,sp2,sp3和sp4独立地是间隔子部分,换句话说,sp1,sp2,sp3和sp4可以彼此不同。sp1,sp2,sp3和sp4可以存在或不存在(b,c,g和i独立地为0或1)。但是,优选存在sp1,sp2,sp3和sp4中的至少一个,即优选b,c,g和i中的至少一个不为0。
优选间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c200亚烷基,c2-c200亚烯基,c2-c200亚炔基,c3-c200亚环烷基,c5-c200亚环烯基,c8-c200亚环炔基,c7-c200烷基亚芳基,c7-c200芳基亚烷基,c8-c200芳基亚烯基和c9-c200芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。当亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个如上定义的杂原子中断时,优选所述基团被一个或多个o原子和/或被一个或多个s-s基团中断。
更优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c100亚烷基,c2-c100亚烯基,c2-c100亚炔基,c3-c100亚环烷基,c5-c100亚环烯基,c8-c100亚环炔基,c7-c100烷基亚芳基,c7-c100芳基亚烷基,c8-c100芳基亚烯基和c9-c100芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
甚至更优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c50亚烷基,c2-c50亚烯基,c2-c50亚炔基,c3-c50亚环烷基,c5-c50亚环烯基,c8-c50亚环炔基,c7-c50烷基亚芳基,c7-c50芳基亚烷基,c8-c50芳基亚烯基和c9-c50芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
还甚至更优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c20亚烷基,c2-c20亚烯基,c2-c20亚炔基,c3-c20亚环烷基,c5-c20亚环烯基,c8-c20亚环炔基,c7-c20烷基亚芳基,c7-c20芳基亚烷基,c8-c20芳基亚烯基和c9-c20芳基亚炔基组成的组,所述亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,烷炔基和环烷基是任选取代的。
在这些优选的实施方式中,进一步优选亚烷基,亚烯基,亚炔基,亚环烷基,亚环烯基,亚环炔基,烷基亚芳基,芳基亚烷基,芳基亚烯基和芳基亚炔基是未取代的和被一个或多个选自o、s和nr3的组的杂原子(优选o)任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,优选氢或甲基。
最优选地,间隔子部分sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c20亚烷基,所述亚烷基被一个或多个选自o、s和nr3的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。在该实施方式中,进一步优选亚烷基是未取代的和被一个或多个选自o、s和nr3的组的杂原子(优选o和/或s-s)任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,优选氢或甲基。
特别优选的间隔子部分sp1,sp2,sp3和sp4包括-(ch2)n-、-(ch2ch2)n-、-(ch2ch2o)n-、-(och2ch2)n-、-(ch2ch2o)nch2ch2-、-ch2ch2(och2ch2)n-、-(ch2ch2ch2o)n-、-(och2ch2ch2)n-、-(ch2ch2ch2o)nch2ch2ch2-和-ch2ch2ch2(och2ch2ch2)n-,其中n是1至50范围内的整数,优选1至40范围内,更优选1至30范围内,甚至更优选在1至20范围内,还甚至更优选1至15范围内。更优选n为1、2、3、4、5、6、7、8、9或10,更优选1、2、3、4、5、6、7或8,甚至更优选1、2、3、4、5或6,还甚至更优选1、2、3或4。
在根据本发明的方法的另一个优选实施方式中,在根据式(4a)和(4b)的接头-缀合物中,间隔子部分sp1,sp2,sp3和/或sp4(如果存在)包含氨基酸序列。包含氨基酸序列的间隔子部分在本领域中是已知的,并且还可以称为肽接头。实例包括包含val-ala部分或val-cit部分的间隔子部分,例如val-cit-pabc,val-cit-pab,fmoc-val-cit-pab等。
如上所述,z1和z2是连接基团。在根据本发明的方法的优选实施方式中,z1和z2独立地选自由-o-,-s-,-nr2-,-n=n-,-c(o)-,-c(o)nr2-,-oc(o)-,-oc(o)o-,-oc(o)nr2-,-nr2c(o)-,-nr2c(o)o-,-nr2c(o)nr2-,-sc(o)-,-sc(o)o-,-s-c(o)nr2-,-s(o)-,-s(o)2-,-os(o)2-,-os(o)2o-,-os(o)2nr2-,-os(o)-,-os(o)o-,-os(o)nr2-,-onr2c(o)-,-onr2c(o)o-,-onr2c(o)nr2-,-nr2oc(o)-,-nr2oc(o)o-,-nr2oc(o)nr2-,-onr2c(s)-,-onr2c(s)o-,-onr2c(s)nr2-,-nr2oc(s)-,-nr2oc(s)o-,-nr2oc(s)nr2-,-oc(s)-,-oc(s)o-,-oc(s)nr2-,-nr2c(s)-,-nr2c(s)o-,-nr2c(s)nr2-,-ss(o)2-,-ss(o)2o-,-ss(o)2nr2-,-nr2os(o)-,-nr2os(o)o-,-nr2os(o)nr2-,-nr2os(o)2-,-nr2os(o)2o-,-nr2os(o)2nr2-,-onr2s(o)-,-onr2s(o)o-,-onr2s(o)nr2-,-onr2s(o)2o-,-onr2s(o)2nr2-,-onr2s(o)2-,-op(o)(r2)2-,-sp(o)(r2)2-,-nr2p(o)(r2)2-及其两种或更多种的组合组成的组,其中r2独立地选自由氢,c1-c24烷基,c2-c24烯基,c2-c24炔基和c3-c24环烷基组成的组,所述烷基,烯基,炔基和环烷基是任选取代的。
在根据本发明的特别优选的方法中,sp1,sp2,sp3和sp4(如果存在)独立地选自由直链或支链c1-c20亚烷基组成的组,所述亚烷基任选被一个或多个选自由o、s和nr3组成的组的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,并且其中q1是根据式(9a),(9j),(9p),(9q),(9n),(9t),(9ze),(9zh),(9zo)或(9o):
其中:
-1是0-10范围内的整数;
-r10是(硫)酯基;以及
-r18选自由任选取代的c1-c12烷基和c4-c12(杂)芳基组成的组。
制备生物缀合物的方法的一个实施方式如图4所示。图4显示了修饰的抗体13a-d如何通过亲核加成到马来酰亚胺上以进行生物缀合过程(对于3-巯基丙酰基-半乳糖胺修饰的13a,导致硫醚结合物14,或对于缀合到工程化的半胱氨酸残基,导致硫醚缀合物17)或在用环辛炔试剂进行应变促进的环加成时(对于13b、13c或13d,分别导致三唑15a、15b或16)。
除了根据本发明的生物缀合物的治疗指数增加之外,制备如本文所述的生物缀合物的方法以及根据本发明的接头-缀合物和磺酰胺接头的另外的优点是在使用磺酰胺接头代替典型的聚乙二醇(peg)间隔子的情况下缀合效率增加。磺酰氨基团,特别是酰基磺酰胺或氨基甲酰基磺酰氨基团的另一个优点是其高极性,其在缀合之前、期间和之后对包含这种基团的接头的溶解度和构建体整体产生积极影响。鉴于这种增加的极性,与含有根据本发明的磺酰胺接头的接头-缀合物的缀合特别适合于将疏水性靶化合物缀合至生物分子。在疏水部分与感兴趣的生物分子缀合的情况下,磺酰胺的高极性也具有积极影响,已知在缀合期间需要大量有机助溶剂和/或诱导生物缀合物的聚集。高水平的共溶剂(高达25%的dmf或甚至50%的dma,丙二醇或dmso)可以在缀合过程期间诱导蛋白质变性和/或在制造过程中可能需要特殊设备。因此,通过在靶分子和生物缀合物形成中的接头-缀合物中的反应性基团q1之间的间隔子中使用根据本发明的磺酰胺接头,有效地解决了与生物缀合物中的疏水性连接部分相关的聚集问题。根据本发明的磺酰胺接头及其在生物缀合过程中的用途的另一个优点是其易于合成和高产率。
为了证明使用根据本发明的磺酰胺接头的这些有益效果,参考pct/nl2015/050697(wo2016/053107),特别是其中的表1-3,图11-14,23和24,实施例57,58,60和61。pct/nl2015/050697(wo2016/053107)的这些表、图和实施例并入本文中。
根据第一方面的方法
因此,本发明在第一方面涉及增加生物缀合物的治疗指数的方法,其包括制备式(a)的生物缀合物的步骤:
b-l-d
(a),
其中:
-b是生物分子;
-l是连接b和d的接头;
-d是靶分子;以及
-每次出现的“-”独立地是键或间隔子部分,
通过使靶分子(d)上的反应性基团q1与生物分子(b)上的官能团f1反应,使得l包含根据式(1)的基团或其盐:
其中:
-a为0或1;以及
-r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或r1是另一个靶分子d,其中d任选地通过间隔子部分与n连接。
上面详细描述了式(a)的生物缀合物,其同样适用于本发明第一方面中使用的生物缀合物。
在本文中,与式(a)的生物缀合物相比,治疗指数增加,其中接头l不包含根据式(1)的基团或其盐。发明人惊奇地发现,当使用根据本发明的接头l时,即使所有其它因素,特别是生物分子的类型和靶分子的类型以及生物分子-靶分子比率保持不变,根据本发明的生物缀合物的治疗指数显著增加。增加的治疗指数可以仅归因于在接头中存在根据式(1)的基团。
增加的治疗指数优选是癌症治疗中增加的治疗指数。
根据本发明第一方面的方法还可以表述为增加生物缀合物的治疗指数的方法,其包括提供由式(a)表示的生物缀合物的步骤:
b-l-d
(a),
-b是生物分子;
-l是连接b和d的接头;
-d是靶分子;以及
-每次出现的“-”独立地是键或间隔子部分,
其中,l包含根据式(1)的基团或其盐:
其中:
-a为0或1;以及
-r1选自由氢,c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基组成的组,所述c1-c24烷基,c3-c24环烷基,c2-c24(杂)芳基,c3-c24烷基(杂)芳基和c3-c24(杂)芳烷基被一个或多个选自o、s和nr3的杂原子任选地取代和任选地中断,其中r3独立地选自由氢和c1-c4烷基组成的组,或r1是另一个靶分子d,其中靶分子任选地通过间隔子部分与n连接。
发明人发现,包含在根据本发明的生物缀合物中的根据本发明的接头对治疗指数的两个方面具有影响:(a)治疗功效和(b)耐受性。因此,增加治疗指数的方法优选用于(a)提高治疗功效,和/或(b)增加式(a)的生物缀合物的耐受性。
因此,在一个实施方式中,根据第一方面的方法用于提高式(a)的生物缀合物的治疗功效。在本文中,“提高治疗功效”也可以表述为“降低有效剂量”或“降低ed50值”或“增加保护指数”。同样,在一个实施方案中,根据第一方面的方法用于增加式(a)的生物缀合物的耐受性。在本文中,“增加耐受性”也可以表述为“增加最大耐受剂量(mtd)”,“增加tp50值”或“降低毒性”。在一个特别优选的实施方式中,根据第一方面的方法用于(a)提高治疗功效和(b)增加式(a)的生物缀合物的耐受性。
根据第一方面的方法在很大程度上是非医学的。在一个实施方式中,该方法是用于增加生物缀合物的治疗功效的非医学或非治疗方法。
本发明的第一方面还可以表述为用于改善式(a)的生物缀合物的治疗功效的接头l,其中l和(a)如上所定义。换句话说,第一方面涉及使用接头l制备式(a)的生物缀合物以改善生物缀合物的治疗功效,其中l和(a)如上所定义。根据第一方面的发明还可以表述为在式(a)的生物缀合物中或在制备式(a)的生物缀合物中使用接头l,以提高生物缀合物的治疗功效,其中l和(a)如上所定义。如本文定义的用途可以称为非医学或非治疗用途。
在根据本方面的方法中使用的生物缀合物优选通过如上定义的制备生物缀合物的方法获得,更优选地,生物缀合物通过如上定义的制备生物缀合物的方法获得。发现由此获得的生物缀合物具有甚至进一步改善的治疗指数。
在一个实施方式中,根据本发明第一方面使用的方法、途或接头还包括将根据本发明的生物缀合物施用于有需要的受试者,最合适地是癌症患者。生物缀合物如抗体-药物-缀合物的使用在癌症治疗领域中是众所周知的,并且根据本发明的生物缀合物在这方面特别适合。
通常,生物缀合物以治疗有效剂量施用。施用可以是单剂量或可以是例如每月进行1-4次,优选每月1-2次。在一个优选的实施方式中,施用每3或4周进行一次,最优选每4周进行一次。鉴于增加的治疗功效,与常规生物缀合物治疗期间的情况相比,施用可以以较低频率进行。如本领域技术人员所理解的,根据本发明的生物缀合物的剂量可以取决于许多因素,并且本领域技术人员可以通过常规实验确定最佳施用方案。生物缀合物通常以0.01-50mg/kg受试者体重的剂量施用,更准确地为0.1-25mg/kg或最准确地为0.5-10mg/kg。在一个实施方式中,通过静脉内注射进行施用。
根据第二方面的方法
本发明在第二方面涉及治疗有需要的受试者的方法,其包括施用如上定义的式(a)的生物缀合物。有需要的受试者最优选是癌症患者。生物缀合物如抗体-药物-缀合物的使用在癌症治疗领域中是众所周知的,并且根据本发明的生物缀合物在这方面特别适合。该方法通常适用于治疗癌症。上面详细描述了式(a)的生物缀合物,其同样适用于本发明第二方面中使用的生物缀合物。
本发明的第二方面还可以表述为用于治疗有需要的受试者的式(a)的生物缀合物,优选用于治疗癌症,其中(a)如上所定义。换句话说,第二方面涉及式(a)的生物缀合物在制备用于治疗有需要的受试者的药物中的用途,优选用于治疗癌症,其中(a)是如上所定义。
根据第二方面的方法也可以表述为靶向肿瘤细胞的方法。在本方面的上下文中,肿瘤细胞的靶向包括治疗,成像,诊断,预防其增殖,包含和减少肿瘤细胞中的一种或多种。根据第二方面的方法也可以表述为靶向肿瘤的方法。在本方面的上下文中,肿瘤细胞的靶向包括治疗,成像,诊断,预防其增殖,包含和减少肿瘤中的一种或多种。最优选地,本方面用于治疗肿瘤。
技术人员理解的是靶分子d的选择可以通过根据本方面的根据本发明的生物缀合物的特定预期用途来确定。例如,在根据本方面的方法用于治疗的情况下,优选靶分子d是药物,更优选细胞毒素。同样,在根据本方面的方法用于成像或诊断的情况下,优选靶分子d是报告分子。在根据本方面的方法的上下文中,优选生物分子b是抗体。同样,优选生物缀合物是抗体-药物-缀合物。
在根据本方面的方法中使用的生物缀合物优选通过如上定义的制备生物缀合物的方法获得,更优选生物缀合物通过如上定义的制备生物缀合物的方法获得。
在根据第二方面的方法中,生物缀合物通常以治疗有效剂量施用。施用可以是单剂量或可以是例如每月进行1-4次,优选每月1-2次。在一个优选的实施方式中,施用每3或4周进行一次,最优选每4周进行一次。如本领域技术人员所理解的,根据本发明的生物缀合物的剂量可以取决于许多因素,并且本领域技术人员可以通过常规实验确定最佳施用方案。生物缀合物通常以0.01-50mg/kg受试者体重的剂量施用,更准确地为0.1-25mg/kg,最准确地为0.5-10mg/kg。在一个实施方式中,通过静脉内注射进行施用。
鉴于增加的治疗功效,与常规生物缀合物和/或较低剂量的治疗相比,施用可以以较低频率进行。在一个实施方式中,根据本发明的生物缀合物的施用剂量低于相同生物缀合物(但不包含根据本发明的接头)的td50,优选剂量为相同生物缀合物(但不包含根据本发明的接头)的td50的至多99-90%,更优选至多89-60%,甚至更优选至多59-30%,最优选至多29-10%。在一个实施方式中,根据本发明的生物缀合物的施用剂量低于相同生物缀合物(但不包含根据本发明的接头)的ed50,优选剂量为相同生物缀合物(但不包含根据本发明的接头)的ed50的至多99-90%,更优选至多89-60%,甚至更优选至多59-30%,最优选至多29-10%。在一个实施方式中,根据本发明的生物缀合物的施用相对于相同生物缀合物(但不包含根据本发明的接头)进行的施用以较低频率进行,优选施用事件的数量为相同生物缀合物(但不包含根据本发明的接头)的施用事件的数量的至多75%,更优选至多为50%。或者,鉴于增加的耐受性,可以在用常规生物缀合物处理的较高剂量下进行施用。在一个实施方式中,根据本发明的生物缀合物的施用剂量高于相同生物缀合物(但不包含根据本发明的接头)的td50,优选剂量为相同生物缀合物(但不包含根据本发明的接头)的td50的至多25-50%,更优选至多50-75%,最优选至多75-100%。在一个实施方式中,剂量比相同生物缀合物(但不包含根据本发明的接头)的td50至少高出因子1.1至1.49,更优选至少高出因子1.5至1.99,甚至更优选高出因子2至4.99,最优选至少高出因子5至10。
实施例
参考pct/nl2015/050697(wo2016/053107)用于合成以下化合物,其适合作为根据本发明的方法或其方式中使用的接头-缀合物:
·化合物18(实施例20);
·化合物20(实施例21,23-25);
·化合物21(实施例26-27);
·化合物23(实施例29-31);
·化合物26(实施例36-38);
·化合物30(实施例43-1,32);
·化合物33(实施例36-37,47);
·化合物35(实施例36-37,49);
·化合物36(实施例29,50);
·化合物37(实施例51-53);
·化合物38(实施例29,54-55);
·化合物39(实施例29,54,56)。
在pct/nl2015/050697(wo2016/053107)中描述了以下修饰的生物分子的制备,其适合作为根据本发明的方法中使用的生物分子:
·曲妥珠单抗(galnprosh)213a(实施例1-6,12-14);
·曲妥珠单抗(galnaz)213b(实施例12,13,15,16-1);
·曲妥珠单抗(f2-galnaz)213c(实施例1,7-13,16-2)。
根据pct/nl2015/050697的实施例59(wo2016/053107)可以制备根据本发明的生物缀合物。已经如此制备了接头-缀合物30或33与修饰的生物分子13b或13c的缀合物(缀合物95-98,参见实施例1-4和图12),并用于实施例29和31的体内研究。
所有上述pct/nl2015/050697(wo2016/053107)的实施例均通过引用并入本文。
减少单克隆抗体的rp-hplc分析
在rp-hplc分析之前,通过将10μg(修饰的)igg溶液与10mmdtt和100mmtrisph8.0以50μl的总体积在37℃下温育15分钟来还原样品。向还原样品中加入49%acn、49%mq和2%甲酸(50μl)的溶液。反相hplc在agilent1100hplc上进行,使用zorbaxphoroshell300sb-c81x755μm(agilenttechnologies)柱,以1ml/min在70℃下运行,使用从25至50%缓冲液b的16.9分钟线性梯度(其中缓冲液a=90%mq,10%acn,0.1%tfa和缓冲液b=90%acn,10%mq,0.1%tfa)。
单克隆抗体的质谱分析
在质谱分析之前,用dtt处理igg,其允许分析轻链和重链两者,或用fabricatortm(可从genovis,lund,sweden商购获得)处理,其允许分析fc/2片段。为了分析轻链和重链两者,将20μg(修饰的)igg的溶液与100mmdtt以4μl的总体积在37℃下温育5分钟。如果存在,在这些条件下将叠氮官能团还原为胺。为了分析fc/2片段,将20μg(修饰的)igg的溶液与fabricatortm(1.25u/μl)磷酸盐缓冲盐水(pbs)ph6.6以10μl的总体积在37℃下温育1小时。在还原或fabricator消化后,将样品使用amiconultra-0.5,ultracel-10膜(millipore)用milliq洗涤三次,以得到约40μl的最终样品体积。接下来,通过jeolaccutof上的电喷雾电离飞行时间(esi-tof)分析样品。使用magtran软件获得解卷积的光谱。
实施例1:13b与30的缀合以获得缀合物96
通过将作为接头-缀合物的化合物30与作为生物分子的修饰的生物分子13b缀合,以制备根据本发明的生物缀合物。向曲妥珠单抗(叠氮化物)2(13b)(15.5ml,255mg,16.47mg/ml在pbsph7.4中)的溶液中加入dma(1.45ml)和化合物30(255μl,40mm溶液dma)。将反应物在室温温育过夜,然后在aktapurifier-10(gehealthcare)上的hiload26/600superdex200pg柱(gehealthcare)上纯化。还原样品的质谱分析显示一种主要重链产物(观察到质量50938da,总重链片段的约80%),对应于缀合的重链。
实施例2:13b与33的缀合以获得缀合物95
通过将作为接头-缀合物的化合物33与作为生物分子的修饰的生物分子13b缀合,以制备根据本发明的生物缀合物。向曲妥珠单抗(叠氮化物)2(13b)(607μl,10mg,16.47mg/ml在pbsph7.4中)的溶液中加入milliq(50μl)和化合物33(10μl,40mm溶液在dma中)。将反应物在室温温育过夜,然后在aktapurifier-10(gehealthcare)上的superdex20010/300gl(gehealthcare)上纯化。还原样品的质谱分析显示一种主要重链产物(观察到质量50982da,总重链片段的约80%),对应于缀合的重链。
实施例3:13c与30的缀合以获得缀合物98
通过将作为接头-缀合物的化合物30与作为生物分子的修饰的生物分子13c缀合,以制备根据本发明的生物缀合物。向曲妥珠单抗(叠氮化物)2(13c)(14.25ml,250mg,17.55mg/ml在pbsph7.4中)的溶液中加入dma(1.4ml)和化合物30(250μl,40mm溶液dma)。将反应物在室温温育过夜,然后在aktapurifier-10(gehealthcare)上的hiload26/600superdex200pg柱(gehealthcare)上纯化。还原样品的质谱分析显示一种主要重链产物(观察到质量50969da,总重链片段的约70%),对应于缀合的重链。
实施例4:13c与33的缀合以获得缀合物98
通过将作为接头-缀合物的化合物33与作为生物分子的修饰的生物分子13c缀合,以制备根据本发明的生物缀合物。向曲妥珠单抗(叠氮化物)2(13c)(14.25ml,250mg,17.55mg/ml在pbsph7.4中)的溶液中加入化合物33(188μl,40mm溶液dma)。将反应物在室温温育过夜,然后在aktapurifier-10(gehealthcare)上的hiload26/600superdex200pg柱(gehealthcare)上纯化。还原样品的质谱分析显示一种主要重链产物(观察到质量51020da,总重链片段的约90%),对应于缀合的重链。
实施例5-16:接头缀合物100、108和111的制备
本文描述了根据本发明的接头-缀合物100和108,以及对照接头-缀合物111的合成。下文描述了针对化合物100、108和111的合成方案。
实施例5:化合物100的制备
将化合物99(通过活化根据pct/nl2015/050697的实施例50中公开的化合物58(wo2016/053107)制备;4.7mg,9.0μmol)在dmf(200μl)中的溶液加入到固体val-cit-pab-mmae(vc-pabmmae,10mg,8.1μmol),然后加入et3n(3.7μl,2.7mg,27μmol)。23小时后,加入在dmf中的2′-(亚乙基二氧)双(乙胺)(1.3μl,1.3mg,8.9μmol)(13μl的10%溶液在dmf中)。将混合物放置4小时,并通过反相(c18)hplc色谱(30→90%mecn(1%acoh)在h2o(1%acoh)中)纯化。得到产物,为无色薄膜(10.7mg,7.1μmol,87%),lcms(esi+)c74h117n12o19s+(m+h+)的计算值为1509.83,实测值为1510.59。
实施例6:化合物101的制备
向bcn-osu(1.00g,3.43mmol)在thf和水(80ml/80ml)的混合物中的溶液中加入γ-氨基丁酸(0.60g,5.12mmol)和et3n(1.43ml,1.04g,10.2mmol)。将混合物搅拌4小时,然后加入dcm(200ml)和饱和nh4cl水溶液(80ml)。分离后,将水层用dcm(2×200ml)萃取。将合并的有机层干燥(na2so4)并浓缩。将残余物用柱色谱(meoh在dcm中0→10%)纯化。得到产物,为无色稠油状物(730mg,2.61mmol,76%)。1hnmr(400mhz,cdcl3)δ(ppm)4.81(bs,1h),4.15(d,j=8.4hz,2h),3.30-3.21(m,2h),2.42(t,j=7.2hz,2h),2.35-2.16(m,6h),1.85(五重峰,j=6.9hz,2h),1.64-1.51(m,2h),1.35(五重峰,j=8.4hz,1h),1.00-0.90(m,2h)。
实施例7:化合物102的制备
将氯磺酰基异氰酸酯(csi;0.91ml,1.48g,10mmol)加入冷却的(-78℃)叔丁醇(5.0ml,3.88g,52mmol)在et2o(50ml)中的溶液中。使得反应混合物温热至室温并浓缩。将残余物悬浮在dcm(200ml)中,随后加入et3n(4.2ml,3.0g,30mmol)和2-(2-氨基乙氧基)乙醇(1.0ml,1.05g;10mmol)。将所得混合物搅拌10分钟并浓缩。将残余物用柱色谱(meoh在dcm中0→10%)纯化两次。得到产物,为无色稠油状物(2.9g,10mmol,100%)。1hnmr(400mhz,cdcl3)δ(ppm)5.75(bs,1h),3.79-3.74(m,2h),3.67-3.62(m,2h),3.61-3.57(m,2h),3.35-3.28(m,2h),1.50(s,9h)。
实施例8:化合物103的制备
向102(2.9g,10mmol)在dcm(40ml)中的溶液中加入ac2o(2.9ml,3.11g,30.5mmol)和et3n(12.8ml,9.29g,91.8mmol)。将反应混合物搅拌2小时,用饱和的nahco3水溶液(50ml)洗涤并干燥(na2so4)。将残余物用柱色谱(20%→100%etoac在庚烷中)纯化两次。得到产物,为无色油状物(2.5g,7.7mmol,77%)。1hnmr(400mhz,cdcl3)δ(ppm)5.48(bs,1h),4.25-4.20(m,2h),3.70-3.60(m,4h),3.33-3.23(m,2h),2.10(s,3h),1.50(s,9h)。
实施例9:化合物104的制备
向103(80mg,0.25mmol)在dcm(8ml)中的溶液中加入tfa(2ml)。40分钟后,浓缩反应混合物。将残余物溶于甲苯(30ml)中并浓缩混合物。得到产物,为无色油状物(54mg,0.24mmol,95%)。1hnmr(400mhz,cdcl3)δ(ppm)5.15(bs,2h),4.26-4.18(m,2h),3.71-3.60(m,4h),3.35-3.27(m,2h),2.08(s,3h)。
实施例10:化合物105的制备
向bcngaba(101)(67mg,0.24mmol)和104(54mg,0.24mmol)在dcm(20ml)中的混合物中加入n-(3-二甲基氨基丙基)-n′-乙基碳二亚胺盐酸盐(edci.hcl;55mg,0.29mmol)和dmap(2.8mg,23μmol)。将混合物搅拌16小时,并用饱和nh4cl水溶液(20ml)洗涤。分离后,将水层用dcm(20ml)萃取。将合并的有机层干燥(na2so4)并浓缩。将残余物用柱色谱(meoh在dcm中0→10%)纯化。得到产物,为无色稠油状物(50mg,0.10mmol,42%)。1hnmr(400mhz,cdcl3)δ(ppm)5.83-5.72(m,1h),5.14-5.04(m,1h),4.23-4.19(m,2h),4.15(d,j=8.1hz,2h),3.67-3.57(m,4h),3.29-3.18(m,4h),2.41-2.32(m,2h),2.31-2.15(m,6h),2.10(s,3h),1.85(五重峰,j=6.6hz,2h),1.65-1.49(m,2h),1.38-1.28(m,1h),1.00-0.89(m,2h)。
实施例11:化合物106的制备
向105(50mg,0.10mmol)在meoh(10ml)中的溶液中加入k2co3(43mg,0.31mmol)。将混合物搅拌3小时,并用饱和nh4cl水溶液(20ml)稀释。用dcm(3×20ml)萃取混合物。将合并的有机层干燥(na2so4)并浓缩。得到产物,为无色薄膜(39mg,0.088mmol,88%)。1hnmr(400mhz,cdcl3)δ(ppm)6.25(bs,1h),5.26-5.’18(m,1h),4.15(d,j=8.0hz,2h),3.77-3.71(m,2h),3.63-3.53(m,4h),3.33-3.27(m,2h),3.27-3.17(m,2h),2.45-2.34(m,2h),2.34-2.14(m,6h),1.85(五重峰,j=6.7hz,2h),1.65-1.48(m,2h),1.41-1.28(m,1h),1.01-0.88(m,2h)。
实施例12:化合物107的制备
向106(152mg,0.34mmol)在dcm(20ml)中的溶液中加入氯甲酸对硝基苯酯(pnp-cocl;69mg,0.34mmol)和吡啶(28μl,27mg,0.34mmol)。将混合物搅拌1.5小时并浓缩。将残余物用柱色谱(50%→100%etoac在庚烷中)纯化。得到产物,为无色稠油状物(98mg,0.16mmol,47%)。1hnmr(400mhz,cdcl3)δ(ppm)8.31-8.26(m,2h),7.46-7.40(m,2h),5.69-5.59(m,1h),4.98-4.91(m,1h),4.46-4.42(m,2h),4.18(d,j=8.1hz,2h),3.79-3.75(m,2h),3.69-3.64(m,2h),3.33-3.24(m,4h),2.39-2.31(m,2h),2.32-2.18(m,6h),1.84(五重峰,j=6.3hz2h),1.65-1.50(m,2h),1.35(五重峰,j=8.5hz,1h),1.01-0.91(m,2h)。
实施例13:化合物108的制备
向val-cit-pab-mmae(16.4mg,13.2μmol)在dmf(400μl)中的溶液中加入et3n(3.4μl,2.5mg,24μmol)。将所得溶液加入到107(6.7mg,11μmol)在dmf(300μl)中的溶液中。加入dmf(50μl)。21.5小时后,加入在dmf中的2′-(亚乙二氧基)双(乙胺)(1.2μl,1.2mg,8.2μmol)(12μl的10%溶液在dmf中)。通过反相(c18)hplc色谱(30→90%mecn(1%acoh)在h2o(1%acoh)中)纯化混合物。得到产物,为无色薄膜(4.3mg,2.7μmol,25%)。lcms(esi+)c78h124n13o20s+(m+h+)的计算值为1594.88,实测值为1594.97。
实施例14:化合物109的制备
向2-(2-(2-(2-氨基乙氧基)乙氧基)乙氧基)乙醇(256mg,1.32mmol)在dcm(30ml)中的溶液中加入bcn-osu(351mg,1.20mmol)和et3n(502μl,364mg,3.60mmol)。将所得溶液搅拌30分钟并用饱和nh4cl水溶液洗涤。分离后,将水相用dcm(30ml)萃取。将合并的有机相干燥(na2so4)并浓缩。将残余物用柱色谱(meoh在dcm中0→10%)纯化。得到产物,为无色油状物(397mg,1.07mmol,90%)。1hnmr(400mhz,cdcl3)δ(ppm)5.93(bs,1h),4.14(d,j=8.1hz,2h),3.77-3.69(m,4h),3.68-3.59(m,8h),3.58-3.52(m,2h),3.42-3.32(m,2h),2.34-2.16(m,6h),1.66-1.51(m,2h),1.36(五重峰,j=8.7hz,1h),1.00-0.85(m,2h)。
实施例15:化合物110的制备
向109(0.40g,1.08mmol)在dcm(50ml)中的溶液中加入氯甲酸对硝基苯酯(pnp-cocl;240mg,1.19mmol)和et3n(452μl,328mg,3.24mmol)。将混合物搅拌20小时并浓缩。将残余物用柱色谱(20%→70%etoac在庚烷中)纯化。得到产物,为无色油状物(424mg,0.79mmol,73%)。1hnmr(400mhz,cdcl3)δ(ppm)8.31-8.26(m,2h),7.42-7.37(m,2h),5.20(bs,1h),4.47-4.43(m,2h),4.15(d,j=8.4hz,2h),3.84-3.80(m,2h),3.75-3.60(m,8h),3.59-3.54(m,2h),3.42-3.32(m,2h),2.35-2.16(m,6h),1.66-1.50(m,2h),1.40-1.30(m,1h),1.00-0.85(m,2h)。
实施例16:化合物111的制备
向val-cit-pab-mmae(vc-pabmmae;13.9mg;0.011mmol)在dmf(400μl)中的溶液中加入et3n(3.4μl,2.5mg,24.3μmol)和110(3.0mg,5.6μmol)在dmf(200μl)中的溶液。25分钟后,et3n(1.1μl,0.80mg,7.9μmol)和另外的110(2.2mg,4.1μmol)在dmf(33μl)中的溶液。17.5h后,加入2′-(亚乙二氧基)双(乙胺)(1.2μl,1.2mg,8.1μmol)在dmf中的溶液(12μl的10%溶液在dmf中)。将混合物在冰箱中放置过夜,并通过反相(c18)hplc色谱(30→90%mecn(1%acoh)在h2o(1%acoh)中)纯化。得到产物,为无色薄膜(10.9mg,7.2μmol,74%)。lcms(esi+)c78h124n11o19+(m+h+)的计算值为1518.91,实测值为1519.09。
实施例17-21:endosh
一方面,本发明涉及包含两种内切糖苷酶的融合酶。在特定实例中,两种内切糖苷酶endos和endoh通过接头连接,优选-(gly4ser)3(his)6-(gly4ser)3-接头。根据本发明的融合酶也称为endosh。根据本发明的酶与seqidno:1具有至少50%的序列同一性,优选与seqidno:1具有至少70%,更优选至少80%的序列同一性,例如与seqidno:1具有至少81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%的序列同一性。可以通过本领域已知的已知方法和/或计算机程序方法容易地计算同一性,例如可从ncbi和其它来源公开获得的blastp(blastmanual,altschul,s.,等,ncbinlmnihbethesda,md20894;altschul,s.,等,j.mol.biol.215:403-410(1990))。优选地,具有与seqidno:1的上述序列同一性的本发明的酶具有endos和endoh活性。最优选地,根据本发明的酶与seqidno:1具有100%的序列同一性。
还包括endos和endoh的融合酶,其中接头被本领域已知的另一种合适的接头取代,其中所述接头可以是刚性的或柔性的。优选地,所述接头是柔性接头,允许相邻蛋白质结构域相对彼此自由移动。优选地,所述柔性接头由氨基酸残基组成,如甘氨酸,丝氨酸,组氨酸和/或丙氨酸,并且具有3至59个氨基酸残基的长度,优选10至45或15至40个氨基酸残基,例如15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39或40个氨基酸残基,或20至38,25至37或30至36个氨基酸残基。任选地,融合酶与标签共价连接或包含标签,以便于本领域中已知的纯化和/或检测,例如fc标签,flag-标签,poly(his)-标签,ha-标签和myc标签。
糖蛋白的修剪在本领域是已知的,例如wo2007/133855或wo2014/065661。根据本发明的酶表现出endos和endoh两种活性,并且能够修剪核心glcnac单元上的糖蛋白(例如抗体)上的聚糖,仅留下糖蛋白上的核心glcnac残基(endos活性)以及分离高甘露糖聚糖(endoh活性)。令人惊讶的是,融合酶的两种活性在约7-8的ph下平稳地起作用,而单体endoh需要ph为6以最佳地操作。
根据本发明的融合酶可以通过本领域常规技术制备,例如将包含酶编码序列的表达载体(例如质粒)导入宿主细胞(例如大肠杆菌)中进行表达,酶可以从中被隔离。制备和纯化根据本发明的融合酶的可能方法在实施例17-19中给出,并且其功能在实施例20和21中得到证实,其中曲妥珠单抗和高甘露糖曲妥珠单抗在单个步骤中被有效修剪。在实施例24中提供了通过融合蛋白endosh有效修剪聚糖的另一个实例。
实施例17:将融合蛋白endosh克隆到(pet22b)表达载体中
含有ecori-hindiii位点之间的endos-(g4s)3(his)6-(g4s)3-endoh(endosh)编码序列(endosh由seqidno:1鉴定)的pet22b-载体从genscript获得。endosh融合蛋白的dna序列由endos的编码残基48-995组成,所述endos通过n-末端连接的甘氨酸-丝氨酸(gs)接头与endoh融合。甘氨酸-丝氨酸(gs)接头包含-(g4s)3(his)6-(g4s)3-形式,允许两种酶的间隔并同时引入imac-纯化标签。
实施例18:融合蛋白endosh的大肠杆菌表达
endosh融合蛋白(由seqidno:1鉴定)的表达始于质粒(pet22b-endosh)转化为bl21细胞。下一步是用bl21细胞接种500ml培养物(lb培养基+氨苄西林)。当od600达到0.7时,用1mmiptg(500μl的1m储备溶液)诱导培养物。
实施例19:从大肠杆菌中纯化融合蛋白endosh
在37℃过夜诱导后,通过离心沉淀培养物。将沉淀重悬于40mlpbs中,并与5ml溶菌酶(10mg/ml)在冰上温育30分钟。半小时后,加入5ml10%triton-x-100并在冰上超声处理(10分钟)。超声处理后,通过离心(10分钟,8000xg)除去细胞碎片,然后通过0.22μm孔径的过滤器过滤。将可溶性提取物上样到histraphp5ml柱(gehealthcare)上。首先用缓冲液a(20mmtris缓冲液,20mm咪唑,500mmnacl,ph7.5)洗涤柱子。用缓冲液b(20mmtris,500mmnacl,250mm咪唑,ph7.5,10ml)洗脱保留的蛋白质。通过sds-page在聚丙烯酰胺凝胶(12%)上分析级分。合并含有纯化的靶蛋白的级分,并通过在4℃下过夜透析将缓冲液与20mmtrisph7.5和150mmnacl交换。使用amiconultra-0.5,ultracel-10膜(millipore)将纯化的蛋白质浓缩至至少2mg/ml。在进一步使用之前将产物储存在-80℃。
实施例20:通过endosh修剪曲妥珠单抗
使用浓度为0.1或1w/w%的endosh修剪在25mmtris缓冲液ph8中的曲妥珠单抗(从epirusbiopharma(utrecht,荷兰)获得;14mg/ml)。将反应物350μg曲妥珠单抗(25μl)和适量endosh在37℃下搅拌并通过ms分析随时间分析1至3小时。在分析之前将样品进行fabricator处理。在37℃下用0.1w/w%endosh1小时后观察到修剪产物的完全转化,其被修剪成核心glcnac糖残基。
实施例21:通过融合蛋白endosh修剪高甘露糖曲妥珠单抗
使用浓度为0.1或1w/w%的endosh修剪在25mmtris缓冲液ph8中的具有高甘露糖聚糖的曲妥珠单抗(通过evitria(zurich,瑞士)在kifunensine的存在下在chok1细胞中瞬时表达而获得)(14mg/ml)。将反应物350μg高甘露糖曲妥珠单抗(25μl)和适量endosh在37℃下搅拌并通过ms分析随时间分析1-3小时。在分析之前将样品进行fabricator处理。在37℃下用1w/w%endosh3小时后观察到修剪产物的完全转化,其被修剪成核心glcnac糖残基。
实施例22-28:cac10生物缀合物的制备
修饰的生物分子13d的制备根据如下所述的程序进行,利用内切糖苷酶融合蛋白endos-接头-endoh(也称为endosh,由seqidno:1鉴定)修剪cac10的聚糖。在第二步中,在存在6-n3-galnac-udp(可商购自glycohub)作为底物的情况下,通过his-tngalnact的作用将修剪的cac10转化为叠氮基修饰的mab13d。cac10生物缀合物的制备示意性地描绘于图13中。基于抗体mab-3但其它与13d相同的修饰的生物分子13e以相同方式制备,如下文进一步描述。
实施例22:cac10的瞬时表达和纯化
通过evitria(zurich,瑞士)以5l规模在chok1细胞中瞬时表达cac10。使用填充有50ml蛋白a琼脂糖凝胶的xk26/20柱纯化上清液。在单次运行中,将5μl上清液上样到柱上,然后用至少10倍柱体积的25mmtrisph7.5,150mmnacl洗涤。用0.1m甘氨酸ph2.7洗脱保留的蛋白质。洗脱的cac10立即用1.5mtris-hclph8.8中和,并用25mmtrisph8.0透析。接下来,使用vivaspinturbo15超滤单元(sartorius)将igg浓缩至约20mg/ml,并在进一步使用前储存在-80℃。
实施例23:his-tngalnact(33-421)的瞬时表达和纯化
通过evitria(zurich,瑞士)以5l规模在chok1细胞中瞬时表达his-tngalnact(33-421)(由seqidno:2鉴定)。使用填充有25mlni琼脂糖凝胶(gehealthcare)的xk16/20柱纯化上清液。每次运行将约1.5l上清液上样到柱上,然后用至少10倍柱体积的缓冲液a(20mmtris缓冲液,5mm咪唑,500mmnacl,ph7.5)洗涤。用缓冲液b(20mmtris,500mmnacl,500mm咪唑,ph7.5)洗脱保留的蛋白质。使用hipreph26/10脱盐柱(gehealthcare)将洗脱级分的缓冲液更换为25mmtrisph8.0。使用vivaspinturbo4超滤单元(sartorius)将纯化的蛋白质浓缩至至少3mg/ml,并在进一步使用前储存在-80℃。
实施例24:通过融合蛋白endosh制备修剪的cac10
使用融合蛋白endosh进行cac10(通过evitria(zurich,瑞士)在chok1细胞中瞬时表达而获得)的聚糖修剪。因此,将cac10(14.5mg/ml)与在25mmtrisph7.5中的endosh(1w/w%)以及150mmnacl在37℃下温育约16小时。修剪的igg用3×1l25mmtris-hclph8.0透析。fabricator消化样品的质谱分析显示fc/2片段的三个峰,属于一种主要产物(观察到质量24105da,总fc/2片段的80%),对应于核心glcnac(fuc)-取代的cac10,和两种次要产物(观察到的质量为23959和24233da,总fc/2片段的约5%和15%),对应于核心glcnac-取代的cac10和核心glcnac(fuc)-取代的具有c-末端赖氨酸的cac10。
实施例25:在tngalnact的作用下6-n3-galnac-udp对修剪的cac10的糖基转移
底物6-n3-galnac-udp(11d)用于制备修饰的生物分子cac10-(6-n3-galnac)21d,适合作为本发明上下文中的生物分子。将如上文实施例24中所述通过endosh处理cac10获得的修剪的cac10(10mg/ml)与底物6-n3-galnac-udp(2.5mm,可商购自glycohub)和在10mmmncl2和25mmtris-hclph8.0中的0.5mg/mlhis-tngalnact(33-421)(5w/w%)在30℃下温育。3小时后,将his-tngalnact(33-421)的量增加至终浓度为1mg/ml(10w/w%),并将反应物在30℃温育过夜。使用aktapurifier-10(gehealthcare)在hitrapmabselectsure5ml柱(gehealthcare)上从反应混合物中纯化生物分子13d。洗脱的igg立即用1.5mtris-hclph8.8中和,并用pbsph7.4透析。接下来,使用amiconultra-0.5,ultracel-10膜(millipore)浓缩igg至浓度为23.38mg/ml。fabricator消化样品的质谱分析显示fc/2-片段的三个峰,属于一种主要产物(观察到质量24333da,总fc/2片段的约80%),对应于核心6-n3-galnac-glcnac(fuc)-取代的cac10,和两种次要产物(观察到质量为24187和24461da,总fc/2片段的约5和15%),对应于核心6-n3-galnac-glcnac-取代的cac10和核心6-n3-galnac-glcnac(fuc)-取代的具有c-末端赖氨酸的cac10。
实施例26:13d与100的缀合以获得缀合物113
通过将作为接头-缀合物的化合物100与作为生物分子的修饰的生物分子13d缀合,以制备根据本发明的生物缀合物。向cac10(叠氮化物)2(13d)(287μl,6.7mg,23.38mg/ml在pbsph7.4中)的溶液中加入pbsph7.4(133μl)和化合物100(27μl,10mm溶液在dmf溶液中)。将反应物在室温下温育过夜,然后在aktapurifier-10(gehealthcare)上的superdex20010/300gl(gehealthcare)上纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量25844da,总fc/2片段的约80%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为1.88。
实施例27:13d与108的缀合以获得缀合物114
通过将作为接头-缀合物的化合物108与作为生物分子的修饰的生物分子13d缀合,以制备根据本发明的生物缀合物。向cac10(叠氮化物)2(13d)(287μl,6.7mg,23.38mg/ml,在pbsph7.4中)的溶液中加入pbsph7.4(133μl)和化合物108(27μl,10mm溶液在dmf中)。将反应物在室温下温育过夜,然后在aktapurifier-10(gehealthcare)上的superdex20010/300gl(gehealthcare)上纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量25928da,总fc/2片段的约70%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为1.85。
实施例28:13d与111的缀合以获得缀合物112
通过将作为接头-缀合物的化合物111与作为生物分子的修饰的生物分子13d缀合,以制备对照生物缀合物。向cac10(叠氮化物)2(13d)(287μl,6.7mg,23.38mg/ml,在pbsph7.4中)的溶液中加入pbsph7.4(48.2μl)化合物111(111.8μl,4mm溶液在dmf中)。将反应物在室温下温育过夜,然后在aktapurifier-10(gehealthcare)上的superdex20010/300gl(gehealthcare)上纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量25853da,总fc/2片段的约80%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为1.88。
实施例29-32:曲妥珠单抗和cac10adc的体内功效和毒性研究
实施例29:用曲妥珠单抗adc95-98进行的体内功效研究
将雌性sho小鼠(crl:sho-prkdcscidhrhr,在实验阶段开始时为6至9周龄,从法国l′arbresles的charlesriver实验室获得)用氯胺酮/甲苯噻嗪麻醉,皮肤用氯己定溶液感染,在肩胛间区域水平上切开,将20mm3肿瘤片段20(从hbcx-13b乳腺癌患者获得的异种移植物模型)置于皮下组织中,并用夹子封闭皮肤。当肿瘤体积在60至200mm3的范围内时,用载体95(3mg/kg和9mg/kg),96(3mg/kg和9mg/kg),97(3mg/kg和9mg/kg),98(3mg/kg和9mg/kg)静脉内注射4只小鼠的组。每周两次测量肿瘤。
肿瘤体积的结果如图14所示。发现接头的类型对肿瘤体积具有显著影响。含有根据本发明的接头(95和97)的adc显著优于具有peg接头的adc(96和98)。
实施例30:用cac10adc112-114进行的体内功效研究
将在实验阶段开始时8至12周龄的cr雌性cb.17scid小鼠(从美国charlesriver实验室获得)在50%matrigel侧腹皮下注射1x107karpas-299肿瘤细胞(karpas-299细胞异种移植模型)。当肿瘤体积在100-150mm3的范围内时,用载体112(1mg/kg),113(1mg/kg)和114(1mg/kg)静脉内注射8只小鼠的组。每周两次测量肿瘤。
肿瘤体积的结果如图15所示。发现接头的类型对肿瘤体积有显著影响。含有根据本发明的接头(113和114)的adc显著优于具有peg接头的adc(112)。
实施例31:用曲妥珠单抗adc97和98进行的大鼠安全性研究
将spraguedawley大鼠(每组3只雄性和3只雌性):ofa:sd,在实验阶段开始时6周龄,从法国saint-germain-nuelles的charlesriver实验室获得,用97((1)20mg/kg和(2)40mg/kg),或98((1)20mg/kg和(2)40mg/kg)静脉注射(推注)处理,使用微量输注装置引入尾静脉(2ml/kg,1ml/min)。用载体处理一组动物(对照)。施用后,将所有动物维持5天观察期。在第5天杀死存活的动物。在随机化/选择时,在施用前(第0天)以及第2天和第4天,对每只动物进行称重。所有动物(包括任何发现死亡或杀死的垂死动物)进行全面尸检程序。对所有动物进行肝、脾和坐骨神经的组织病理学检查。收集血液样品(包括杀死的垂死动物),并进行血液学和血清临床化学参数两者的测定。
血小板计数和体重的结果描绘于图16中,并证明动物能够同样耐受根据本发明的缀合物(97)和具有现有技术的接头的缀合物(98)。没有观察到血小板计数和体重的显著差异,而载体处理的大鼠的两个参数都迅速下降。
实施例32-42:接头-缀合物121、124、129和130的制备
本文描述了根据本发明的接头-缀合物124、126和130,以及对照接头-缀合物121、125和129的合成。
实施例32:化合物119的制备
向溶液110(0.90g;1.69mmol)在dcm(50ml)中的溶液中加入二乙醇胺(dea,231mg;2.20mmol)在dmf(7ml)中的溶液和et3n(707μl;513mg;5.07mmol)。将所得混合物在室温下搅拌43小时,并用饱和nh4cl水溶液(50ml)洗涤。将水相用dcm(50ml)萃取,将合并的有机层干燥(na2so4)并浓缩。将残余物通过快速柱色谱(dcm→meoh/dcm1/9)纯化。得到产物,为无色薄膜(784mg;1.57mmol;93%)。1hnmr(400mhz,cdcl3)δ(ppm)5.67-5.60(m,1h),4.32-4.27(m,2h),4.14(d,j=8.4hz,2h),3.89-3.79(m,4h),3.75-3.60(m,10h,3.58-3.53(m,2h),3.53-3.44(m,4h),3.40-3.33(m,2h),2.35-2.18(m,6h),1.62-1.56(m,2h),1.42-1.30(m,1h),1.00-0.88(m,2h)。
实施例33:化合物120的制备
向119(0.78g;1.55mmol)在dcm(20ml)中的溶液中加入氯甲酸4-硝基苯酯(938mg;4.65mmol)和et3n(1.08ml;784mg;7.75mmol)。将所得混合物在室温下搅拌17小时并浓缩。将残余物通过快速柱色谱(dcm→meoh/dcm1/9(柱1),50%etoac在庚烷中→etoac(柱2))纯化两次。得到产物,为浅黄色油状物(423mg;0.51mmol;33%)。1hnmr(400mhz,cdcl3)δ(ppm)8.31-8.25(m,4h),7.42-7.35(m,4h),5.22-5.14(m,1h),4.48-4.43(m,4h),4.33-4.28(m,2h),4.14(d,j=8.4hz,2h),3.78-3.68(m,6h),3.67-3.59(m,8h),3.57-3.51(m,2h),3.39-3.32(m,2h),2.34-2.16(m,6h),1.60-1.55(m,2h),1.40-1.30(m,1h),0.99-0.88(m,2h)。
实施例34:接头-缀合物121的制备
向120(34mg,41μmol)在dmf(400μl)中的溶液中加入三乙胺(28μl;20mg;201μmol)和vc-pabc-mmae.tfa(83mg;67μmol)在dmf(1.0ml)中的溶液。将混合物用dmf(1200μl)稀释,并静置41小时,并加入2,2′-(亚乙二氧基)双(乙胺)(47μl,48mg,322μmol)。80分钟后,通过rphplc(c18,30%→90%mecn(1%acoh)在水(1%acoh)中)纯化反应混合物,得到所需产物,为无色油状物(66mg,24μmol,58%(基于120))。lcms(esi+)c142h226n22o352+(m+2h+)的计算值为1400.33,实测值为1401.08。
实施例35:化合物122的制备
向化合物99(0.39g;0.734mmol)在dcm(30ml)中的溶液中加入二乙醇胺(dea,107mg;1.02mmol)在dmf(2ml)中的溶液和et3n(305μl;221mg;2.19mmol)。将所得混合物在室温下搅拌17小时,并用饱和nh4cl水溶液(30ml)洗涤。将水相用dcm(30ml)萃取,将合并的有机层干燥(na2so4)并浓缩。将残余物通过快速柱色谱(dcm→meoh/dcm1/9)纯化。得到产物,为无色薄膜(163mg;0.33mmol;45%)。1hnmr(400mhz,cdcl3)δ(ppm)6.29(bs,1h),4.33-4.29(m,2h),4.28(d,j=8.2hz,2h),3.90-3.80(m,4h),3.69-3.64(m,2h),3.61(t,j=4.8hz,2h),3.52(t,j=5.0hz,4h),3.32(t,j=5.1hz,2h),2.37-2.18(m,6h),1.60-1.55(m,2h),1.39(五重峰,j=8.7hz,1h),1.05-0.94(m,2h)。
实施例36:化合物123的制备
向122(163mg,0.33mmol)和氯甲酸4-硝基苯酯(134mg,0.66mmol)在dcm(10ml)中的溶液中加入et3n(230μl;167mg;1.65mmol)。将反应混合物搅拌17小时并浓缩。将残余物通过快速柱色谱法(50%etoac在庚烷中→100%etoac)纯化。得到产物,为无色油状物(69mg;0.084mmol;25%)。1hnmr(400mhz,cdcl3)δ(ppm)8.29-8.23(m,4h),7.42-7.35(m,4h),5.81-5.71(m,1h),4.53-4.43(m,4h),4.36-4.30(m,2h),4.25(d,j=8.2hz,2h),3.81-3.70(m,4h),3.70-3.65(m,2h),3.62-3.56(m,2h),3.32-3.24(m,2h),2.34-2.14(m,6h),1.60-1.45(m,2h),1.35(五重峰,j=8.7hz,1h),1.02-0.91(m,2h)。
实施例37:接头-缀合物124的制备
向123(27mg,33μmol)在dmf(400μl)中的溶液中加入三乙胺(22μl;16mg;158μmol)和vc-pabc-mmae.tfa(96mg;78μmol)在dmf(1.0ml)中的溶液。将混合物静置19小时,并加入2,2′-(亚乙二氧基)双(乙胺)(37μl,38mg,253μmol)。2小时后,将反应混合物用dmf(100μl)稀释,并通过rphplc(c18,30%→90%mecn(1%acoh)在水(1%acoh)中)纯化,得到所需产物,为无色薄膜(41mg,14.7μmol,45%)。lcms(esi+)c138h219n23o35s2+(m+2h+)的计算值为1395.79,实测值为1396.31。
实施例38:化合物125的制备
将bcn-osu碳酸盐(66mg,0.23mmol),氨基-dpeg8-酸(100mg,0.23mmol)和et3n(69mg,94μl,0.678mmol)在thf/水(10ml/10ml)中的混合物搅拌过夜。加入磷酸钾缓冲液(0.5m,ph3.0)并通过加入1nhcl水溶液使ph达到3.0。用etoac(20ml)萃取水溶液。将有机相干燥(na2so4)并浓缩。得到产物,为无色油状物(138mg,0.22mmol;97%)。1hnmr(400mhz,cdcl3)δppm5.43-5.35(m,1h),4.14(d,2h,j=8.0hz),3.77(t,2h,j=6.0hz),3.68-3.60(m,28h),3.58-3.53(m,2h),3.40-3.33(m,2h),2.60(t,2h,j=6.0hz),2.35-2.16(m,6h),1.65-1.50(m,2h),1.40-1.30(m,1h),1.00-0.85(m,2h)。
实施例39:化合物126的制备
在n2气氛下将bcn醇(0.384g,2.55mmol)在mecn(25ml)中的溶液冷却至0℃,并逐滴加入氯磺酰基异氰酸酯(csi)(0.255ml,415mg,2.93mmol,1.15当量)。搅拌15分钟后,滴加et3n(1.42ml,1.03g,10.2mmol,4当量),继续搅拌10分钟。接着,加入2-(2-(2-氨基乙氧基)乙氧基)乙酸(1.0g,6.1mmol,2.4当量)在h2o(5ml)中的溶液,将反应混合物在室温下搅拌2小时。此后,加入chcl3(50ml)和h2o(100ml),分离各层。向分液漏斗中的水层中加入ch2cl2(100ml)并在分离各层之前用1nhcl将ph调节至4。将水层用ch2cl2(2×100ml)萃取两次,将有机层合并并干燥(na2so4),过滤并浓缩。将残余物通过在二氧化硅上的快速柱色谱纯化,用ch2cl2至20%meoh的ch2cl2溶液洗脱。得到0.42g(1.0mmol,39%)的126,为无色粘性蜡状物。
实施例40:化合物128的制备
称量四(三苯基膦)钯pd(pph3)4(4.8mg,4.15μmol)并置于n2气氛下。通过将n2鼓泡通过溶液以使吡咯烷(5.0μl,4.3mg,60μmol)在dcm(1ml)中的溶液脱气。通过将n2鼓泡通过溶液以使127(27mg,24μmol)在dcm(6ml)中的溶液脱气。当仍然鼓泡n2通过溶液时,加入脱气的吡咯烷溶液。将称重的pd(pph3)4溶解在ch2cl2(1ml)中并加入0.9ml该溶液。在鼓泡n250分钟后,加入ch2cl2(25ml)并将混合物用饱和nh4cl水溶液(25ml)洗涤。分离后,水层用ch2cl2(2×25ml)萃取。将合并的有机层干燥(na2so4)并浓缩。将残余物通过rp-hplc(30-90%mecn(0.1%甲酸)在h2o(0.1%甲酸)中)纯化。合并的级分通过spe(hco3-)柱并浓缩。加入mecn后(50ml)再次浓缩混合物,所得残余物用于下一步骤。
实施例41:化合物129的制备
将128(6.8mg,7.4μmol)和125(5.6mg,9.0μmol)在chcl3(400μl)中的混合物加入到edc.hcl(2.6mg,13.5μmol)中。将混合物静置1.5小时,加入edc·hcl(2.6mg,13.6μmol)和2,2′-(亚乙二氧基)双(乙胺)(1.3μl,1.3mg,8.8μmol)。将混合物静置过夜,并用dcm(10ml)稀释。将有机溶液用饱和nh4cl水溶液洗涤,干燥(na2so4)并浓缩。将残余物通过反相(c18)hplc色谱(30→90%mecn(无酸)在h2o(0.01%甲酸)中)纯化。在收集之前,hplc收集管填充有5%(nh4)hco3水溶液。合并含有所需产物的级分,用二氯甲烷(10ml)萃取,将有机相干燥(na2so4)并浓缩,得到所需产物(4.6mg,3.0μmol,41%)。lcms(esi+)c79h109n8o22+(m+h+)的计算值为1521.77,实测值为1521.99。
实施例42:化合物130的制备
向128在chcl3(5ml)中的溶液中加入126(15mg,36μmol)在chcl3(0.8ml)中的溶液。将所得混合物加入到固体edc.hcl(4.7mg,25μmol),加入chcl3(5ml)并将混合物静置16小时。加入dcm(30ml)并将所得混合物用水(30ml)洗涤。分离后,水相用dcm(30ml)萃取。将合并的有机层干燥(na2so4)并浓缩。将残余物通过rp-hplc(30-90%mecn(无酸)在h2o(0.01%甲酸)中)纯化。在收集之前,hplc收集管填充有5%(nh4)hco3水溶液。用dcm(3×20ml)提取合并的hplc级分。将合并的有机层干燥(na2so4)并浓缩。得到产物130,为浅黄色油状物(21mg,16μmol,分子量1323g/mol,67%相对于从127的两步)。
实施例43-44:cac10生物缀合物的制备
实施例43:13d与121的缀合以获得缀合物115
通过将作为接头-缀合物的化合物121与作为生物分子13d的叠氮化物修饰的cac10缀合,以制备根据本发明的生物缀合物。向cac10-(6-n3-galnac)2(13d)(8.408ml,246.0mg,29.3mg/ml在pbsph7.4中)的溶液中加入丙二醇(11.909ml)和化合物121(410.6μl,40mm)在dmf中的溶液。将反应物在室温下温育约40小时。将反应混合物透析至ph7.4的pbs,并在aktapurifier-10(gehealthcare)上的hiload26/600superdex200pg(gehealthcare)上纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量27132da,总fc/2片段的约80%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为3.81。
实施例44:13d与124的缀合以获得缀合物116
通过将作为接头-缀合物的化合物124与作为生物分子13d的叠氮化物修饰的cac10缀合,以制备根据本发明的生物缀合物。因此,向cac10-(6-n3-galnac)2(13d)(9.95ml,205mg,20.7mg/ml在pbsph7.4中)的溶液中加入pbsph7.4(1.0ml),dmf(2.568ml)和化合物124(171.7μl,40mm溶液在dmf中)。将反应物在室温下温育过夜,然后在aktapurifier-10(gehealthcare)上的hiload26/600superdex200pg(gehealthcare)上透析和纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量27124da,总fc/2片段的约80%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为3.79。
实施例45-48:mab-3生物缀合物的制备
修饰的生物分子13e的制备根据上文针对cac10所述的类似程序进行,利用内切糖苷酶融合蛋白endosh修剪mab-3的聚糖。在第二步中,在存在6-n3-galnac-udp(可商购自glycohub)作为底物的情况下,通过his-tngalnact的作用将修饰的mab-3转化为叠氮基修饰的抗体13e。
实施例45:通过融合蛋白endosh制备修剪的mab-3
用融合蛋白endosh进行mab-3的聚糖修剪。向mab-3(23.21ml,200mg,8.6mg/ml在pbsph7.4中)的溶液中加入endosh(526μl,2.0mg,3.8mg/ml在25mmtris-hclph7.5中)。将反应在37℃下温育约16小时。fabricator消化样品的质谱分析显示fc/2片段的一个主峰,属于一种主要产物(观察到质量24139da,总fc/2片段的约90%),对应于核心glcnac(fuc)-取代的mab-3。将修剪的igg用2×1l25mmtris-hclph8.0和150mmnacl透析,然后通过旋转过滤浓缩至21.5mg/ml(amiconultra-4,ultracel-10膜,millipore)
实施例46:在tngalnact的作用下6-n3-galnac-udp对修剪的mab-3的糖基转移
底物6-n3-galnac-udp(11d)用于制备修饰的生物分子mab-3-(6-n3-galnac)213e,适合作为本发明上下文中的生物分子。向实施例48中获得的修剪的mab-3(9.297ml,200mg,21.5mg/ml在25mmtris-hclph8.0与150mmnacl中)的溶液中加入mncl2(133μl,0.1m在mq中),his-tngalnact(33-421)(3.112ml,15mg,4.82mg/ml在25mmtris-hclph8.0中)和6-n3-galnac-udp(1.0ml,63mg,0.1m在mq中)。将反应在30℃下温育约16小时。使用aktapurifier-10(gehealthcare)在hitrapmabselectsure5ml柱(串联连接的3个柱,gehealthcare)上从反应混合物中纯化生物分子13e。洗脱的igg立即用1.5mtris-hclph8.8中和,并用pbsph7.4透析。接下来,使用amiconultra-4,ultracel-10膜(millipore)浓缩igg至浓度为20.17mg/ml。fabricator消化样品的质谱分析显示fc/2片段的一个主峰,属于一种主要产物(观察到质量24365da,总fc/2片段的约90%),对应于核心6-n3-galnac-glcnac(fuc)-取代的mab-3。
实施例47:13e与129的缀合以获得缀合物117
通过将作为接头-缀合物的化合物129与作为生物分子的叠氮化物修饰的mab-3缀合,以制备根据本发明的生物缀合物。因此,向mab-3-(6-n3-galnac)2(13e)(1.667ml,40.6mg,24.6mg/ml在pbsph7.4中)的溶液中加入pbsph7.4(636μl),dmf(163μl)和化合物129(244μl,10mm溶液在dmf中)。将反应物在室温下温育过夜,然后在aktapurifier-10(gehealthcare)上的superdex20010/300gl(gehealthcare)上透析和纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量25890da,总fc/2片段的约90%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为1.96。
实施例48:13e与130的缀合以获得缀合物118
通过将作为接头-缀合物的化合物130与作为生物分子的叠氮化物修饰的mab-3缀合,以制备根据本发明的生物缀合物。因此,向mab-3-(6-n3-galnac)2(13e)(1.667ml,40.6mg,24.6mg/ml在pbsph7.4中)的溶液中加入pbsph7.4(636μl),dmf(190μl)和化合物130(217μl,10mm溶液在dmf中)。将反应物在室温下温育过夜,然后在aktapurifier-10(gehealthcare)上的superdex20010/300gl(gehealthcare)上透析和纯化。fabricator消化样品的质谱分析显示一种主要产物(观察到质量25691da,总fc/2片段的约90%),对应于缀合的fc/2片段。还原样品的rp-hplc分析表明平均dar为1.98。
实施例49-51:用mab-3adc进行的体内功效和毒性研究
实施例49:用cac10adc115和116进行的体内功效研究
将在实验阶段开始时8至12周龄的cr雌性cb.17scid小鼠(从美国charlesriver实验室获得)在50%matrigel侧腹皮下注射1x107karpas-299肿瘤细胞(karpas-299细胞异种移植模型)。当肿瘤体积在100-150mm3的范围内时,用载体115(1和2mg/kg)和
在一项分开但相同的研究中,用载体116(1mg/kg)和
发现接头的类型对肿瘤体积具有显著影响。含有根据本发明的接头的adc(116)在相同剂量下显著优于
实施例50:用cac10adc112-114进行的大鼠安全性研究
将从美国charlesriver实验室获得的在实验阶段开始时5-6周龄的雌性wistar大鼠(每组2只雌性)用112(40,60,70或80mg/kg),113(40,60,70或80mg/kg)或114(40,60,70或80mg/kg)处理。通过使用微量输注装置(2ml/kg,1ml/min)通过静脉内(推注)注射施用测试项目以引入尾静脉。用载体(对照)处理一组动物。施用后,将所有动物维持12天观察期。在第12天对存活的动物实施安乐死。在随机化/选择时,在施用前(第0天)和随后的所有日期直至第12天,对每只动物进行称重。任何具有单次观察>30%体重减轻或连续三次测量>25%体重减轻的个体动物被安乐死。所有动物(包括任何发现的死亡或杀死的垂死动物)都接受完整的尸检程序。对所有动物进行肝、脾和坐骨神经的组织病理学检查。收集血液样品(包括杀死的垂死动物),并进行血液学和血清临床化学参数两者的测定。
对于每个adc的不同剂量方案,大鼠体重减轻百分比的结果如图18a-c所示。从这些结果清楚地看出,发现所有112-114的最大耐受剂量(mtd)为60mg/kg。
实施例51:用cac10adc115,116和
将从美国charlesriver实验室获得的在实验阶段开始时5-6周龄的雌性wistar大鼠(每组2只雌性)用115(80,120,140或160mg/kg),116(80,120,140或160mg/kg)或
对于每个adc的不同剂量方案,大鼠体重减轻百分比的结果如图19a-c所示。从这些结果可以清楚地看出,adcetris的最大耐受剂量(mtd)在15mg/kg和20mg/kg之间,而发现adc115和116的mtd为120mg/kg。
实施例52-53:用mab-3adc进行的体内功效和毒性研究
实施例52:用mab-3adc117和118进行的体内功效研究
将5×106mda-mb-231肿瘤细胞皮下植入雌性无胸腺裸鼠中。当肿瘤体积达到88-172mm3时,在10只小鼠的组中开始施用载体117,118或(靶-阴性)对照adc。通过尾静脉注射一次静脉内(i.v.)施用所有处理。施用体积为10ml/kg体重,并逐步升高至每只个体动物的体重。如果肿瘤体积达到1500mm3的终体积或在研究结束时(以先到者为准)对动物实施安乐死。为了计算该组的平均肿瘤体积,应用以下规则:当动物由于肿瘤大小退出研究时,对动物所记录的最终肿瘤体积包括用于计算随后时间点的平均体积的数据。当一组中少于50%的动物保留在研究中时,肿瘤体积和体重值不用于计算组平均肿瘤体积/体重。prism(graphpad,sandiego,ca)用于图形表示和统计分析。误差条表示sem。图20显示了所有四组的平均肿瘤体积。
实施例53:用mab-3adc117和118进行的大鼠安全性研究
大鼠耐受性研究在covance实验室进行,符合美国农业部(usda)动物福利法案,实验动物研究所的实验动物护理和使用指南以及美国国立卫生研究院(nih)准则。将24只约250克的crl:cd(sd)雄性大鼠随机分成各3只动物的组。通过尾静脉注射给予大鼠单次静脉注射剂量(2,3或6mg/kg)的117,118或载体。施用体积为5ml/kg体重,并逐步升高至每只个体动物的体重。如果它们显示出不良的临床状况或在研究结束时(以先到者为准)对动物实施安乐死。在研究期间定期进行动物临床观察。在第1天的1,3和6小时;在第2,3,7,8,14和21天(最后一个研究日)收集血样(在100μl和1.8ml之间)。
结果:117在3mg/kg时耐受性良好,但在6mg/kg时耐受性差,由于临床条件差导致在第10天早期牺牲。118在3mg/kg和6mg/kg耐受性良好。在研究期间,所有这些组的体重增加显著低于载体处理组中观察到的体重增加,这与减少的食物消耗相关。在用两种测试剂量(3和6mg/kg)的117和118处理的动物中观察到网织红细胞,红细胞团,血小板,嗜中性粒细胞,单核细胞,白细胞和淋巴细胞的剂量依赖性减少。用3mg/kg的118处理的动物在第21天显示出这些参数可逆性的证据。117和118的mtd分别确定为3和6mg/kg。
融合蛋白endosh的序列鉴定(seqidno:1):
(接头加下划线,endoh序列用斜体表示)
his-tngalnact的序列(33-421)(seqidno:2):
- 还没有人留言评论。精彩留言会获得点赞!