三种抗病毒化合物的组合制剂的制作方法
本申请按照35u.s.c§119(e)要求2016年6月2日提交的美国临时申请第62/344,904号的权益,其全部内容并入本文。
背景技术:
丙型肝炎被认为是肝脏的慢性病毒性疾病。虽然靶向肝脏的药物被广泛使用并且已显示出有效性,但毒性和其它副作用限制了它们的有用性。丙型肝炎病毒(hcv)的抑制剂可用于限制hcv感染的建立和进展以及hcv的诊断测定。
已知维帕他韦、索非布韦和伏西瑞韦是有效的抗hcv剂,如例如美国专利号7,964,580、8,575,135和9,296,782中所述。然而,迄今为止还没有在组合制剂或特定共制剂中给予维帕他韦、索非布韦和伏西瑞韦的治疗益处。
技术实现要素:
现已发现,三种活性抗病毒剂即索非布韦、维帕他韦和伏西瑞韦(voxilaprevir),可共同配制成固定剂量组合物。所得的包含这三种活性抗病毒剂的片剂表现出令人惊讶和意想不到的益处,例如优异的稳定性和溶出曲线。
因此,在一个实施方案中,本公开提供了药物组合物,其包含:
a)有效量的维帕他韦,其中维帕他韦基本上是无定形的;
b)有效量的索非布韦,其中索非布韦基本上是结晶的;和
c)有效量的伏西瑞韦,其中伏西瑞韦基本上是无定形的。
在一些实施方案中,将维帕他韦配制为包含分散在由药学上可接受的聚合物a形成的聚合物基质内的维帕他韦的固体分散体。在一个实施方案中,聚合物a是亲水的。在另一个实施方案中,聚合物a是非离子聚合物。在又一个实施方案中,聚合物a是离子聚合物。在各种实施方案中,聚合物a是羟丙甲纤维素、交聚维酮、聚维酮、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇、乙酸琥珀酸羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素或邻苯二甲酸乙酸纤维素。在某些实施方案中,固体分散体中维帕他韦与聚合物a的重量比为约5∶1至约1∶5。
在一些实施方案中,将伏西瑞韦配制为包含分散在由药学上可接受的聚合物b形成的聚合物基质内的伏西瑞韦的固体分散体。在一个实施方案中,聚合物b是亲水的。在另一个实施方案中,聚合物b是非离子聚合物。在又一个实施方案中,聚合物b是离子聚合物。在各种实施方案中,聚合物b是羟丙甲纤维素、交聚维酮、聚维酮、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇、乙酸琥珀酸羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素或邻苯二甲酸乙酸纤维素。在某些实施方案中,固体分散体中维帕他韦与聚合物b的重量比为约5∶1至约1∶5。
在一些实施方案中,基本上结晶的索非布韦在约6.1、20.1和20.8°2θ±0.2处具有xrpd2θ-反射。在一个实施方案中,基本上结晶的索非布韦在约6.1、8.2、10.4、12.7、17.2、17.7、18.0、18.8、19.4、19.8、20.1、20.8、21.8和23.3°2θ±0.2处具有xrpd2θ-反射。在另一个实施方案中,痕量的基本上结晶的索非布韦在约12.6和13.5°2θ±0.2处具有xrpd2θ-反射。
在一些实施方案中,本文公开的药物组合物包含约20w/w%至约80w/w%的索非布韦。在某些实施方案中,本文公开的药物组合物包含约20w/w%至约55w/w%的索非布韦。在一个实施方案中,本文公开的药物组合物包含约31w/w%的索非布韦。
在一些实施方案中,本文公开的药物组合物包含约1w/w%至约45w/w%的包含维帕他韦的固体分散体。在某些实施方案中,本文公开的药物组合物包含约5w/w%至约25w/w%的包含维帕他韦的固体分散体。在一个实施方案中,本文公开的药物组合物包含约15w/w%的包含维帕他韦的固体分散体。
在一些实施方案中,本文公开的药物组合物包含约1w/w%至约45w/w%的包含伏西瑞韦的固体分散体。在某些实施方案中,本文公开的药物组合物包含约5w/w%至约25w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,本文公开的药物组合物包含约15w/w%的包含伏西瑞韦的固体分散体。
在一些实施方案中,本文公开的药物组合物包含:a)约20w/w%至约40w/w%的索非布韦;b)约10w/w%至约30w/w%的包含维帕他韦的固体分散体;和c)约10w/w%至约30w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,本文公开的药物组合物包含:a)约31w/w%的索非布韦;b)约15w/w%的包含维帕他韦的固体分散体;和c)约15w/w%的包含伏西瑞韦的固体分散体。
在一些实施方案中,本文公开的药物组合物还包含稀释剂、崩解剂、润滑剂、助流剂或其任何组合。
在一些实施方案中,稀释剂选自:磷酸二钙、纤维素、可压缩糖、脱水磷酸氢钙、乳糖、乳糖一水合物、甘露醇、微晶纤维素、淀粉、磷酸钙以及它们的组合。在另一个实施方案中,稀释剂是微晶纤维素和乳糖一水合物的混合物,其存在量为约10w/w%至约40w/w%。
在一些实施方案中,崩解剂选自:交联羧甲基纤维素钠、交聚维酮、微晶纤维素、改性玉米淀粉、聚维酮、预胶化淀粉、羟基乙酸淀粉钠以及它们的组合。在一个实施方案中,崩解剂是交联羧甲基纤维素钠,其存在量为约1w/w%至约15w/w%。
在一些实施方案中,润滑剂选自:硬脂酸钙、硬脂酸镁、聚乙二醇、硬脂酰富马酸钠、硬脂酸、滑石以及它们的组合。在一个实施方案中,润滑剂是硬脂酸镁,其存在量为约0.5w/w%至约3w/w%。
在一些实施方案中,助流剂选自:胶体二氧化硅、滑石、淀粉、淀粉衍生物以及它们的组合。在一个实施方案中,助流剂是胶体二氧化硅,其存在量为约0.5w/w%至约3w/w%。
在一些实施方案中,本文公开的药物组合物还包含:约5w/w%至约25w/w%的微晶纤维素;约5w/w%至约15w/w%的乳糖一水合物;约1w/w%至约15w/w%的交联羧甲基纤维素钠;约0.5w/w%至约3w/w%的硬脂酸镁;和约0.5w/w%至约3w/w%的胶体二氧化硅。在一个实施方案中,本文公开的药物组合物还包含:约19w/w%的微晶纤维素;约9w/w%的乳糖一水合物;约8w/w%的交联羧甲基纤维素钠;约2w/w%的硬脂酸镁;和约1w/w%的胶体二氧化硅。
在一些实施方案中,本文公开的药物组合物可以配制成片剂。在一个实施方案中,片剂还包含本文公开的稀释剂、本文公开的崩解剂、本文公开的润滑剂、本文公开的助流剂或其任何组合。在一个实施方案中,片剂包含:
颗粒内组分,包含有效量的维帕他韦,其中维帕他韦基本上是无定形的;有效量的索非布韦,其中索非布韦基本上是结晶的;有效量的伏西瑞韦,其中伏西瑞韦基本上是无定形的;本文公开的稀释剂、本文公开的崩解剂、本文公开的润滑剂和本文公开的助剂;知
颗粒外组分,包含本文公开的稀释剂、本文公开的崩解剂和本文公开的润滑剂。
在一个实施方案中,片剂中的颗粒内和颗粒外稀释剂可以是相同的。在一个实施方案中,片剂中的颗粒内和颗粒外稀释剂可以是不同的。在一个实施方案中,片剂中的颗粒内和颗粒外崩解剂可以是相同的。在一个实施方案中,片剂中的颗粒内和颗粒外崩解剂可以是不同的。在一个实施方案中,片剂中的颗粒内和颗粒外润滑剂可以是相同的。在一个实施方案中,片剂中的颗粒内和颗粒外润滑剂可以是不同的。
在一些实施方案中,本文公开的药物组合物被配制用于立即释放。
在另一个实施方案中,本公开提供了包含本文公开的药物组合物的药物剂型,其中所述药物剂型包含约5mg至约500mg维帕他韦。在某些实施方案中,本文公开的药物剂型包含约5mg至约300mg维帕他韦。在一个实施方案中,本文公开的药物剂型包含约100mg维帕他韦。在另一个实施方案中,本文公开的药物剂型包含约200mg包含维帕他韦的固体分散体。
在一些实施方案中,本文公开的药物剂型包含约5mg至约500mg伏西瑞韦。在某些实施方案中,本文公开的药物剂型包含约5mg至约300mg伏西瑞韦。在一个实施方案中,本文公开的药物剂型包含约100mg伏西瑞韦。在另一个实施方案中,本文公开的药物剂型包含约200mg包含伏西瑞韦的固体分散体。
在一些实施方案中,本文公开的药物剂型包含约200mg至约600mg索非布韦。在某些实施方案中,本文公开的药物剂型包含约300mg至约500mg索非布韦。在一个实施方案中,本文公开的药物剂型包含约400mg索非布韦。
在另一个实施方案中,本公开提供药物剂型,其包含:a)约100mg维帕他韦;b)约400mg索非布韦;和c)约100mg伏西瑞韦。在另一个实施方案中,本公开提供药物剂型,其包含:a)约200mg包含维帕他韦的固体分散体;b)约400mg索非布韦;和c)约200mg包含伏西瑞韦的固体分散体。
在另一个实施方案中,本公开提供了包含本文公开的药物剂型的片剂。在一个实施方案中,片剂包含:a)约100mg维帕他韦;b)约400mg索非布韦;和c)约100mg伏西瑞韦。在另一个实施方案中,片剂包含:a)约200mg包含维帕他韦的固体分散体;b)约400mg索非布韦;和c)约200mg包含伏西瑞韦的固体分散体。在一些实施方案中,本文公开的片剂包含膜包衣。
在另一个实施方案中,本公开提供了治疗有需要的人类患者的丙型肝炎的方法,包括向患者施用治疗有效量的本文公开的药物组合物、本文公开的药物剂型或本文公开的片剂。
在一些实施方案中,施用本文公开的药物组合物、本文公开的药物剂型或本文公开的片剂约12周或更短时间。在一个实施方案中,本文所公开的药物组合物、本文公开的药物剂型或本文公开的片剂每天施用一次持续约12周。
在一些实施方案中,施用本文公开的药物组合物、本文公开的药物剂型或本文公开的片剂约8周或更短时间。在一个实施方案中,本文所公开的药物组合物、本文公开的药物剂型或本文公开的片剂每天施用一次持续约8周。
在一些实施方案中,施用本文公开的药物组合物、本文公开的药物剂型或本文公开的片剂约6周或更短时间。在一个实施方案中,本文公开的药物组合物、本文公开的药物剂型或本文公开的片剂每天施用一次持续约6周。
在一些实施方案中,施用本文公开的药物组合物、本文公开的药物剂型或本文公开的片剂约4周或更短时间。在一个实施方案中,本文所公开的药物组合物、本文公开的药物剂型或本文公开的片剂每天施用一次持续约4周。
在一些实施方案中,丙型肝炎病毒基因型是1、2、3、4、5或6。在具体的实施方案中,丙型肝炎病毒是基因型1a、1b、2a、2b、2c、2d、3a、3b、3c、3d、3e、3f、4a、4b、4c、4d、4e、4f、4g、4h、4i、5a或6a。
附图说明
图1描绘了伏西瑞韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为颗粒内填充剂组成的函数。
图2描绘了索非布韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为颗粒内填充剂组成的函数。
图3描绘了维帕他韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为颗粒内填充剂组成的函数。
图4描绘了伏西瑞韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为交联羧甲基纤维素钠(ccs)的量的函数。
图5描绘了维帕他韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为交联羧甲基纤维素钠(ccs)的量的函数。
图6描绘了索非布韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为交联羧甲基纤维素钠(ccs)的量的函数。
图7描绘了伏西瑞韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为片剂总重量和索非布韦、维帕他韦和伏西瑞韦的相对量的函数。
图8描绘了维帕他韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为片剂总重量和索非布韦、维帕他韦和伏西瑞韦的相对量的函数。
图9描绘了索非布韦在共干燥制粒索非布韦/维帕他韦/伏西瑞韦片剂(400/100/100mg)中的溶出曲线作为片剂总重量和索非布韦、维帕他韦和伏西瑞韦的相对量的函数。
图10描绘了索非布韦从用于1期和3期临床研究的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线。
图11描绘了维帕他韦从用于1期和3期临床研究的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线。
图12描绘了伏西瑞韦从用于1期和3期临床研究的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线。
图13描绘了索非布韦在索非布韦/维帕他韦/伏西瑞韦膜包衣片中的溶出曲线作为ph的函数。
图14描绘了维帕他韦在索非布韦/维帕他韦/伏西瑞韦膜包衣片中的溶出曲线作为ph的函数。
图15描绘了伏西瑞韦在索非布韦/维帕他韦/伏西瑞韦膜包衣片中的溶出曲线作为ph的函数。
图16a描绘了伏西瑞韦从索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为结晶伏西瑞韦形式viii的含量的函数。
图16b描绘了伏西瑞韦从索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为结晶伏西瑞韦形式x的含量的函数。
图17描绘了索非布韦从索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为结晶伏西瑞韦形式viii和x的含量的函数。
图18描绘了维帕他韦从索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为结晶伏西瑞韦形式viii和x的含量的函数。
图19描绘了维帕他韦从含有维帕他韦喷雾干燥固体分散体的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为纯无定形维帕他韦游离碱的函数。
图20描绘了索非布韦从含有维帕他韦喷雾干燥固体分散体的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为纯无定形维帕他韦游离碱的函数。
图21描绘了伏西瑞韦从含有维帕他韦喷雾干燥固体分散体的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为纯无定形维帕他韦游离碱的函数。
图22描绘了伏西瑞韦从含有伏西瑞韦喷雾干燥固体分散体的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为纯无定形伏西瑞韦游离酸的函数。
图23描绘了索非布韦从含有伏西瑞韦喷雾干燥固体分散体的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为纯无定形伏西瑞韦游离酸的函数。
图24描绘了维帕他韦从含有伏西瑞韦喷雾干燥固体分散体的索非布韦/维帕他韦/伏西瑞韦膜包衣片的溶出曲线作为纯无定形伏西瑞韦游离酸的函数。
图25描绘了伏西瑞韦从含有不同的伏西瑞韦喷雾干燥的固体分散体粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图26描绘了索非布韦从含有不同的伏西瑞韦喷雾干燥的固体分散体粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图27描绘了维帕他韦从含有不同的伏西瑞韦喷雾干燥的固体分散体粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图28描绘了维帕他韦从含有不同的维帕他韦喷雾干燥的固体分散体粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图29描绘了索非布韦从含有不同的维帕他韦喷雾干燥的固体分散体粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图30描绘了伏西瑞韦从含有不同的维帕他韦喷雾干燥的固体分散体粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图31描绘了索非布韦从含有不同的索非布韦粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图32描绘了维帕他韦从含有不同的索非布韦粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
图33描绘了伏西瑞韦从含有不同的索非布韦粒度分布的索非布韦/维帕他韦/伏西瑞韦片剂的溶出曲线。
具体实施方式
1.定义
如在本公开中使用的,以下词语和短语通常旨在具有如下所述的含义,除非使用它们的上下文另有说明。
术语“包括”及其变体,例如“含有”和“包含”应以开放的、包含性的含义来解释,即“包括但不限于”。此外,单数形式“一”、“一个”、和“该”包括复数指代物,除非上下文另有明确说明。因此,提及“化合物”包括多种这样的化合物,并且提及“测定”包括提及一种或多种测定及本领域技术人员已知的其等同物。
如本文所用,在定量测量的上下文中使用的术语“约”表示指示的量±10%。例如,“约2∶8”意味着1.8-2.2∶7.2-8.8。
在整个公开内容中对数值范围的描述旨在用作单独提及落入包括限定范围的值的范围内的每个单独值的简写符号,并且每个单独的值被并入说明书中,好像其在本文中被单独描述。
如本文所用的术语“w/w%”是指基于包含该组分的组合物的总重量的组分重量。例如,如果组分a在100mg组合物中的含量为50w/w%,则组分a的含量为50mg。
术语“有效量”、“药学有效量”和“治疗有效量”是指可以有效引发所需生物学或医学反应的量,包括当施用于个体用于治疗疾病时足以实现对疾病的这种治疗的化合物的量。有效量将根据化合物、疾病及其严重程度和待治疗个体的年龄、体重等而变化。有效量可包括一定范围的量。此外,有效量包括当与其他药剂组合时有效的药剂的量。
术语“无定形”是指这样的状态,其中材料在分子水平上缺乏长程有序,并且取决于温度,可以表现出固体或液体的物理性质。通常,这种材料不能提供独特的x射线衍射图案,并且虽然表现出固体的性质,但更正式地描述为液体。在加热时,发生从固体到液体性质的变化,其特征在于状态的变化,通常是二阶(玻璃化转变)。
本文所用的术语“基本上无定形”是指组合物中存在的大于50%、或大于55%、或大于60%、或大于65%、或大于70%、或大于75%、或大于80%、或大于85%、或大于90%、或大于95%、或大于99%的化合物为无定形形式。“基本上无定形”也可以指具有不超过约20%结晶度、或不超过约10%结晶度、或不超过约5%结晶度、或不超过约2%结晶度的材料。
术语“结晶”是指其中该材料在分子水平上具有规则有序的内部结构并给出具有确定峰的独特x射线衍射图案的固相。当充分加热时,这些材料也将表现出液体的性质,但是从固体到液体的变化的特征在于相变,通常是一阶(熔点)。
本文所用的术语“基本上结晶”是指组合物中存在的大于50%;或大于55%、或大于60%、或大于65%、或大于70%、或大于75%、或大于80%、或大于85%、或大于90%、或大于95%、或大于99%的化合物为结晶形式。“基本上结晶”还可以指具有无定形形式不超过约20%、或不超过约10%、或不超过约5%、或不超过约2%的材料。
术语“固体分散体”(“sd”)是指一种或多种活性剂在固态聚合物基质中的分散体,其通过多种方法制备,包括喷雾干燥、熔化(熔融)、溶剂或熔化-溶剂方法。例如,在一些实施方案中,本文公开的药物组合物可包含伏西瑞韦的固体分散体,其中伏西瑞韦分散在由药学上可接受的聚合物例如交聚维酮形成的聚合物基质中。类似地,在一些实施方案中,本文公开的药物组合物可包含维帕他韦的固体分散体,其中伏西瑞韦分散在由药学上可接受的聚合物例如交聚维酮形成的聚合物基质中。
术语“喷雾干燥的固体分散体”(“ssd”)是指通过喷雾干燥方法制备的固体分散体。
本文所用的术语“无定形固体分散体”是指包含无定形活性剂和聚合物的稳定的固体分散体。“无定形活性剂”是指无定形固体分散体含有基本上无定形的固态形式的活性剂。例如,在其中本文公开的药物组合物包含伏西瑞韦的固体分散体的一些实施方案中,伏西瑞韦可以是基本上无定形的固态形式。同样地,在其中本文公开的药物组合物包含维帕他韦的固体分散体的一些实施方案中,维帕他韦可以是基本上无定形的固态形式。
本文所用的术语“聚合物基质”定义为包含一种或多种聚合物的组合物,其中活性剂分散或包含在基质中。
术语“聚合物”是指由通过聚合过程产生的重复结构单元组成的化学化合物或化合物的混合物。本文通篇描述了用于本发明的合适聚合物。
术语“药学上可接受的”是指在生物学上或其它方面合乎需要的材料,例如,该材料可以掺入给予患者的药物组合物中,而不会引起任何显著的不良生物学效应或以任何有害的方式与任何一种包含它的组合物的其他组分相互作用。药学上可接受的媒介(例如载体、佐剂和/或其他赋形剂)优选满足毒理学和制造测试的所需标准和/或包含在由美国食品和药物管理局制备的非活性成分指南中。例如,通常要求这种材料是基本上无菌的,例如用于注射剂。
术语“载体”或“药学上可接受的载体”是指稀释剂、崩解剂、沉淀抑制剂、表面活性剂、助流剂、粘合剂、润滑剂和与化合物一起施用的赋形剂和媒介。载体通常在本文中描述,并且也在e.w.martin的“remington′spharmaceuticalsciences”中描述。载体的实例可包括但不限于单硬脂酸铝、硬脂酸铝、羧甲基纤维素、羧甲基纤维素钠、交联羧甲基纤维素钠、交聚维酮、异硬脂酸甘油酯、单硬脂酸甘油酯、羟乙基纤维素、羟乙基纤维素、羟甲基纤维素、羟基硬脂酸羟基二十八烷酯、羟丙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、乳糖、乳糖一水合物、硬脂酸镁、甘露醇、微晶纤维素、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆188、泊洛沙姆237、泊洛沙姆407、聚维酮、二氧化硅、胶体二氧化硅、硅氧烷、硅氧烷粘合剂4102和硅氧烷乳液。然而,应该理解,选择用于药物组合物的载体和组合物中这些载体的量可以根据配制方法(例如干法制粒制剂、固体分散制剂)而变化。
术语“稀释剂”是指用于在递送前稀释目标化合物的化合物。稀释剂也可用于稳定化合物。稀释剂的非限制性实例包括淀粉、糖类、二糖、蔗糖、乳糖、乳糖一水合物、多糖、纤维素、纤维素醚、羟丙基纤维素、微晶纤维素、糖醇、木糖醇、山梨糖醇、麦芽糖醇、可压缩糖、碳酸钙或碳酸钠、磷酸二钙、脱水磷酸氢钙、甘露醇和磷酸钙。
当在本文中使用时,术语“粘合剂”涉及任何药学上可接受的薄膜,其可用于将活性组分和载体的惰性组分粘合在一起以保持粘合和离散部分。粘合剂的非限制性实例包括羟丙基纤维素、羟丙基甲基纤维素、聚维酮、交聚维酮和乙基纤维素。
术语“崩解剂”是指一种物质,其在加入至固体制剂后促进其在给药后的分解或崩解,并允许尽可能有效地释放活性成分以使其快速溶出。崩解剂的非限制性实例包括玉米淀粉、羟基乙酸淀粉钠、交联羧甲基纤维素钠、交聚维酮、微晶纤维素、改性玉米淀粉、羧甲基淀粉钠、聚维酮、预胶化淀粉和海藻酸。
术语“润滑剂”是指添加到粉末混合物中以防止压实的粉末物质在压片或包封过程中粘附到设备上的物质。润滑剂可以帮助片剂从模具脱模,并且可以改善粉末流动。润滑剂的非限制性实例包括硬脂酸镁、硬脂酸、二氧化硅、脂肪、硬脂酸钙、聚乙二醇、硬脂酰富马酸钠或滑石;和增溶剂如脂肪酸,包括月桂酸、油酸和c8/c10脂肪酸。
术语“膜包衣”是指在基质(例如片剂)表面上的薄的均匀薄膜。膜包衣特别适用于保护活性成分免于光解降解。膜包衣的非限制性实例包括聚乙烯醇类、羟乙基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、聚乙二醇4000和邻苯二甲酸乙酸纤维素膜包衣。
术语“助流剂”是指片剂和胶囊制剂中使用的物质,用于改善片剂压制期间的流动性并产生抗结块效果。助流剂的实例可包括胶体二氧化硅、滑石、气相二氧化硅、淀粉、淀粉衍生物和膨润土。
疾病或病症的“治疗”和“治疗”包括以下内容:(1)预防或降低发生疾病或病症的风险,即,导致疾病或病症的临床症状不发生在可能暴露于或倾向于疾病或病症但尚未经历或表现出疾病或病症的症状的个体中,(2)抑制疾病或病症,即阻止或减少疾病或病症或其临床症状的发展,(3)缓解疾病或病症,即引起疾病或病症或其临床症状消退。
术语“持续病毒学应答”是指停止治疗后的一段特定的时间患者样品(即血液样品)中缺乏可检测的病毒(即hcv)的rna(或其中rna低于检测限)。例如,4周时的svr表明在停止hcv治疗后4周在患者中未检测到rna或rna低于检测限。
“sof/vel/vox固定剂量组合”或“sof/vel/voxfdc”是指含有维帕他韦、索非布韦和伏西瑞韦的组合的药物制剂。在具体的实施方案中,sof/vel/voxfdc是含有约400mg结晶索非布韦、约200mg无定形velssd(相当于100mg维帕他韦)和约200mg无定形voxssd(相当于100mg伏西瑞韦)的片剂。
2.药物组合物
本文提供药物组合物,其包含有效量的维帕他韦(或包含维帕他韦的固体分散体)、有效量的索非布韦和有效量的伏西瑞韦(或包含伏西瑞韦的固体分散体)的组合,其中维帕他韦基本上是无定形的,索非布韦基本上是结晶的,并且伏西瑞韦基本上是无定形的。
a.维帕他韦
维帕他韦是非结构5a(ns5a)蛋白的选择性抑制剂(参见例如wo2013/075029和美国专利no.8,575,135,描述维帕他韦的合成)。ns5a非结构蛋白是一种磷蛋白,没有明显的酶活性;然而,它充当细胞途径的多功能调节剂,包括宿主细胞生长、免疫和先天免疫以及病毒复制。ns5a通过其n-末端两亲性螺旋(它是复制复合物的一部分)与宿主细胞膜结合。(elazaretal.,j.virol.(2004)78:11393-11400和peninetal.,j.biol.chem.(2004)279:40835-40843.)最近的研究表明,ns5a被组织成三个结构域:n-末端结构域中的前213个氨基酸构成结构域i并含有锌结合基序,表明蛋白质是锌金属蛋白,结构域ii和iii在蛋白质的c-末端区域。(tellinghuisenetal.,j.biol.chem.(2004)279:48576-48587和tellinghuisenetal.,nature(2005)435:374-379.)ns5a以两种磷酸化形式存在:56kd的基础形式和58kd的过磷酸化形式。蛋白质通过宿主细胞激酶在特定位点磷酸化,主要在结构域ii和iii内的丝氨酸残基上磷酸化。(ideetal.,gene(1997)201:151-158;kanekoetal.,biochem.biophys.res.commun.(1994)205:320-326;katzeetal.,virology(2000)278:501-513;reedetal.,j.biol.chem.(1999)274:28011-28018;reedetal.,j.virol.(1997)71:7187-7197;和tanjietal.,j.virol.(1995)69:3980-3986.)
维帕他韦具有以下化学结构:
维帕他韦的化学名称为{(2s)-1-[(2s,5s)-2-(9-{2-[(2s,4s)-1-{(2r)-2-[(甲氧基羰基)氨基)]-2-苯基乙酰基}-4-(甲氧基甲基)吡咯烷-2-基]-1h-咪唑-5-基}-1,11-二氢异色烯并[4′,3′:6,7]萘并[1,2-d]咪唑-2-基)-5-甲基吡咯烷-1-基]-3-甲基-1-氧代丁烷-2-基}氨基甲酸甲酯。
维帕他韦可以具有多种形式中的任何一种,包括游离碱形式、结晶形式、其盐、其水合物、其溶剂化物和无定形形式。选择具有用于本文公开的药物组合物的特定形式的维帕他韦在本领域技术人员的能力范围内。维帕他韦的结晶形式i-xviii及其制备方法描述于美国专利申请公开号2015/0361085,其全部内容通过引用并入本文。维帕他韦的结晶形式i-xviii,其可以用作制备无定形形式的起始材料,具有根据其中公开的xrpd方法测量的以下特征xrpd图案2θ值(例如,通过使用cu-kα辐射的衍射仪):
(a)4.8、5.2、6.0°2θ±0.2(形式i);
(b)6.1、7.3、9.6°2θ±0.2(形式ii,双盐酸盐);
(c)7.2、7.6°2θ±0.2(形式iii,双盐酸盐);
(d)7.5、11.2、14.5°2θ(形式iv,双盐酸盐);
(e)7.1、10.6、14.1°2θ±0.2(形式v,双盐酸盐);
(f)3.8、6.7、7.6°2θ±0.2(形式vi,双盐酸盐);
(g)7.5、14.6、21.6°2θ±0.2(形式vii,磷酸盐);
(h)4.2、8.3、16.0°2θ±0.2(形式viii,磷酸盐);
(i)8.4、16.1、16.3°2θ(形式ix,磷酸盐);
(j)6.6、9.5、10.6°2θ±0.2(形式x,磷酸盐);
(k)8.9、13.1、18.1°2θ±0.2(形式xi,磷酸盐);
(1)3.8、7.5、16.9°2θ±0.2°2θ(形式xii,磷酸盐);
(m)4.1、15.9、22.9°2θ(形式xiii,磷酸盐);
(n)3.5、6.9、8.3°2θ±0.2(形式xiv,磷酸盐);
(o).8、15.9°2θ±0.2(形式xv,磷酸盐);
(p)4.1、8.1、15.6°2θ±0.2(形式xvi,l-酒石酸盐);
(q).2、15.8、22.6°2θ±0.2(形式xvii,l-酒石酸盐);和
(r)6.7、7.6、18.9°2θ±0.2(形式xviii,双氢溴酸盐)。
选择具有用于本文公开的药物组合物的特定形式的维帕他韦在本领域技术人员的能力范围内。
在一个实施方案中,药物组合物包含具有游离碱形式的维帕他韦。在另一个实施方案中,药物组合物包含具有基本上无定形形式的维帕他韦。在一个具体实施方案中,药物组合物包含具有无定形游离碱形式的维帕他韦。
维帕他韦可以治疗有效量存在于药物组合物中。在一些实施方案中,药物组合物包含约0.1w/w%至约50w/w%的维帕他韦。在某些实施方案中,药物组合物包含约0.1w/w%至约40w/w%、约0.1w/w%至约35w/w%、约0.5w/w%至约25w/w%、约0.5w/w%至约20w/w%、约0.5w/w%至约15w/w%、或约0.5w/w%至约10w/w%的维帕他韦。在其他实施方案中,药物组合物包含约0.1w/w%、约0.5w/w%、约1w/w%、约2w/w%、约4w/w%、约5w/w%、约7w/w%、约10w/w%、约12w/w%、约15w/w%、约17w/w%、约20w/w%、约为25w/w%、约30w/w%、约35w/w%、约40w/w%或约45w/w%的维帕他韦。在一个实施方案中,药物组合物包含约16.7w/w%的维帕他韦。在另一个实施方案中,药物组合物包含约15.4w/w%的维帕他韦。在另一个实施方案中,药物组合物包含约13.8w/w%的维帕他韦。
在一些实施方案中,药物组合物包含维帕他韦,其配制为分散在由药学上可接受的聚合物(称为聚合物a)形成的聚合物基质内的固体分散体。固体分散体的起始材料可包括具有上述任何形式(例如游离碱、结晶、盐、水合物、溶剂化物、无定形物等)的维帕他韦。在一个实施方案中,起始材料可包括具有基本上无定形形式的维帕他韦。
在一个实施方案中,所得固体分散体包含具有游离碱形式的维帕他韦。在另一个实施方案中,固体分散体包含具有基本上无定形形式的维帕他韦。在另一个实施方案中,固体分散体包含具有无定形游离碱形式的维帕他韦。
用于包含维帕他韦的固体分散体的聚合物a的选择是基于溶液中维帕他韦的稳定性和物理特性。聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇
在一个实施方案中,聚合物a是亲水的。亲水性聚合物的非限制性实例包括多糖、多肽、纤维素衍生物如甲基纤维素、羧甲基纤维素钠、羟乙基纤维素、乙基纤维素、乙酸琥珀酸羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、邻苯二甲酸乙酸纤维素、羟丙基纤维素、聚维酮、交聚维酮、羟丙甲纤维素、硝酸纤维素、聚环氧乙烷、聚乙烯醇和甲基丙烯酸共聚物。
在另一个实施方案中,聚合物a是非离子的。非离子聚合物在筛选溶解度实验中显示出益处。非离子聚合物的非限制性实例包括羟丙甲纤维素,交聚维酮,聚维酮,甲基纤维素,羟乙基纤维素,羟丙基纤维素,乙基纤维素,硝酸纤维素,聚环氧乙烷,聚乙烯醇,聚乙二醇和聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇
在又一个实施方案中,聚合物a是离子的。离子聚合物的非限制性实例包括乙酸琥珀酸酸羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、邻苯二甲酸乙酸纤维素和甲基丙烯酸共聚物。
在进一步的实施方案中,聚合物a选自羟丙甲纤维素、羟丙基纤维素、
在一些实施方案中,维帕他韦与聚合物a的重量比为约5∶1至约1∶5。在某些实施方案中,维帕他韦与聚合物a的重量比为约4∶1至约1∶4、约3∶1至约1∶3、或约2∶1至约1∶2。在一些实施方案中,维帕他韦与聚合物a的重量比为约5∶1、4∶1、3∶1、2∶1、1∶1、1∶5、1∶4、1∶3、1∶2、1∶3、1∶4或1∶5。在一个具体实施方案中,维帕他韦与聚合物a的重量比为约1∶1。在另一个具体实施方案中,维帕他韦与聚合物a的重量比为约1∶2。在另一个具体实施方案中,维帕他韦与聚合物a的重量比为约2∶1。
在一些实施方案中,聚合物a是交聚维酮。在一个实施方案中,维帕他韦与交聚维酮的重量比为约5∶1至约1∶5。在某些实施方案中,维帕他韦与交聚维酮的重量比为约4∶1至约1∶4、约3∶1至约1∶3、或约2∶1至约1∶2。在一些实施方案中,维帕他韦与交聚维酮的重量比为约5∶1、4∶1、3∶1、2∶1、1∶1、1∶5、1∶4、1∶3、1∶2、1∶3∶1∶4或1∶5。在一个具体的实施方案中,维帕他韦与交聚维酮的重量比为约1∶1。在另一个具体实施方案中,维帕他韦与交聚维酮的重量比为约1∶2。在另一个具体实施方案中,维帕他韦与交聚维酮的重量比为约2∶1。
包含维帕他韦的固体分散体可以治疗有效量存在于药物组合物中。在一些实施方案中,药物组合物包含约0.1w/w%至约50w/w%的包含维帕他韦的固体分散体。在某些实施方案中,药物组合物包含约0.1w/w%至约40w/w%、约0.1w/w%至约35w/w%、约0.5w/w%至约25w/w%、约0.5w/w%至约20w/w%、约0.5w/w%至约15w/w%、或约0.5w/w%至约10w/w%的包含维帕他韦的固体分散体。在进一步的实施方案中,药物组合物包含约0.1w/w%、约0.5w/w%、约1w/w%、约2w/w%、约4w/w%、约5w/w%、约7w/w%、约10w/w%、约12w/w%、约15w/w%、约17w/w%、约20w/w%、约25w/w%、30w/w%、约35w/w%、约40w/w%、或约45w/w%的包含维帕他韦的固体分散体。在一个实施方案中,药物组合物包含约16.7w/w%的包含维帕他韦的固体分散体。在另一个实施方案中,药物组合物包含约15.4w/w%的包含维帕他韦的固体分散体。在又一个实施方案中,药物组合物包含约13.8w/w%的包含维帕他韦的固体分散体。
在一个示例性实施方案中,药物组合物包含约15.4w/w%的包含维帕他韦的固体分散体,其中固体分散体包含约7.7%的维帕他韦和约7.7%的聚合物a。在一个实施方案中,药物组合物包含约15.4w/w%的包含维帕他韦的固体分散体,其中固体分散体包含约7.7%的维帕他韦和约7.7%的聚合物a,并且其中聚合物a是交聚维酮。
本领域熟知用于制备固体分散体的各种技术,包括但不限于熔融挤出、喷雾干燥、冻干和溶液蒸发。
熔融挤出方法通常包括将化合物包埋在热塑性载体中。在升高的温度和压力下加工混合物,其在分子水平上将化合物分散在基质中以形成固溶体。挤出的材料可以进一步加工成各种剂型,包括胶囊、片剂和透粘膜系统。
溶液蒸发方法通常包括将化合物溶解在合适的液体溶剂中,随后将溶液直接加入聚合物熔体中,然后蒸发直至留下透明的无溶剂薄膜。将薄膜进一步干燥至恒重。
冻干方法通常包括将化合物和载体共溶解在普通溶剂中,冷冻并升华以获得冻干的分子分散体。
喷雾干燥方法通常包括将化合物和聚合物在溶剂中混合以提供进料溶液,并喷雾干燥进料溶液以提供固体分散体。
在一些实施方案中,包含维帕他韦的固体分散体是喷雾干燥的固体分散体。相对于其他制剂方法例如湿法和干法制粒制剂,维帕他韦的喷雾干燥固体分散体提供改善的体内和体外性能和可制造性/可扩展性。
因此,在一些实施方案中,包含维帕他韦的固体分散体通过喷雾干燥方法配制,所述方法包括:a)通过在合适的溶剂中溶解分散在由聚合物a形成的聚合物基质内的维帕他韦(作为无定形游离碱)来制备进料溶液;b)喷雾干燥溶液;c)任选地对喷雾干燥的维帕他韦颗粒进行二次干燥以除去残留的溶剂。关于喷雾干燥方法的步骤a),基于维帕他韦和/或聚合物a的性质,例如溶解度、玻璃化转变温度、粘度和分子量,选择合适的溶剂在本领域技术人员的能力范围内。可接受的溶剂包括但不限于水、丙酮、乙酸甲酯、乙酸乙酯、氯化溶剂、乙醇、二氯甲烷和甲醇。在一些实施方案中,溶剂选自乙醇、二氯甲烷和甲醇。在某些实施方案中,溶剂是乙醇或甲醇。在一个实施方案中,溶剂是乙醇。
按照上述喷雾干燥方法的步骤b),当用溶剂溶解维帕他韦和聚合物a后,可以将溶液喷雾干燥。喷雾干燥是众所周知的方法,其中液体原料分散成液滴与加热的工艺气流一起进入干燥室,以帮助除去溶剂并产生粉末产物。合适的喷雾干燥参数是本领域已知的,并且选择用于喷雾干燥的合适参数在本领域技术人员的知识范围内。例如,目标进料浓度通常为约10%至约50%,目标为约20%,粘度为约1cp至约300cp、或约1cp至约80cp、或约4cp至60cp。喷雾干燥设备的入口温度通常为约50-190℃,而出口温度为约30-90℃。双流体喷嘴和/或液压喷嘴可用于喷射干燥的维帕他韦。双流体喷嘴气流可以是约1-100kg/hr,液压喷嘴流量可以是约15-300kg/hr,腔室气流可以是约25-2500kg/hr。在一些情况下,喷雾干燥的材料通常具有小于约500μm、约200μm、约150μm、约100μm、约50μm或约25μm的粒度(d90)。在其他情况下,如果需要,可以使用研磨步骤以进一步减小粒度。喷雾干燥方法和用于形成无定形分散体的其它技术的进一步描述在美国专利号6,763,607和美国专利公开号2006-0189633中,其全部内容通过引用并入本文。
在一些实施方案中,包含维帕他韦的喷雾干燥的固体分散体的粒度(d90)小于约500μm、约450μm、约400μm、约350μm、约300μm、约250μm、约200μm、约150μm、约100μm、约75μm、约50μm或约25μm。在某些实施方案中,包含维帕他韦的喷雾干燥的固体分散体的粒度(d90)为约10μm至约150μm。
通过上述喷雾干燥步骤b)和任选的二级干燥步骤c)除去溶剂(例如乙醇),在宽范围的喷雾干燥出口温度下产生高产率,在喷雾干燥室上没有材料积累,如实施例中所述。还如实施例中所述,维帕他韦在乙醇进料溶液中显示出良好的化学稳定性。
b.索非布韦
索非布韦是非结构蛋白5b(ns5b)蛋白的选择性抑制剂(参见例如wo2010/132601和美国专利7,964,580,描述索非布韦的合成)。ns5b聚合酶是从单链病毒rna合成双链rna所必需的,所述单链病毒rna在hcv的复制周期中用作模板,因此被认为是hcv复制复合物中的必需组分。(k.ishi,etal,hepatology(1999)29:1227-1235;v.lohmann,etal.,virology(1998)249:108-118.)hcvns5b聚合酶的抑制阻止了双链hcvrna的形成,因此构成了开发hcv特异性抗病毒疗法的有吸引力的途径。
索非布韦具有以下化学结构:
如前所述,索非布韦的化学名称是2-(((s)-(((2r,3r,4r,5r)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2h)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基)氨基)丙酸-(s)-异丙酯。
在一个实施方案中,药物组合物包含基本上结晶形式的索非布韦。索非布韦的结晶形式(形式1-8)及其制备方法描述于美国专利申请公开号2010/0298257、2011/0251152和2015/0175646,其各自通过引用整体并入本文。形式1-8的索非布韦具有以下特征x射线粉末衍射(xrpd)图案2θ值,其根据其中公开的xrpd方法测量(例如,通过使用cu-kα辐射的衍射仪):
(a)7.5、9.6和18.3°2θ±0.2(形式1a);
(b)5.0、7.3和18.1°2θ±0.2(形式ib);
(c)6.9、24.7和25.1°2θ±0.2(形式2);
(d)19.7、20.6和24.6°2θ±0.2(形式3);
(e)5.0、6.8和24.9°2θ±0.2(形式4);
(f)5.2、6.6和19.1°2θ±0.2(形式5);
(g)6.1、20.1和20.8°2θ±0.2(形式6);
(h)12.6、16.9和17.3°2θ±0.2(形式7);和
(i)8.6、9.2和17.1°2θ±0.2(形式8)。
如美国专利公布号2010/0298257和2011/0251152所述,形式6可以被称为形式2,例如由食品与药品管理局。
或者,形式6和7的特征在于根据其中公开的方法测量的以下特征xrpd图案2θ-值:
6.1和12.7°2θ±0.2(形式6);和
12.6和13.52θ±0.2(形式7)。
选择具有用于本文公开的药物组合物的特定形式的索非布韦在本领域技术人员的能力范围内。然而,在一些实施方案中,药物组合物包含基本上结晶的索非布韦,其具有选自约6.1,8.2、10.4、12.7、17.2、17.7、18.0、18.8、19.4、19.8、20.1、20.8、21.8和23.3°2θ±0.2(形式6)的至少三个xrpd2θ-反射。在另一个实施方案中,药物组合物包含基本上结晶的索非布韦,其具有在约6.1、20.1和20.8°2θ±0.2(形式6)的xrpd2θ-反射。在另一个实施方案中,药物组合物包含基本上结晶的索非布韦,其具有在约6.1和12.7°2θ±0.2的xrpd2θ-反射。
在一些实施方案中,药物组合物包含基本上结晶的索非布韦,其具有选自约8.2、10.5、12.6、13.5、16.9、17.0、17.3、19.5、20.2、21.0、23.4和27.3°2θ±0.2(形式7)的至少三个xrpd2θ-反射(°2θ±0.2)。在另一个实施方案中,药物组合物包含基本上结晶的索非布韦,其具有在约12.6、16.9和17.3°2θ±0.2(形式7)的xrpd2θ-反射(°2θ±0.2)。在另一个实施方案中,药物组合物包含基本上结晶的索非布韦,其具有在约12.6和13.5°2θ±0.2的xrpd2θ-反射(°2θ±0.2)。
在一些实施方案中,药物组合物包含基本上结晶的索非布韦,其具有形式6以及痕量的形式7。
如上所述,基本上结晶的索非布韦(例如,具有形式6和痕量的形式7)可以以治疗有效量包含在药物组合物中。在一些实施方案中,药物组合物包含约10w/w%至约80w/w%的索非布韦。在各种实施方案中,组合物包含约15w/w%至约65w/w%、约20w/w%至约60w/w%、约25w/w%至约55w/w%、约30w/w%至约50w/w%、或约35w/w%至约45w/w%的索非布韦。在其他实施方案中,药物组合物包含约10w/w%、约15w/w%、约20w/w%、约25w/w%、约30w/w%、约35w/w%、约40%、约45w/w%、约50w/w%、约55w/w%、约60w/w%、约65w/w%、或约70w/w%、或约75%w/w。在一个实施方案中,药物组合物包含约33.3w/w%的索非布韦。在另一个实施方案中,药物组合物包含约27.6w/w%的索非布韦。在另一个实施方案中,药物组合物包含约30.8w/w%的索非布韦。
在一些实施方案中,索非布韦的粒度可通过经由空气喷射筛分方法保留在1000μm和1400μm筛网上的质量来测量。在一个实施方案中,索非布韦的粒度为保留在1000μm筛网上的0-4%质量范围和保留在1400μm筛网上的0-3%质量范围。
c.伏西瑞韦
伏西瑞韦是泛基因型5a(ns5a)蛋白酶抑制剂(参见例如wo2014/008285和美国专利号9,296,782,描述伏西瑞韦的合成)。
伏西瑞韦具有以下化学结构:
伏西瑞韦的化学名称为(lar,5s,8s,9s,10r,22ar)-5-叔丁基-n-{(1r,2r)-2-(二氟甲基)-1-[(1-甲基环丙烷磺酰基)氨基甲酰基]环丙基}-9-乙基-18,18-二氟-14-甲氧基-3,6-二氧代-1,1a,3,4,5,6,9,10,18,19,20,21,22,22a-十四氢-8h-7,10-甲烷基环丙烷[18,19][1,10,3,6]二氧杂二氮杂环十九碳九烯并[11,12-b]喹喔啉-8-甲酰胺。
伏西瑞韦可以具有多种形式中的任何一种,包括游离酸形式、结晶形式、其盐、其水合物、其溶剂化物和无定形形式。wo2015/100144al和美国专利申请公开号2015/0175625a1中描述了各种形式的伏西瑞韦和制备所述形式的方法,这两篇文献均通过引用并入本文。可以作为无定形形式的起始材料的伏西瑞韦的结晶形式i-xxi具有以下特征xrpd图案2θ值,其根据其中公开的xrpd方法测量(例如,通过使用cu-kα辐射的衍射仪):
(a)8.6、11.1和15.5°2θ±0.2(形式i,乙醇溶剂化物);
(b)8.7、13.0和17.4°2θ±0.2(形式ii,乙酸乙酯溶剂化物)
(c)11.1、12.8和19.7°2θ±0.2(形式iii,异丙醇溶剂化物);
(d)8.7、8.9和16.0°2θ±0.2(形式iv,脱水化物);
(e)6.2、12.4和19.6°2θ±0.2(形式v,甲醇溶剂化物);
(f)14.6、15.4和20.0°2θ±0.2(形式vi,无水);
(g)6.5、8.5和18.7°2θ±0.2(形式vii,无水);
(h)7.8、8.2和20.2°2θ±0.2(形式viii,无水);
(i)6.1、9.5和19.49±0.2(形式ix,无水);
(j)8.0、19.0和20.4±0.2(形式x,半水合物);
(k)11.0、13.9和20.9±0.2(形式xi,二水合物);
(1)12.4、14.6和19.3±0.2(形式xii,四水合物);
(m)8.5、11.0和15.4±0.2(形式xiii,乙酸异丙酯溶剂化物);
(n)11.2、15.7和17.9±0.2(形式xiv,四氢呋喃溶剂化物);
(o)9.7、11.0和15.5±0.2(形式xv,2-甲基四氢呋喃溶剂化物);
(p)5.8、7.8和18.8±0.2(形式xvi,甲苯溶剂化物);
(q)7.9、18.9和20.3±0.2(形式xvii,甲苯溶剂化物);
(r)5.6、6.4和7.5±0.2(形式xviii,叔丁基醚溶剂化物);
(s)11.1、15.5和19.8±0.2(形式xix,叔丁基醚溶剂化物);
(t)11.9、14.5和19.1±0.2(形式xx,二甲基乙酰胺溶剂化物);知
(u)11.7、12.2和14.4±0.2(形式xxi,二甲基甲酰胺溶剂化物)。
选择具有用于本文公开的药物组合物的特定形式的伏西瑞韦在本领域技术人员的能力范围内。
在一个实施方案中,药物组合物包含具有无定形游离酸形式的伏西瑞韦。
伏西瑞韦可以治疗有效量存在于药物组合物中。在一些实施方案中,药物组合物包含约0.1w/w%至约50w/w%的伏西瑞韦。在某些实施方案中,药物组合物包含约0.1w/w%至约40w/w%、约0.1w/w%至约35w/w%、约0.5w/w%至约25w/w%、约0.5w/w%至约20w/w%、约0.5w/w%至约15w/w%、或约0.5%至约10w/w%的伏西瑞韦。在进一步的实施方案中,药物组合物包含约0.1w/w%、约0.5w/w%、约1w/w%、约2w/w%、约4w/w%、约5w/w%、约7w/w%、约10w/w%、约12w/w%、约15w/w%、约17w/w%、约20w/w%、约25w/w%、约30w/w%、约35w/w%、约40w/w%、或约45w/w%的伏西瑞韦。在一个实施方案中,药物组合物包含约16.7w/w%的伏西瑞韦。在另一个实施方案中,药物组合物包含约15.4w/w%的伏西瑞韦。在另一个实施方案中,药物组合物包含约13.8w/w%的伏西瑞韦。
在一些实施方案中,伏西瑞韦的有效量与药物组合物中维帕他韦的有效量相同。在其他实施方案中,伏西瑞韦的有效量不同于药物组合物中维帕他韦的有效量。
在一些实施方案中,所述药物组合物包含配制为分散在由药学上可接受的聚合物(称为聚合物b)形成的聚合物基质内的固体分散体的伏西瑞韦。固体分散体的起始材料可包括具有上述任何形式(例如游离碱、结晶、盐、水合物、溶剂化物、无定形物等)的伏西瑞韦。在一个实施方案中,起始材料可包括作为乙酸乙酯溶剂化物的伏西瑞韦(形式ii)。
在各种实施方案中,固体分散体包含具有游离酸形式的伏西瑞韦。在另一个实施方案中,药物组合物包含形式vi的伏西瑞韦。在另一个实施方案中,药物组合物包含形式viii的伏西瑞韦。在进一步的实施方案中,药物组合物包含具有基本上无定形形式的伏西瑞韦。在一些实施方案中,固体分散体包含具有无定形游离酸形式的伏西瑞韦。
用于包含伏西瑞韦的固体分散体的聚合物b的选择是基于溶液中伏西瑞韦的稳定性和物理特性。聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇
在一个实施方案中,聚合物b是亲水的。亲水性聚合物的非限制性实例包括多糖、多肽、纤维素衍生物如甲基纤维素、羧甲基纤维素钠、羟乙基纤维素、乙基纤维素、乙酸琥珀酸羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、邻苯二甲酸乙酸纤维素、羟丙基纤维素、聚维酮、交聚维酮、羟丙甲纤维素、硝酸纤维素、聚环氧乙烷、聚乙烯醇和甲基丙烯酸共聚物。
在另一个实施方案中,聚合物b是非离子的。非离子聚合物在筛选溶解度实验中显示出益处。非离子聚合物的非限制性实例包括羟丙甲纤维素、交聚维酮、聚维酮、甲基纤维素、羟乙基纤维素、羟丙基纤维素、乙基纤维素、硝酸纤维素、聚环氧乙烷、聚乙烯醇、聚乙二醇和聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇
在又一个实施方案中,聚合物b是离子的。离子聚合物的非限制性实例包括乙酸琥珀酸羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、邻苯二甲酸乙酸纤维素和甲基丙烯酸共聚物。
在另一个实施方案中,聚合物b选自羟丙甲纤维素、羟丙基纤维素、
在一些实施方案中,包含伏西瑞韦的固体分散体中的聚合物b与包含维帕他韦的固体分散体中的聚合物a相同。在其他实施方案中,包含伏西瑞韦的固体分散体中的聚合物b与包含维帕他韦的固体分散体中的聚合物a不同。
在一些实施方案中,伏西瑞韦与聚合物b的重量比为约5∶1至约1∶5。在某些实施方案中,伏西瑞韦与聚合物b的重量比为约4∶1至约1∶4、约3∶1至约1∶3、或约2∶1至约1∶2。在一些实施方案中,伏西瑞韦与聚合物b的重量比为约5∶1、4∶1、3∶1、2∶1、1∶1、1∶5、1∶4、1∶3、1∶2、1∶3、1∶4或1∶5。在一个具体实施方案中,伏西瑞韦与聚合物b的重量比为约1∶1。在另一个具体实施方案中,伏西瑞韦与聚合物b的重量比为约1∶2。在另一个具体实施方案中,伏西瑞韦与聚合物b的重量比为约2∶1。
在一些实施方案中,聚合物b是交聚维酮。在一些实施方案中,伏西瑞韦与交聚维酮的重量比为约5∶1至约1∶5。在某些实施方案中,伏西瑞韦与交聚维酮的重量比为约4∶1至约1∶4、约3∶1至约1∶3、或约2∶1至约1∶2。在一些实施方案中,伏西瑞韦与交聚维酮的重量比为约5∶1、4∶1、3∶1、2∶1、1∶1、1∶5、1∶4、1∶3、1∶2、1∶3、1∶4或1∶5。在一个具体实施方案中,伏西瑞韦与交聚维酮的重量比约为1∶1。在另一个具体实施方案中,伏西瑞韦与交聚维酮的重量比为约1∶2。在另一个具体实施方案中,伏西瑞韦与交聚维酮的重量比约为2∶1。
在一些实施方案中,伏西瑞韦与聚合物b的重量比与维帕他韦与聚合物a的重量比相同。在其他实施方案中,伏西瑞韦与聚合物b的重量比不同于维帕他韦与聚合物a的重量比。
包含伏西瑞韦的固体分散体可以治疗有效量存在于药物组合物中。在一些实施方案中,药物组合物包含约0.1w/w%至约50w/w%的包含伏西瑞韦的固体分散体。在某些实施方案中,药物组合物包含约0.1w/w%至约40w/w%、约0.1w/w%至约35w/w%、约0.5w/w%至约25w/w%、约0.5w/w%至约20%w/w、约0.5w/w%至约15w/w%、或约0.5w/w%至约10w/w%的包含伏西瑞韦的固体分散体。在进一步的实施方案中,药物组合物包含约0.1w/w%、0.5w/w%、1w/w%、2w/w%、4w/w%、5w/w%、约7w/w%、约10w/w%、约12w/w%、约15w/w%、约17w/w%、约20w/w%、约25w/w%、约30w/w%、约35w/w%、约40w/w%、或约45w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,药物组合物包含约16.7w/w%的包含伏西瑞韦的固体分散体。在另一个实施方案中,药物组合物包含约15.4w/w%的包含伏西瑞韦的固体分散体。在另一个实施方案中,药物组合物包含约13.8w/w%的包含伏西瑞韦的固体分散体。
在一个实施方案中,药物组合物包含约15.4w/w%的包含伏西瑞韦的固体分散体,其中固体分散体包含约7.7%的伏西瑞韦和约7.7%的聚合物b。在一个实施方案中,药物组合物包含约15.4w/w%的包含伏西瑞韦的固体分散体,其中固体分散体包含约7.7%的伏西瑞韦和约7.7%的聚合物b,并且其中聚合物b是交聚维酮。
在一些实施方案中,包含伏西瑞韦的固体分散体的有效量与药物组合物中包含维帕他韦的固体分散体的有效量相同。在其他实施方案中,包含伏西瑞韦的固体分散体的有效量不同于在药物组合物中包含维帕他韦的固体分散体的有效量。
在一些实施方案中,可以根据本领域已知的技术和如本文所公开的技术喷雾干燥包含伏西瑞韦的固体分散体。在一些具体实施方案中,包含伏西瑞韦的固体分散体通过喷雾干燥方法配制,所述方法包括:a)通过在合适的溶剂中溶解分散在由聚合物b形成的聚合物基质内的伏西瑞韦(作为其结晶乙酸乙酯溶剂化物)来制备进料溶液;b)喷雾干燥溶液;c)任选地对喷雾干燥的伏西瑞韦颗粒进行二次干燥以除去残留的溶剂。
关于喷雾干燥方法的步骤a),基于伏西瑞韦和/或聚合物b的性质例如溶解度、玻璃化转变温度、粘度和分子量,选择合适的溶剂在本领域技术人员的能力范围内。可接受的溶剂包括但不限于水、丙酮、乙酸甲酯、乙酸乙酯、氯化溶剂、乙醇、二氯甲烷和甲醇。在一些实施方案中,溶剂选自丙酮、乙醇、二氯甲烷和甲醇。在某些实施方案中,溶剂是丙酮或二氯甲烷。在一个实施方案中,溶剂是丙酮。
在上述喷雾干燥方法的步骤b)中,在用溶剂溶解伏西瑞韦和聚合物b后,可以将溶液喷雾干燥,例如通过雾化进料溶液成液滴的喷嘴将进料溶液泵送到干燥室中,同时引入加热的气体以除去溶剂并产生固体颗粒。
在一些实施方案中,包含伏西瑞韦的喷雾干燥的固体分散体的粒度(d90)小于约500μm、约450μm、约400μm、约350μm、约300μm、约250μm、约200μm、约150μm、约100μm、约75μm、约50μm或约25μm。在某些实施方案中,包含维帕他韦的喷雾干燥的固体分散体的粒度(d90)为约10μm至约150μm。
通过喷雾干燥步骤b)和任选的二级干燥步骤c)除去溶剂(例如乙醇),如上所述,在宽范围的喷雾干燥出口温度下产生高产率,在喷雾干燥室上没有材料积累,如实施例中所述。还如实施例中所述,伏西瑞韦在丙酮进料溶液中显示出良好的化学稳定性。
如前所述,在一些实施方案中,药物组合物包括有效量的三种活性成分中的每一种,即维帕他韦(或包含维帕他韦的固体分散体),索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)。在此类实施方案中,维帕他韦可以基本上是无定形的,索非布韦可以基本上是结晶的,并且伏西瑞韦可以基本上是无定形的。
在其他实施方案中,本公开提供了药物组合物,其包含基本上无定形的伏西瑞韦或包含伏西瑞韦的固体分散体。在一些实施方案中,伏西瑞韦具有基本上无定形的游离酸形式。在一些实施方案中,药物组合物包含约0.1w/w%至约50w/w%的伏西瑞韦作为单一活性成分。在某些实施方案中,药物组合物包含约0.1w/w%至约40w/w%、约0.1w/w%至约35w/w%、约0.5w/w%至约25w/w%、约0.5w/w%至约20w/w%、约0.5w/w%至约15w/w%、或约0.5w/w%至约10w/w%的伏西瑞韦作为单一活性成分。在一些实施方案中,药物组合物包含约10w/w%的伏西瑞韦作为单一活性成分。
在其中药物组合物包含伏西瑞韦作为单一活性成分的另一个实施方案中,伏西瑞韦可以作为分散在由药学上可接受的聚合物(例如本文公开的聚合物b)形成的聚合物基质内的固体分散体存在。在一些实施方案中,这种固体分散体可包括具有基本上无定形游离酸形式的伏西瑞韦。在一些实施方案中,固体分散体中的伏西瑞韦与聚合物b的重量比为约1∶5至约5∶1。在一些实施方案中,固体分散体中的伏西瑞韦与聚合物的重量比为约1∶1。在一些实施方案中,药物组合物包含约0.1w/w%至约50w/w%的作为单一活性成分的伏西瑞韦的固体分散体。在某些实施方案中,药物组合物包含约0.1w/w%至约40w/w%、约0.1w/w%至约35w/w%、约0.5w/w%至约25w/w%、约0.5w/w%至约20w/w%、约0.5w/w%至约15w/w%、或约0.5w/w%至约10w/w%的作为单一活性成分的伏西瑞韦的固体分散体。在一些实施方案中,药物组合物包含约20w/w%的作为单一活性成分的伏西瑞韦的固体分散体。
d.赋形剂
如上所述,本文公开的药物组合物可包含:有效量的维帕他韦(或包含维帕他韦的固体分散体);和有效量的索非布韦;和有效量的伏西瑞韦(或包含伏西瑞韦的固体分散体),其中维帕他韦基本上是无定形的,索非布韦基本上是结晶的,并且伏西瑞韦基本上是无定形的。本文公开的药物组合物可以进一步包含药物赋形剂,例如稀释剂、粘合剂、填充剂、助流剂、崩解剂、润滑剂、增溶剂以及它们的组合。此类组合物可以以药学领域熟知的方式制备(参见,例如remington’spharmaceuticalsciences,macepublishingco.,philadelphia,pa17thed.(1985);和modernpharmaceutics,marceldekker,inc.3rded.(g.s.banker&c.t.rhodes,eds.)。
在一些实施方案中,药物组合物包含选自磷酸氢钙、纤维素、可压缩糖、脱水磷酸氢钙、乳糖、乳糖一水合物、甘露醇、微晶纤维素、淀粉、磷酸钙以及它们的组合的稀释剂。
在一个实施方案中,药物组合物包含乳糖一水合物,其量为约0至约45w/w%、约5w/w%至约40w/w%、约5w/w%至约35w/w%、约5w/w%至约25w/w%、或约10w/w%至约20w/w%。在具体的实施方案中,乳糖一水合物在药物组合物中以约0w/w%、约5w/w%、约10w/w%、约15w/w%、约20w/w%、约25w/w%、约30w/w%、约35w/w%、约40w/w%、或约45w/w%存在。在一个示例性实施方案中,乳糖一水合物以约5.4w/w%存在于药物组合物中。在另一个示例性实施方案中,乳糖一水合物以约6.4w/w%存在于药物组合物中。在另一个实施方案中,乳糖一水合物以约7.9w/w%存在于药物组合物中。在另一个示例性实施方案中,乳糖一水合物以约9w/w%存在于药物组合物中。在另外的示例性实施方案中,乳糖一水合物以约12.2w/w%存在于药物组合物中。在另一个示例性实施方案中,乳糖一水合物以约12.8w/w%存在于药物组合物中。
在另一个实施方案中,药物组合物包含微晶纤维素,其量为约0至约45w/w%、约5w/w%至约40w/w%、约5w/w%至约35w/w%、约5w/w%至约25w/w%、或约10w/w%至约20w/w%。在具体的实施方案中,乳糖一水合物在药物组合物中以约0w/w%、约5w/w%、约10w/w%、约15w/w%、约20w/w%、约25w/w%、约30w/w%、约35w/w%、约40w/w%、或约45w/w%存在。在一个示例性实施方案中,微晶纤维素以约15.42w/w%存在于药物组合物中。在另一个示例性实施方案中,微晶纤维素以约16.4w/w%存在于药物组合物中。在另一个实施方案中,微晶纤维素以约17.9w/w%存在于药物组合物中。在另一个示例性实施方案中,微晶纤维素以约19w/w%存在于药物组合物中。在另外的示例性实施方案中,微晶纤维素以约22.2w/w%存在于药物组合物中。在另一个示例性实施方案中,微晶纤维素以约22.8w/w%存在于药物组合物中。
在另一个实施方案中,药物组合物包含乳糖一水合物和微晶纤维素的混合物,其量为约0至约45w/w%、约5w/w%至约40w/w%、约5w/w%至约35w/w%、约5w/w%至约25w/w%、或约10w/w%至约20w/w%。在具体的实施方案中,乳糖一水合物和微晶纤维素的混合物以约0w/w%、约5w/w%、约10w/w%、约15w/w%、约20w/w%、约25w/w%、约30w/w%、约35w/w%、约40w/w%、或约45w/w%存在于药物组合物中。在另外的实施方案中,混合物中乳糖一水合物与微晶纤维素的重量比为约2∶1至1∶2。在一个示例性实施方案中,混合物中乳糖一水合物与微晶纤维素的重量比为约1∶1。
在一些实施方案中,药物组合物包含选自交联羧甲基纤维素钠、交聚维酮、微晶纤维素、改性玉米淀粉、聚维酮、预胶化淀粉、羟基乙酸淀粉钠以及它们的组合的崩解剂。
在一个实施方案中,药物组合物包含交联羧甲基纤维素钠,其量为约1w/w%至约20w/w%、约1w/w%至约15w/w%、约1w/w%至约10w/w%、约5w/w%至约10w/w%、约1w/w%至约8w/w%、或约2w/w%至约8w/w%。在具体的实施方案中,交联羧甲基纤维素钠在药物组合物中的存在量为约1w/w%、约3w/w%、约4w/w%、约5w/w%、约6%w/w、约7w/w%、约8w/w%、约9w/w%、约10w/w%、约11w/w%、约12w/w%、约13w/w%、约14w/w%或约15w/w%。在一个示例性实施方案中,交联羧甲基纤维素钠以约2.5w/w%的量存在于药物组合物中。在另一个示例性实施方案中,交联羧甲基纤维素钠在药物组合物中的存在量为约5.5w/w%。在另一个示例性实施方案中,交联羧甲基纤维素钠在药物组合物中的存在量为约8w/w%。
在一些实施方案中,药物组合物包含选自胶体二氧化硅、滑石、淀粉、淀粉衍生物以及它们的组合的助流剂。
在一个实施方案中,药物组合物包含胶体二氧化硅,其量为约0至约5w/w%、约0.1w/w%至约4.5w/w%、约0.1w/w%至约4w/w%、约0.5w/w%至约5.0w/w%、约0.5w/w%至约3w/w%、约0.5w/w%至约2w/w%、或约0.5w/w%至约1.5w/w%。在具体的实施方案中,胶体二氧化硅的存在量为约0w/w%、约0.1w/w%、约0.5w/w%、约0.75w/w%、约1.25w/w%、约1.5w/w%、或约2w/w%。在一个示例性实施方案中,胶体二氧化硅在药物组合物中的存在量为约1w/w%。
在一些实施方案中,药物组合物包含选自硬脂酸钙、硬脂酸镁、聚乙二醇、硬脂酰富马酸钠、硬脂酸、滑石以及它们的组合的润滑剂。
在一个实施方案中,药物组合物包含硬脂酸镁,其量为约0至约3w/w%、约0.1w/w%至约2.5w/w%、约0.5w/w%至约3w/w%、约0.5w/w%至约2.5w/w%、约0.5w/w%至约2w/w%、约1w/w%至约3w/w%或约1w/w%至约2w/w%。在具体的实施方案中,硬脂酸镁在药物组合物中的存在量为约0.1w/w%、约0.5w/w%、约0.75w/w%、约1w/w%、约1.5w/w%、约2w/w%、约2.5w/w%或约3w/w%。在一个示例性实施方案中,硬脂酸镁在药物组合物中的存在量为约0.75w/w%。
在一些实施方案中,药物组合物包含:a)约20w/w%至约40w/w%的索非布韦;b)约10w/w%至约30w/w%的包含维帕他韦的固体分散体;和c)约10w/w%至约30w/w%的包含伏西瑞韦的固体分散体。在一些实施方案中,药物组合物还包含:d)约5w/w%至约25w/w%的微晶纤维素;e)约5w/w%至约15w/w%的乳糖一水合物;f)约1w/w%至约15w/w%的交联羧甲基纤维素钠;g)约0.5w/w%至约3w/w%的硬脂酸镁;和h)约0.5w/w%至约3w/w%的胶体二氧化硅。
在一个实施方案中,所述药物组合物包含:a)约30.8w/w%的索非布韦;b)约15.4w/w%的包含维帕他韦的固体分散体;和c)约15.4w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约7.7w/w%存在且聚合物a以约7.7w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约7.7w/w%存在且聚合物b以约7.7w/w%存在。在一个实施方案中,药物组合物还包含:d)约19w/w%的微晶纤维素;e)约9w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,药物组合物包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35%w存在。在一个实施方案中,药物组合物还包含:d)约16.4w/w%的微晶纤维素;e)约6.4w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,药物组合物包含:a)约33.3w/w%的索非布韦;b)约16.1w/w%的包含维帕他韦的固体分散体;和c)约16.1w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,药物组合物还包含:d)约10w/w%的微晶纤维素;e)约12.8w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,药物组合物包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,药物组合物还包含:d)约22.8w/w%的微晶纤维素;e)约8w/w%的交联羧甲基纤维素钠;和g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在进一步的实施方案中,药物组合物包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,药物组合物还包含:d)约17.9w/w%的微晶纤维素;e)约7.9w/w%的乳糖一水合物;f)约5w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另外的实施方案中,药物组合物包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1:1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1:1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,药物组合物还包含:d)约15.4w/w%的微晶纤维素;e)约5.4w/w%的乳糖一水合物;f)约10w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,药物组合物包含:a)约27.6w/w%的索非布韦;b)约13.8w/w%的包含维帕他韦的固体分散体;c)约13.8w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约6.9w/w%存在且聚合物a以约6.9w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约6.9w/w%存在且聚合物b以约6.9w/w%存在。在一个实施方案中,药物组合物还包含:d)约22.2w/w%的微晶纤维素;e)约12.2w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,药物组合物可包含:约20.0w/w%的伏西瑞韦固体分散体。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约10w/w%存在且聚合物b以约10w/w%存在。在一个实施方案中,药物组合物还包含:d)约34.75w/w%的微晶纤维素;e)约34.75w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;h)约1w/w%的胶体二氧化硅。
3.给药方式
本文公开的药物组合物可以通过各种方法以单剂量或多剂量给药,包括例如直肠、口腔、鼻内和透皮途径、动脉内注射、静脉内、腹膜内、肠胃外、肌肉内、皮下、口服、局部给药、作为吸入剂、或通过浸渍或涂覆的装置例如支架、或插入动脉的圆柱形聚合物。
一种给药方式是肠胃外给药,例如通过注射给药。其中可以掺入本文所述的药物组合物用于注射给药的形式包括例如水性或油性悬浮液、或乳液、芝麻油、玉米油、棉籽油或花生油、酏剂、甘露醇、右旋糖、或无菌水溶液以及类似的药物载体。
另一种给药方式是通过吸入。用于吸入或吹入的组合物可包括在药学上可接受的水性或有机溶剂或其混合物中的溶液和悬浮液以及粉末。液体或固体组合物可含有如本文所述的合适的药学上可接受的赋形剂。在一些实施方案中,组合物通过口服或鼻呼吸途径施用以产生局部或全身作用。在其他实施方案中,可以通过使用惰性气体雾化药学上可接受的溶剂中的组合物。雾化溶液可以直接从雾化装置吸入,或者雾化装置可以连接到面罩或间歇正压呼吸机。溶液、悬浮液或粉末组合物可以从以适当方式递送制剂的装置给药,优选口服或经鼻给药。
在一些实施方案中,本文公开的药物组合物可以口服给药。给药可以通过例如片剂、胶囊或肠溶包衣片剂给药。在制备包含至少一种本文所述化合物的固体药物组合物时,活性成分通常用赋形剂稀释和/或包封在这样的载体中,所述载体可以是胶囊、小袋、纸或其它容器的形式。当赋形剂用作稀释剂时,它可以是固体、半固体或液体材料的形式,其充当活性成分的媒介、载体或介质。因此,组合物可以是片剂、丸剂、粉末、锭剂、小袋、扁囊剂、酏剂、悬浮液、乳液、溶液、糖浆、气溶胶(作为固体或液体介质)、软膏、软和硬明胶胶囊、无菌注射溶液和无菌包装粉末的形式。
为了制备固体药物组合物如片剂,可以将主要活性成分与药物赋形剂混合以形成含有本文所述化合物的均匀混合物的固体预制剂组合物。当将这些预制剂组合物称为均匀时,活性成分可以均匀地分散在整个组合物中,使得组合物可以容易地细分成等效的单位剂型,例如片剂、丸剂和胶囊剂。
在一些实施方案中,可以配制本文公开的药物组合物和共制剂,以便在通过采用本领域已知的方法施用于个体后提供活性成分的快速、持续或延迟释放。“持续释放制剂”是旨在延长的时间内在体内缓慢释放治疗剂的制剂,而“速释制剂”是旨在一段缩短的时间内在体内快速释放治疗剂的制剂。在一些情况下,可以包衣速释制剂,使得治疗剂只有到达体内所需的靶标(例如胃)才释放。
在其中将本文公开的药物组合物配制成片剂或丸剂的一些实施方案中,可以将片剂或丸剂包衣或以其他方式混合以提供具有延长/持续作用的优点的剂型,或保护免受胃酸性条件的影响。例如,片剂或丸剂可包括延时材料,例如单独使用或与蜡一起使用的单硬脂酸甘油酯或二硬脂酸甘油酯。另外,片剂或丸剂可包含内剂量组分和外剂量组分,后者在前者上形成包膜。这两种组分可以通过肠溶层分开,所述肠溶层用于抵抗胃中的崩解并允许内部组分完整地进入十二指肠或延迟释放。多种材料可用于肠溶层或包衣,这种材料包括许多聚合酸和聚合酸与诸如虫胶、鲸蜡醇和乙酸纤维素的材料的混合物。
在其中将本文公开的药物组合物配制成片剂或丸剂的一些实施方案中,可以将片剂或丸剂包衣或以其他方式混合用于立即释放。
在其中将本文公开的药物组合物配制成片剂或丸剂的一些实施方案中,片剂或丸剂可具有配置以限制光解降解的膜包衣。可以通过常规筛选市售制剂来选择合适的膜包衣。在一个实施方案中,膜包衣包含基于聚乙烯醇的包衣。在另一个实施方案中,膜包衣包含聚乙烯醇与二氧化钛、聚乙二醇和滑石中的一种或多种的组合。在另一个实施方案中,膜包衣以约3.0w/w%存在于药物组合物中。
在一些实施方案中,本文公开的药物组合物可以配制成单层片剂。这种单层片剂通常可以包含在单一均匀层中共混的活性成分(即维帕他韦、索非布韦和伏西瑞韦)。制备单层片剂的示例性方法包括但不限于共干法制粒和双制粒。本文公开的药物组合物的共干法制粒包括将所有活性成分(即维帕他韦、索非布韦和伏西瑞韦)和赋形剂一起干法制粒。本文公开的药物组合物的双制粒是多步骤方法,包括(i)将两种活性成分(例如,索非布韦和维帕他韦或索非布韦和伏西瑞韦)和赋形剂共同干燥制粒以形成颗粒a,(ii)将第三种活性成分(例如,分别为伏西瑞韦或维帕他韦)和赋形剂干法制粒以形成颗粒b;(iii)将颗粒a和颗粒b混合/拌合在一起。
在一些实施方案中,片剂包含:有效量的维帕他韦,其中维帕他韦基本上是无定形的;有效量的索非布韦,其中索非布韦基本上是结晶的;有效量的伏西瑞韦,其中伏西瑞韦基本上是无定形的;本文公开的稀释剂、本文公开的崩解剂、本文公开的润滑剂、本文公开的助流剂或其任何组合。
在一个实施方案中,片剂包含:
颗粒内组分,其包含:有效量的维帕他韦,其中维帕他韦基本上是无定形的;有效量的索非布韦,其中索非布韦基本上是结晶的;有效量的伏西瑞韦,其中伏西瑞韦基本上是无定形的;本文公开的稀释剂、本文公开的崩解剂、本文公开的润滑剂和本文公开的助流剂;和
颗粒外组分,其包含:本文公开的稀释剂、本文公开的崩解剂和本文公开的润滑剂。
在一个实施方案中,片剂中的颗粒内和颗粒外稀释剂可以是相同的。在一个实施方案中,片剂中的颗粒内和颗粒外稀释剂可以是不同的。在一个实施方案中,片剂中的颗粒内和颗粒外崩解剂可以是相同的。在一个实施方案中,片剂中的颗粒内和颗粒外崩解剂可以是不同的。在一个实施方案中,片剂中的颗粒内和颗粒外润滑剂可以是相同的。在一个实施方案中,片剂中的颗粒内和颗粒外润滑剂可以是不同的。
在一些实施方案中,片剂包含:a)约20w/w%至约40w/w%的索非布韦;b)约10w/w%至约30w/w%的包含维帕他韦的固体分散体;和c)约10w/w%至约30w/w%的包含伏西瑞韦的固体分散体。在一些实施方案中,片剂还包含:d)约5w/w%至约25w/w%的微晶纤维素;e)约5w/w%至约15w/w%的乳糖一水合物;f)约1w/w%至约15w/w%的交联羧甲基纤维素钠;g)约0.5w/w%至约3w/w%的硬脂酸镁;和h)约0.5w/w%至约3w/w%的胶体二氧化硅。
在一个实施方案中,片剂包含:a)约30.8w/w%的索非布韦;b)约15.4w/w%的包含维帕他韦的固体分散体;c)约15.4w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约7.7w/w%存在且聚合物a以约7.7w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约7.7w/w%存在且聚合物b以约7.7w/w%存在。在一个实施方案中,片剂还包含:d)约19w/w%的微晶纤维素;e)约9w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,片剂包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,片剂还包含:d)约16.4w/w%的微晶纤维素;e)约6.4w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,片剂包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,片剂还包含:d)约10w/w%的微晶纤维素;e)约12.8w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,片剂包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,片剂还包含:d)约22.8w/w%的微晶纤维素;e)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在进一步的实施方案中,片剂包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,片剂还包含:d)约17.9w/w%的微晶纤维素;e)约7.9w/w%的乳糖一水合物;f)约5w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,片剂包含:a)约33.3w/w%的索非布韦;b)约16.7w/w%的包含维帕他韦的固体分散体;和c)约16.7w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约8.35w/w%存在且聚合物a以约8.35w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约8.35w/w%存在且聚合物b以约8.35w/w%存在。在一个实施方案中,片剂还包含:d)约15.4w/w%的微晶纤维素;e)约5.4w/w%的乳糖一水合物;f)约10w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,片剂包含:a)约27.6w/w%的索非布韦;b)约13.8w/w%的包含维帕他韦的固体分散体;和c)约13.8w/w%的包含伏西瑞韦的固体分散体。在一个实施方案中,包含维帕他韦的固体分散体包含重量比1∶1的维帕他韦与聚合物a(例如交聚维酮),使得维帕他韦以约6.9w/w%存在且聚合物a以约6.9w/w%存在。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约6.9w/w%存在且聚合物b以约6.9w/w%存在。在一个实施方案中,片剂还包含:d)约22.2w/w%的微晶纤维素;e)约12.2w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
在另一个实施方案中,片剂可包括:约20.0w/w%的伏西瑞韦的固体分散体。在一个实施方案中,包含伏西瑞韦的固体分散体包含重量比1∶1的伏西瑞韦与聚合物b(例如交聚维酮),使得伏西瑞韦以约10w/w%存在且聚合物b以约10w/w%存在。在一个实施方案中,片剂还包含:d)约34.75w/w%的微晶纤维素;e)约34.75w/w%的乳糖一水合物;f)约8w/w%的交联羧甲基纤维素钠;g)约1.5w/w%的硬脂酸镁;和h)约1w/w%的胶体二氧化硅。
4.剂量
本文公开的化合物(例如,维帕他韦或包含维帕他韦的固体分散体、索非布韦和/或伏西瑞韦或包含伏西瑞韦的固体分散体)对于任何特定个体的具体剂量水平将取决于多种因素,包括使用的特定化合物的活性、年龄、体重、总体健康状况、性别、饮食、给药时间、给药途径、排泄率、药物组合和接受治疗的个体中特定疾病的严重程度。例如,剂量可表示为每千克个体体重中本文所述化合物的mg数(mg/kg)。当调节广泛不同大小的个体之间的剂量时,例如当在儿童和成人中使用药物时或在非人类个体如犬中转换有效剂量为适合人类个体的剂量时,根据个体的体重进行标准化特别有用。最终给药方案通常由主治医师根据良好的医疗实践和上述因素确定。
本文公开的化合物的给药剂量和给药频率还可取决于药代动力学和药效学信息。关于本文公开的化合物(例如,索非布韦、维帕他韦和/或伏西瑞韦)的药代动力学和药效学信息可以通过临床前体外和体内研究收集,随后在临床试验过程中在人中证实。因此,对于本文公开的化合物,最初可以从生物化学和/或基于细胞的测定估计治疗有效剂量。然后可以在动物模型中配制剂量以达到有效治疗目标疾病或病症的所需循环浓度范围。随着人体研究的进行,将出现治疗各种疾病和病症的适当剂量水平和持续时间的进一步信息。
本文公开的化合物的给药剂量和给药频率可另外取决于毒性和疗效数据。毒性和疗效可通过细胞培养物或实验动物中的标准药物学程序确定,例如,用于测定ld50(对50%群体致死的剂量)和ed50(在50%群体中治疗有效的剂量)。毒性和治疗效果之间的剂量比是“治疗指数”,其通常表示为比率ld50/ed50。具有大治疗指数即毒性剂量显著高于有效剂量的化合物是优选的。从这种细胞培养测定和另外的动物研究中获得的数据可用于配制供人类使用的剂量范围。这些化合物的剂量优选在包括ed50的循环浓度范围内,毒性很小或没有毒性。
本文公开的任何化合物的治疗有效量可以单剂量或多剂量提供,以达到所需的治疗终点。如本文所用,“剂量”是指个体每次服用的活性成分(例如,索非布韦、维帕他韦或伏西瑞韦)的总量。如本文所用,“个体”是指人、家畜(例如犬和猫)、农场动物(例如牛、马、绵羊、山羊和猪)、实验室动物(例如小鼠、大鼠、仓鼠、豚鼠、猪、兔、犬和猴子)等。
在一些实施方案中,本文公开的化合物配制成单位剂型或药物剂型。术语“单位剂型”或“药物剂型”是指适合作为人类患者和其他哺乳动物的单位剂量的物理上离散的单元,每个单元含有预定量的活性物质(经计算可产生所需的治疗效果)与合适的药物赋形剂(例如片剂或胶囊)。化合物通常以药学有效量给药。
本文公开的任何化合物的单位剂量也可以使用上述任何合适的模式每日施用一次、两次、三次或四次或更多次。另外,用本文公开的化合物给药或治疗可持续数天;例如,对于一个治疗周期,通常治疗将持续至少7天、14天或28天。治疗周期是众所周知的,并且经常在周期之间与约1至28天,通常约7天或约14天的休息期交替。在其他实施方案中,治疗周期也可以是连续的。
在具体的实施方案中,可以向个体施用本文所述化合物的初始日剂量(例如,约1-800mg初始剂量),其中剂量随后可以增量增加直至达到临床功效。可以使用约5、10、25、50或100mg增量来增加剂量。剂量可以每天、每隔一天、每周两次或每周一次等增加。
在一些实施方案中,维帕他韦的单位剂量为约1mg至约1000mg。在某些实施方案中,维帕他韦的单位剂量为约10mg至约800mg、约10mg至约600mg、约10mg至约400mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约10mg至约75mg、约50mg至约600mg、约50mg至约400mg、约50mg至约300mg、约50mg至约250mg约50mg至约200mg、约50mg至约150mg、约50mg至约100mg、约50mg至约75mg、约75mg至约600mg、约75mg至约400mg、约75mg至约300mg、约75mg至约250mg、约75mg至约200mg、约75mg至约150mg或约75mg至约100mg。
在一些实施方案中,维帕他韦的单位剂量为约5mg、约10mg、约15mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约350mg、约400mg、约450mg、约500mg或约600mg。在一个实施方案中,维帕他韦的单位剂量为约100mg。
在一些实施方案中,如上所公开的单位剂量的维帕他韦可以每天一次、每天两次、三次或四次或更多次施用于个体。例如,在一个实施方案中,维帕他韦的单位剂量为约100mg,每天一次。
在另外的实施方案中,维帕他韦可以以片剂形式施用于个体,其中片剂包含单位剂量的维帕他韦,如上所述。例如,在一个实施方案中,片剂包含约100mg维帕他韦。在另一个实施方案中,片剂包含约100mg维帕他韦并且每天一次施用于个体。
在一些实施方案中,维帕他韦作为固体分散体存在于本文公开的药物组合物中,其中维帕他韦分散在由药学上可接受的聚合物a形成的聚合物基质内。因此,在一些实施方案中,包含维帕他韦和聚合物a的固体分散体的单位剂量为约1mg至1000mg、约10mg至约800mg、约10mg至约600mg、约10mg至约400mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约10mg至约75mg、约50mg至约600mg、约50mg至约400mg、约50mg至约300mg、约50mg至约250mg、约50mg至约200mg、约50mg至约150mg、约50mg至约100mg、约50mg至约75mg、约75mg至约600mg、约75mg至约400mg、约75mg至约300mg、约75mg至约250mg、约75mg至约200mg、约75mg至约150mg或约75mg至约100mg。
在一些实施方案中,包含维帕他韦和聚合物a的固体分散体的单位剂量为约5mg、约10mg、约15mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约350mg、约400mg、约450mg、约500mg或约600mg。在一个实施方案中,包含维帕他韦和化合物a的固体分散体的单位剂量为约200mg。在其中包含维帕他韦和聚合物a的固体分散体的单位剂量为约200mg一个实施方案中,维帕他韦与聚合物a的重量比可为约1∶1(即,固体分散体包含约100mg维帕他韦和约100mg聚合物a)。
在一些实施方案中,如上所公开的包含维帕他韦的固体分散体的单位剂量可以每天一次、每天两次、三次或四次或更多次施用于个体。例如,在一个实施方案中,包含维帕他韦的固体分散体的单位剂量为每天一次约200mg。在其中包含维帕他韦的固体分散体的单位剂量为每天一次约200mg一个实施方案中,维帕他韦与聚合物a的重量比可为约1∶1。
在另外的实施方案中,包含维帕他韦的固体分散体可以以片剂形式施用于个体,其中片剂包含单位剂量的包含维帕他韦的固体分散体,如上所述。例如,在一个实施方案中,片剂包含约200mg的维帕他韦固体分散体。在另一个实施方案中,片剂包含约200mg的包含维帕他韦的固体分散体,并且每天一次施用于个体。在片剂包含约200mg包含维帕他韦的固体分散体并且每天一次施用于个体的一个实施方案中,维帕他韦与聚合物a的重量比可为约1∶1。
在一些实施方案中,索非布韦的单位剂量为约1mg至1000mg、约10mg至约800mg、约10mg至约600mg、约10mg至约500mg、约10mg至约450mg、约10mg至约400mg、约10mg至约350mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约100mg、约10mg至约50mg、约50mg至约600mg、约50mg至约500mg、约50mg至约450mg、约50mg至约400mg、约50mg至约350mg、约50mg至约300mg、约50mg至约250mg、约50mg至约200mg、约50mg至约100mg、约100mg至约600mg、约100mg至约500mg、约100mg至约450mg、约100mg至约400mg、约100mg至约350mg、约100mg至约300mg、约100mg至约250mg、约100mg至约200mg、约200mg至约600mg、约200mg至约500mg、约200mg至约450mg、约200mg至约400mg、约200mg至约350mg、约200mg至约300mg、约200mg至约250mg、约300mg至约600mg、约300mg至约500mg、约300mg至约450mg、约300mg至约400mg或约300mg至约350mg。
在一些实施方案中,索非布韦的单位剂量为约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg或约800mg。在一个实施方案中,索非布韦的单位剂量为约400mg。
在一些实施方案中,如上所公开的,单位剂量的索非布韦可以每天一次、每天两次、三次或四次或更多次施用于个体。例如,在一个实施方案中,索非布韦的单位剂量为约400mg,每天一次。
在另外的实施方案中,可以以片剂形式向个体施用索非布韦,其中所述片剂包含单位剂量的索非布韦,如上所述。例如,在一个实施方案中,片剂包含约400mg索非布韦。在另一个实施方案中,片剂包含约400mg索非布韦并且每天一次施用于个体。
在一些实施方案中,伏西瑞韦的单位剂量为约1mg至约1000mg。在某些实施方案中,伏西瑞韦的单位剂量为约10mg至约800mg、约10mg至约600mg、约10mg至约400mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约10mg至约75mg、约50mg至约600mg、约50mg至约400mg、约50mg至约300mg、约50mg至约250mg、约50mg至约200mg、约50mg至约150mg、约50mg至约100mg、约50mg至约75mg、约75mg至约600mg、约75mg至约400mg、约75mg至约300mg、约75mg至约250mg、约75mg至约200mg、约75mg至约150mg或约75mg至约100mg。
在一些实施方案中,单位剂量的伏西瑞韦为约5mg、约10mg、约15mg、约25mg、约50mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约350mg、约400mg、约450mg、约500mg或约600mg。在一个实施方案中,伏西瑞韦的单位剂量为约100mg。
在一些实施方案中,如上所公开的,单位剂量的伏西瑞韦可以每天一次、每天两次、三次或四次或更多次施用于个体。例如,在一个实施方案中,伏西瑞韦的单位剂量是约100mg,每天一次。
在另外的实施方案中,可将伏西瑞韦以片剂形式施用于个体,其中片剂包含单位剂量的伏西瑞韦,如上所述。例如,在一个实施方案中,片剂包含约100mg伏西瑞韦。在另一个实施方案中,片剂包含约100mg伏西瑞韦并且每天一次施用于个体。
在一些实施方案中,伏西瑞韦作为固体分散体存在于本文公开的药物组合物中,其中伏西瑞韦分散在由药物聚合物b形成的聚合物基质内。因此,在一些实施方案中,包含伏西瑞韦和聚合物b的固体分散体的单位剂量约1mg至约1000mg、约10mg至约800mg、约10mg至约600mg、约10mg至约400mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约10mg至约75mg、约50mg至约600mg、约50mg至约400mg、约50mg至约300mg、约50mg至约250mg、约50mg至约200mg、约50mg至约150mg、约50mg至约100mg、约50mg至约75mg、约75mg至约600mg、约75mg至约400mg、约75mg至约300mg、约75mg至约250mg、约75mg至约200mg、约75mg至约150mg或约75mg至约100mg。
在一些实施方案中,包含伏西瑞韦和聚合物b的固体分散体的单位剂量为约5mg、约10mg、约15mg、约25mg、约50mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约350mg、约400mg、约450mg、约500mg或约600mg。在一个实施方案中,包含伏西瑞韦和化合物b的固体分散体的单位剂量为约200mg。在一个实施方案中,其中包含伏西瑞韦和聚合物b的固体分散体的单位剂量为约200mg,伏西瑞韦与聚合物b的重量比可为约1∶1(即,固体分散体包含约100mg维帕他韦和约100mg聚合物b)。
在一些实施方案中,如上所公开的,包含伏西瑞韦的固体分散体的单位剂量可以每天一次、每天两次、三次或四次或更多次施用于个体。例如,在一个实施方案中,包含伏西瑞韦的固体分散体的单位剂量为每天一次约200mg。在其中包含伏西瑞韦的固体分散体的单位剂量为每天一次约200mg一个实施方案中,伏西瑞韦与聚合物b的重量比可为约1∶1。
在另外的实施方案中,可以以片剂形式将包含伏西瑞韦的固体分散体施用于个体,其中所述片剂包含单位剂量的包含伏西瑞韦的固体分散体,如上所述。例如,在一个实施方案中,片剂包含约200mg伏西瑞韦固体分散体。在另一个实施方案中,片剂包含约200mg包含伏西瑞韦的固体分散体,并且每天一次施用于个体。在其中片剂包含约200mg包含伏西瑞韦的固体分散体并且每天一次施用于个体的一个实施方案中,所述伏西瑞韦与聚合物b的重量比可为约1∶1。
在一些实施方案中,药物组合物、药物剂型或片剂包含约300mg至约500mg索非布韦;约25mg至约175mg维帕他韦;和约25mg至约175mg伏西瑞韦。在一个实施方案中,药物组合物或者药物剂型或片剂还包含约150mg至约350mg微晶纤维素;约25mg至约175mg乳糖一水合物;约25mg至约175mg交联羧甲基纤维素钠;约1mg至约25mg胶体二氧化硅;和约1mg至约15mg硬脂酸镁。
在一个实施方案中,药物组合物、药物剂型或片剂包含约400mg索非布韦;约100mg维帕他韦;和约100mg伏西瑞韦。在一个实施方案中,药物组合物或者药物剂型或片剂还包含约246.9mg微晶纤维素;约116.6mg乳糖一水合物;约104mg交联羧甲基纤维素钠;约13mg胶体二氧化硅;和约9.75mg硬脂酸镁。在一个实施方案中,药物组合物或者药物剂型或片剂还包含约39mg膜包衣,例如基于聚乙烯醇的膜包衣。
在另一个实施方案中,药物组合物、药物剂型或片剂包含约400mg索非布韦;约200mg包含分散在由药学上可接受的聚合物a形成的聚合物基质中的维帕他韦的固体分散体;和约200mg分散在由药学上可接受的聚合物b形成的聚合物基质中的伏西瑞韦固体分散体。在一个实施方案中,维帕他韦与聚合物a的重量比为约1∶1,使得其固体分散体包含约100mg伏西瑞韦和约100mg聚合物a。在一个实施方案中,伏西瑞韦与聚合物b的重量比为约1∶1,使得其固体分散体包含约100mg伏西瑞韦和约100mg聚合物b。在一个实施方案中,聚合物a和/或聚合物b是交聚维酮。在一个实施方案中,药物组合物、药物剂型或片剂还包含约246.9mg微晶纤维素;约116.6mg乳糖一水合物;约104mg交联羧甲基纤维素钠;约13mg胶体二氧化硅;和约9.75mg硬脂酸镁。在一个实施方案中,药物组合物或者药物剂型或片剂还包含约39mg膜包衣,例如基于聚乙烯醇的膜包衣。
在一些实施方案中,组合使用的维帕他韦、索非布韦和伏西瑞韦的量或剂量不超过每种药剂单独使用的水平,例如作为单一疗法。在某些实施方案中,组合使用的维帕他韦、索非布韦和伏西瑞韦的量或剂量比每种药剂单独使用(例如作为单一疗法)的量或剂量低(例如低至少20%、至少30%、至少40%或至少50%)。在其他实施方案中,导致丙型肝炎治疗的组合使用的维帕他韦、索非布韦和伏西瑞韦的量或剂量比每种药剂单独使用(例如作为单一疗法)的量或剂量低(例如低至少20%、至少30%、至少40%或至少50%)。
4.治疗方法和用途
本文描述的治疗方法可以体内或离体应用于细胞群。“体内”是指在活体内,如动物或人体内。在本文中,本文所述的治疗方法可以治疗性地用于个体。“离体”意味着活的个体之外。离体细胞群的实例包括体外细胞培养物和生物样品,包括从个体获得的流体或组织样品。这些样品可以通过本领域熟知的方法获得。示例性生物流体样品包括血液、脑脊髓液、尿液和唾液。在本文中,本文所述的化合物和组合物可用于多种目的,包括治疗和实验目的。例如,本文所述的化合物和组合物可以离体使用以确定用于给定适应症、细胞类型、个体和其他参数的本公开化合物的最佳给药方案和/或给药剂量。从这种用途中收集的信息可用于实验目的或临床中以设定体内治疗方案。本文所述的化合物和组合物可适用的其他离体用途描述如下或对本领域技术人员而言是显而易见的。可以进一步表征所选化合物以检查人或非人个体的安全性或耐受性剂量。可以使用本领域技术人员公知的方法检查这些性质。
在一个实施方案中,本公开提供了治疗有需要的人的丙型肝炎病毒(hcv)的方法,包括给予人:有效量的维帕他韦(或包含维帕他韦的固体分散体);有效量的索非布韦;和有效量的伏西瑞韦(或包含伏西瑞韦的固体分散体),其中维帕他韦基本上是无定形的,索非布韦基本上是结晶的,并且伏西瑞韦基本上是无定形的。
在一些实施方案中,本文公开的方法包括通过口服给予人日剂量的维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)。
在一些实施方案中,将维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)共同配制并以组合制剂同时施用或递送至人类患者以治疗丙型肝炎。
在其他实施方案中,将维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)交替或同时在分开的制剂中施用或递送至人类患者以治疗丙型肝炎。在一些实施方案中,例如,分别使用维帕他韦(或包含维帕他韦的固体分散体)的组合物、索非布韦的组合物和伏西瑞韦(或包含伏西瑞韦的固体分散体)的组合物。
在一些实施方案中,所述方法包括施用维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的组合,提供协同作用。术语“协同作用”和“协同效应”包括与其各自的效果相比高于两种或更多种药剂的加合效应。在某些实施方案中,协同作用或协同效应是指组合使用两种或更多种药剂的有利效果,例如在药物组合物中或在治疗方法中。当活性成分是(1)在组合制剂中共同配制和同时施用或递送时;(2)作为单独的制剂交替或平行递送时;或(3)通过一些其他方案时,可以获得协同效应。在交替疗法中递送时,当化合物依次施用或递送时,例如在单独的片剂、丸剂或胶囊中,或通过在单独的注射器中的不同注射,可以获得协同效应。通常,在交替治疗期间,每种活性成分的有效剂量依次施用即连续施用,而在联合治疗中,两种或多种活性成分的有效剂量一起施用。如本文所用,维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的组合的协同抗hcv效应大于预测的该组合的单个化合物的纯加合效应。
在一个实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂可有效治疗一种或多种基因1型hcv感染患者、基因2型hcv感染患者、基因3型hcv感染患者、基因4型hcv感染患者、基因5型hcv感染患者和/或基因6型hcv感染患者。
在一个实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂在治疗基因1型(包括基因型1a和/或基因型1b)hcv感染患者中是有效的。
在另一个实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂在治疗基因2型(包括基因型2a、基因型2b、基因型2c和/或基因型2d)hcv感染患者中是有效的。
在另一个实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂在治疗基因3型(包括基因型3a、基因型3b、基因型3c、基因型3d、基因型3e和/或基因型3f)hcv感染患者中是有效的。
在另一个实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂在治疗基因4型(包括基因型4a、基因型4b、基因型4c、基因型4d、基因型4e、基因型4f、基因型4g、基因型4h、基因型4i和/或基因型4j)hcv感染患者中是有效的。
在另一个实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂在治疗基因5型(包括基因型5a)hcv感染患者中是有效的。
在另外的实施方案中,如本文所公开的,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂在治疗基因6型(包括基因型6a)hcv感染患者中是有效的。
在另一个实施方案中,如本文所述,包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型和片剂是全基因型的(pangenotypic),意味着它们可用于所有基因型和其抗药性突变体。
在一些实施方案中,将如本文所述的包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型或片剂施用于个体以治疗hcv约24周或更短、约22周或更短、约20周或更短、约18周或更短、约16周或更短、约12周或更短、约10周或更短、约8周或更短、约6周或更短或约4周或更短。如前所述,本文公开的药物组合物、药物剂型或片剂可以每天一次、每天两次、每隔一天一次、每周两次、每周三次或每周四次或更多次施用。
在一些实施方案中,如本文所述,施用包含维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)的药物组合物、药物剂型或片剂可以在约24周、约20周、约16周、约12周、约10周、约8周、约6周、或约4周、或约4个月、或约5个月、或约6个月、或约1年、或约2年产生持续的病毒学应答。
在一些实施方案中,本文提供了用于治疗人类hcv并发症(comorbidity)的方法,其中所述治疗在治疗并发症方面也是有效的。hcv的“并发症”是与hcv同时发生的疾病。
在一些实施方案中,本文提供了用于治疗人类hcv的方法,其中人也患有肝硬化。然而,本文提供了用于治疗人类hcv的方法,其中人类也不患有肝硬化。
5.联合治疗
在一些实施方案中,本文公开的药物组合物和治疗方法可以进一步与一种或多种另外的治疗剂使用或组合用于治疗hcv和其他病症如hiv感染。当与维帕他韦(或包含维帕他韦的固体分散体)、索非布韦和伏西瑞韦(或包含伏西瑞韦的固体分散体)使用或组合时,另外的治疗剂可以是具有治疗效果的任何药剂。
合适的其他治疗剂的非限制性实例包括干扰素、利巴韦林或其类似物、hcvns3蛋白酶抑制剂、α-葡糖苷酶1抑制剂、肝保护剂、hcvns5b聚合酶的核苷或核苷酸抑制剂、hcvns5b聚合酶的非核苷抑制剂、hcvns5a抑制剂、tlr-7激动剂、亲环蛋白抑制剂、hcvires抑制剂、药代动力学增强剂和用于治疗hcv的其他药物或治疗剂。
更具体地,另外的治疗剂可以选自:
1)干扰素,例如聚乙二醇化的rifn-α2b(peg-内含子)、聚乙二醇化的rifn-α2a(pegasys)、rifn-α2b(内含子a)、rifn-α2a(roferon-a)、干扰素α(mor-22、opc-18、alfaferone、alfanative、multiferon、subalin)、干扰素alfacon-1(infergen)、干扰素α-nl(wellferon)、干扰素α-n3(alferon)、干扰素-β(avonex、dl-8234)、干扰素-ω(ωduros、biomed510)、albinterferonα-2b(albuferon)、ifnαxl、blx-883(locteron)、da-3021、糖基化干扰素α-2b(avi-005)、peg-infergen、peg化干扰素λ(聚乙二醇化il-29)或belerofon、ifnα-2bxl、rifn-α2a、共有ifnα、推断因子(infergen)、利比(rebif)、聚乙二醇化ifn-β、口服干扰素α、feron、reaferon、intermaxα、r-ifn-β、和infergen+actimmuneribavirin和利巴韦林类似物、例如rebetol、copegus、vx-497和韦拉米啶(taribavirin);
2)利巴韦林及其类似物,例如利巴韦林(rebetol,copegus)和taribavirin(韦拉米啶);
3)hcvns3蛋白酶抑制剂,例如波普瑞韦(sch-503034、sch-7)、tmc435350、bi-1335、bi-1230、vby-376、gs-9256、gs-9451、as-101、yh-5258、yh5530、mk6325和mk2748;化合物x-8、化合物x-9、化合物x-10、abt-450、化合物x11(下文描述)、西咪普韦(tmc-435)、波普瑞韦(sch-503034)、narlaprevir(sch-900518)、vaniprevir(mk-7009)、mk-5172、丹诺普韦(itmn-191)、sovaprevir(ach-1625)、neceprevir(ach-2684)、特拉匹韦(vx-950)、vx-813、vx-500、faldaprevir(bi-201335)、阿那匹韦(bms-650032)、bms-605339、vby-376、phx-1766、yh5531、biln-2065和biln-2061;
4)α-葡糖苷酶1抑制剂,例如西戈斯韦(mx-3253)、米格列醇和ut-231b;
5)肝保护剂,例如emericasan(idn-6556)、me-3738、gs-9450(lb-84451)、silibilin和mitoq;
6)hcvns5b聚合酶抑制剂,例如valopicitabine(nm-283)和inx-189(现为bms986094);vch-916、vch-222、gl60667、biln-1941、psi-7792和gs-9190;化合物x-4(下文描述)、化合物x-5(下文描述)、abt-333、化合物x-6(下文描述)、abt-072、化合物x-7(下文描述)、tegobuvir(gs-9190)、gs-9669、tmc647055、setrobuvir(ana-598)、非利布韦(pf-868554)、vx-222、idx-375、idx-184、idx-102、bi-207127、valopicitabine(nm-283)、psi-6130(r1656)、psi-7851、bcx-4678、nesbuvir(hcv-796)、bilb1941、mk-0608、nm-107、r7128、vch-759、gsk625433、xtl-2125、vch-916、jtk-652、mk-3281、vby-708、a-848837、gl59728、a-63890、a-48773、a-48547、bc-2329、bms-791325和bilb-1941;
8)hcvns5a抑制剂,例如azd-2836(a-831)、ach-3102、ach-2928、mk8325、mk-4882、psi-461、idx719、abt-267:化合物x-1(下文描述)、化合物x-2(下文描述)、化合物x-3(下文描述)、jnj-47910382、达卡他韦(bms-790052)、mk-8742、edp-239、idx-719、ppi-668、gsk-2336805、ach-3102、a-831、a-689、azd-2836(a-831)、azd-7295(a-689)和bms-790052;
9)tlr-7激动剂,例如咪喹莫特、852a、gs-9524、ana-773、ana-975、azd-8848(dsp-3025)和sm-360320;
10)亲环蛋白抑制剂,例如debio-025、scy-635和nfm811;
11)hcvires抑制剂,例如mci-067;
12)药代动力学增强剂,例如bas-100、spi-452、pf-4194477、tmc-41629、gs-9350、gs-9585和罗红霉素;和
13)治疗hcv的其他药物,如胸腺素α1(zadaxin)、硝唑尼特(alinea、ntz)、bivn-401(virostat)、pyn-17(altirex)、kpe02003002、actilon(cpg-10101)、gs-9525、krn-7000、civacir、gi-5005、xtl-6865、bit225、ptx-111、itx2865、tt-033i、ana971、nov-205、tarvacin、ehc-18、vgx-410c、emz-702、avi4065、bms-650032、bms-791325、巴维昔单抗、mdx-1106(ono-4538)、oglufanide和vx-497(merimepodib);苯并咪唑衍生物、苯并-1,2,4-噻二嗪衍生物和苯丙氨酸衍生物。
在某些实施方案中,另外的治疗剂选自hcvns5b聚合酶的非核苷抑制剂(abt-072和abt-333),hcvns5a抑制剂(abt-267、ach-3102和ach-2928)和hcvns3蛋白酶抑制剂(abt-450和ach-1625)。
在一个实施方案中,另外的治疗剂是hcvns3蛋白酶抑制剂,其非限制性实例包括:
在另一个实施方案中,另外的治疗剂是亲环蛋白抑制剂,例如wo2013/185093中公开的亲环蛋白抑制剂。亲环蛋白抑制剂的非限制性实例包括:
和立体异构体及其立体异构体的混合物。
在另一个实施方案中,另外的治疗剂是hcvns5b聚合酶的非核苷抑制剂,其非限制性实例包括gs-9669。
化合物x-1是hcvns5a蛋白的抑制剂,由以下化学结构表示:
(参见,例如美国专利申请公开号2010/0310512a1)。
化合物x-2是ns5a抑制剂,由以下化学结构表示:
化合物x-3是ns5a抑制剂,由以下化学结构表示:
(参见,例如美国专利申请公开号2013/0102525及其中的参考文献)。
化合物x-4是ns5bthumbii聚合酶抑制剂,由以下化学结构表示:
化合物x-5是设计为通过hcvns5b聚合酶抑制病毒rna复制的核苷酸抑制剂前药,并且由以下化学结构表示:
化合物x-6是hcv聚合酶抑制剂,由以下结构表示:
(参见,例如美国专利申请公开第2013/0102525号及其中的参考文献)。
化合物x-7是hcv聚合酶抑制剂,由以下结构表示:
(参见,例如美国专利申请公开第2013/0102525号及其中的参考文献)。
化合物x-8是hcv蛋白酶抑制剂,由以下化学结构表示:
(参见,例如美国专利申请公开第2014/0017198号及其中的参考文献)。
化合物x-9是hcv蛋白酶抑制剂,由以下化学结构表示:
(参见,例如美国专利号8,178,491和其中的参考文献)。
化合物x-10是hcv蛋白酶抑制剂,由以下化学结构表示:
化合物x-11是hcv蛋白酶抑制剂,由以下化学结构表示:
(参见,例如美国专利申请公开第2013/0102525号及其中的参考文献)。
在另一个实施方案中,本申请提供了治疗有需要的人类患者的丙型肝炎的方法,包括给予患者治疗有效量的如本文所述的药物组合物和选自下组的另外的治疗剂:聚乙二醇化rifn-α2b、聚乙二醇化rifn-α2a、rifn-α2b、ifnα-2bxl、rifn-α2a、共有ifnα、推断因子、利比、locteron、avi-005、peg-infergen、聚乙二醇化ifn-β、口服干扰素α、feron、reaferon、intermaxα、r-ifn-β、infergen+actimmune、ifn-ω与duros、albuferon、rebetol、copegus、levovirin、vx-497、韦拉米啶(taribavirin)、a-831、a-689、nm-283、valopicitabine、r1626、psi-6130(r1656)、hcv-796、bilb1941、mk-0608、nm-107、r7128、vch-759、pf-868554、gsk625433、xtl-2125、sch-503034(sch-7)、vx-950(特拉匹韦)、itmn-191和biln-2065、mx-3253(西戈斯韦)、ut-231b、idn-6556、me3738、mitoq和lb-84451、苯并咪唑衍生物、苯并-1,2,4-噻二嗪衍生物和苯丙氨酸衍生物、日达仙、硝唑尼特(alinea)、bivn-401(virostat)、debio-025、vgx-410c、emz-702、avi4065、巴维昔单抗、oglufanide、pyn-17、kpe02003002、actilon(cpg-10101)、krn-7000、civacir、gi-5005、ana-975(艾沙托立宾)、xtl-6865、ana971、nov-205、tarvacin、ehc-18和nim811以及药学上可接受的载体或赋形剂。
在另一个实施方案中,本申请提供了一种组合物,其包含:
a)第一药物组合物,其包含有效量的维帕他韦(或包含维帕他韦的固体分散体),其中维帕他韦基本上是无定形的;有效量的索非布韦,其中索非布韦基本上是结晶的;和有效量的伏西瑞韦(包含伏西瑞韦的固体分散体),其中伏西瑞韦基本上是无定形的,如本文所述;知
b)第二药物组合物,其包含至少一种选自下组的其它治疗剂:hiv蛋白酶抑制化合物、逆转录酶的hiv非核苷抑制剂、逆转录酶的hiv核苷抑制剂、逆转录酶的hiv核苷酸抑制剂、hiv整合酶抑制剂、gp41抑抑剂、cxcr4抑制剂、gp120抑制剂、ccr5抑抑剂、干扰素、利巴韦林类似物、ns3蛋白酶抑制剂、α-葡糖苷酶1抑制剂、肝保护剂、hcv非核苷抑制剂和治疗hcv的其它药物以及它们的组合。
另外的治疗剂可以是治疗其他病症如hiv感染的治疗剂。因此,另外的治疗剂可包括例如hiv蛋白酶抑制化合物、hiv逆转录酶的非核苷抑制剂、逆转录酶的hiv核苷抑制剂、逆转录酶的hiv核苷酸抑制剂、hiv整合酶抑制剂、gp41抑制剂、cxcr4抑制剂、gp120抑制剂、ccr5抑制剂、干扰素、利巴韦林类似物、ns3蛋白酶抑制剂、ns5b聚合酶抑制剂、α-葡糖苷酶1抑制剂、肝保护剂、hcv的非核苷抑制剂和用于治疗hcv的其他药物。
更具体地,另外的治疗剂可以选自:
1)hiv蛋白酶抑制剂,例如安普那韦、阿扎那韦、福沙那韦、茚地那韦、洛匹那韦、利托那韦、洛匹那韦+利托那韦、奈非那韦、沙奎那韦、替拉那韦、brecanavir、地瑞那韦、tmc-126、tmc-114、莫折那韦(dmp-450)、je-2147(ag1776)、ag1859、dg35、l-756423、ro0334649、kni-272、dpc-681、dpc-684和gw640385x、dg17、ppl-100;
2)逆转录酶的hiv非核苷抑制剂,例如capravirine、乙米韦林、delaviridine、依法韦伦、奈韦拉平、(+)胡酮素a、依曲韦林、gw5634、dpc-083、dpc-961、dpc-963、miv-150和tmc-120、tmc-278(利匹韦林)、依法韦伦、bilr355bs、vrx840773、uk-453,061、rdea806;
3)逆转录酶的hiv核苷抑制剂,例如齐多夫定、恩曲他滨、去羟肌苷、司他夫定、扎西他滨、拉米夫定、阿巴卡韦、安多匹韦、依鲁西汀、阿洛夫定、miv-210、拉西维(±-ftc)、d-d4fc、恩曲他滨、叠氮膦、福齐夫定替酯、福齐夫定替酯、apricitibine(avx754)、氨多索韦、kp-1461、阿巴卡韦+拉米夫定、阿巴卡韦+拉米夫定+齐多夫定、齐多夫定+拉米夫定;
4)逆转录酶的hiv芯苷酸抑制剂,例如替诺福韦、替诺福韦地索普西富马酸盐+恩曲他滨、替诺福韦地索普西富马酸盐+恩曲他滨+依法韦仑、阿德福韦;
5)hiv整合酶抑制剂,例如姜黄素、姜黄素衍生物、莴苣酸、莴苣酸衍生物、3,5-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸衍生物、金黄三羧酸、金黄三羧酸衍生物、咖啡酸苯乙酯、咖啡酸苯乙酯衍生物、酪氨酸磷酸化抑制剂、酪氨酸磷酸化抑制剂衍生物、槲皮素、槲皮素衍生物、s-1360、zintevir(ar-177)、l-870812和l-870810、mk-0518(雷特格韦)、bms-707035、mk-2048、ba-011、bms-538158、gsk364735c;
6)gp41抑制剂,例如恩夫韦肽、西夫韦肽、fb006m、tri-1144、spc3、des6、基因座gp41、covx和rep9;
7)cxcr4抑制剂,例如amd-070;
8)进入抑制剂,例如sp01a、tnx-355;
9)gp120抑制剂,例如bms-488043和blockaide/cr;
10)g6pd和nadh-氧化酶抑制剂,例如免疫素;
11)ccr5抑制剂,例如aplaviroc、vicriviroc、incb9471、pro-140、incb15050、pf-232798、ccr5mab004和马拉韦罗;
12)干扰素,例如聚乙二醇化的rifn-α2b、聚乙二醇化的rifn-α2a、rifn-α2b、ifnα-2bxl、rifn-α2a、共有ifnα、infergen、利比、locteron、avi-005、peg-推断因子、聚乙二醇化ifn-β、口服干扰素α、feron、reaferon、intermaxα、r-ifn-β、infergen+actimmune、ifn-ω与duros和albuferon;
13)利巴韦林类似物,例如rebetol、copegus、levovirin、vx-497和韦拉米啶(taribavirin);
14)ns5a抑制剂,例如a-831、a-689和bms-790052;
15)ns5b聚合酶抑制剂,例如nm-283、valopicitabine、r1626、psi-6130(r1656)、hcv-796、bilb1941、mk-0608、nm-107、r7128、vch-759、pf-868554、gsk625433和xtl-2125;
16)ns3蛋白酶抑制剂,例如sch-503034(sch-7)、vx-950(特拉匹韦)、itmn-191和biln-2065,
17)α-葡萄糖苷酶1抑制剂,例如mx-3253(西戈斯韦)和ut-231b;
18)肝保护剂,例如idn-6556、me3738、mitoq和lb-84451;
19)hcv的非核苷抑制剂,例如苯并咪唑衍生物、苯并-1,2,4-噻二嗪衍生物和苯丙氨酸衍生物;
20)治疗丙型肝炎的其他药物,如日达仙、硝唑尼特(alinea)、bivn-401(virostat)、debio-025、vgx-410c、emz-702、avi4065、巴维昔单抗、oglufanide、pyn-17、kpe02003002、actilon(cpg-10101)、krn-7000、civacir、gi-5005、ana-975(isatonbine)、xtl-6865、ana971、nov-205、tarvacin、ehc-18和nim811;
21)药代动力学增强剂,例如bas-100和spi452;
20)rna酶h抑制剂,例如odn-93和odn-112;和
22)其他抗hiv药物,例如vgv-1、pa-457(bevirimat)、安普利近、hrg214、cytolin、polymun、vgx-410、kd247、amz0026、cyt99007、a-221hiv、bay50-4798、mdx010(iplimumab)、pbs119、alg889和pa-1050040。
预期另外的治疗剂将以本领域已知的方式施用,剂量和给药频率可由本领域技术人员选择。例如,可以每天一次,每天两次,每天三次,或每天多次或四次以约0.01mg至约2克的剂量施用(例如,以片剂形式)另外的药剂。
实施例
在以下实施例和整个本公开中,本文使用的缩写各自具有如下的含义:
实施例1:片剂制备和制剂
a.片剂的剂量选择
i.索非布韦
索非布韦表现出多种形式,包括其结晶形式和溶剂化物(参见,例如美国专利申请公开号:2010/0298257、2011/0251152和2015/0175646)。在一些实施方案和本文提供的实施例中,片剂制剂包括具有形式6和任选的痕量的形式7的索非布韦。索非布韦的结晶形式6和7是非吸湿性的,并且在37℃下具有≥2mg/ml的类似水溶解度。索非布韦的形式6是热力学稳定的形式,并且当在水中悬浮时保持物理稳定。索非布韦的形式7尽管在水中短时间内物理稳定,但在长时间搅拌下可以转化为形式6。另外,形式6和7不是光敏性的,当在敞口容器中在40℃/75%rh下储存1个月时保持物理和化学稳定。
为片剂制剂选择的索非布韦剂量为400mg每天一次。对400mg索非布韦剂量的支持源自用早期病毒学和人类暴露数据的emaxpk/pd建模,该数据也支持从其他测试剂量中选择400mg索非布韦剂量。
400mg索非布韦剂量的平均索非布韦主要代谢产物auctau与通过该模型确定的可达到的由基线的约77%的最大hcvrna变化相关,该值在暴露-响应s形曲线的平台的尖端上。在s形emax模型中,在20%至80%的最大效应范围内存在相对线性的暴露-响应关系。因此,考虑到使用200mg片剂的索非布韦暴露与高达1200mg的单剂量成剂量-比例,预计低于400mg剂量将导致hcvrna从基线变化幅度的显著降低。类似地,为了改善暴露-响应曲线的平台中77%的功效预测,需要显著增加暴露(并因此剂量)以显著增加抗病毒效果。
当与另外的hcv治疗剂一起给予24周时,与每天一次200mg剂量相比,每天一次400mg索非布韦剂量与基因1型hcv感染患者中的svr率较高相关。两种剂量水平的安全性和耐受性似乎相似。此外,当每天一次400mg索非布韦加上其他hcv治疗剂被给予至基因2型或3型hcv感染患者时,观察到100%svr24。
ii.维帕他韦
维帕他韦表现出多种形式,包括游离碱、结晶形式、无定形形式、其盐、其溶剂化物和其水合物。在某些实施方案中以及在本文提供的实施例中,片剂包含基本上无定形游离碱形式的维帕他韦。
在单一和多个口服剂量的维帕他韦后,最大血浆浓度出现在1.50至3.25小时之间(中位数tmax)。维帕他韦在5-450mg剂量范围内表现出非线性pk。如通过auc和cmax所评估的,暴露的增加大于来自5-50mg的剂量比例,并且小于来自50-450mg剂量比例。与维帕他韦的半衰期一致,随时间观察到适度的累积。在大于5mg的多个每天一次剂量的维帕他韦后,服用后24小时的维帕他韦平均血浆浓度高于针对基因1型至6型hcv复制子抑制病毒复制50%(ec50)的蛋白质调节浓度的化合物(表1)。
表1
注意:除tmax、tlast和t1/2外,所有pk参数均报告为平均值(%cv),tmax、tlast和t1/2报告为中位数(q1,q3)。
a按组给予vel:第1组=50mg,第2组=150mg,第3组=5mg,第4组=450mg,第5组和第6组(在禁食状态下合并)=100mg。
bvel150mg组(除了一名患者)的平均值(%cv)cl/f为31,403.8(40.5)ml/h。
iii.伏西瑞韦
伏西瑞韦表现出各种形式,如例如wo2015/100144和美国专利申请公开号2015/0175625a1描述。使用伏西瑞韦的结晶形式vi进行初步研究。如前所述,伏西瑞韦的形式vi的特征在于x射线粉末衍射图,其包括以下峰(±0.2°):14.6、15.4和20.0°2θ,如在使用cu-kα辐射的衍射仪上测定的。在单一和多个口服剂量的伏西瑞韦形式vi后,最大血浆浓度出现在2.0至5.0小时之间(中位数tmax)。伏西瑞韦vi型在30-300mg剂量范围内表现出基本上线性的pk。伏西瑞韦vi型在单次服用30、100和300mg剂量后的中值半衰期(t1/2)分别为9.37小时、36.67小时和35.49小时。在多次服用30、100和300mg剂量后,伏西瑞韦形式vi的中值半衰期(t1/2)分别为40.95、30.49和27.61小时。伏西瑞韦形式vi在健康个体中在30-300mg范围内单次和多次给药后表现出剂量-线性药代动力学。在100-300mg剂量之间观察到ctau适度小于剂量比例的增加。在所有剂量水平的每天一次给药7天后,实现了伏西瑞韦形式vi的稳态浓度(表2)。
表2
单一剂量
多剂量
注意:除tmax、tlast和t1/2外,所有pk参数均报告为平均值(%cv),tmax、tlast和t1/2报告为中位数。
发现伏西瑞韦的结晶形式vi是物理亚稳态的,并且转化为结晶形式viii,其表现出水溶性和口服生物利用度(在犬模型中),其比结晶形式vi的水溶性和口服生物利用度低约50%。如前所述,伏西瑞韦的形式viii的特征在于x射线粉末衍射图,其包括以下峰(±0.2°):7.8、8.2和20.2°2θ,如使用cu-kα辐射在衍射仪上测定的。
因此,选择以无定形游离酸形式的伏西瑞韦的喷雾干燥分散体掺入片剂制剂中。如表3所示,健康个体的相对生物利用度研究证实,与相,给予包含100mg无定形游离酸形式的伏西瑞韦的片剂达到比包含伏西瑞韦形式vi的片剂(2x50mg片剂)高约9%的暴露(auc)和43%的cmax。
表3
单一剂量
b.包含维帕他韦的固体分散体
在一些实施方案中以及在本文提供的实施例中,片剂制剂包括维帕他韦的喷雾干燥的固体分散体(ssd)。选择具有无定形游离碱形式的维帕他韦作为形成基本上无定形的维帕他韦ssd的起始材料。
通过将维帕他韦和交聚维酮溶解在进料溶剂中来制备喷雾干燥的进料溶液。在某些情况下,可以使用强力混合或均质化来避免组合物结块。
最初在溶解度、稳定性和粘度方面评估进料溶液的合适溶剂。乙醇、甲醇、丙酮和二氯甲烷均表现出优异的溶解性。评估基于乙醇和甲醇的原料的制备容易性并在一定范围的入口和出口温度下喷雾干燥以评估喷雾干燥方法的稳健性。虽然两种溶剂均使维帕他韦和交聚维酮快速溶解,但选择乙醇用于实施例中所述的研究。
使用均质化制备10%维帕他韦和10%交聚维酮的乙醇溶液。维帕他韦和交聚维酮的乙醇溶液的粘度低。总之,维帕他韦和交聚维酮以1∶1的重量比组合证明在乙醇进料溶液中具有良好的化学稳定性。除非另有说明,术语velssd或维帕他韦ssd是指通过喷雾干燥制备的无定形固体分散体,其包含1∶1比例的维帕他韦和交聚维酮。
喷雾干燥溶液以除去乙醇导致在各种喷雾干燥出口温度下的高产率,在喷雾干燥室上没有材料积累。使用市售的喷雾干燥器(例如anhydro、buchi或niro喷雾干燥器)进行喷雾干燥。
在60℃的托盘烘箱中二次干燥过程中快速除去包括乙醇溶剂的有机挥发性杂质,用室内空气或双锥干燥器吹扫。干燥失重可归因于水,这可通过karlfischer滴定法确认。通过干燥6小时,残留乙醇降低至低于ich指导的0.5w/w%。
c.包含伏西瑞韦的固体分散体
i.喷雾干燥
在一些实施方案中以及在本文提供的实施例中,片剂制剂包括伏西瑞韦的喷雾干燥的固体分散体(ssd)。选择伏西瑞韦的乙酸乙酯溶剂化物(eas)形式ii作为形成基本上无定形的伏西瑞韦ssd的起始材料。如前所述,伏西瑞韦eas形式ii的特征在于x射线粉末衍射图,其包括以下峰(±0.2°):8.7、13.0和17.4°2θ,如在使用cu-kα辐射的衍射仪上测定的。
喷雾干燥方法由以下三个连续步骤组成:
(1)通过将伏西瑞韦eas形式ii和交聚维酮溶解在合适的溶剂中来制备进料溶液。
(2)将进料溶液喷雾干燥得到作为无定形游离酸的伏西瑞韦的首先干燥的固体分散体。通过喷嘴将进料溶液泵入干燥室,喷嘴将进料溶液雾化成液滴。将热氮气干燥气体与雾化的进料溶液同时引入干燥室,并提供从液滴中蒸发溶剂所需的能量。所得的喷雾干燥的固体颗粒离开干燥室并在旋风分离器中与气流分离。将颗粒收集在旋风分离器底部的容器中。将氮气干燥气体循环回干燥室,并通过冷凝器从气流中除去大部分夹带的溶剂蒸气。
(3)对喷雾干燥的颗粒进行二次干燥以除去水和残留溶剂得到伏西瑞韦ssd,其中伏西瑞韦ssd表现出无定形游离酸形式。除非另有说明,术语“伏西瑞韦ssd”是指伏西瑞韦的无定形固体分散体,其具有1∶1比例的伏西瑞韦与交聚维酮。
用于喷雾干燥方法的合适溶剂的选择基于(1)伏西瑞韦eas形式ii和交聚维酮在溶剂中的溶解度,(2)在溶剂存在下的伏西瑞韦eas形式ii的化学稳定性,和(3)溶剂对进料溶液性质和所得固体分散体的颗粒性质的影响。丙酮和二氯甲烷被评价为进料溶液的溶剂,因为它们的沸点低,并且伏西瑞韦eas形式ii在这些溶剂中具有高溶解度(>300mg/ml)。
通过将7.5w/w%的伏西瑞韦eas形式ii和7.5w/w%交聚维酮溶解在丙酮或dcm中来制备含有15w/w%固体的进料溶液。伏西瑞韦eas形式ii和交聚维酮在两种溶剂中迅速溶解。在buchi迷你喷雾干燥器b-290上分别以150g和360g的固体批量喷雾干燥丙酮和dcm进料溶液。将经初步干燥的伏西瑞韦(无定形游离酸)固体分散体在65℃的真空烘箱中进行二次干燥。
基于丙酮的进料溶液(84%)获得了比基于dcm的进料溶液(70%)更高的总工艺产率。得到的伏西瑞韦ssd具有相当的残留溶剂含量(~0.3%)。从dcm进料溶液获得的基本上无定形的伏西瑞韦的喷雾干燥的固体分散体具有比从丙酮进料溶液获得的喷雾干燥的分散体(6μm)更大的平均粒度(13μm)。总之,使用丙酮和dcm进料溶液的喷雾干燥方法被认为是可接受的。然而,由于与dcm的600ppm(0.06%)相比较,丙酮作为残留溶剂的相对高的ich限为5000ppm(0.5%),因此选择丙酮而不是dcm。
ii.化学和物理稳定性
伏西瑞韦ssd具有吸湿性,当在25℃下在0%和90%rh之间循环时,可逆重量增加11%。另外,当暴露于120万勒克斯-小时/200w.hr/m2时,伏西瑞韦ssd不是光敏感的。在固态下,当在40℃/75%rh的开放条件下储存12个月时,伏西瑞韦保持基本上无定形而没有明显的相分离或重结晶,并且在40℃/75%rh的开放条件下储存1个月时化学稳定且总杂质/降解产物保持在2.0-2.2w/w%之间。。
评估了交聚维酮过氧化物含量对伏西瑞韦ssd化学稳定性的影响。对交聚维酮进行测试并释放至不超过400ppm过氧化物的规格。将具有典型过氧化物含量≤400ppm的交聚维酮(批次a)和具有高过氧化物含量665ppm的交聚维酮(批次b)二者加工成伏西瑞韦ssd。将伏西瑞韦ssd包装在指定的商业包装配置中(即,密封在含有5w/w%干燥剂的铝袋中的聚乙烯袋)并在25℃/60%rh和40℃/75%rh下储存6个月。如表4所示,伏西瑞韦ssd显示出优异的稳定性,并且在储存6个月后没有增加总的伏西瑞韦降解产物。数据表明,伏西瑞韦ssd的稳定性不受高达或超过400ppm的药典规格限值的交聚维酮过氧化物水平的影响。
表4
avoxssd包装在热封铝袋内的封闭pe袋中,pe袋和铝袋之间有干燥剂。干燥剂重量为散装粉末重量的约5%。
还评估了伏西瑞韦ssd效力对其化学和物理稳定性的影响(表5)。该开发研究将具有50w/w%伏西瑞韦/50w/w%交聚维酮的典型伏西瑞韦ssd(批次c)的性质与具有40w/w%伏西瑞韦/60w/w%交聚维酮的亚强效伏西瑞韦ssd(批次d)的性质和具有60w/w%伏西瑞韦/40w/w%交聚维酮的超强效伏西瑞韦ssd(批次e)进行了比较。将伏西瑞韦ssd包装在指定的商业包装配置中(即,密封在含有5w/w%干燥剂的铝袋中的聚乙烯袋)并在25℃/60%rh和40℃/75%rh下储存6个月。如表5所示,所有批次表现出相当的性能,voxssd含水量为0.1-0.8%。所有批次的伏西瑞韦ssd均显示出优异的稳定性,在储存6个月后没有增加总的伏西瑞韦降解产物。在整个研究期间,所有样品通过xrpd保持无定形。数据表明,伏西瑞韦ssd的稳定性不受伏西瑞韦ssd效力水平不低于40w/w%且不超过60w/w%的影响。
表5
avoxssd包装在热封铝袋内的封闭pe袋中,pe袋和铝袋之间有干燥剂。干燥剂重量为散装粉末重量的约5%。
另外评估了再加工的伏西瑞韦ssd对伏西瑞韦ssd的化学和物理稳定性的影响。将伏西瑞韦再加工(再溶解、喷雾干燥、二次干燥)两次,并按指定的商业包装配置(即密封在含有5w/w%干燥剂的铝袋中的聚乙烯袋)包装并在25℃/60%rh和40℃/75%rh下储存6个月。如表6所示,所有批次的伏西瑞韦ssd显示出优异的稳定性,并且在储存6个月后没有增加总的伏西瑞韦降解产物。在整个研究期间,所有样品通过xrpd保持无定形。数据表明,伏西瑞韦ssd的稳定性不受伏西瑞韦ssd的再加工的影响。
表6
avoxssd包装在热封铝袋内的封闭pe袋中,pe袋和铝袋之间有干燥剂。干燥剂重量为散装粉末重量的约5%。
d.固态相容性
索非布韦、维帕他韦ssd和伏西瑞韦ssd在固态下具有化学和物理相容性。索非布韦、维帕他韦ssd和伏西瑞韦ssd的固态相容性通过制备由49.75w/w%索非布韦、24.88w/w%维帕他韦ssd和24.88w/w%伏西瑞韦ssd和0.25w/w%硬脂酸镁(作为润滑剂添加)组成的粉末混合物来评估。使用碾压机将粉末混合物干法制粒,然后研磨。得到的颗粒(批次f)含有400mg索非布韦、100mg维帕他韦(作为200mg维帕他韦ssd)和100mg伏西瑞韦(作为200mg伏西瑞韦ssd),相当于索非布韦/维帕他韦/伏西瑞韦片剂:400/100/100mg中的相对组合物。
在开放和关闭条件下在25℃/60%rh和40℃/75%rh下评估玻璃瓶(避光保存)包装的索非布韦/维帕他韦ssd/伏西瑞韦ssd颗粒的化学和物理稳定性6个月。如表7中总结的,储存6个月后,索非布韦、维帕他韦和伏西瑞韦是化学稳定的,且没有增加索非布韦(保持在0.0%)、维帕他韦(保持在0.4%和0.5%之间)和伏西瑞韦(保持在1.1%和1.4%之间)的总杂质/降解产物。在所研究的时间段内没有观察到降解产物含量的上升趋势。
表7
a维帕他韦作为维帕他韦ssd加入,其由50w/w%无定形维帕他韦游离碱和50w/w%交聚维酮组成。
b伏西瑞韦作为伏西瑞韦ssd加入,其由50w/w%无定形伏西瑞韦游离酸和50w/w%交聚维酮组成。
注意:将颗粒储存在玻璃瓶中并避光。
d.片剂制备
使用(i)共干燥制粒和(ii)双制粒中两种方法之一制备包含索非布韦、基本上无定形的维帕他韦ssd和基本上无定形的伏西瑞韦ssd的单层片剂。
i.共干燥制粒
通过共干燥制粒制造单层片剂包括共同干燥制粒维帕他韦、索非布韦ssd和伏西瑞韦ssd,随后将共干燥制粒制剂压制成单层片剂。使用10kn/cm的辊压力、2mm的间隙宽度和1.00mm的研磨筛尺寸以1.0-1.3kg的规模成功制造索非布韦/维帕他韦ssd/伏西瑞韦ssd。最终的粉末混合物的平均粒度为416μm,细粒(<63μm)百分比为8%,体积和振实密度为0.58g/ml和o.73g/ml,并显示出可接受的流动性质(流动指数为12mm和在15kpa下ft4粉末渗透压降为1.2毫巴)。将最终的粉末混合物压制成1300mg芯片。在15-35kp的硬度范围内,芯片表现出脆性≤0.2%重量损失和崩解时间<10分钟。
将片剂进一步膜包衣以减少用聚乙烯醇基包衣的光解降解。将片剂包衣至目标3%重量增加。
颗粒内填料组合物
在共干燥制粒的单层片剂中另外包括颗粒内和颗粒外组分(例如赋形剂)。表8描述了颗粒内填料组合物对索非布韦、维帕他韦ssd和伏西瑞韦ssd的各种共干燥制粒制剂(制剂a-g)的溶出的影响。
表8
a所有制剂均以8kn/cm的压实力和1.25mm的筛网尺寸、2mm的间隙、1rpm的辊速和90rpm的造粒机速度制造。
b在与其他原型制剂类似的碾压参数下加工制剂g。
注意:溶出条件:0.15%西曲溴铵(ctab)的50nm乙酸盐缓冲液,ph4.5,75rpm,900ml,37℃,uspii型装置。
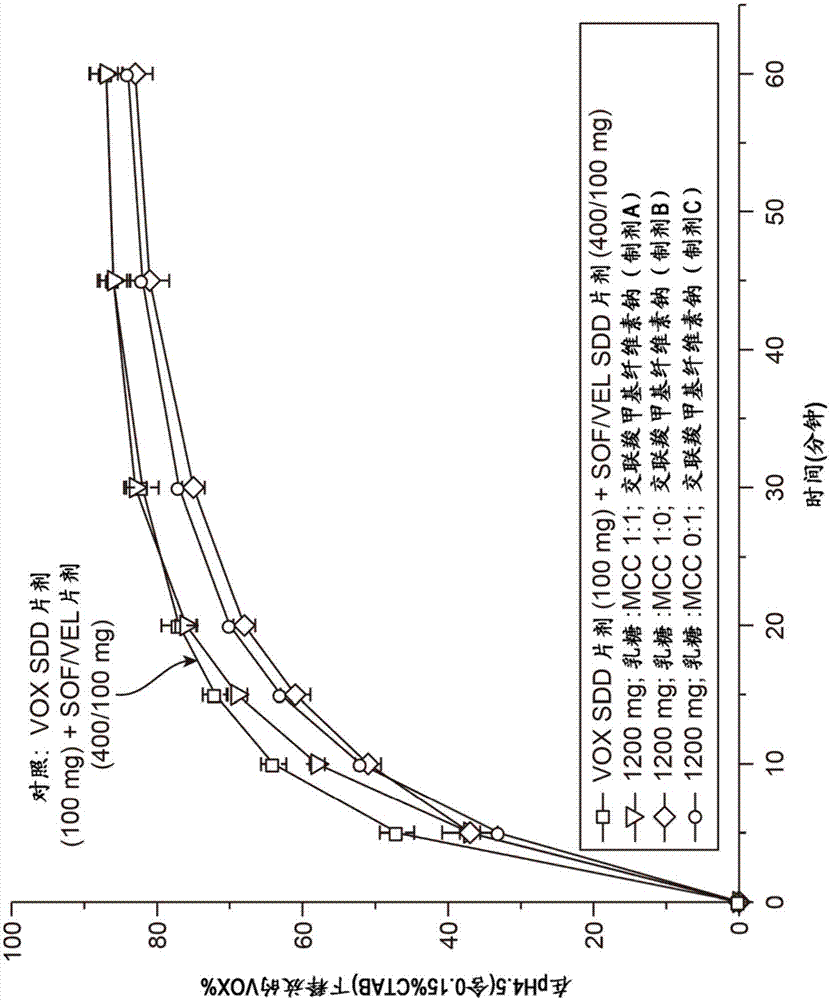
制剂a-c的比较揭示了乳糖一水合物和/或微晶纤维素含量对包含33.33w/w%的索非布韦、16.67w/w%的维帕他韦ssd和16.67w/w%的伏西瑞韦的制剂的影响,制剂a包含重量比1∶1的微晶纤维素和乳糖一水合物,制剂b仅包含乳糖一水合物(即,没有微晶纤维素),制剂c仅包含微晶纤维素(即,没有乳糖一水合物)。
如表8和图1所示,溶出结果表明,在20分钟时伏西瑞韦ssd从包含1∶1乳糖一水合物和微晶纤维素的混合物的制剂a的释放为76%,这大于伏西瑞韦从仅包含乳糖一水合物的制剂b的释放(68%)或仅包含微晶纤维素的制剂c的释放(70%)。
乳糖一水合物和/或微晶纤维素含量对索非布韦的溶出曲线没有影响(表8,图2)。所有三种制剂(即制剂a、b、c)在20分钟时释放100-102%的索非布韦,相当于在20分钟时从索非布韦/维帕他韦ssd片剂释放98%的索非布韦。
相比之下,与含有1∶1乳糖一水合物与微晶纤维素的混合物的制剂a相比,维帕他韦ssd在早期时间点(<20分钟)从含有单独的乳糖一水合物或单独的微晶纤维素的制剂b和c的溶出曲线稍微慢些(表8,图3)。
崩解剂含量
表8还描述了崩解剂含量对共干燥制粒制剂a、d和e的溶出的影响,其中每种制剂包含33.33w/w%的索非布韦、16.67w/w%的维帕他韦ssd和16.67w/w%的伏西瑞韦。使用交联羧甲基纤维素作为崩解剂制备这些制剂中的每一种,其包含2.5w/w%的颗粒外交联羧甲基纤维素钠。颗粒内交联羧甲基纤维素钠的量从2.5w/w%(制剂d)增加至5.5w/w%(制剂a)至7.50w/w%(制剂e)。
如表8和图4所示,溶出结果表明,总交联羧甲基纤维素钠含量从5%至8w/w%的增加显著改善了伏西瑞韦ssd的溶出性能,在20分钟时的释放由含有5w/w%交联羧甲基纤维素钠的制剂d的69%增加至含有8w/w%交联羧甲基纤维素钠的制剂a的78%。另一方面,总交联羧甲基纤维素钠含量从8%(制剂a)增加至10%(制剂e)对伏西瑞韦的溶出曲线没有显著影响。
维帕他韦ssd的溶出性能随着总交联羧甲基纤维素钠含量从5%到8w/w%的增加而提高,20分钟时的释放从含有5w/w%交联羧甲基纤维素钠的制剂d的93%增加到含有8w/w%交联羧甲基纤维素钠的制剂a的96%(表8,图5)。然而,总交联羧甲基纤维素钠含量从8%(制剂f)增加至10%(制剂e)导致维帕他韦ssd伏西瑞韦的溶出稍微缓慢。
索非布韦的溶出随着总交联羧甲基纤维素钠含量从5%增加到8w/w%而略微变慢,20分钟时的释放从含有5w/w%交联羧甲基纤维素钠的制剂d的98%减少到含有8w/w%交联羧甲基纤维素钠的制剂a的96%(表8,图6)。总交联羧甲基纤维素钠含量从8%(制剂a)增加至10%(制剂e)对索非布韦的溶出曲线没有显著影响。
索非布韦、维帕他韦ssd和伏西瑞韦ssd的相对浓度
表8另外描述了索非布韦、维帕他韦ssd和伏西瑞韦ssd的相对浓度对共干燥制粒制剂的溶出的影响,该制剂包括:33.33w/w%索非布韦、16.67w/w%维帕他韦ssd和16.67w/w%伏西瑞韦ssd(制剂a);30.77w/w%索非布韦、15.38w/w%维帕他韦ssd和15.38w/w%的伏西瑞韦ssd(制剂g);和27.6w/w%索非布韦、13.8w/w%维帕他韦ssd和13.8w/w%伏西瑞韦ssd(制剂f)。
如表8和图7所示,溶出结果表明,伏西瑞韦ssd在早期时间点(20分钟时)从制剂a(含有16.67w/w%伏西瑞韦ssd)和g(含15.38w/w%伏西瑞韦ssd负载)的溶出略微慢于从制剂f(含有13.8w/w%伏西瑞韦ssd)的溶出。如表8和图8所示,与维帕他韦ssd从制剂g(含有15.38w/w%维帕他韦ssd)的溶出相比,维帕他韦ssd从制剂a(含有16.67w/w%维帕他韦ssd)和f(含有13.8w/w%维帕他韦ssd)的溶出稍微慢一些。如表8和图9所示,与索非布韦从制剂g(含有30.8w/w%索非布韦)的溶出相比,索非布韦从制剂a(含33.3w/w%索非布韦)和f(含27.6w/w%索非布韦)的溶出更慢。
此外,发现20分钟时从制剂g(400/100/100mg)释放的索非布韦(101%)、维帕他韦ssd(97%)和伏西瑞韦ssd(75%)与索非布韦/维帕他韦ssd(400/100mg)和伏西瑞韦ssd(100mg)片剂释放的索非布韦(98%)、维帕他韦ssd(97%)和伏西瑞韦ssd(77%)相当,片剂的组成分别列于表9和表10中。
表9
a基于药物含量因子(dcf)调节索非布韦药物物质的量,同时调节微晶纤维素。velssd含有50w/w%vel和50w/w%交聚维酮。
b基于其药物含量调节velssd的实际量,同时调节微晶纤维素的量。
copadryiipink85f94644含有聚乙烯醇(40.00w/w%),usp,ph.eur.,二氧化钛(24.95w/w%),usp,ph.eur.,聚乙二醇/peg(20.20w/w%),nf,ph.eur.,滑石(14.80w/w%),usp,ph.eur.,氧化铁红(0.05w/w%),nf。
d代表理论目标增重3%(范围2%至4%)。
e在涂膜过程中使用纯净水,并在此过程中将其除去。
表10
avox是作为voxssd引入的。
bvoxssd含有50w/w%vox和50w/w%交聚维酮。
c基于其药物含量进行调节voxssd的实际量,同时调节乳糖一水合物的量。
d相当于10w/w%的vox。
e相当于100mgvox。
fopadryiiblue85f105080含有40.00w/w%聚乙烯醇(usp,ph.eur.)、22.99w/w%二氧化钛(usp,ph.eur.)、20.20w/w%聚乙二醇/peg3350(nf,ph.eur.)、14.80w/w%滑石(usp,ph.eur.)和2.01w/w%fd&cblue#1/brilliantbluefcf铝色淀。
g表示理论增重为3w/w%,允许范围为2%至4%。
h纯化水用于制备涂膜悬浮液,并在膜包衣过程中除去。
鉴于索非布韦/维帕他韦ssd/伏西瑞韦ssd的上述溶出度数据,选择制剂g(含30.77w/w%索非布韦、15.38w/w%维帕他韦ssd(7.69w/w%维帕他韦和7.69w/w%交聚维酮)、15.38w/w%伏西瑞韦ssd(7.69w/w%伏西瑞韦和7.69w/w%交聚维酮)、8.97w/w%乳糖一水合物和8.99w/w%微晶纤维素作为填充剂、8w/w%交联羧甲基纤维素钠作为崩解剂、1w/w%胶体二氧化硅作为助流剂和1.5w/w%硬脂酸镁作为润滑剂)而非制剂a和f(参见表8)。
ii.双制粒
双制粒单层索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂,包含400mg索非布韦、200mg维帕他韦ssd和200mg伏西瑞韦ssd,被开发作为共干燥制粒单层片剂方法的替代品。对于双制粒方法,将索非布韦和维帕他韦ssd或索非布韦和伏西瑞韦ssd共干燥粒化,并与干燥粒化的伏西瑞韦ssd或干燥粒化的维帕他韦ssd(分别)混合,在最终混合步骤中混合,然后压制成单层片剂。然而,基于维帕他韦ssd从双制粒制剂的差的溶出性能、索非布韦和伏西瑞韦ssd在五肽胃泌素预处理的禁食犬中低血浆暴露以及片剂含量均匀性的缺乏,未选择双制粒方法作为片剂制造的所需方法。
实施例2:化学和物理稳定性
评估了索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(制剂g)的化学稳定性、物理稳定性和溶出性质并总结于表11a、11b中。在一些实施方案中,将膜包衣片剂包装在具有1g硅胶干燥剂小罐和聚酯纤维环的75ml和100ml白色hdpe瓶(分别为批次a和b,如表11a、11b中所述)中。75ml和100mlhdpe瓶分别含有14片和28片。每个hdpe瓶都使用带有引入密封的铝面线的白色连续螺纹、防止儿童使用的聚丙烯螺旋盖加盖。评价包装的片剂(14和28计数)在40℃/75%rh和25℃/60%rh下的稳定性。另外,在40℃/75%rh的开放条件下评价14计数瓶(无盖)的稳定性。
表11a
a溶出条件:1.0w/v%ctab的190mm乙酸盐缓冲液,ph4.0,75rpm,900ml,37℃,uspii型装置。
b膜包衣片,批次a包装为:14ct.,在圈和1g干燥剂存在下,在75mlhdpe瓶中。对于开放条件,14个计数的hdpe瓶在没有盖子的情况下稳定放置。
c在xrpd图中观察到与开放条件下硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.52θ°)。
表11b
a溶出条件:1.0w/v%ctab的190mm乙酸盐缓冲液,ph4.0,75rpm,900ml,37℃,uspii型装置。
d膜包衣片剂,批次b包装为:28ct.,在圈和1克干燥剂存在下,在100mlhdpe瓶中。
表11a、11b中给出的总体数据表明,包装的片剂在40℃/75%rh和25℃/60%rh下6个月具有可接受的化学稳定性,其中索非布韦的总杂质/降解产物保持在0.0%,维帕他韦的保持在0.0%,而伏西瑞韦的保持在0.8-0.9%之间。在所研究的时间段内没有观察到降解产物含量的上升趋势。在40℃/75%rh和25℃/60%rh下储存6个月后,包装片剂的含水量保持在1.9-2.3%之间。
还如表11a、11b所示,当在开放条件下在40℃/75%rh下储存6个月时,片剂具有可接受的化学稳定性,索非布韦的总杂质/降解产物保持在0.0%,维帕他韦的保持在0.0-1.0%之间,并且伏西瑞韦的保持在0.8-1.0%之间。在开放条件下40℃/75%rh下储存6个月,含水量增加至5.8%。
所有片剂批次均显示,在开放和封闭条件下在40℃/75%rh和25℃/60%rh下储存6个月后,在含有1.0w/v%ctab的ph4.0乙酸盐缓冲液中30分钟时,索非布韦的一致的释放率为98%至103%,维帕他韦的为94%至100%,伏西瑞韦的为95%至100%之间。
此外,如表11a、11b中总结的,所有片剂都是物理稳定的。在封闭条件下储存6个月后,对于包装的片剂(28个计数)没有观察到xrpd图案的变化。对于在开放条件下储存的包装片剂(14个计数),观察到xrpd图中与硬脂酸镁的物理形态变化相关的微小变化(在3.5-5.5±2θ°)。
另外评估了索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(制剂g)的膜包衣水平对维帕他韦光降解的影响(表12)。根据ichq1b指南评估片芯和膜包衣片剂,总照度超过120万勒克斯小时,总辐照度大于200w.hr/m2。如表12所示,未包衣的片芯显示出高达0.3%的维帕他韦损失,并且在暴露于光后索非布韦和伏西瑞韦没有变化。膜包衣的所有片剂的重量增加范围为2.1%至5.4%,具有化学稳定性,并且显示索非布韦(保持在0.0%)、维帕他韦(保持在0.4%)和伏西瑞韦(保持在0.0%)的降解产物水平没有增加。膜包衣片剂符合所有包衣水平的外观描述。因此,≥2%的膜包衣水平足以保护维帕他韦免于光降解。
表12
a用2-5w/w%的opadryiibeige85f170040膜包衣的片剂含有:40.00w/w%聚乙烯醇-部分水解,usp,ph.eur.;23.65w/w%二氧化钛,usp,ph.eur.;20.20w/w%macrogol/peg3350,nf,ph.eur.;14.80w/w%滑石,usp,ph.eur.;1.14w/w%氧化铁黄;0.12w/w%氧化铁红,nf;0.09w/w%磁性氧化铁,nf。
b根据ichq1b指南,总照度超过120万勒克斯小时,总辐照度超过200w.hr/m2。
具有表13中所述制剂的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂用于1、2和3期临床研究(其中此类制剂基本上等同于上表8中所述的制剂g)。
表13
a基于每批次的药物含量因子调节索非布韦药物物质的实际量。相应地调节乳糖一水合物的量。
b基于velsdd药物含量调节velsdd的实际量。相应地调节乳糖一水合物的量。
c相当于7.6925w/w%的维帕他韦和7.6925w/w%的交聚维酮。
d相当于100mg维帕他韦和100mg交聚维酮。
e基于喷雾干燥的分散体药物含量因子调节voxsdd的实际量。相应地调节乳糖一水合物的量。
f相当于7.6925w/w%的伏西瑞韦和7.6925w/w%的交聚维酮。
g相当于100mg伏西瑞韦和100mg交聚维酮。
hopadryiibeige85f170040含有40.00w/w%聚乙烯醇-部分水解,usp,ph.eur.;23.65w/w%二氧化钛,usp,ph.eur.;20.20w/w%macrogol/peg3350,nf,ph.eur.;14.80w/w%滑石,usp,ph.eur.;1.14w/w%氧化铁黄;0.12w/w%氧化铁红,nf;0.09w/w%磁性氧化铁,nf。
i表示理论目标增重3w/w%(范围2-5%)。
j使用足够的水进行膜包衣,并在此过程中将其除去。
图10-12描绘了具有表13中所述制剂的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的额外溶出曲线,其用于1、2和3期临床研究,其中溶出测试在含有2.0w/v%聚山梨醇酯80的ph5.0乙酸盐缓冲液下进行。测试了四个批次的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂,批次a制造了100kg,批次b、c和d制造了145kg。制剂和制造过程的所有其他方面在其他方面是等同的。这四批产品采用相同的商业配置包装:28个计数,100mlftpde瓶,1克硅胶干燥剂小罐和聚酯纤维圈。批次a表现出良好的含量均匀性,索非布韦的平均强度为98.9%,维帕他韦ssd的为97.7%,伏西瑞韦ssd的为98.6%,相应的相对标准偏差(rsd)分别为1.8%、1.7%和1.7%。批次b、c和d也被发现具有可接受的含量均匀性,对于索非布韦,平均强度在99.9%至100.6%之间,对于维帕他韦ssd在99.0%至104.7%之间,对于伏西瑞韦在101.0至102.3%之间,以及相应的rsd分别为1.0%至1.9%、1.0%至1.8%(维帕他韦)、1.0%至1.8%。如图10、11和12所示,索非布韦、维帕他韦ssd和伏西瑞韦ssd分别从索非布韦/维帕他韦ssd/伏西瑞韦ssd膜包衣片剂(批次a-d)的溶出在含有1.0w/v%ctab的ph4.0乙酸盐缓冲液中15分钟后完成。此外,对于批次a,在30分钟时索非布韦溶出的量保持在98-100%之间,维帕他韦ssd溶出的量保持在90-92%之间,伏西瑞韦ssd溶出的量保持在89-93%之间。对于批次b和c,在30分钟时索非布韦溶出的量保持在98%和101%之间,维帕他韦ssd溶出的量在92%和97%之间,伏西瑞韦ssd溶出的量保持在92%和96%之间。对于批次d,在30分钟时索非布韦溶出的量保持在100%,维帕他韦ssd溶出的量保持在90%和91%之间,伏西瑞韦ssd溶出的量保持在89%和91%之间。60分钟后,维帕他韦ssd和伏西瑞韦ssd从与所有四批相关的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的释放在60分钟后完成。
与索非布韦/维帕他韦ssd/伏西瑞韦ssd膜包衣片剂(批次a)相关的稳定性数据列于表14中。总体数据表明,在所有条件下,包装片剂在长达6个月具有可接受的化学稳定性,其中索非布韦的总杂质/降解产物保持在0.0%,维帕他韦ssd的保持在0.5-0.9%之间,并且伏西瑞韦ssd的保持在0.0%。在所研究的时间段内没有观察到降解产物含量的上升趋势。在40℃/75%rh、30℃/75%rh和25℃/60%rh下储存6个月,包装片剂的含水量保持在1.9-2.3%之间。如表14中总结的,包装片剂(批次a)在储存6个月后物理上是稳定的,xrpd图没有变化。
表14
asof/vel/vox片剂,批次a以指定的商业包装配置包装:28-计数,100mlhpde瓶,圈,1g干燥剂。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
与索非布韦/维帕他韦ssd/伏西瑞韦ssd膜包衣片剂(批次b-d)相关的稳定性数据分别列于表15a-15c中。对于批次b和c,总体数据表明包装片剂在所有条件下具有长达6个月的可接受的化学稳定性,其中索非布韦的总杂质/降解产物保持在0.0%,维帕他韦ssd的保持在0.4和0.7%之间,并且伏西瑞韦ssd的保持在0.0%。在所研究的时间段内没有观察到降解产物含量的上升趋势。在40℃/75%rh、30℃/75%rh和25℃/60%rh下储存6个月,包装片剂的含水量保持在1.8-2.3%之间。包装片剂在储存6个月后物理上是稳定的,xrpd图没有变化。
对于批次d,包装片剂在所有条件下具有长达1个月的可接受的化学稳定性,其中索非布韦的总杂质/降解产物保持在0.0%,维帕他韦ssd的保持在0.7-0.8%之间,并且伏西瑞韦ssd的保持在0.0%。在所研究的时间段内没有观察到降解产物含量的上升趋势。在40℃/75%rh、30℃/75%rh和25℃/60%rh下储存1个月,包装片剂的含水量保持在1.9-2.3%之间。
表15a
asofvelvox片剂,批次b以指定的商业包装配置包装:28-计数,100mlhpde瓶,圈,1g干燥剂。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表15b
asof/vel/vox片剂,批次c以指定的商业包装配置包装:28-计数,100mlhpde瓶,圈,1g干燥剂。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表15c
asof/vel/vox片剂,批次d以指定的商业包装配置包装:28-计数,100mlhpde瓶,圈,1g干燥剂。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
实施例3:物理化学性质和生物学性质
a.溶出度作为培养基ph和组成的函数
使用装置ii(桨),75rpm,在37℃下具有900ml培养基,获得索非布韦、维帕他韦和伏西瑞韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(包含30.77w/w%索非布韦、15.38w/w%维帕他韦ssd、15.38w/w%伏西瑞韦ssd的制剂g)的溶出曲线作为在各种培养基中ph的函数(图13-15)。索非布韦是一种具有高且不依赖于ph的水溶性的bcs3类化合物。维帕他韦是一种具有ph依赖性溶解度的bcs4类化合物。伏西瑞韦是一种具有ph依赖性溶解度的bcs2类化合物。
如图13所示,索非布韦溶出在20分钟内完成,并且与培养基ph和组成无关。
如图14所示,维帕他韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出取决于ph和培养基组成。在ph2.0、4.5和6.8缓冲液、禁食模拟肠液(fassif)和进食状态模拟肠液(fessif)中观察到维帕他韦的不完全溶出。当将2.0w/v%聚山梨醇酯80加入到ph4.0、5.0和6.0缓冲液中时,维帕他韦的溶出得到改善。在含有2.0w/v%聚山梨醇酯80的ph4.0和5.0中观察到维帕他韦在60分钟时完全溶出。
如图15所示,伏西瑞韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出取决于ph和培养基组成。在ph2.0、4.5和6.8缓冲液、禁食模拟肠液(fassif)和进食状态模拟肠液(fessif)中观察到伏西瑞韦的不完全溶出。当将2.0w/v%聚山梨醇酯80加入到ph4.0、5.0和6.0缓冲液中时,伏西瑞韦的溶出度得到改善。在含有2.0w/v%聚山梨醇酯80的ph4.0和5.0中观察到伏西瑞韦在60分钟时完全溶出。
b.溶出度作为结晶的伏西瑞韦形式viii和x含量的函数
获得索非布韦、维帕他韦和伏西瑞韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(包含30.77w/w%索非布韦、15.38w/w%维帕他韦ssd、15.38w/w%伏西瑞韦ssd的制剂g)的溶出曲线作为片剂中结晶形式viii和x含量的函数。
索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂由加有0、5w/w%、10w/w%和20w/w%结晶伏西瑞韦形式viii和x(相对于总伏西瑞韦w/w%)的伏西瑞韦ssd制备。如前所述,伏西瑞韦的形式viii的特征在于x射线粉末衍射图,其包括以下峰(±0.2°):7.8、8.2和20.2°2θ,如使用cu-kα辐射在衍射仪上测定的。如前所述,伏西瑞韦的形式x的特征在于x射线粉末衍射图,其包括以下峰(±0.2°):8.0、19.0和20.4±0.2°2θ,如使用cu-kα辐射在衍射仪上测定的。
伏西瑞韦从含有0-20w/w%的伏西瑞韦形式viii和x的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出曲线分别如图16a和16b所示。含有0w/w%结晶伏西瑞韦的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂在30分钟时释放91%的伏西瑞韦。加入含有5%、10%和20w/w%形式viii或x的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂,分别在30分钟时释放出84%、80%和73%的伏西瑞韦。
索非布韦和维帕他韦从含有0-20w/w%的伏西瑞韦形式viii和x的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出曲线分别如图17和18所示。索非布韦和维帕他韦从加入的片剂的释放不受片剂中结晶伏西瑞韦形式viii和x(高达20w/w%)的存在的影响。所有片剂批次在30分钟时释放97-101%的索非布韦和89-91%的维帕他韦。
这些结果表明所提出的溶出方法能够区分voxssd中掺入的伏西瑞韦和作为纯药物存在于sof/vel/vox片剂中的伏西瑞韦形式viii或x。
c.溶出度作为纯无定形维帕他韦游离碱含量的函数
将维帕他韦(作为无定形游离碱)掺入到具有在喷雾干燥的分散体中的交聚维酮的片剂制剂中,以改善其相对于纯无定形维帕他韦游离碱药物物质的溶出度和药代动力学性能。为了证明维帕他韦作为维帕他韦ssd的加入是药物产品的关键质量属性,将维帕他韦从含有维帕他韦ssd的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出与维帕他韦从含有纯无定形维帕他韦游离碱和交聚维酮的物理混合物的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出进行比较。所有片剂含有7.7w/w%无定形维帕他韦游离碱,可以是维帕他韦ssd或纯药物物质。
图19中显示了维帕他韦的溶出曲线,图20和图21中分别显示了索非布韦和伏西瑞韦的溶出曲线。如图19所示,在30分钟时,维帕他韦从含有纯无定形维帕他韦游离碱的片剂释放62%,相较之下,在30分钟时维帕他韦从含有维帕他韦ssd的片剂释放91%。如图20和图21所示,索非布韦和伏西瑞韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的释放没有受到纯无定形维帕他韦游离碱的存在的影响。两个药物批次在30分钟时释放101%至106%的索非布韦和91%至96%的维帕他韦。
结果表明维持维帕他韦处于分散状态对于合适的药物产品溶出的必要性,并且还表明所提出的溶出方法区分含有维帕他韦作为维帕他韦ssd和纯无定形维帕他韦游离碱的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂。
d.溶出度作为纯无定形的伏西瑞韦游离酸含量的函数
将伏西瑞韦(作为无定形游离酸)掺入在喷雾干燥的分散体中具有交聚维酮的片剂中以改善其相对于纯药物的溶出度和药代动力学性能。为了证明伏西瑞韦作为伏西瑞韦ssd的掺入是药物产品的关键质量属性,将伏西瑞韦从含有伏西瑞韦ssd的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出与伏西瑞韦从含有纯无定形的伏西瑞韦游离酸和交聚维酮的物理混合物的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出进行比较。所有片剂含有7.7w/w%无定形的伏西瑞韦游离酸,以伏西瑞韦ssd中或作为纯药物物质。
图22显示了伏西瑞韦的溶出曲线,图23和24分别为索非布韦和维帕他韦的溶出曲线。如图22所示,从含有纯无定形伏西瑞韦游离酸的片剂中释放出伏西瑞韦受到影响。与含有伏西瑞韦ssd的片剂释放91%的伏西瑞韦相比,该片剂在30分钟时释放了76%的伏西瑞韦。如图23和图24所示,索非布韦和维帕他韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的释放不受纯无定形伏西瑞韦游离酸的存在的影响。两个药物批次在30分钟内释放98%至101%的索非布韦和91%至92%的维帕他韦。
结果表明维持伏西瑞韦处于分散状态对于合适的药物产品溶出的必要性,并且还表明所提出的溶出方法区分含有伏西瑞韦作为伏西瑞韦ssd和纯无定形伏西瑞韦游离酸的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂。
e.压力研究
评估了以下压力因素对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的物理和化学稳定性的影响:
(i)伏西瑞韦ssd和维帕他韦ssd,以及索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂含水量;
(ii)维帕他韦ssd和伏西瑞韦ssd中的交聚维酮过氧化物含量;
(iii)再加工的维帕他韦ssd和伏西瑞韦ssd;
(iv)伏西瑞韦ssd和维帕他韦ssd效力(改变维帕他韦或伏西瑞韦与交聚维酮的比例);和
(v)用结晶伏西瑞韦形式viii和x药物播种(seeding)索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂。
对于每项影响研究,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂均采用指定的商业包装配置(28-计数,100mlhpde瓶,环,1g干燥剂)包装,并在25℃/60%rh和40℃/75%rh下储存12周。片剂也包装在开口容器中(28-计数,100ml无盖的hpde瓶),并在40℃/75%rh下储存4周,在50℃/92%rh下储存1周。
i.维帕他韦ssd和伏西瑞韦ssd含水量对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的影响
维帕他韦ssd和伏西瑞韦ssd含水量对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的化学稳定性、物理稳定性和溶出度的影响(表16a-16b)。使用含水量7.0%的维帕他韦ssd和含水量3.2%的伏西瑞韦ssd来制备片剂。
稳定性结果显示在表16a-16b中。所有片剂在所有条件下都是化学稳定的,其中维帕他韦、索非布韦和伏西瑞韦的总杂质/降解产物保持在0.0%。对于在封闭条件下储存长达12周的片剂含水量保持在2.4%和2.7%之间,各种温度/湿度条件下干燥剂为1g。对于在开放条件下在40℃/75%rh下储存长达4周的片剂,含水量增加至5.3%。在所研究的时间段内的30分钟时,所有片剂批次显示索非布韦在98%至101%之间一致释放,维帕他韦在89%至92%之间一致释放,并且伏西瑞韦在90%至95%之间一致释放。
在所有条件下,所有片剂都是物理稳定的。在xrpd图中观察到的峰与索非布韦或制剂赋形剂一致。如表16a中总结的,在用1g干燥剂研究的封闭条件下,在长达12周的储存片剂中未观察到固体形式的变化。如表16b所示,对于在50℃/92%rh(1周)和40℃/75%rh(4周)的开放条件下储存的片剂,观察到xrpd图中与硬脂酸镁的物理形态变化相关的微小变化(在3.5-5.5±2θ°)。
如表16a-16b所示,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的稳定性和溶出性质不受高达7.0%的维帕他韦ssd含水量和高达3.2%的伏西瑞韦ssd含水量的影响。
表16a
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表16b
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
ii.维帕他韦ssd残留乙醇含量和伏西瑞韦ssd残留丙酮含量对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的影响
评估了维帕他韦ssd和伏西瑞韦ssd残留溶剂含量对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的化学稳定性、物理稳定性和溶出度的影响(表17a-17b)。含有6.0%残留乙醇的维帕他韦ssd和含有2.1%残留丙酮的伏西瑞韦ssd的开发批次用于制造索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂。基于维帕他韦ssd和伏西瑞韦ssd药物含量因子调节维帕他韦ssd和伏西瑞韦ssd的量,同时调节乳糖一水合物的量。
如表17a-17b所示,所有片剂在所有条件下都是化学稳定的,其中索非布韦、维帕他韦和伏西瑞韦的总杂质/降解产物保持在0.0%。对于在不同温度/湿度条件下用1g干燥剂研究的封闭条件下储存长达12周的片剂,含水量保持在2.0-2.1%之间。对于在开放条件下在40℃/75%rh下储存长达4周的片剂,含水量增加至5.2%。此外,在所研究的时间段内的30分钟时,所有片剂均显示索非布韦在99%至101%之间一致释放,维帕他韦在87%至91%之间一致释放,并且伏西瑞韦在85%至95%之间一致释放。
还如表17a-17b所示,所有片剂在所有条件下都是物理稳定的。在xrpd图中观察到的峰与索非布韦或制剂赋形剂一致。在用1g干燥剂研究的封闭条件下,对于储存长达12周的片剂,没有观察到固体形式的变化。对于在开放条件下在50℃/92%rh(1周)和40℃/75%rh(4周)下储存的片剂,在xrpd图中观察到与硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.5±2θ°)。
表17a-17b中显示的数据表明,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的稳定性和溶出性能不受维帕他韦ssd中6.0%残留乙醇和伏西瑞韦ssd中2.1%残留丙酮的影响。
表17a
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表17b
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
iii.交聚维酮过氧化物含量对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的影响
评估了交聚维酮过氧化物含量对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的化学稳定性、物理稳定性和溶出度的影响(表18a-18b)。具有544ppm过氧化物含量的交聚维酮被掺入用于索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的维帕他韦ssd开发批次中。具有655ppm过氧化物含量的交聚维酮被掺入用于生产索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的伏西瑞韦ssd的开发批次(批次150629401)中。
如表18a-18b所示,所有片剂都是化学稳定的,索非布韦和维帕他韦的总杂质/降解产物保持在0.0%,伏西瑞韦的总杂质/降解产物在0.2-0.3%之间。对于在各种温度/湿度条件下干燥剂为1g的封闭条件下储存12周的片剂,含水量保持在2.0-2.2%之间。对于在开放条件下在40℃/75%rh下储存4周的片剂,含水量增加5.2%。在所研究的时间段内的30分钟时,所有片剂批次均显示索非布韦在99%至100%之间一致释放,维帕他韦在85%至90%之间一致释放,并且伏西瑞韦在87%至93%之间一致释放。
还如表18a-18b所示,所有片剂在所有条件下都是物理稳定的。在片剂的xrpd图中观察到的所有峰与索非布韦或制剂赋形剂一致。在用1g干燥剂研究的封闭条件下,对于储存长达12周的片剂,没有观察到固体形式的变化。对于在开放条件下在50℃/92%rh(1周)和40℃/75%rh(4周)下储存的片剂,在xrpd图中观察到与硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.5±2θ°)。
表18a-18b中显示的结果表明,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的稳定性和溶出性质不受交聚维酮过氧化物含量水平超过400ppm的药典规格限制的影响。
表18a
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表18b
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
iv.再加工的维帕他韦ssd和伏西瑞韦ssd对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂稳定性的影响
评估了再加工的维帕他韦ssd和伏西瑞韦ssd对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的化学稳定性、物理稳定性和溶出度的影响(表19a-18b)。维帕他韦ssd和伏西瑞韦ssd(批次150629203)再加工(再溶解、喷雾干燥、二次干燥)两次,并用于生产索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂。
如表19a-18b所示,所有片剂在所有条件下都是化学稳定的,其中索非布韦的总杂质/降解产物保持在0.0%,维帕他韦的总杂质/降解产物保持在0.5-0.6%之间,并且伏西瑞韦的总杂质/降解产物在0.2-0.3%之间。对于在各种温度/湿度条件下使用lg干燥剂的封闭条件下储存长达12周的片剂,含水量保持在2.0-2.3%之间。对于在开放条件下在40℃/75%rh下储存长达4周的片剂,含水量增加至5.2%。在所研究的时间段内的30分钟时,所有片剂批次均显示索非布韦在98%至100%之间一致释放,维帕他韦在83%至85%之间一致释放,并且伏西瑞韦在87%至90%之间一致释放。
还如表19a-19b所示,所有片剂在所有条件下都是物理稳定的。在片剂的xrpd图中观察到的所有峰与索非布韦或制剂赋形剂一致。在用lg干燥剂研究的封闭条件下,对于储存长达12周的片剂,没有观察到固体形式的变化。对于在开放条件下在50℃/92%rh(1周)和40℃/75%rh(4周)下储存的片剂,在xrpd图中观察到与硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.5±2θ°)。
表19a-9b中显示的数据表明,在研究12周的条件下,维帕他韦ssd和伏西瑞韦的再加工不影响索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的化学和物理稳定性。
表19a
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表19b
a包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
v.维帕他韦ssd和伏西瑞韦ssd效力对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的影响
亚强效维帕他韦ssd(40w/w%维帕他韦/60%交聚维酮;批次a),超强效维帕他韦ssd(55w/w%维帕他韦和45%交聚维酮;批次b),亚强效伏西瑞韦ssd(40w/w%伏西瑞韦/60%交聚维酮;批次c),超强效伏西瑞韦ssd(60w/w%伏西瑞韦和45%交聚维酮;批次d)(表20a-20d和21a-21d)。亚强效和超强效维帕他韦ssd和伏西瑞韦ssd的开发批次用于生产四批索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(批次a-d)。基于维帕他韦ssd和伏西瑞韦ssd药物含量因子调节维帕他韦ssd和伏西瑞韦ssd的量,同时调节乳糖一水合物的量。
表20a-20d显示封闭条件下的稳定性结果,表21a-21d显示开放条件下的稳定性结果。所有片剂批次在所有条件下都是化学稳定的,索非布韦和维帕他韦的总杂质/降解产物保持在0.0%,而伏西瑞韦的保持在0.7%。对于在不同温度/湿度条件下在lg干燥剂的封闭条件下储存长达12周的片剂,含水量保持在1.8-2.5%之间(表20a-20d)。对于在开放条件下在40℃/75%rh下储存长达4周的片剂,含水量增加至5.8%(表21a-21d)。
含有超强效维帕他韦ssd和超强效伏西瑞韦ssd的批次a显示,在研究的封闭条件下在30分钟时,索非布韦的一致释放率为99%至102%,维帕他韦的一致释放率为90%至92%,并且伏西瑞韦的一致释放率为91%至93%(表20a)。来自批次a的维帕他韦和伏西瑞韦的溶出度在40℃/75%rh的开放条件下储存4周后30分钟时,维帕他韦的溶出度降低至85%,伏西瑞韦的溶出度降低至85%(表21a)。
在研究的封闭条件下在30分钟时,含有亚强效的维帕他韦ssd和亚强效的伏西瑞韦ssd的批次b显示,索非布韦在82%-84%之间最缓慢但一致的释放,维帕他韦在61%-63%之间一致释放,而伏西瑞韦在60%-63%之间一致释放(表20b)。在40℃/75%rh的开放条件下储存4周后30分钟时,来自批次b的维帕他韦、索非布韦和伏西瑞韦的溶出度,索非布韦增加至100%,维帕他韦和伏西瑞韦增加至91%(表21b)。
在研究的封闭条件下在30分钟时,含有亚强效维帕他韦ssd和超强效伏西瑞韦ssd的批次c和含有超强效维帕他韦ssd和亚强效伏西瑞韦ssd的批次d显示,索非布韦在98%-101%之间一致释放,维帕他韦在81%-87%之间一致释放,以及伏西瑞韦为84%-88%之间一致释放(表20c)。在40℃/75%rh的开放条件下储存4周后30分钟时,维帕他韦和伏西瑞韦从c和d的溶出度,维帕他韦增加至89-93%和伏西瑞韦增加至92%(表21c)。
所有片剂在所有条件下都是物理稳定的。在片剂的xrpd图中观察到的所有峰与索非布韦或制剂赋形剂一致。如表20a-20d和21a-20d中总结的,在用1g干燥剂研究的封闭条件下,对于储存长达12周的片剂没有观察到固体形式的变化。对于在开放条件下在50℃/92%rh(1周)和40℃/75%rh(4周)下储存的片剂,在xrpd图中观察到与硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.5±2θ°)。
因此,在研究长达12周的条件下,维帕他韦在维帕他韦ssd中的效力和伏西瑞韦在伏西瑞韦ssd中的效力不影响索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的化学和物理稳定性。
表20a
a包装由封闭条件下具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
注意:i/d是指总杂质/降解产物。
表20b
a包装由封闭条件下具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
注意:i/d是指总杂质/降解产物。
表20c
a包装由封闭条件下具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
注意:i/d是指总杂质/降解产物。
表20d
a包装由封闭条件下具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
注意:i/d是指总杂质/降解产物。
表21a
a包装由开放条件下的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
表21b
a包装由开放条件下的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
表21c
a包装由开放条件下的无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
表21d
a包装由开放条件下无盖的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
c在xrpd图中观察到的微小变化(在3.5-5.52θ°)与开放条件下硬脂酸镁的物理形态变化有关。
vi.加入结晶的伏西瑞韦形式viii和x的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的物理稳定性
评估结晶的伏西瑞韦形式viii和x晶种对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的物理稳定性和溶出度的影响(表22和23)。如表22中所述,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂批次a和b分别掺入5w/w%和10w/w%的形式viii(相对于总的伏西瑞韦w/w%)。索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂批次c和d如表23中所述,分别加入10w/w%和20w/w%的形式x(相对于总的伏西瑞韦w/w%)。
加入5w/w和10w/w%形式viii的片剂的结果总结于表22中。加入10w/w%形式viii的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂显示,在所研究的时间段内的30分钟时,索非布韦在98%至100%之间一致释放,维帕他韦在90%至96%之间一致释放,以及伏西瑞韦在80%至85%之间一致释放。在片剂的xrpd图中观察到的所有峰与索非布韦、形式viii或制剂赋形剂一致。在研究的封闭储存条件下没有观察到额外的结晶峰。对于在50℃/92%rh(1周)和40℃/75%rh(4周)的开放条件下储存的样品,在xrpd图中观察到与硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.3±2θ°)。
加入10w/w%和20w/w%形式x的片剂的结果总结在表23中。加入10w/w%形式x的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂显示,在30分钟时,索非布韦在97%至100%之间一致释放,维帕他韦在89%至95%之间一致释放,以及伏西瑞韦在80%至85%之间一致释放。在片剂的xrpd图中观察到的所有峰与索非布韦、形式x或制剂赋形剂一致。在研究的封闭储存条件下没有观察到额外的结晶峰。对于在50℃/92%rh(1周)和40℃/75%rh(4周)的开放条件下储存的样品,在xrpd图中观察到与硬脂酸镁的物理形态变化有关的微小变化(在3.5-5.3±2θ°)。
根据表22和23中呈现的数据,无定形的维帕他韦游离碱和无定形的伏西瑞韦游离酸在预先存在的结晶伏西瑞韦存在下没有显示出结晶倾向。
表22
a相对于总vox的w/w%。
b包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
cdl(检测限)通过xrpd对于形式viiisof/vel/vox片剂为5%。
d溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
e被加入片剂的xrpd图中的微小变化(3.5-5.5±2θ°)与开放条件下硬脂酸镁的物理形态变化有关。
表23
a相对于总vox的w/w%。
b包装由用于封闭条件的具有1克干燥剂和聚酯圈的100mlhdpe瓶中的28个计数和用于开放条件的无盖的100mlhdpe瓶中的28个计数组成。
cdl(检测限)通过xrpd对于形式xsof/vel/vox片剂为10%。
d溶出条件:,含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
e被加入的片剂的xrpd图中的微小变化(3.5-5.5±2θ°)与开放条件下硬脂酸镁的物理形态变化有关。
f.干燥剂和包装配置对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂稳定性的影响
评估了干燥剂和包装配置对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的物理稳定性、化学稳定性和溶出度的影响(表24a-24c)。
索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂采用指定的商业包装配置(28-计数,100mlhpde瓶,圈,1g干燥剂)包装,在25℃/60%rh和40℃/75%rh下储存6个月。
如表24a-24c所示,所有片剂批次在所有条件下都是化学稳定的,索非布韦的总杂质/降解产物保持在0.0%,维帕他韦的总杂质/降解产物保持在0.3-0.5%之间,并且伏西瑞韦的总杂质/降解产物保持在0.0%。对于在25℃/60%rh和40℃/75%rh下具有三种(0、1g和3g)干燥剂水平的封闭条件下储存长达6个月的片剂,含水量保持在1.8%至2.6%之间。所有片剂批次显示,在所研究的时间段内的30分钟时,索非布韦在99%至102%之间一致释放,维帕他韦在90%至96%之间一致释放,并且伏西瑞韦在90%至95%之间一致释放。
所有片剂在所有条件下都是物理稳定的。在片剂的xrpd图中观察到的所有峰与索非布韦或制剂赋形剂一致。在整个研究期间,xrpd未观察到固体形式的变化。
表24a-24c中呈现的数据表明,在研究6个月的条件下,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂在存在或不存在干燥剂的情况下是化学和物理稳定的。
表24a
a包装由具有聚酯圈和1g或3g干燥剂或无干燥剂的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表24b
a包装由具有聚酯圈和1g或3g干燥剂或无干燥剂的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
表24c
a包装由具有聚酯圈和1g或3g干燥剂或无干燥剂的100mlhdpe瓶中的28个计数组成。
b溶出条件:含有2.0w/v%聚山梨醇酯80和0.001w/v%bht的ph5.0的50mm乙酸钠缓冲液,75rpm,在37℃下900ml,uspii型装置。
g.伏西瑞韦ssd粒度分布对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂溶出度的影响
评估了伏西瑞韦ssd粒度对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出性能的影响(图25-27)。在hovionefarmaciencia(loures,portugal)的psd-3级喷雾干燥器上制造伏西瑞韦ssd,其在二次干燥后具有d10=约3、d50=约17和d90=约37μm的粒度分布,并用于生产索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(图25-27中的批次a)。在二次干燥后粒度分布为d10=约19、d50=约48、d90=约92μm的伏西瑞韦ssd在富士化学工业株式会社(日本富山县)的psd-4级喷雾干燥器上制造,并用于生产索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(图25-27中的批次b)。如图25所示,在研究范围内伏西瑞韦ssd粒度不影响伏西瑞韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的释放。两个药物批次均在30分钟时释放87%至89%的伏西瑞韦。
索非布韦和维帕他韦的溶出曲线分别如图26和27所示。两个片剂批次(a和b)具有相当的溶出曲线,其中在30分钟时索非布韦在98和99%之间一致释放,维帕他韦在88和90%之间一致释放。如图26和27所示,这些索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂批次显示出与3期临床研究中使用的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂批次相当的溶出曲线(批次a-d,如图10-13和表10-14中所述)。用于制造这些临床片剂的伏西瑞韦ssd在二次干燥后表现出d10=约4至约10μm,d50=约20至约29μm,和d90=约38至约54μm的粒度分布。这些临床批次在30分钟时释放98%至100%的索非布韦,90%至92%的维帕他韦,以及91%至92%的伏西瑞韦。
h.维帕他韦ssd粒度分布对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂溶出的影响
评估了维帕他韦ssd粒度对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的溶出性能的影响(图28-30)。在hovionefarmaciencia(loures,portugal)的psd-4级喷雾干燥器上制造伏西瑞韦ssd,其在二次干燥后具有d10=9、d50=29和d90=62μm以及d10=17、d50=53和d90=112μm的粒度分布,并用于生产索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(图28-30中的批次a和b)。如图28所示,在研究范围内伏西瑞韦ssd粒度不影响维帕他韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的释放。两个药物批次(a和b)均在30分钟时释放92%至93%的伏西瑞韦。
索非布韦和伏西瑞韦的溶出曲线分别如图29和30所示。片剂批次(a和b)在30分钟时释放97%至99%的索非布韦、89%至93%的维帕他韦以及89%至93%的伏西瑞韦。还如图所示,这些索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂显示出与3期临床研究中使用的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂相当的溶出曲线(批次a-d)。用于制造这些临床片剂的维帕他韦ssd在二次干燥后表现出d10=19-22μm、d50=50-52μm和d90=98-107μm的粒度分布。这些临床批次在30分钟时释放98%至100%的索非布韦、90%至92%的维帕他韦以及91%至92%的伏西瑞韦。
i.维帕他韦ssd粒度分布对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂溶出的影响
索非布韦药物物质的粒度通过使用空气喷射筛分方法保留在1000μm和1400μm筛网上的质量来测量(图31-33)。索非布韦粒度对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂溶出性能的作用。将保留在1000μm筛网上2%质量的索非布韦和保留在1400μm筛网上1%质量的索非布韦用于生产索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(批次a)。将保留在1000μm筛网上6%质量的索非布韦和保留在1400μm筛网上3%质量的索非布韦用于生产sof/vel/vox片剂(批次b)。如图31所示,索非布韦粒度不影响在研究范围内索非布韦从索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂的释放。这两个片剂批次在30分钟时释放了101%的索非布韦。
图32和33分别提供了维帕他韦和伏西瑞韦的溶出曲线。两个片剂批次在30分钟时释放了91%至93%的维帕他韦和91%至94%的伏西瑞韦。如所述图中所示,批次a和b表现出与3期临床研究(批次a-d,如图10-13和表10-13中所述)中使用的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂批次相当的溶出曲线。用于制造这些临床片剂的索非布韦的粒度范围为保留在1000μm筛网上的0-4%质量和保留在1400μm筛网上的0-3%质量。这些临床批次在30分钟时释放98%至100%的索非布韦、90%至92%的维帕他韦以及91%至92%的伏西瑞韦。
实施例4:相对生物利用度(犬模型)
在五肽胃泌素预处理的禁食犬中评估了索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(制剂g,参见表8)的体内pk性能以及伏西瑞韦ssd片剂和索非布韦/维帕他韦ssd片剂的共同给药(表25、26)。如表25和26所示,口服给予制剂g(100mg索非布韦/25mg维帕他韦ssd/25mg伏西瑞韦ssd)后,伏西瑞韦ssd、维帕他韦ssd、索非布韦和代谢物的平均pk参数与对照(共同施用伏西瑞韦ssd和索非布韦/维帕他韦ssd片剂)相似。这些代谢物包括:
表25
avoxssd由20w/w%维帕他韦ssd、34.75w/w%乳糖一水合物、34.75w/w%微晶纤维素、8w/w%交联羧甲基纤维素钠、1.0w/w%二氧化硅、1.5w/w%硬脂酸镁组成。索非布韦/伏西瑞韦ssd片剂(由40w/w%sof、20%velssd、35.5w/w%微晶纤维素、3w/w%交联羧甲基纤维素钠、1.5w/w%硬脂酸镁组成。
表26
avoxssd由20w/w%维帕他韦ssd、34.75w/w%乳糖一水合物、34.75w/w%微晶纤维素、8w/w%交联羧甲基纤维素钠、1.0w/w%二氧化硅、1.5w/w%硬脂酸镁组成。索非布韦/伏西瑞韦ssd片剂(由40w/w%sof、20%velssd、35.5w/w%微晶纤维素、3w/w%交联羧甲基纤维素钠、1.5w/w%硬脂酸镁组成)。
实施例5:食物效应研究(犬模型)
还评估了口服索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂制剂g后食物对五肽胃泌素预处理的犬的效应。还如表25和表26(上文再现)所示,在口服给予制剂g(100mg索非布韦/25mg维帕他韦/25mg伏西瑞韦)与高脂肪膳食食物之后,前述的维帕他韦ssd、索非布韦和代谢物m1和m2的平均pk参数与在禁食的犬中给予制剂g(100mg索非布韦/25mg维帕他韦/25mg伏西瑞韦)相似。相比之下,当片剂与高脂肪膳食一起施用时,伏西瑞韦ssd的血浆暴露(auc0-last)增加1.6倍。
实施例6:相对生物利用度(人类个体)
在禁食的健康个体中评估索非布韦/维帕他韦ssd/伏西瑞韦ssd共干燥制粒单层片剂和共同施用的400/100mg索非布韦/维帕他韦ssd片剂和100mg伏西瑞韦ssd片剂的相对生物利用度。研究结果总结在表27中。当以索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂或以索非布韦/维帕他韦ssd和伏西瑞韦ssd片剂施用时,索非布韦、其代谢物m1和m2、维帕他韦ssd和伏西瑞韦ssd的暴露相似。平均百分比(%gmr)范围为95.3%至113%。基于这些数据,选择单层共干燥制粒的索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂用于3期临床开发。
表27
asof/velssd片剂,400/100mg
bvoxssd片剂,100mg
实施例7:食物效应研究(人类个体)
食物(高热量/高脂肪膳食)对索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂(400/100/100mg)的药代动力学的效应。表28总结了该研究的结果。与食物一起施用索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂基本上不会改变索非布韦、其代谢物m1和m2或维帕他韦ssd的血浆暴露。与禁食状态相比,在进食状态下施用索非布韦/维帕他韦ssd/伏西瑞韦ssd(400/100/100mg)后,伏西瑞韦ssd的暴露显著更高(%gmr:aucinf为533%,cmax为780%)。因此,索非布韦/维帕他韦ssd/伏西瑞韦ssd片剂与食物一起服用。
表28
应当理解,尽管已经通过优选实施方案和可选特征具体地公开了本发明,但是本领域技术人员可以采用本文公开的本发明的修改、改进和变化,并且这些修改、改进和变化被认为是在本发明的范围内。这里提供的材料、方法和实施例是优选实施方案的代表,是示例性的,并不意图作为对本发明范围的限制。
本文概括地和一般性地描述了本发明。落入上位公开内容中的每个较窄的下位和次上位群组也构成本发明的一部分。这包括本发明的一般性描述,条件或否定限制是从该上位中去除任何主题,无论是否在本文中具体叙述了被排除的材料。
另外,在描述本发明的马库什群组的特征或方面时,本领域技术人员将认识到,因此也描述了本发明马库什群组的任何单个成员或成员子群。
本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体明确地并入本文,其程度如同每个单独地通过引用并入。如果发生冲突,以本说明书包括定义为准。
- 还没有人留言评论。精彩留言会获得点赞!