心脏病的非侵入性影像诊断剂的制作方法
本发明涉及心脏病的非侵入性影像诊断剂。
背景技术:
在慢性心力衰竭中,心室肥大、纤维化等左室重构在心脏中进展,已报道了肾素-血管紧张素-醛固酮系统(raas)的亢进与该过程有关。raas是在体内调节血压的循环系统的调节机构,近年来,除了该全身循环系统的raas以外,还报道了表明raas、醛固酮合成系统在心脏局部存在的数据。
例如,非专利文献1中记载:通过心脏导管检查的采血表明了在人衰竭心脏中合成·分泌醛固酮。
另外,非专利文献2中,通过利用剖检心脏进行的研究,明确了作为醛固酮合成酶的cyp11b2的基因表达亢进。而且表明,该cyp11b2的基因表达的亢进与心肌的纤维化、心脏功能障碍有关。
另外,开发了多种选择性地抑制cyp11b2的化合物,进行了意图通过选择性地抑制cyp11b2来治疗心血管疾病的尝试(专利文献1~3、非专利文献3~5)。
虽然并非以心血管疾病为对象,但为了描绘肾上腺的病变以使得原发性醛固酮症的影像诊断成为可能,还开发了各种相对于cyp11b2显示高选择性的放射性化合物(专利文献4~11、非专利文献6)
现有技术文献
专利文献
专利文献1:日本特表2013-512271号公报
专利文献2:日本特表2011-520799号公报
专利文献3:日本特表2014-526539号公报
专利文献4:日本特表2013-534911号公报
专利文献5:日本特开2014-129315号公报
专利文献6:日本特开2015-093831号公报
专利文献7:日本特开2015-093832号公报
专利文献8:日本特开2015-093833号公报
专利文献9:日本特开2015-110563号公报
专利文献10:日本特开2015-193545号公报
专利文献11:国际公开2015/199205小册子
非专利文献
非专利文献1:mizuno,y.等,circulation,vol.103,p.72-7(2001)
非专利文献2:satoh,m.等,clinicalscience,vol.102,p.381-386(2002)
非专利文献3:grombein,c.m.,europeanjournalofmedicinalchemistry,vol.89,p.597-605(2015)
非专利文献4:grombein,c.m.,europeanjournalofmedicinalchemistry,vol.90,p.788-796(2015)
非专利文献5:martin,r.e.等,journalofmedicinalchemistry,vol.58,p.8054-8065(2015)
非专利文献6:abe,t.,journalofclinicalendocrinolmetabolism,vol.101,p.1008-1015(2016)
技术实现要素:
认为存在下述可能:通过对心脏中cyp11b2的表达进行检测,能够对心力衰竭等心脏病的进展过程进行评价。然而,目前不存在能检测这些病变的非侵入性的方法。
作为检测生物体内的分子水平的变化的方法之一,可举出使用单光子断层扫描(spect)及正电子发射断层扫描(pet)进行的核医学诊断。专利文献4~11及非专利文献6中,报道了相对于cyp11b2显示高选择性的spect或pet用示踪剂,但它们是以肾上腺为靶标,是否适于心脏中的造影这点并不明确。
另外,尚未获得心脏病患者的心脏局部中cyp11b2的表达是否亢进至能通过核医学诊断来描绘的水平的见解。
本发明是鉴于上述情况而作出的,目的在于提供一种用于非侵入性地检测心脏病的病变的技术。
通过本发明,可提供心脏病的非侵入性影像诊断剂,其包含具有与醛固酮合成酶结合的能力的放射性标记化合物或其盐作为有效成分。
通过本发明,能够非侵入性地检测心脏病的病变。
附图说明
通过以下说明的优选实施方式、及其附带的以下附图进一步说明上述的目的、及其他的目的、特征及优点。
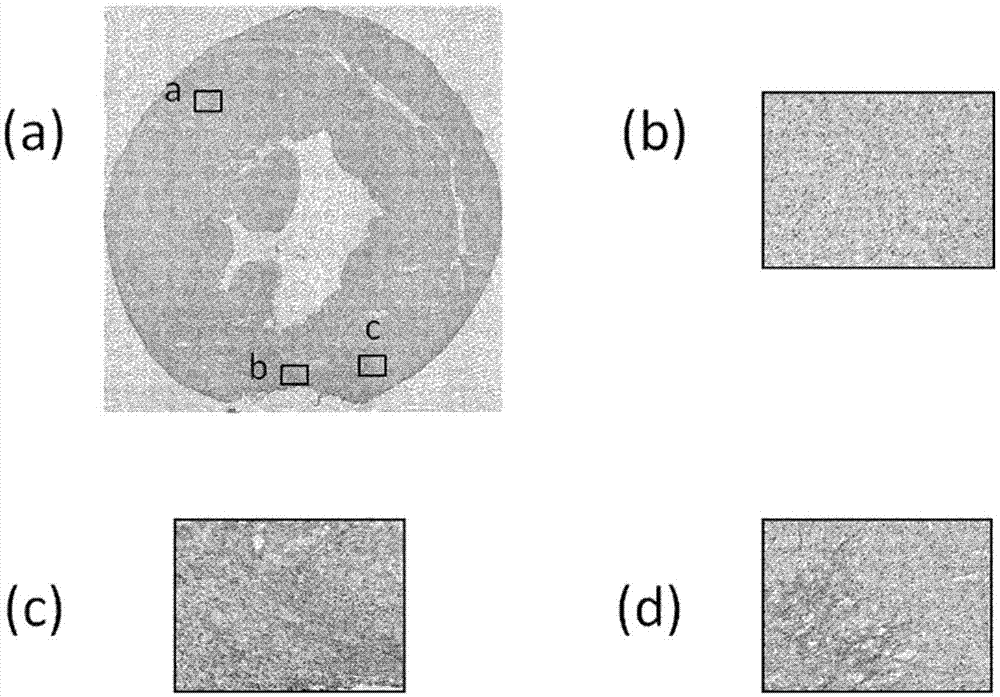
[图1]为表示使用了缺血性心脏病模型大鼠心脏组织切片的cyp11b2的免疫染色的结果的图。(a)为切片的整体图,(b)为非缺血部位的放大图,(c)及(d)为缺血再灌注部位的放大图。
[图2]为表示施予了6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)的个体的放射自显影图的结果的图。(a)为将各切片的放射自显影图从心底部向心尖部排列的图,(b)为使(a)中用虚线包围的放射自显影图旋转90度后的放大图。
[图3]为表示图2(b)所示的心脏组织切片的相邻切片的染色结果的图。(a)为表示he染色的结果的图,(b)为表示masson三色染色的结果的图,(c)为表示cyp11b2的免疫染色的结果的图。
[图4]为表示使用了6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)的体外(invitro)放射自显影的结果的图。(a)为表示将正常大鼠的心脏组织切片浸渍于含有6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)的液体中的结果的图。(b)~(d)为表示将缺血性心脏病模型大鼠的心脏组织切片浸渍于含有6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)的液体中的结果的图。(e)为表示将正常大鼠的心脏组织切片浸渍于含有6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)、及5μmol/l的6-氯-5-氟-1-(2-氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物1)的液体中的结果的图。(f)~(h)为表示将缺血性心脏病模型大鼠的心脏组织切片浸渍于含有6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)、及5μmol/l的6-氯-5-氟-1-(2-氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物1)的液体中的结果的图。
[图5]为表示使用了1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的体外放射自显影的结果的图。(a)为表示将正常大鼠的心脏组织切片浸渍于含有1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的液体中的结果的图。(b)为表示将缺血性心脏病模型大鼠的心脏组织切片浸渍于含有1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的液体中的结果的图。(c)为表示将正常大鼠的心脏组织切片浸渍于含有1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)、及5μmol/l的1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-碘苯并咪唑(化合物2)的液体中的结果的图。(d)为表示将缺血性心脏病模型大鼠的心脏组织切片浸渍于含有1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)、及5μmol/l的1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-碘苯并咪唑(化合物2)的液体中的结果的图。
[图6]为表示使用了1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的缺血性心脏病模型大鼠心脏组织切片的放射自显影及染色的结果的图。(a)为表示放射自显影的结果的图,(b)为表示masson三色染色的结果的图,(c)为表示cyp11b2的免疫染色的结果的图。
[图7]为表示使用了6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)及1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的放射自显影的结果的比较的图。(a)为表示在浸渍于含有6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)的液体中的切片的放射自显影图上设定的roi(感兴趣区域;regionofinterest)的例子的图。(b)为分别以柱状图来表示6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(化合物[18f]1)的缺血再灌注部位的信号强度/非缺血部位的信号强度比的图。(c)为表示在浸渍于含有1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的液体中的切片的放射自显影图上设定的roi的例子的图。(d)为分别以柱状图来表示1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的缺血再灌注部位的信号强度/非缺血部位的信号强度比的图。
[图8]为表示使用了正常大鼠以及缺血性心脏病模型大鼠制作后1天、3天及1周的大鼠心脏的1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的放射自显影及染色的结果的图。(a)为以柱状图来表示缺血再灌注部位的信号强度/非缺血部位的信号强度比的图,(b)为表示masson三色染色的结果的图。
[图9]为将1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(化合物[123i]2)的spect造影影像与计算机断层扫描影像叠合来进行显示的图。(a)为正常大鼠的短轴截面影像,(b)为正常大鼠的水平长轴截面影像,(c)为正常大鼠的垂直长轴截面影像,(d)为缺血性心脏病模型大鼠的短轴截面影像,(e)为缺血性心脏病模型大鼠的水平长轴截面影像,(f)为缺血性心脏病模型大鼠的垂直长轴截面影像。
[图10]为表示使用了心肌炎模型大鼠及正常大鼠的各心脏组织切片的cyp11b2的免疫染色的结果的图。(a)为心肌炎模型大鼠的心脏组织切片的整体图,(b)为(a)的放大图,(c)为正常大鼠的心脏组织切片的整体图,(d)为(c)的放大图。
[图11]为表示2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘-1-甲基-1h-苯并[d]咪唑(化合物[123i]3)的体外放射自显影的结果的图。(a)为表示正常大鼠的心脏组织切片的放射自显影的结果的图,(b)为表示心肌炎模型大鼠的心脏组织切片的放射自显影的结果的图,(c)为表示正常大鼠的心脏组织切片的masson三色染色的结果的图,(d)为表示心肌炎模型大鼠的心脏组织切片的masson三色染色的结果的图,(e)为表示正常大鼠的心脏组织切片的cyp11b2免疫染色的结果的图,(f)为表示心肌炎模型大鼠的心脏组织切片的cyp11b2的免疫染色的结果的图。
[图12]为表示使用了高血压性心脏病模型大鼠及正常大鼠的各心脏组织切片的cyp11b2的免疫染色的结果的图。(a)为高血压性心脏病模型的心脏组织切片的整体图,(b)为(a)的放大图,(c)为正常大鼠的心脏组织切片的整体图,(d)为(c)的放大图。
[图13]为表示2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘-1-甲基-1h-苯并[d]咪唑(化合物[123i]3)的体外放射自显影的结果的图。(a)为表示正常大鼠的心脏组织切片的放射自显影的结果的图,(b)为表示高血压性心脏病模型大鼠的心脏组织切片的放射自显影的结果的图,(c)为表示正常大鼠的心脏组织切片的masson三色染色的结果的图,(d)为表示高血压性心脏病模型大鼠的心脏组织切片的masson三色染色的结果的图,(e)为表示正常大鼠的心脏组织切片的cyp11b2免疫染色的结果的图,(f)为表示高血压性心脏病模型大鼠的心脏组织切片的cyp11b2的免疫染色的结果的图。
[图14]为表示使用了2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘-1-甲基-1h-苯并[d]咪唑(化合物[123i]3)的体外放射自显影的结果的图。(a)为表示将正常大鼠的心脏组织切片浸渍于含有2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘-1-甲基-1h-苯并[d]咪唑(化合物[123i]3)的液体中的结果的图。(b)为表示将缺血性心脏病模型大鼠的心脏组织切片浸渍于含有2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘-1-甲基-1h-苯并[d]咪唑(化合物[123i]3)的液体中的结果的图。
具体实施方式
本发明是包含具有与醛固酮合成酶结合的能力的放射性标记化合物或其盐作为有效成分的、心脏病的非侵入性影像诊断剂。通过本发明的影像诊断剂,能描绘出心脏的纤维化进展的部位。
本发明中,所谓“非侵入性影像诊断剂”,是在核医学诊断中使用的物质,优选为在正电子发射断层扫描(pet)或单光子断层扫描(spect)中使用的物质。
本发明中,所谓“心脏病”,是包括缺血性心脏病和非缺血性心脏病的疾病,优选为由于心脏的纤维化而产生的疾病,作为一例,可举出心力衰竭。
本发明中,所谓“缺血性心脏病”,没有限制,只要是由于心肌缺血而产生的心脏病即可,可举出例如冠状动脉性心脏病心绞痛、心肌梗塞、急性冠状动脉综合征、缺血性心力衰竭等。
另外,本发明中,所谓“非缺血性心脏病”,可举出心肌炎、高血压性心脏病、扩张型心肌病、肥厚型心肌病、非缺血性心力衰竭等。
本发明中,所谓“放射性标记化合物”,没有限制,只要是在核医学诊断中使用的经放射性同位素标记的化合物即可。作为放射性同位素,可举出例如碳-11、氟-18、氯-34m、溴-76、碘-123或碘-124。对于本发明的非侵入性影像诊断剂而言,在使用碳-11、氟-18、氯-34m、碘-124等发射正电子的核素作为放射性同位素的情况下,可作为正电子发射断层扫描用的影像诊断剂使用,在使用碘-123作为放射性卤素原子的情况下,可作为单光子断层扫描用的影像诊断剂使用。
本发明中,所谓“具有与醛固酮合成酶结合的能力”,是指具有与人cyp11b2结合的能力。
本发明中,作为“具有与醛固酮合成酶结合的能力的放射性标记化合物”,没有限制,只要具有与人cyp11b2结合的能力即可,可举出例如美国申请公开2005/0033060号公报、日本特表2009-539822号公报中记载的与肾上腺皮质腺瘤、肾上腺皮质癌具有亲和性的放射性标记化合物、日本特表2013-534911号公报、日本特开2014-129315号公报、日本特开2015-093831号公报、日本特开2015-093832号公报、日本特开2015-093833号公报、日本特开2015-110563号公报、日本特开2015-193545号公报、国际公开2015/199205小册子中记载的具有cyp11b2选择性的放射性标记化合物。另外,可以是将日本特表2013-512271号公报、日本特表2011-520799号公报、日本特表2011-525894号公报、日本特表2012-526774号公报、日本特表2013-510896号公报、日本特表2014-526539号公报、日本特表2014-527077号公报、日本特表2014-533736号公报中记载的化合物的构成元素之一替换成前述的放射性同位素而得到的化合物。
本发明中,优选的放射性标记化合物是国际公开2015/199205小册子中记载的由下述通式(1)表示的化合物。
[化学式1]
上述通式(1)中,r1表示氢原子或co2ra。r2表示氢原子、卤素原子或co2ra。r3表示氢原子或碳原子数为1~10的羟基烷基。r4表示氢原子、羟基或碳原子数为1~10的烷氧基。r5表示氢原子可以被卤素原子取代的碳原子数为1~5的链状烷基、氢原子可以被卤素原子取代的碳原子数为3~5的环状烷基、碳原子数为1~5的羟基烷基、或者邻卤代苄基、对卤代苄基或间卤代苄基。a表示ch或氮原子。x1及x3各自独立地表示氢原子或卤素原子。x2表示氢原子、卤素原子或腈基,x1、x2及x3中的至少1个为卤素原子。
上述通式(1)的放射性标记化合物中,“co2ra”为羧酸酯基。ra各自独立地为碳原子数为1~10的烷基,烷基可以为直链也可以为支链,优选为碳原子数为1~5的烷基(甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基),更优选为碳原子数为1~3的烷基(甲基、乙基、正丙基、异丙基)。作为“co2ra”,特别优选ra为甲基的“羧酸甲酯基”。
另外,上述通式(1)的放射性标记化合物中,所谓“卤素原子”,为氟原子、氯原子、溴原子或碘原子。
另外,上述通式(1)的化合物中,所谓“羟基烷基”,是指-(ch2)moh表示的基团。例如,通式(1)中,r3中,m为1~10的整数,优选为1~3的整数。通式(1)中,r5中,m为1~5的整数,优选为1~3的整数。
另外,上述通式(1)的放射性标记化合物中,所谓“烷氧基”,是指直链或支链的烷基键合于氧原子而成的基团,优选可举出甲氧基、乙氧基、丙氧基、异丙氧基,更优选为甲氧基。
上述通式(1)的放射性标记化合物中,作为“链状烷基”,为非环状烷基,可以为直链状,也可以为支链状,优选可举出甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基。这些链状烷基中的1个或2个以上的氢原子可以被卤素原子取代,优选被氟原子取代。具体而言,可举出氟甲基、1-氟乙基、1,1-二氟乙基、1,1,1-三氟乙基、1-氟丙基。
另外,上述通式(1)的放射性标记化合物中,作为“环状烷基”,可举出环丙基、环丁基、环戊基。这些环状烷基中的1个或2个以上的氢原子可以被卤素原子取代。
另外,上述通式(1)的放射性标记化合物中,所谓“卤代苄基”,是指苄基的苯环的2位、3位、或4位的氢原子被卤素原子取代而得到的基团,2位的氢原子被卤素原子取代而得到的基团是邻卤代苄基,3位的氢原子被卤素原子取代而得到的基团是间卤代苄基,4位的氢原子被卤素原子取代而得到的基团是对卤代苄基。其中,优选对卤代苄基。
上述通式(1)的放射性标记化合物是r2、r5、或x2中的任一个包含放射性卤素原子的化合物,优选为具备以下的(a)、(b)、(c)或(d)的结构的化合物。
(a)r2中,作为卤素原子,使用放射性卤素原子。
(b)使r5为-(ch2)nx4表示的基团,并且,作为x4的卤素原子,使用放射性卤素原子。
(c)使r5为对卤代苄基,并且,作为被导入至苄基的4位的卤素原子,使用放射性卤素原子。
(d)作为x2的卤素原子,使用放射性卤素原子。
此处,所谓“放射性卤素原子”,是指氟-18、氯-34m、溴-76、碘-123或碘-124中的任一种。
更优选的是,上述通式(1)中,r3为氢原子,r4为氢原子或碳原子数为1~10的烷氧基,r5为氢原子可以被卤素原子取代的碳原子数为1~5的链状烷基、碳原子数为3~5的环状烷基、或者邻卤代苄基、对卤代苄基或间卤代苄基,x2为卤素原子,x3为氢原子。r5更优选为甲基、乙基、丙基、异丙基、-(ch2)nx4(其中,n表示1~5的整数,x4表示卤素原子。)表示的基团、环丙基、或对卤代苄基。
另外,进一步优选的是,上述通式(1)中,r2为氢原子或卤素原子。
另外,进一步优选的是,上述通式(1)中,r5为甲基、乙基、-(ch2)nx4表示的基团、或环丙基。-(ch2)nx4表示的基团中,n优选为1~3的整数,更优选为2或3,进一步优选为2。x4优选为氟原子。
作为本发明涉及的化合物的具体方式之一,可举出通式(2)表示的化合物。
[化学式2]
通式(2)中,r12表示氢原子、卤素原子或co2ra,x11表示氢原子或卤素原子,x12表示卤素原子,x14表示氢原子、卤素原子或羟基,n表示1~5的整数。上述通式(2)的放射性标记化合物中,“co2ra”与上述通式(1)中的定义含义相同。
通式(2)表示的化合物为通式(1)中r1为氢原子,r2为氢原子、卤素原子、或co2ra(其中,ra为碳原子数为1~10的烷基),r3、r4为氢原子,r5为碳原子数为1~5的链状烷基、或-(ch2)nx14表示的基团,a为ch,x1为氢原子或卤素原子,x2为卤素原子,x3为氢原子的化合物。通式(2)中,r12可以表示氢原子或co2ra,优选为氢原子。另外,x14优选为氢原子或氟原子,n优选为1~3的整数。
通式(2)中,r12、x12、或x14为放射性卤素原子,优选使x12或x14为放射性卤素原子,更优选r12为氢原子、x12或x14为放射性卤素原子,这种情况下,进一步更优选n为1~3的整数。需要说明的是,放射性卤素原子的定义与前述的定义含义相同。
上述通式(1)及(2)表示的化合物可利用国际公开2015/199205小册子中记载的方法得到。
本发明中,所谓“盐”,只要是作为医药被允许的盐即可。例如,可形成由盐酸、氢溴酸、硫酸、硝酸、磷酸等无机酸、或乙酸、三氟乙酸、马来酸、琥珀酸、苯乙醇酸、富马酸、丙二酸、丙酮酸、草酸、羟基乙酸、水杨酸、吡喃糖苷酸(葡糖醛酸、半乳糖醛酸等)、α-羟基酸(柠檬酸、酒石酸等)、氨基酸(天冬氨酸、谷氨酸等)、芳香族酸(苯甲酸、肉桂酸等)、磺酸(对甲苯磺酸、乙磺酸等)等有机酸衍生的盐。
本发明的非侵入性影像诊断剂是以适于向生物体内施予的形态包含上述的放射性标记化合物或其盐的配方物。该非侵入性影像诊断剂优选以非经口方式、即通过注射来施予,更优选为水溶液。所述组合物可以适当地包含ph调节剂、制药学上被允许的增溶剂、稳定剂或抗氧化剂等追加成分。
实施例
以下,记载实施例,进一步详细地说明本发明,但本发明不受这些内容的限制。
下述实施例中,如下所示地定义供于实验的化合物的名称。
化合物1:6-氯-5-氟-1-(2-氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑
化合物[18f]1:6-氯-5-氟-1-(2-[18f]氟乙基)-2-[5-(咪唑-1-基甲基)吡啶-3-基]苯并咪唑(通式(2)表示的化合物中r12表示氢原子、x11表示氟原子、x12表示氯原子、x14表示氟-18、n表示整数2的化合物)
化合物2:1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-碘苯并咪唑
化合物[123i]2:1-(2-氟乙基)-2-[5-{(咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘苯并咪唑(通式(2)表示的化合物中r12表示氢原子、x11表示氢原子、x12表示碘-123、x14表示氟原子、n表示整数2的化合物)
化合物3:2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-碘-1-甲基-1h-苯并[d]咪唑
化合物[123i]3:2-[5-{(1h-咪唑-1-基)甲基}吡啶-3-基]-6-[123i]碘-1-甲基-1h-苯并[d]咪唑(通式(2)表示的化合物中r12表示氢原子、x11表示氢原子、x12表示碘-123、x14表示氢原子、n表示整数1的化合物)
关于化合物1,按照国际公开2015/199205小册子的化合物100的合成法合成。
关于化合物[18f]1,按照国际公开2015/199205小册子的化合物[18f]100的合成法合成,使用在其公开的tlc条件下放射化学纯度为95%以上的化合物。
关于化合物2,按照国际公开2015/199205小册子的化合物604的合成法合成。
关于化合物[123i]2,按照国际公开2015/199205小册子的化合物[123i]604的合成法合成,使用在其公开的tlc条件下放射化学纯度为95%以上的化合物。
关于化合物3,按照国际公开2015/199205小册子的化合物607的合成法合成。
关于化合物[123i]3,按照国际公开2015/199205小册子的化合物[123i]607的合成法合成,使用在其公开的tlc条件下放射化学纯度为95%以上的化合物。
(实施例1)缺血性心脏病模型大鼠心脏中的cyp11b2表达评价
在异氟烷麻醉下将wistar大鼠(雄)开胸,将左冠状动脉结扎30分钟,然后进行再灌注,关胸,制作缺血性心脏病模型大鼠。在手术后约1周,在麻醉下处死大鼠,将心脏取出,从心底部侧制作5μm厚的切片。使用制作的切片,实施免疫染色,确认了cpy11b2的表达·分布。关于抗cyp11b2抗体,使用了按照ogishimat等,endocrinology,1992,vol.130,pp.2971-7记载的方法制作的抗cyp11b2抗体,二抗使用了抗兔hrp标记聚合物(hrplabelledpolymeranti-rabbit)(dako公司制)。通过针对与二抗结合的hrp而应用dab+(3,3’-二氨基联苯胺四盐酸盐)·底物试剂盒(dako公司制),从而检测cyp11b2表达部位。
将结果示于图1。图1为表示cyp11b2的免疫染色的结果的图。图1(a)为切片的整体图,图1(b)为非缺血部位(图1(a)中的roia)的20倍放大图,图1(c)为缺血再灌注部位(图1(a)中的roib)的20倍放大图,图1(d)为缺血再灌注部位(图1(a)中的roic)的20倍放大图。如图1所示那样,在缺血再灌注部位确认到了cyp11b2表达。另外,确认到在非缺血部位中,cyp11b2未表达或低水平表达。
(实施例2)使用了缺血性心脏病模型大鼠的离体(exvivo)放射自显影
与实施例1同样地,制作缺血性心脏病模型大鼠,在手术后1周至3周之间,施予化合物[18f]1(约50mbq/只)。在施予后20分钟,在麻醉下处死大鼠,将心脏取出,从心底部向心尖部制作20μm厚的冷冻切片。将制作的切片在成像板(imagingplate)(bas-sr2040,fujifilmcorporation制)上暴露2小时,用荧光·图像分析仪(fluoroimageanalyzer,fla-7000,gehealthcare公司制)得到放射自显影图。
另外,使用心底部侧切片的相邻切片,分别实施he染色、masson三色染色、与实施例1同样的cyp11b2的免疫染色。
将施予了化合物[18f]1的个体的结果示于图2~3。图2示出施予了化合物[18f]1的个体的放射自显影图的结果。图2(a)中,将各切片的放射自显影图从心底部向心尖部排列而示出。图2(b)为使图2(a)中用虚线包围的放射自显影图旋转90度后的放大图。另外,图3表示图2(b)所示的切片的相邻切片的染色结果。图3(a)示出he染色的结果,图3(b)示出masson三色染色的结果,图3(c)示出cyp11b2的免疫染色的结果。
如图2所图示那样,确认到了化合物[18f]1的局部聚集。另外,根据图3的染色结果,在与化合物[18f]1的聚集部分对应的位置,确认到了炎症反应、纤维化、cyp11b2的表达。
(实施例3)使用了缺血性心脏病模型大鼠的体外放射自显影
与实施例1同样地,制作缺血性心脏病模型大鼠,在手术后1周至3周之间,在异氟烷麻醉下将大鼠处死,摘取心脏,制作5μm的切片,在-80℃下保存,直至使用。将切片从-80℃恢复至室温,进行30分钟以上干燥,然后,浸渍于磷酸缓冲生理盐水中30分钟,接下来,通过浸渍于含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水中30分钟而进行亲水化。分别制备包含化合物[18f]1(放射性浓度:约40kbq/ml)或化合物[123i]2(放射性浓度:约10kbq/ml)的含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水,将已亲水化的切片在室温下浸渍30分钟。然后,在含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水、磷酸缓冲生理盐水、磷酸缓冲生理盐水的各溶液中各浸渍5分钟,对切片进行洗涤。将洗涤后的切片充分干燥,然后,对于化合物[18f]1而言,在成像板(bas-sr2040,fujifilmcorporation制)上曝光约3小时,对于化合物[123i]2而言,在成像板(bas-sr2040,fujifilmcorporation制)上曝光约16小时,使用荧光·图像分析仪(fla-7000,gehealthcare公司制)得到放射自显影图。
另外,在含有化合物[18f]1及5μmol/l化合物1的液体、或含有化合物[123i]2及5μmol/l化合物2的液体中同样地浸渍切片,得到放射自显影图。
另外,使用从正常大鼠摘取的心脏进行同样的实验。
将化合物[18f]1的结果示于图4。图4(a)、图4(e)为正常大鼠的切片,图4(b)~(d)、(f)~(h)为缺血性心脏病模型大鼠的切片。图4(a)~(d)为浸渍于含有化合物[18f]1的液体中的结果,图4(e)~(h)为浸渍于含有化合物[18f]1及化合物1(5μmol/l)的液体中的结果。如图4所示那样,确认到了化合物[18f]1向病变区域的聚集。另外,由于通过添加过量的非标记化合物从而抑制了聚集,因此表明结合是特异性的。
将化合物[123i]2的结果示于图5。图5(a)、图5(c)为正常大鼠的切片,图5(b)、(d)为缺血性心脏病模型大鼠的切片。图5(a)、(b)为浸渍于含有化合物[123i]2的液体中的结果,图5(c)、(d)为浸渍于含有化合物[123i]2及化合物2(5μmol/l)的液体中的结果。如图5所示那样,确认到了化合物[123i]2向病变区域的聚集。另外,由于通过添加过量的非标记化合物从而抑制了聚集,因此表明结合是特异性的。
对图5(b)的切片也进行了染色。将结果示于图6。图6(a)表示放射自显影的结果。图6(b)表示masson三色染色的结果,图6(c)表示cyp11b2的免疫染色的结果。如图6所图示那样,化合物[123i]2的聚集与纤维化区域充分一致。另外,确认到了cyp11b2在缺血再灌注部位的表达。
关于化合物[18f]1及化合物[123i]2的放射自显影,在缺血再灌注部位及非缺血部位取roi,对各部位的信号强度之比进行比较。将其结果示于图7(n=4)。图7(a)为浸渍于化合物[18f]1中的切片的放射自显影图的一例。图7(c)为浸渍于化合物[123i]2中的切片的放射自显影图的一例。图7(a)、(c)中的用实线包围的区域均为缺血再灌注部位的roi,用虚线包围的区域均为非缺血部位的roi。图7(b)中,用柱状图示出各大鼠中的化合物[18f]1的缺血再灌注部位的信号强度/非缺血部位的信号强度比。图7(d)中,用柱状图示出各大鼠中的化合物[123i]2的缺血再灌注部位的信号强度/非缺血部位的信号强度比。如图7所示那样,确认到了化合物[18f]1及化合物[123i]2在缺血再灌注部位的聚集与非缺血部位相比有所增加。另外,就化合物[123i]2而言,确认到了比化合物[18f]1更高度的聚集。
(实施例4)缺血性心脏病模型大鼠制作后的因时间经过而对化合物聚集产生的影响的研究
与实施例1同样地,制作缺血性心脏病模型大鼠,在手术后1天(3只)、3天(4只)及1周(4只),在异氟烷麻醉下将大鼠处死,摘取心脏,制作5μm的切片,在-80℃下保存,直至使用。将切片从-80℃恢复至室温,进行30分钟以上干燥,然后,浸渍于磷酸缓冲生理盐水中30分钟,接下来,通过浸渍于含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水中30分钟而进行亲水化。制备包含化合物[123i]2(放射性浓度:约10kbq/ml)的含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水,将已亲水化的切片在室温下浸渍30分钟。然后,在含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水、磷酸缓冲生理盐水、磷酸缓冲生理盐水的各溶液中各浸渍5分钟,对切片进行洗涤。将洗涤后的切片充分干燥,然后,在成像板(bas-sr2040,fujifilmcorporation制)上曝光约16小时,使用荧光·图像分析仪(fla-7000,gehealthcare公司制),得到放射自显影图。
另外,使用从正常大鼠(2只)摘取的心脏进行同样的实验。
将结果示于图8。图8(a)为以柱状图来表示使用了正常大鼠以及缺血性心脏病模型大鼠制作后1天、3天及1周的心脏的放射自显影中的、化合物[123i]2的缺血再灌注部位的信号强度/非缺血部位的信号强度比的图。图8(b)示出使用了图8(a)中使用的切片的相邻切片的masson三色染色的结果。如图8(a)所示那样,化合物[123i]2的聚集随着术后的时间经过而增加。另外,如图8(b)所示那样,确认到了伴随术后的时间经过对纤维化的促进。
(实施例5)使用了缺血性心脏病模型大鼠的spect摄影实验
与实施例1同样地,制作缺血性心脏病模型大鼠,在手术后1周,施予化合物[123i]2(约100mbq/只),从施予后150分钟开始,使用动物用spect装置(fx3000,trifoil公司制),实施约8分钟的静态摄影。以143-175kev的能量窗来实施收集,利用osem(orderedsubsetexpectationmaximization,有序子集最大期望值)法对收集的数据进行重建而形成影像。为了确定心脏的位置,实施了计算机断层扫描摄影。另外,使用正常大鼠进行了同样的实验。
将结果示于图9。图9(a)~(c)中,示出使用了正常大鼠的基于化合物[123i]2的spect摄影的结果。图9(a)~(c)中,h的箭头表示心脏,l的箭头表示肝脏。图9(d)~(f)中,示出使用了缺血性心脏病模型大鼠的基于化合物[123i]2的spect摄影的结果。图9(d)~(f)中,i的箭头表示缺血再灌注部位。图9(a)、(d)为短轴截面影像,图9(b)、(e)为水平长轴截面影像,图9(c)、(f)为垂直长轴截面影像。图9的spect影像均与计算机断层扫描影像叠合来进行显示。如图9所示那样,在缺血性心脏病模型大鼠心脏中,确认到了未在正常大鼠心脏中观察到的化合物[123i]2的聚集。
(实施例6)心肌炎模型大鼠心脏中的cyp11b2表达评价
以成为5mg/ml的方式,使用磷酸缓冲液将猪心脏肌球蛋白(porcineheartcardiacmyosin)(sigma-aldrich)稀释(溶液a)。向完全弗氏佐剂(sigma-aldrich)10ml中添加结核菌h37ra(difco)100mg,进行混合(溶液b)。以1:1的比例将溶液a及溶液b混合,直至溶液变得均匀(溶液c)。在异氟烷麻醉下向lewis大鼠(雄,7周龄,日本charlesriver)的左右后肢足跖各施予50μl溶液c。喂养至免疫化后21天,然后在麻醉下处死大鼠,将心脏取出,制作5μm厚的切片。使用制作的切片,实施免疫染色,确认了cpy11b2的表达·分布。关于抗cyp11b2抗体,使用了按照ogishimat等,endocrinology,1992,vol.130,pp.2971-7记载的方法制作的抗cyp11b2抗体,二抗使用了抗兔hrp标记聚合物(hrplabelledpolymeranti-rabbit)(dako公司制)。通过针对与二抗结合的hrp而应用dab+(3,3’-二氨基联苯胺四盐酸盐)·底物试剂盒(dako公司制),从而检测cyp11b2表达部位。另外,使用从对lewis大鼠进行常规喂养后的大鼠(正常大鼠)摘取的心脏进行了同样的实验。
将结果示于图10。图10为表示cyp11b2的免疫染色的结果的图。图10(a)为心肌炎模型的心脏组织切片的整体图,图10(b)为图10(a)中的病变部的40倍放大图。图10(c)为正常大鼠的心脏组织切片的整体图,图10(d)为图10(c)中的正常部的40倍放大图。如图10所示那样,在心肌炎模型大鼠的心脏中,确认到了cyp11b2表达。另外,确认到在正常大鼠的心脏中,cyp11b2未表达或低水平表达。
(实施例7)使用了心肌炎模型大鼠的体外放射自显影
与实施例6同样地,制作心肌炎模型大鼠,摘取心脏,制作5μm的切片,在-80℃下保存,直至使用。将切片从-80℃恢复至室温,进行30分钟以上干燥,然后,浸渍于磷酸缓冲生理盐水中30分钟,接下来,通过浸渍于含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水中30分钟而进行亲水化。分别制备包含化合物[123i]3(放射性浓度:约10kbq/ml)的含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水,将已亲水化的切片在室温下浸渍30分钟。然后,在含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水、磷酸缓冲生理盐水、磷酸缓冲生理盐水的各溶液中各浸渍5分钟,对切片进行洗涤。将洗涤后的切片充分干燥,然后,在成像板(bas-sr2040,fujifilmcorporation制)上将化合物[123i]3曝光约16小时,使用荧光·图像分析仪(fla-7000,gehealthcare公司制),得到放射自显影图。另外,使用从正常大鼠摘取的心脏进行了同样的实验。使用放射自显影中使用的切片的相邻切片,分别实施masson三色染色、与实施例6同样的cyp11b2的免疫染色。
将化合物[123i]3的体外放射自显影的结果示于图11。图11(a)示出正常大鼠的心脏组织切片的放射自显影的结果,图11(b)示出心肌炎模型大鼠的心脏组织切片的放射自显影的结果。图11(c)示出正常大鼠的心脏组织切片的masson三色染色的结果,图11(d)示出心肌炎模型大鼠的心脏组织切片的masson三色染色的结果。图11(e)示出正常大鼠的心脏组织切片的cyp11b2免疫染色的结果,图11(f)示出心肌炎模型大鼠的心脏组织切片的cyp11b2的免疫染色的结果。如图11所图示那样,在心肌炎模型大鼠的心脏组织切片中,确认到了化合物[123i]3的聚集与正常大鼠的心脏组织切片相比有所增加。另外,化合物[123i]3的聚集与纤维化区域充分一致,确认到了cyp11b2在纤维化区域中的表达。
(实施例8)高血压性心脏病模型大鼠心脏中的cyp11b2表达评价
对dis/eis(dahl-iwais)大鼠(雄,japanslc)从5周龄起饲喂添加有8%食盐的饲料(orientalyeastco.,ltd.),喂养至11周龄后,在麻醉下处死大鼠,将心脏取出,制作5μm厚的切片。使用制作的切片,实施免疫染色,确认cpy11b2的表达·分布。关于抗cyp11b2抗体,使用了按照ogishimat等,endocrinology,1992,vol.130,pp.2971-7记载的方法制作的抗cyp11b2抗体,二抗使用了抗兔hrp标记聚合物(hrplabelledpolymeranti-rabbit)(dako公司制)。通过针对与二抗结合的hrp而应用dab+(3,3’-二氨基联苯胺四盐酸盐)·底物试剂盒(dako公司制),从而检测cyp11b2表达部位。另外,使用从用未添加食盐的饲料喂养dis/eis大鼠后的大鼠(正常大鼠)摘取的心脏进行了同样的实验。
将结果示于图12。图12为表示cyp11b2的免疫染色的结果的图。图12(a)为高血压性心脏病模型大鼠的心脏组织切片的整体图,图12(b)为图12(a)中的病变部的40倍放大图。图12(c)为正常大鼠的心脏组织切片的整体图,图12(d)为图12(c)中的正常部的40倍放大图。如图12所示那样,在高血压性心脏病模型大鼠心脏中,确认到了cyp11b2表达。另外,确认到在正常大鼠中,cyp11b2未表达或低水平表达。
(实施例9)使用了高血压性心脏病模型大鼠的体外放射自显影
与实施例8同样地,制作高血压性心脏病模型大鼠,摘取心脏,制作5μm的切片,在-80℃下保存,直至使用。将切片从-80℃恢复至室温,进行30分钟以上干燥,然后,浸渍于磷酸缓冲生理盐水中30分钟,接下来,通过浸渍于含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水中30分钟而进行亲水化。分别制备包含化合物[123i]3(放射性浓度:约10kbq/ml)的含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水,将已亲水化的切片在室温下浸渍30分钟。然后,在含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水、磷酸缓冲生理盐水、磷酸缓冲生理盐水的各溶液中各浸渍5分钟,对切片进行洗涤。将洗涤后的切片充分干燥,然后,在成像板(bas-sr2040,fujifilmcorporation制)上将化合物[123i]3曝光约16小时,使用荧光·图像分析仪(fla-7000,gehealthcare公司制),得到放射自显影图。另外,使用从正常大鼠摘取的心脏进行了同样的实验。使用放射自显影中使用的切片的相邻切片,分别实施masson三色染色、与实施例8同样的cyp11b2的免疫染色。
将化合物[123i]3的体外放射自显影的结果示于图13。图13(a)示出正常大鼠的心脏组织切片的放射自显影的结果,图13(b)示出高血压性心脏病模型大鼠的心脏组织切片的放射自显影的结果。图13(c)示出正常大鼠的心脏组织切片的masson三色染色的结果,图13(d)示出高血压性心脏病模型大鼠的心脏组织切片的masson三色染色的结果。图13(e)示出正常大鼠的心脏组织切片的cyp11b2免疫染色的结果,图13(f)示出高血压性心脏病模型大鼠的心脏组织切片的cyp11b2的免疫染色的结果。如图13所图示那样,在高血压性心脏病模型大鼠的心脏组织切片中,确认到了化合物[123i]3的聚集与正常大鼠的心脏组织切片相比有所增加。另外,化合物[123i]3的聚集与纤维化区域充分一致,确认到了cyp11b2在纤维化区域中的表达。
(实施例10)使用了缺血性心脏病模型大鼠的体外放射自显影
与实施例1同样地,制作缺血性心脏病模型大鼠,在手术后1周内,在异氟烷麻醉下将大鼠处死,摘取心脏,制作5μm的切片,在-80℃下保存,直至使用。将切片从-80℃恢复至室温,进行30分钟以上干燥,然后,浸渍于磷酸缓冲生理盐水中30分钟,接下来,通过浸渍于含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水中30分钟而进行亲水化。分别制备包含化合物[123i]3(放射性浓度:约10kbq/ml)的含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水,将已亲水化的切片在室温下浸渍30分钟。然后,在含有1w/v%牛血清白蛋白的磷酸缓冲生理盐水、磷酸缓冲生理盐水、磷酸缓冲生理盐水的各溶液中各浸渍5分钟,对切片进行洗涤。将洗涤后的切片充分干燥,然后,在成像板(bas-sr2040,fujifilmcorporation制)上进行约16小时曝光,使用荧光·图像分析仪(fla-7000,gehealthcare公司制),得到放射自显影图。另外,使用从正常大鼠摘取的心脏进行了同样的实验。
将结果示于图14。图14(a)为将正常大鼠的切片浸渍于含有化合物[123i]3的液体中的结果,图14(b)为将缺血性心脏病模型大鼠的切片浸渍于含有化合物[123i]3的液体中的结果。如图14所示那样,确认到了化合物[123i]3在病变区域的聚集与正常大鼠相比有所增加。
由以上的结果表明,利用具有与醛固酮合成酶结合的能力的放射性标记化合物,能在心脏病患者中进行纤维化进展等心肌重构过程的核医学诊断。
本申请主张以于2016年6月10日提出申请的日本申请特愿2016-115806号为基础的优先权,将其全部公开内容并入本文。
- 还没有人留言评论。精彩留言会获得点赞!