缀合的C1酯酶抑制剂及其用途的制作方法
本申请要求于2016年4月4日提交的美国临时申请号62/318,003的优先权和权益,其全部内容据此以引用方式并入本文。
背景技术:
c1抑制剂(c1-inh)也称为c1酯酶抑制剂,是丝氨酸蛋白酶抑制剂蛋白超家族中的最大成员。它是重度糖基化的丝氨酸蛋白酶抑制剂,具有抑制补体系统的自发活化的主要功能。c1-inh调节补体级联系统,在调节接触(激肽释放酶-激肽)扩增级联中起关键作用,并且参与凝血和纤维蛋白溶解系统的调节。karnaukhova,e.,c1-esteraseinhibitor:biologicalactivitiesandtherapeuticapplications.jhematolthrombdis,1:113(2013)。
由于c1-inh不能抑制补体系统的活化,所以受试者中c1-inh的功能障碍和/或缺陷已与各种自身免疫性疾病相关联。这种疾病的一个实例是遗传性血管性水肿(hae),这是一种罕见的但可能危及生命的病症,其特征在于炎症的无法预测和反复发作。hae发作的症状包括自然发生或由轻度创伤引发的面部、口和/或气道的肿胀。这种肿胀也可在身体的任何部位发生。在某些情况下,hae与c1抑制剂的低血浆水平相关,而在其他情况下,蛋白以正常或升高的量循环,但它是功能失调的。除炎症发作之外,它还可导致更严重或危及生命的适应症,如自身免疫性疾病或红斑狼疮。
仍然需要改良的c1酯酶抑制剂来治疗和预防各种c1酯酶介导的适应症。
技术实现要素:
本发明尤其提供了改良的长效c1酯酶抑制剂,其可用于有效治疗各种补体介导的病症,包括hae。
具体地讲,本发明提供了表现出与血浆来源的c1-inh相当或甚至更长的半衰期的c1酯酶抑制剂缀合物(也称为“缀合的c1酯酶抑制剂”)。本发明部分基于以下令人惊讶的发现:peg化和聚唾液酸化的c1-inh可具有延长(例如,至少4天)的血清半衰期。考虑了缀合的c1-inh的长血清半衰期导致优异的体内功效并且允许优选的给药方案和施用途径。例如,本文所述的缀合的c1-inh可以与目前批准的c1-inh治疗剂相比降低的频率皮下或静脉内施用而仍实现所需的功效(例如,预防)。本文所述的缀合的c1抑制剂蛋白可使用血浆来源或重组产生的c1-inh来制备。因此,本文所述的缀合的c1-inh可以按具有成本效益的方式制造并且不依赖于血液供应。因为它们可以在培养细胞中重组产生,所以它们在生产和最终产品方面比从人血液、人血液成分(例如,血浆)或动物乳中纯化的那些产品提供更好的一致性。因此,本发明提供了用于治疗hae和其他补体介导的病症的更安全、更有效的缀合的c1酯酶抑制剂。
在一个方面,本发明提供了缀合的c1-inh,其包含c1-inh蛋白和至少一个与c1-inh蛋白共价连接的peg部分。在一些实施方案中,c1-inh蛋白包含至少一个聚糖残基,并且该至少一个peg部分与该至少一个聚糖残基共价连接。在一些实施方案中,该至少一个peg部分通过肟键与c1-inh蛋白共价连接。
在一些实施方案中,该至少一个peg部分与c1-inh的聚糖残基或胺基形成共价肟键。在一些实施方案中,该至少一个peg部分与聚糖残基形成共价肟键。在一些实施方案中,该至少一个peg部分与c1-inh的胺基形成共价肟键。
在一些实施方案中,该聚糖残基是c1-inh的唾液酸残基或半乳糖残基。在一些实施方案中,该聚糖残基是唾液酸残基。
在一些实施方案中,适合于本发明的c1-inh蛋白是重组产生或血浆来源的。
在一些实施方案中,c1-inh蛋白包括c1-inh结构域,其具有与seqidno:1、seqidno:2、seqidno:37或seqidno:38至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同的氨基酸序列。
在一些实施方案中,c1-inh蛋白是融合蛋白。在一些实施方案中,融合蛋白包括直接或间接与c1-inh结构域融合的fc结构域。在一些实施方案中,fc结构域衍生自igg1。在一些实施方案中,fc结构域包含对应于根据eu编号的l234a和l235a的氨基酸置换。在一些实施方案中,fc结构域在对应于igg1的根据eu编号的thr250、met252、ser254、thr256、thr307、glu380、met428、his433和/或asn434的位置处包含一个或多个氨基酸置换。
在一些实施方案中,融合蛋白包括直接或间接与c1-inh结构域融合的白蛋白结构域。
在一些实施方案中,本发明提供了一种c1-inh蛋白,其具有包含不超过约50%(例如,不超过45%、40%、35%、30%、25%、20%、15%、10%或5%)的中性聚糖种类的糖基化谱。
在一些实施方案中,本发明提供了一种c1-inh蛋白,其具有包含约5%至约25%的中性聚糖种类的糖基化谱。
在一些实施方案中,本发明提供了一种c1-inh蛋白,其平均每个分子包含至少约30%(例如,至少35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)的带电聚糖。
在一些实施方案中,c1-inh蛋白含有少于约20%(例如,少于15%、10%或5%)的甘露糖、α-半乳糖、ngna或寡甘露糖型糖基化中的一种或多种。
在一些实施方案中,c1-inh蛋白具有包含下述项中的一种或多种的糖基化谱:约5%至约30%的中性聚糖种类、约10%至约30%的单唾液酸化聚糖种类、约30%至约50%的二唾液酸化聚糖种类、约15%至约35%的三唾液酸化聚糖种类、或约5%至约15%的四唾液酸化聚糖种类。
在一些实施方案中,c1-inh蛋白具有包含下述项的糖基化谱:不超过30%的中性聚糖种类、约20%至约30%的单唾液酸化聚糖种类、约30%至约40%的二唾液酸化聚糖种类、约10%至约20%的三唾液酸化聚糖种类、以及约5%至约10%的四唾液酸化聚糖种类。
在一些实施方案中,c1-inh蛋白平均每个分子包含至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个唾液酸化的聚糖残基。
在一些实施方案中,c1-抑制剂多肽平均每摩尔蛋白包含至少约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40摩尔唾液酸。
在一些实施方案中,本文所述的具有糖基化谱的c1-inh蛋白是融合蛋白。在某些实施方案中,本文所述的具有糖基化谱的c1-inh蛋白是未缀合的蛋白。
在一些实施方案中,与c1-inh蛋白缀合的peg的分子量为约1kda至50kda、约1kda至40kda、约5kda至40kda、约1kda至30kda、约1kda和25kda、约1kda和20kda、约1kda和15kda、约1kda和10kda或约1kda和5kda。在一些实施方案中,与c1-inh蛋白缀合的peg的分子量为或大于约1kda、2kda、3kda、4kda、5kda、10kda、15kda、20kda、25kda、30kda、35kda、40kda、45kda或50kda。在一些实施方案中,与c1-inh蛋白缀合的peg具有直链或支链结构。在一些实施方案中,支链peg部分可具有2、3、4或5个臂分支。
在一些实施方案中,缀合的c1-inh具有约1至约25、约1至约20、约1至约15、1至约10、或约1至约5的peg/c1-inh比。
在一些实施方案中,缀合的c1-inh具有与血浆来源的人c1-inh蛋白相当或更大的半衰期。在一些实施方案中,缀合的c1-inh的半衰期在血浆来源的c1-inh蛋白的半衰期的100%-500%的范围内。在一些实施方案中,缀合的c1-inh蛋白的半衰期为至少约70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165或170小时。
在一些实施方案中,缀合的c1-inh的半衰期为至少约3、4、5、6、7、8、9、10、11、12、13或14天。
在一些实施方案中,缀合的c1-inh的比活性在血浆来源的人c1-inh蛋白的比活性的50%-150%范围内。
另一方面,本发明提供了制备缀合的c1酯酶抑制剂(c1-inh)的方法,包括以下步骤:提供包含至少一个聚糖残基和/或至少一个胺基的c1-inh蛋白,并在允许peg部分与该至少一个聚糖残基和/或该至少一个胺基反应的条件下提供peg部分以形成键,从而产生缀合的c1-inh。
在一些实施方案中,该peg部分包含peg-ch2-o-nh2。在一些具体实施方案中,该至少一个聚糖残基是唾液酸残基。在另外的实施方案中,该至少一个聚糖残基是半乳糖残基。
在一些实施方案中,本文所述的方法还包括在与peg部分反应之前氧化该至少一个聚糖残基的步骤。在一些实施方案中,氧化步骤包括使用高碘酸盐氧化。在一些实施方案中,高碘酸盐氧化在高碘酸盐与c1-inh的摩尔比为约20:1至约50:1的条件下进行。在一些实施方案中,高碘酸盐与peg的摩尔比为约2.5至约40。在一些实施方案中,peg与c1-inh的摩尔比为25:1至100:1。
在另外的实施方案中,本方法还包括纯化缀合的c1-inh的步骤。在一些实施方案中,纯化步骤包括阴离子交换、切向流过滤、渗滤和透析中的一种或多种。
在另外的方面,本发明提供了药物组合物,其包含缀合的c1酯酶抑制剂(c1-inh)和药学上可接受的载体。
在一些实施方案中,包含缀合的c1-inh的药物组合物是液体。在其他实施方案中,包含缀合的c1-inh的药物组合物被冻干。
在另一个方面,本发明提供了试剂盒,其包含含有缀合的c1-inh的药物组合物(例如,呈液体和冻干形式)。在一些实施方案中,该试剂盒含有注射器。在一些实施方案中,该注射器预装载有包含缀合的c1-inh的药物组合物。
在一些实施方案中,其中该药物组合物被冻干,该试剂盒还包含复溶缓冲液。
在另一方面,本发明提供了治疗补体介导的病症的方法,包括向需要治疗的受试者施用缀合的c1酯酶抑制剂(c1-inh)的药物组合物。
在相关的方面,本发明提供了包含缀合的c1-酯酶抑制剂(c1-inh)的组合物在制造用于治疗补体介导的病症的药剂中的用途。
在一些实施方案中,补体介导的病症选自遗传性血管性水肿、抗体介导的排斥、视神经脊髓炎谱系疾病、创伤性脑损伤、脊髓损伤、缺血性脑损伤、烧伤、中毒性表皮坏死松解症、多发性硬化、肌萎缩性侧索硬化(als)、帕金森氏病、中风、慢性炎性脱髓鞘性多发性神经病(cidp)、重症肌无力和/或多灶性运动神经病。
在一些实施方案中,本发明提供了包含缀合的c1酯酶抑制剂(c1-inh)的组合物,该缀合的c1酯酶抑制包含:包含至少一个聚糖残基的c1-inh蛋白;至少一个聚唾液酸(psa)部分。在一些实施方案中,该至少一个聚唾液酸(psa)部分与该至少一个聚糖残基共价连接。
另一方面,本发明提供了包含缀合的c1酯酶抑制剂(c1-inh)的组合物,该缀合的c1酯酶抑制剂包含:包含至少一个聚糖残基的c1-inh蛋白;和至少一个聚唾液酸(psa)部分。在一些实施方案中,该至少一个聚唾液酸(psa)部分通过肟键或腙键与c1-inh蛋白共价连接。在一些实施方案中,该聚唾液酸(psa)部分通过肟键与c1-inh蛋白共价连接。在一些实施方案中,该聚唾液酸(psa)部分通过肟键与c1-inh蛋白共价连接。在一些实施方案中,肟键位于psa部分与c1-inh的聚糖残基或胺基之间。
在一些实施方案中,该聚糖残基是唾液酸残基。
在一些实施方案中,c1-inh蛋白是重组产生或血浆来源的。
在一些实施方案中,c1-inh蛋白包含c1-inh结构域,其具有与seqidno:1、seqidno:2、seqidno:37或seqidno:38至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
在一些实施方案中,c1-inh蛋白是融合蛋白。在一些实施方案中,融合蛋白可包含直接或间接与c1-inh结构域融合的fc结构域。在一些实施方案中,fc结构域可衍生自igg1。在一些实施方案中,fc结构域可包含对应于根据eu编号的l234a和l235a的氨基酸置换。在一些实施方案中,融合蛋白可包含直接或间接与c1-inh结构域融合的白蛋白结构域。
在一些实施方案中,在peg化之前,c1-inh蛋白具有包含不超过约50%、45%、40%、35%、30%、25%、20%、15%、10%或5%的中性聚糖种类的糖基化谱。
在一些实施方案中,在peg化之前,c1-inh蛋白具有包含约5%至约25%的中性聚糖种类的糖基化谱。
在一些实施方案中,c1-inh蛋白平均每个分子包含至少约30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的带电聚糖。
在一些实施方案中,在与psa缀合之前,c1-inh蛋白包含少于约20%、15%、10%或5%的甘露糖、α-半乳糖、ngna或低聚甘露糖型糖基化中的一种或多种。
在一些实施方案中,在与psa缀合之前,c1-inh蛋白具有包含下述项中的一种或多种的糖基化谱:约5%至约30%的中性聚糖种类、约10%至约30%的单唾液酸化聚糖种类、约30%至约50%的二唾液酸化聚糖种类、约15%至约35%的三唾液酸化聚糖种类、或约5%至约15%的四唾液酸化聚糖种类。
在一些实施方案中,在与psa缀合之前,c1-inh蛋白具有包含下述项的糖基化谱:不超过30%的中性聚糖种类、约20%至约30%的单唾液酸化聚糖种类、约30%至约40%的二唾液酸化聚糖种类、约10%至约20%的三唾液酸化聚糖种类、以及约5%至约10%的四唾液酸化聚糖种类。
在一些实施方案中,c1-inh蛋白平均每个分子包含至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个唾液酸化的聚糖残基。
在一些实施方案中,c1-inh蛋白平均每摩尔蛋白包含至少约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40摩尔唾液酸
在一些实施方案中,psa的分子量为约1kda至50kda、约1kda至40kda、约5kda至40kda、约1kda至30kda、约1kda至25kda、约1kda至20kda、约1kda至15kda、约1kda至10kda或约1kda至5kda。
在一些实施方案中,psa的分子量为约1kda、5kda、10kda、15kda、20kda、25kda、30kda、35kda、40kda、45kda或50kda。
在一些实施方案中,缀合的c1-inh具有约1至约25、约1至约20、约1至约15、约1至约10或约1至约5的psa/c1-inh比。
在一些实施方案中,缀合的c1-inh具有与血浆来源的人c1-inh相当或更大的半衰期。
在一些实施方案中,缀合的c1-inh的半衰期在血浆来源的c1-inh的半衰期的100%-500%范围内。
在一些实施方案中,缀合的c1-inh的半衰期为至少约70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165或170小时。
在一些实施方案中,缀合的c1-inh的半衰期为至少约3、4、5、6、7、8、9、10、11、12、13或14天。
在一些实施方案中,缀合的c1-inh的比活性在血浆来源的人c-inh的比活性的50%-150%范围内。
另一方面,本发明提供了一种制备缀合的c1酯酶抑制剂(c1-inh)的方法。在一些实施方案中,该方法包括以下步骤:提供包含至少一个聚糖残基和/或至少一个胺基的c1-inh蛋白;在允许聚唾液酸(psa)部分与该至少一个聚糖残基和/或该至少一个胺基反应的条件下提供psa部分以形成键,从而产生缀合的c1-inh。在一些实施方案中,该至少一个聚糖残基是唾液酸残基。
在一些实施方案中,该方法还包括在与psa部分反应之前氧化该至少一个聚糖残基的步骤。在一些实施方案中,氧化步骤包括高碘酸盐氧化。在一些实施方案中,高碘酸盐氧化可以在高碘酸盐与c1-inh的摩尔比为约20:1至约50:1的条件下进行。在一些实施方案中,高碘酸盐与psa的摩尔比可以为约2.5至约40。
在一些实施方案中,psa与c1-inh的摩尔比为约25:1至100:1。
在一些实施方案中,该方法还包括纯化缀合的c1-inh的步骤。
在一些实施方案中,纯化步骤包含阴离子交换、切向流过滤渗滤和透析中的一种或多种。
另一方面,本发明提供了通过上述方面或实施方案的方法制备的缀合的c1酯酶抑制剂(c1-inh)。
在另一方面,本发明提供了药物组合物,其包含上述方面或实施方案的缀合的c1酯酶抑制剂(c1-inh)和药学上可接受的载体。在一些实施方案中,该药物组合物的组分是液体。在一些实施方案中,该药物组合物的组分被冻干。
在一个方面,本发明提供了试剂盒,其包含上述方面或实施方案的药物组合物和注射器。在一些实施方案中,该注射器预装载有药物组合物。在一些实施方案中,该药物组合物被冻干,并且该试剂盒还包含复溶缓冲液。
在另一方面,本发明提供了治疗补体介导的病症的方法,其包括向需要治疗的受试者施用上述方面或实施方案的药物组合物。在一些实施方案中,补体介导的病症选自遗传性血管性水肿、抗体介导的排斥、视神经脊髓炎谱系疾病、创伤性脑损伤、脊髓损伤、缺血性脑损伤、烧伤、中毒性表皮坏死松解症、多发性硬化、肌萎缩性侧索硬化(als)、帕金森氏病、中风、慢性炎性脱髓鞘性多发性神经病(cidp)、重症肌无力、多灶性运动神经病。
在另外的方面,本发明提供了包含上述方面或实施方案的缀合的c1-酯酶抑制剂的组合物在制造用于治疗补体介导的病症的药剂中的用途。在一些实施方案中,补体介导的病症选自遗传性血管性水肿、抗体介导的排斥、视神经脊髓炎谱系疾病、创伤性脑损伤、脊髓损伤、缺血性脑损伤、烧伤、中毒性表皮坏死松解症、多发性硬化、肌萎缩性侧索硬化(als)、帕金森氏病、中风、慢性炎性脱髓鞘性多发性神经病(cidp)、重症肌无力和/或多灶性运动神经病。
本发明的其他特征、目的和优点在随后的详细描述中是显而易见的。然而,应该理解,虽然指出了本发明的实施方案,但该详细描述仅作为说明而不是限制给出。根据详细描述,在本发明的范围内的各种改变和修改对于本领域技术人员将变得显而易见。
附图说明
附图仅用于说明性目的,而不是限制。
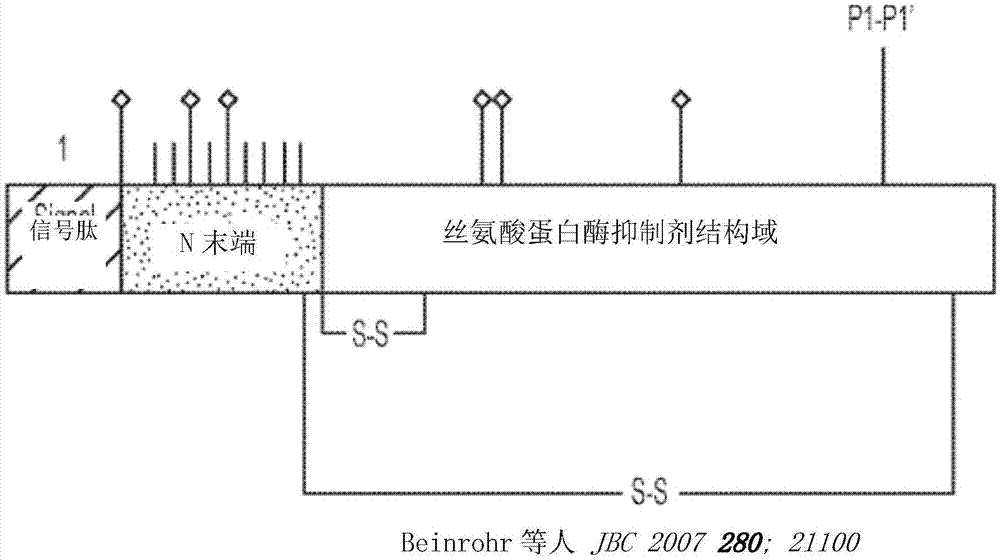
图1是c1-inh的示意图。从左到右,三个结构域是信号肽、n-末端(也称为n-末端结构域)和丝氨酸蛋白酶抑制剂结构域。n-联聚糖显示为具有菱形头部的长垂直线,并且o-联聚糖显示为短垂直线。
图2描绘了成熟的c1-inh氨基酸序列和peg化的潜在位点。
图3描绘了描绘示例性胺介导的peg化的化学方程的示意图。
图4a是描绘示例性聚糖介导的氨氧基peg化的化学方程的示意图。图4b是描绘示例性唾液酸介导(sam)的氨氧基peg化的化学方程的示意图。
图5描绘了描绘示例性半乳糖介导(gam)的peg化的化学方程的示意图。
图6(a图和b图)描绘了与唾液酸相比通过氨基进行的c1-inhpeg化(5kda或40kda)的初步大鼠研究结果。提供了rhc1-inh和cinryze作为比较物。图c描绘了用5kda或40kda的peg进行c1-inhpeg化的sds-page凝胶。
图7描绘了示例性peg化过程a的示意图。
图8描绘了示例性peg化过程b的示意图。
图9a-e描绘了汇总适用于peg化c1-inh的几种示例性peg化方案的示意图。
图10a描绘了5ksamkhr5辛基载荷样品的c1-inh-pegic50。图10b描绘了在通过tff去除游离peg之前和之后的c1-inh-pegic50。
图11描绘了从游离peg和其他污染物中纯化的示例性40kdapeg化c1-inh的色谱结果。
图12描绘了从游离peg和其他污染物中纯化的示例性20kdapeg化c1-inh的色谱结果。
图13描绘了从游离peg和其他污染物中纯化的示例性5kdapeg化c1-inh的色谱结果。
图14描绘了iv施用peg化rhc1inh与rhc1inh的非人灵长类动物(nhp)pk研究的结果。
图15描绘了nhppk研究的结果,其中向nhp施用不同的c1-inh-peg载荷。
图16描绘了iv与sc施用peg化rhc1-inh的nhp研究结果。
图17描绘了具有各种5kpeg载荷的c1-inh-peg样品的大鼠pk滴定分析的结果。
图18(a-e图)描绘了一系列凝胶和曲线图,它们描绘了c1-inh-peg的纯度。a图和b图是用于检测c1-inh-peg样品中游离peg的碘化钡(barium-iodine)染色的sds-page凝胶。c图和d图是用于检测c1-inh-peg样品中游离peg1k和peg2k的rp-hplc曲线图。e图描绘了两个荷载有c1-inh样品的sds-page凝胶。
图19(a-c图)描绘了一系列曲线图和凝胶,它们描绘了通过sam过程缀合的c1-inh-peg样品的纯度、ic50和pk数据。a图是各种c1-inh样品的ic50曲线图。b图是描绘了c1-inh样品纯度和相关的c1-inh样品ic50值的sds-page凝胶。c图是描绘了来自大鼠研究的pk值的曲线图,其中大鼠接受静脉内c1-inh-peg和未peg化的c1-inh。
图20(a、b和c图)描绘了一系列描绘c1-inhic50值的曲线图。
图21描绘了用于c1-inh的示例性胺偶联peg化过程的示意图。
图22(a-d图)描绘了一系列凝胶和曲线图,它们描绘了c1-inh-peg的纯度。a图是用于检测c1-inh-peg样品中游离peg的碘化钡染色的sds-page凝胶。b图描绘了用于检测游离peg1k和peg2k的rp-hplc曲线图。c图和d图描绘了游离nhs-peg20k(c图)和nhs-peg40k(d图)的纯化色谱图。
图23(a-c图)描绘了一系列曲线图和凝胶,它们描绘了c1-inh样品的纯度、ic50和pk数据。a图是各种c1-inh样品的ic50曲线图。b图是描绘了来自大鼠研究的pk值的曲线图,其中大鼠接受静脉内c1-inh-peg和未peg化的c1-inh。c图是描绘了c1-inh样品纯度和相关的c1-inh样品ic50值的sds-page凝胶。
图24(a图和b图)描绘了凝胶和曲线图,它们描绘了通过唾液酸介导(sam)的过程制备的c1-inh-psa的纯度。a图是sds凝胶,b图是c1-inh-psa的ic50曲线图。
图25(a、b和c图)描绘了一系列示出来自大鼠研究的pk值的曲线图,其中大鼠接受静脉内c1-inh-peg、c1-inh-psa、cinryze-peg、c1-inh或cinryze。
定义
为了使本发明更容易理解,首先在下文定义了某些术语。下述术语和其他术语的另外定义在说明书各处阐述。
动物:如本文使用的,术语“动物”指动物界的任何成员。在一些实施方案中,“动物”指处于任何发育阶段的人。在一些实施方案中,“动物”指处于任何发育阶段的非人动物。在某些实施方案中,非人动物是哺乳动物(例如啮齿类动物、小鼠、大鼠、兔、猴、犬、猫、绵羊、牛、灵长类动物和/或猪)。在一些实施方案中,动物包括但不限于哺乳动物、鸟类、爬行动物、两栖动物、鱼类、昆虫和/或蠕虫。在一些实施方案中,动物可以为转基因动物、基因工程改造的动物和/或克隆。
大约或约:如本专利申请中使用的,术语“约”和“大约”作为等价物使用。本专利申请中以及或不以及约/大约使用的任何数字意欲涵盖由相关领域的普通技术人员了解的任何正常波动。如本文使用的,当应用于一个或多个目的值时,术语“大约”或“约”指与所述参考值相似的值。在某些实施方案中,术语“大约”或“约”指落入所述值任一方向(大于或小于)中的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的一系列值,除非另有说明或从上下文中另外显而易见的(除非该数字超过可能值的100%)。
生物利用率:如本文使用的,术语“生物利用率”一般指达到受试者血流的施用剂量的百分比。
生物活性的:如本文使用的,短语“生物活性的”指在生物系统中,且特别是在生物体中具有活性的任何试剂的特征。例如,当施用于生物时,对该生物体具有生物效应的试剂视为生物活性的。在特定实施方案中,当肽是生物活性的情况下,共享肽的至少一种生物活性的该肽的一部分通常被称为“生物活性”部分。
载体或稀释剂:如本文使用的,术语“载体”或“稀释剂”指用于制备药物制剂的药学上可接受(例如,对于人类施用安全和无毒)的载体或稀释物质。示例性稀释剂包括无菌水、注射用抑菌水(bwfi)、ph缓冲溶液(例如磷酸缓冲盐溶液)、无菌盐水溶液、林格溶液或右旋糖溶液。
c1抑制剂或c1酯酶抑制剂或c1-inh:如本文使用的,除非另有说明,否则术语“c1-抑制剂”或“c1酯酶抑制剂”或“c1-inh”可全部互换使用,并且指保留c1-inh基本生物活性的任何野生型、天然、天然存在、重组产生和/或经修饰的c1-inh蛋白(例如,具有一个或多个氨基酸突变、缺失、截短、插入的c1-inh蛋白和/或融合蛋白)。“c1-抑制剂”或“c1酯酶抑制剂”或“c1-inh”可以是融合蛋白。在一些实施方案中,c1-inh融合蛋白包含c1-inh多肽或结构域和fc结构域。在一些实施方案中,c1-inh融合蛋白包含c1-inh多肽或结构域和白蛋白结构域。在一些实施方案中,融合蛋白还包含接头。c1-inh蛋白可以在重组细胞中重组表达。在某些实施方案中,c1-inh在哺乳动物细胞(优选cho细胞)或人细胞(优选ht1080或hek细胞)中表达。
缀合物:如本文使用的,术语“缀合物”可以指直接或间接共价附着至蛋白的部分。通常,当蛋白附着至缀合物时,它可以称为缀合蛋白或蛋白缀合物。在一些实施方案中,本文描述的缀合物是聚乙二醇(peg)。当蛋白附着至peg部分时,它可以称为peg化蛋白。
功能等价物或衍生物:如本文使用的,在氨基酸序列的功能性衍生物的上下文中,术语“功能等价物”或“功能衍生物”指示保留与原始序列基本上相似的生物活性(功能或结构)的分子。功能性衍生物或等价物可以为天然衍生物或合成制备的。示例性的功能性衍生物包括具有一个或多个氨基酸的置换、缺失或添加的氨基酸序列,条件是蛋白的生物活性是保守的。置换氨基酸期望地具有与被置换氨基酸相似的化学-物理性质。期望的相似的化学-物理性质包括电荷、膨松性、疏水性、亲水性等等中的相似性。
融合蛋白:如本文使用的,术语“融合蛋白”或“嵌合蛋白”指通过连接两种或更多种最初分离的蛋白或其一部分而产生的蛋白。在一些实施方案中,每种蛋白之间将存在接头或间隔物。
半衰期:如本文使用的,术语“半衰期”是数量例如蛋白浓度或活性降至如在时间段开始时测量时其值的一半所需的时间。
遗传性血管性水肿或hae:如本文使用的,术语“遗传性血管性水肿”或“hae”指特以炎症的无法预测和反复发作为特征的血液病症。hae通常与c1-inh缺乏相关,所述c1-inh缺乏可能是低水平的c1-inh或者具有受损或降低活性的c1-inh的结果。症状包括但不限于可在身体任何部位发生的肿胀,所述部位如面部、四肢、生殖器、胃肠道和上呼吸道。
改进、增加或减少:如本文使用的,术语“改善”、“增加”或“减少”或语法等价物指示相对于基线测量的值,所述基线测量例如在本文所述的治疗开始之前相同个体中的测量,或在不存在本文所述的治疗的情况下在对照受试者(或多个对照受试者)中的测量。“对照受试者”是患有与正在接受治疗的受试者相同形式的疾病的受试者,其与正在接受治疗的受试者大约相同的年龄。
体外:如本文使用的,术语“体外”指在人造环境中,例如在试管或反应容器中,在细胞培养等中,而不是在多细胞生物体内发生的事件。
体内:如本文使用的,术语“体内”指在多细胞生物内,例如人和非人动物内发生的事件。在基于细胞的系统的背景下,该术语可用于指在活细胞内(与例如体外系统相反)发生的事件。
接头:如本文使用的,术语“接头”指在融合蛋白中,除在天然蛋白中的特定位置处出现的那种外的氨基酸序列,并且一般设计为柔性的或在两个蛋白部分之间插入结构,例如α-螺旋。接头也被称为间隔物。接头或间隔物通常本身不具有生物学功能。
多肽:如本文使用的,术语“多肽”指经由肽键连接在一起的氨基酸的连续链。该术语用于指任何长度的氨基酸链,但本领域普通技术人员将理解,该术语并不限于长链,并且可以指包含经由肽键连接在一起的两个氨基酸的最小链。如本领域技术人员已知的,多肽可进行加工和/或修饰。如本文使用的,术语“多肽”和“肽”可互换使用。
预防:如本文使用的,当与疾病、病症和/或状况的发生结合使用时,术语“预防”指降低疾病、病症和/或状况发展的风险。参见“风险”的定义。
蛋白:如本文使用的,术语“蛋白”指充当离散单位的一种或多种多肽。如果单个多肽是离散功能单元,并且不需要与其他多肽永久或暂时物理结合以便形成离散功能单元,则术语“多肽”和“蛋白”可互换使用。如果离散功能单元由超过一种彼此物理结合的多肽组成,则术语“蛋白”指离散单元物理偶联和共同起作用的多种多肽。
风险:如从上下文应理解的,疾病、病症和/或状况的“风险”包括特定个体将发展成疾病、病症和/或状况(例如肌营养不良)的可能性。在一些实施方案中,风险表示为百分比。在一些实施方案中,风险为0、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90直至100%。在一些实施方案中,风险表示为相对于与参考样品或参考样品组相关的风险的风险。在一些实施方案中,参考样品或参考样品组具有疾病、病症、病况和/或事件(例如肌营养不良)的已知风险。在一些实施方案中,参考样品或参考样品组来自与特定个体相当的个体。在一些实施方案中,相对风险是0、1、2、3、4、5、6、7、8、9、10或更多。
受试者:如本文使用的,术语“受试者”指人或任何非人动物(例如小鼠、大鼠、兔、犬、猫、牛、猪、绵羊、马或灵长类动物)。人包括出生前和出生后形式。在许多实施方案中,受试者是人类。受试者可以为患者,其指提供给医疗提供者用于疾病的诊断或治疗的人。术语“受试者”在本文中可与“个体”或“患者”互换使用。受试者可患有或易患疾病或病症,但可表现出或可不表现出疾病或病症的症状。
基本上:如本文使用的,术语“基本上”指显示出目的特征或性质的总体或接近总体程度或范围的定性条件。生物领域的普通技术人员应理解,生物学现象和化学现象很少(如果有的话)完成和/或进行至完成或达到或避免绝对结果。术语“基本上”因此在本文中用于捕获许多生物学现象和化学现象固有的潜在缺乏的完整性。
基本同源性:短语“基本同源性”在本文中用于指氨基酸或核酸序列之间的比较。如本领域普通技术人员应了解的,如果两个序列在相应位置含有同源残基,则它们一般视为“基本同源的”。同源残基可以为相同的残基。可替代地,同源残基可以是不相同的残基,具有适当相似的结构和/或功能特征。例如,如本领域普通技术人员众所周知的,某些氨基酸通常被分类为“疏水”或“亲水”氨基酸,和/或具有“极性”或“非极性”侧链。一种氨基酸置换相同类型的另一种氨基酸可经常被视为“同源”置换。
如本领域众所周知的,可使用各种算法中的任一种比较氨基酸或核酸序列,所述算法包括可在商业计算机程序中获得的那些算法,例如用于核苷酸序列和blastp的blastn、缺口blast和用于氨基酸序列的psi-blast。示例性的此类程序在以下文献中有所描述:altschul等人,basiclocalalignmentsearchtool,j.mol.biol.,215(3):403-410,1990;altschul等人,methodsinenzymology;altschul等人,“gappedblastandpsi-blast:anewgenerationofproteindatabasesearchprograms”,nucleicacidsres.25:3389-3402,1997;baxevanis等人,bioinformatics:apracticalguidetotheanalysisofgenesandproteins,wiley,1998;和misener等人,(编辑),bioinformaticsmethodsandprotocols(methodsinmolecularbiology,第132卷),humanapress,1999。除鉴定同源序列之外,上述程序通常提供同源性程度的指示。在一些实施方案中,如果其相应残基的至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多在相关残基段上是同源的,则两个序列表示为基本同源。在一些实施方案中,相关段是全序列。在一些实施方案中,相关段是至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500个或更多个残基。
基本同一性:短语“基本同一性”在本文中用于指氨基酸或核酸序列之间的比较。如本领域普通技术人员应了解的,如果两个序列在相应位置含有相同残基,则它们一般视为“基本相同的”。如本领域众所周知的,可使用各种算法中的任一种比较氨基酸或核酸序列,所述算法包括可在商业计算机程序中获得的那些算法,例如用于核苷酸序列和blastp的blastn、缺口blast和用于氨基酸序列的psi-blast。示例性的此类程序在以下文献中有所描述:altschul等人,basiclocalalignmentsearchtool,j.mol.biol.,215(3):403-410,1990;altschul等人,methodsinenzymology;altschul等人,nucleicacidsres.25:3389-3402,1997;baxevanis等人,bioinformatics:apracticalguidetotheanalysisofgenesandproteins,wiley,1998;和misener等人,(编辑),bioinformaticsmethodsandprotocols(methodsinmolecularbiology,第132卷),humanapress,1999。除鉴定相同序列之外,上述程序通常提供同一性程度的指示。在一些实施方案中,如果其相应残基的至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多在相关残基段上是相同的,则两个序列表示为基本相同。在一些实施方案中,相关段是全序列。在一些实施方案中,相关段是至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500个或更多个残基。
患有:患有“疾病、病症和/或状况”的个体已被诊断有或表现出疾病、病症和/或状况的一种或多种症状。
易患:“易患”疾病、病症和/或状况的个体仍未被诊断患有疾病、病症和/或状况。在一些实施方案中,易患疾病、病症和/或状况的个体可不表现出疾病、病症和/或状况的症状。在一些实施方案中,易患疾病、病症、状况或事件(例如dmd)的个体可通过下述中的一种或多种来表征:(1)与疾病、病症和/或状况的发展有关的基因突变;(2)与疾病、病症和/或状况的发展有关的遗传多态性;(3)与疾病、病症和/或状况相关的蛋白的表达和/或活性增加和/或降低;(4)与疾病、病症、状况和/或事件的发展相关的习惯和/或生活方式,(5)已经历移植,计划经历移植或需要移植。在一些实施方案中,易患疾病、病症和/或状况的个体将发展疾病、病症和/或状况。在一些实施方案中,易患疾病、病症和/或状况的个体将不发展疾病、病症和/或状况。
治疗有效量:如本文使用的,术语治疗剂的“治疗有效量”意指当施用于患有或易患疾病、病症和/或状况的受试者时,足以治疗、诊断、预防和/或延迟疾病、病症和/或状况的症状发作的量。本领域普通技术人员应了解,治疗有效量通常经由包含至少一个单位剂量的给药方案施用。
治疗:如本文使用的,术语“治疗”指用于部分或完全缓解、改善、减轻、抑制、预防、延迟以下的发作、减少以下的严重性和/或减少以下的发生率:特定疾病、病症和/或状况的一种或多种症状或特征。治疗可施用于未表现出疾病征兆和/或仅表现出疾病早期征兆的受试者,用于降低与疾病相关病理发展的风险。
具体实施方式
本发明尤其提供了用于改善补体介导的病症的治疗的缀合的c1-inh,所述病症包括遗传性血管性水肿(hae)。具体地讲,本发明提供的缀合的c1-inh是peg化c1-inh。
考虑了缀合的c1-inh(例如,peg化c1-inh或聚唾液酸(psa)缀合的c1-inh)与未缀合(例如,未peg化)但在其他方面相同的c1-inh相比具有延长的半衰期。根据本发明,任何c1-inh蛋白可以是缀合的(例如,peg化或psa缀合的),包括但不限于血浆来源或重组表达的c1-inh蛋白。在一些实施方案中,可以缀合(例如,peg化或psa缀合)的c1-inh蛋白是融合蛋白。如下所述,根据本发明进行缀合(例如,peg化或psa缀合)的结果延长了体内半衰期同时出乎意料地保留了c1-inh蛋白良好的生物利用率和/或生物活性。因此,本文提供的缀合(例如,peg化或psa缀合)的c1-inh允许通过例如降低给药频率和增加预防功效来改善hae和其他补体介导的疾病、病症或状况的治疗。
下述节段详细描述了本发明的各个方面。节段的使用并不意味着限制本发明。每个节段可适用于本发明的任何方面。在本专利申请中,除非另有说明,否则使用“或”意指“和/或”。本文引用的所有技术的公开内容以引用的方式全文并入。
c1-inh蛋白
本发明可用于缀合任何c1-inh蛋白。人c1-inh是重要的抗炎血浆蛋白,具有广泛范围的抑制性和非抑制性生物活性。通过序列同源性、其c末端结构域的结构和蛋白酶抑制机制,它属于丝氨酸蛋白酶抑制剂超家族,最大类别的血浆蛋白酶抑制剂,其还包括抗凝血酶、α1-蛋白酶抑制剂、纤溶酶原激活物抑制剂、以及调节不同生理系统的许多其他结构上相似的蛋白。c1-inh是补体系统、激肽生成的接触系统和固有凝血途径中的蛋白酶抑制剂。cai,s.&davis,a.e.,complementregulatoryproteinc1inhibitorbindstoselectinsandinterfereswithendothelial-leukocyteadhesion,jimmunol,171:4786-4791(2003)。具体地,c1-inh已显示抑制补体系统的c1r和c1s。c1-inh也是凝血因子xi和xii的主要调节剂,以及激肽释放酶、和凝血和纤维蛋白溶解系统的其他丝氨酸蛋白酶,包括组织型纤溶酶原激活物和纤溶酶。
c1-inh的低血浆含量或其功能障碍导致补体和接触血浆级联两者的激活,并且也可影响其他系统。c1-inh血浆含量降低至低于55μg/ml(正常的~25%)的水平已显示诱导c1的自发性激活。
图1中提供了描绘c1-inh结构的示意图。显示了信号肽、n末端结构域和丝氨酸蛋白酶抑制剂结构域。c1-inh是分泌所需并且从c1-inh蛋白的剩余部分中切割的22个氨基酸信号肽。c1-inh具有两个结构域:具有365个氨基酸的c末端结构域,其是典型的丝氨酸蛋白酶抑制剂结构域,以及具有113个氨基酸的n末端结构域。蛋白由连接结构域的两个二硫桥稳定。这些二硫桥由与c末端(丝氨酸蛋白酶抑制剂)结构域的cys406形成二硫键的n末端结构域的cys101,以及与c末端结构域的cys183形成二硫键的n末端结构域的cys108形成。丝氨酸蛋白酶抑制剂结构域负责c1-inh的蛋白酶活性。p1-p1’指示arg444-thr445易切断键。
糖基化蛋白的超过26%的重量是碳水化合物。聚糖不均匀地分布在人c1-inh上。n-末端是重糖基化的,具有三个n-联(显示为具有菱形头部的长垂直线)和至少七个o-联(显示为短垂直线)碳水化合物基团。三个n-附着的聚糖附着至丝氨酸蛋白酶抑制剂结构域中的天冬酰胺残基asn216、asn231和asn330(显示为具有菱形头部的长垂直线)。尽管特别长且重糖基化的n末端结构域的功能作用仍不清楚,但它对于蛋白的构象稳定性、识别、对内毒素和选择素的亲和力以及清除可能是重要的。碳水化合物部分的固有异质性极大地促成了整个c1-inh的异质性,这是产生模拟血浆来源的c1-inh性质的重组c1-inh的困难原因之一。
如本文使用的,适于根据本发明进行缀合和使用的c1-inh蛋白包含保留c1-inh基本生物活性的具有野生型和经修饰的氨基酸序列的c1-inh多肽或结构域(例如,具有氨基酸突变、缺失、截短和/或插入的c1-inh蛋白)。通常,使用重组技术产生c1-inh蛋白,但也可以是血浆来源的。
在一些实施方案中,适合于本发明的c1-inh多肽或结构域包括与野生型人c1-inh蛋白(氨基酸1-478)(氨基酸1-97加下划线)至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同或同源的氨基酸序列:
npnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:1)。
在一些实施方案中,适合于本发明的c1-inh多肽或结构域包括与成熟的野生型人c1-inh蛋白(氨基酸98-478)至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同或同源的氨基酸序列:
gsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:2)。
在一些实施方案中,适合于本发明的c1-inh多肽或结构域包括与具有e165q突变(突变的氨基酸带粗体且加下划线)的人c1-inh蛋白(氨基酸1-478)至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同或同源的氨基酸序列:
npnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:37)。
在一些实施方案中,适合于本发明的c1-inh多肽或结构域包括与具有e165q突变(突变的氨基酸带粗体且加下划线)的成熟人c1-inh蛋白(氨基酸98-478)至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同或同源的氨基酸序列:
gsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:38)。
人c1-inh蛋白的同源物或相似物可根据本领域普通技术人员已知的用于改变多肽序列的方法来制备,所述方法例如在编译此类方法的参考文献中发现的。如本领域普通技术人员应了解的,如果两个序列在相应位置含有同源残基,则它们一般视为“基本同源的”。同源残基可以为相同的残基。可替代地,同源残基可以是不相同的残基,具有适当相似的结构和/或功能特征。例如,如本领域普通技术人员众所周知的,某些氨基酸通常被分类为“疏水”或“亲水”氨基酸,和/或具有“极性”或“非极性”侧链。一种氨基酸置换相同类型的另一种氨基酸可通常被视为“同源”置换。在一些实施方案中,氨基酸的保守置换包括在下述组内的氨基酸中进行的置换:(a)m、i、l、v;(b)f、y、w;(c)k、r、h;(d)a、g;(e)s、t;(f)q、n;以及(g)e、d。在一些实施方案中,“保守氨基酸置换”指不改变其中进行氨基酸置换的蛋白的相对电荷或尺寸特征的氨基酸置换。
如本领域众所周知的,可使用各种算法中的任一种比较氨基酸或核酸序列,所述算法包括可在商业计算机程序中获得的那些算法,例如用于核苷酸序列和blastp的blastn、缺口blast和用于氨基酸序列的psi-blast。示例性的此类程序在以下文献中有所描述:altschul等人,basiclocalalignmentsearchtool,j.mol.biol.,215(3):403-410,1990;altschul等人,methodsinenzymology;altschul等人,“gappedblastandpsi-blast:anewgenerationofproteindatabasesearchprograms”,nucleicacidsres.25:3389-3402,1997;baxevanis等人,bioinformatics:apracticalguidetotheanalysisofgenesandproteins,wiley,1998;和misener等人,(编辑),bioinformaticsmethodsandprotocols(methodsinmolecularbiology,第132卷),humanapress,1999。除鉴定同源序列之外,上述程序通常提供同源性程度的指示。
在一些实施方案中,适用于本发明的c1-inh多肽或结构域可以是截短的c1-inh蛋白。例如,适用于本发明的c1-inh多肽或结构域包括seqidno:1、seqidno:2、seqidno:37或seqidno:38中任一者的部分或片段。
c1-inh融合蛋白
在一些实施方案中,可根据本发明进行缀合的c1-inh蛋白包括c1-inh融合蛋白。c1-inh融合蛋白可包括c1-inh结构域(也称为c1-inh多肽)和另一种结构域或部分,该另一种结构域或部分通常可以通过例如增强或增加c1-inh蛋白的半衰期、稳定性、效力和/或递送或者降低或消除免疫原性、清除率或毒性来促进c1-inh的治疗效果。用于c1-inh融合蛋白的此类合适的结构域或部分包括但不限于fc结构域和白蛋白结构域。合适的融合结构域或部分(例如,fc或白蛋白结构域)可以直接或间接连接、融合或附着至n-末端、c-末端或内部连接至c1-inh蛋白。以下章节描述了可进行缀合的示例性c1-inh融合蛋白。
fc结构域
在一些实施方案中,合适的c1-inh融合蛋白含有结合至fcrn受体的fc结构域或其部分。作为非限制性实例,合适的fc结构域可以衍生自免疫球蛋白亚类,诸如igg。在一些实施方案中,合适的fc结构域衍生自igg1、igg2、igg3或igg4。在一些实施方案中,合适的fc结构域衍生自igm、iga、igd或ige。特别合适的fc结构域包括衍生自人抗体或人源化抗体的那些。在一些实施方案中,合适的fc结构域是经修饰的fc部分,例如经修饰的人fc部分。
c1-抑制剂fc融合蛋白可以作为二聚体存在,如图1所示。
在一些实施方案中,适合于本发明的fc结构域可包括与野生型人igg1fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同的氨基酸序列:
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:3)。
在一些实施方案中,合适的fc结构域可包括一种或多种减少或消除补体激活和/或抗体依赖性细胞介导的细胞毒性(adcc)活性(也称为“效应子功能”)的突变。例如,合适的fc结构域可包括对应于igg1的根据eu编号的l234a和l235a(lala)的突变。具有lala突变(突变残基加下划线)的示例性人igg1fc结构域如下所示:
dkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:4)。
在一些实施方案中,适用于本发明的fc结构域包括与seqidno:4至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同同时保持对应于igg1的根据eu编号的l234a和l235a(lala)的突变的氨基酸序列。
考虑了改善fc结构域与fcrn受体之间的结合导致延长的血清半衰期。因此,在一些实施方案中,合适的fc结构域包含一个或多个导致与fcrn的结合改善的氨基酸突变。fc结构域内影响与fcrn的改善结合的各种突变在本领域中是已知的,并且可适用于实践本发明。在一些实施方案中,合适的fc结构域在对应于人igg1的根据eu编号的thr250、met252、ser254、thr256、thr307、glu380、met428、his433和/或asn434的一个或多个位置处包含一个或多个突变。
例如,合适的fc结构域可含有h433k(his433lys)和/或n434f(asn434phe)的突变。作为非限制性实例,合适的fc结构域可含有突变h433k(his433lys)和n434f(asn434phe)。可包括在fc结构域中的另外的氨基酸置换包括在例如美国专利号6,277,375、8,012,476和8,163,881中描述的那些,所有这些专利据此以引用方式并入本文。
在一些实施方案中,适用于本发明的fc结构域包括与人igg1fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同同时保持对应于人igg1的根据eu编号的thr250、met252、ser254、thr256、thr307、glu380、met428、his433和/或asn434的一个或多个突变(下加下划线)的氨基酸序列:
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealkfhytqkslslspgk(seqidno:5)。
在一些实施方案中,适用于本发明的fc结构域包括与人igg1fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同同时保持对应于igg1的l234a和l235a(lala)的突变以及对应于人igg1的根据eu编号的thr250、met252、ser254、thr256、thr307、glu380、met428、his433和/或asn434的一个或多个突变的氨基酸序列(突变残基加下划线):
dkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealkfhytqkslslspgk(seqidno:6)。
在一些实施方案中,本发明使用衍生自igg4的fc结构域。不希望受任何理论束缚,据报道igg4具有比wtigg1更低的补体活性。因此,在一些实施方案中,本发明使用野生型人igg4fc结构域。在一些实施方案中,适合于本发明的fc结构域衍生自具有对应于核心铰链区序列中根据eu索引的s228p置换的突变的人igg4。根据kabat等人(1987sequencesofproteinsofimmunologicalinterest.unitedstatesdepartmentofhealthandhumanservices,washingtondc.),该置换也被称为s241p。不希望受任何理论束缚,考虑了该置换具有使铰链区核心的序列与野生型iggl或igg2同种型抗体的序列相同的效果,并且导致产生同源形式的igg4抗体,因此消除了常常导致异二聚体igg4抗体产生的重链的解离和重新组合。另外,igg4衍生的fc结构域可用于高浓度下的稳定性。
因此,在一些实施方案中,适合于本发明的fc结构域包括与野生型人igg4fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同的氨基酸序列:
eskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seqidno:9)。
在一些实施方案中,适用于本发明的fc结构域包括与人igg4fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同同时保持对应于根据eu编号的s241p置换的突变的氨基酸序列(突变残基加下划线):
eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seqidno:10)。
在一些实施方案中,本文所述的fc结构域可包括信号肽。适用于本发明的示例性信号肽包括与metpaqllfllllwlpdttg至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同的氨基酸序列。
例如,合适的fc结构域可具有与具有信号肽的人igg1fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同并且具有增强与fcrn受体结合的突变的氨基酸序列(信号肽和突变残基加下划线):
metpaqllfllllwlpdttgdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealkfhytqkslslspgk(seqidno:7)。
在一些实施方案中,适用于本发明的fc结构域包括与具有信号肽的人igg1fc结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同并且同时具有lala和增强与fcrn受体结合的突变的氨基酸序列(突变残基加下划线):
metpaqllfllllwlpdttgdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealkfhytqkslslspgk(seqidno:8)。
示例性c1-inh-fc融合蛋白
在具体的实施方案中,合适的c1-inh融合蛋白包括c1-inh多肽或结构域和fc结构域。在一些实施方案中,合适的c1-inh融合蛋白包括将c1-inh多肽或结构域与fc结构域缔合的接头。在某些实施方案中,如图2所示,fc部分可直接与全长(1-478aa)以及成熟(98-478)的c1-抑制剂的n-末端区域融合。作为非限制性实例,合适的c1-inhfc融合蛋白可具有如下所示的氨基酸序列:
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgknpnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:11)
或
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:12)
或
dkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgknpnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:13)
或
dkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:14)
或
eskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgknpnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:32)
或
eskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:33)
或
eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgknpnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:15)
或
eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra(seqidno:16)。
在一些实施方案中,合适的c1-inhfc融合蛋白具有与seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:32或seqidno:33至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或以上同源或相同的氨基酸序列。
考虑了c1-inh-fc融合蛋白可以各种构型提供,包括同型二聚体或单体构型。例如,可以设计合适的同型二聚体构型以使融合伴侣(例如,c1-inh多肽加接头)的c末端附着至两条fc多肽链的n-末端。可以设计合适的单体构型以使融合伴侣(例如,c1-inh多肽加接头)的c末端与一个fc二聚体融合。
单体(在本文中也称为单价)形式可用于某些应用和施用途径,例如皮下施用。单体构型可降低空间位阻、增加半衰期和/或可增加生物利用率。
不希望受任何理论束缚,考虑了单价形式可特别用于c1-inh-fc融合构建体,因为c1-inh为自杀性抑制剂。由于其为自杀性抑制剂,所以二聚体fc融合体的一个c1-inh“臂”的结合将导致该结合的c1-inh融合蛋白的清除率增加,即使在第二臂保持未结合的情况下也是如此。
fc融合蛋白(单体和二聚体两者)的优势在于:据发现,fc表达比单独c1-inh的表达以更高的水平发生。比较二聚体c1-inh-fc构建体与没有fc融合的c1-inh的活性测定已显示具有相似的c1q结合活性。还测试了包含接头的情况,并且发现接头不影响c1-inh-fc融合蛋白结合其靶标的能力。
制备单体抗体融合蛋白的方法包括在以下文献中描述的那些:例如,pct公开号wo2011/063348、wo2012/020096、wo2013/138643、wo2014087299;dumont,j.等人,monomericfcfusions:impactonpharmacokineticandbiologicalactivityofproteintherapeutics,biodrugs,20(3):151-160(2006);ishino,t.等人,proteinstructureandfolding:half-lifeextensionofbiotherapeuticsmodalitybyn-glycosylationfortheengineeringamonomericfcdomain,j.biol.chem.,288:16529-16537(2013),这些文献的公开内容据此以引用方式并入本文。
单价c1-抑制剂可以通过使用与仅表达fc的质粒共转染的含有fc-c1的质粒来制备。另外,它可以通过使用双启动子质粒来制备,其中一个启动子生成fc-c1,另一个启动子生成fc。单价fc还可以使用双特异性技术来制备,其中fc铰链区中的特定氨基酸被突变以赋予fc区稳定性(例如,杵臼(knobandhole)技术或其他驱使单价c1形成的稳定突变)。
白蛋白结构域
在一些实施方案中,合适的c1-inh融合蛋白含有白蛋白结构域。白蛋白是可溶的单体蛋白,其占血清蛋白的约一半。白蛋白主要用作类固醇、脂肪酸和甲状腺激素的载体蛋白,并且在稳定细胞外液体积中发挥作用。白蛋白具有分子量为66,500的球状未糖基化血清蛋白。白蛋白在肝脏中合成为前白蛋白原,其具有在初生蛋白从粗面内质网释放之前被去除的n-末端肽。产物白蛋白原继而在高尔基体小泡中裂解以产生分泌的白蛋白。
白蛋白由三个同源结构域(i-iii)组成,并且它们中的每一者由两个亚结构域(a和b)组成。配体与人血清白蛋白结合的主要区域位于亚结构域iia和iiia的空腔中,其主要由疏水性和带正电荷的残基形成并且表现出相似的化学性质。人血清白蛋白具有585个氨基酸,分子量为66,500da。这些氨基酸包括35个半胱氨酸,除了其中一个以外,所有这些半胱氨酸都参与形成17个稳定化二硫键。
通常,白蛋白具有延长的19天的血清半衰期。fcrn控制白蛋白的长血清半衰期。fcrn是双重结合受体,除了白蛋白以外还结合igg,并且保护这两种蛋白免于细胞内降解。已经显示白蛋白分子的c末端结构域对于结合fcrn是重要的。具体地讲,结构域iiib显示出对于结合fcrn是重要的。在一些实施方案中,缺乏结构域iiib或464his、510his和535his突变会消除fcrn结合。
通常,本发明的白蛋白融合蛋白是单体的。在一些实施方案中,由于上文关于单体fc融合体实施方案所述的原因,该特征可优于二聚体fc融合体实施方案。
在一些实施方案中,适合于本发明的白蛋白多肽包括与野生型人血清蛋白至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同的氨基酸序列:
mkwvtfisllflfssaysrgvfrrdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktykttlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasraalgl(seqidno:17)。
在一些实施方案中,适合于本发明的白蛋白多肽包括与野生型人血清蛋白的d3结构域至少50%(例如,至少55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%)相同的氨基酸序列:
metpaqllfllllwlpdttgveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasraalgl(seqidno:20)。
接头或间隔物
c1-inh多肽或结构域可以直接或间接连接至fc结构域或白蛋白结构域。在一些实施方案中,合适的c1-inh融合蛋白含有接合c1-inh多肽或结构域和fc或白蛋白结构域的接头或间隔物。氨基酸接头或间隔物通常被设计为柔性的或者在两个蛋白部分之间插入某一结构(诸如α-螺旋)。接头或间隔物可以相对较短,或者可以更长。通常,接头或间隔物在长度上含有例如3-100(例如,5-100、10-100、20-100、30-100、40-100、50-100、60-100、70-100、80-100、90-100、5-55、10-50、10-45、10-40、10-35、10-30、10-25、10-20)个氨基酸。在一些实施方案中,接头或间隔物在长度上等于或长于2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个氨基酸。通常,较长的接头可降低空间位阻。在一些实施方案中,接头将包含甘氨酸和丝氨酸残基的混合物。在一些实施方案中,接头可另外包含苏氨酸、脯氨酸和/或丙氨酸残基。因此,在一些实施方案中,接头包含10-100、10-90、10-80、10-70、10-60、10-50、10-40、10-30、10-20、10-15个氨基酸。在一些实施方案中,接头包含至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90或95个氨基酸。在一些实施方案中,接头不是由alevlfqgp(seqidno:37)组成的接头。
作为非限制性实例,适合于本发明的接头或间隔物包括但不限于ggg接头和ggggsggggs((ggggs)2接头seqidno:27)。在一些实施方案中,接头包含序列ggg和/或seqidno:27的序列。
其他合适的接头包括gapgggggaaaaaggggggap(gag接头,seqidno:34)、gapgggggaaaaaggggggapgggggaaaaaggggggap(gag2接头,seqidno:35)和gapgggggaaaaaggggggapgggggaaaaaggggggapgggggaaaaaggggggap(gag3接头,seqidno:36)。
合适的接头或间隔物还包括具有与上述示例性接头(例如ggg接头、ggggsggggs((ggggs)2接头seqidno:27)、gag接头(seqidno:34)、gag2接头(seqidno:35)或gag3接头(seqidno:36))至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或以上同源或相同的氨基酸序列的那些。适合与一些实施方案一起使用的另外的接头可见于2012年3月2日提交的us2012/0232021,其公开内容据此以引用方式全文并入本文。
通常,包括将c1-inh多肽或结构域与fc或白蛋白结构域缔合而基本上不影响或降低c1-inh多肽或结构域与其任何同源配体(例如,c1等)结合的能力的接头。
c1-inh蛋白的糖基化/聚糖图谱(谱)
根据本发明,c1-inh蛋白可以通过聚糖残基和/或胺基进行缀合。具体地讲,c1-inh蛋白可以在聚糖残基(例如,唾液酸残基或半乳糖残基)处缀合。因此,适合于根据本发明进行缀合的c1-inh蛋白可以用不同的聚糖图谱(具体为唾液酸含量)来表征。在一些实施方案中,c1-inh蛋白具有与血浆来源的c1-inh相似的糖基化谱。在一些实施方案中,c1-inh蛋白具有与血浆来源的c1-inh不同的糖基化谱。
不希望受任何理论束缚,认为包括聚糖键以及分支结构的形状和复杂性的聚糖图谱可影响体内清除率、生物利用率和/或功效。
通常,可通过酶促消化和后续的色谱分析来确定聚糖图谱。各种酶可用于酶促消化,包括但不限于合适的糖基化酶、肽酶(例如内肽酶、外肽酶)、蛋白酶和磷酸酶。在一些实施方案中,合适的酶是碱性磷酸酶。在一些实施方案中,合适的酶是神经氨酸酶。聚糖可通过色谱分析来检测。例如,聚糖可通过伴随脉冲安培检测的高效阴离子交换色谱(hpae-pad)或尺寸排阻高效液相色谱(hplc)来检测。可根据本领域已知和本文公开的方法,使用聚糖的标准曲线计算聚糖图谱上由每个峰表示的聚糖数量。
在一些实施方案中,c1-inh蛋白可以用聚糖图谱来表征。可基于相对于预定参考标准中的对应峰组面积的峰组面积来确定与每个峰组对应的聚糖的相对量。用于聚糖图谱的各种参考标准是本领域中已知的,并且可用于实践本发明。在一些实施方案中,c1-inh蛋白的特征在于聚糖图谱,其包含选自指示以下的峰组的五个或更少的峰组:中性、单唾液酸化、二唾液酸化、三唾液酸化或四唾液酸化的c1-inh蛋白。
在一些实施方案中,c1-inh蛋白具有包含下述至少一种的糖基化谱:中性聚糖种类、单唾液酸化种类、二唾液酸化种类、三唾液酸化种类和/或四唾液酸化种类。在一些实施方案中,c1-inh蛋白具有包含中性聚糖种类、单唾液酸化种类、二唾液酸化种类、三唾液酸化种类和四唾液酸化种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含不超过约50%、45%、40%、35%、30%、25%、20%、15%、10%或5%的中性聚糖种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含约5%至约30%的中性聚糖种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含约5%至约25%的中性聚糖种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含约10%至约20%的中性聚糖种类的糖基化谱。在一些实施方案中,c1-inh蛋白平均每个分子包含至少约80%的带电聚糖(例如,每个分子大于约85%、90%、95%或99%的聚糖)。在一些实施方案中,c1-inh蛋白具有包含约10%至约30%的单唾液酸化种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含约30%至约50%的二唾液酸化种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含约15%至约35%的三唾液酸化种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含约5%至约15%的四唾液酸化种类的糖基化谱。在一些实施方案中,c1-inh蛋白具有包含不超过30%的中性聚糖种类、约20%至约30%的单唾液酸化聚糖种类、约30%至约40%的二唾液酸化聚糖种类、约10%至约20%的三唾液酸化聚糖种类以及约5%至约10%的四唾液酸化聚糖种类的糖基化谱。
在一些实施方案中,c1-inh蛋白具有相似于血浆来源的c1-inh的唾液酸化谱。在一些实施方案中,c1-inh蛋白具有不同于血浆来源的c1-inh的唾液酸化谱。在一些实施方案中,c1-inh蛋白具有使半衰期与血浆来源的c1-inh的半衰期相似或更长的唾液酸化谱。在一些实施方案中,c1-inh蛋白平均每个分子包含至少约10、11、12、13或14个唾液酸化的聚糖残基。在一些实施方案中,c1-inh蛋白平均每个分子包含至少约15、16、17、18、19、20、21、22、23、24、25、26、27、28或29个唾液酸化的聚糖残基。在一些实施方案中,c1-inh蛋白平均每个分子包含至少约30、31、32、33、34、35、36、37、38、39或40个唾液酸化的聚糖残基。
在一些实施方案中,c1-inh蛋白含有低于约20%、15%、10%或5%的甘露糖、α-半乳糖、n-羟乙酰神经氨酸(ngna)或寡甘露糖型糖基化中的一种或多种。在一些实施方案中,c1-inh蛋白含有不超过约20%、15%、10%或5%的甘露糖、α-半乳糖、n-羟乙酰神经氨酸(ngna)或寡甘露糖型糖基化中的一种或多种。
在一些实施方案中,c1-inh蛋白具有非免疫原性的糖基化谱。在一些实施方案中,c1-inh蛋白具有与血浆来源的人c1-inh相比血清清除率未增加的糖基化谱。在一些实施方案中,c1-inh蛋白具有与血浆来源的人c1-inh相比血清清除率降低的糖基化谱。在一些实施方案中,c1-inh蛋白具有与考奈司他α(conestatalfa)相比血清清除率降低的糖基化谱。
操纵蛋白的糖基化谱的各种方法是本领域已知的。这些方法以及还有待开发的其他方法是本发明考虑了的。操纵本发明的c1-inh蛋白和多肽的糖基化谱的方法包括体外、原位和体内方法。在一些实施方案中,表达的蛋白或多肽的糖基化谱通过表达的蛋白或多肽的表达后化学修饰而改变。在一些实施方案中,操纵细胞培养条件以实现具有所需糖基化谱的蛋白的表达。这些细胞培养条件包括生产和培养过程的控制,包括培养的长度、培养基的添加物和/或基因的共表达以增强糖基化。宿主细胞和经转染的宿主细胞的特定克隆的选择也可用于增强糖基化。增强糖基化的一些方法包括纯化方法以富集具有所需糖基化谱的蛋白或多肽。
在一些实施方案中,经工程改造以表达c1-inh蛋白的细胞也可被改造为修饰糖基化,具体地为增加所表达的c1-inh的唾液酸化。例如,细胞可经工程改造为在糖基化途径(野生型或突变)中表达异源酶以实现所需的糖基化(例如,增加唾液酸化)。在一些实施方案中,细胞还可经工程改造为过表达内源酶以实现所需的糖基化(例如,增加唾液酸化)。在一些实施方案中,细胞经工程改造为减少或防止(例如,通过反义构建体)会减少、抑制或降解唾液酸化的内源酶的表达。
本文所述的各种糖基化模式/聚糖图谱并且具体地为唾液酸化谱或水平可以适用于单独的c1-inh结构域或多肽或者融合蛋白(例如,c1-inh-fc或c1-inh-白蛋白融合蛋白)的情况。具有本文所述的糖基化模式/聚糖图谱并且具体地为唾液酸化谱或水平的c1-inh蛋白可以是缀合的或非缀合的。考虑了所需的糖基化模式/聚糖图谱(包括所需的唾液酸化谱或水平)可延长c1-inh蛋白的体内半衰期。具体地讲,所需的糖基化模式/聚糖图谱(包括所需的唾液酸化谱或水平)与fc或白蛋白融合体组合在即使没有缀合的情况下也可以实现本申请中描述的c1-inh蛋白的所需体内半衰期。然而,缀合(例如,peg化)进一步延长了c1-inh蛋白(包括具有所需糖基化模式或唾液酸化水平的那些)的体内半衰期。
peg化
根据本发明,化学或生物部分可以直接或间接与本文所述的c1-inh蛋白进行缀合。具体地讲,这种部分是聚乙二醇(peg)部分,包括但不限于单个或多个(例如,2-4)peg部分。如本文使用的,peg部分直接或间接与蛋白缀合的过程称为peg化。如本文所述,peg化可导致c1-inh的半衰期延长。
peg化可以通过本领域已知的任何合适的反应进行。制备peg化蛋白的方法通常可包括:(a)使多肽与聚乙二醇(诸如peg的反应性酯或醛衍生物)在使多肽附着至一个或多个peg基团的条件下反应;(b)获得一种或多种反应产物。通常,可以基于已知参数和所需结果逐一确定反应条件。
存在许多可供本领域技术人员使用的peg附着方法并且在以下文献中有所描述:例如,ep0401384;malik等人,exp.hematol.,20:1028-1035(1992);ep0154316;ep0401384;wo92/16221;以及wo95/34326。例如,本文所述的peg化治疗分子的步骤可通过与反应性聚乙二醇分子的酰化反应或烷基化反应来进行。
在一些实施方案中,进行缀合的peg部分是活化的peg。例如,合适的peg部分可包括氨氧基官能团。在一些实施方案中,合适的peg部分可包括酰肼官能团。在一些实施方案中,合适的peg部分可包括马来酰亚胺或碘乙酰胺官能团。在一些实施方案中,合适的peg部分可包括n-羟基琥珀酰亚胺(nhs)酯。因此,peg部分可以通过肟键、酰胺键、腙键、硫醚键或其他类型的键与c1-inh蛋白缀合。
在一些实施方案中,peg部分可具有直链或支链结构。例如,peg部分可包括2、3、4或5个臂分支。合适的peg-nhs部分可包括直链peg-nhs1k、直链peg-nhs2k、直链peg-nhs5k、支链peg-nhs5k、支链peg-nhs20k或支链peg-nhs40k。作为另一个实例,peg-氨氧基部分可包括直链或支链的peg-氨氧基2k、peg-氨氧基5k、peg-氨氧基5k、peg-氨氧基10k、peg-氨氧基20k或peg-氨氧基40k。
在一些实施方案中,peg通过c1-inh蛋白的一个或多个氨基酸残基与c1-inh缀合。参见图3。
在一些实施方案中,peg通过c1-inh蛋白的一个或多个半乳糖残基与c1-inh缀合。在一些实施方案中,在peg与半乳糖残基缀合之前,c1-inh蛋白的一个或多个半乳糖残基被氧化。
在一些实施方案中,peg通过c1-inh蛋白的一个或多个唾液酸残基与c1-inh缀合。在一些实施方案中,在peg与唾液酸残基缀合之前,c1-inh蛋白的一个或多个唾液酸残基被氧化。
在一些实施方案中,peg通过肟键与氧化的唾液酸缀合。在一些实施方案中,peg通过腙键与氧化的唾液酸缀合。
根据本发明,c1-inh蛋白可以各种水平peg化。例如,peg与c1-inh的摩尔比可在约5:1至100:1、约10:1至100:1、约15:1至100:1、约20:1至100:1、约25:1至100:1、约30:1至100:1、约40:1至100:1、约50:1至100:1、约10:1至90:1、约10:1至80:1、约10:1至70:1、约10:1至60:1、约10:1至50:1、约10:1至40:1、约15:1至35:1或20:1至30:1的范围内。在一些实施方案中,peg与c1-inh的摩尔比可为至少约1:1、至少约5:1、至少约10:1、至少约15:1、至少约20:1、至少约25:1、至少约30:1、至少约35:1、至少约40:1、至少约45:1或至少约50:1。
在一些实施方案中,peg与唾液酸的摩尔比为至少约1:1、至少约1:5、至少约1:10、至少约1:15、至少约1:20、至少约1:25、至少约1:30、至少约1:35、至少约1:40、至少约1:45、至少约1:50。在一些实施方案中,peg与唾液酸的摩尔比为约1:1至约1:50、约1:1至约1:45、约1:1至约1:40、约1:1至约1:35、约1:1至约1:30、约1:1至约1:25、约1:1至约1:20、约1:1至约1:15、约1:1至约1:10或约1:1至约1:5。
聚唾液酸缀合
聚唾液酸(psa),也称为多聚乙酰神经氨酸(ca),是一种天然存在的多糖。它是具有α(2→8)酮苷键的n-乙酰基神经氨酸的均聚物,并且在其非还原端含有邻二醇基。它带有负电荷,并且是人体的天然成分。
psa由n-乙酰基神经氨酸的聚合物(通常是均聚物)组成。仲氨基通常携带有乙酰基,但它也可以携带有羟乙酰基。羟基上可能的取代基包括乙酰基、乳酰基、乙基、硫酸根和磷酸根基团。
psa和经修饰的psa(mpsa)通常包含基本上由通过2,8-糖苷键或2,9-糖苷键或这些的组合(例如,交替的2,8-键和2,9-键)连接的n-乙酰基神经氨酸部分组成的直链聚合物。在一些实施方案中,psa和mpsa的糖苷键是α-2,8。此类psa和mpsa衍生自多聚乙酰神经氨酸。典型的psa和mpsa包含至少2个、优选至少5个、更优选至少10个以及最优选至少20个n-乙酰基神经氨酸部分。因此,它们可包含2至300个n-乙酰基神经氨酸部分、优选5至200个n-乙酰基神经氨酸部分或最优选10至100个n-乙酰基神经氨酸部分。psa和ca优选基本上不含除n-乙酰基神经氨酸以外的糖部分。在一些实施方案中,psa包含至少90%、至少95%和/或至少98%的n-乙酰基神经氨酸部分。
当psa包含除n-乙酰基神经氨酸以外的部分(例如,在mpsa中)时,它们优选位于该聚合物链的一个或两个末端。此类“其他”部分可以是例如通过氧化或还原而衍生自末端n-乙酰基神经氨酸部分的部分。
例如,wo2001/087922描述了这样的mpsa,其中非还原末端n-乙酰基神经氨酸单元通过与高碘酸钠反应转化成醛基。另外,wo2005/016974描述了这样的mpsa,其中还原末端n-乙酰基神经氨酸单元经还原在该还原末端n-乙酰基神经氨酸单元处还原性地打开环,由此形成邻二醇基团,随后通过氧化将该邻二醇基团转化为醛基。
可以由在非还原端含有单个醛基的氧化psa制备不同的psa衍生物。氨氧基psa的制备在例如wo2012/166622中有所描述,其内容据此以引用方式并入本文。含有末端氨基的psa-nh2可以通过用nh4cl和含有末端巯基的psa-sh通过psa-nh2与2-亚胺基硫醇烷(traut试剂)的反应进行还原胺化来制备,两种规程都描述于us7,645,860b2中。根据us7,875,708b2,psa酰肼可以通过氧化的psa与肼的反应来制备。psa酰肼可以通过氧化的psa与己二酸二酰肼的反应来制备(wo2011/012850a2)。
多聚乙酰神经氨酸(psa的亚类)是具有α(2→8)酮苷键的n-乙酰基神经氨酸(nana)的均聚物,并且尤其由具有k1抗原的特定大肠杆菌菌株产生。多聚乙酰神经氨酸具有许多生理功能。它们是药物和化妆品的重要原料。
如本文使用的,“唾液酸部分”包括唾液酸单体或聚合物(“多糖”),其可溶于水溶液或悬浮液并且在psa-凝血蛋白缀合物以药学有效量施用后对哺乳动物具有很小的或没有负面影响(诸如副作用)。在一个方面,这些聚合物的特征在于具有1、2、3、4、5、10、20、30、40、50、60、70、80、90、100、200、300、400或500个唾液酸单元。在某些方面,链中组合有不同的唾液酸单元。
在一些实施方案中,多糖化合物的唾液酸部分是高度亲水的,而在另一个实施方案中,整个化合物是高度亲水的。亲水性主要由唾液酸单元的侧链羧基以及由羟基赋予。糖单元可含有其他官能团,诸如胺、羟基或硫酸根基团或其组合。这些基团可存在于天然存在的糖类化合物中,或者被引入衍生的多糖化合物中。
天然存在的聚合物psa可作为表现出宽的大小分布(例如,sigmac-5762)和高多分散性(pd)的多分散制备物获得。因为多糖通常在携带共纯化内毒素固有风险的细菌中产生,所以纯化长唾液酸聚合物链可提高内毒素含量增加的可能性。也可以合成制备具有1-4个唾液酸单元的短psa分子(kangsh等人,chemcommun.2000;227-8;ressdk和linhardtrj,currentorganicsynthesis.2004;1:31-46),从而最大限度地降低高内毒素水平的风险。然而,现在可以制造具有窄大小分布和低多分散性并且还不含内毒素的psa制备物。在一个方面,特别用于本公开的多糖化合物是由细菌产生的那些。这些天然存在的多糖中的一些被称为糖脂。在一些实施方案中,这些多糖化合物基本上不含末端半乳糖单元。
在一些实施方案中,psa通过c1-inh蛋白的一个或多个唾液酸残基与c1-inh缀合。在一些实施方案中,在psa与唾液酸残基缀合之前,c1-inh蛋白的一个或多个唾液酸残基被氧化。
在一些实施方案中,psa通过肟键与氧化的唾液酸缀合。在一些实施方案中,psa通过腙键与氧化的唾液酸缀合。
根据本发明,c1-inh蛋白可以各种水平与psa缀合。例如,psa与c1-inh的摩尔比可在约5:1至100:1、约10:1至100:1、约15:1至100:1、约20:1至100:1、约25:1至100:1、约30:1至100:1、约40:1至100:1、约50:1至100:1、约10:1至90:1、约10:1至80:1、约10:1至70:1、约10:1至60:1、约10:1至50:1、约10:1至40:1、约15:1至35:1或20:1至30:1的范围内。在一些实施方案中,psa与c1-inh的摩尔比可为至少约1:1、至少约5:1、至少约10:1、至少约15:1、至少约20:1、至少约25:1、至少约30:1、至少约35:1、至少约40:1、至少约45:1或至少约50:1。
在一些实施方案中,psa与唾液酸的摩尔比为至少约1:1、至少约1:5、至少约1:10、至少约1:15、至少约1:20、至少约1:25、至少约1:30、至少约1:35、至少约1:40、至少约1:45、至少约1:50。在一些实施方案中,psa与唾液酸的摩尔比为约1:1至约1:50、约1:1至约1:45、约1:1至约1:40、约1:1至约1:35、约1:1至约1:30、约1:1至约1:25、约1:1至约1:20、约1:1至约1:15、约1:1至约1:10或约1:1至约1:5。
延长的半衰期
根据本发明,缀合(例如,peg化或psa缀合)延长了c1-inh的体内半衰期。通常,缀合(例如,peg化或psa缀合)的c1-inh具有比未缀合(例如,未peg化或未psa缀合)的c1-inh更长的半衰期。在一些实施方案中,缀合(例如,peg化或psa缀合)的c1-inh具有与血浆来源的人c1-inh蛋白相当或更大的半衰期。在一些实施方案中,缀合(例如,peg化或psa缀合)的c1-inh的半衰期在血浆来源的c1-inh蛋白的半衰期的约80%-500%、90%-500%、100%-500%、110%-500%、120%-500%、80%-400%、90%-300%、100%-300%、100%-250%、100%-200%或100%-150%范围内。
在一些实施方案中,缀合(例如,peg化或psa缀合)的c1-inh蛋白的半衰期为至少约70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165或170小时。在一些实施方案中,缀合(例如,peg化或psa缀合)的c1-inh的体内半衰期为或长于约2天、2.5天、3天、3.5天、4天、4.5天、5天、5.5天、6天、6.5天、7天、7.5天、8天、8.5天、9天、9.5天、10天、11天、12天、13天或14天。在一些实施方案中,缀合(例如,peg化或psa缀合)的c1-inh蛋白的体内半衰期在以下范围内:0.5至14天、0.5至10天、1天至10天、1天至9天、1天至8天、1天至7天、1天至6天、1天至5天、1天至4天、1天至3天、2天至10天、2天至9天、2天至8天、2天至7天、2天至6天、2天至5天、2天至4天、2天至3天、2.5天至10天、2.5天至9天、2.5天至8天、2.5天至7天、2.5天至6天、2.5天至5天、2.5天至4天、3天至10天、3天至9天、3天至8天、3天至7天、3天至6天、3天至5天、3天至4天、3.5天至10天、3.5天至9天、3.5天至8天、3.5天至7天、3.5天至6天、3.5天至5天、3.5天至4天、4天至10天、4天至9天、4天至8天、4天至7天、4天至6天、4天至5天、4.5天至10天、4.5天至9天、4.5天至8天、4.5天至7天、4.5天至6天、4.5天至5天、5天至10天、5天至9天、5天至8天、5天至7天、5天至6天、5.5天至10天、5.5天至9天、5.5天至8天、5.5天至7天、5.5天至6天、6天至10天、7天至10天、8天至10天、9天至10天、10天至11天、11天至12天、12天至13天、13天至14天。
药物组合物
本发明还提供了含有本文所述的缀合的c1-inh和生理上可接受的载体的药物组合物。载体和缀合的c1-inh蛋白通常是无菌的并被配制成适合施用模式。
合适的药学可接受的载体包括但不限于水、盐溶液(例如nacl)、盐水、缓冲盐水、醇、甘油、乙醇、阿拉伯树胶、植物油、苯甲醇、聚乙二醇、明胶、碳水化合物例如乳糖、直链淀粉或淀粉、糖例如甘露醇、蔗糖或其他、右旋糖、硬脂酸镁、滑石、硅酸、粘性石蜡、芳香油、脂肪酸酯、羟甲基纤维素、聚乙烯吡咯烷酮等、以及其组合。需要时,药物制剂可与助剂(例如,润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂、调味剂和/或芳香物质等等)混合,所述助剂不会有害地与活性化合物反应或干扰其活性。在一个优选实施方案中,使用适合于静脉内施用的水溶性载体。
需要时,合适的药物组合物或药剂还可含有少量润湿剂或乳化剂或ph缓冲剂。组合物可以为液体溶液、悬浮液、乳液、片剂、丸剂、胶囊、缓释制剂或粉末。组合物也可用传统的粘合剂和载体如甘油三酯配制成栓剂。经口制剂可包括标准载体例如药物级的甘露醇、乳糖、淀粉、硬脂酸镁、聚乙烯吡咯烷酮、糖精钠、纤维素、碳酸镁等。
药物组合物或药剂可根据常规程序配制为适合施用于人类的药物组合物。例如,在一些实施方案中,用于静脉内施用的组合物通常是无菌等渗水性缓冲液中的溶液。必要时,组合物还可包括增溶剂和局部麻醉剂,以缓解在注射部位处的疼痛。一般地,成分分开供应或以单位剂型混合在一起供应,例如作为在指示活性剂数量的气密密封容器例如安瓿或小药囊中的干燥冻干粉末或无水浓缩物。当组合物通过输注施用时,它可以用含有无菌药物级水、盐水或右旋糖/水的输液瓶来分配。当组合物通过注射施用时,可提供用于注射的无菌水或盐水的安瓿,以便可在施用之前混合成分。
本文所述的缀合的c1-inh可配制为中性或盐形式。药学可接受的盐包括与游离氨基形成的那些,如源自盐酸、磷酸、乙酸、草酸、酒石酸等的那些,以及与游离羧基形成的那些,例如源自钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙氨基乙醇、组氨酸、普鲁卡因等的那些。
优选的制剂包含50mmnapo4(ph7.2)、50mm山梨糖醇和150mm甘氨酸。制剂可以是液体的,或者可以被冻干并在施用之前复溶。
施用途径
本文所述的缀合的c1-inh(或者含有本文所述的缀合的c1-inh的组合物或药剂)通过任何适当的途径施用。在一些实施方案中,全身施用缀合的c1-inh或含有其的药物组合物。全身施用可以为静脉内、皮内、颅内、鞘内、吸入、透皮(局部)、眼内、肌内、皮下、肌内、经口和/或透粘膜施用。在一些实施方案中,皮下施用缀合的c1-inh或含有其的药物组合物。如本文使用的,术语“皮下组织”被定义为紧接在皮肤之下的松散的不规则的结缔组织层。例如,皮下施用可通过将组合物注射到区域包括但不限于大腿部、腹部、臀部或肩胛部的区域内来执行。在一些实施方案中,静脉内施用缀合的c1-inh或含有其的药物组合物。在一些实施方案中,经口施用缀合的c1-inh或含有其的药物组合物。在一些实施方案中,颅内施用缀合的c1-inh或含有其的药物组合物。在一些实施方案中,鞘内施用缀合的c1-inh或含有其的药物组合物。需要时,可同时使用多于一个途径。
在一些实施方案中,缀合的c1-inh或含有其的药物组合物通过皮下(即在皮肤之下)施用于受试者。为了这样的目的,可使用注射器注射制剂。然而,用于制剂施用的其他装置是可用的,例如注射装置(例如inject-easetm和genjecttm装置);注射笔(如genpentm);无针装置(例如medijectortm和biojectortm);和皮下贴剂递送系统。因此,本发明还提供了一种试剂盒,该试剂盒包括:含有缀合的c1-inh的药物组合物(例如,呈液体和冻干形式),和注射装置(诸如注射器)。在一些实施方案中,该注射器预装载有包含缀合的c1-inh的药物组合物。其中该药物组合物被冻干,该试剂盒还包括复溶缓冲液。
本发明考虑单次施用以及多次施用治疗有效量的本文所述的缀合的c1-inh或含有其的药物组合物。取决于受试者状况(例如,遗传性血管性水肿)的性质、严重性和程度,可以按规律的间隔施用缀合的c1-inh或含有其的药物组合物。在一些实施方案中,缀合的c1-inh或含有其的药物组合物的治疗有效量可以按规律的间隔定期(例如,每年一次、每六个月一次、每五个月一次、每三个月一次、双月一次(每两个月一次)、每月一次(每一个月一次)、双周一次(每两周一次)、每周一次、每天一次或连续)施用。
在一些实施方案中,施用仅在个体中产生局部效应,而在其他实施方案中,施用在个体的多个部分各处产生效应,例如全身效应。通常,施用导致将缀合的c1-inh递送至一个或多个靶组织。在一些实施方案中,缀合的c1-inh被递送至一个或多个靶组织,包括但不限于心脏、脑、皮肤、血液、脊髓、横纹肌(例如,骨骼肌)、平滑肌、肾、肝、肺和/或脾。在一些实施方案中,缀合的c1-inh被递送至心脏。在一些实施方案中,缀合的c1-inh被递送至中枢神经系统,特别是脑和/或脊髓。在一些实施方案中,缀合的c1-inh被递送至三头肌、胫骨前肌、比目鱼肌、腓肠肌、二头肌、斜方肌、三角肌、四头肌和/或膈肌。
剂型和给药方案
在一些实施方案中,组合物以治疗有效量和/或根据与特定所需结果相关的施用方案(例如,预防补体介导的慢性疾病,例如hae)施用。
根据本发明的待施用的特定剂量或量可例如取决于所需结果的性质和/或程度、施用途径和/或施用时机的细节、和/或一个或多个特征(例如,体重、年龄、个人历史、遗传特征、生活方式参数、心脏缺陷的严重性和/或心脏缺陷的风险水平等、或其组合)。这些剂量或量可由普通技术人员确定。在一些实施方案中,根据标准临床技术确定适当的剂量或量。可替代地或另外地,在一些实施方案中,通过使用一种或多种体外或体内测定来确定适当的剂量或量,以帮助鉴定待施用的期望或最佳的剂量范围或量。
在各种实施方案中,缀合的c1-inh以治疗有效量施用。一般地,治疗有效量足以对受试者实现有意义的益处(例如,预防、治疗、调节、治愈、防止和/或改善潜在的疾病或状况)。一般地,施用于有此需要的受试者的治疗剂(例如,缀合的c1-inh)的量将取决于受试者的特征。这些特征包括受试者的状况、疾病严重性、一般健康状况、年龄、性别和体重。本领域普通技术人员将能够容易地根据这些和其他相关因素确定适当剂量。另外,可任选地采用客观和主观测定来确定最佳剂量范围。在一些特定实施方案中,可从源自体外或动物模型测试系统的剂量-响应曲线推断待施用的适当剂量或量。
在一些实施方案中,组合物作为药物制剂提供。在一些实施方案中,药物制剂是或包含单位剂量,用于根据与实现hae发作的减少发生率或风险相关的施用方案施用。
在一些实施方案中,包含本文所述的缀合的c1-inh的制剂作为单一剂量施用。在一些实施方案中,以规律的间隔施用包含本文所述的缀合的c1-inh的制剂。如本文使用的,以“间隔”施用指示治疗有效量是周期性地(与一次性剂量不同)施用。间隔可通过标准的临床技术来确定。在一些实施方案中,包含本文所述的缀合的c1-inh的制剂双月一次、每月一次、每月两次、三周一次、双周一次、每周一次、每周两次、每周三次、每天一次、每天两次或每六小时一次施用。单一个体的施用间隔不需要是固定的间隔,而是可随着时间过去变化,这取决于个体的需要。
治疗有效量通常以可包含多个单位剂量的给药方案施用。对于任何特定的治疗性蛋白,治疗有效量(和/或有效给药方案内的适当单位剂量)可例如根据施用途径、与其他药物试剂的组合而变。另外,用于任何特定患者的特定治疗有效量(和/或单位剂量)可取决于各种因素,包括待治疗的病症和病症的严重性;所采用的特定药物试剂的活性;所采用的特定组合物;患者的年龄、体重、一般健康状况、性别和饮食;所采用的特定c1-inh的施用时间、施用途径和/或排泄或代谢速率;治疗的持续时间;以及医学领域众所周知的类似因素。
如本文使用的,术语“双月一次”意指施用一次/两个月(即每两个月一次);术语“每月一次”意指施用一次/月;术语“三周一次”意指施用一次/三周(即每三周一次);术语“双周一次”意指施用一次/两周(即每两周一次);术语“每周一次”意指施用一次/周;而“每天一次”意指施用一次/天。
在一些实施方案中,包含本文所述的缀合的c1-inh的制剂无限期地以规律间隔施用。在一些实施方案中,包含本文所述的缀合的c1-inh的制剂在限定时期内以规律间隔施用。
应进一步理解,对于任何特定受试者,应该根据个体需要和施用酶替代疗法或监督施用酶替代疗法的人的专业判断,随时间调整具体的剂量方案,并且本文所述的剂量范围仅为示例性的,并不预期限制本发明的范围或实践。
组合疗法
在一些实施方案中,缀合的c1-inh与目前用于治疗补体介导的疾病的一种或多种已知治疗剂(例如,皮质类固醇)组合施用。在一些实施方案中,已知的治疗剂根据其标准或批准的给药方案和/或时间表施用。在一些实施方案中,已知的治疗剂根据与其标准或批准的给药方案和/或时间表相比改变的方案施用。在一些实施方案中,这种改变的方案与标准或批准的给药方案的不同之处在于一个或多个单位剂量的量被改变(例如减少或增加),和/或给药在频率中改变(例如,单位剂量之间的一个或多个间隔扩大,导致更低的频率,或间隔减少,导致更高的频率)。
补体介导的病症
缀合的c1-inh和含有其的药物组合物可用于治疗hae和各种其他补体介导的病症。
在一些实施方案中,由本发明提供的缀合蛋白适合于与补体介导的病症(例如,nmosd、amr或hae事件)相关的急性发作。这些发作可很长或很短。在一些实施方案中,疾病或病症是慢性的。在一些实施方案中,本发明的组合物和方法被预防性使用。可使用本文公开的组合物和方法治疗的示例性补体介导的疾病包括但不限于遗传性血管性水肿、抗体介导的排斥、视神经脊髓炎谱系疾病、创伤性脑损伤、脊髓损伤、缺血性脑损伤、烧伤、中毒性表皮坏死松解症、多发性硬化、肌萎缩性侧索硬化(als)、帕金森氏病、中风、慢性炎性脱髓鞘性多发性神经病(cidp)、重症肌无力、多灶性运动神经病。
实施例
本发明的其他特征、目的和优点在下述实例中是显而易见的。然而,应该理解,尽管示出了本发明的实施方案,但实例仅给出用于说明而不是限制。在本发明的范围内的各种改变和修改根据实例对于本领域技术人员将变得显而易见。
实施例1.c1-inh的peg化
本实施例示出了适用于c1-inh蛋白peg化的示例性方法。探索了三种不同的peg化策略。示例性peg化方案示于图3至图5中。这些方案是peg与唾液酸残基的缀合(唾液酸介导[sam]的化学过程)、peg与半乳糖酸残基的缀合(半乳糖介导[gam]的化学过程)和胺介导的peg缀合。
利用氨氧基-peg以便形成更稳定的肟键。利用基于在以下文献中描述的方法开发的技术进行peg化:park等人,carbohydrate-mediatedpolyethyleneglycolconjugationoftshimprovesitspharmacologicalproperties.endocrinology,march2013,154(3):1373–1383。
与具有较少或没有唾液酸残基的蛋白相比,糖基化蛋白上暴露的唾液酸残基通常导致半衰期延长,而已知碳水化合物链上的末端半乳糖残基会引起受体介导的清除并且降低蛋白的血清半衰期。因此,最初的努力集中在gampeg缀合以便阻断受体介导的c1inh清除。虽然所有这三种方法似乎都是有前景的,但我们惊讶地发现胺和sampeg化产生具有最小和可接受效力损失的最大程度的c1-inhpeg化。相比之下,gampeg化效率较低且具有更大的异质性。
进行了初始体内pk研究来评估peg化c1-inh。具体地讲,在大鼠pk研究中比较sam5kda和40kdapeg化c1-inh与氨基peg化c1-inh。参见图6(a-c图),使用c1-inh采用抗原测定法对peg化c1-inh定量以绘制标准曲线。还通过western印迹分析样品以检查潜在的降解。1mg/kgiv和3mg/kg的剂量在人体的
使用1mg/kg静脉内施用给雄性sd大鼠,进一步进行了c1-inh-peg的药代动力学研究。这些结果提供在下表1中。
*peg为直链。**peg为支链
表1.c1-inh-peg静脉内施用于雄性spraguedawley(sd)大鼠的药代动力学参数。
此外,在nhp研究中,观察到皮下生物利用率为约30%至40%,这是相比未缀合的重组c1-inh蛋白的意外改进。
因此,peg化的c1-inh似乎具有适合于治疗用途的半衰期和足够的生物利用率。
实施例2.示例性peg化方案
过程a
将纯化的c1-inh透析到ph5.6的100mm乙酸钠中。在4℃下进行高碘酸盐氧化30分钟。在4℃下用甘油淬灭反应15分钟。将氧化的c1-inh透析到乙酸盐缓冲液中。然后将材料在4℃下peg化过夜,然后进行甘氨酸淬灭。通过阴离子交换去除游离peg。图7中提供了过程a的示例性示意图。
通过过程a制备的c1-inh-peg40kda使用以下方法进一步纯化。
用样品稀释缓冲液(ph7.00的5mmnapo4)将约1mg的与c1-inh缀合的40kdapeg胺稀释20倍。所得溶液表现出0.716ms/cm的电导率。将样品上样到10mlgigacapq(650)柱xk16上。整个过程的流速为150cm/h。用样品稀释缓冲液充分洗涤柱,然后用10倍柱体积梯度洗脱蛋白至500mmnacl中。收集2ml级分并通过sds-page分析样品。色谱结果示于表11中。然后合并峰级分并透析到配制缓冲液(50mm磷酸盐(ph=7.1)、150mm甘氨酸、50mm山梨糖醇)中,浓缩至≥1.0mg/ml,并且通过在280nm处的吸光度进行定量(nano-drop)。
对c1-inh-peg20kda制备物进行类似的纯化并示于图12中,以及对c1-inh-peg5kda制备物进行类似的纯化并示于图13中。
使用消光系数和衍生自蛋白的氨基酸序列的分子量在nano-drop仪器上对所有样品进行定量。结果在下表2中示出:
表2:c1-inhpeg化过程样品的定量。
过程b
通过tff缓冲液交换将纯化的c1-inh交换到ph5.6的100mm乙酸钠中。在室温下进行高碘酸盐氧化30分钟。以40x摩尔过量提供高碘酸盐。反应中存在高达4mg/ml的c1-inh。在室温下用甘油淬灭反应15分钟。然后将材料在室温下peg化过夜。以100x摩尔过量提供peg。反应中存在高达2mg/ml的c1-inh。通过tff缓冲液交换去除游离peg。图8中提供了过程b的示例性示意图。
适合于peg化c1-inh的其他示例性peg化方案汇总于图9a-e中。
sam过程-peg5k
在此过程中,使用pelliconxl,biomax,30kda(pes)tff盒以10x渗滤体积交换将约200ml辛基载荷物质(约0.9mg/mlc1-inh的tris/硫酸铵溶液)缓冲液交换到ph5.6的100mm乙酸钠中。在室温下用1.6mm高碘酸钠(40x)温和搅拌处理40μmc1-inh(3.7mg/ml)30分钟(50ml反应,在100mm乙酸钠中,ph5.6)。在室温下用1.5%甘油淬灭反应15分钟。
在室温下用2.16mm5kda-peg(100x)处理21.6μmc1-inh(2mg/ml),温和搅拌过夜(92.5ml反应,在100mm乙酸钠中,ph5.6)。然后在室温下用2.16mm甘氨酸(100x)淬灭反应1小时。
使用pelliconxl,biomax100kdamwco(pes)tff盒以10x渗滤体积交换通过tff渗滤到ph7.1的50mm磷酸钠、150mm甘氨酸和50mm山梨糖醇中以去除游离peg。然后使用22um,pes,milliporesteriflip过滤器对产物进行过滤灭菌。peg化样品的ic50示于图10(a图和b图)以及图20(a-b图)中。
各个工艺步骤后的产量如下表3所示:
表3:辛基载荷peg化步骤产量。
sam过程-peg直链2k、5k,支链5k、10k、20k、40k
sam过程还用于制备具有以下种类的peg的c1-inh-peg:直链2k、直链5k、支链5k、支链10k、支链20k和支链40k。
用amicon离心过滤器(截留30k)纯化用peg2k、5k和10k进行peg化的c1-inh。通过akta系统纯化用peg-氨氧基20k或40k进行peg化的c1-inh,以去除游离peg。c1-inh的表征如图18(a-e图)所示。测定通过sam过程制备的c1-inh-peg的纯度和效力并在大鼠模型中评估pk。这些数据提供在图19(a-c图)中。peg化样品的其他表征和ic50值示于图24(a和b图)中。
用于生成c1-inh-peg的sampeg化条件示于下表4中。
表4.用于生成c1-inh-peg的sampeg化条件。
通过胺偶联过程进行peg化
还使用胺偶联过程制备了c1-inh-peg。图21中描绘了通过氨基偶联过程进行的示例性peg化的示意图。
通过amicon离心过滤器(截留30k)纯化用peg1k、直链5k和支链5k进行peg化的c1-inh。使用碘化钡染色来检测peg5k部分的游离peg,并且利用rp-hplc来检测游离peg1k和peg2k。通过aktapure色谱系统纯化用nhs-peg20k和40k进行peg化的c1-inh。peg化c1-inh的表征示于图22(a-d图)中。
测定通过胺偶联过程制备的c1-inh-peg的纯度、效力并在大鼠模型中评估pk。这些数据提供在图23(a-c图)中。
用于通过胺偶联过程生成c1-inh-peg的peg化条件示于下表5中。
表5.用于通过胺偶联过程生成c1-inh-peg的peg化条件。*用100xpeg20k进行peg化具有低转化率并用另外的40xpeg20k进行再处理。
实施例3:iv施用的peg化c1-inh的非人灵长类动物pk研究
将非人灵长类动物(nhp)(食蟹猴)分成两组,并且静脉内给药30mg/kg的重组人c1-inh(rhc1-inh)或5mg/kg的peg化rhc1-inh。该研究的示例性结果汇总于图14和表6中。
在nhp中,与rhc1-inh相比,peg化rhc1-inh显示出低6倍的清除率和长3倍的终末半衰期。在大鼠研究中也观察到类似的趋势,其显示出清除率降低4倍,半衰期增加4倍。
表6:peg化rhc1inh与rhc1inh的nhppk研究结果
a研究中三只猴子中的一只在408小时后显示出消除率增加并被排除在pk计算之外
peg载荷对iv施用c1-inh的nhp的pk的影响
对nhp进行了进一步的pk研究。nhp接受5x、10x、20x和40x载荷下iv施用的c1-inh-peg。示例性结果示于图15中。
实施例4:iv与sc施用peg化c1-inh的nhp的pk研究
将nhp分成两组,并静脉内给药5mg/kg的peg化c1-inh或皮下(sc)给药10mg/kg的peg化c1-inh。该研究的结果汇总于图16和表7中。在整个研究的时间过程中维持peg化c1-inh的功能活性(sa=4.8u/mg)。
显著且出乎意料的是,在nhp中,peg化c1-inh表现出85%的生物利用率,并且半衰期与iv施用的半衰期相当。迄今为止收集的临床前数据支持每周一次或甚至更低频率给药的可能性。
表7:nhp中的peg化rhc1-inh的iv与sc给药
在nhp中sc给药后,对于hrc1-inh,f=58%
实施例5:氧化/滴定以测试使pk曲线最大化的最小peg
所使用的dt-1215滴定测定法是基于elisa的方法,其用抗peg抗体从血清样品中捕获peg-rc1-inh蛋白。然后该蛋白用标记的抗c1-inh蛋白进行检测。使用peg-rc1-inh绘制标准曲线。图17描绘了dt-1215滴定分析和样品比活性的结果。表8和表9提供了进一步的数据。
表8:在不同水平的高碘酸盐处理下观察到的比活性的变化。如表9(下文)中所见,高碘酸盐水平的变化导致peg与c1inh的比率不同。
表9:与未缀合的c1inh相比在不同peg水平下实现的半衰期。
实施例6:peg化c1-inh的物理表征
使用sec和sec-mal分析peg化制备物的纯度。在25℃下测量0.1mg/mlpeg-c1-inh蛋白的cd光谱。通过aviv和cdnn软件处理cd数据。基于cd光谱和二级结构分析,当蛋白被peg化时未观察到显著变化。根据c1-inh的c-末端晶体结构(2oay),27%为螺旋和30%为β-折叠。
表10:数据表明,peg化不会改变c1-inh的二级结构。
通过nanodsf测量peg化c1-inh的解链温度(tm)。发现peg化不会显著改变c1-inh的热稳定性。测得40kda氨基-peg化c-inh的tm比所测试的其他缀合物高2℃。数据提供在表11中。
表11:peg化c1-inh的tm分析。
使用核磁共振(nmr)来表征peg化水平。胺上的peg化很低,每c1-inh约3个peg部分。唾液酸可以被高度peg化以达到5kpeg反应物的饱和度。唾液酸上的40kpeg化达到每个分子约9个peg。在不同的高碘酸盐浓度下对peg化水平定量。数据提供在表12中。
表12:peg化c1-inh制备物的nmr表征。
实施例7:c1-inh-psa的特征
通过唾液酸介导(sam)的过程将c1-inh与聚唾液酸(psa)缀合。测定由sam过程制备的c1-inh-psa的纯度和效力。这些数据提供在图24(a和b图)中。数据表明,尽管游离psa不干扰效力测定本身,但在此所测试的psa:c1inh条件下c1-inh效力降低约4-7倍。
使用c1-inh-psa、c1-inh-peg和
等价方案和范围
本领域的技术人员将认识到,或者使用不超出常规的实验就能够确定本文所述的发明的具体实施方案的许多等价方案。本发明的范围无意限于以上说明书,而是如以下权利要求书所阐述。
- 还没有人留言评论。精彩留言会获得点赞!