至少包含一种pI为5.8至8.5的基础胰岛素以及带有羧酸根电荷和疏水性基团的共聚氨基酸的PH7的可注射溶液的制作方法
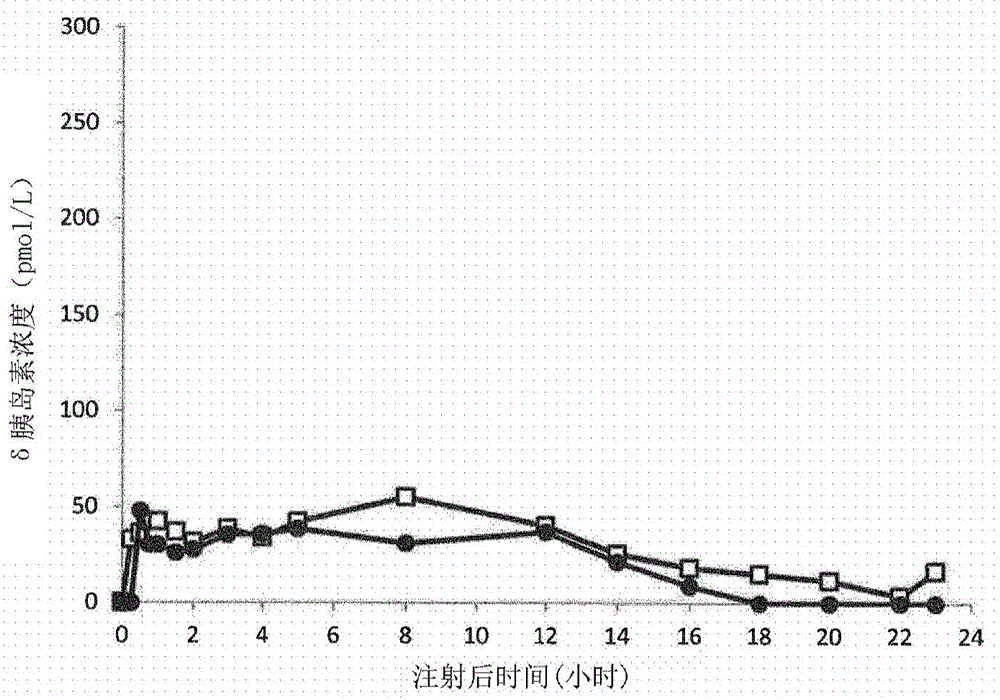
本发明涉及ph为6.0至8.0的可注射水溶液形式的物理稳定组合物,其至少包含一种等电点(pi)为5.8至8.5的基础胰岛素;以及带有羧酸根电荷和疏水性基团的共聚氨基酸。胰岛素治疗或通过注射胰岛素的糖尿病治疗近年来已经取得了显著的进步,特别是由于新胰岛素的开发,所述新胰岛素与人胰岛素相比提供更好的患者血糖校正,并且其改善了对胰腺的生理活动的模拟。当在患者中诊断出ii型糖尿病时,开始逐步治疗。首先,患者服用经口抗糖尿病药物(oad),例如二甲双胍。当单独的oad不再足以调节血液中的葡萄糖水平时,必须进行治疗的改变,并且根据患者的特异性,可建立不同的治疗组合。例如,除oad之外,患者还可进行基于甘精胰岛素或地特胰岛素类型的基础胰岛素的治疗,并随后根据病理状况的发展,进行基于基础胰岛素和餐时胰岛素的治疗。此外,现今,为了确保当在前的治疗不再能够控制血糖水平时将oad治疗转变为基础胰岛素/餐时胰岛素治疗,推荐注射glp-1ra的类似物。glp-1ra代表胰高血糖素样肽-1受体激动剂,并且是促胰岛素释放肽或肠降血糖素,并且属于胃肠激素(或肠激素)家族,其在血糖过高时例如在餐后刺激胰岛素的分泌。胃肠激素(肠激素)也称为饱腹感激素。其特别地包括glp-1ra(胰高血糖素样肽-1受体激动剂)和gip(葡萄糖依赖性促胰岛素释放肽)、胃泌酸调节素(胰高血糖素原的衍生物)、肽yy、胰淀素、缩胆囊素、胰多肽(pp)、食欲刺激素和肠抑肽,其具有肽或蛋白质结构。其还响应于葡萄糖和脂肪酸刺激胰岛素的分泌,并且因此其是用于治疗糖尿病的潜在候选物。迄今为止在所述胃肠激素中,glp-1ra是在药物开发中贡献最佳结果的那些。其使患有ii型糖尿病的患者可减轻体重,同时更好地控制他们的血糖。还已开发了glp-1ra的类似物或衍生物,特别地是为了提高其稳定性。此外,为了以简化方式满足糖尿病患者的每日胰岛素需求,糖尿病患者目前可以使用两种类型的具有互补作用的胰岛素:餐时胰岛素(或所谓的速效胰岛素)和基础胰岛素(或所谓的短效胰岛素)。餐时胰岛素允许在餐时和零食中摄入的葡萄糖的迅速管理(代谢和/或储存)。患者在每次摄入食物之前必须自施用餐时胰岛素的注射剂,即每天约2至3次注射。最常用的餐时胰岛素是:人重组胰岛素,(来自novonordisk的门冬胰岛素)、(来自elililly的赖脯胰岛素)和(来自sanofi的谷赖胰岛素)。基础胰岛素确保在食物摄入期之外维持患者的血糖稳态。其基本上通过阻断内源性葡萄糖产生(肝葡萄糖)而发挥作用。基础胰岛素的日剂量通常相当于每日总胰岛素需要量的40至50%。根据使用的基础胰岛素,该剂量以在一天内定期分配的1次或2次注射施用。最常用的基础胰岛素是(来自novonordisk的地特胰岛素)和(来自sanofi的甘精胰岛素)。完整的说,应注意nph(胰岛素nph代表中性鱼精蛋白hagedorn胰岛素;humuline)是最古老的基础胰岛素。该制剂是通过阳离子蛋白质鱼精蛋白使人胰岛素(在中性ph下为阴离子)沉淀得到的。由此形成的微晶分散在水性混悬液中,并且在皮下注射之后缓慢溶解。这种缓慢溶解确保了胰岛素的延长释放。然而,这种释放不确保随时间的恒定胰岛素浓度。释放曲线为钟形的,并且持续仅12至16小时。因此,所述胰岛素每天注射两次。这种基础胰岛素nph的效果比现代基础胰岛素和差得多。nph是中效基础胰岛素。随着速效胰岛素类似物的出现,nph的原理已经发展,产生所谓的“预混合”产品,其同时提供迅速作用和中等作用。(novonordisk)和(elililly)是包含部分地被鱼精蛋白复合的速效胰岛素类似物和的制剂。因此,这些制剂包含被认为具有中等作用的胰岛素类似物微晶和具有迅速作用的保持可溶的胰岛素部分。这些制剂确实提供速效胰岛素的优点,但是其也具有nph的缺陷,即,限制于12至16小时的作用持续时间和“钟形”胰岛素释放曲线。然而,这些产品使得患者能够自施用中效基础胰岛素与速效餐时胰岛素一起的单注射。并且,许多患者希望降低其注射次数。目前市售的基础胰岛素可基于允许延长作用的技术方案进行分类,并且迄今为止,使用两种方法。第一种方法,即地特胰岛素的方法,是与白蛋白的体内结合。这涉及在ph7下可溶的类似物,其包含在b29位结合的脂肪酸侧链(十四烷酰基),这在体内允许该胰岛素与白蛋白结合。其延长作用主要是由于皮下注射后对白蛋白的这种亲和力。然而,其药动学曲线不能覆盖一天,并且因此其通常以每天两次注射使用。在ph7下可溶的另一种胰岛素是以d名称销售的德谷胰岛素。其也包含与胰岛素结合的脂肪酸侧链(十六烷二酰基-γ-l-glu)。第二种方法,甘精胰岛素的方法,是在生理ph下的沉淀。甘精胰岛素是如下获得的人胰岛素的类似物:通过两个精氨酸残基延伸人胰岛素b链的c端部分并用甘氨酸残基替代天冬酰胺残基a21(us5,656,722)。添加两个精氨酸残基旨在调节甘精胰岛素在生理ph下的pi(等电点),并且以这种方式使人胰岛素的这种类似物不溶于生理介质。另外,a21的替代旨在使甘精胰岛素在酸性ph下稳定,并且能够将其配制成在酸性ph下为可注射溶液的溶液形式。在皮下注射期间,甘精胰岛素从酸性ph(ph4-4.5)至生理ph(中性ph)的过渡导致其沉淀在皮肤下。甘精胰岛素微粒的缓慢再溶解确保缓慢且延长的作用。甘精胰岛素的降血糖作用在24小时的持续时间内几乎恒定,这允许大多数患者每天自身限于单次注射。现今认为甘精胰岛素是最常用的基础胰岛素。然而,甘精胰岛素类型的真正的缺点可以是等电点为5.8至8.5的基础胰岛素制剂所必需的酸性ph,因为甘精胰岛素制剂的这种酸性ph有时在注射期间会给患者带来疼痛,尤其是这会阻止与其他蛋白质的任何配制,特别是与餐时胰岛素的配制,因为后者在酸性ph下不稳定。由于以下事实在酸性ph下配制餐时胰岛素是不可能的:在这些条件下,餐时胰岛素经历a21位中脱酰胺的二次反应,这使其不满足适用于可注射药物的稳定性要求。迄今为止,在申请wo2013/021143a1、wo2013/104861a1、wo2014/124994a1和wo2014/124993a1中,示出了可在中性ph下溶解例如等电点为5.8至8.5的甘精胰岛素类型的这些基础胰岛素,同时不依赖于ph地维持体外介质(含有它的体外介质)和体内介质(皮肤下)之间的溶解度差异。特别地,申请wo2013/104861a1描述了ph为6.0至8.0的可注射水溶液形式的组合物,其至少包含(a)等电点pi为5.8至8.5的基础胰岛素和(b)带有羧酸根电荷并且被疏水性基团取代的共聚氨基酸。现有技术的这些组合物的主要缺点是其不足够稳定而不满足适用于药物制剂的规范。在本专利申请的实验部分的一些实施例中,示出特别是在wo2013/104861a1中描述的组合物随时间呈现出不令人满意的稳定性。因此,需要发现这样的溶液,其允许溶解等电点(pi)为5.8至8.5的基础胰岛素,同时在注射之后保持其基本特性,但也使得可满足基于胰岛素的药物产品的标准物理稳定性条件。令人惊讶的是,申请人已发现,根据本发明的带有羧酸根电荷和疏水性基团的共聚氨基酸使得可获得溶液形式的组合物,其不仅满足wo2013/104861a1中描述的要求,而且另外地能够赋予所述组合物以提高的物理稳定性,而不需要提高所用赋形剂的量。此外,当将等电点为5.8至8.5的基础胰岛素在组合物中与餐时胰岛素和/或胃肠激素组合时,这些从未达到先验的性能得以维持。因此,令人惊讶地,根据本发明的共聚氨基酸对甘精胰岛素的亲和力提高,因为其使得可在[hy]/[基础胰岛素]比值低于现有技术下获得甘精胰岛素溶液的溶解和稳定化;此外,这些结果是在不改变并且甚至提高甘精胰岛素的沉淀倾向下获得的,如实验部分所示出的。此外,这种亲和力的提高使得可在长期治疗的情况下限制对所述赋形剂的暴露水平。根据本发明的带有羧酸根电荷和疏水性基团hy的共聚氨基酸表现出优异的抗水解性。这特别地可在加速条件下(例如通过在碱性ph(ph12)下的水解测试)验证。此外,例如芬顿氧化(oxydationdefenton)类型的强制氧化测试显示,带有羧酸根电荷和疏水性基团hy的共聚氨基酸表现出良好的抗氧化性。因此,本发明涉及ph为6.0至8.0的可注射水溶液形式的物理稳定组合物,其至少包含:a)等电点(pi)为5.8至8.5的基础胰岛素,和b)带有羧酸根电荷和至少一个式i疏水性基团的共聚氨基酸。在一个实施方案中,本发明涉及ph为6.0至8.0的可注射水溶液形式的组合物,其至少包含:a)一种等电点(pi)为5.8至8.5的基础胰岛素;b)带有羧酸根电荷和疏水性基团hy的共聚氨基酸,所述共聚氨基酸由谷氨酸或天冬氨酸单元组成,并且所述疏水性基团hy具有下式i:其中:-gpr是式ii或ii’基团:-gpa是式iii或iii’基团:-gpc是式iv基团:-hy包含多于30个碳原子,-*表示通过酰胺官能团结合的不同基团的连接位点;-a是等于0或1的整数;-b是等于0或1的整数;-p是等于1或2的整数,并且○如果p等于1,则a等于0或1且gpa是式iii’基团;并且○如果p等于2,则a等于1且gpa是式iii基团;-c是等于0或1的整数,并且如果c等于0,则d等于1或2;-d是等于0、1或2的整数;-r是等于0或1的整数,并且○如果r等于0,则式i疏水性基团通过疏水性基团的羰基与共聚氨基酸的n端位置的氮原子之间的共价键与共聚氨基酸结合,由此形成酰胺官能团,其来源于共聚氨基酸之前体的n端位置的胺官能团与疏水性基团之前体所带有的酸官能团的反应;并且○如果r等于1,则式i疏水性基团如下与共聚氨基酸结合:●通过疏水性基团的氮原子与共聚氨基酸的羰基之间的共价键,由此形成酰胺官能团,其来源于疏水性基团之前体的胺官能团与共聚氨基酸之前体所带有的酸官能团的反应,或●通过疏水性基团的羰基与共聚氨基酸的n端位置的氮原子之间的共价键,由此形成酰胺官能团,其来源于疏水性基团之前体的酸官能团与共聚氨基酸之前体在n端位置所带有的胺官能团的反应;-r是选自以下的基团:○直链或支链二价烷基,在gpr是式ii基团的情况下,所述烷基包含2至12个碳原子,或者,在gpr是式ii’基团的情况下,所述烷基包含1至11个碳原子;○直链或支链二价烷基,在gpr是式ii基团的情况下,所述烷基包含2至11个碳原子,或者,在gpr是式ii’基团的情况下,所述烷基包含1至11个碳原子,所述烷基带有一个或更多个-conh2官能团;以及○包含4至14个碳原子和1至5个氧原子的未经取代的醚或聚醚基团;-a是包含1至6个碳原子的直链或支链烷基;-b是包含1至9个碳原子的直链或支链烷基,其任选地包含芳环;-cx是直链或支链的一价烷基,其中x表示碳原子数,并且:○如果p等于1,则x为11至25(11≤x≤25);○如果p等于2,则x为9至15(9≤x≤15),-疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0<i≤0.5;-当共聚氨基酸带有数个疏水性基团时,则它们是相同或不同的,-谷氨酸或天冬氨酸单元的聚合度dp为5至250;-游离酸官能团是选自na+和k+的碱性阳离子的盐的形式。根据本发明的组合物的ph为6.0至8.0,优选6.6至7.8,或更优选6.8至7.6。所述带有羧酸根电荷和疏水性基团hy的共聚氨基酸在ph为6至8、温度为25℃和浓度低于60mg/ml下在水溶液中可溶。“物理稳定组合物”应理解为是指满足欧洲、美国和国际药典中描述的目视检查的标准的组合物,即澄清且不含可见颗粒但也无色的组合物。“可注射水溶液”应理解为意指溶剂为水的溶液,其满足ep和us药典的条件。“由谷氨酸或天冬氨酸单元组成的共聚氨基酸”应理解为意指通过肽键彼此结合的谷氨酸或天冬氨酸单元的非环状直链,所述链具有对应于一端的羧酸的c端部分和对应于该链的另一端的胺的n端部分。“可溶的”应理解为意指能够使得在25℃下在蒸馏水中以小于60mg/ml的浓度制备不含颗粒的澄清溶液。“烷基”应理解为意指不包含杂原子的直链或支链碳链。共聚氨基酸是谷氨酸和/或天冬氨酸单元的链中的统计学共聚氨基酸。在所述式中,*表示所表示的不同元件的连接位点。在一个实施方案中,根据本发明的组合物的特征在于,hy包含多于30个碳原子。在一个实施方案中,根据本发明的组合物的特征在于,hy包含30至70个碳原子。在一个实施方案中,当p=1时,x为11至25(11≤x≤25)。特别地,当x为15至16(x=15或16)时,则r=1且r是醚或聚醚基团,并且当x大于17(x≥17)时,则r=1且r是醚或聚醚基团。在一个实施方案中,当p=2时,x为9至15(9≤x≤15)。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团选自下式v所示的其中p=1的式i疏水性基团:gpr、gpa、gpc、r和a具有上文给出的定义。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中r等于1(r=1)并且a等于0(a=0)。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中r等于1(r=1)并且a等于1(a=1)。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含2至12个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含2至6个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含2至6个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含2至4个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含2至4个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含2个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii基团,其中r是包含6个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii’基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii’基团,其中r是包含1至11个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii’基团,其中r是包含1至6个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是包含2至5个碳原子且带有一个或更多个酰胺官能团(-conh2)的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii’或ii基团,其中r是包含2至5个碳原子且带有一个或更多个酰胺官能团(-conh2)的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是选自下式所示基团的基团:在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是式x1基团。在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是式x2基团。在一个实施方案中,根据本发明的组合物的特征在于,基团r通过酰胺官能团与共聚氨基酸结合,所述酰胺团由相对于酰胺官能团(-conh2)在δ或ε位置(或者在第4或5位)的碳携带。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是包含4至14个碳原子和1至5个氧原子的未经取代的直链醚或聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是包含4至6个碳原子的醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是由式x7的式表示的醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中gpr是式ii或ii’基团,其中r是包含6至10个碳原子和2至3个氧原子的直链聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是选自下式所示基团的聚醚基团:在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是式x3基团。在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是式x4基团。在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是式x5基团。在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii或ii’基团,其中r是式x6基团。在一个实施方案中,根据本发明的组合物的特征在于式v疏水性基团,其中gpr是其中r是选自下式所示基团的聚醚基团的基团:在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii基团,其中r是式x5聚醚基团。在一个实施方案中,所述组合物的特征在于式v疏水性基团,其中gpr是式ii基团,其中r是式x6聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中a等于0(a=0)并且r等于0(r=0)。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa选自下式所示基团:在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1),并且式iii’基团gpa是式y1基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1),并且式iii’基团gpa是式y2基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa是式y3基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa是式y4基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa是式y5基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa是式y6基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa是式y7基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式v基团,其中a等于1(a=1)并且式iii’基团gpa是式y8基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自下文中所示的式iva、ivb或ivc基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中基团gpc是式iva。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中b等于0的式iva、ivb或ivc基团,其分别具有下文中所示的式ivd、ive和ivf:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中基团gpc对应于其中b=0的式iv或iva,并且对应于式ivd。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中其中b=1的式iv基团gpc选自这样的基团,其中b是选自下式所示基团的氨基酸残基:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式的基团gpc对应于其中b=1的式iv或iva,其选自这样的基团,其中b是选自下式所示基团的氨基酸残基:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自直链烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自支链烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自包含11至14个碳原子之基团的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自下式所示基团的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自包含15至16个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自下式所示基团的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自下式所示基团的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自包含17至25个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自包含17至18个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自下式所示烷基的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自包含19至25个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自下式所示烷基的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式v基团,其中式iv基团gpc选自其中cx选自包含18至19个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述式i疏水性基团选自下式vi所示的其中a=1且p=2的式i疏水性基团:其中:gpr、gpa、gpc、r和a具有上文给出的定义。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团,其中r是包含2至12个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团,其中r是包含2至6个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团,其中r是包含2至6个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团,其中r是至少一个包含2至4个碳原子的烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团,其中r是包含2至4个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii基团,其中r是包含2个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii’基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii’基团,其中r是包含1至11个碳原子的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii’基团,其中r是包含1至6个碳原子的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是包含2至5个碳原子且带有一个或更多个酰胺官能团(-conh2)的二价烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是包含2至5个碳原子且带有一个或更多个酰胺官能团(-conh2)的二价直链烷基。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是选自下式所示基团的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr基团中使所述gpr基团与共聚氨基酸结合参与形成酰胺官能团的胺官能团由相对于酰胺官能团(-conh2)在δ或ε位置(或者在第4或5位)的碳携带。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是包含4至14个碳原子和1至5个氧原子的未经取代的直链醚或聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述醚基团r是包含4至6个碳原子的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述醚基团是式x7在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是包含6至10个碳原子和2至3个氧原子的直链聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是选自下式所示基团的直链聚醚基团:在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是式x3的直链聚醚基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是式x4的直链聚醚基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是式x5的直链聚醚基团。在一个实施方案中,所述组合物的特征在于,所述疏水性基团是式vi基团,其中gpr是式ii或ii’基团,其中r是式x6的直链聚醚基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iii基团gpa选自下文中所示的式iiia、iiib和iiic基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iii基团gpa是下文中所示的式iiib基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iii基团gpa是式iiic基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自下文中所示的式iva、ivb和ivc基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中基团gpc是式iva基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中b等于0的式iva、ivb或ivc基团,其分别对应于下文中所示的式ivd、ive和ivf:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中基团gpc对应于其中b=0的式iv或iva,并且其对应于式ivd。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自包含9至15个碳原子的直链烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自包含9至15个碳原子的支链烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自包含9或10个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自下式所示基团的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自包含11至15个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自包含11至13个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自下式所示基团的基团:在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自包含14或15个碳原子的烷基的基团。在一个实施方案中,根据本发明的组合物的特征在于,所述疏水性基团是式vi基团,其中式iv基团gpc选自其中cx选自下式所示基团的基团:在式i、v和vi中,*表示疏水性基团与共聚氨基酸的连接位点。基团hy通过酰胺官能团与共聚氨基酸连接。在式ii和ii’中,*从左到右分别表示gpr与以下的连接位点:-共聚氨基酸,以及-如果a=1,则为gpa;或者如果a=0,则为gpc。在式iii和iii’中,*从左到右分别表示gpa与以下的连接位点:-如果r=1,则为gpr;或者如果r=0,则为共聚氨基酸,以及-gpc。在式iv中,*表示gpc与以下的连接位点:-如果a=1,则为gpa;如果r=1且a=0,则为gpr;或者如果r=0且a=0,则为共聚氨基酸。不同基团gpr、gpa和gpc之间的所有连接都是酰胺官能团。基团hy、gpr、gpa、gpc和d各自独立地残基彼此相同或不同。当共聚氨基酸包含一个天冬氨酸单元或数个天冬氨酸单元时,所述天冬氨酸单元可经历结构重排。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自下式vii的共聚氨基酸:其中:·d独立地表示-ch2-基团(天冬氨酸单元)或-ch2-ch2-基团(谷氨酸单元),·hy是选自式i、v或vi疏水性基团的疏水性基团,其中r=1,且gpr是式ii基团,·r1是选自式i、v或vi疏水性基团的疏水性基团,其中r=0或r=1且gpr是式ii’基团;或者是选自h、c2至c10直链酰基、c4至c10支链酰基、苄基、末端“氨基酸”单元和焦谷氨酸的基团,·r2是选自式i、v或vi疏水性基团的疏水性基团,其中r=1且gpr是式ii基团;或者是-nr’r”基团,相同或不同的r’和r”选自h、c2至c10直链或支链或环状烷基、苄基,并且所述烷基r’和r”一起任选地形成一个或更多个饱和的、不饱和的和/或芳香族的碳环和/或任选地包含选自o、n和s的杂原子;·x表示选自碱性阳离子的阳离子实体;·n+m表示共聚氨基酸的聚合度dp,即每个共聚氨基酸链的单体单元的平均数,并且5≤n+m≤250。在一个实施方案中,根据本发明的组合物的特征在于,当共聚氨基酸包含天冬氨酸单元时,则共聚氨基酸可另外包含式viii和/或viii’的单体单元:“具有统计学接枝的共聚氨基酸”用于表示带有羧酸根电荷和至少一个疏水性基团的共聚氨基酸,式viia的共聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自下式viia的式vii共聚氨基酸,其中r1=r’1且r2=r’2:其中:-m、n、x、d和hy具有上文给出的定义,-r’1是选自h、c2至c10直链酰基、c4至c10支链酰基、苄基、末端“氨基酸”单元和焦谷氨酸的基团,-r’2是-nr’r”基团,相同或不同的r’和r”选自h、c2至c10直链或支链或环状烷基、苄基,并且所述烷基r’和r”一起任选地形成一个或更多个饱和的、不饱和的和/或芳香族的碳环和/或任选地包含选自o、n和s的杂原子。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viia的共聚氨基酸,其中hy是式vi基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viia的共聚氨基酸,其中hy是式vi基团,其中r=1。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viia的共聚氨基酸,其中hy是式vi基团,其中r=1,并且对于gpc,b=0。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viia的共聚氨基酸,其中hy是式vi基团,并且其中gpc是式ivd基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viia的共聚氨基酸,其中hy是式vi基团,并且其中gpc是式ivd基团且r=1。“具有确定接枝的共聚氨基酸”是指带有羧酸根电荷和至少一个疏水性基团的共聚氨基酸,式viib的共聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自下式viib的式vii共聚氨基酸,其中n=0:其中m、x、d、r1和r2具有上文给出的定义,并且至少r1或r2是式i、v或vi疏水性基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自viib的式vii共聚氨基酸,其中n=0,并且r1或r2是式i、v或vi的疏水性基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的式viib共聚氨基酸,其中r1=r’1:其中m、x、d、r’1和r2具有上文给出的定义,并且r2是式i、v或ⅵ疏水性基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib”的式viib共聚氨基酸,其中r2=r’2:其中m、x、d、r1和r’2具有上文给出的含义,并且r1是式i、v或ⅵ疏水性基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib或viib”的共聚氨基酸,其中r1是式i、v或vi疏水性基团,其中r=0或r=1且gpr为式ii’。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib或viib”的共聚氨基酸,其中r1是式vi疏水性基团且gpr是式ii’。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib或viib”的共聚氨基酸,其中r1是式vi疏水性基团,且gpr为式ii’,且gpc为式iva。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib或viib”的共聚氨基酸,其中r1是式vi疏水性基团,且gpr为式ii’,且gpc为式ivd。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib或viib’的共聚氨基酸,其中r2是式i、v或vi疏水性基团,其中r=1且gpr为式ii。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式v疏水性基团,其中r=1且gpr为式ii且a=0。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式v疏水性基团,其中r=1,gpr为式ii,且a=0,且gpc为式iva或ivc。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式v疏水性基团,其中r=1,gpr为式ii,且a=0,且gpc为式iva。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib′的共聚氨基酸,其中r2是式v疏水性基团,其中r=1,gpr为式ii,且a=0,且gpc为式ivc。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式v疏水性基团,其中r=1,gpr为式ii,且a=0,且gpc为式ivd或ivf。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式v疏水性基团,其中r=1,gpr为式ii,且a=0,且gpc为式ivd。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式v疏水性基团,其中r=1,gpr为式ii,且a=0,且gpc为式ivf。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式vi疏水性基团,其中r=1且gpr为式ii且a=1。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式vi疏水性基团,其中r=1,gpr为式ii,a=1,且gpc为式iva或ivd。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式vi疏水性基团,其中r=1,gpr为式ii,a=1,且gpc为式ivd。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式vi疏水性基团,其中r=1,gpr为式ii,a=1,且gpc为式ivd,其中x=11。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式vi疏水性基团,其中r=1,gpr为式ii,a=1,且gpc为式ivd,其中x=13。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式viib’的共聚氨基酸,其中r2是式vi疏水性基团,其中r=1,gpr为式ii,a=1,且gpc为式ivd,其中x=15。在一个实施方案中,所述组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自下式xx的共聚氨基酸:其中:·d独立地表示-ch2-基团(天冬氨酸单元)或-ch2-ch2-基团(谷氨酸单元),·hy是选自式i、v或vi疏水性基团的疏水性基团,其中r=1,且gpr是式ii基团,·r1是选自式i、v或vi疏水性基团的疏水性基团,其中r=0或r=1且gpr是式ii’基团;或者是选自h、c2至c10直链酰基、c4至c10支链酰基、苄基、末端“氨基酸”单元和焦谷氨酸的基团,·r2是选自式i、v或vi疏水性基团的疏水性基团,其中r=1且gpr是式ii基团;或者是-nr’r”基团,相同或不同的r’和r”选自h、c2至c10直链或支链或环状烷基、苄基,并且所述烷基r’和r”一起任选地形成一个或更多个饱和的、不饱和的和/或芳香族的碳环和/或任选地包含选自o、n和s的杂原子;·r1或r2中的至少一个是如上限定的疏水性基团;·x表示h或选自金属阳离子的阳离子实体;·n+m表示共聚氨基酸的聚合度dp,即每个共聚氨基酸链的单体单元的平均数,并且5≤n+m≤250。在一个实施方案中,根据本发明的组合物的特征在于,r1是选自c2至c10直链酰基、c4至c10支链酰基、苄基、末端“氨基酸”基团和焦谷氨酸的基团。在一个实施方案中,根据本发明的组合物的特征在于,r1是选自c2至c10直链酰基或c4至c10支链酰基的基团。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式vii、viia、viib、viib’或viib”的共聚氨基酸,其中所述共聚氨基酸选自其中d基团是-ch2-基团(天冬氨酸单元)的共聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于,带有羧酸根电荷和疏水性基团的共聚氨基酸选自式vii、viia、viib、viib’或viib”的共聚氨基酸,其中所述共聚氨基酸选自其中基团d是-ch2-ch2-基团(谷氨酸单元)的共聚氨基酸。疏水性基团与基础胰岛素的比值是指直至获得预期性能其各自摩尔浓度的比值:[hy]/[基础胰岛素](mol/mol),所述预期性能即基础胰岛素在ph6.0至8.0下的溶解、基础胰岛素的沉淀和根据本发明的组合物的稳定性。测量的疏水性基团与基础胰岛素之间的比值[hy]/[基础胰岛素]的最小值是以下值,在该值下基础胰岛素溶解,因为溶解是获得的最小效果;这种溶解决定只有在基础胰岛素在6.0至8.0的ph下溶解时才可观察到的所有其他技术效果。在根据本发明的组合物中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]可大于由溶解界限决定的最小值。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤2。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤1.75。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤1.5。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤1.25。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤1.00。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤0.75。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤0.5。在一个实施方案中,疏水性基团相对于基础胰岛素的比值[hy]/[基础胰岛素]≤0.25。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.007至0.3。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.3。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.02至0.2。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.007至0.15。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.1。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.02至0.08。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含9至10个碳原子的式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.03至0.15。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含11至12个碳原子的式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.015至0.1。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含11至12个碳原子的式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.02至0.08。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含13至15个碳原子的式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.1。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含13至15个碳原子的式vi,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.06。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.007至0.3。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.3。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.015至0.2。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含11至14个碳原子的式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.1至0.2。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含15至16个碳原子的式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.04至0.15。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含17至18个碳原子的式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.02至0.06。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含19至25个碳原子的式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.06。在一个实施方案中,根据本发明的组合物的特征在于,疏水性基团对应于其中基团cx包含19至25个碳原子的式v,并且疏水性基团的数目与谷氨酸或天冬氨酸单元的数目之间的比值i为0.01至0.05。在一个实施方案中,根据本发明的组合物的特征在于,n+m为10至200。在一个实施方案中,根据本发明的组合物的特征在于,n+m为15至150。在一个实施方案中,根据本发明的组合物的特征在于,n+m为15至100。在一个实施方案中,根据本发明的组合物的特征在于,n+m为15至80。在一个实施方案中,根据本发明的组合物的特征在于,n+m为15至65。在一个实施方案中,根据本发明的组合物的特征在于,n+m为20至60。在一个实施方案中,根据本发明的组合物的特征在于,n+m为20至50。在一个实施方案中,根据本发明的组合物的特征在于,n+m为20至40。在一个实施方案中,至少一个式i疏水性基团选自以下式i基团,其中r=1,a=0,p=1,gpr对应于其中r是的式ii,gpc对应于其中x=15且cx是的式ivd。在一个实施方案中,至少一个式i疏水性基团选自以下式i基团,其中r=1,a=0,p=1,gpr对应于其中r是的式ii,gpc对应于其中x=19且cx是的式ivd。在一个实施方案中,至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=9且cx是的式ivd。在一个实施方案中,至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=11且cx是的式ivd。在一个实施方案中,至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=22+/-5,i=0.05+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=0,p=1,gpr对应于其中r是的式ii,gpc对应于其中x=19且cx是的式ivd。聚合度dp和比值i的值通过将来源于共聚氨基酸之疏水性基团的信号的积分与来源于共聚氨基酸主链的信号的积分进行比较来通过d2o中1hnmr评估。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=25+/-5,i=0.07+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=0,p=1,gpr对应于其中r是的式ii,gpc对应于其中x=15且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=23+/-5,i=0.05+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=0,p=1,gpr对应于其中r是的式ii,gpc对应于其中x=19且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viib的共聚氨基酸,其中dp=25+/-5,0.033≤i≤0.05,并且式i疏水性基团选自以下式i基团,其中r=1,a=0,p=1,gpr对应于其中r是的式ii,gpc对应于其中x=19且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=22+/-5,i=0.05+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=11且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=35+/-5,i=0.05+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=11且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=65+/-5,i=0.05+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=11且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=22+/-5,i=0.04+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=22+/-5,i=0.03+/-0.01,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viia的共聚氨基酸,其中dp=22+/-5,i=0.07+/-0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是的式ii,gpa对应于式iiib,gpc对应于其中x=9且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viib的共聚氨基酸,其中dp=27+/-5,0.031≤i≤0.045,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=11且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii、viib、viib’或viib”的共聚氨基酸,其中dp=22+/-5,0.037≤i≤0.055,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii、viib、viib’或viib”的共聚氨基酸,其中dp=22+/-5,0.037≤i≤0.055,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii或viib的共聚氨基酸,其中dp=60+/-10,0.014≤i≤0.02,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸是式vii、viib、viib’或viib”的共聚氨基酸,其中dp=40+/-5,0.022≤i≤0.029,并且至少一个式i疏水性基团选自以下式i基团,其中r=1,a=1,p=2,gpr对应于其中r是-ch2-ch2-的式ii,gpa对应于式iiib,gpc对应于其中x=13且cx是的式ivd。本发明还涉及带有羧酸根电荷和式i、v或vi疏水性基团的所述共聚氨基酸。在一个实施方案中,本发明还涉及式i’、v’和vi’的所述疏水性基团的前体:gpr、gpa、gpc、r、a、p具有上文给出的含义。本发明还涉及用于制备稳定的可注射组合物的方法。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过谷氨酸n-羧酸酐衍生物或天冬氨酸n-羧酸酐衍生物的开环聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过综述文章adv.polym.sci.2006,202,1-18(deming,t.j.)所述的谷氨酸n-羧酸酐衍生物或天冬氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过谷氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过谷氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸,所述谷氨酸n-羧酸酐衍生物选自聚谷氨酸甲酯n-羧酸酐(gluome-nca)、聚谷氨酸苄酯n-羧酸酐(gluobz1-nca)和聚谷氨酸叔丁酯n-羧酸酐(gluotbu-nca)。在一个实施方案中,谷氨酸n-羧酸酐衍生物是聚-l-谷氨酸甲酯n-羧酸酐(l-gluome-nca)。在一个实施方案中,谷氨酸n-羧酸酐衍生物是聚-l-谷氨酸苄酯n-羧酸酐(l-gluobz1-nca)。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自如出版物nature1997,390,386-389(deming,t.j.)中所述使用过渡金属的有机金属配合物作为引发剂通过谷氨酸n-羧酸酐衍生物或天冬氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自如专利fr2,801,226(touraud,f.;等)以及该专利中引用的参考文献所述使用氨或伯胺作为引发剂通过谷氨酸n-羧酸酐衍生物或天冬氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自如出版物j.am.chem.soc.2007,129,14114-14115(luh.;等)中所述使用六甲基二硅氮烷作为引发剂或如出版物j.am.chem.soc.2008,130,12562-12563(luh.;等)中所述使用甲硅烷基化胺作为引发剂通过谷氨酸n-羧酸酐衍生物或天冬氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于用于合成通过谷氨酸n-羧酸酐衍生物或天冬氨酸n-羧酸酐衍生物的聚合获得的聚氨基酸(共聚氨基酸从其来源)的方法包括水解酯官能团的步骤。在一个实施方案中,该水解酯官能团的步骤可由在酸性介质中水解或在碱性介质中水解组成,或者其可通过氢化进行。在一个实施方案中,该水解酯官能团的步骤是在酸性介质中水解。在一个实施方案中,该水解酯官能团的步骤通过氢化进行。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚氨基酸的解聚获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚氨基酸的酶促解聚获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚氨基酸的化学解聚获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚氨基酸的酶促和化学解聚获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚氨基酸的解聚获得的聚氨基酸,所述较高分子量的聚氨基酸选自聚谷氨酸钠和聚天冬氨酸钠。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚谷氨酸钠的解聚获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸源自通过较高分子量的聚天冬氨酸钠的解聚获得的聚氨基酸。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸通过使用本领域技术人员公知的形成酰胺键的方法将疏水性基团接枝到聚-l-谷氨酸或聚-l-天冬氨酸上获得。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸通过使用用于肽合成的形成酰胺键的方法将疏水性基团接枝到聚-l-谷氨酸或聚-l-天冬氨酸上获得。在一个实施方案中,根据本发明的组合物的特征在于共聚氨基酸通过如专利fr2,840,614(chan,y.p.;等)中所述将疏水性基团接枝到聚-l-谷氨酸或聚-l-天冬氨酸上获得。下面,用于胰岛素的单位是药典推荐的单位;在下表中给出了mg/ml的相关对应关系:等电点为5.8至8.5的基础胰岛素应理解为意指在ph7下不溶且在标准糖尿病模型中的作用持续时间为8至24小时或更长的胰岛素。这些等电点为5.8至8.5的基础胰岛素是重组胰岛素,其一级结构主要通过引入碱性氨基酸(例如精氨酸或赖氨酸)进行修饰。它们例如描述于以下专利、专利申请或出版物中:wo2003/053339、wo2004/096854、us5,656,722和us6,100,376,其内容通过引用并入本文。在一个实施方案中,等电点为5.8至8.5的基础胰岛素是甘精胰岛素。甘精胰岛素由sanofi以商品名(100u/ml)或(300u/ml)销售。在一个实施方案中,等电点为5.8至8.5的基础胰岛素是生物仿制药甘精胰岛素。生物仿制药甘精胰岛素处于由elililly以商品名或销售的过程中。在一个实施方案中,根据本发明的组合物包含40至500u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含40u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含100u/ml(或约3.6mg/ml)的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含150u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含200u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含225u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含250u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含300u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含400u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,根据本发明的组合物包含500u/ml的等电点为5.8至8.5的基础胰岛素。在一个实施方案中,等电点为5.8至8.5的基础胰岛素与共聚氨基酸之间的重量比或共聚氨基酸/基础胰岛素为0.2至8。在一个实施方案中,重量比为0.2至6。在一个实施方案中,重量比为0.2至5。在一个实施方案中,重量比为0.2至4。在一个实施方案中,重量比为0.2至3。在一个实施方案中,重量比为0.2至2。在一个实施方案中,重量比为0.2至1。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸的浓度为至多60mg/ml。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸的浓度为至多40mg/ml。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸的浓度为至多20mg/ml。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸的浓度为至多10mg/ml。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸的浓度为至多5mg/ml。在一个实施方案中,带有羧酸根电荷和疏水性基团的共聚氨基酸的浓度为至多2.5mg/ml。在一个实施方案中,根据本发明的组合物还包含餐时胰岛素。餐时胰岛素在ph7下可溶。餐时胰岛素应理解为意指所谓的速效或“普通”胰岛素。所谓的速效餐时胰岛素是必须响应于进餐期间蛋白质和糖类摄入所诱导的需要的胰岛素;其必须在小于30分钟内起效。在一个实施方案中,所谓的“普通”餐时胰岛素是人胰岛素。在一个实施方案中,餐时胰岛素是欧洲药典和美国药典中所述的重组人胰岛素。人胰岛素例如以商品名(elililly)和(novonordisk)销售。所谓的非常速效(快速作用)餐时胰岛素是通过重组获得的胰岛素,其一级结构被修饰以缩短其作用时间。在一个实施方案中,所谓的非常速效(快速作用)餐时胰岛素选自包含以下的组:赖脯胰岛素谷赖胰岛素和门冬胰岛素在一个实施方案中,餐时胰岛素是赖脯胰岛素。在一个实施方案中,餐时胰岛素是谷赖胰岛素。在一个实施方案中,餐时胰岛素是门冬胰岛素。在一个实施方案中,根据本发明的组合物包含总共60至800u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共100至500u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共800u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共700u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共600u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共500u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共400u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共300u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共266u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共200u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。在一个实施方案中,根据本发明的组合物包含总共100u/ml的胰岛素,其具有餐时胰岛素和等电点为5.8至8.5的基础胰岛素的组合。对于如上所述包含60至800u/ml的制剂,等电点为5.8至8.5的基础胰岛素与餐时胰岛素之间的比例例如以百分比表示为25/75、30/70、40/60、50/50、60/40、63/37、70/30、75/25、80/20、83/17、90/10。然而,可使用任何其他比例。在一个实施方案中,根据本发明的组合物还包含胃肠激素。“胃肠激素”应理解为意指选自以下的激素:glp-1ra(胰高血糖素样肽-1受体激动剂)和gip(葡萄糖依赖性促胰岛素释放肽)、胃泌酸调节素(胰高血糖素原衍生物)、肽yy、胰淀素、缩胆囊素、胰多肽(pp)、食欲刺激素和肠抑肽、其类似物或衍生物和/或其可药用盐。在一个实施方案中,胃肠激素是选自以下的glp-1ra类似物或衍生物:艾塞那肽(exenatide)或(astra-zeneca)、利拉鲁肽(liraglutide)或(novonordisk)、利西拉肽(lixisenatide)或(sanofi)、阿必鲁肽(albiglutide)或(gsk)或者杜拉鲁肽(dulaglutide)或(elililly&co)、其类似物或衍生物及其可药用盐。在一个实施方案中,胃肠激素是普兰林肽(pramlintide)或(astra-zeneca)。在一个实施方案中,胃肠激素是艾塞那肽或其类似物或衍生物及其可药用盐。在一个实施方案中,胃肠激素是利拉鲁肽或其类似物或衍生物及其可药用盐。在一个实施方案中,胃肠激素是利西拉肽或其类似物或衍生物及其可药用盐。在一个实施方案中,胃肠激素是阿必鲁肽或其类似物或衍生物及其可药用盐。在一个实施方案中,胃肠激素是杜拉鲁肽或其类似物或衍生物及其可药用盐。在一个实施方案中,胃肠激素是普兰林肽或其类似物或衍生物及其可药用盐。当用于提及肽或蛋白质时,“类似物”应理解为意指其中一个或更多个组成氨基酸残基已被替换成其他氨基酸残基和/或其中已消除一个或更多个组成氨基酸残基和/或其中已添加一个或更多个组成性氨基酸残基的肽或蛋白质。目前定义的类似物之可接受同源性百分比为50%。当用于提及肽或蛋白质时,“衍生物”应理解为意指已通过参考肽或蛋白质或类似物中不存在的取代基进行化学修饰的肽或蛋白质或类似物,即已通过产生共价键以引入取代基进行修饰的肽或蛋白质。在一个实施方案中,取代基选自脂肪链。在一个实施方案中,胃肠激素的浓度为0.01至100mg/ml。在一个实施方案中,艾塞那肽、其类似物或衍生物及其可药用盐的浓度为0.04至0.5mg/ml。在一个实施方案中,利拉鲁肽、其类似物或衍生物及其可药用盐的浓度为1至10mg/ml。在一个实施方案中,利西拉肽、其类似物或衍生物及其可药用盐的浓度为0.01至1mg/ml。在一个实施方案中,阿必鲁肽、其类似物或衍生物及其可药用盐的浓度为5至100mg/ml。在一个实施方案中,杜拉鲁肽、其类似物或衍生物及其可药用盐的浓度为0.1至10mg/ml。在一个实施方案中,普兰林肽、其类似物或衍生物及其可药用盐的浓度为0.1至5mg/ml。在一个实施方案中,根据本发明的组合物通过以10/90至90/10的体积比混合等电点为5.8至8.5的基础胰岛素的商业溶液和glp-1ra、glp-1ra类似物或衍生物的商业溶液产生。在一个实施方案中,根据本发明的组合物包含每日剂量的基础胰岛素和每日剂量的胃肠激素。在一个实施方案中,根据本发明的组合物包含40u/ml至500u/ml的等电点为5.8至8.5的基础胰岛素,以及0.05至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含40u/ml至500u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含40u/ml至500u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含40u/ml至500u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含40u/ml至500u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含500u/ml的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含500u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含500u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含500u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含500u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含400u/ml的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含400u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含400u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含400u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含400u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含300u/ml的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含300u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含300u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含300u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含300u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含225u/ml的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含225u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含225u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含225u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含225u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含200u/ml的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含200u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含200u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含200u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含200u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含100u/ml(或约3.6mg/ml)的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含100u/ml(或约3.6mg/ml)的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含100u/ml(或约3.6mg/ml)的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含100u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含100u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物包含40u/ml的等电点为5.8至8.5的基础胰岛素,以及0.04至0.5mg/ml的艾塞那肽。在一个实施方案中,根据本发明的组合物包含40u/ml的等电点为5.8至8.5的基础胰岛素,以及1至10mg/ml的利拉鲁肽。在一个实施方案中,根据本发明的组合物包含40u/ml的等电点为5.8至8.5的基础胰岛素,以及0.01至1mg/ml的利西拉肽。在一个实施方案中,根据本发明的组合物包含40u/ml的等电点为5.8至8.5的基础胰岛素,以及5至100mg/ml的阿必鲁肽。在一个实施方案中,根据本发明的组合物包含40u/ml的等电点为5.8至8.5的基础胰岛素,以及0.1至10mg/ml的杜拉鲁肽。在一个实施方案中,根据本发明的组合物还包含浓度为0至5000μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为0至4000μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为0至3000μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为0至2000μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为0至1000μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为50至600μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为100至500μm的锌盐。在一个实施方案中,根据本发明的组合物还包含浓度为200至500μm的锌盐。在一个实施方案中,根据本发明的组合物还包含缓冲剂。在一个实施方案中,根据本发明的组合物包含浓度为0至100mm的缓冲剂。在一个实施方案中,根据本发明的组合物包含浓度为15至50mm的缓冲剂。在一个实施方案中,根据本发明的组合物包含选自磷酸盐缓冲剂、三(三羟甲基氨基甲烷)和柠檬酸钠的缓冲剂。在一个实施方案中,缓冲剂是磷酸钠。在一个实施方案中,缓冲剂是三(三羟甲基氨基甲烷)。在一个实施方案中,缓冲剂是柠檬酸钠。在一个实施方案中,根据本发明的组合物还包含防腐剂。在一个实施方案中,防腐剂选自单独或混合物形式的间甲酚和苯酚。在一个实施方案中,防腐剂的浓度为10至50mm。在一个实施方案中,防腐剂的浓度为10至40mm。在一个实施方案中,根据本发明的组合物还包含表面活性剂。在一个实施方案中,表面活性剂选自丙二醇和聚山梨酯。根据本发明的组合物还可包含添加剂,例如张力剂。在一个实施方案中,张力剂选自甘油、氯化钠、甘露糖醇和甘氨酸。根据本发明的组合物还可包含符合药典并且与常规浓度下使用的胰岛素相容的所有赋形剂。本发明还涉及根据本发明的药物制剂,其特征在于其通过干燥和/或冻干获得。在局部和全身释放的情况下,考虑的施用方式是通过静脉内、皮下、皮内或肌肉内途径。还考虑了透皮、经口、经鼻、经阴道、经眼、口含、经肺施用途径。本发明还涉及ph为6.0至8.0的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素。本发明还涉及ph为6.0至8.0的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素,以及餐食胰岛素。本发明还涉及ph为6.0至8.0的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素,以及如上定义的胃肠激素。本发明还涉及ph为6.0至8.0的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素、餐食胰岛素,以及如上定义的胃肠激素。本发明还涉及ph为6.6至7.8的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素。本发明还涉及ph为6.6至7.8的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素,以及餐时胰岛素。本发明还涉及ph为6.6至7.8的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素,以及如上定义的胃肠激素。本发明还涉及ph为6.6至7.8的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素、餐时胰岛素,以及如上定义的胃肠激素。本发明还涉及ph为6.6至7.6的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素。本发明还涉及ph为6.6至7.6的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素,以及餐时胰岛素。本发明还涉及ph为6.6至7.6的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素,以及如上定义的胃肠激素。本发明还涉及ph为6.6至7.6的单剂量制剂,其包含等电点为5.8至8.5的基础胰岛素、餐时胰岛素,以及如上定义的胃肠激素。在一个实施方案中,单剂量制剂还包含如上定义的共聚氨基酸。在一个实施方案中,制剂为可注射溶液的形式。在一个实施方案中,等电点为5.8至8.5的基础胰岛素是甘精胰岛素。在一个实施方案中,餐时胰岛素是人胰岛素。在一个实施方案中,胰岛素如欧洲药典和美国药典中所述的重组人胰岛素。在一个实施方案中,餐时胰岛素选自包含以下的组:赖脯胰岛素谷赖胰岛素和门冬胰岛素在一个实施方案中,餐时胰岛素是赖脯胰岛素。在一个实施方案中,餐时胰岛素是谷赖胰岛素。在一个实施方案中,餐时胰岛素是门冬胰岛素。在一个实施方案中,glp-1ra、glp-1ra类似物或衍生物选自包含以下的组:艾塞那肽利拉鲁肽利西拉肽阿必鲁肽杜拉鲁肽或一种其衍生物。在一个实施方案中,胃肠激素是艾塞那肽。在一个实施方案中,胃肠激素是利拉鲁肽。在一个实施方案中,胃肠激素是利西拉肽。在一个实施方案中,胃肠激素是阿必鲁肽。在一个实施方案中,胃肠激素是杜拉鲁肽。由于溶液外观的变化,可用肉眼观察到并简单地控制通过根据本发明具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸对等电点为5.8至8.5的基础胰岛素在ph6.0至8.0下的溶解。由于溶液外观的变化,可用肉眼观察到并简单地控制通过根据本发明具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸对等电点为5.8至8.5的基础胰岛素在ph6.6至7.8下的溶解。此外并且同样重要的是,申请人能够证实,在根据本发明的具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸的存在下,在ph6.0至8.0下溶解的等电点为5.8至8.5的基础胰岛素无论是单独使用还是与餐时胰岛素或胃肠激素组合都能维持其缓慢的胰岛素作用。申请人还能够证实,在根据本发明的具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸和等电点为5.8至8.5的基础胰岛素的存在下,在ph6.0至8.0下混合的餐时胰岛素维持其迅速的胰岛素作用。根据本发明的组合物的制备具有以下优点:可通过以水溶液或冻干形式简单地混合等电点为5.8至8.5的基础胰岛素的水溶液,以及根据本发明的具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸来进行。如果需要,将制剂的ph调节至ph6至8。根据本发明的组合物的制备具有以下优点:可通过以水溶液或冻干形式简单地混合根据本发明的等电点为5.8至8.5的基础胰岛素的水溶液、餐时胰岛素的溶液,以及具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸来进行。如果需要,将制剂的ph调节至ph6至8。根据本发明的组合物的制备具有以下优点:可通过以水溶液或冻干形式简单地混合根据本发明的等电点为5.8至8.5的基础胰岛素的水溶液,glp-1ra、glp-1ra类似物或衍生物的溶液,以及具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸来进行。如果需要,将制剂的ph调节至ph6至8。根据本发明的组合物的制备具有以下优点:可通过以水溶液或冻干形式简单地混合根据本发明的等电点为5.8至8.5的基础胰岛素的水溶液,餐时胰岛素的溶液,glp-1ra、glp-1ra类似物或衍生物的溶液,以及具有羧酸根电荷和至少一个疏水性基团的共聚氨基酸来进行。如果需要,将制剂的ph调节至ph6至8。在一个实施方案中,在以水溶液或以冻干形式与餐时胰岛素混合之前,通过超滤浓缩基础胰岛素和共聚氨基酸的混合物。如果需要,通过在混合物中添加这些赋形剂的浓缩溶液,用赋形剂(例如甘油、间甲酚、氯化锌和聚山梨酯调节混合物的组成。如果需要,将制剂的ph调节至ph6至8。图1:与施用组合物c4(100u/ml,0.50u/kg)(实心圆圈)后相比,施用实施例db6的组合物db3k(200u/ml,0.5u/kg胰岛素)(空心方块)后相对于基础胰岛素水平的偏差的中值曲线(横坐标:以小时表示的注射后时间,纵坐标:以pmol/l表示的δ胰岛素浓度);施用通过皮下注射对狗(n=10)进行。图2:与施用组合物c4(100u/ml,0.50u/kg)(实心圆圈)后相比,施用实施例db6的组合物db3k(200u/ml,0.5u/kg胰岛素)(空心方块)后以相对于基础水平的偏差百分比计的血糖±平均值的标准偏差的平均值曲线(横坐标:以小时表示的注射后时间,纵坐标:以相对于基础水平的偏差的百分比表示的葡萄糖水平);施用通过皮下注射对狗(n=10)进行。实施例参考以下实施例,以非限制性方式更详细地描述本发明。部分aaa:疏水性分子的合成,其中p=1在接枝到共聚氨基酸上之前,基团在下表1a中通过相应的疏水性分子表示。表1a:根据本发明合成的疏水性分子的列表和结构。实施例aa4:分子aa4分子a1:通过棕榈酰氯与l-脯氨酸之间的反应获得的产物。在90分钟内将棕榈酰氯(23.0g,83.7mmol)在丙酮(167ml)中的溶液滴加至l-脯氨酸(10.6g,92.1mmol)在1n氢氧化钠水溶液(230ml;230mmol)中的溶液。在室温下搅拌14小时后,将非均匀混合物冷却至0℃,然后通过烧结过滤器过滤以得到白色固体,将其用水(2×100ml)洗涤,然后用二异丙醚(100ml)洗涤。将固体减压干燥。然后将固体在200ml水中回流溶解,然后添加8ml37%盐酸溶液直至获得ph为1。然后将乳白色反应介质冷却至0℃。将所得沉淀物通过烧结过滤器过滤,然后用水(5×50ml)洗涤直至获得中性ph的滤液,然后将其在50℃下在真空烘箱中干燥过夜。将产物通过在二异丙醚中重结晶纯化。获得白色固体。产率:22.7g(77%)。1hnmr(cdcl3,ppm):0.88(3h);1.19-1.45(24h);1.58-1.74(2h);1.88-2.14(3h);2.15-2.54(3h);3.47(1h);3.58(1h);4.41(0.1h);4.61(0.9h)6.60-8.60(1h).分子a2:通过分子a1与boc-1-氨基-4,7,10-三氧杂-13-十三烷胺之间的反应获得的产物。在室温下将n,n-二异丙基乙胺(dipea)(4.1g,31.8mmol)、1-羟基苯并三唑(hobt)(2.2g,16.4mmol)然后n-(3-二甲基氨基丙基)-n’-乙基碳二亚胺(edc)(3.2g,16.6mmol)依次添加至分子a1(4.5g,12.7mmol)在90ml氯仿中的溶液。在室温下搅拌15分钟后,添加boc-1-氨基-4,7,10-三氧杂-13-十三烷胺(4.5g,14.0mmol)在5ml氯仿中的溶液。在室温下搅拌18小时后,添加0.1nhcl溶液(100ml),然后添加饱和nacl溶液(50ml)。分离各相,然后将有机相依次用0.1nhcl溶液/饱和nacl(100ml/50ml)、饱和nacl溶液(100ml)、饱和nahco3溶液(100ml)、然后饱和nacl溶液(100ml)洗涤。有机相用无水硫酸钠干燥,过滤,然后减压浓缩。通过快速色谱(甲醇,二氯甲烷)纯化后获得黄色油状物。产率:7.7g(92%)。1hnmr(cdcl3,ppm):0.88(3h);1.22-1.37(24h);1.44(9h);1.59-1.67(2h);1.67-2.00(6h);2.06-2.45(4h);3.18-3.76(18h);4.28(0.2h);4.52(0.8h);4.69-5.04(1h);6.77(0.2h);7.20(0.8h).分子aa4在0℃下,将二氧六环(29.5ml,118mmol)中的4m盐酸滴加至分子a2(7.7g,11.8mmol)在90ml二氯甲烷中的溶液。在室温下搅拌3小时30分钟后,将溶液减压浓缩。将残余物通过快速色谱(甲醇,二氯甲烷)纯化以得到黄色油状物。与二异丙醚共蒸发并在50℃下真空干燥可获得作为盐酸盐形式的分子aa4。产率:5.4g(76%)。1hnmr(cdcl3,ppm):0.88(3h);1.08-1.40(24h);1.49-1.65(2h);1.76-2.39(10h);3.07-3.28(3h);3.34-3.80(15h);4.34(0.05h);4.64(0.95h);7.35(0.05h);7.66-8.58(3.95h).lc/ms(esi):556.7;(计算值([m+h]+):556.5).实施例aa7:分子aa7分子a3:通过花生四烯酸与l-脯氨酸之间的反应获得的产物。在0℃下将二环己基碳二亚胺(dcc)(10.45g,50.6mmol)和n-羟基琥珀酰亚胺(nhs)(5.83g,50.6mmol)依次添加至thf(500ml)中的花生四烯酸溶液(15.51g,49.63mmol)。在室温下搅拌17小时后,将介质冷却至0℃持续20分钟,通过烧结过滤器过滤。将l-脯氨酸(6g,52.11mmol)、dipea(60.5ml)和水(50ml)添加至滤液。在室温下搅拌48小时后,将混合物用1nhcl水溶液处理至ph1,并将所得固体通过烧结过滤器过滤,用水洗涤直至母液的ph为中性,然后真空下燥以得到淡黄色固体。通过硅胶色谱(环己烷,乙酸乙酯)纯化后,获得白色固体。产率:10.96g(54%)。1hnmr(cdcl3,ppm):0.88(3h);1.28(34h);1.66(2h);1.95-2.15(2h);2.34(2h);2.45(1h);3.47(1h);3.56(1h);4.60(1h).lc/ms(esi):410.4;(计算值([m+h]+):410.6).分子a4:通过分子a3与boc-1-氨基-4,7,10-三氧杂-13-十三烷之间的反应获得的产物。在室温下将dipea(9.32ml)和2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲四氟硼酸盐(tbtu)(9.45g,29.4mmol)添加至分子a3(10.96g,26.75mmol)在thf(135ml)中的溶液。搅拌30分钟后,添加boc-1-氨基-4,7,10-三氧杂-13-十三烷(10.29g,32.11mmol)。在室温下搅拌18小时后,减压蒸发溶剂,并将残余物用乙酸乙酯(400ml)稀释。有机相用饱和nahco3溶液、1nhcl水溶液、水、饱和nacl水溶液洗涤,然后用na2so4干燥,过滤并真空浓缩。将残余物通过快速色谱(环己烷,乙酸乙酯,甲醇)纯化以得到固化的无色油状物。获得固体。产率:14.2g(75%)。1hnmr(cdcl3,ppm):0.88(3h);1.24(32h);1.43(9h);1.57-2.00(8h);2.10-2.45(4h);3.20-3.75(18h);4.30(0.20h);4.55(0.80h);5.03(1h);6.75(0.20h);7.20(0.80h).lc/ms(esi):712.8;(计算值([m+h]+):713.1).分子aa7在0℃下将二氧六环(25ml)中的4nhcl添加至分子a4(14.25g,20.01mmol)在二氯甲烷(100ml)中的溶液。在0℃下搅拌20小时并在25℃下搅拌4小时后,将介质真空浓缩。将残余物在甲醇中溶解四次并减压蒸发以得到盐酸盐形式的分子aa7的白色固体。产率:12.7g(98%)。1hnmr(dmso-d6,ppm):0.85(3h);1.23(32h);1.45(2h);1.64(2h);1.70-2.05(6h);2.10-2.30(2h);2.82(2h);3.08(2h);3.30-3.60(14h);4.15-4.30(1h);7.73-8.13(4h).lc/ms(esi):612.7;(计算值([m+h]+):612.9).实施例aa10:分子aa10分子a23:通过哌啶甲酸与花生酸之间的反应获得的产物。通过类似于制备分子a3的方法,将其应用于花生酸(2.30g,7.37mmol)和哌啶甲酸(1.00g,7.74mmol),过滤酸化至ph1的水相后得到白色固体,用水洗涤固体,然后用二氯甲烷洗涤。产率:1.65克(53%)1hnmr(cdcl3,ppm):0.88(3h);1.07-1.88(37h);2.10(1h);2.28-2.45(2h);2.52(1h);2.91-3.17(1.5h);3.42(0.5h);3.72(0.5h);3.84(0.5h);4.08(0.5h);4.56(0.5h).lc/ms(esi):424.4;848.0;(计算值([m+h]+):424,4;([2m+h]+):847.8).分子a24:通过分子a23与boc-1-氨基-4,7,10-三氧杂-13-十三烷胺之间的反应获得的产物。通过类似于用于制备分子a4的方法,将其应用于分子a23(1.65g,3.89mmol)和tbtu(1.01g,7.79mmol),得到分子a24的白色固体。产率:1.97克(70%)1hnmr(cdcl3,ppm):0.88(3h);1.15-2.70(54h);3.10-3.46(6h);3.46-3.71(12.6h);3.92(0.4h);4.17(0.6h);4.49(0.4h);4.80-5.16(1h);6.35-6.76(1h).lc/ms(esi):726.8;(计算值([m+h]+):726.6).分子aa10通过类似于用于制备分子aa4的方法,将其应用于分子a24(1.97g,2.71mmol),通过蒸发溶剂,在丙酮中研磨,过滤和用丙酮洗涤,然后在50℃下减压干燥,获得分子aa10的白色固体。产率:1.66克(92%)1hnmr(dmso-d6,ppm):0.86(3h);1.09-1.90(42h);2.05-2.68(5h);2.45-2.68(1h);2.78-3.19(6h);3.36-3.44(2h);3.44-3.60(10h);3.69-3.87(1h);4.20(0.4h);4.35(0.6h).lc/ms(esi):626.7;(计算值([m+h]+):626.5).ab:共聚氨基酸的合成具有统计学接枝的共聚氨基酸(式vii或viia)表1b:根据本发明合成的共聚氨基酸的列表具有限定的接枝的共聚氨基酸(式vii或viib)表1c:根据本发明合成的共聚氨基酸的列表。实施例ab6:共聚氨基酸ab6-被分子aa7修饰的数均分子量(mn)为4000g/mol的聚-l-谷氨酸钠共聚氨基酸ab6-1:相对数均分子量(mn)为3500g/mol的聚-l-谷氨酸,源自通过己胺启动的γ-苄基-l-谷氨酸n-羧酸酐的聚合。在预先在烘箱中干燥的圆底烧瓶中,将γ-苄基-l-谷氨酸n-羧酸酐(89.9g,341mmol)在真空下放置30分钟,然后引入无水dmf(200ml)。然后将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入己胺(2.05ml,15.5mmol)。将混合物在4℃至室温下搅拌2天。然后将反应混合物在65℃下加热2小时,冷却至室温,然后在搅拌下逐滴倾倒入二异丙醚(3l)中。通过过滤回收白色沉淀物,用二异丙醚(2×200ml)洗涤,然后在30℃下真空下干燥以得到聚(γ-苄基-l-谷氨)酸(pblg)。在4℃下,将乙酸(240ml,1.37mol)中的33%氢溴酸(hbr)溶液滴加至pblg(74.8g)在三氟乙酸(tfa,340ml)中的溶液。将混合物在室温下搅拌2小时,然后在搅拌下逐滴倾倒到二异丙醚和水的1∶1(v/v)混合物(4l)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,用二异丙醚和水的1∶1(v/v)混合物(340ml)洗涤,然后用水(340ml)洗涤。然后通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(1.5l)中。溶解后,通过添加水将理论浓度调节至20g/l理论值,直至获得2.1l的最终体积。将溶液通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后浓缩共聚氨基酸溶液直至获得1.8l的最终体积。然后将水溶液通过添加37%盐酸溶液酸化,直至ph达到2。搅拌4小时后,过滤获得的沉淀物,用水(2×340ml)洗涤,然后在30℃下真空干燥以得到相对于聚氧乙烯(peg)标准的数均分子量(mn)为3500g/mol的聚-l-谷氨酸。共聚氨基酸ab6将数均分子量(mn)为3500g/mol的共聚氨基酸ab6-1(10.0g)在30℃-40℃下溶解在dmf(420ml)中,然后保持在该温度下。平行地,将分子aa7的盐酸盐(1.47g,2.3mmol)混悬在dmf(12ml)中,并添加三乙胺(0.23g,2.3mmol),然后在搅拌下将混合物稍微加热直至溶解完全。将nmm(7.6g,75mmol)、aa7溶液然后2-羟基吡啶n-氧化物(hopo,0.84g,7.5mmol)依次添加至共聚氨基酸的dmf溶液。然后将反应介质冷却至0℃,然后添加edc(1.44g,7.5mmol),并将介质经过2小时恢复至室温。将反应介质通过0.2mm编织过滤器过滤,并在搅拌下逐滴倾倒到3.5l含15重量%nacl和hcl(ph2)的水上。在添加结束时,用37%hcl溶液将ph重新调节至2,并使混悬液静置过夜。通过过滤收集沉淀物,然后用100ml水冲洗。通过在搅拌下缓慢添加1nnaoh水溶液直至ph为7,将获得的白色固体溶解在500ml水中,然后通过0.45μm过滤器过滤溶液。获得的澄清溶液通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。将溶液通过0.2μm过滤器过滤并储存在2-8℃。干提取物:21.6mg/g。dp(基于1hnmr评估):20。基于1hnmr:i=0.025。计算出的共聚氨基酸ab6的平均分子量为3369g/mol。hplc-水性sec(校准物peg):mn=4000g/mol。实施例ab7:共聚氨基酸ab7-在其一端被分子aa7的乙酰基封端的数均分子量(mn)为3300g/mol的聚-l-谷氨酸钠共聚氨基酸ab7-1:相对数均分子量(mn)为3600mol且dp为21的聚-l-谷氨酸,源自通过己胺引发的γ-苄基-l-谷氨酸n-羧酸酐的聚合,并在其一端以乙酰基封端。在预先在烘箱中干燥的圆底烧瓶中,将γ-苄基-l-谷氨酸n-羧酸酐(glu(obn)-nca,100.0g,380mmol)在真空下放置30分钟,然后引入无水dmf中(225ml)。然后将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入己胺(1.78g,17mmol)。将混合物在4℃至室温下搅拌2天,然后在二异丙醚(3.4l)中沉淀。通过过滤回收沉淀物,用二异丙醚(225ml)洗涤两次,然后干燥以得到白色固体,将其溶解在450mlthf中。将dipea(31ml,176mmol),然后乙酸酐(17ml,176mmol)依次添加至该溶液中。在室温下搅拌一夜后,在搅拌下将溶液缓慢倾倒入二异丙醚(3l)中。搅拌1小时后,过滤沉淀物,用二异丙醚(250ml)洗涤两次,然后在30℃下真空干燥以得到在其一端以乙酰基封端的聚(γ-苄基-l-谷氨)酸。在4℃下将乙酸(235ml)中的33%氢溴酸(hbr)溶液滴加至三氟乙酸(tfa,335ml)中的上述共聚氨基酸(72g)的溶液。将混合物在室温下搅拌3小时30分钟,然后在搅拌下逐滴倾倒到二异丙醚和水的1∶1(v/v)混合物(4l)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,用二异丙醚和水的1∶1(v/v)混合物(340ml)洗涤,然后用水(340ml)洗涤。然后通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(1.5l)中。溶解后,通过添加水将溶液稀释,直至获得2.1l的最终体积。将溶液通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后浓缩共聚氨基酸溶液直至获得1.8l的最终体积。然后将水溶液通过添加37%盐酸溶液酸化,直至ph达到2。搅拌4小时后,过滤获得的沉淀物,用水(330ml)洗涤,然后在30℃下真空干燥以得到相对于聚氧乙烯标准(peg)的数均分子量(mn)为3600g/mol且平均聚合度为21的聚-l-谷氨酸。共聚氨基酸ab7通过将与用于制备共聚氨基酸ab6类似的方法应用于分子aa7的盐酸盐(1.43g,2.2mmol)和共聚氨基酸ab7-1(10.0g),获得被分子aa7修饰的聚-l-谷氨酸钠盐。干提取物:24.3mg/g。dp(基于1hnmr评估):21。基于1hnmr:i=0.03。计算出的共聚氨基酸ab7的平均分子量为3677g/mol。hplc-水性sec(校准物peg):mn=3300g/mol。实施例ab8:共聚氨基酸ab8-被分子aa7修饰的数均分子量(mn)为3600g/mol的聚-l-谷氨酸钠。共聚氨基酸ab8-1:数均分子量(mn)为3800g/mol的聚-l-谷氨酸,源自通过氨引发的γ-甲基-l-谷氨酸n-羧酸酐的聚合。通过将与专利申请fr-a-2801226中描述的类似的方法应用于γ-甲基-l-谷氨酸n-羧酸酐(25.0g,133.6mmol)和二氧六环中的0.5n氨溶液(12.1ml,6.05mmol),获得聚-l-谷氨酸。共聚氨基酸ab8通过将与用于制备共聚氨基酸ab6类似的方法应用于分子aa7的盐酸盐(2.1g,3.24mmol)和共聚氨基酸ab8-1(14.3g),获得被分子aa7修饰的聚-l-谷氨酸钠。干提取物:25.2mg/g。dp(基于1hnmr评估):24。基于1hnmr:i=0.03。计算出的共聚氨基酸ab8的平均分子量为4099g/mol。hplc-水性sec(校准物peg):mn=3600g/mol。实施例ab10:共聚氨基酸ab10-被分子aa4修饰的数均分子量(mn)为2600g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸ab7类似的方法应用于分子aa4的盐酸盐和通过与用于制备共聚氨基酸ab6-1类似的方法获得的聚-l-谷氨酸,获得被分子aa4修饰的聚-l-谷氨酸钠。干提取物:18.3mg/g。dp(基于1hnmr评估):25。基于1hnmr:i=0.08。计算出的共聚氨基酸ab10的平均分子量为4870g/mol。hplc-水性sec(校准物peg):mn=2600g/mol。实施例ab21:共聚氨基酸ab21-被分子aa7修饰的数均分子量(mn)为3400g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸ab6类似的方法应用于分子aa7的盐酸盐(2.44g,2.4mmol)和通过与用于制备共聚氨基酸ab6-1类似的方法获得的聚-l-谷氨酸(10g),获得被分子aa7修饰的聚-l-谷氨酸钠。干提取物:22.7mg/g。dp(基于1hnmr评估):22。基于1hnmr:i=0.056。计算出的共聚氨基酸ab21的平均分子量为4090g/mol。hplc-水性sec(校准物peg):mn=3400g/mol。实施例ab17:共聚氨基酸ab17-在其一端被分子aa7修饰的数均分子量(mn)为3500g/mol的聚-l-谷氨酸钠将分子aa7的盐酸盐(2.80g,4.32mmol)、氯仿(5ml)、分子筛(1.3g)以及amberliteirn150离子交换树脂(1.3g)依次引入到合适的容器中。在滚转机(rouleaux)上搅拌1小时后,过滤介质并用氯仿冲洗树脂。将混合物蒸发,然后与甲苯共蒸发。将残余物溶解在无水dmf(30ml)中以直接用于聚合反应。将γ-苄基-l-谷氨酸n-羧酸酐(25.0g,94.9mmol)在预先在烘箱中干燥的圆底烧瓶中在真空下放置30分钟,然后引入无水dmf(140ml)。将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入如上所述制备的分子aa7的溶液。将混合物在4℃至室温下搅拌2天,然后在65℃下加热2小时。然后将反应混合物冷却至室温,然后在搅拌下逐滴倾倒入二异丙醚(1.7l)中。通过过滤回收白色沉淀物,用二异丙醚(140ml)洗涤两次,然后在30℃下真空干燥以获得白色固体。将固体在tfa(160ml)中稀释,并随后在0℃下滴加乙酸(62ml,354mmol)中的33%氢溴酸(hbr)溶液。将溶液在室温下搅拌2小时,然后在搅拌下逐滴倾倒到二异丙醚/水的1∶1(v/v)混合物(1.9l)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,依次用二异丙醚和水的1∶1(v/v)混合物(280ml),然后用水(140ml)洗涤。通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(530ml)中。溶解后,通过添加水将理论浓度调节至20g/l理论值,直至获得800ml的最终体积。将混合物通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后将共聚氨基酸溶液浓缩至约30g/l理论值并将ph调节至7.0。将水溶液通过0.2μm过滤并储存在4℃。干提取物:25.2mg/g。dp(基于1hnmr评估)=26因此i=0.038。计算出的共聚氨基酸ab17的平均分子量为4500g/mol。hplc-水性sec(校准物peg):mn=3500g/mol。实施例ab18:共聚氨基酸ab18-在其一端被分子aa7修饰的数均分子量(mn)为3700g/mol的聚-l-谷氨酸钠。使用分子aa7的盐酸盐(2.80g,4.32mmol)作为引发剂,通过γ-甲基-谷氨酸n-羧酸酐(25.0g,133.6mmol)的聚合获得在其一端被分子aa7修饰的聚-l-谷氨酸钠,根据专利申请fr-a-2801226中描述的方法使用37%盐酸溶液进行甲酯的脱保护。干提取物:44.3mg/g。dp(通过1hnmr评估)=22因此i=0.045。计算出的共聚氨基酸ab18的平均分子量为3896g/mol。hplc-水性sec(校准物peg):mn=3700g/mol。实施例ab2l’:共聚氨基酸ab21’-在其一端被分子aa10修饰的数均分子量(mn)为3500g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸ab17的方法类似的方法应用于分子aa10的盐酸盐(0.916g,1.38mmol)和γ-苄基-l-谷氨酸n-羧酸酐(7.19g,27.3mmol),获得了在其一端被分子aal0修饰的聚-l-谷氨酸钠。干提取物:14.8mg/gdp(通过1hnmr估计)=25,因此i=0.04计算出的共聚氨基酸ab21’的平均分子量为4364g/mol。hplc-水性sec(校准物peg):mn=3500g/mol。部分b:疏水性基团bb:疏水性分子的合成,其中p=2在接枝到共聚氨基酸上之前,基团在下表1c’中以相应的疏水性分子表示。表1c’:根据本发明合成的疏水性分子的列表。实施例ba1:分子ba1分子b1:通过癸酸与l-脯氨酸之间的反应获得的产物。在0℃下将二环己基碳二亚胺(dcc)(16.29g,78.96mmol)和n-羟基琥珀酰亚胺(nhs)(9.09g,78.96mmol)依次添加至thf(520ml)中的癸酸溶液(14.28g,82.91mmol)中。在室温下搅拌60小时后,将混合物冷却至0℃持续20分钟,通过烧结过滤器过滤。将l-脯氨酸(10g,86.86mmol)、二异丙基乙胺(dipea)(68.8ml)和水(60ml)添加至滤液。在室温下搅拌24小时后,将介质用水(300ml)稀释。水相用乙酸乙酯(2×250ml)洗涤,用1nhcl水溶液酸化至ph约1,然后用二氯甲烷(3×150ml)萃取。将合并的有机相用na2so4干燥,过滤,真空浓缩,残余物通过硅胶色谱(环己烷,乙酸乙酯)纯化。产率:14.6g(69%)。1hnmr(cdcl3,ppm):0.87(3h);1.26(12h);1.65(2h);2.02(3h);2.34(2h);2.41(1h);3.48(1h);3.56(1h);4.58(1h).lc/ms(esi):270.2;(计算值([m+h]+):270.4).分子b2:通过分子b1与l-赖氨酸之间的反应获得的产物。通过将与用于制备分子b1类似的方法应用于分子b1(14.57g,54.07mmol)和l-赖氨酸(4.15g,28.39mmol),获得黄色油状物。产率:16.4g(93%)。1hnmr(cdcl3,ppm):0.88(6h);1.26(24h);1.35-1.65(8h);1.85-2.35(12h);2.53(0.2h);2.90(0.8h);3.45-3.75(5h);4.50-4.70(3h);7.82(1h).lc/ms(esi):649.6;(计算值([m+h]+):649.9).分子b3:通过分子b2与boc-乙二胺之间的反应获得的产物。在室温下将dipea(8.80ml)和2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲四氟硼酸盐(tbtu,8.52g,26.54mmol)添加至分子b2(16.4g,25.27mmol)在thf(170ml)中的溶液中。搅拌30分钟后,添加boc-乙二胺(4.45g,27.8mmol)。在室温下搅拌2小时后,减压蒸发溶剂,并将残余物用乙酸乙酯(400ml)稀释。将有机相用水(250ml)、饱和nahco3水溶液(250ml)、1nhcl水溶液(250ml)、饱和nacl水溶液(250ml)洗涤,并用na2so4干燥。过滤并真空浓缩后,将获得的残余物用硅胶色谱(乙酸乙酯,甲醇)纯化以得到无色油状物。产率:12.8g(64%)。1hnmr(cdcl3,ppm):0.87(6h);1.25-1.60(42h);1.80-2.05(4h);2.15-2.45(9h);3.10-3.75(10h);4.30(1h);4.50(2h);5.50(0.6h);5.89(0.2h);6.15(0.2h);7.03(1h);7.47(1h).lc/ms(esi):791.8;(计算值([m+h]+):792.1).分子ba1在5℃下将4nhcl的二氧六环溶液(20.2ml)添加至分子b3(12.78g,16.15mmol)在二氯甲烷(110ml)中的溶液中。在5℃下搅拌20小时后,将介质真空浓缩。将获得的残余物溶解在甲醇并真空蒸发,重复该操作4次以得到盐酸盐形式的分子ba1的白色固体。产率:11.4g(97%)。1hnmr(dmso-d6,ppm):0.85(6h);1.25-1.50(33h);1.57(1h);1.70-2.40(12h);2.82(2h);3.00(2h);3.25-3.70(6h);4.05-4.50(3h);7.75-8.45(6h).lc/ms(esi):691.6;(计算值([m+h]+):692.0).实施例ba2:分子ba2分子b4:通过月桂酸与l-脯氨酸之间的反应获得的产物。通过将与用于制备分子b1类似的方法应用于月桂酸(31.83g,157.9mmol)和l-脯氨酸(20g,173.7mmol),获得黄色油状物。产率:34.3g(73%)。1hnmr(cdcl3,ppm):0.87(3h);1.26(16h);1.70(2h);1.90-2.10(3h);2.35(2h);2.49(1h);3.48(1h);3.56(1h);4.60(1h).lc/ms(esi):298.2;(计算值([m+h]+):298.4).分子b5:通过分子b4与l-赖氨酸之间的反应获得的产物。通过将与用于制备分子b1类似的方法应用于分子b4(33.72g,113.36mmol)和l-赖氨酸(8.70g,59.51mmol),获得白色固体。产率:26.2g(66%)。1hnmr(cdcl3,ppm):0.88(6h);1.26(32h);1.35-1.65(8h);1.85-2.35(15h);2.87(1h);3.40-3.75(5h);4.50-4.75(3h);7.87(1h).lc/ms(esi):705.6;(计算值([m+h]+):706.0).分子b6:通过boc-乙二胺与分子b5之间的反应获得的产物。通过将与用于制备分子b3类似的方法应用于分子b5(25.74g,36.51mmol)和boc-乙二胺(6.43g,40.16mmol),获得无色油状物。产率:30.9g(定量)。1hnmr(cdcl3,ppm):0.88(6h);1.35-1.65(50h);1.85-2.35(13h);3.05-3.75(10h);4.25-4.65(3h);5.50(0.4h);5.88(0.2h);6.16(0.2h);7.08(1h);7.26(1h);7.49(0.2h).lc/ms(esi):847.8;(计算值([m+h]+):848.2).分子ba2通过将与用于制备分子ba1类似的方法应用于分子b6(30.9g,36.47mmol),将在真空浓缩后获得的残余物溶解在甲醇中并真空蒸发,该操作重复4次以在减压干燥后得到盐酸盐形式的分子ba2的白色固体。产率:27.65g(97%)。1hnmr(dmso-d6,ppm):0.85(6h);1.10-2.40(54h);2.75-3.15(4h);3.25-3.60(6h);4.05-4.50(3h);7.50-8.50(6h).lc/ms(esi):747.6;(计算值([m+h]+):748.1).实施例ba3:分子ba3分子b7:通过豆蔻酸与l-脯氨酸之间的反应获得的产物。通过将与用于制备分子b1类似的方法应用于豆蔻酸(18.93g,82.91mmol)和l-脯氨酸(10g,86.86mmol),获得淡黄色油状物。产率:20g(78%)。1hnmr(cdcl3,ppm):0.88(3h);1.28(20h);1.70(2h);1.90-2.10(3h);2.36(2h);2.51(1h);3.47(1h);3.56(1h);4.61(1h).lc/ms(esi):326.2;(计算值([m+h]+):326.6).分子b8:通过分子b7与l-赖氨酸之间的反应获得的产物通过将与用于制备分子b1类似的方法应用于分子b7(20.02g,61.5mmol)和l-赖氨酸(4.72g,32.29mmol),获得白色固体。产率:12.3g(53%)。1hnmr(dmso-d6,ppm):0.85(6h);1.26(40h);1.35-1.50(6h);1.50-2.10(10h);2.10-2.25(4h);3.01(2h);3-31-3.55(4h);4.10-4.40(3h);7.68(0.6h);7.97(1h);8.27(0.4h);12.50(1h).lc/ms(esi):761.8;(计算值([m+h]+):762.1).分子b9:通过boc-乙二胺与分子b8之间的反应获得的产物。通过将与用于制备分子b3类似的方法应用于分子b8(12g,15.77mmol)和boc-乙二胺(3.03g,18.92mmol),通过硅胶柱柱色谱(乙酸乙酯,甲醇)纯化后,获得无色油状物。产率:12.5g(88%)。1hnmr(dmso-d6,ppm):0.85(6h);1.20-1.55(55h);1.50-2.25(14h);2.95-3.10(6h);3.31-3.55(4h);4.10-4.40(3h);6.74(1h);7.60-8.25(3h).lc/ms(esi):904.1;(计算值([m+h]+):904.3).分子ba3在将与用于制备分子分子ba1类似的方法应用于分子b9(12.5g,13.84mmol)之后,将在真空浓缩后获得的残余物溶解在甲醇中并真空蒸发,该操作重复4次以在减压干燥后得到盐酸盐形式的分子ba3的白色固体。产率:9.2g(79%)。1hnmr(dmso-d6,ppm):0.85(6h);1.10-1.65(48h);1.70-2.35(12h);2.85(2h);3.01(2h);3.25-3.65(6h);4.10-4.50(3h);7.70-8.40(6h).lc/ms(esi):803.9;(计算值([m+h]+):804.2).实施例ba4:分子ba4分子b10:通过分子b8与boc-1-氨基-4,7,10-三氧杂-13-十三烷之间的反应获得的产物。通过将与用于制备分子b3类似的方法应用于分子b8(29.80g,39.15mmol)和boc-1-氨基-4,7,10-三氧杂-13-十三烷(15.05g,49.96mmol),获得浓稠的无色油状物。产率:25.3g(61%)。1hnmr(dmso-d6,ppm):0.85(6h);1.25-2.35(75h);2.85-3.20(6h);3.25-3.65(16h);4.10-4.45(3h);6.38(0.1h);6.72(0.9h);7.50-8.25(3h).lc/ms(esi):1064.2;(计算值([m+h]+):1064.5).分子ba4在将与用于制备分子ba1类似的方法应用于分子b10(25.3g,23.8mmol)之后,将在真空浓缩后获得的残余物溶解在甲醇中并真空蒸发,重复该操作4次以在减压干燥后得到盐酸盐形式的分子ba4的白色固体。产率:20.02g(84%)。1hnmr(dmso-d6,ppm):0.85(6h);1.15-2.35(66h);2.80-3.20(6h);3.30-3.65(16h);4.10-4.45(3h);7.55-8.60(6h).lc/ms(esi):964.9;(计算值([m+h]+):964.6).实施例ba5:分子ba5分子b12:通过分子a1与l-赖氨酸之间的反应获得的产物。通过将与用于制备分子b1类似的方法应用于分子a1(19.10g,54.02mmol)和l-赖氨酸(4.15g,28.36mmol),在将反应介质减压浓缩后获得油状残余物。将该残余物在水(150ml)中稀释,用乙酸乙酯(2×75ml)洗涤,然后通过缓慢添加6nhcl将水相酸化至ph1。将产物用二氯甲烷萃取3次,有机相用na2so4干燥,然后过滤并减压浓缩以得到11.2g黄色油状残余物。平行地,将先前的乙酸乙酯有机相用2nhcl水溶液(2×75ml)、饱和nacl水溶液(75ml)洗涤,用na2so4干燥,过滤并浓缩以得到10.2g黄色油状残余物。通过将这些残余物中的每一种在丙酮中重结晶,获得白色残余物。产率:11.83克(54%)1hnmr(cdcl3,ppm):0.87(6h);1.06-2.44(70h);2.78-2.96(1h);3.35-3.75(5h);4.28-4.43(0.1h);4.43-4.52(0.2h);4.52-4.61(1.8h);4.61-4.75(0.9h);7.74-8.02(2h).lc/ms(esi):818.0;(计算值([m+h]+):818.7).分子b13:通过分子b12与boc-乙二胺之间的偶联获得的产物。在室温下,将dipea(3.42g,26.43mmol)添加至分子b12(18.00g,22.02mmol)在thf(110ml)中的溶液。将反应介质冷却至0℃,然后依次添加hobt(337mg,2.20mmol)、edc(4.64g,24.23mmol),以及随后boc-乙二胺(4.23g,26.43mmol)。将反应混合物在在0℃下搅拌1小时,然后在室温下搅拌24小时并减压浓缩。将残余物溶解在乙酸乙酯(250ml)和二氯甲烷(40ml)中,有机相用1nhcl水溶液(2×125ml)、饱和nacl水溶液(2×125ml)洗涤,用na2so4干燥并减压浓缩。在乙腈中重结晶两次后获得白色固体。产率:17.5g(83%)1hnmr(dmso-d6,ppm):0.85(6h);1.15-2.29(79h);2.92-3.12(6h);3.30-3.59(4h);4.06-4.13(0.65h);4.16-4.29(2h);4.38-4.42(0.35h);6.71-6.76(1h);7.60-7.69(1.3h);7.76-7.81(0.65h);7.93-7.97(0.35h);8.00-8.04(0.35h);8.10-8.17(0.35h).lc/ms(esi):960.4;(计算值([m+h]+):960.8).分子ba5通过将与用于制备分子ba1类似的方法应用于分子b13(24.4g,25.43mmol),将在真空浓缩后获得的残余物溶解在二氯甲烷(150ml)中,有机相用2m氢氧化钠水溶液(90ml)洗涤2次。添加乙腈(120ml),通过减压浓缩除去二氯甲烷。然后将介质静置72小时,过滤并用乙腈冲洗,然后减压干燥后,获得白色固体。该操作重复4次。产率:14.28g(65%)1hnmr(dmso-d6,ppm):0.85(6h);1.06-2.32(70h);2.53-2.63(2h);2.89-3.61(10h);4.04-4.43(3h);7.55-7.62(0.65h);7.65-7.72(0.65h);7.80(0.65h);7.91(0.35h);8.03(0.35h);8.14-8.23(0.35h).lc/ms(esi):860.0;(计算值([m+h]+):860.8).实施例ba6:分子ba6分子b14:通过分子b7与2,3-二氨基丙酸之间的偶联获得的产物通过将与用于制备分子b1类似的方法应用于分子b7(80.00g,245.78mmol)和2,3-二氨基丙酸二盐酸盐(22.84g,129.04mmol),在乙腈中重结晶后获得白色固体。产率:69g(78%)1hnmr(dmso-d6,ppm):0.86(6h);1.08-1.38(40h);1.40-1.55(4h);1.68-2.30(12h);3.16-3.66(6h);4.20-4.39(3h);7.67-8.31(2h);12.70(1h).lc/ms(esi):719.4;741.5;(计算值([m+h]+):719.6;([m+na]+):741.6).分子b15:通过b14与boc-乙二胺之间的偶联获得的产物通过将与用于制备分子b13类似的方法应用于分子b14(32.00g,44.50mmol)在二氯甲烷中的溶液和boc-乙二胺(8.56g,53.40mmol),在通过硅胶色谱(乙酸乙酯,甲醇)纯化后获得无色油状物。产率:24.5g(64%)1hnmr(dmso-d6,ppm):0.85(6h);1.16-2.42(65h);2.89-3.14(4h);3.17-3.66(6h);4.11-4.43(3h);6.77(1h);7.38-8.23(3h).lc/ms(esi):861.7;(计算值([m+h]+):861.7).分子ba6通过将与用于制备分子ba5类似的方法应用于分子b15(24.50g,28.45mmol),在乙腈中重结晶后获得白色固体。产率:19.7g(91%)1hnmr(dmso-d6,ppm):0.85(6h);1.10-2.40(58h);2.51-2.62(2h);2.90-3.16(2h);3.16-3.67(6h);4.04-4.47(3h);7.33-8.27(3h).lc/ms(esi):761.5;(计算值([m+h]+):761.6).实施例ba7:分子ba7分子b16:通过n-(叔丁氧基羰基)-1,6-二氨基己烷与分子b8之间的反应获得的产物。通过将与用于制备分子b13类似的方法应用于分子b8(10g,13.14mmol)和二氯甲烷中的n-(叔丁氧基羰基)-1,6-二氨基己烷(3.41g,15.77mmol),在乙腈中重结晶后获得白色固体。产率:10.7g(85%)1hnmr(cdcl3,ppm):0.88(6h);1.17-2.40(79h);3.00-3.71(10h);4.26-4.58(3h);4.67(1h);6.74(1h);7.34-7.49(2h).lc/ms(esi):969.9;(计算值([m+h]+):959.8).分子ba7在将与用于制备分子ba1类似的方法应用于分子b16(10.5g,10.94mmol)之后,将2nnaoh水溶液滴加至冷却至0℃的反应。水相用二氯甲烷萃取,然后有机相用5%nacl水溶液洗涤3次。用na2so4干燥后,过滤有机相,真空浓缩,并将残余物在乙腈中重结晶。产率:5.4g(58%)。1hnmr(cdcl3,ppm):0.88(6h);1.19-2.40(72h);2.67(2h);3.03-3.70(8h);4.26-4.57(3h);6.71(1h);7.39-7.49(2h).lc/ms(esi):859.8;(计算值([m+h]+):859.7).bb:共聚氨基酸的合成具有统计学接枝的共聚氨基酸(式vii或viia)表1d:根据本发明合成的共聚氨基酸的列表具有限定的接枝的共聚氨基酸(式vii或viib)表1e:根据本发明合成的共聚氨基酸的列表。实施例bb1:共聚氨基酸bb1-被分子ba2修饰的数均分子量(mn)为2400g/mol的聚-l-谷氨酸钠共聚氨基酸bb1-1:相对数均分子量(mn)为3860g/mol的聚-l-谷氨酸,源自由己胺引发的γ-苄基-l-谷氨酸n-羧酸酐的聚合。在预先在烘箱中干燥的圆底烧瓶中,将γ-苄基-l-谷氨酸n-羧酸酐(90.0g,342mmol)真空下放置30分钟,然后引入无水dmf(465ml)。然后将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入己胺(1.8ml,14mmol)。将混合物在4℃至室温下搅拌2天。然后将反应介质在65℃加热4小时,冷却至室温,然后在搅拌下逐滴倾倒入冷的二异丙醚(6l)中。通过过滤回收白色沉淀物,用二异丙醚(500ml,然后250ml)洗涤,然后在30℃下真空干燥以得到聚(γ-苄基-l-谷氨酸)(pblg)。在4℃下,将乙酸(135ml,0.77mol)中的33%氢溴酸(hbr)溶液滴加至pblg(42.1g)在三氟乙酸(tfa,325ml)中的溶液。将混合物在室温下搅拌2小时,然后在搅拌下逐滴倾倒到二异丙醚和水的1∶1(v/v)混合物(1.6l)上。搅拌1小时30分钟后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,用二异丙醚和水的1∶1(v/v)混合物(200ml)洗涤。然后通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将所获得的固体溶解在水(1l)中。溶解后,通过添加水将理论浓度调节至25g/l理论值,直至获得1.5l的最终体积。将溶液通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后将水溶液通过添加37%盐酸溶液酸化,直至ph达到2。搅拌4小时后,过滤获得的沉淀物,然后在30℃下真空干燥以得到相对于聚氧乙烯(peg)标准的数均分子量(mn)为3860g/mol的聚-l-谷氨酸。共聚氨基酸bb1将共聚氨基酸bb1-1(10.0g)在30-40℃下溶解在dmf(700ml)中,然后冷却至0℃。将分子ba2的盐酸盐(2.95g,3.8mmol)混悬于dmf(45ml)中,并然后向该混悬液添加三乙胺(0.39g,3.8mmol),然后在搅拌下将混合物稍微加热直至溶解完全。在0℃下将dmf(14ml)中的n-甲基吗啉(nmm,7.6g,75mmol)和氯甲酸乙酯(ecf,8.1g,75mmol)添加至共聚氨基酸的溶液。在0℃下10分钟后,添加ba2溶液,并将介质在30℃下保持1小时。将反应介质逐滴倾倒到6l含15重量%氯化钠和hcl(ph2)的水上,然后静置过夜。通过过滤收集沉淀物,用ph2的氯化钠溶液(1l)洗涤,并真空干燥约1小时。将获得的白色固体溶解在水(600ml)中,并通过缓慢添加1nnaoh水溶液将ph调节至7。通过添加水将体积调节至700ml。在通过0.45μm过滤器过滤后,将获得的澄清溶液通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。放出后,将溶液通过0.2μm过滤器过滤并储存在2-8℃。干提取物:19.7mg/g。dp(基于1hnmr评估评估):23。基于1hnmr评估:i=0.05。计算出的共聚氨基酸bb1的平均分子量为4350g/mol。hplc-水性sec(校准物peg):mn=2400g/mol。实施例bb2:共聚氨基酸bb2-被分子ba2修饰的数均分子量(mn)为4900g/mol的聚-l-谷氨酸钠将通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量(mn)为4100g/mol的聚-l-谷氨酸(5.0g)在30-40℃下溶解在dmf(205ml)中,然后保持在该温度。平行地,将分子ba2的盐酸盐(1.44g,1.84mmol)混悬在dmf(10ml)中,并添加三乙胺(0.19g,1.84mmol),然后在搅拌下将混合物稍微加热直至溶解完全。将nmm(3.7g,36.7mmol)、分子ba2的溶液、然后2-羟基吡啶n-氧化物(hopo,0.31g,2.76mmol)依次添加至共聚氨基酸的dmf溶液中。然后将反应介质冷却至0℃,然后添加edc(0.53g,2.76mmol),并使介质的温度经过3小时的时间升至室温。在搅拌下将反应介质逐滴倾倒到1.55l含有15重量%nacl和hcl(ph2)的水上。在添加结束时,用1nhcl溶液将ph重新调节至2,并使混悬液静置过夜。通过过滤收集沉淀物,然后用100ml水冲洗。通过在搅拌下缓慢添加1nnaoh水溶液直至ph为7,将获得的白色固体溶解在200ml水中,然后通过0.45μm过滤器过滤溶液。获得的澄清溶液通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。获得的溶液通过0.2μm过滤器过滤并储存在2-8℃。干提取物:16.3mg/g。dp(基于1hnmr评估):21。基于1hnmr:i=0.047。计算出的共聚氨基酸bb2的平均分子量为3932g/mol。hplc-水性sec(校准物peg):mn=4900g/mol。实施例bb3:共聚氨基酸bb3-被分子ba2修饰的数均分子量(mn)为6400g/mol的聚-l-谷氨酸钠共聚氨基酸bb3-1:数均分子量(mn)为17500g/mol的聚-l-谷氨酸,源自由l-亮氨酸引发的γ-甲基-l-谷氨酸n-羧酸酐的聚合。使用l-亮氨酸作为引发剂,通过γ-甲基-谷氨酸n-羧酸酐的聚合获得相对于聚甲基丙烯酸甲酯(pmma)标准的数均重量(mn)为17500g/mol的聚-l-谷氨酸,根据专利申请fr-a-2801226中描述的方法使用37%盐酸溶液进行甲酯的脱保护。通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba2的盐酸盐(3.23g,4.1mmol)和共聚氨基酸bb3-1(11g),获得被分子ba2修饰的聚-l-谷氨酸钠。干提取物:27.5mg/g。dp(基于1hnmr评估):34。基于1hnmr:i=0.049计算出的共聚氨基酸bb3的平均分子量为6405g/mol。hplc-水性sec(校准物peg):mn=6400g/mol。实施例bb4:共聚氨基酸bb4-被分子ba2修饰的数均分子量(mn)为10500g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba2的盐酸盐(5g,6.35mmol)和通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量mn=10800g/mol的聚-l-谷氨酸(21.7g),获得被分子ba2修饰的聚-l-谷氨酸钠。干提取物:28.2mg/g。dp(基于1hnmr评估):65。基于1hnmr:i=0.04。计算出的共聚氨基酸bb4的平均分子量为11721g/mol。hplc-水性sec(校准物peg):mn=10500g/mol。实施例bb5:共聚氨基酸bb5-在其一端以乙酰基封端并被分子ba2修饰的数均分子量(mn)为3600g/mol的聚-l-谷氨酸钠共聚氨基酸bb5-1:mn为3700g/mol的聚-l-谷氨酸,源自由己胺引发的γ-苄基-l-谷氨酸n-羧酸酐的聚合,并且在其一端以乙酰基封端。将γ-苄基-l-谷氨酸n-羧酸酐(100.0g,380mmol)在预先在烘箱中干燥的圆底烧瓶中在真空下放置30分钟,然后引入无水dmf(250ml)。然后将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入己胺(2.3ml,17mmol)。将混合物在4℃至室温下搅拌2天,然后在二异丙醚(3.4l)中沉淀。通过过滤回收沉淀物,用二异丙醚(225ml)洗涤两次,然后干燥以获得白色固体,将其溶解在450mlthf中。依次向该溶液添加n,n-二异丙基乙胺(dipea,31ml,176mmol)、然后乙酸酐(17ml,176mmol)。在室温下搅拌过夜后,在搅拌下经过30分钟时间将溶液缓慢倒入二异丙醚(3l)中。搅拌1小时后,过滤沉淀物,用二异丙醚(200ml)洗涤两次,然后在30℃下真空干燥以获得在其一端以乙酰基封端的聚(γ-苄基-l-谷氨酸)。在4℃下将乙酸(235ml,1.34mol)中的33%氢溴酸(hbr)溶液滴加至封端的共聚氨基酸(72g)在三氟乙酸(tfa,335ml)中的溶液。将混合物在室温下搅拌3小时30分钟,然后在搅拌下逐滴倾倒到二异丙醚和水的1∶1(v/v)混合物(4l)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,用二异丙醚和水的1∶1(v/v)混合物(340ml)洗涤,然后用水(340ml)洗涤。然后通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(1.5l)中。溶解后,通过添加水将理论浓度调节至20g/l理论值,直至获得2.1l的最终体积。将溶液通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后浓缩共聚氨基酸溶液直至获得1.8l的最终体积。然后将水溶液通过添加37%盐酸溶液酸化,直至ph达到2。搅拌4小时后,过滤获得的沉淀物,用水(330ml)洗涤,然后在30℃下真空干燥以得到相对于聚氧乙烯(peg)标准的数均分子量(mn)为3700g/g的聚-l-谷氨酸。共聚氨基酸bb5通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba2的盐酸盐(6.92g,8.8mmol)和共聚氨基酸bb5-1(30.0g),获得在其一端以乙酰基封端并被分子ba2修饰的聚-l-谷氨酸钠。干提取物:29.4mg/g。dp(基于1hnmr评估):23。基于1hnmr:i=0.042。计算出的共聚氨基酸bb5的平均分子量为4302g/mol。hplc-水性sec(校准物peg):mn=3600g/mol。实施例bb6:共聚氨基酸bb6-在其一端以乙酰基封端并被分子ba2修饰的数均分子量(mn)为4100g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba2的盐酸盐(5.8g,7.4mmol)和用氨代替己胺获得的数据分子量mn=3800g/mol的聚-l-谷氨酸(25g),获得在其一端以乙酰基封端并被分子ba2修饰的聚-l-谷氨酸钠。干提取物:27.6mg/g。dp(基于1hnmr评估):24。基于1hnmr:i=0.04。计算出的共聚氨基酸bb6的平均分子量为4387g/mol。hplc-水性sec(校准物peg):mn=4100g/mol。实施例bb7:共聚氨基酸bb7-被分子ba2修饰的数均分子量(mn)为4200g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba2的盐酸盐(7.07g,9.0mmol)和通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量mn=3600g/mol的聚-l-谷氨酸(30.0g),获得被分子ba2修饰的聚-l-谷氨酸钠。干提取物:28.3mg/g。dp(基于1hnmr评估):22。基于1hnmr:i=0.042。计算出的共聚氨基酸bb7的平均分子量为4039g/mol。hplc-水性sec(校准物peg):mn=4200g/mol。实施例bb8:共聚氨基酸bb8-被分子ba2修饰的数均分子量(mn)为5200g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba2的盐酸盐(0.85g,1.1mmol)和通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量mn=4100g/mol的聚-l-谷氨酸(5.0g),获得被分子ba2修饰的聚-l-谷氨酸钠。干提取物:28.6mg/g。dp(基于1hnmr评估):21。基于1hnmr:i=0.026。计算出的共聚氨基酸bb8的平均分子量为3620g/mol。hplc-水性sec(校准物peg):mn=5200g/mol。实施例bb9:共聚氨基酸bb9-被分子ba3修饰的数均分子量(mn)为4700g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba3的盐酸盐(3.05g,3.6mmol)和通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量mn=4100g/mol的聚-l-谷氨酸(10.0g),获得被分子ba3修饰的聚-l-谷氨酸钠。干提取物:28.6mg/g。dp(基于1hnmr评估):26。基于1hnmr:i=0.05。计算出的共聚氨基酸bb9的平均分子量为4982g/mol。hplc-水性sec(校准物peg):mn=4700g/mol。实施例bb10:共聚氨基酸bb10-被分子ba3修饰的数均分子量(mn)为4200g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba3的盐酸盐(1.90g,2.3mmol)和通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量mn=3500g/mol的聚-l-谷氨酸(10.0g),获得被分子ba3修饰的聚-l-谷氨酸钠。干提取物:25.9mg/g。dp(基于1hnmr评估):22。基于1hnmr:i=0.029。计算出的共聚氨基酸bb10的平均分子量为3872g/mol。hplc-水性sec(校准物peg):mn=4200g/mol。实施例bb11:共聚氨基酸bb11-在其一端以乙酰基封端并被分子ba4修饰的数均分子量(mn)为3900g/mol聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba4的盐酸盐(2.21g,2.2mmol)和通过与用于制备共聚氨基酸bb5-1类似的方法获得的数均分子量mn=3700g/mol的聚-l-谷氨酸(10g),获得在其一端以乙酰基封端并被分子ba4修饰聚-l-谷氨酸钠。干提取物:28.1mg/g。dp(基于1hnmr评估):22。基于1hnmr:i=0.032。计算出的共聚氨基酸bb11的平均分子量为4118g/mol。hplc-水性sec(校准物peg):mn=3900g/mol。实施例bb12:共聚氨基酸bb12-在其一端以乙酰基封端并被分子ba3修饰的数均分子量(mn)为3900g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子ba3的盐酸盐(1.9g,2.3mmol)和通过与用于制备共聚氨基酸bb5-1类似的方法获得的数均分子量mn=3600g/mol的聚-l-谷氨酸(10g),获得在其一端以乙酰基封端并被分子ba3修饰聚-l-谷氨酸钠。干提取物:26.7mg/g。dp(基于1hnmr评估):23。基于1hnmr:i=0.03。计算出的共聚氨基酸bb12的平均分子量为4145g/mol。hplc-水性sec(校准物peg):mn=3900g/mol。实施例bb13:共聚氨基酸bb13-被分子ba1修饰的数均分子量(mn)为2800g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb1类似的方法应用于分子ba1的盐酸盐(3.65g,5mmol)和通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量mn=3600g/mol的聚-l-谷氨酸(10g),获得被分子ba1修饰聚-l-谷氨酸钠。干提取物:25.6mg/g。dp(基于1hnmr评估):25。基于1hnmr:i=0.08。计算出的共聚氨基酸bb13的平均分子量为5253g/mol。hplc-水性sec(校准物peg):mn=2800g/mol。实施例bb14:共聚氨基酸bb14-在其一端被分子ba2修饰的数均分子量(mn)为4020g/mol的聚-l-谷氨酸钠将分子ba2的盐酸盐(2.12g,2.70mmol)、氯仿(40ml)、分子筛(1.5g)以及amberliteirn150离子交换树脂(1.5g)依次引入到合适的容器中。在滚转机上搅拌1小时后,过滤介质并用氯仿冲洗残余物。将混合物蒸发,然后与甲苯共蒸发。将残余物溶解在无水dmf(20ml)中以直接用于聚合反应。将γ-苄基-l-谷氨酸n-羧酸酐(18g,68.42mmol)在预先在烘箱中干燥的圆底烧瓶中在真空下放置30分钟,然后引入无水dmf(100ml)。将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入如上所述制备的分子ba2的溶液。将混合物在4℃至室温下搅拌2天,然后在65℃下加热2小时。然后将反应混合物冷却至室温,然后在搅拌下逐滴倾倒入二异丙醚(1.2l)中。通过过滤回收白色沉淀物,用二异丙醚(100ml)洗涤两次,然后在30℃下真空干燥以获得白色固体。将固体在tfa(105ml)中稀释,并随后在0℃下滴加乙酸(38ml,220mmol)中的33%氢溴酸(hbr)溶液。将溶液在室温下搅拌2小时,然后在搅拌下逐滴倾倒到二异丙醚/水的1∶1(v/v)混合物(600ml)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,依次用二异丙醚和水的1∶1(v/v)混合物(200ml),然后用水(100ml)洗涤。通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(450ml)中。将混合物通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后将共聚氨基酸溶液浓缩至约30g/l理论值并将ph调节至7.0。将水性溶液通过0.2μm过滤器过滤并在4℃下储存。干提取物:22.3mg/g。dp(通过1hnmr评估)=29,因此i=0.034。计算出的共聚氨基酸bb14的平均分子量为5089g/mol。hplc-水性sec(校准物peg):mn=4020g/mol。实施例bb15:共聚氨基酸bb15-在其一端被分子ba3修饰的数均分子量(mn)为3610g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于分子ba3的盐酸盐(3.62g,4.32mmol)和25.0g(94.97mmol)的γ-苄基-l-谷氨酸n-羧酸酐,获得在其一端被分子ba3修饰的聚-l-谷氨酸钠。干提取物:26.5mg/gdp(通过1hnmr评估)=24,因此i=0.042。计算出的共聚氨基酸bb15的平均分子量为4390g/mol。hplc-水性sec(校准物peg):mn=3610g/mol。实施例bb16:共聚氨基酸bb16-在其一端被分子ba4修饰的数均分子量(mn)为3300g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于分子ba4的盐酸盐(5.70g,5.70mmol)和29.99g(113.9mmol)的γ-苄基-l-谷氨酸n-羧酸酐,获得在其一端被分子ba4修饰的聚-l-谷氨酸钠。干提取物:32.3mg/gdp(通过1hnmr评估)=23,因此i=0.043。计算出的共聚氨基酸bb16的平均分子量为4399g/mol。hplc-水性sec(校准物peg):mn=3300g/mol。实施例bb17:共聚氨基酸bb17-在其一端被分子ba3修饰的数均分子量(mn)为10700g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于分子ba3的盐酸盐(2.51g,3mmol)和52.7g(200mmol)的γ-苄基-l-谷氨酸n-羧酸酐,获得在其一端被分子ba3修饰的聚-l-谷氨酸钠。干提取物:24.5mg/gdp(通过1hnmr评估)=65,因此i=0.015。计算出的共聚氨基酸bb17的平均分子量为10585g/mol。hplc-水性sec(校准物peg):mn=10700g/mol。实施例bb18:共聚氨基酸bb18-在其一端被分子ba3修饰的数均分子量(mn)为6600g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于分子ba3的盐酸盐(2.51g,3mmol)和31.6g(120mmol)的γ-苄基-l-谷氨酸n-羧酸酐,获得在其一端被分子ba3修饰的聚-l-谷氨酸钠。干提取物:27.3mg/gdp(通过1hnmr评估)=40,因此i=0.025。计算出的共聚氨基酸bb18的平均分子量为6889g/mol。hplc-水性sec(校准物peg):mn=6600g/mol。实施例bb19:共聚氨基酸bb19-在其一端被分子ba3修饰的数均分子量(mn)为3400g/mol)的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于分子ba3的盐酸盐(36.26g,43.2mmol)和γ-苄基-l-谷氨酸n-羧酸酐(250.0g,949.7mmol),获得在其一端被分子ba3修饰的聚-l-谷氨酸钠。干提取物:22.4mg/gdp(通过1hnmr评估)=25,因此i=0.04。计算出的共聚氨基酸bb19的平均分子量为4540g/mol。hplc-水性sec(校准物peg):mn=3400g/mol。实施例bb20:共聚氨基酸bb20-在其一端被分子ba3修饰的数均分子量(mn)为2500g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于游离胺形式的分子ba3(1.017g,12.7mmol)和γ-苄基-l-谷氨酸n-羧酸酐(5.0g,19.0mmol),获得在其一端被分子ba3修饰的聚-l-谷氨酸钠。干提取物:11.2mg/gdp(通过1hnmr评估)=17,因此i=0.059。计算出的共聚氨基酸bb20的平均分子量为3332g/mol。hplc-水性sec(校准物peg):mn=2500g/mol。实施例bb21:共聚氨基酸bb21-在其一端被分子ba3修饰的数均分子量(mn)为1100g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于游离胺形式的分子ba3(3.814g,4.75mmol)和γ-苄基-l-谷氨酸n-羧酸酐(10.0g,38.0mmol),获得在其一端被分子ba3修饰的聚-l-谷氨酸钠。干提取物:16.1mg/gdp(通过1hnmr评估)=9,因此i=0.11。计算出的共聚氨基酸bb21的平均分子量为2123g/mol。hplc-水性sec(校准物peg):mn=1100g/mol。实施例bb22:共聚氨基酸bb22-在其一端被分子ba3修饰的数均分子量(mn)为2900g/mol的聚-d-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于游离胺形式的分子ba3(2.77g,3.45mmol)和γ-苄基-d-谷氨酸n-羧酸酐(20.0g,76.0mmol),获得在其一端被分子ba3修饰的聚-d-谷氨酸钠。干提取物:15.2mg/gdp(通过1hnmr评估)=21,因此i=0.048。计算出的共聚氨基酸bb22的平均分子量为3936g/mol。hplc-水性sec(校准物peg):mn=2900g/mol。实施例b23:共聚氨基酸bb23-在其一端被分子ba3修饰的数均分子量(mn)为2800g/mol的d-或l-谷氨酸钠单元的无规共聚物将γ-苄基-l-谷氨酸n-羧酸酐(20.0g,76.00mmol)和γ-苄基-d-谷氨酸n-羧酸酐(20.0g,76.00mmol)在预先在烘箱中干燥的圆底烧瓶中在真空下放置30分钟,然后引入无水dmf(75ml)。将混合物在氩气下搅拌直至溶解完全,冷却至4℃,然后迅速引入游离胺形式的分子ba3(5.55g,6.91mmol)在氯仿(14.5ml)中的溶液。将混合物在4℃至室温下搅拌18小时,然后在65℃下加热2小时。然后将反应混合物冷却至室温,然后在搅拌下逐滴倾倒入二异丙醚(1.2l)中。通过过滤回收白色沉淀物,用二异丙醚(80ml)洗涤三次,然后在30℃下真空干燥直至获得白色固体。将固体在tfa(152ml)中稀释,并随后在0℃下滴加乙酸(106ml,220mmol)中的33%氢溴酸(hbr)溶液。将溶液在室温下搅拌3小时,然后在搅拌下逐滴倾倒到二异丙醚/水的1∶1(v/v)混合物(1.84l)上。在滴液漏斗中分离水相,并通过添加10nnaoh水溶液将ph调节至7.2。添加水(250ml)后,将混合物通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后将共聚氨基酸溶液浓缩至约25g/l,通过0.2μm过滤器过滤并在4℃下储存。干提取物:28.2mg/g。dp(通过1hnmr评估)=21,因此i=0.048。计算出的共聚氨基酸bb23的平均分子量为3936g/mol。hplc-水性sec(校准物peg):mn=2800g/mol。实施例bb24:共聚氨基酸bb24-在其一端被分子ba3修饰的数均分子量(mn)为2800g/mol的聚-d-谷氨酸钠和聚-l-谷氨酸钠的嵌段共聚物将γ-苄基-d-谷氨酸n-羧酸酐(13.5g,51.3mmol)在预先在烘箱中干燥的圆底烧瓶中在真空下放置30分钟,然后引入无水dmf(52ml)。将混合物在氩气下搅拌直至溶解完全,冷却至0℃,然后迅速引入游离胺形式的分子ba3(3.43g,4.27mmol)在氯仿(8.6ml)中的溶液。将混合物在0℃下搅拌24小时,然后添加γ-叔丁基-l-谷氨酸n-羧酸酐(13.5g,58.9mmol)在dmf(15ml)中的溶液。然后将混合物在0℃至室温下搅拌21小时,然后在65℃下加热2小时。然后将反应混合物冷却至室温,然后在搅拌下逐滴倾倒入二异丙醚(0.8l)中。通过过滤回收白色沉淀物,用二异丙醚(53ml)洗涤三次,然后在30℃下真空干燥直至获得白色固体。将固体在tfa(96ml)中稀释,并随后在0℃下滴加乙酸(68ml,388mmol)中的33%氢溴酸(hbr)溶液。将溶液在室温下搅拌2小时,然后在搅拌下逐滴倾倒到二异丙醚/水的1∶1(v/v)混合物(1.2l)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,依次用二异丙醚和水的1∶1(v/v)混合物(100ml)、然后水(100ml)洗涤。通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(900ml)中。将混合物通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。然后将共聚氨基酸溶液浓缩至约20g/l理论值并将ph调节至7.0。将水溶液通过0.2μm过滤器过滤并在4℃下储存。干提取物:23.9mg/gdp(通过1hnmr评估)=25,因此i=0.04计算出的共聚氨基酸bb24的平均分子量为4541g/mol。hplc-水性sec(校准物peg):mn=2800g/mol。实施例bb25:共聚氨基酸bb25-在其一端被分子ba5修饰的数均分子量(mn)为2800g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于游离胺形式的分子ba5(1.70g,1.98mmol)和γ-苄基-l-谷氨酸n-羧酸酐(11.46g,43.5mmol),获得在其一端被分子ba5修饰的聚-l-谷氨酸钠。干提取物:19.8mg/gdp(通过1hnmr评估)=23,因此i=0.043计算出的共聚氨基酸bb25的平均分子量为4295g/mol。hplc-水性sec(校准物peg):mn=2800g/mol。实施例bb26:共聚氨基酸bb26-在其一端被分子ba6修饰的数均分子量(mn)为2900g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于游离胺形式的分子ba6(3.05g,4.01mmol)和γ-苄基-l-谷氨酸n-羧酸酐(22.78g,86.5mmol),获得在其一端被分子ba6修饰的聚-l-谷氨酸钠。干提取物:16.9mg/gdp(通过1hnmr评估)=21,因此i=0.048计算出的共聚氨基酸bb26的平均分子量为3894g/mol。hplc-水性sec(校准物peg):mn=2900g/mol。实施例bb42:共聚氨基酸bb42-在其一端被分子b8修饰的数均分子量(mn)为3200g/mol的聚-l-谷氨酸钠将dcc(0.659g,3.19mmol)和nhs(0.365g,3.17mmol)添加至分子b8(2.366g,3.11mmol)在dmf(19.5ml)中的溶液。在室温下搅拌16小时后,将溶液过滤以直接用于下面的反应。将γ-苄基-l-谷氨酸n-羧酸酐(18.0g,68.4mmol)在预先在烘箱中干燥的圆底烧瓶中在真空下放置30分钟,然后引入无水dmf(40ml)。然后将混合物在氩气下搅拌直至溶解完全,冷却至0℃,然后迅速引入己胺(0.411ml,3.11mmol)。在0℃下搅拌30小时后,添加上面制备的分子b8的溶液。将溶液在0℃至室温下搅拌72小时,然后在搅拌下逐滴倾倒入二异丙醚(0.9l)中。通过过滤回收沉淀物,用二异丙醚(5次,100ml)洗涤,然后在30℃下真空干燥以得到白色固体。将固体在tfa(69ml)中稀释,然后将溶液冷却至4℃。然后滴加乙酸(48ml,0.274mol)中的33%hbr溶液。将混合物在室温下搅拌2小时,然后在搅拌下逐滴倾倒到二异丙醚和水的1∶1(v/v)混合物(0.8l)上。搅拌2小时后,使非均匀混合物静置过夜。通过过滤回收白色沉淀物,用二异丙醚和水的1∶1(v/v)混合物(70ml),然后用水(70ml)洗涤。然后通过添加10n氢氧化钠水溶液,然后添加1n氢氧化钠水溶液将ph调节至7,将获得的固体溶解在水(0.42l)中。溶解后,通过添加水将理论浓度调节至20g/l理论值,直至获得0.63l的最终体积。将溶液通过0.45μm过滤器过滤,然后通过用0.9%nacl溶液,然后用水超滤纯化,直至渗透物的电导率小于50μs/cm。获得的溶液通过0.2μm过滤器过滤并储存在2-8℃。干提取物:22.2mg/gdp(基于1hnmr评估):22基于1hnmr:i=0.045计算出的共聚氨基酸bb42的平均分子量为4160g/mol。hplc-水性sec(校准物peg):mn=3200g/mol。实施例bb44:共聚氨基酸bb44-在其一端被分子ba7修饰的数均分子量(mn)为3300g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb14类似的方法应用于游离胺形式的分子ba7(4.45g,5.18mmol)和30.0g(113.96mmol)的γ-苄基-l-谷氨酸n-羧酸酐,获得在其一端被分子ba7修饰的聚-l-谷氨酸钠。干提取物:29.0mg/gdp(通过1hnmr评估)=25,因此i=0.04计算出的共聚氨基酸bb44的平均分子量为4597g/mol。hplc-水性sec(校准物peg):mn=3300g/mol。部分ce:反例共聚氨基酸cea:反例疏水性分子的合成表1f:反例疏水性分子实施例cea1:分子cea1分子ce1:通过月桂酸与l-赖氨酸之间的反应获得的产物。通过将与用于制备分子b1类似的方法应用于月桂酸(19.58g,97.72mmol)和l-赖氨酸(7.5g,51.3mmol),获得米色固体。产率:18.8g(75%)1hnmr(dmso-d6,ppm):0.85(6h);1.12-1.78(42h);1.96-2.16(4h);2.92-3.07(2h);4.06-4.20(1h);7.70(1h);7.95(1h);12.40(1h).lc/ms(esi):511.5;(计算值([m+h]+):511.8).分子ce2:通过分子ce1与boc-乙二胺之间的反应获得的产物。通过将与用于制备分子b3类似的方法应用于分子ce1(18.70g,36.61mmol),将反应介质减压浓缩后获得的残余物在乙腈/thf混合物(1/1vol.)中研磨,过滤并用乙腈洗涤。干燥后,获得浅黄色固体。产率:13.7g(57%)1hnmr(cdcl3,ppm):0.87(6h);1.09-1.89(51h);2.08-2.31(4h);3.13-3.48(6h);4.35(1h);5.20(1h);5.85(1h);6.46(1h);6.94(1h).lc/ms(esi):653.5;(计算值([m+h]+):654.0).分子cea1在将与用于制备分子ba1类似的方法应用于分子ce2(22.2g,34mmol)之后,将在真空浓缩后获得的残余物在热甲醇中重结晶。冷却至室温后,过滤固体,用冷甲醇洗涤,然后用丙酮洗涤,并真空干燥以得到浅黄色固体。产率:16.3g(81%)。1hnmr(meod,ppm):0.90(6h);1.20-1.85(42h);2.15-2.30(4h);3.06(2h);3.19(2h);3.40(1h);3.55(1h);4.13(1h).lc/ms(esi):553.5;(计算值([m+h]+):553.9).分子cea2和分子cea3根据专利美国专利no.4,826,818(kenjim.等)中描述的方案合成分子cea2和cea3。部分ceb:反例共聚氨基酸的合成表1g:反例共聚氨基酸实施例ceb1:共聚氨基酸ceb1-被分子cea1修饰的数均分子量为3800g/mol的聚-l-谷氨酸钠将通过与用于制备共聚氨基酸bb1-1类似的方法获得的数均分子量(mn)为8500g/mol的聚-l-谷氨酸(2.0g)在30-40℃下溶解在dmf(27ml)中,然后将溶液冷却至0℃。向该溶液添加edc(0.59g,3.06mmol)在dmf(6ml)中的溶液、hobt(0.41g,3.06mmol)在dmf(1ml)中的溶液和dipea(1.76ml,18.3mmol)。然后添加分子cea1(0.21g,1.84mmol)在dmf(0.9ml)中的溶液,并将混合物在25℃下搅拌3小时。用滴加的11ml水稀释反应介质,然后通过用0.9%nacl水溶液,然后用水透析纯化。获得的溶液通过0.2μm过滤器过滤并储存在2-8℃。干提取物:16.3mg/g。dp(基于1hnmr评估):42。基于1hnmr:i=0.024。计算出的共聚氨基酸ceb1的平均分子量为6924g/mol。hplc-水性sec(校准物peg):mn=3800g/mol。实施例ceb2:共聚氨基酸ceb2-在其一端以乙酰基封端并被亮氨酸胆固醇酯修饰的数均分子量为2575g/mol的聚-l-谷氨酸钠根据专利美国专利no.4,826,818(kenji,m.等)中描述的方法制备亮氨酸胆固醇酯的对甲苯磺酸盐。通过将与用于制备共聚氨基酸bb13类似的方法应用于亮氨酸胆固醇酯的对甲苯磺酸盐(1.23g,1.8mmol)和通过与用于制备共聚氨基酸bb5-1类似的方法获得的数均分子量mn=3600g/mol的聚-l-谷氨酸(5g),获得在其一端以乙酰基封端并被亮氨酸胆固醇酯修饰的聚-l-谷氨酸钠。干提取物:15.4mg/g。dp(通过1hnmr评估):22。基于1hnmr:i=0.05。计算出的共聚氨基酸ceb2的平均分子量为3973g/mol。hplc-水性sec(校准物peg):mn=2575g/mol。实施例ceb3:共聚氨基酸ceb3-在其一端以乙酰基封端并被天冬氨酸二月桂酯修饰的数均分子量为5820g/mol的聚-l-谷氨酸钠根据专利美国专利no.4,826,818(kenji,m.等)中描述的方法制备天冬氨酸二月桂酯的对甲苯磺酸盐。通过将与用于制备共聚氨基酸bb13类似的方法应用于天冬氨酸二月桂酯的对甲苯磺酸盐(0.89g,1.9mmol)和通过与用于制备共聚氨基酸bb5-1类似的方法获得的数均分子量mn=8500g/mol的聚-l-谷氨酸(5g),获得在其一端以乙酰基封端并被天冬氨酸二月桂酯修饰的聚-l-谷氨酸钠。干提取物:19.3mg/g。dp(通过1hnmr评估):43。基于1hnmr:i=0.05。计算出的共聚氨基酸ceb3的平均分子量为7565g/mol。hplc-水性sec(校准物peg):mn=5820g/mol。实施例ceb4:共聚氨基酸ceb4-被(±)-α-生育酚修饰的数均分子量为5085g/mol的聚-l-谷氨酸钠通过将与专利fr2,840,614(ping,c.u.等.)中描述的类似的方法应用于(±)-α-生育酚(0.5g,1.16mmol)和通过与专利fr2985429a1中描述的类似的方法获得的聚-l-谷氨酸(3g),获得被(±)-α-生育酚修饰的聚-l-谷氨酸钠。干提取物:10.9mg/g。dp(通过1hnmr评估):20。基于1hnmr:i=0.05。计算出的共聚氨基酸ceb4的平均分子量为3473g/mol。hplc-水性sec(校准物peg):mn=5085g/mol。实施例cebx4:共聚氨基酸cebx4-在其一端以乙酰基封端并被分子cea1修饰的数均分子量(mn)为3300g/mol的聚-l-谷氨酸钠通过将与用于制备共聚氨基酸bb2类似的方法应用于分子cea1的盐酸盐(0.918g,1.56mmol)和通过与用于制备共聚氨基酸bb5-1类似的方法获得的数均分子量mn=3700g/mol的聚-l-谷氨酸(5.0g),获得在其一端以乙酰基封端并被分子cea1修饰的聚-l-谷氨酸钠。干提取物:17.4mg/gdp(基于1hnmr评估):22基于1hnmr:i=0.042。计算出的共聚氨基酸cebx4的平均分子量为3941g/mol。hplc-水性sec(校准物peg):mn=3300g/mol。部分c-甘精胰岛素、餐时胰岛素或glp-1ra组合物实施例c1:100u/ml的速效胰岛素类似物溶液该溶液是由elililly公司以名称销售的商业化赖脯胰岛素溶液。该产品是一种速效胰岛素类似物。中的赋形剂是间甲酚(3.15mg/ml)、甘油(16mg/ml)、磷酸二钠(1.88mg/ml)、氧化锌(以获得0.0197mg锌离子/ml)、用于调节ph(ph7-7.8)的氢氧化钠和盐酸,以及水。实施例c2:100u/ml的速效胰岛素类似物溶液该溶液是由novonordisk公司在美国以名称和在欧洲以名称销售的商业化门冬胰岛素溶液。该产品是一种速效胰岛素类似物。的赋形剂是甘油(16mg)、苯酚(1.50mg/ml)、间甲酚(1.72mg/ml)、锌(19.6μg/ml)、二水合磷酸二钠(1.25mg/ml)、氯化钠(0.5mg/ml)、用于调节ph(ph7.2-7.6)的氢氧化钠和盐酸,以及水。实施例c3:100u/ml的速效胰岛素类似物溶液该溶液是由sanofi公司以名称销售的商业化谷赖胰岛素溶液。该产品是一种速效胰岛素类似物。的赋形剂为间甲酚(3.15mg/ml)、氨丁三醇(6mg/ml)、氯化钠(5mg/ml)、聚山梨酯20(0.01mg/ml)、用于调节ph(ph7.3)的氢氧化钠和盐酸,以及水。实施例c4:100u/ml的缓慢作用胰岛素类似物溶液该溶液是由sanofi公司以名称销售的商业化甘精胰岛素溶液。该产品是一种缓慢作用胰岛素类似物。中的赋形剂为氯化锌(30μg/ml)、间甲酚(2.7mg/ml)、甘油(85%)(20mg/ml)、用于调节ph(ph4)的氢氧化钠和盐酸,以及水。实施例c5:100iu/ml的人胰岛素溶液该溶液是由novonordisk以名称销售的商业化人胰岛素溶液。的赋形剂是氯化锌、甘油、间甲酚、用于调节ph(ph6.9-7.8)的氢氧化钠和盐酸,以及水。实施例c6:100iu/ml的人胰岛素溶液该溶液是由elililly以名称名称umuline销售的商业化人胰岛素溶液。umuline的赋形剂是甘油、间甲酚、用于调节ph(ph7.0-7.8)氢氧化钠和盐酸,以及水。实施例d1:3mg/ml的glp-1ra杜拉鲁肽溶液该溶液是由elililly公司以名称销售的杜拉鲁肽(杜拉鲁肽)溶液。中的赋形剂是无水柠檬酸(0.14mg/ml)、甘露糖醇(46.4mg/ml)、聚山梨酯80(0.20mg/ml)、二水合柠檬酸三钠(2.74mg/ml),以及水。实施例d2:0.25mg/ml的glp-1ra艾塞那肽溶液该溶液是由elililly公司以名称销售的艾塞那肽溶液。中的赋形剂是间甲酚(20mm)、甘露糖醇、冰醋酸、三水合乙酸钠,以及水。实施例d3:6mg/ml的glp-1ra利拉鲁肽溶液该溶液是由novonordisk公司以名称销售的利拉鲁肽溶液。中的赋形剂是二水合磷酸二钠、丙二醇(1.42mg/ml)、苯酚(5.5mg/ml),以及水。实施例d4:0.1mg/ml的glp-1ra利西拉肽溶液该溶液是由sanofi公司以名称销售的利西拉肽溶液。中的赋形剂是甘油、乙酸钠、甲硫氨酸、间甲酚(25mm)、用于调节ph盐酸和氢氧化钠,以及水。实施例d5:60mg/ml的glp-1ra阿必鲁肽溶液阿必鲁肽以待重构的固体形式存在,由gsk公司以名称销售。在注射装置中,通过旋转装置远端使笔致动来混合最初位于分开的隔室中的粉末和溶解所需体积的水,直到获得特征性的“咔哒”声(“click”noise)。在由产品的用户说明书中描述的混合步骤和静置时间组成的程序之后,该溶液准备好用于注射。中的赋形剂是甘露糖醇(153mm)、聚山梨酯80(0.01%w/w)、磷酸钠(10mm)、二水合海藻糖(117mm)。i.确定用于溶解甘精胰岛素的最小比值实施例g3:用于确定在ph7下溶解50u/ml甘精胰岛素的最小浓度的方案。以一定方式将间甲酚和甘油的浓溶液添加至ph7的共聚氨基酸储备溶液,以获得浓度为c共氨基酸储液/赋形剂(mg/ml)的共聚氨基酸溶液。以一定方式调节添加的赋形剂的量,使得以ph7.1的共聚氨基酸/50u/ml甘精胰岛素的组合物获得35mm的间甲酚浓度和184mm的甘油浓度。在3ml小瓶中,以一定方式将0.5ml的浓度为100u/ml的商品名为的甘精胰岛素的商业溶液浓度添加至0.5ml体积的浓度为c共氨基酸储液/赋形剂(mg/ml)的共聚氨基酸溶液,使得获得ph7.1的组合物c共聚氨基酸(mg/m1)/甘精胰岛素50u/ml。出现浑浊。通过添加浓naoh将ph调节至ph7.1,并将溶液在静止条件下在40℃的烘箱中放置1夜。以一定方式对于不同浓度的c共氨基酸储液/赋形剂(mg/ml)进行该操作,以便以至多0.25mg/ml的步长改变共聚氨基酸的浓度c共聚氨基酸(mg/ml)。在40℃下过夜后,目视检查样品,并使用zetasizer(malvem)以173°的角度进行静态光散射测量。能够使甘精胰岛素溶解的共聚氨基酸的最低浓度定义为使ph7的共聚氨基酸/甘精胰岛素的混合物在视觉上清澈并且呈现小于3000kcps/s的散射强度的最低浓度。表2:用于溶解甘精胰岛素的最小比值。ii.溶解/沉淀a)包含甘精胰岛素的组合物制备方法ca1:根据使用液体形式(在溶液中)的甘精胰岛素和液体形式(在溶液中)的共聚氨基酸的方法,制备ph7.1的共聚氨基酸/50u/ml甘精胰岛素的稀释组合物以一定方式将间甲酚和甘油的浓溶液添加至ph7.1的共聚氨基酸储备溶液,以便获得浓度为c共聚氨基酸储液/赋形剂(mg/ml)的共聚氨基酸溶液。所添加的赋形剂的量以一定方式调节,以便以ph7.1的共聚氨基酸/50u/ml甘精胰岛素的组合物获得35mm的间甲酚浓度和184mm的甘油浓度。在无菌广口瓶中,以一定方式将体积v甘精胰岛素的浓度为100u/ml的根据商品名销售的市售甘精胰岛素溶液添加至体积v共聚氨基酸储液/赋形剂的浓度为c共聚氨基酸储液/赋形剂(mg/ml)的共聚氨基酸溶液中,以获得ph7.1下的共聚氨基酸c稀释的共聚氨基酸(mg/ml)/50u/ml甘精胰岛素的稀释组合物(mg/ml)。出现浑浊。通过添加浓naoh使ph调节至ph7.1,并将溶液在静态条件下在烘箱中40℃下放置2小时,直至溶解完全。将该视觉上澄清的溶液放置在+4℃。制备方法ca2:根据用于浓缩稀释的组合物的方法,借助于共聚氨基酸制备ph7.1的共聚氨基酸/甘精胰岛素的浓缩组合物。通过由再生纤维素制成的3kda膜(由millipore公司销售的ultra-15)超滤来浓缩实施例ca1中所述的ph7.1下的共聚氨基酸/50u/ml甘精胰岛素的组合物。在该超滤步骤之后,渗余物是澄清的,并且通过反相色谱法(rp-hplc)确定组合物中甘精胰岛素的浓度。然后通过在赋形剂间甲酚/甘油的溶液中稀释以一定方式将组合物中甘精胰岛素的浓度调节至期望值,以便获得35mm的间甲酚最终浓度和300mosm/kg的渗量。测量ph并通过添加浓naoh和hcl将ph调节至7.1。该溶液在ph7.1下视觉上澄清,具有甘精胰岛素浓度c甘精胰岛素(u/ml),且共聚氨基酸浓度c共聚氨基酸(mg/ml)=c稀释的共聚氨基酸(mg/ml)×c甘精胰岛素(u/ml)/50(u/ml)。根据该制备方法ca2,制备共聚氨基酸/甘精胰岛素的组合物,例如,其中甘精胰岛素浓度为200u/ml和400u/ml。实施例ca3:制备ph7.1的共聚氨基酸/200u/ml甘精胰岛素的组合物。根据实施例ca2中所述的方法以一定方式制备共聚氨基酸/200u/ml甘精胰岛素的组合物,以便获得甘精胰岛素浓度c甘精胰岛素=200u/ml和共聚氨基酸浓度c共聚氨基酸(mg/ml)。这些组合物示于下表3中。实施例ca4:在共聚氨基酸/200u/ml甘精胰岛素的组合物中沉淀甘精胰岛素将1ml实施例ca3中制备的共聚氨基酸/甘精胰岛素溶液添加至2ml含有20mg/mlbsa(牛血清白蛋白)的pbs溶液。pbs/bsa混合物模拟皮下环境的组成。出现沉淀物。在4000rpm下进行离心以将沉淀物与上清液分离。接下来,通过rp-hplc在上清液中测定甘精胰岛素。结果是甘精胰岛素大部分以沉淀形式存在。结果在表3中示出:表3:用本发明的共聚氨基酸制备的共聚氨基酸/甘精胰岛素(200u/ml)的组合物;甘精胰岛素的溶解/沉淀。实施例db3:制备ph7.1的共聚氨基酸/甘精胰岛素/杜拉鲁肽的组合物将2ml实施例d1的杜拉鲁肽溶液和1ml水添加至3ml根据实施例ca2的方案制备的共聚氨基酸/甘精胰岛素溶液,其中甘精胰岛素的浓度为400u/ml,以获得6mlph7的组合物。用0.1n氢氧化钠溶液将ph调节至7.1。含有7mg/ml共聚氨基酸ab6、200u/ml甘精胰岛素和1mg/ml杜拉鲁肽的组合物是澄清的,表明甘精胰岛素和杜拉鲁肽在ph7.1的共聚氨基酸存在下的良好溶解性。将该澄清溶液放置在+4℃。根据实施例db3的方案,制备具有不同共聚氨基酸的组合物并示于下表4中。实施例db5:制备ph7.2的共聚氨基酸/甘精胰岛素/杜拉鲁肽的组合物根据实施例db3的方案,制备ph7.2的具有不同共聚氨基酸的组合物,并示于下表4中。表4:ph7.2的共聚氨基酸/甘精胰岛素(200u/ml)/杜拉鲁肽(1mg/ml)的组合物。实施例db6:制备ph7.2的共聚氨基酸/甘精胰岛素的组合物根据实施例ca2的步骤,制备下表5中所述的组合物db3k。表5:ph7.2的共聚氨基酸bb15/甘精胰岛素(200u/ml)的组合物。db3k甘精胰岛素u/ml200bb15mg/ml5间甲酚mm25zn(ii)mm1.12甘油mm120ps20mm0.032甘露醇mm85ps80mm0.051ph7.2部分d’-反例根据实施例ca2中所述的方法以一定方式制备反例共聚氨基酸/200u/ml甘精胰岛素的组合物,以便获得甘精胰岛素浓度c甘精胰岛素=200u/ml和反例共聚氨基酸浓度c反例共聚氨基酸(mg/ml)。这些组合物示于下表6中。表6:反例共聚氨基酸/甘精胰岛素(200u/ml)的组合物。iii.确定获得沉淀所需的白蛋白量实施例g1:制备ph7.1的稀释的共聚氨基酸/65u/ml甘精胰岛素组合物。以一定方式将间甲酚和甘油的浓溶液添加至ph7的共聚氨基酸储备溶液,以便获得浓度为c共聚氨基酸储液/赋形剂(mg/ml)的共聚氨基酸溶液。所添加的赋形剂的量以一定方式调节,以便以ph7.1的共聚氨基酸/65u/ml甘精胰岛素的组合物中获得35mm的间甲酚浓度和184mm的甘油浓度。在无菌广口瓶中,以一定方式将体积v甘精胰岛素的浓度为100u/ml的以商品名销售的市售甘精胰岛素溶液添加至体积v储液共聚氨基酸/赋形剂的浓度c储液共聚氨基酸/赋形剂(mg/ml)的共聚氨基酸溶液,以便获得ph7.1的稀释的共聚氨基酸组合物c稀释的共聚氨基酸(mg/ml)/65u/ml甘精胰岛素。出现浑浊。通过添加浓naoh使ph调节至ph7.1,并将溶液在静态条件下在烘箱中在40℃下放置2小时,直至溶解完全。将该视觉上澄清的溶液放置在+4℃。实施例g2:通过改变白蛋白的浓度,沉淀ph7.1的共聚氨基酸/65u/ml甘精胰岛素组合物以一定方式将含有0.3mlbsa(牛血清白蛋白)溶液的ph7.4的pbs缓冲液(磷酸盐缓冲盐水)和1ml稀释的共聚氨基酸/甘精胰岛素65u/ml组合物(ph7.1)分别引入到一次性uv比色皿中,以便在pbs缓冲液中获得含有50u/ml甘精胰岛素、白蛋白浓度cbsa(mg/ml)的混合物。制备数种的不同浓度含bsa的pbs缓冲液,以便通过pbs缓冲液使最终混合物中白蛋白的浓度从1至12.7mg/ml(1;2.9;3.9;6.8;9.7;12.7mg/ml)改变以及改变生理盐浓度。在pbs缓冲液中添加bsa溶液后,通过移液管的几次来回抽打使混合物迅速均质化。混合后1小时,用jascov-530uv-vis分光光度计在500nm处进行吸光度测量。在500nm处的吸光度测量使得可评价来源于甘精胰岛素沉淀的混合物的浊度。浊度作为白蛋白浓度之函数而提高以达到反映甘精胰岛素完全沉淀的平台期。允许定量沉淀的临界白蛋白浓度定义为在500nm处的吸光度值达到在平台期测量的吸光度的80%时的白蛋白浓度。注意到,在本发明的组合物中,临界bsa量较低。结果在下表7中报告:表7:在1h时80%沉淀的临界白蛋白浓度(mg/ml)(50u/ml甘精胰岛素)。iv.研究根据本发明组合物的稳定性部分e:通过研究共聚氨基酸/200u/ml甘精胰岛素确定根据本发明组合物的物理稳定性。实施例e1:在25℃下在动态条件下加速的稳定性。将填充有1ml组合物共聚氨基酸/甘精胰岛素的3个3ml小瓶垂直放置在轨道搅拌器中。将搅拌器放置在25℃的烘箱中,并将小瓶以250rpm进行搅拌。每天/每周目视检查小瓶,以检测可见颗粒的出现或浑浊。该检查根据欧洲药典(ep2.9.20)的推荐进行:小瓶经受至少2000lux的照明,并在白色背景和黑色背景上进行观察。稳定周数对应于至少2个小瓶呈现可见颗粒或浑浊的持续时间。这些结果与美国药典(usp<790>)一致。加速稳定性的结果(用不同的组合物获得)示于下表8中。表8:在25℃下在动态条件下(在250rpm的搅拌下)共聚氨基酸/甘精胰岛素(200u/ml)的组合物的稳定性结果。(*当甘精胰岛素溶液的ph被调节至ph7时出现沉淀物)。组合物共聚氨基酸在25℃下在动态条件下的稳定性(以天计)ca3-*ca3bab1811ca3cbb5>30ca3dbb1119ca3ebb1411ca3fbb1517ca3hceb17ca3iceb2>15ca3jceb37ca3kceb47ca3mab21’11ca3nbb18>44ca3obb1739ca3pbb2518ca3qbb2639ca3tbb2022ca3ubb2128ca3wcebx42实施例e2:在30℃下在静态条件下的加速稳定性将填充有1ml组合物的5个3ml小瓶垂直放置在轨道搅拌器中并维持在30℃。每天目视检查小瓶,以检测可见颗粒的出现或浑浊。该检查根据欧洲药典(ep2.9.20)的推荐进行:小瓶经受至少2000lux的照明,并在白色背景和黑色背景上进行观察。稳定周数对应于至少2个小瓶呈现可见颗粒或浑浊的持续时间。这些结果与美国药典(usp<790>)一致。加速稳定性结果(用不同组合物获得)示于下表9中.表9:在30℃下在静态条件下共聚氨基酸/甘精胰岛素(200u/ml)的组合物的稳定性结果。(*当溶液的ph调节至ph7时出现沉淀物)。v.根据本发明的组合物的实例实例h1:制备ph7.1的共聚氨基酸和200u/ml甘精胰岛素的组合物以类似于实施例ca3的方式,制备150u/ml甘精胰岛素和共聚氨基酸的组合物。如下表9a所示:表9a:ph7.1的共聚氨基酸和200u/ml甘精胰岛素的组合物实施例h2:制备ph7.1的共聚氨基酸和150u/ml甘精胰岛素的组合物以与实施例h1类似的方式,制备150u/ml甘精胰岛素和共聚氨基酸的组合物。它们示于下表9b中:表9b:共聚氨基酸/甘精胰岛素(150u/ml)的组合物实施例h3:制备ph7.1的共聚氨基酸和300u/ml甘精胰岛素的组合物以类似于实施例h1的方式,制备300u/ml甘精胰岛素和共聚氨基酸的组合物。它们示于下表10中:表10:共聚氨基酸/甘精胰岛素(300u/ml)的组合物部分f:狗中的药动学和药效学研究实施例f1:共聚氨基酸bb15(5mg/ml)/甘精胰岛素(200u/ml)在狗中的药动学和药效学研究为了评价施用共聚氨基酸和甘精胰岛素的组合物(组合物db3k)后胰岛素的药动学和药效学的目的,进行狗的研究。将组合物db3k的胰岛素的降血糖作用和药动学曲线与以相同剂量注射组合物c4(ph4)的那些进行比较。禁食约18小时的10只动物以0.5u/kg胰岛素的剂量在肩胛间区域上方的颈部接受注射。在注射前的一小时内,抽取血液样品以确定基础胰岛素水平,并收集3个样品以确定基础葡萄糖水平。然后在施用之后23小时期间抽取血液样品以描述胰岛素的药动学。通过血糖仪确定血糖持续24小时。通过elisa测试确定胰岛素水平。以相对于基础水平的偏差表示的胰岛素中值药动学曲线示于图1中。以基础水平的偏差百分比表示的葡萄糖平均药效学曲线示于图2中。药动学曲线显示,施用组合物db3k后,迅速达到平台期并在施用后保持长达14小时,然后胰岛素浓度缓慢降低。该曲线类似于注射组合物c4后获得的曲线,表明组合物db3k不会改变甘精胰岛素的动力学。通过施用组合物db3k和注射组合物c4获得的药效学结果示于图2中。在施用组合物db3k后,观察到血糖降低,直至施用后约4小时达到平台期,该平台期保持长达约13小时。然后血糖逐渐升高,直至施用后约19小时达到其基础水平。该曲线类似于注射组合物c4后获得的曲线,表明甘精胰岛素的效果用组合物db3k很好地保持。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1