化学组合物的制作方法
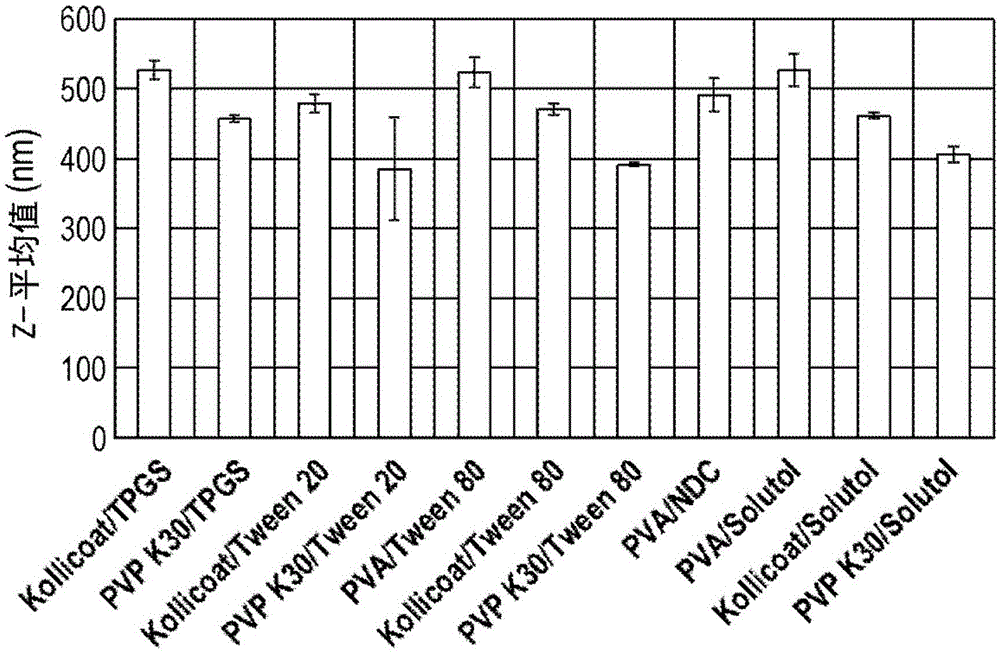
以疟疾作为寄生虫感染的实例,对于其来说提供改善的治疗和改善的预防性二者都是希望的,读者将毫无疑问地知晓疟疾是在热带和亚热带区域广泛分布的媒介传播的传染病。每年有超过2亿人感染疟疾并且将近500,000人死亡,大多数发生在撒哈拉以南的非洲的幼年儿童中。此外,文献指出每年数千万旅行者需要疟疾预防(lederk.等人,clin.infectdis.,2004,39,1104-1112)。疟疾由疟原虫属(plasmodium)的原生动物引起。最严重的疾病形式由恶性疟原虫(p.falciparum)引起,但是其他相关物种间日疟原虫(p.vivax)、卵形疟原虫(p.ovale)、三日疟原虫(p.malariae)和诺氏疟原虫(p.knowlesi)能够感染人类。此类人致病性疟原虫属物种通常被称为疟疾寄生虫。尽管目前不存在针对疟疾的有效疫苗,用于治疗和预防疟疾的有效口服制剂已经已知多年。例如,阿托伐醌(atovaquone)与盐酸氯胍(proguanilhydrochloride)的组合制剂可以商品名malaronetm获得,并且标准(成人)片剂含有250mg的阿托伐醌和100mg的盐酸氯胍。为了防止成人(体重超过40kg)中的疟疾,应当在进入疟疾地区之前24至48小时每天一次地服用一个标准片剂,在疟疾地区停留的时间段内继续每天一次地服用一个片剂,并且在离开疟疾地区之后再继续服用7天,即对于在疟疾地区仅一天的停留来说2.25至2.5g的阿托伐醌。为了治疗成人中的疟疾,应当在三天内每天服用四个标准片剂,即总计3g的阿托伐醌。阿托伐醌是羟基-1,4-萘醌并且是抗原生动物剂。其作为实际上不溶于水但是高度亲脂性的黄色结晶固体存在。以下示出了阿托伐醌的结构。对于严重疟疾的治疗,世界卫生组织推荐(如2011年)青蒿酯(artesunate)(青蒿素(artemisinin)的衍生物)的肠胃外(或直肠)制剂,直到患者能够耐受口服药物。青蒿素是天然存在的倍半萜内酯,以下示出了其结构。衍生自青蒿素的制剂是目前据信最迅速针对疟疾寄生虫起作用的物质之一,并且因此优选用于严重疟疾的治疗。然而,在不批准使用例如静脉内青蒿酯的国家,如美国,可以使用静脉内奎尼丁(quinidine)。以下示出了奎尼丁的结构。用于疟疾的(a)预防和(b)治疗的其他目前可用的制剂分别包括:(a)多西环素(doxycycline)、甲氟喹(mefloquine)、氯喹(chloroquine)和伯氨喹(primaquine),以及(b)复方蒿甲醚(coartem)(蒿甲醚(artemether)加本芴醇(lumefantrine))、奎宁(quinine)和氯喹(chloroquine)。疟疾的有效预防、控制和治疗带来了大量挑战,尤其是在对药物和卫生保健的获取有限的撒哈拉以南的非洲。健康工作人员和消费者对疟疾预防方案和抗疟疾治疗的差的坚持性(adherence)与预防/治疗失败、严重疟疾和死亡有关。差的坚持性导致体内的亚治疗(sub-therapeutic)药物浓度,这将不会根除所有疟疾寄生虫并且可能允许耐药性寄生虫的生长。体内的药物浓度可能由错失的剂量和/或由被服用但是并未以及时的方式服用的剂量而成为亚治疗的。因此,患者对疟疾预防方案和抗疟疾治疗的高坚持性水平在确保处方制剂的有效性方面是重要的。因此,从减少给药、施用的容易程度、患者坚持性/依从性增加以及简化随访护理的观点中的任何一个或多个来看,治疗和/或预防疟疾的改进方式将是合乎需要的。由于与针对改善疟疾的治疗和/或预防的需求所给出的相同的原因,如以上简要提及的治疗和/或预防以下其他寄生虫和真菌疾病如弓形虫病(toxoplasmosis)(由寄生虫刚地弓形虫(toxoplasmagondii)引起)、巴贝虫病(babesiosis)(由寄生虫田鼠巴贝虫(babesiamicroti)引起)和肺囊虫肺炎(pneumocystispneumonia)(由真菌耶氏肺囊虫(pneumocystisjirovecii)引起)中的任何一种的改进方式也将是合乎需要的。因此,本发明的目的是消除和/或缓解与现有抗寄生虫和抗真菌的预防和/或治疗供给物有关的缺点中的至少一个,而无论是否在本文中或另外确定。此外,本发明的目的是提供用于预防和/或治疗寄生虫和真菌感染(尤其是疟疾、弓形虫病、巴贝虫病和肺囊虫肺炎)的改进的化学组合物。根据本发明的第一方面,提供了一种固体组合物,所述固体组合物包含分散在一种或多种载体材料内的阿托伐醌纳米粒子,其中所述阿托伐醌以至少10重量%的量存在。为了避免任何疑义,根据本发明的第一方面的固体组合物包含分散在一种或多种固体载体材料内的固体阿托伐醌纳米粒子。如果存在多于一种固体载体材料,则所述两种以上固体载体材料以其中分散有固体阿托伐醌纳米粒子的混合物存在。一种或多种固体载体材料有效地形成其中分散有固体阿托伐醌纳米粒子的基质。因此,本发明的化学组合物是物质的混合物,并且在本说明书中对“化学组合物”或“固体组合物”的所有提及都应当相应地解释。根据本发明的第二方面,提供了一种水性分散体,所述水性分散体包含分散在水性介质中的多个阿托伐醌纳米粒子,每个阿托伐醌纳米粒子是核心,在至少一些核心周围可以设置由一种或多种载体材料组成的外层,其中所述阿托伐醌以至少10mg/ml的浓度存在。在整个本说明书中,对于外层来说,“可以设置”意指阿托伐醌纳米粒子中的一些将设置有所述外层,但是并非全部阿托伐醌纳米粒子需要设置有所述外层,尽管全部可以设置有所述外层。为了避免任何疑义,根据本发明的第二方面的水性分散体包含分散在水性介质中的多个固体阿托伐醌纳米粒子,每个固体阿托伐醌纳米粒子是核心,在核心周围可以设置由一种或多种载体材料组成的外层(就其厚度、组成和/或任何其他性质而言不需要是均匀层)。根据本发明的第三方面,提供了一种油性分散体,所述油性分散体包含分散在油性介质中的多个阿托伐醌纳米粒子和一种或多种载体材料,其中所述阿托伐醌以至少10mg/ml的浓度存在。所述分散体的物理组成的范围可以从(a)其一种或多种载体材料完全溶解或分散在油性介质(适合的非水性稀释剂)并且固体阿托伐醌纳米粒子分散在油性介质中,至(b)含有一些阿托伐醌纳米粒子的一种或多种载体材料的基质的较小粒子分散在油性介质中以使得阿托伐醌纳米粒子保持截留在基质中,即基质本身不溶解。根据固体材料即阿托伐醌和一种或多种载体材料与能够相应地变化的油性介质的比例,油性分散体可以是具有高的固体材料与油性介质比例的糊剂形式。在整个本说明书中,除非另外指出,使用作为名词的术语“一种或多种分散体”和类似术语意指本发明的水性分散体和油性分散体二者。根据本发明的第四方面,提供了一种阿托伐醌纳米粒子的可肌内注射制剂。根据本发明的第五方面,提供了一种阿托伐醌纳米粒子的可皮下注射制剂。换句话说,本发明还提供了阿托伐醌的稳定的可直接肌内注射制剂和阿托伐醌的稳定的可直接皮下注射制剂二者,其每一个可以是固体形式的(或基本上固体形式的,例如糊剂)或液体形式的,其中阿托伐醌以纳米粒子的形式存在。在整个本说明书中,除非另外指出,使用术语“一种或多种可注射制剂”和类似术语意指可肌内注射制剂和可皮下注射制剂二者。本发明的固体组合物、分散体和可注射制剂中的每一种包含固体纳米颗粒形式的阿托伐醌。本发明的纳米粒子提供了改进的阿托伐醌剂型。本发明的固体组合物、分散体和可注射制剂中的每一种还提供了实现阿托伐醌在体内的全身分布的方式并且提供了在循环血流中的较高药物水平。这些优点为更有效地治疗和/或预防全身性感染,尤其是全身性寄生虫和真菌感染提供了机会。备选地或另外地,这些优点还可以使得所需的阿托伐醌剂量降低。在固体组合物中设置纳米粒子也可以是有利的,因为当需要分别形成用于施用例如肠胃外施用的纳米粒子的水性分散体或油性分散体时,它们能够分散在适合的水性或油性稀释剂(药用或兽医可接受的可注射油)中。这样的固体组合物的分散体可以形成本发明的可注射制剂。当通过将固体组合物分散在的油性稀释剂中来形成油性分散体时,所述分散体的物理组成的范围可以从(a)其一种或多种载体材料完全溶解或分散在油性稀释剂中以使得阿托伐醌纳米粒子释放并且分散在油性稀释剂中,至(b)例如通过应用于块状固体组合物的碾磨或研磨或其他适合的粉碎技术形成的组合物的较小粒子分散在油性稀释剂中。在后一种情况中,分散在油性稀释剂中的组合物的较小粒子为含有一些阿托伐醌纳米粒子的一种或多种载体材料的基质的有效离散部分;基质本身不溶解并且阿托伐醌纳米粒子保持截留在基质中。同样地,提供随时可用的可注射制剂—无论是固体形式还是液体形式—提供了容易施用的药物的简单且方便的形式。本发明的固体组合物和分散体二者理想地适用于个性化药物方案,因为二者是基本上均匀的(或者在分散体的情况中能够使其基本上均匀),意味着可以根据需要准确地测量阿托伐醌的部分剂量。此外,本发明的固体组合物可容易地分散在水性介质或油性介质中以分别提供稳定的水性分散体或油性分散体。这样的稳定分散体本身能够以预定方式分配以提供准确的阿托伐醌的液体剂量。也可以使用本发明的可注射制剂(无论是以固体还是液体形式)实现阿托伐醌的准确给药。这样的提供个性化剂量的方法特别适用于儿科施用,因为儿童需要较低的剂量。此外,可以使阿托伐醌剂量相应地适应于患者的体重、年龄和其他情况(如寄生虫或真菌感染的阶段或严重性)。根据本发明的第六方面,提供了水性分散体,所述水性分散体可通过以下方式获得,通过以下方式获得,或者通过以下方式直接获得:将第一方面的固体组合物分散在水性介质中。根据本发明的第七方面,提供了油性分散体,所述油性分散体可通过以下方式获得,通过以下方式获得,或者通过以下方式直接获得:将第一方面的固体组合物分散在油性介质(非水性介质)中。根据本发明的第八方面,提供了用于制备如本文中限定的固体组合物的方法。根据本发明的第九方面,提供了一种固体组合物,所述固体组合物可通过根据第八方面的方法中的任一种获得,通过根据第八方面的方法中的任一种获得,或者通过根据第八方面的方法中的任一种直接获得。根据本发明的第十方面,提供了一种药物组合物,所述药物组合物包含本发明的第一或第九方面的固体组合物、或本发明的第二或第六方面的水性分散体、或本发明的第三或第七方面的油性分散体,以及任选的另外的药用稀释剂、载体或赋形剂。所述组合物还可以是兽医组合物。根据本发明的第十一方面,提供了用作药物的如本文中限定的固体组合物、分散体或可注射制剂。根据本发明的第十二方面,提供了用于治疗和/或预防寄生虫和真菌感染(例如疟疾、弓形虫病、巴贝虫病、肺囊虫肺炎)的如本文中限定的固体组合物、分散体或可注射制剂。根据本发明的第十三方面,提供了如本文中限定的固体组合物或分散体在制备用于治疗和/或预防寄生虫和真菌感染(例如疟疾、弓形虫病、巴贝虫病、肺囊虫肺炎)的药物中的用途。根据本发明的第十四方面,提供了一种治疗和/或预防寄生虫感染(例如疟疾、弓形虫病、巴贝虫病)或真菌感染(例如肺囊虫肺炎)的方法,所述方法包括向患有寄生虫或真菌感染或处于患有寄生虫或真菌感染的风险下的患者施用治疗有效量的如本文中限定的固体组合物、药物或兽医可注射组合物、分散体或可注射制剂。根据本发明的第十五方面,提供了一种用于制备注射用阿托伐醌无菌液体制剂的试剂盒,所述试剂盒包含:第一容器,所述第一容器包含如本文中限定的固体组合物、药物或兽医可注射组合物或可注射制剂;和第二容器,所述第二容器包含足以将所述阿托伐醌稀释至至少10mg/ml的浓度的量的无菌水性或油性(非水性)稀释剂。为了避免任何疑义,除非另外说明,本发明的任何方面的特征(包括任选的、适合的和优选的特征)应被认为也是本发明的任何和所有其他方面的特征(包括任选的、适合的和优选的特征)。定义术语“纳米粒子”或“纳米颗粒”在本文中用于意指具有小于或等于1微米(μm)但是大于或等于1纳米(nm)即在1-1000nm范围内的尺寸的粒子。这些术语是清楚的并且被本领域技术人员充分理解而没有任何混淆,尤其是petros和desimone,naturereviewsdrugdiscovery,2010,9,615-627所证明的。除非另外说明,术语“粒度”在本文中用于指代数均粒径。除非另外说明,术语“患者”包括人类患者和动物患者二者。术语“阿托伐醌”在本文中用于指代在背景部分中作为阿托伐醌说明的分子,并且还包括其药用盐、溶剂化物和衍生物,其前药,以及其任何多晶或非晶形式。术语“其他药物”在本文中用于指代可以在组合预防性和/或治疗性疗法中与根据本发明配制的阿托伐醌组合使用的其他药物的以下(非穷举)清单:氯胍(proguanil)、甲氟喹(mefloquine)、氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、奎宁(quinine)、奎尼丁(quinidine)、蒿甲醚(artemether)、本芴醇(lumefantrine)、伯氨喹(primaquine)、多西环素(doxycycline)、四环素(tetracycline)、克林霉素(clindamycin)、二氢青蒿素(dihydroartemisinin)、哌喹(piperaquine)和具有或不具有磺胺多辛(sulfadoxine)的乙胺嘧啶(pyrimethamine),以及其药用盐、溶剂化物和衍生物,其前药,和其任何多晶或非晶形式。应理解的是,提及“预防”涉及预防性治疗并且包括预防或延缓在患者中发展的状态、病症或病况的临床症状的表现,所述患者可能受所述状态、病症或病况折磨或者易患所述状态、病症或病况但是尚未经历或者显示出所述状态、病症或病况的临床或亚临床症状。具体参照疟疾,因为疟疾寄生虫局限于循环血流(在红细胞中),或者对于感染的前几天来说局限于肝脏,阿托伐醌的预防效果扩展至初期肝脏阶段(病因性预防(causalprophylaxis))和红细胞阶段(抑制性预防(suppressiveprophylaxis))二者。将进一步理解的是,提及状态、病症或病况的“治疗”包括:(1)抑制所述状态、病症或病况,即阻止、减少或延缓疾病的发展或其复发(在维持治疗的情况中)或其至少一种临床或亚临床症状;或(2)使疾病缓和或减弱,即使所述状态、病症或病况或其临床或亚临床症状中的至少一种消退。在本发明的上下文中,术语“预防”不应被认为仅指在治疗特定状态、病症或病况中完全有效的药物,而且还涵盖部分有效的药物。此外,当从患者群体方面考虑以用于治疗时,术语“预防”应当被认为涵盖可用于降低在该目标群体中的目标病症或病况(例如疟疾、弓形虫病、巴贝虫病、肺囊虫肺炎)的发病率的药物,以及可用于将目标状态、病症或病况从目标群体中完全根除的药物。“治疗有效量”意指当施用至患者以用于治疗和/或预防疾病时足以针对疾病实现这样的治疗/预防的化合物的量。“治疗有效量”将根据化合物、疾病及其严重性以及待治疗的患者的年龄、重量等变化。术语“基本上由……组成”在本文中用于表示给定的产品或方法仅由指定的材料或步骤以及不实质上影响要求保护的发明一个或多个特征的任选的其他材料或步骤组成。适宜地,基本上由一种指定材料(或多种指定材料)组成的产品包含大于或等于85%的指定材料,更适宜大于或等于90%、更适宜大于或等于95%、最适宜大于或等于98%的一种或多种指定材料。除非另外说明,在本文中讨论的重量百分数(“重量%”)是指具体组分作为组合物的总重量的比例的重量%。在本文中提及载体材料与另一种载体材料另一种载体材料“(基本上)不可溶混”意指包含两种载体材料的混合物不能形成单一相。固体组合物本发明提供了一种固体组合物,所述固体组合物包含分散在一种或多种载体材料内的阿托伐醌纳米粒子,其中所述阿托伐醌以至少10重量%的量存在。优选地,阿托伐醌以至少15重量%、进一步优选至少20重量%、更进一步优选至少25重量%、更进一步优选至少30重量%、更进一步优选至少40重量%、更进一步优选至少50重量%、更进一步优选至少60重量%、更进一步优选70重量%、并且最优选至少80重量%的量存在。优选地,所述一种或多种载体材料可以提供亲水聚合物和表面活性剂活性,并且进一步优选地,可以选自由下列各项组成的组:聚乙烯醇-聚乙二醇接枝共聚物;聚乙烯醇;聚乙烯吡咯烷酮k30;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;聚氧乙烯(20)脱水山梨糖醇单油酸酯;脱氧胆酸钠;d-α-生育酚聚乙二醇1000琥珀酸酯;和聚乙二醇(15)-羟基硬脂酸酯。在整个本说明书中描述了“所述一种或多种载体材料可以提供亲水聚合物和表面活性剂活性”,其意指可以存在提供亲水聚合物活性和表面活性剂活性二者的单一载体材料,或者可以存在多种载体材料,在这种情况中,在多种载体材料中的一种(或多种)载体材料可以提供亲水聚合物活性,同时在多种载体材料中的另一种载体材料(或另外的多种载体材料)可以提供表面活性剂活性。在后一种情况中,为了简单,对于分别提供亲水聚合物活性和表面活性剂活性的载体材料来说,可以将所述一种或多种载体材料简称为“(亲水)聚合物”或“表面活性剂”。因此,所述一种或多种固体载体材料可以以下面组合中的任何一种或多种提供:-聚乙烯醇-聚乙二醇接枝共聚物和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯醇和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠;-聚乙烯醇和聚乙二醇(15)-羟基硬脂酸酯。更进一步优选地,所述一种或多种载体材料可以选自由下列各项组成的组:聚乙烯醇-聚乙二醇接枝共聚物;聚乙烯醇;聚乙烯吡咯烷酮k30;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;聚氧乙烯(20)脱水山梨糖醇单油酸酯;脱氧胆酸钠;和d-α-生育酚聚乙二醇1000琥珀酸酯。因此,所述一种或多种固体载体材料可以以下面组合中的任何一种或多种提供:-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠。所述一种或多种固体载体材料优选是水溶性的。在本发明的上下文中,应用于一种或多种载体材料的“水溶性”意指其在环境温度和压力下在水中的溶解度为至少10g/l。优选地,单个固体阿托伐醌纳米粒子基本上由阿托伐醌组成。本发明的固体组合物可以原样施用至患者,或者进一步配制以提供例如可注射制剂如肌内储库型注射剂(depotinjection)或皮下储库型注射剂的形式的药物组合物。阿托伐醌纳米粒子具有小于或等于1微米(μm)的平均粒度。优选地,阿托伐醌纳米粒子具有在100至1000nm之间的平均粒度。进一步优选地,阿托伐醌纳米粒子具有在200至850nm之间的平均粒度。可以通过在本领域中已知的任何适合的技术(例如激光衍射、激光散射、电子显微镜)来评估粒度。已经通过以下方式评估本文中的粒度:将固体组合物分散在水性介质中,并且使用zetasizer(malverninstrumentsltd)通过动态光散射确定粒度。阿托伐醌纳米粒子的多分散度可以小于或等于0.8,优选小于或等于0.6,并且更优选小于或等于0.4。多分散度涉及阿托伐醌纳米粒子的尺寸并且可以通过在本领域中已知的适合技术(例如激光衍射、激光散射、电子显微镜)确定。本文中的阿托伐醌纳米粒子的粒度的多分散度已经使用malvernzetasizer(malverninstrumentsltd)进行评估。当分散在水性介质中时,阿托伐醌纳米粒子的平均ζ电位可以在-100至+100mv之间。在一个实施方案中,阿托伐醌纳米粒子的ζ电位可以在-30至+30mv之间。在另一个实施方案中,阿托伐醌纳米粒子的ζ电位可以在-25至+25mv之间。在又一个实施方案中,阿托伐醌纳米粒子的ζ电位可以在-25至+10mv之间。通常,已经发现,较小量级(正或负)的ζ电位允许纳米粒子更好地穿透进入细胞中并且在细胞中累积。根据本发明,平均ζ电位能够通过在本领域中已知的技术测量,如使用zetasizer(malverninstrumentsltd)。固体组合物可以包含较大尺寸的固体粒子或颗粒,例如尺寸为5至30微米(μm),其中每个粒子或颗粒含有多个分散在一种或多种固体载体材料中的固体阿托伐醌纳米粒子。当固体组合物与水性介质混合时,这些较大的粒子或颗粒分散以形成离散的固体阿托伐醌纳米粒子。亲水聚合物以下亲水聚合物适用于在本发明中使用:-聚乙烯醇-聚乙二醇接枝共聚物(可以商品名kollicoattm获得);-聚乙烯醇(‘pva’);-聚乙烯吡咯烷酮k30,具有30,000的平均mw(‘pvpk30’)。表面活性剂以下表面活性剂适用于在本发明中使用:-聚氧乙烯(20)脱水山梨糖醇单月桂酸酯,也称为聚山梨醇酯20(可以商品名tweentm20获得);-聚氧乙烯(20)脱水山梨糖醇单油酸酯,也称为聚山梨醇酯80(可以商品名tweentm80获得);-脱氧胆酸钠;-d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙二醇(15)-羟基硬脂酸酯(可以商品名solutoltmhs获得)。特别地,以下表面活性剂优选用于在本发明中使用:-聚氧乙烯(20)脱水山梨糖醇单月桂酸酯,也称为聚山梨醇酯20(可以商品名tweentm20获得);-聚氧乙烯(20)脱水山梨糖醇单油酸酯,也称为聚山梨醇酯80(可以商品名tweentm80获得);-脱氧胆酸钠;-d-α-生育酚聚乙二醇1000琥珀酸酯。在本发明中,具有表面活性剂活性的固体载体材料适宜地选自能够使与如本文中限定的具有亲水聚合物活性的载体材料一起的阿托伐醌纳米粒子稳定并且也被批准用于药物用途(例如它们被美国食品药品监督管理局批准使用)的那些表面活性剂。亲水聚合物和表面活性剂的具体组合当然,前述亲水聚合物中的任何一种或多种可以与前述表面活性剂中的任何一种或多种组合以用于在本发明中使用。然而,一种或多种亲水聚合物和一种或多种表面活性剂的以下组合特别优选用于在本发明中使用:-聚乙烯醇-聚乙二醇接枝共聚物和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯醇和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠;-聚乙烯醇和聚乙二醇(15)-羟基硬脂酸酯。固体组合物的制剂在特别的实施方案中,如本文中限定的固体组合物可以包含10至99重量%的阿托伐醌。优选地,或者在另一个实施方案中,固体组合物可以包含15至95重量%的阿托伐醌。进一步优选地,或者在另一个实施方案中,固体组合物可以包含至少20重量%、更优选或备选至少40重量%、更进一步优选或备选至少60重量%、并且最优选或备选至少80重量%的阿托伐醌。阿托伐醌以至少10重量%的任何量存在,如在10-99重量%、或10-95重量%、或10-90重量%的范围内。备选地,阿托伐醌可以以至少15重量%的量存在,如在15-99重量%、或15-95重量%、或15-90重量%的范围内。进一步备选地,阿托伐醌可以以至少20重量%的量存在,如在20-99重量%,或20-95重量%、或20-90重量%的范围内。更进一步备选地,阿托伐醌可以以至少25重量%的量存在,如在25-99重量%、或25-95重量%、或25-90重量%的范围内。再进一步备选地,阿托伐醌可以以至少30重量%的量存在,如在30-99重量%、或30-95重量%、或30-90重量%的范围内。再进一步备选地,阿托伐醌可以以至少40重量%的量存在,如在40-99重量%、或40-95重量%、或40-90重量%的范围内。再进一步备选地,阿托伐醌可以以至少50重量%的量存在,如在50-99重量%、或50-95重量%、或50-90重量%的范围内。再进一步备选地,阿托伐醌可以以至少60重量%的量存在,如在60-99重量%、或60-95重量%、或60-90重量%的范围内。再进一步备选地,阿托伐醌可以以至少70重量%的量存在,如在70-99重量%、或70-95重量%、或70-90重量%的范围内。再进一步备选地,阿托伐醌可以以至少80重量%的量存在,如在80-99重量%、或80-95重量%、或80-90重量%的范围内。本发明的固体组合物因此允许高的载药量,这将潜在有毒的赋形剂(例如表面活性剂)维持至最低限度。固体组合物可以包含1至90重量%的一种或多种选择的载体材料。优选地,或者在一个实施方案中,固体组合物可以包含5至85重量%的一种或多种载体材料。进一步优选地,或者在另一个实施方案中,固体组合物可以包含10至80重量%的一种或多种载体材料。在特别的实施方案中,固体组合物可以包含20至60重量%的一种或多种选择的载体材料。为了避免疑义,选择的载体材料的百分含量是指全部所述选择的载体材料在该组合物中的总重量的量。在特别的实施方案中,固体组合物可以包含1至90重量%的亲水聚合物。优选地,或者在另一个实施方案中,固体组合物可以包含8至70重量%的亲水聚合物。进一步优选地,或者在另一个实施方案中,固体组合物可以包含10至60重量%的亲水聚合物。更进一步优选地,或者在特别的实施方案中,固体组合物可以包含10至50重量%的亲水聚合物。在特别的实施方案中,固体组合物可以包含1至70重量%的表面活性剂。优选地,或者在另一个实施方案中,固体组合物可以包含2至50重量%的表面活性剂。进一步优选地,或者在另一个实施方案中,固体组合物可以包含3至30重量%的表面活性剂。在一个实施方案中,固体组合物可以以在30:1至1:10之间的相应比率包含提供亲水聚合物活性的载体材料和提供表面活性剂活性的载体材料。优选地,或者在特别的实施方案中,固体组合物可以以在15:1至1:2之间的相应比率包含提供亲水聚合物活性的载体材料和提供表面活性剂活性的载体材料。进一步优选地,或者在另一个实施方案中,固体组合物可以以在10:1至2:1之间的相应比率包含提供亲水聚合物活性的载体材料和提供表面活性剂活性的载体材料。更进一步优选地,或者在特别的实施方案中,固体组合物可以以在6:1至3:1之间的相应比率包含提供亲水聚合物活性的载体材料和提供表面活性剂活性的载体材料。在特别优选的实施方案中,固体组合物包含:-40至90重量%的阿托伐醌;-8至40重量%的提供亲水聚合物活性的载体材料;和-2至20重量%的提供表面活性剂活性的载体材料。例如,固体组合物可以包含一种或多种另外的赋形剂以进一步促进纳米粒子分散体在药用稀释剂或在体内的分散或稳定。用于制备固体组合物的方法本发明的固体组合物可以通过在本领域中公知的多种方法制备。用于形成这样的组合物的适合的技术通常在horn和rieger,angew.chem.int.ed.,2001,40,4330-4361中描述。例如,固体组合物可以通过碾磨固体形式的阿托伐醌制备。碾磨可以在一种或多种载体材料(例如亲水聚合物和表面活性剂)的存在下进行,或者备选地,它们可以在碾磨步骤之后与碾磨的药物混合。然而,通常优选的是,本发明的固体阿托伐醌组合物通过水包油(o/w)乳液技术制备,其中阿托伐醌溶解在油相中并且例如提供亲水聚合物和表面活性剂活性的一种或多种载体材料存在于水相中。然后通过冷冻干燥、喷雾干燥或喷雾粒化将油和水溶剂移除以提供根据本发明的固体组合物。因此,根据本发明的一个方面,提供了一种用于制备如本文中限定的固体组合物的方法,所述方法包括:(a)制备水包油乳液,所述水包油乳液包含:-包含阿托伐醌的油相;和-包含如本文中限定的一种或多种选择的载体材料的水相;和(b)从所述水包油乳液中移除油和水以形成所述固体组合物。本发明的方法的优点是:在初始步骤中形成的乳液充分均匀且稳定,以允许在移除油和水时的有效且均匀的干燥。此外,形成的纳米粒子在其物理形式(尺寸、形状等)方面基本上均匀。可以通过在本领域中公知的方法进行水包油乳液形成步骤。因此可以使用用于形成水包油乳液的任何适合的方法。特别地,可以通过在本领域中公知的方法进行油相和水相的混合以形成水包油乳液。例如,混合可以包括搅拌、超声处理、均化或它们的组合。在特别的实施方案中,通过超声处理和/或均化来促进混合。例如,可以通过使用在wo2004/011537a1(cooper等)中描述的方法进行水包油乳液形成步骤,其通过引用适当地结合于此。在特别的实施方案中,水包油乳液形成包括:(i)提供包含阿托伐醌的油相;(ii)提供包含一种或多种选择的载体材料的水相;和(iii)将油相和水相混合以产生水包油乳液。适宜地,通过将阿托伐醌溶解于适合的有机溶剂来提供油相。适宜地,通过将一种或多种选择的载体材料溶解于水性介质、优选溶解于水来提供水相。在使用多于一种所述选择的载体材料的实施方案中,可以通过将相应数量的每种选择的载体材料的单独制备的水溶液混合来提供水相。在特别的实施方案中,在混合步骤(iii)之前或期间加入另外的水性介质(例如水)或有机溶剂。在水包油乳液中的阿托伐醌的浓度适宜地尽可能浓,以促进所述方法的有效规模扩大。例如,在油相中的一种或多种药物的浓度适宜地是10mg/ml或更高,更适宜15mg/ml或更高,甚至更适宜大于20mg/ml或更高。在水相中的提供亲水聚合物活性的载体材料的浓度适宜地是0.5至50mg/ml。在水相乳液中的提供表面活性剂活性的载体材料的浓度适宜地是0.5至50mg/ml。形成油相的有机溶剂(基本上)不可与水溶混。适宜地,有机溶剂是非质子的。适宜地,有机溶剂具有小于120℃、适宜地小于100℃、适宜地小于90℃的沸点。在特别的实施方案中,有机溶剂选自在与残留溶剂相关的国际协调会议(internationalconferenceonharmonization,ich)准则中列出的2类或3类溶剂。在特别的实施方案中,有机溶剂选自氯仿、二氯甲烷、二氯乙烷、四氯乙烷、环己烷、己烷、异辛烷、十二烷、癸烷、甲基丁基酮(mbk)、甲基环己烷、四氢呋喃、甲苯、二甲苯、乙酸丁酯、矿物油、叔丁基甲基醚、庚烷、乙酸异丁酯、乙酸异丙酯、乙酸甲酯、甲基乙基酮、乙酸乙酯、乙基醚、戊烷和乙酸丙酯,以及它们的任何适宜的组合。在特别的实施方案中,有机溶剂选自氯仿、二氯甲烷、甲基乙基酮(mek)、甲基丁基酮(mbk)和乙酸乙酯。在混合步骤(iii)中的水相与油相的体积比适宜地在20:1至1:1之间,更适宜在10:1至1:1之间,并且最适宜在6:1至2:1之间。混合步骤(iii)适宜地产生基本上均匀的水包油乳液。如之前指出的,可以使用在本领域中公知的方法进行混合。适宜地,混合步骤(iii)包括搅拌、超声处理、均化或它们的组合。在特别的实施方案中,混合步骤(iii)包括超声处理和/或均化。可以使用在本领域中公知的方法进行油和水的移除。适宜地,将油和水移除包括冷冻干燥、喷雾干燥或喷雾粒化。可以使用在wo2004/011537a1(cooper等)中描述的方法进行油和水的移除,其全部内容通过引用结合于此。在特别的实施方案中,将油和水移除包括将水包油乳液冷冻干燥。将油和水移除可以适宜地包括将水包油乳液冷冻并且之后将溶剂在真空下移除。优选地,可以通过将水包油乳液外部冷却来进行水包油乳液的冷冻。例如,可以通过将容器浸没在冷却介质如液氮中将含有水包油乳液的容器外部冷却。用于冷冻目的的备选的介质对本领域技术人员来说是众所周知的。备选地,含有水包油乳液的容器可以设置有冷却剂通过其循环以将水包油乳液冷冻的外部“套管”。备选地,容器可以包括冷却剂通过其循环从而将水包油乳液冷冻的内部元件。在进一步的备选方案中,通过与在有效冷冻乳液的温度下的冷却介质直接接触来冷冻水包油乳液。本领域技术人员基于用于冷冻的乳液的冷冻温度将充分理解“有效冷冻乳液的温度”。应该理解的是,技术人员能够基于乳液及其载体材料的凝固点容易地确定什么温度将会是这样有效的。在通过与冷却介质接触来冷冻乳液的情况下,可以将冷却介质(例如液氮)加入至水包油乳液中,或者可以将水包油乳液加入至冷却介质中。在特别的实施方案中,适宜地以逐滴方式将水包油乳液加入至流体介质(例如液氮)中,其中可以适宜地形成水包油乳液的冷冻液滴。这种加入顺序提供较高的最终产物纯度。可以适宜地将冷冻液滴分离(例如在真空下,以移除流体介质/液氮)。之后适宜地在真空下将溶剂从冷冻液滴中移除。之后分离所得的固体组合物。在备选的方面中,本发明提供了一种用于制备如本文中限定的固体组合物的方法,所述方法包括:-在一种或多种溶剂中制备单一相溶液,所述单一相溶液包含阿托伐醌和一种或多种选择的载体材料;和-移除所述一种或多种溶剂以形成固体组合物。在本发明的这个方面中,包含阿托伐醌和一种或多种选择的载体材料的单一相溶液全部溶解在一种溶剂或两种以上可溶混溶剂中。在wo2008/006712中充分描述了这样的方法,其全部内容通过引用适当地结合于此。wo2008/006712还列出了用于形成单一相溶液的适合的溶剂以及它们的组合。在一个实施方案中,单一相溶液包含共同溶解阿托伐醌和一种或多种选择的载体材料的两种以上溶剂(例如乙醇和水)。在另一个实施方案中,单一相包含单一溶剂,例如乙醇或水。可以使用在本领域中公知的方法进行一种或多种溶剂的移除。适宜地,将一种或多种溶剂移除包括冷冻干燥、喷雾干燥或喷雾粒化。在特别的实施方案中,将一种或多种溶剂移除包括将单一相溶液冷冻干燥。将一种或多种溶剂移除可以适宜地包括将单一相溶液冷冻并且之后将溶剂在真空下移除。本发明还提供了一种固体组合物,所述固体组合物可通过本文中所述的方法中的任一种获得,通过本文中所述的方法中的任一种获得,或者通过本文中所述的方法中的任一种直接获得。固体阿托伐醌纳米粒子的水性或油性分散体本发明提供了一种水性分散体,所述水性分散体包含分散在水性介质中的多个阿托伐醌纳米粒子,每个阿托伐醌纳米粒子是核心,在至少一些核心周围可以设置由一种或多种载体材料组成的外层,其中所述阿托伐醌以至少10mg/ml的浓度存在。本发明还提供了一种油性分散体,所述油性分散体包含分散在油性介质中的多个阿托伐醌纳米粒子和一种或多种载体材料,其中所述阿托伐醌以至少10mg/ml的浓度存在。优选地,或者在一个实施方案中,阿托伐醌以至少15mg/ml的浓度存在于分散体中。进一步优选地,或者在备选的实施方案中,阿托伐醌以至少18mg/ml的浓度存在于分散体中。更进一步优选地,或者在备选的实施方案中,阿托伐醌以至少20mg/ml或甚至至少25mg/ml的浓度存在于分散体中。优选地,所述一种或多种载体材料可以提供亲水聚合物和表面活性剂活性,并且进一步优选地,可以选自由下列各项组成的组:聚乙烯醇-聚乙二醇接枝共聚物;聚乙烯醇;聚乙烯吡咯烷酮k30;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;聚氧乙烯(20)脱水山梨糖醇单油酸酯;脱氧胆酸钠;d-α-生育酚聚乙二醇1000琥珀酸酯;和聚乙二醇(15)-羟基硬脂酸酯。因此,所述一种或多种固体载体材料可以以下面组合中的任何一种或多种提供:-聚乙烯醇-聚乙二醇接枝共聚物和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯醇和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠;-聚乙烯醇和聚乙二醇(15)-羟基硬脂酸酯。更进一步优选地,所述一种或多种载体材料可以选自由下列各项组成的组:聚乙烯醇-聚乙二醇接枝共聚物;聚乙烯醇;聚乙烯吡咯烷酮k30;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;聚氧乙烯(20)脱水山梨糖醇单油酸酯;脱氧胆酸钠;和d-α-生育酚聚乙二醇1000琥珀酸酯。因此,所述一种或多种固体载体材料可以以下面组合中的任何一种或多种提供:-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠。所述一种或多种载体材料优选是水溶性的,以使得它们溶解和/或分散在水性介质中,并且能够在单个阿托伐醌核心周围(即在根据本发明的水性分散体中的每个阿托伐醌纳米粒子周围)形成外层。例如,水性介质可以是无菌水。本发明还提供了水性分散体,所述水性分散体可通过以下方式获得,通过以下方式获得,或者通过以下方式直接获得:将如本文中限定的固体组合物分散在水性介质中。适宜地,水性分散体在即将使用前制备。本发明还提供了油性分散体,所述油性分散体可通过以下方式获得,通过以下方式获得,或者通过以下方式直接获得:将如本文中限定的固体组合物分散在油性介质中。适宜地,油性分散体在即将使用前制备。当将固体组合物分散在水性介质中时,例如提供亲水聚合物和表面活性剂活性的一种或多种载体材料溶解在水性介质中从而以分散形式释放固体阿托伐醌纳米粒子。然后,之前分散在一种或多种选择的载体材料的固体混合物中的阿托伐醌纳米粒子以设置有外层的形式分散在水性介质中,其中阿托伐醌核心中的至少一些各自独立地“涂布”有一种或多种选择的载体材料。认为这样的外层为纳米粒子赋予了稳定性,从而防止过早凝结和聚集。当将固体组合物分散在油性介质中时,例如提供亲水聚合物和表面活性剂活性的一种或多种载体材料可以溶解在油性介质中从而以分散形式释放固体阿托伐醌纳米粒子。然后,之前分散在一种或多种选择的载体材料的固体混合物中的阿托伐醌纳米粒子分散在油性介质中。这样的物理形式可以形成油性分散体的物理形式所落入的连续体(continuum)的一端;所述连续体的另一端是例如通过研磨使固体组合物粉碎以形成分散在油性介质中的(在其中分散有阿托伐醌纳米粒子的一种或多种载体材料的)组合物的较小粒子,以使得阿托伐醌纳米粒子保持截留在基质中,即基质本身不溶解。适宜地,阿托伐醌、提供亲水聚合物活性的一种或多种载体材料和提供表面活性剂活性的一种或多种载体材料的相对量(包括比率)与相对于固体组合物所限定的相同。然而,必须调节它们在作为整体的分散体中的相应的重量%值以考虑水性/油性介质。在特别的实施方案中,水性/油性介质占总分散体的20至99.5重量%。优选地,或者在特别的实施方案中,水性/油性介质可以占总分散体的50至98重量%。进一步优选地,或者在特别的实施方案中,水性/油性介质可以占总分散体的70至95重量%。适宜地,分散体的其余部分基本上由阿托伐醌和一种或多种选择的载体材料组成,其在作为整体的分散体内的比例参照相对于固体组合物所述的比例相应地进行计算(并且成比例扩大)。在特别的实施方案中,水性介质是水,优选无菌水。在备选的实施方案中,水性介质包含水和一种或多种另外的药用稀释剂或赋形剂。在特别的实施方案中,油性介质是非水性介质,其选自包括下列各项的组:角鲨烯;天然油,如甘油三酯;矿物油;合成油;植物油,优选鳄梨油;米糠油;霍霍巴油(jojobaoil);巴西棕榈油(babassuoil);红花籽油;大豆油;维生素e;维生素e乙酸酯;非植物油如硅油和石蜡油;以及蜡,包括巴西棕榈蜡、小烛树蜡和卵磷脂。可以使用油的混合物。在备选的实施方案中,提供油性介质连同一种或多种另外的药用稀释剂或赋形剂。在一个特别优选的实施方案中,油性介质是大豆油。就化学稳定性和粒子本身的稳定性(即相对于聚集、凝结等)两方面而言,本发明的分散体有利地在长时间阶段内稳定。可以认为本发明的分散体是本发明的药物组合物。因此,本发明的分散体可以原样施用或者与一种或多种另外的赋形剂进一步配制以提供适用于肠胃外施用的分散体(例如,用于静脉内、皮下、肌内或腹膜内给药的无菌分散体)。本发明的分散体允许从其中选取测量的等分试样以用于在个性化药物方案中准确给药。在分散体中的阿托伐醌纳米粒子的粒度、多分散度和ζ电位是如在上文中相对于固体组合物所限定的。当然将会理解的是,通过将固体组合物分散在水性介质中从而形成本发明的水性分散体来测量在固体组合物中存在的阿托伐醌纳米粒子的粒度、多分散度和ζ电位。用于制备水性分散体或油性分散体的方法可以通过在本领域中公知的方法形成分散体。例如,可以在一种或多种选择的载体材料的水性/油性混合物的存在下碾磨阿托伐醌。然而,在本发明的特别的方面中,提供了一种用于制备水性分散体的方法,所述方法包括将如本文中限定的固体阿托伐醌组合物分散在水性介质中。在特别的实施方案中,水性介质是水。在备选的实施方案中,水性介质包含水和一种或多种另外的赋形剂。然而,在本发明的特别的方面中,提供了一种用于制备油性分散体的方法,所述方法包括将如本文中限定的固体阿托伐醌组合物分散在油性介质中。在特别的实施方案中,油性介质是大豆油。在备选的实施方案中,油性介质包含大豆油和一种或多种另外的赋形剂。将固体组合物分散在水性/油性介质中可以包括将固体组合物加入至水性/油性介质中并且适宜地搅动所得的混合物(例如通过振荡、均化、超声处理、搅拌等)。阿托伐醌的可注射制剂本发明还提供了一种阿托伐醌纳米粒子的可肌内注射制剂。本发明还提供了一种阿托伐醌纳米粒子的可皮下注射制剂。所述制剂可以是固体形式的(或基本上固体形式的,例如糊剂)或液体形式的,其中阿托伐醌以纳米粒子的形式存在。阿托伐醌纳米粒子可以分散在一种或多种载体材料内。当处于液体形式时,每个阿托伐醌纳米粒子可以作为核心提供,在核心周围设置由一种或多种载体材料组成的外层。优选地,所述一种或多种载体材料可以提供亲水聚合物和表面活性剂活性,并且进一步优选地,可以选自由下列各项组成的组:聚乙烯醇-聚乙二醇接枝共聚物;聚乙烯醇;聚乙烯吡咯烷酮k30;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;聚氧乙烯(20)脱水山梨糖醇单油酸酯;脱氧胆酸钠;d-α-生育酚聚乙二醇1000琥珀酸酯;和聚乙二醇(15)-羟基硬脂酸酯。因此,所述一种或多种固体载体材料可以以下面组合中的任何一种或多种提供:-聚乙烯醇-聚乙二醇接枝共聚物和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇-聚乙二醇接枝共聚物和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和聚乙二醇(15)-羟基硬脂酸酯;-聚乙烯醇和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠;-聚乙烯醇和聚乙二醇(15)-羟基硬脂酸酯。更进一步优选地,所述一种或多种载体材料可以选自由下列各项组成的组:聚乙烯醇-聚乙二醇接枝共聚物;聚乙烯醇;聚乙烯吡咯烷酮k30;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;聚氧乙烯(20)脱水山梨糖醇单油酸酯;脱氧胆酸钠;和d-α-生育酚聚乙二醇1000琥珀酸酯。因此,所述一种或多种固体载体材料可以以下面组合中的任何一种或多种提供:-聚乙烯醇-聚乙二醇接枝共聚物和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯吡咯烷酮k30和d-α-生育酚聚乙二醇1000琥珀酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单月桂酸酯;-聚乙烯吡咯烷酮k30和聚氧乙烯(20)脱水山梨糖醇单油酸酯;-聚乙烯醇和脱氧胆酸钠。阿托伐醌纳米粒子的可注射制剂被有利地设计为用于作为储库型注射剂施用,从而克服与对预防和/或治疗的差的坚持性有关的前述问题(尤其是就疟疾而言)以及所产生的后果。此外,储库型注射剂是有益的,因为其可以比常规制剂更容易地施用并且允许更简单的随访护理/持续护理。优选地,阿托伐醌纳米粒子的可注射制剂提供了阿托伐醌的控释大剂量(bolus)制剂,当施用至患者(经由肌内或皮下注射)时,其在从施用日期开始至少约两周的时间段内将阿托伐醌释放至所述患者的血流中。进一步优选地,释放的时间段是从注射施用日期开始至少约三周,更进一步优选至少约一个月,更优选至少约三个月,并且最优选至少约六个月。药物或兽医组合物本发明提供了一种可注射形式的药物或兽医组合物,所述药物或兽医组合物包含如本文中限定的固体组合物以及任选的一种或多种另外的(药用)赋形剂。优选地,所述药物或兽医组合物可以以可肌内注射或可皮下注射形式提供。进一步优选地,所述药物或兽医组合物可以以储库型形式提供。稍早在本说明书中概述了这样的形式的益处。优选地,药物或兽医组合物提供了阿托伐醌的控释大剂量制剂,当以储库型形式施用至患者时,其在从施用日期开始至少约两周的时间段内将阿托伐醌释放至所述患者的血流中。进一步优选地,释放的时间段是从制剂施用日期开始至少约三周,更进一步优选至少约一个月,更优选至少约三个月,并且最优选至少约六个月。在特别的实施方案中,药物或兽医组合物是如本文中所述的分散体。这样的分散制剂可以用于准确地测量较小的剂量,如适用于向儿童或小型动物施用的那些。应该理解的是,可以使用在本领域中公知的常规(药物)赋形剂通过常规工序获得本发明的不同的药物或兽医组合物。本发明的药物或兽医组合物含有治疗有效量的阿托伐醌。本领域技术人员将知晓如何确定并且选择适当的治疗有效量的包含在本发明的药物或兽医组合物中的阿托伐醌。纳米粒子制剂和药物或兽医组合物的用途本发明提供了用作药物的如本文中限定的固体组合物、分散体、可注射制剂、或药物或兽医组合物。所述药物可以作为单一疗法使用或者其可以与任何一种或多种其他药物组合,从而提供阿托伐醌与所述一种或多种其他药物的组合疗法。这样的“其他药物”包括,但不限于:氯胍(proguanil)、甲氟喹(mefloquine)、氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、奎宁(quinine)、奎尼丁(quinidine)、蒿甲醚(artemether)、本芴醇(lumefantrine)、伯氨喹(primaquine)、多西环素(doxycycline)、四环素(tetracycline)、克林霉素(clindamycin)、二氢青蒿素(dihydroartemisinin)、哌喹(piperaquine)和具有或不具有磺胺多辛(sulfadoxine)的乙胺嘧啶(pyrimethamine)。原则上,本文中限定的固体组合物、分散体、可注射制剂、或药物或兽医组合物可以用于治疗和/或预防寄生虫或真菌感染。预期了治疗和/或预防感染如疟原虫属的寄生虫的感染。特别地,所述感染可以是疟疾。还预期了治疗和/或预防其他感染,如弓形虫属的寄生虫的感染(例如弓形虫病)、巴贝虫属的寄生虫的感染(例如巴贝虫病)和肺囊虫属的真菌的感染(例如肺囊虫肺炎)。所述治疗和/或预防可以使用单一疗法实现或者可以是阿托伐醌制剂与任何一种或多种其他药物组合,从而提供阿托伐醌与所述一种或多种其他药物的组合疗法。这样的“其他药物”包括,但不限于:氯胍(proguanil)、甲氟喹(mefloquine)、氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、奎宁(quinine)、奎尼丁(quinidine)、蒿甲醚(artemether)、本芴醇(lumefantrine)、伯氨喹(primaquine)、多西环素(doxycycline)、四环素(tetracycline)、克林霉素(clindamycin)、二氢青蒿素(dihydroartemisinin)、哌喹(piperaquine)和具有或不具有磺胺多辛(sulfadoxine)的乙胺嘧啶(pyrimethamine)。本发明还提供了用于治疗和/或预防疟疾、弓形虫病、巴贝虫病和肺囊虫肺炎的如本文中限定的固体组合物、分散体、可注射制剂、或药物或兽医组合物。所述治疗和/或预防可以使用单一疗法实现或者可以是阿托伐醌制剂与任何一种或多种其他药物组合,从而提供阿托伐醌与所述一种或多种其他药物的组合疗法。这样的“其他药物”包括,但不限于:氯胍(proguanil)、甲氟喹(mefloquine)、氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、奎宁(quinine)、奎尼丁(quinidine)、蒿甲醚(artemether)、本芴醇(lumefantrine)、伯氨喹(primaquine)、多西环素(doxycycline)、四环素(tetracycline)、克林霉素(clindamycin)、二氢青蒿素(dihydroartemisinin)、哌喹(piperaquine)和具有或不具有磺胺多辛(sulfadoxine)的乙胺嘧啶(pyrimethamine)。本发明还提供了如本文中限定的固体组合物、分散体、可注射制剂、或药物或兽医组合物在制备用于治疗和/或预防寄生虫和真菌感染(例如疟原虫属的寄生虫的感染,尤其是疟疾;弓形虫属的寄生虫的感染,尤其是弓形虫病;巴贝虫属的寄生虫的感染,尤其是巴贝虫病;或肺囊虫属的真菌的感染,尤其是肺囊虫肺炎)的药物中的用途。所述用途可以作为单一疗法进行或者可以是阿托伐醌制剂与任何一种或多种其他药物组合,从而提供阿托伐醌与所述一种或多种其他药物的组合疗法。这样的“其他药物”包括,但不限于:氯胍(proguanil)、甲氟喹(mefloquine)、氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、奎宁(quinine)、奎尼丁(quinidine)、蒿甲醚(artemether)、本芴醇(lumefantrine)、伯氨喹(primaquine)、多西环素(doxycycline)、四环素(tetracycline)、克林霉素(clindamycin)、二氢青蒿素(dihydroartemisinin)、哌喹(piperaquine)和具有或不具有磺胺多辛(sulfadoxine)的乙胺嘧啶(pyrimethamine)。本发明还提供了一种治疗和/或预防寄生虫或真菌感染(例如疟原虫属的寄生虫的感染,尤其是疟疾;弓形虫属的寄生虫的感染,尤其是弓形虫病;巴贝虫属的寄生虫的感染,尤其是巴贝虫病;或肺囊虫属的真菌的感染,尤其是肺囊虫肺炎)的方法,所述方法包括向患有所述感染(例如疟原虫属的寄生虫的感染,尤其是疟疾;弓形虫属的寄生虫的感染,尤其是弓形虫病;巴贝虫属的寄生虫的感染,尤其是巴贝虫病;或肺囊虫属的真菌的感染,尤其是肺囊虫肺炎)或处于患有所述感染的风险下的患者施用治疗有效量的如本文中限定的固体组合物、分散体、可注射制剂、或药物或兽医组合物。所述治疗和/或预防可以使用单一疗法实现或者可以是阿托伐醌制剂与任何一种或多种其他药物组合,从而提供阿托伐醌与所述一种或多种其他药物的组合疗法。这样的“其他药物”包括,但不限于:氯胍(proguanil)、甲氟喹(mefloquine)、氯喹(chloroquine)、羟氯喹(hydroxychloroquine)、奎宁(quinine)、奎尼丁(quinidine)、蒿甲醚(artemether)、本芴醇(lumefantrine)、伯氨喹(primaquine)、多西环素(doxycycline)、四环素(tetracycline)、克林霉素(clindamycin)、二氢青蒿素(dihydroartemisinin)、哌喹(piperaquine)和具有或不具有磺胺多辛(sulfadoxine)的乙胺嘧啶(pyrimethamine)。特别地,本发明可以用于提供一种通过经由肌内注射以约200mg/kg的剂量施用阿托伐醌来预防疟疾的方法。优选地,这样的方法将在施用之后提供至少28天的预防效果。备选地,剂量可以是约100mg/kg并且提供至少21天的预防。备选地,剂量可以是约50mg/kg并且提供至少7天的预防。进一步备选地,剂量可以是约35mg/kg并且提供至少7天的预防。在上述用途中的任何一种或全部中,阿托伐醌纳米粒子的施用形式优选提供阿托伐醌的控释大剂量制剂,当施用至患者时,其在从施用日期开始至少约两周的时间段内将阿托伐醌释放至所述患者的血流中。进一步优选地,释放的时间段是从注射施用日期开始至少约三周,更进一步优选至少约一个月,更优选至少约三个月,并且最优选至少约六个月。施用途径无论是作为单一疗法还是作为组合疗法(如在上文中讨论的),本发明的固体组合物、分散体和药物或兽医组合物可以通过任何方便的施用途径施用至患者。可以在限定的治疗和/或预防性方案中组合使用多于一种施用途径,尤其对于组合疗法来说,其中组合中的一种组分可以经由一种途径施用,而组合中的另一种组分可以经由不同的途径施用。在此设想了所有这样的组合。施用途径包括但不限于:口服(例如通过摄入);颊部;舌下;经皮(包括例如通过贴剂、膏药等);经粘膜(包括例如通过贴剂、膏药等);鼻内(例如,通过鼻腔喷雾);眼部(例如,通过滴眼液);肺部(例如,通过使用例如气溶胶经由例如嘴或鼻的吸入或吹入疗法);直肠(例如,通过栓剂或灌肠剂);阴道(例如,通过阴道栓);肠胃外,例如通过注射,包括皮下、皮内、肌内、静脉内、动脉内、心内、鞘内、脊柱内、囊内、囊下、眶内、腹膜内、气管内、表皮下、关节内、蛛网膜下和胸骨内;或者通过植入储库或储器,例如皮下或肌内。最优选地,施用途径是通过肠胃外植入储库型或储器型制剂。优选地,本发明的可注射制剂是储库型制剂,其被施用从而在至少数周优选数月的时间段内在患者中提供阿托伐醌的控释制剂。附图现在将参考附图仅通过非限制性实例的方式更具体地描述本发明,其中:图1是使用在实施例1中描述的筛选“中选(hit)”得到的阿托伐醌纳米粒子的z-平均粒度的图表;图2是如在实施例1中描述的将全标度(标准)制剂与半标度制剂比较的阿托伐醌纳米粒子的z-平均粒度的图表;图3a-3k是如在实施例2中描述的与未配制的阿托伐醌相比的在6小时的时间段内从根据本发明的多种组合物中释放的阿托伐醌的百分比的个别曲线;图4是如在实施例2中描述的与未配制的阿托伐醌相比的在图3a-3k中个别地绘制的组合物中的每一种在24小时释放的阿托伐醌的百分比的图表;图5a-5c是如在实施例4中描述的与未配制的阿托伐醌相比的在6小时的时间段内从根据本发明的多种组合物中释放的阿托伐醌的百分比的个别曲线;图6是如在实施例4中描述的与未配制的阿托伐醌相比的在图5a-5c中个别地绘制的组合物中的每一种在24小时释放的阿托伐醌的百分比的图表;图7是如在实施例5中描述的与未配制的阿托伐醌相比的在6小时的时间段内从根据本发明的多种油性分散体中释放的阿托伐醌的百分比的图表;图8a和8b分别是如在实施例6中描述的针对acs_atq_7和acs_atq_8的多种给药方案和剂量攻击间隔的用于确定阿托伐醌的纳米制剂用于在小鼠中在42天的时间段内提供抗疟疾预防的功效的实验的结果的图表;图9a和9b分别是如在实施例7中描述的示出在通过向小鼠肌内注射200mg/kg纳米制剂而进行施用之后acs_atq_7和acs_atq_8的血浆浓度随时间变化的药物动力学曲线;和图10是示出阿托伐醌的血浆浓度与所提供的保护功效之间的相关性的曲线。实施例除非另外规定,所有材料均购自sigma-aldrich或fisherscientific并且在不进行进一步纯化的情况下使用。实施例1-阿托伐醌纳米制剂的筛选使用阿托伐醌(a)在氯仿中的80mg/ml储备溶液、聚合物(p)的22.5mg/ml储备溶液和表面活性剂(s)的22.5mg/ml储备溶液(这两种储备溶液均在水中)来制备样品。按以下比例加入储备溶液:100μl(a);63μl(p)和32μl(s)(因此在1:4的油与水(o/w)混合物中固体质量比是:80%(a);13%(p)和7%(s))。之后使用covariss2x,以20的工作循环(dutycycle)、10的强度和500循环/脉冲(burst)在频率扫描模式下,将混合物乳化30秒。在乳化后立即将样品低温冷冻。制备42个样品的矩阵。在已经制备全部42个样品之后,将它们冻干(virtisbenchtopk)42小时以得到干燥多孔产物;之后将样品密封在单独的小瓶中,直到进行分析。在该筛选中采用的聚合物和表面活性剂在下表1a和表1b中详述:表1a-最初筛选的7种亲水聚合物的清单表1b-最初筛选的6种表面活性剂的清单*ndc是脱氧胆酸钠。**vit-e-peg-琥珀酸酯,也称为维生素e-tpgs,是d-α-生育酚聚乙二醇1000琥珀酸酯。***solutoltm,也称为kolliphortmhs15,是聚乙二醇(15)-羟基硬脂酸酯。测试了一种聚合物和一种表面活性剂的所有组合(总计42种组合)。筛选分析在即将进行分析之前,通过加入16ml的水来分散样品。之后使用malvernzetasizernanozs通过动态光散射(dls)测量活性有机纳米颗粒分散体的粒度。使用自动测量优化进行三次测量,使用malvernzetasizer软件版本7.11进行数据分析。如果满足以下标准,则认为粒子中选。纳米分散质量评价标准如果粒子符合以下标准,则确定其中选:(i)样品完全分散,不具有可见的大粒子;(ii)粒子z-平均值<1000nm;(iii)多分散指数(pdi)<0.4;(iv)三次扫描之间的标准差与平均的z-平均值相差<5%;并且(v)三次dls扫描中的至少两个通过“尺寸质量报告”。“尺寸质量报告”基于所记录的数据的可靠性涵盖了十二个测试并且通过malvernzetasizer软件自动应用于每个测量。这些测试确保样品在适用于dls的尺寸范围内,具有低于1的pdi,在正确浓度范围内,并且确保累积量和分布拟合良好(即数据误差小于0.005)。在第一次筛选中有十一个中选者通过选择标准,它们在重复筛选时也通过了第二次筛选。选择这十一个用于进一步研究。用通过dls和ζ电位分析表征而制备的样品平行地重制这十一个中选者以显示再现性(图1;误差条为±1s.d.),同时针对待进行的生物测定制备另外的样品。为了进行药理学评估,将要制备结合氚标记的阿托伐醌的十一个制剂中选者。然而,为了将适量的放射性结合至制剂中,以半标度制备制剂。未标记的半标度制剂与未标记的全标度制剂的初始比较显示,半标度制剂产生与全标度制剂相似的尺寸的粒子,如在图2中所示(误差条为±1s.d.)。随后,按照与半标度制剂相同的工序制备放射性标记的粒子,但是其在阿托伐醌储备溶液中包含3h阿托伐醌。对于药物来说,以7.4kbq/mg(0.2μci/mg)制备样品。在下表2中所示,制备的样品通过dls表征并且测量ζ电位。表2dz=z-平均直径;pdi=多分散指数;ζ-p=ζ电位。实施例2-从固体组合物中的阿托伐醌释放的评估使用快速平衡透析(rapidequilibriumdialysis,red)(thermofisherscientific)评估阿托伐醌从根据本发明的其固体组合物连同等同的未配制的阿托伐醌制剂中的释放速率。将十一个“中选”制剂分散在模拟间质液(simulatedinterstitialfluid,sif)中并且随后稀释为1mg/ml的阿托伐醌。sif由来自牛血液的35mg/ml牛血清白蛋白(bsa)和2mg/mlγ-球蛋白组成并且溶解在蒸馏水中。未配制的阿托伐醌首先溶解在dmso中,之后用sif稀释,以使得dmso体积为总体积的<1%。在制备以上悬浮液之后,将每个的0.5ml加入至8kdamwcored插入物的供体隔室中,并且将1mlsif加入至受体隔室中。随后将含有red插入物的平板在37℃、100rpm下温育24小时,之后取样0.5ml的受体内含物并且在0.5、1、2、3、4、5、6和24小时的时间点用新鲜预热(至37℃)的sif替换。在温育之后,将4ml的ultimagold液体闪烁混合液(meridianbiotechnologies,英国)加入至每个0.1ml的样品中并且使用perkinelmer3100ts闪烁计数器将放射性确定为衰变/分钟(dpm)。如在图3a-3k(误差条为±1s.d.)和图4(24小时之后的释放)(误差条为±1s.d.)中所示,对于与未配制的阿托伐醌相比的十一个中选制剂中的每一个,将数据表示为释放并跨膜扩散的阿托伐醌的量作为起始供体量的百分比(一式三份地)。阿托伐醌在最初6小时的时间段内的释放速率(在图3a-3k中示出)在下表3中提供。表3制剂释放速率(h-1)未配制的阿托伐醌0.006acs_atq_10.0112acs_atq_20.0324acs_atq_30.017acs_atq_40.069acs_atq_50.0014acs_atq_60.0013acs_atq_70.0031acs_atq_80.0151acs_atq_90.0095acs_atq_100.0016acs_atq_110.0038实施例3-在鼠疟疾模型中的阿托伐醌纳米制剂的测试在伯氏疟原虫(plasmodiumberghei)的小鼠模型中研究在实施例2中确定的多种阿托伐醌制剂。使用由感染伯氏疟原虫(anka2.34)品系的c57bl6雄性小鼠(6周龄,~20g)组成的鼠疟疾模型。寄生虫的子孢子形式从感染的斯氏按蚊(anophelesstephensi)的唾液腺中获得。实验策略是测试在第0天时的静脉内子孢子攻击之前一天(第-1天预防)或七天(第-7天预防)肌内给药的阿托伐醌纳米制剂的保护小鼠的能力。在剪尾血液样品中的寄生虫导致药物失效。在攻击之后对动物监测至多42天。所有纳米制剂含有80重量%的阿托伐醌。赋形剂和一级释放速率系数在下表4中列出。将meprontm(可从gsk获得并且含有150mg/ml阿托伐醌)作为未配制的比较物口服给药并且使用10%泊洛沙姆188(pluronictmf-68)作为口服赋形剂对照。表4药物给药对于每20g动物,在40μl的总体积中以36mg/kg将纳米制剂给药。所述剂量以每次20μl的两次注射肌内施用。通过将冻干的纳米制剂在纯净无菌水中重悬以得到所需浓度,制备所述剂量。将口服阿托伐醌对照(meprontm)在10%泊洛沙姆188(pluronictmf-68)中稀释并且通过填喂以200μl体积施用36mg/kg。在给药之前大约16h将所有动物禁食并且在给药后4-6h恢复。子孢子攻击在感染伯氏疟原虫(anka2.34品系)的swisswebster小鼠上喂食已经饥饿6小时的4-6天龄的斯氏按蚊。将喂食的蚊子保持在19℃和80%相对湿度下。在感染后18天,将蚊子唾液腺解剖至rpmi培养基中并且通过穿过281/2g针数次而进行均化,以释放子孢子。通过血细胞计数器和光学显微镜对子孢子进行计数,并且将其稀释至25,000/mlrpmi。在攻击时,静脉内提供在200μlrpmi中的5,000个子孢子。将小鼠分配在三个群体中。这种方法一致地在感染后第3天产生可检测的血液阶段寄生虫血症(parasitemia),并且感染动物在感染后7天内死于疟疾。药效学终点通过借助光学显微镜检验的剪尾血液样品的giemsa染色的薄涂片监测感染动物的明显的血液阶段寄生虫血症。取样在攻击后72h开始并且每48-72h重复一次。在攻击后42天不具有可检测的血液阶段寄生虫血症的小鼠被认为是受保护的。结果与口服阿托伐醌对照一样,针对第-1天预防所测试的全部三种纳米制剂都是保护性的。然而,当在攻击之前7天给药(第-7天预防)时,口服阿托伐醌对照是无效的。在这种方案中,样品acs_atq_4和acs_atq_6也是无效的。然而,样品acs_atq_2显示出部分功效,保护了6只动物中的4只,并且样品acs_atq_7和acs_atq_8得到在第-7天预防情况下的完全并且一致的保护。这些结果在下表5中提供。表5*在表5中的数据针对36mg/kg的剂量,然而使用3mg/kg的剂量的初始实验显示,样品acs_atq_2、acs_atq_4和acs_atq_6在第-1天都是保护性的;考虑到它们在第-1天的功效,对于在第-1天针对攻击的36mg/kg的样品acs_atq_4和acs_atq_6不进行重新测试,以保存测试材料。实施例4-从具有不同阿托伐醌加载量的固体组合物中的阿托伐醌释放的评估使用快速平衡透析(rapidequilibriumdialysis,red)(thermofisherscientific)评估阿托伐醌从具有不同阿托伐醌加载量的根据本发明的其固体组合物连同等同的未配制的阿托伐醌制剂中的释放速率。样品acs_atq_4、acs_atq_6和acs_atq_8—已经用80重量%的阿托伐醌配制—各自具有20重量%、40重量%和60重量%的阿托伐醌加载量。使用阿托伐醌(a)在氯仿中的5mg/ml储备溶液、聚合物(p)的22.5mg/ml储备溶液和表面活性剂(s)的22.5mg/ml储备溶液(这两种储备溶液均在水中)来制备样品。按以下比例加入储备溶液:100μl(a);63μl(p)和32μl(s)(因此在1:4的油与水(o/w)混合物中固体质量比是:20%(a)、52%(p)和28%(s))。之后使用covariss2x,以20的工作循环(dutycycle)、10的强度和500循环/脉冲(burst)在频率扫描模式下,将混合物乳化30秒。在乳化之后立即将样品低温冷冻,并且之后冻干(virtisbenchtopk)42小时,以得到干燥多孔产物。之后将样品密封在单独的小瓶中,直到通过dls进行分析。通过调节阿托伐醌储备溶液的浓度并且之后按照以上给出的相同工序来改变阿托伐醌加载量(对于40重量%和60重量%的样品)。在下表6中所示,制备的样品通过dls表征。表6dz=z-平均直径;pdi=多分散指数。随后,按照与以上相同的工序制备放射性标记的粒子,但是其在阿托伐醌储备溶液中包含3h阿托伐醌。对于药物来说,以7.4kbq/mg(0.2μci/mg)制备样品。将九个(3x3)另外的放射性标记制剂分散在sif中并且随后稀释为1mg/ml的阿托伐醌。sif由来自牛血液的35mg/mlbsa和2mg/mlγ-球蛋白组成并且溶解在蒸馏水中。未配制的阿托伐醌首先溶解在dmso中,之后用sif稀释,以使得dmso体积为总体积的<1%。在制备以上悬浮液之后,将每个的0.5ml加入至8kdamwcored插入物的供体隔室中,并且将1mlsif加入至受体隔室中。随后将含有red插入物的平板在37℃、100rpm下温育24小时,之后取样0.5ml的受体内含物并且在0.5、1、2、3、4、5、6和24小时的时间点用新鲜预热(至37℃)的sif替换。在温育之后,将4ml的ultimagold液体闪烁混合液(meridianbiotechnologies,英国)加入至每个0.1ml的样品中并且使用perkinelmer3100ts闪烁计数器将放射性确定为衰变/分钟(dpm)。如在图5a-5c和图6(24小时之后的释放)(误差条为±1s.d.)中所示,对于与未配制的阿托伐醌相比的九个新的制剂连同三个现有的80重量%制剂中的每一个,将数据表示为释放并跨膜扩散的阿托伐醌的量作为起始供体量的百分比(一式三份地)。阿托伐醌在最初6小时的时间段内的释放速率(在图5a-5c中示出)在下表7中提供。表7制剂释放速率(h-1)未配制的阿托伐醌0.0060atq_4_20%0.0088atq_4_40%0.0073atq_4_60%0.0020atq_4_80%0.0690atq_6_20%0.0063atq_6_40%0.0031atq_6_60%0.0030atq_6_80%0.0013atq_8_20%0.0348atq_8_40%0.0195atq_8_60%0.0153atq_8_80%0.0151显然,存在在所研究的24小时的时间段内释放的阿托伐醌的百分比的变化(如在图6中所示),以及从所测试的制剂中的每一种的释放速率的变化(如在表7中所示);在选择适当的阿托伐醌加载量和赋形剂的组合的情况下,可以根据具体的临床需求设计释放方案。实施例5-用于释放研究的阿托伐醌(油性分散体)的糊状纳米制剂的制备按照与在以上实施例1中描述的相同的筛选工序制备包含阿托伐醌纳米粒子的固体组合物,不同之处在于使用60重量%的阿托伐醌(a)、30重量%的聚合物(p)和10重量%的表面活性剂(s)。按照在实施例1中列出的标准来评估中选者,并且该筛选在该加载量下确定了另外十一个中选者以用于进一步研究。选择三个制剂(从十一个制剂中)以作为潜在的长效控释储库型可注射糊剂进行研究。通过将冷冻干燥的配制的整料(monolith)与大豆油共混来制备糊剂。如在本说明书中稍早指出的,大豆油与固体成分的比率决定油性分散体是液体还是糊剂(在较大的固体与油的比例的情况下)。使用red和uv-可见光光谱进行阿托伐醌从这些糊剂向水中的释放。还将未配制的阿托伐醌与大豆油共混为糊剂作为对照。释放研究显示出在制剂内不同的聚合物和表面活性剂的存在影响阿托伐醌向水中的释放速率曲线(如在图中所示7)。实施例6-在鼠疟疾模型中的阿托伐醌纳米制剂的扩展测试对于acs_atq_7和acs_atq_8,在持续时间和范围方面扩展在实施例2中进行的测试。实验策略是测试在第0天时的静脉内子孢子攻击之前一天(第-1天预防)、七天(第-7天预防)、14天(第-14天预防)、21天(第-21天预防)或28天(第-28天预防)肌内给药的阿托伐醌纳米制剂的保护小鼠的能力。在剪尾血液样品中的寄生虫导致药物失效。在攻击之后对动物监测至多42天。所有纳米制剂含有80重量%的阿托伐醌。acs_atq_7和acs_atq_8的赋形剂和一级释放速率系数可以在表4中找到。药物给药以与实施例3相同的方式将纳米制剂给药,但是除了之前测试的36mg/kg的浓度以外还使用50、100和200mg/kg的浓度。子孢子攻击与实施例3一样。药效学终点与实施例3一样,结果是二元的,如果在攻击后42天所有小鼠均保持无寄生虫,则认为小鼠是受保护的并且预防是成功的。相反,如果在给药群体中的任何小鼠中检测到明显的寄生虫血症,则认为预防失败。结果对于acs_atq_7和acs_atq_8,再次发现在36mg/kg下第-1天预防是成功的。在该早期时间点未测试较高的给药方案,因为推断它们将会是有效的。发现针对acs_atq_7和acs_atq_8二者测试的全部给药方案都提供有效的第-7天预防。对于acs_atq_7和acs_atq_8二者,仅通过100或200mg/kg的给药方案有效地提供第-14天和第-21天预防。发现仅acs_atq_7或acs_atq_8的200mg/kg的最高剂量提供有效的第-28天预防。这些结果总结在表8中,并且acs_atq_7和acs_atq_8分别总结在图8a和8b中。图8a和8b描绘了成功的给药方案和剂量攻击间隔(即每个圆表示在相应的剂量攻击间隔提供成功的预防的给药方案)。表8对于acs_atq_7和acs_atq_8的发现与在第-7天预防失败的以200mg/kg施用的口服阿托伐醌以及纳米制剂赋形剂(即聚合物加表面活性剂)的肌内注射的结果形成对比。结果还显示,对于acs_atq_7和acs_atq_8二者,预防的持续时间是剂量依赖性的,较高的剂量提供较长的预防。实施例7-阿托伐醌纳米制剂的肌内注射的鼠药物动力学用200mg/kg的阿托伐醌纳米制剂对小鼠进行肌内注射。每隔一段时间收获血液(microtainer管,bdbiosciences),离心(1300xg,10分钟,4℃),并且收集血浆并且储存在-80℃直到使用。所测试的纳米制剂是acs_atq_7和acs_atq_8。通过uplc-ms/ms测定在血浆中的阿托伐醌的浓度。简而言之,将乙腈和含氘阿托伐醌内标加入至25μl的解冻血浆中,接着进行过滤(captiva过滤板,agilenttechnologies)。在反相柱上分离5μl等分试样并且利用电喷雾电离通过三重四极杆api4000(sciex,framingham,ma,usa)质量分析仪监测阿托伐醌。对于250-50,000ng/ml,根据fda准则对测定进行检验。保守地解释在250和77ng/ml(检测限)之间的值。结果在acs_atq_7的肌内注射之后6h容易地检测到在小鼠血浆中的阿托伐醌浓度,并且发现半衰期为7天,大大长于对于在小鼠中口服给药的阿托伐醌已知的9小时半衰期。发现acs_atq_8的肌内注射的半衰期为10.6天。acs_atq_7和acs_atq_8的这些实验的结果分别描绘于图9a和9b中的图表中。根据实施例3、6和7的发现,并且将血浆浓度与实施例所示出的功效比较,能够看出>200ng/ml的阿托伐醌的血浆浓度与成功的预防相关(图10)。结论是,鼠疟疾模型证实,阿托伐醌的纳米制剂在纳米制剂的肌内注射之后提供至多28天的有效疟疾预防。因为阿托伐醌在人体中的分布比在小鼠中的分布慢大约八倍(血浆半衰期分别为70小时和9小时),所以能够预期在人体中通过类似施用的阿托伐醌纳米制剂得到的有效预防的持续时间超过在鼠模型中观察到的28天。阿托伐醌长效纳米制剂因此将安全的、广泛研究的、临床使用的药物与在其他fda批准的药物中使用的赋形剂组合。以上给出的发现表明,单一肌内剂量的纳米配制的阿托伐醌将在长时间段内提供针对恶性疟原虫疟疾的病因性预防。这对其旅行通常持续4周以下的到疟疾区域旅行的非免疫人群来说是有吸引力的选择,并且如果仔细开发,其还可以在疟疾控制工作中提供迫切需要的新的干预。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1