包含多糖-蛋白缀合物的多价肺炎球菌疫苗组合物的制作方法
本发明申请主张2016年9月30日提交的印度临时专利申请号201641033563的优先权,并且以其整体通过引用结合于此。
本公开涉及包含缀合至一种或多种载体蛋白的一种或多种肺炎链球菌(streptococcuspneumoniae)血清型的荚膜肺炎球菌多糖的多价肺炎球菌疫苗组合物。当缀合时,在本文中将荚膜肺炎球菌多糖和载体蛋白称为多糖-蛋白缀合物。
背景技术:
肺炎链球菌(streptococcuspneumoniae)(“肺炎球菌(pneumococcus)”)是导致侵袭性疾病如肺炎、菌血症和脑膜炎以及与定殖有关的疾病,如急性中耳炎(例如,中耳的定殖)的革兰氏阳性细菌。这些肺炎球菌引起的疾病导致了发病和死亡,特别是在小于24个月和大于60岁的人中。在美国,对于大于60岁的人,肺炎球菌肺炎的比例估计为3至8人/100,000人。在20%的病例中,肺炎球菌肺炎导致菌血症和脑膜炎,即使使用抗生素治疗,总计死亡率接近30%。
已评价了蛋白如肺炎球菌溶血素和肺炎球菌表面蛋白a(pspa)在肺炎球菌疫苗中作为载体蛋白候选物的适合性。尽管两者在小鼠中均为部分保护性的(paton等人,"effectofimmunizationwithpneumolysinonsurvivaltimeofmicechallengedwithstreptococcuspneumoniae."infectimmun.1983may;40(2):548-552和mcdaniel等人,"pspa,asurfaceproteinofstreptococcuspneumoniae,iscapableofelicitingprotectionagainstpneumococciofmorethanonecapsulartype."infectimmun.1991jan;59(1):222-228),但是对于它们作为免疫原在疫苗中的应用仍存在缺陷。肺炎球菌溶血素,尽管在肺炎球菌中非常保守,但是处于其天然状态时具有毒性(alonsodeveiasco等人,"streptococcuspneumoniae:virulencefactors,pathogenesis,andvaccines."microbiolrev.1995dec;59(4):591-603)。另一方面,pspa在血清学和结构上是异源的(crain等人,"pneumococcalsurfaceproteina)isserologicallyhighlyvariableandisexpressedbyallclinicallyimportantcapsularserotypesofstreptococcuspneumoniae."infectimmun.1990oct;58(10):3293-3299)。它在疫苗制剂中的使用将需要多种pspa类型,因此提高了疫苗制备的复杂性。
肺炎球菌表面粘附蛋白a(“psaa”)是多功能脂蛋白并且参与宿主细胞的粘附和定殖。它是高度保守的表面蛋白并且跨整个已知的肺炎链球菌(s.pneumoniae)血清型具有97%的同源性。psaa是免疫原性的并且已知在肺炎球菌的天然鼻咽定殖期间,抗psaa抗体是增加的。
可以施用肺炎球菌疫苗以防止感染。当前的疫苗包括多价肺炎球菌多糖疫苗(包含来自两种或更多种血清型的肺炎球菌多糖)和肺炎球菌缀合物疫苗。已知肺炎球菌多糖疫苗的保护效力与对荚膜多糖所产生的抗体浓度有关。用多糖包封肺炎球菌细胞,从而产生了超过90种不同的肺炎球菌血清型。荚膜是肺炎球菌的主要毒力决定因子——它不仅保护细胞的内表面抵抗补体介导的细胞溶解,而且它的免疫原性也较差。
默克(merck)的
尽管有了这些疫苗,仍需要包含可替代的多糖血清型和载体蛋白的其他多价肺炎球菌疫苗,以及它们的简单而有效的生产。
已经在其他参考文献中描述了肺炎球菌疫苗。例如,美国专利号5,360,897公开了包含具有至少两个羰基的细菌性病原体肺炎链球菌(s.pneumoniae)的完整荚膜聚合物的还原胺化产物以及细菌毒素或类毒素的免疫原性缀合物,所述缀合物包含交联的缀合物,其中荚膜聚合物和毒素或类毒素之间存在直接的共价连接。
美国专利号5,693,326提供了制备缀合物疫苗的一般性方法,其中对于激活的病毒、真菌或细菌多糖,使用选自1-氰基-4-(二甲基氨)-四氟硼酸吡啶、n-氰基三乙基-四氟硼酸铵和p-硝基苯基氰酸酯的有机氰基化剂以形成激活的碳水化合物并随后与蛋白或载体蛋白偶联。
美国专利号5,854,416公开了被称为psaa(肺炎球菌表面粘附蛋白a)的来自肺炎链球菌(s.pneumonia)的37-kda蛋白的氨基酸和dna序列,并且美国专利号7,862,823公开了包含肺炎球菌荚膜多糖与至少两种不同载体蛋白如dt的和tt的多价缀合物疫苗组合物。
美国专利号7,955,605描述了制备由19a组成的免疫原性缀合物的方法,其中激活的血清型19a多糖和载体蛋白在二甲基亚砜(dmso)中重悬浮以形成缀合物。
美国专利号8,192,746公开了具有缀合至crm197的来自血清型1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的荚膜多糖的15价肺炎球菌多糖-蛋白缀合物疫苗组合物
美国专利号8,465,749提供了通过在指定ph范围,使多糖与cdap反应并且使蛋白与肼(hydrazine)或己二酸二酰肼反应来制备缀合物疫苗的方法。
美国专利号8,557,250b2公开了包括将多种氰酸酯激活的免疫原性独特的多糖混合物与至少一种酰肼(hydrazide)激活的蛋白接触的方法。
美国专利号8,808,708、7,955,605和美国专利号8,603,484描述了由多糖-蛋白缀合物和载体蛋白crm197组成的13价免疫原性组合物,其中血清型包括1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f和23f。
美国专利公开号2009/0017059a1公开了其中血清型19a和19f缀合至不同细菌类毒素的免疫原性组合物,细菌类毒素包括破伤风类毒素、白喉类毒素、百日咳类毒素、细菌细胞溶素和/或肺炎球菌溶血素。
美国专利公开号2010/0074922a1公开了含有10种或更多种血清型的免疫原性组合物,其中19f荚膜糖缀合至dt,血清型18c荚膜糖缀合至破伤风类毒素并且血清型1、4、5、6b、7f、9v、14和23f荚膜糖缀合至分离自流感嗜血杆菌(haemophilusinfluenzae)的蛋白d。
美国专利公开号2010/0239604描述了包含来自血清型19a和19f的多价肺炎链球菌(s.pneumoniae)荚膜糖缀合物的免疫原性组合物,其中血清型19a缀合至第一细菌类毒素,而19f缀合至第二细菌类毒素而2至9种肺炎链球菌(s.pneumoniae)荚膜糖缀合至蛋白d。
美国专利公开号2012/321658a1公开了免疫原性组合物,其中血清型1、3、19a和19f通过化学性质而不是还原胺化直接或间接连接至一种或多种蛋白载体,并且一种或多种不同的糖选自由血清型4、5、6a、6b、7f、9v、14、18c和23f组成的第二组,这些血清型通过还原胺化连接至一种或多种蛋白载体。
in140/del/2011提供了包含(a)7种或更多种、(b)10种或更多种多糖的肺炎链球菌(s.pneumonia)疫苗,这些多糖来自缀合至选自包含dt、白喉类毒素、crm197和破伤风类毒素的组的至少2种或更多种载体蛋白的不同血清型。
wo专利公开号2013/191459a1公开了包含缀合至crm197的来源于荚膜多糖1、2、3、4、5、6a、6b、7f、9n、9v、14、18c、19a、19f和23f的不同肺炎链球菌(s.pneumoniae)血清型的缀合的15价组合物。
wo专利公开号2014/092377a1公开了13价组合物,其中12种血清型选自1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f和23f,而且最后一种血清型为缀合至crm197的12或9n。
wo专利公开号2014/092378a1描述了免疫原性缀合物组合物,其中12种血清型选自1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f和23f,而剩余的一个来自缀合至crm197的22f或者33f。
wo2016207905a2公开了多价肺炎球菌缀合物疫苗(pcv)组合物,其包含:1)用cdap激活并缀合至载体蛋白crm197的选自肺炎链球菌(s.pneumoniae)血清型1、3、4、5、6b、7f、9n、9v、15b、14、18c、19a、19f、22f、23f和33f的至少12种荚膜多糖,和2)药学上可接受的载体,其中该组合物不含来自血清型6a的荚膜多糖。
中国专利申请公开号cn101590224描述了含有缀合至crm197的血清型1、2、4、5、6a、6b、7f、9n、9v、14、18c、19a、19f和23f的14价肺炎球菌多糖-蛋白缀合物疫苗。
中国专利申请公开号cn103623401公开了14多价肺炎球菌荚膜多糖-蛋白缀合物组合物,其中所述14种不同的血清型为缀合至crm197的1、3、4、5、6a、6b、9v、14、18c、19a、19f、22f、23f和33f。
中国专利申请公开号cn103656632公开了含有缀合至crm197的血清型6a和选自由1、2、3、4、5、6b、7f、8、9n、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f组成的组的至少一种其他血清型的多价肺炎球菌荚膜多糖组合物。
中国专利申请公开号cn103656631提供了多价肺炎球菌荚膜多糖-蛋白缀合物组合物及其制备方法。从24种不同血清型的肺炎球菌荚膜多糖和载体蛋白以共价连接方式制备所述缀合物组合物,其中所述24种不同的血清型为缀合至crm197的1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f。
中国专利申请公开号cn104069488公开了14种不同血清型的多价肺炎球菌荚膜多糖和载体蛋白,其中所述14种血清型包括缀合至crm197的1、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f。
deborah等人(1996,21卷,1期,17-22页)描述了与菌毛粘附蛋白具有显著同源性的psaa。使用完全弗氏佐剂或titermaxtm佐剂、用psaa对cba/cahnjxid小鼠的免疫显著保护小鼠抵抗用高达45倍ld50的剂量的3型肺炎球菌株wu2的异源静脉内激发。
miyajien等人(2001,vaccine;20(5-6):805-12)公开了作为最重要的人病原体之一的肺炎链球菌(s.pneumoniae)。构建了含有全长psaa或截短pspa基因的dna疫苗载体。两种构建体均显示了抗原在脊椎动物细胞中的瞬时表达并且在肌内注射的balb/c小鼠中引起了对肺炎球菌抗原的显著抗体应答。
wuorimaa等人(2001,thepaediatricinfectiousdiseasejournal,20(3)卷,272-277页)公开了在健康幼儿(toddler)中评价使用tt和dt两者作为载体的11价肺炎球菌缀合物疫苗的耐受性和免疫原性的研究。
gatchalian等人(2001,17thannualmeetingoftheeur.soc.paed.inf.dis(espid),posternumber4,p1apostersession1,istanbulturkey)公开了获得自已经接受11价疫苗剂量的婴儿的调理吞噬测定(opa)结果,这些婴儿对于血清型3不能显示与其他测试血清型相当水平的抗体反应。
andersonp等人(2003,vaccine;21(13-14):1554-9)公开了四价缀合物疫苗与单独偶联至破伤风类毒素或白喉crm197的每种多糖类型6a、14、19f和23f或者单独偶联至破伤风类毒素和白喉crm197的多糖类型6a、14、19f和23f的半剂量的混合物的比较研究。
nurkka等人(2004,ped.inf.dis.j.,23:1008-1014)公开了11价肺炎球菌蛋白d缀合物疫苗的免疫原性和安全性研究,其中对于血清型3,在接受三次疫苗剂量然后接受相同疫苗或肺炎球菌多糖疫苗的加强剂量的婴儿中未观察到致敏效果。
除了组合物、方法等以外,上述参考文献公开了包含来自一种或多种血清型的多糖的多价肺炎球菌疫苗以及这些多糖与载体蛋白如crm197、蛋白d、dt和tt的缀合。考虑到在多个地区占优势的不同血清型,仍需要具有改善的免疫应答的包含多糖血清型的新的缀合物的其他多价肺炎球菌疫苗以及它们的简单并有效的生产。
技术实现要素:
在一些实施方式中,本公开提供了肺炎球菌疫苗组合物,该组合物包含两种或更多种分别单独缀合至作为载体蛋白的肺炎球菌表面粘附蛋白a(psaa)或者psaa和crm197的组合的荚膜肺炎球菌多糖血清型。
在一个实施方式中,本公开提供了作为10价、14价、15价、17价、18价、19价、20价、22价、23价、24价或25价肺炎球菌疫苗组合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,该肺炎球菌多糖是选自肺炎球菌血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45的每一种血清型。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,该肺炎球菌多糖来自选自与作为载体蛋白的肺炎球菌表面粘附蛋白a(psaa)缀合的肺炎球菌血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45的每一种血清型。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,该肺炎球菌多糖来自选自与作为载体蛋白的肺炎球菌表面粘附蛋白a(psaa)或者psaa和crm197的组合缀合的血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45的血清型。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,该肺炎球菌多糖来自选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45的血清型,其中至少3种肺炎球菌多糖与肺炎球菌表面粘附蛋白a(psaa)缀合。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,该肺炎球菌多糖来自与肺炎球菌表面粘附蛋白a(psaa)缀合的血清型3、6a、6b。
在另一个实施方式中,本公开提供了包含至少10种肺炎球菌多糖的肺炎球菌疫苗组合物,该肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且载体蛋白包括psaa,或者psaa和crm197的组合。
在另一个实施方式中,本公开提供了包含至少14种肺炎球菌多糖缀合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少17种肺炎球菌多糖缀合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少19种肺炎球菌多糖缀合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少20种肺炎球菌多糖缀合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少22种肺炎球菌多糖缀合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少24种肺炎球菌多糖缀合物的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含两种或更多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中血清型选自3、5、6a、6b、9v和18c并且载体蛋白是psaa。
在另一个实施方式中,本公开提供了包含两种或更多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中血清型选自1、3、4、5、6a、6b、7f、9v、14、18c、19f、19a和22f并且载体蛋白是psaa。
在另一个实施方式中,本公开提供了包含两种或更多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中血清型选自1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19f、19a、22f、23f、33f、34、35、38和45并且载体蛋白是psaa。
在另一个实施方式中,本公开提供了包含一种或多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中血清型是1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45并且载体蛋白是psa。
在另一个实施方式中,本公开提供了包含一种或多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中该肺炎球菌多糖分别单独缀合至psaa或者psaa和crm197的组合。
在另一个实施方式中,本公开提供了包含至少6种分别单独缀合至psaa的肺炎球菌多糖和一种或多种分别单独缀合至crm197的肺炎球菌多糖的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少5种分别单独缀合至psaa的肺炎球菌多糖和至少5种分别单独缀合至crm197的肺炎球菌多糖的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了包含至少5种分别单独缀合至psaa的肺炎球菌多糖和至少5种分别单独缀合至crm197的肺炎球菌多糖的14价肺炎球菌疫苗。
在另一个实施方式中,本公开提供了包含至少5种分别单独缀合至psaa的肺炎球菌多糖血清型和至少5种分别单独缀合至crm197的肺炎球菌多糖血清型的17价肺炎球菌疫苗。
在另一个实施方式中,本公开提供了包含至少5种分别单独缀合至psaa的肺炎球菌多糖血清型和至少5种分别单独缀合至crm197的肺炎球菌多糖血清型的20价肺炎球菌疫苗。
在另一个实施方式中,本公开提供了包含至少5种分别单独缀合至psaa的肺炎球菌多糖血清型和至少5种分别单独缀合至crm197的肺炎球菌多糖血清型的22价肺炎球菌疫苗。
在另一个实施方式中,本公开提供了包含至少5种分别单独缀合至psaa的肺炎球菌多糖血清型和至少5种分别单独缀合至crm197的肺炎球菌多糖血清型的24价肺炎球菌疫苗。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的14价肺炎球菌疫苗,其中至少血清型3和6b缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、7f、9v、14、18c、19a、19f、22f、23f和33f的14价肺炎球菌疫苗,其中至少血清型3和6a缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的15价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b的17价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45的20价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38的22价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38的22价肺炎球菌疫苗,其中血清型1、3、6a、10a、12f、15a、15b、22f、34、35b、38缀合至psaa并且血清型14、5、6b、7f、9v、14、18c、19a、19f、23f和33f缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38的24价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种缀合至crm197。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38的24价肺炎球菌疫苗,其中血清型1、3、6a、8、10a、12f、15a、15b、16f、22f、34、35、38缀合至psaa并且一种或多种血清型14、5、6b、7f、9v、14、18c、19a、19f、23f和33f缀合至crm197。
在另一个实施方式中,本公开提供了配制成剂量单位的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了配制成剂量单位的肺炎球菌疫苗组合物,其中剂量单位包含约0.1μg至约50μg的每种多糖,约0.1μg至约10μg或者约1μg至约5μg的每种多糖,其中每种多糖分别单独缀合至约1.5μg至约5μg载体蛋白的载体蛋白。
在另一个实施方式中,本公开提供了包含药学上可接受的稀释剂、缓冲剂、防腐剂、稳定剂、佐剂和/或冷冻干燥赋形剂的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了配制成作为单位剂量小瓶、多次剂量小瓶或者预填充注射器提供的剂量单位的肺炎球菌疫苗组合物。
在另一个实施方式中,本公开提供了作为单一0.5ml剂量的肺炎球菌疫苗组合物,单一剂量包含约2.2至4.4μg的一种或多种肺炎球菌多糖;约1μg至约10μg的缀合至一种或多种肺炎球菌多糖中的每一种上的psaa;约1μg至约10μg缀合至一种或多种肺炎球菌多糖中的每一种上的crm197;约0.2mg至约1mg的磷酸铝佐剂;和赋形剂。
在另一个实施方式中,本公开提供了包含分别单独缀合至psaa或者psaa和crm197的组合的肺炎球菌多糖血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f和33f的13价肺炎球菌疫苗,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约25μg至约30μg的psaa和crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含分别单独缀合至psaa或者psaa和crm197的组合的肺炎球菌多糖血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的14价肺炎球菌疫苗,其中所述肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约30μg至约35μg的psaa和crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含分别单独缀合至psaa或者psaa和crm197的组合的肺炎球菌多糖血清型1、3、4、5、6a、7f、9v、14、18c、19a、19f、22f、23f和33f的14价肺炎球菌疫苗,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2至4.4μg的每种多糖,约30μg至约35μg的psaa和crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的15价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197,其中所述肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约5μg至约20μg的psaa、约20μg至约40μg的crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b的17价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b中的一种或多种缀合至crm197,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约5μg至约20μg的psaa、约20μg至约40μg的crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45的20价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45中的一种或多种缀合至crm197,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约5μg至约20μg的psaa、约20μg至约50μg的crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38的22价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种缀合至crm197,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约5μg至约20μg的psaa、约20μg至约50μg的crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38的22价肺炎球菌疫苗,其中血清型1、3、6a、10a、12f、15a、15b、22f、34、35b、38缀合至psaa并且血清型14、5、6b、7f、9v、14、18c、19a、19f、23f和33f缀合至crm197,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约20μg至约40μg的psaa、约20μg至约40μg的crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38的24价肺炎球菌疫苗,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种缀合至crm197,其中肺炎球菌疫苗组合物是作为无菌液体配制的约0.5ml剂量,其包含约2.2μg至约4.4μg的每种多糖,约5μg至约20μg的psaa、约20μg至约50μg的crm197,作为约0.5mg磷酸铝的约0.125mg元素铝、氯化钠和l-组氨酸缓冲液。
附图说明
图1:sec-hplc色谱图显示了血清型7f(a)、血清型14(b)、血清型19f(c)、血清型3(d)、血清型6a(e)和血清型6b(f)的缀合反应动力学。
图2:sec-hplc色谱图显示了血清型5(a)、血清型9v(b)、血清型18c(c)、血清型3(d)、血清型6a(e)和血清型6b(f)的缀合反应动力学。
图3:在使用如在实施例3中所描述的本公开的组合物免疫的兔中对不同血清型的免疫应答。
图4:在用prevnar
图5:在使用如在实施例4中所描述的本公开的另一种组合物免疫的兔中对不同血清型的免疫应答。
具体实施方式
在一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,其中一种或多种肺炎球菌多糖为天然肺炎球菌多糖。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,其中一种或多种该肺炎球菌多糖为片段化的,每种片段化的肺炎球菌多糖的平均分子量小于天然肺炎球菌多糖的平均分子量。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,其中在缀合至载体蛋白之前,通过用1-氰基-4-二甲基氨-四氟硼酸吡啶(cdap)激活肺炎球菌多糖中的每一种以形成氰酸酯。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,其中一种或多种肺炎球菌多糖直接偶联至载体蛋白的氨基或者通过间隔子偶联至氨基。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,其中间隔子为胱胺、半胱胺、己二胺、己二酸二酰肼(adh)、edac或edc。
在另一个实施方式中,本公开提供了包含一种或多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中psaa载体蛋白是修饰的psaa并且不包含野生型疏水性n末端前导肽。
在另一个实施方式中,本公开提供了包含一种或多种血清型的肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,其中psaa载体蛋白包含290个氨基酸。
本公开提供了包含分别单独缀合至载体蛋白的两种或更多种荚膜肺炎球菌多糖血清型(在本文中将其称为多糖-蛋白缀合物和/或缀合物)的肺炎球菌疫苗组合物。当包含在本文所描述的肺炎球菌疫苗组合物中时,肺炎球菌疫苗为多价肺炎球菌多糖-蛋白缀合物疫苗(在本文中还称为多价缀合物疫苗、缀合物疫苗和/或多糖-蛋白缀合物疫苗)。除多价缀合物疫苗之外,本公开提供了将其制备和/或施用于对其有需要的受试者的方法。
在一些实施方式中,肺炎球菌疫苗组合物是包含一种或多种缀合物的多价免疫原性组合物。例如,缀合物可以包含两种或更多种肺炎球菌多糖,肺炎球菌多糖中的每一种选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45的肺炎球菌多糖。
在一些实施方式中,肺炎球菌疫苗组合物是多价的并且包含5种肺炎球菌多糖(5价)、10种肺炎球菌多糖(10价)、11种肺炎球菌多糖(11价)、12种肺炎球菌多糖(12价)、13种肺炎球菌多糖(13价)、14种肺炎球菌多糖(14价)、15种肺炎球菌多糖(15价)、16种肺炎球菌多糖(16价)、17种肺炎球菌多糖(17价)、18种肺炎球菌多糖(18价)、19种肺炎球菌多糖(19价)、20种肺炎球菌多糖(20价)、21种肺炎球菌多糖(21价)、22种肺炎球菌多糖(22价)、23种肺炎球菌多糖(23价)、24种肺炎球菌多糖(24价)、25种肺炎球菌多糖(25价的)、26种肺炎球菌多糖(26价)、27种肺炎球菌多糖(27价)、28种肺炎球菌多糖(28价)、29种肺炎球菌多糖(29价)或者30种肺炎球菌多糖(30价)。在其他实施方式中,肺炎球菌疫苗组合物是10价、14价、15价、17价、18价、19价、20价、22价、23价、24价或25价肺炎球菌疫苗组合物。
出乎意料地,与包含未缀合至载体蛋白的肺炎球菌多糖的多价肺炎球菌疫苗相比,本公开所述的多价肺炎球菌缀合物疫苗组合物提供了改善的免疫应答。更具体地,当将来自肺炎链球菌(streptococcuspneumoniae)的一种或多种血清型的肺炎球菌多糖缀合至psaa和/或crm197时,出乎意料地,本公开的多价肺炎球菌缀合物疫苗组合物是最有效的。
载体蛋白是以足够量和纯度可获得的无毒且非反应原性蛋白。在一些实施方式中,本公开提供了包含缀合至一种或多种肺炎链球菌(s.pneumoniae)多糖(在本文中还称为“肺炎球菌多糖”)的一种或多种载体蛋白的肺炎球菌缀合物疫苗组合物。通过将肺炎球菌多糖缀合至载体蛋白,与非缀合肺炎球菌多糖相比,肺炎球菌多糖具有提高的免疫原性。通过本公开有用的载体蛋白应符合标准缀合程序。
crm197为白喉毒素的变体并且在疫苗中使用时是无毒的。crm197可以分离自在基于酪蛋白氨基酸和酵母提取物的培养基中生长的白喉棒杆菌(corynebacteriumdiphtheriae)株c7(β197)的培养。可以根据美国专利号5,614,382中所描述的方法重组制备crm197。作为另外一种选择,可以根据文献中已知的方法或者根据pct专利公开wo2016/079755中所公开的方法重组制备crm197。可以通过超滤、硫酸铵沉淀和离子交换色谱或者本领域熟知的其他方法纯化crm197。
在一些实施方式中,将本公开的肺炎球菌多糖缀合至一种或多种载体蛋白。例如,将肺炎球菌多糖分别单独缀合至载体蛋白。在其他实施方式中,将多于一种肺炎球菌多糖缀合至载体蛋白。例如,将两种肺炎球菌多糖、三种肺炎球菌多糖、四种肺炎球菌多糖、五种肺炎球菌多糖、六种肺炎球菌多糖、七种肺炎球菌多糖、八种肺炎球菌多糖、九种肺炎球菌多糖或十种肺炎球菌多糖缀合至载体蛋白。在一些实施方式中,将肺炎球菌多糖缀合至多于一种载体蛋白。例如,将肺炎球菌多糖缀合至一种载体蛋白、两种载体蛋白、三种载体蛋白和/或四种载体蛋白。
在一些实施方式中,载体蛋白是psaa。在其他实施方式中,使用载体蛋白的组合,其包括两种或更多种载体蛋白,如psaa和crm197,它们分别单独缀合至每种肺炎球菌多糖。在其他实施方式中,载体蛋白是两种载体蛋白并且包括psaa和crm197。
在一些实施方式中,载体蛋白是选自以下载体蛋白中的一种或多种:psaa,crm197,失活的细菌毒素如破伤风类毒素、百日咳类毒素、霍乱类毒素、来自铜绿假单胞菌(pseudomonasaeruginosa)的外毒素a,细菌外膜蛋白如外膜复合物c(ompc)、孔蛋白、转铁蛋白结合蛋白、肺炎球菌溶血素、pspa、来自a族或b族链球菌的c5a肽酶或者流感嗜血杆菌(haemophilusinfluenzae)蛋白d、卵清蛋白、钥孔血蓝素(klh)、牛血清白蛋白(bsa)和结核菌素纯蛋白衍化物(ppd)。
此外,一种或多种缀合物可以包括天然(例如,野生型)载体蛋白和/或一种或多种缀合物可以包括从它们的天然形式修饰成非天然形式(例如,经工程设计以缺少一个或多个氨基酸)的载体蛋白。在一些实施方式中,载体蛋白可以经工程设计以消除一个或多个蛋白结构域如前导肽或者可能具有对于本公开的缀合物所不期望的性质的其他结构域。例如,psaa可以是具有亲水性指数2.052的经工程设计以缺少疏水性n末端前导肽的290个氨基酸的载体蛋白。
在一些实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45。所选择的肺炎球菌多糖分别单独缀合至载体蛋白psaa,或者所选择的肺炎球菌多糖的第一部分缀合至psaa而所选择的肺炎球菌多糖的第二部分缀合至crm197。在任何这些实施方式中,肺炎球菌多糖-蛋白缀合物疫苗组合物是免疫原性多价肺炎球菌多糖-蛋白缀合物组合物,如10价、13价、14价、15价、17价、18价、19价、20价、22价、23价、24价或25价免疫原性多价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45。所选择的肺炎球菌多糖分别单独缀合至载体蛋白psaa。在其他实施方式中,所选择的肺炎球菌多糖的第一部分缀合至psaa而所选择的肺炎球菌多糖的第二部分缀合至crm197。在任何这些实施方式中,肺炎球菌多糖-蛋白缀合物疫苗组合物是免疫原性多价肺炎球菌多糖-蛋白缀合物组合物,如10价、13价、14价、15价、17价、18价、19价、20价、22价、23价、24价或25价免疫原性多价肺炎球菌多糖-蛋白缀合物组合物。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45。在这些实施方式中,所选择的肺炎球菌多糖中的至少三种分别单独缀合至载体蛋白psaa并且其他肺炎球菌多糖分别单独缀合至载体蛋白crm197。在任何这些实施方式中,肺炎球菌多糖-蛋白缀合物疫苗组合物是免疫原性多价肺炎球菌多糖-蛋白缀合物组合物,如10价、13价、14价、15价、17价、18价、19价、20价、22价、23价、24价或25价免疫原性多价肺炎球菌多糖-蛋白缀合物组合物。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45。在这些实施方式中,至少第一个五个所选择的肺炎球菌多糖分别单独缀合至载体蛋白psaa并且至少第二个五个多糖分别单独缀合至载体蛋白crm197。第一个五个所选择的肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且第二个五个选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45。在其他实施方式中,所选择的肺炎球菌多糖的第一部分缀合至psaa而所选择的肺炎球菌多糖的第二部分缀合至crm197。在任何这些实施方式中,肺炎球菌多糖-蛋白缀合物疫苗组合物是免疫原性多价肺炎球菌多糖-蛋白缀合物组合物,如10价、14价、15价、17价、18价、19价、20价、22价、23价、24价或25价免疫原性多价肺炎球菌多糖-蛋白缀合物组合物。
在其他实施方式中,本公开提供了包含至少三种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的14价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,该14价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在其他实施方式中,本公开提供了包含至少三种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的15价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,该15价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在一些实施方式中,本公开提供了包含至少三种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的17价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,所述17价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在其他实施方式中,本公开提供了包含至少三种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的20价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,所述20价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在其他实施方式中,本公开提供了包含至少五种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的22价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,所述22价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在一些实施方式中,本公开提供了包含至少五种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的24价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,所述24价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在其他实施方式中,本公开提供了包含至少五种肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的25价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至psaa。此外,所述25价肺炎球菌多糖-蛋白缀合物疫苗组合物还包含至少五种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45,并且缀合至crm197。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的14价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f、23f和33f。在所选择的血清型中,至少血清型3和血清型6b缀合至psaa,并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种中的每一种缀合至crm197。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的14价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、7f、9v、14、18c、19a、19f、22f、23f和33f。在所选择的血清型中,至少血清型3和血清型6a缀合至psaa,并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种中的每一种缀合至crm197。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的15价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f。在所选择的血清型中,至少血清型3、6a和6b缀合至psaa,并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种中的每一种缀合至crm197。
在一些实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的17价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、6b、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b。在所选择的血清型中,至少血清型3、6a和6b缀合至psaa,并且血清型1、4、5、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b中的一种或多种中的每一种缀合至crm197。
在一些实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的20价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、6b、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45。在所选择的血清型中,至少血清型3、6a和6b缀合至psaa,并且血清型1、4、5、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45中的一种或多种中的每一种缀合至crm197。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的22价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38。在所选择的血清型中,至少血清型3、6a和6b缀合至psaa,并且血清型1、4、5、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种中的每一种缀合至crm197。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的22价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38。在所选择的血清型中,血清型1、3、6a、10a、12f、15a、15b、22f、34、35和38缀合至psaa,并且血清型14、5、6b、7f、9v、14、18c、19a、19f、23f和33f中的每一种缀合至crm197。
在其他实施方式中,本公开提供了包含肺炎球菌多糖(例如,荚膜肺炎球菌多糖)的24价肺炎球菌多糖-蛋白缀合物疫苗组合物,这些肺炎球菌多糖选自血清型1、3、4、5、6a、6b、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38。在所选择的血清型中,血清型1、3、6a、8、10a、12f、15a、15b、16f、22f、34、35和38缀合至psaa,并且血清型14、5、6b、7f、9v、14、18c、19a、19f、23f和33f中的每一种缀合至crm197。
本公开的肺炎球菌多糖-蛋白缀合物组合物还可以包含以下各项中的一种或多种:药学上可接受的载体、药学上可接受的稀释剂、缓冲剂、防腐剂、稳定剂、佐剂和/或冷冻干燥赋形剂。例如,本公开的肺炎球菌多糖-蛋白缀合物组合物可以包含药学上可接受的载体。在一些实施方式中,本公开的肺炎球菌多糖-蛋白缀合物组合物包含至少10种肺炎球菌多糖,其选自血清型1、2、3、4、5、6a、6b、6c、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、16f、17f、18c、19f、19a、20a、20b、22f、23a、23b、23f、24b、24f、31、33f、34、35b、35f、38、39和45。所选择的血清型分别单独缀合至psaa或者psaa和crm197的组合,和药学上可接受的载体
在一些实施方式中,可以根据常规方法从一种或多种微生物(例如,肺炎链球菌(streptococcuspneumoniae))提取在本公开的组合物中有用的肺炎球菌多糖。例如,可以根据已知程序制备肺炎球菌多糖。此外,可以根据pct专利公开wo2016/174683a1中所描述的程序进行肺炎球菌多糖的纯化。
可以根据常规方法纯化所提取的肺炎球菌多糖并且可以以其天然形式使用。在其他实施方式中,所提取和纯化的肺炎球菌多糖可以经片段化以获得肺炎球菌多糖的一个或多个部分,肺炎球菌多糖的每个部分的平均分子量小于所提取和纯化的肺炎球菌多糖的平均分子量。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖的肺炎球菌疫苗组合物,每种肺炎球菌多糖的分子量在约150kda至450kda之间。
在另一个实施方式中,本公开提供了包含分别单独缀合至载体蛋白的一种或多种荚膜肺炎球菌多糖血清型,如多糖-蛋白缀合物的肺炎球菌疫苗组合物,其中每种多糖-蛋白缀合物的分子量为约1,500kda至约15,000kda。
在其他实施方式中,可以在缀合至一种或多种载体蛋白之前激活所提取和纯化的肺炎球菌多糖。例如,可以在缀合至一种或多种载体蛋白之前(例如,化学)激活所提取和纯化的肺炎球菌多糖。每种激活的肺炎球菌多糖可以分别单独缀合至载体蛋白,从而形成多糖-蛋白缀合物(例如,糖缀合物)。在其他实施方式中,可以将一种或多种激活的肺炎球菌多糖缀合至单个载体蛋白和/或可以将激活的肺炎球菌多糖缀合至单个载体蛋白。可以通过已知的技术制备缀合物。
在一些实施方式中,可以化学激活肺炎球菌多糖并且随后根据已知技术,如美国专利号4,365,170、4,673,574和4,902,506中所描述的那些,缀合至载体蛋白。例如,可以通过用氧化剂如高碘酸盐(例如,高碘酸钠、高碘酸钾或高碘酸)、通过碳水化合物的一个或多个邻位(邻近的,vicinal)羟基的随机氧化切割以及一个或多个反应性醛基的形成,将末端羟基氧化成醛来激活肺炎球菌多糖。
还可以通过cdap(1-氰基-4-二甲基氨-四氟硼酸吡啶)激活肺炎球菌多糖并随后缀合至一种或多种载体蛋白如psaa、crm197、pspa或其组合。在其他实施方式中,用cdap激活以形成氰酸酯的肺炎球菌多糖可以直接缀合至一种或多种载体蛋白或使用间隔子(例如,接头)缀合。间隔子可以偶联至载体蛋白上的氨基。在一些实施方式中,间隔子可以是胱胺或半胱胺,其产生了可以通过与马来酰亚胺激活的载体蛋白(例如,使用gmbs)或者卤代乙酰基化载体蛋白(例如,使用碘乙酰胺、乙基碘乙酰胺hcl、siab、sia、sbap和/或n-琥珀酰亚胺基溴乙酸酯)的硫醚键合偶联至载体蛋白的硫醇化多糖。在其他实施方式中,使用己二胺或己二酸二酰肼(adh)偶联所述氰酸酯并且使用碳二亚胺(例如,edac或edc)化学,通过蛋白载体上的羧基,将氨基衍生化的糖缀合至载体蛋白。在国际专利申请公开号wo93/15760、国际专利申请公开号wo95/08348、国际专利申请公开号wo96/29094和chu等人,1983,infect.immunity40:245-256中描述了这些缀合物。
用于本公开的多糖-蛋白缀合物和和疫苗组合物的其他适合的激活和/或偶联技术包括碳二亚胺、酰肼、活性酯、降冰片烷、p-硝基苯甲酸、n-羟基琥珀酰亚胺、s-nhs、edc、tstu的使用和国际专利申请公开号wo98/42721中所描述的其他方法。例如,缀合可以包括可以通过糖的自由羰基与gdi的反应形成的羰基接头(参见bethell等人,1979,j.biol.chem.254:2572-4;hearn等人,1981,j.chromatogr.218:509-18),然后,与蛋白偶联以形成氨基甲酸酯键,在一些实施方式中,异头末端可以被还原为伯醇羟基,对该伯醇羟基任选地保护/去保护,伯醇羟基与cdi反应以形成cdi氨基甲酸酯中间体并将所述cdi氨基甲酸酯中间体与蛋白上的氨基偶联。
例如,用于本公开的多糖-蛋白缀合物和疫苗组合物的另一种适合的激活和/或偶联技术包括以下方法:可以将尺寸分级的(尺寸化的,sized)肺炎球菌多糖(例如,约6ml,浓度约10mg/ml的尺寸分级的多糖)和cdap(例如,约100mg/ml的乙腈(w/v)溶液)在玻璃小瓶中以约1比约1的比值混合(例如,通过搅拌约1分钟)。可以根据需要,调整所述多糖溶液的ph(例如,用约0.2m三乙胺调至约9.25并且在室温下搅拌3min)。另外,可以将psaa(例如,约4ml,浓度约15mg/ml的溶液)缓慢添加至激活的肺炎球菌多糖(例如,以约1比约1的比值(ps:载体蛋白))。可以调整反应的ph(例如,使用0.2m三甲胺调至约9.05)并且可以继续反应(例如,通过在室温下搅拌5小时)。可以使反应混合物淬灭(例如,通过添加过量浓度的甘氨酸)。
在一些实施方式中,可以使用膜(例如,100kmwco膜)渗滤反应混合物并且可以通过尺寸-排阻色谱纯化。可以使用sec-malls和蒽酮法分析所述渗滤和纯化的部分。可以汇集已分析的含有缀合物的级分并过滤除菌(例如,使用0.2μm过滤器)。
在肺炎球菌多糖与一种或多种载体蛋白的缀合之后,可以通过多种技术纯化多糖-蛋白缀合物(例如,相对于多糖-蛋白缀合物的量富集)。这些技术包括但不限于浓缩/渗滤操作、沉淀/洗脱、柱色谱和深层过滤。例如,在纯化缀合物之后,可以将缀合物混合以配制本公开的肺炎球菌多糖-蛋白缀合物组合物,其可以用作疫苗。
在一些实施方式中,本公开提供了制备本文所描述的肺炎球菌疫苗组合物的多糖-蛋白缀合物的方法,其中方法还包括将所述多糖-蛋白缀合物配制成包含佐剂、赋形剂和缓冲剂的肺炎球菌疫苗组合物。
在一些实施方式中,本公开提供了制备本文所描述的肺炎球菌疫苗组合物的多糖-蛋白缀合物的方法,其中所述佐剂是磷酸铝。
在一些实施方式中,本公开提供了治疗对其有需要的受试者的方法,其包括向所述对其有需要的受试者施用本文所描述的肺炎球菌疫苗组合物。
在一些实施方式中,受试者患有由肺炎链球菌(streptococcuspneumoniae)介导的疾病,如侵袭性肺炎球菌疾病(ipd)。
在一个实施方式中,所述受试者是人,如婴儿(年龄小于约1岁)、幼儿(年龄约12个月至约24个月)、低龄儿童(年龄约2岁至约5岁)、较大儿童(年龄约5岁至约13岁)、青少年(adolescent)(年龄约13岁至约18岁)、成年人(年龄约18岁至约65岁)或者老年人(年龄大于约65岁)。
在一些实施方式中,本公开提供了引起对肺炎链球菌(s.pneumoniae)荚膜多糖缀合物的免疫应答的方法,其包括向受试者施用免疫有效量的本文所描述的肺炎球菌疫苗组合物。
在一个实施方式中,引起对肺炎链球菌(s.pneumoniae)荚膜多糖缀合物的免疫应答的方法包括向受试者全身、皮下和/或粘膜施用本文所描述的肺炎球菌疫苗组合物。
在一些实施方式中,本公开的疫苗组合物剂量中每种缀合物的量为足以引起免疫保护应答,如无显著副作用的免疫保护应答的量。尽管取决于于肺炎球菌血清型,每种缀合物的量可以不同,但是每种疫苗组合物剂量可以包含缀合至每种载体蛋白的约0.1μg至约50μg的每种肺炎球菌多糖,约0.1μg至约10μg,或者约1至约5μg的每种肺炎球菌多糖(包含约1.5μg至约5μg的载体蛋白)。
在另一个实施方式中,本公开提供了包含肺炎球菌多糖和载体蛋白的肺炎球菌疫苗组合物,肺炎球菌疫苗组合物的蛋白与多糖的百分比(蛋白/ps)为约0.5至约2.0蛋白/ps,优选地,0.7至1.2。
在一些实施方式中,本公开提供了肺炎球菌多糖-蛋白缀合物疫苗组合物,其包含分子量在约100kda至约400kda,约125kda至约425kda,约150kda至约450kda,约175kda至约475kda,约200kda至约500kda,约250kda至约55kda或者约300kda至约600kda的范围内的肺炎球菌多糖。
在其他实施方式中,本公开提供了肺炎球菌多糖-蛋白缀合物疫苗组合物,其包含分子量在约1,000kda至约10,000kda,约1,500kda至约15,000kda,约2,000kda至约20,000kda,约2,500kda至约25,000kda或者约3,000kda至约30,000kda的范围内的一种或多种多糖-蛋白缀合物。
可以使用已知方法产生本公开的肺炎球菌多糖-蛋白缀合物疫苗组合物。例如,可以将肺炎球菌多糖-蛋白缀合物疫苗组合物与药学上可接受的稀释剂或媒介物,例如,水或盐溶液一起配制。另外,肺炎球菌多糖-蛋白缀合物疫苗组合物还可以包含以下各项中的一种或多种:缓冲剂、防腐剂或稳定剂、聚山梨醇酯、佐剂,如铝化合物,例如,氢氧化铝、磷酸铝或羟基磷酸铝和/或冷冻干燥赋形剂。可以相关于向对其有需要的受试者的施用模式和途径选择在本公开的肺炎球菌多糖-蛋白缀合物疫苗组合物中上述化合物中任一种的包含,并且其还可以基于标准药物实践。
在一些实施方式中,本公开提供了制备包含选自血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的肺炎球菌多糖的14价肺炎球菌多糖-蛋白缀合物组合物的方法,其中至少血清型3和6b缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197。用于制备所述14价肺炎球菌多糖-蛋白缀合物组合物的方法包括以下步骤:
(a)将14种肺炎球菌多糖中的一种或多种(例如,使用cdap激活的)单独缀合至免疫原性载体蛋白,如psaa和/或crm197,
(b)使用尺寸排阻色谱渗滤并纯化缀合物,
(c)使用sec-malls分析所纯化的级分,将含有所述14缀合物中每一种的部分汇集,并对所述一价缀合物级分过滤除菌,和
(d)将所述14种缀合物(例如,对于每种血清型约2.2至4.4μg,约5μg至约10μg的psaa和约15μg至约36μg的crm197)、佐剂(如磷酸铝)、赋形剂和缓冲剂配制成14价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,可以(例如,无菌)过滤十四价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,本公开提供了制备包含选自血清型1、3、4、5、6a、7f、9v、14、18c、19a、19f、22f、23f和33f的肺炎球菌多糖的14价肺炎球菌多糖-蛋白缀合物组合物的方法,其中至少血清型3和6a缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197。用于制备所述14价肺炎球菌多糖-蛋白缀合物组合物的方法包括以下步骤:
(a)将14种肺炎球菌多糖中的一种或多种(例如,使用cdap激活的)单独缀合至免疫原性载体蛋白,如psaa和/或crm197,
(b)使用尺寸排阻色谱渗滤并纯化缀合物,
(c)使用sec-malls分析所纯化的级分,将含有所述14缀合物中每一种的部分汇集,并对一价缀合物级分过滤除菌,和
(d)将所述14种缀合物(例如,对于每种血清型约2.2至4.4μg,约5μg至约10μg的psaa和约15μg至约36μg的crm197)、佐剂(如磷酸铝)、赋形剂和缓冲剂配制成14价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,可以(例如,无菌)过滤十四价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,本公开提供了制备包含选自血清型1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f的肺炎球菌多糖的15价肺炎球菌多糖-蛋白缀合物组合物的方法,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种缀合至crm197。用于制备所述15价肺炎球菌多糖-蛋白缀合物组合物的方法包括以下步骤:
(a)将15种肺炎球菌多糖中的一种或多种(例如,使用cdap激活的)单独缀合至免疫原性载体蛋白,如psaa和/或crm197,
(b)使用尺寸排阻色谱渗滤并纯化缀合物,
(c)使用sec-malls分析所纯化的级分,将含有所述15缀合物中每一种的级分汇集,并对一价缀合物级分过滤除菌,和
(d)将所述15种缀合物(例如,对于每种血清型约2.2至4.4μg,约5μg至约20μg的psaa和约20μg至约40μg的crm197)、佐剂(如磷酸铝)、赋形剂和缓冲剂配制成15价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,可以(例如,无菌)过滤所述15价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,本公开提供了制备包含选自血清型1、3、4、5、6a、6b、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b的肺炎球菌多糖的17价肺炎球菌多糖-蛋白缀合物组合物的方法,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b中的一种或多种缀合至crm197。用于制备所述17价肺炎球菌多糖-蛋白缀合物组合物的方法包括以下步骤:
(a)将所述17种肺炎球菌多糖中的一种或多种(例如,使用cdap激活的)单独缀合至免疫原性载体蛋白,如psaa和/或crm197,
(b)使用尺寸排阻色谱渗滤并纯化缀合物,
(c)使用sec-malls分析所纯化的级分,将含有所述17缀合物中每一种的级分汇集,并对一价缀合物级分过滤除菌,和
(d)将所述17种缀合物(例如,对于每种血清型约2.2至4.4μg,约5μg至约20μg的psaa和约20μg至约40μg的crm197)、佐剂(如磷酸铝)、赋形剂和缓冲剂配制成17价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,可以(例如,无菌)过滤所述17价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,本公开提供了制备包含选自血清型1、3、4、5、6a、6b、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45的肺炎球菌多糖的20价肺炎球菌多糖-蛋白缀合物组合物的方法,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45中的一种或多种缀合至crm197。用于制备所述20价肺炎球菌多糖-蛋白缀合物组合物的方法包括以下步骤:
(a)将所述20种肺炎球菌多糖中的一种或多种(例如,使用cdap激活的)单独缀合至免疫原性载体蛋白,如psaa和/或crm197,
(b)使用尺寸排阻色谱渗滤并纯化缀合物,
(c)使用sec-malls分析所纯化的级分,将含有所述20缀合物中每一种的级分汇集,并对一价缀合物级分过滤除菌,和
(d)将所述20种缀合物(例如,对于每种血清型约2.2至4.4μg,约5μg至约20μg的psaa,和约20μg至约50μg的crm197)、佐剂(如磷酸铝)、赋形剂和缓冲剂配制成20价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,可以(例如,无菌)过滤所述20价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,本公开提供了制备包含选自血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38的一种或多种肺炎球菌多糖的22价肺炎球菌多糖-蛋白缀合物组合物的方法,其中至少血清型3、6a和6b缀合至psaa并且血清型1、4、5、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种缀合至crm197。用于制备所述22价肺炎球菌多糖-蛋白缀合物组合物的方法包括以下步骤:
(a)将所述22种肺炎球菌多糖中的一种或多种(例如,使用cdap激活的)单独缀合至免疫原性载体蛋白,如psaa和/或crm197,
(b)使用尺寸排阻色谱渗滤并纯化缀合物,
(c)使用sec-malls分析所纯化的级分,将含有所述22缀合物中每一种的级分汇集,并对一价缀合物级分过滤除菌,和
(d)将所述22种缀合物(例如,对于每种血清型约2.2至4.4μg,约5μg至约20μg的psaa,和约20μg至约50μg的crm197)、佐剂(如磷酸铝)、赋形剂和缓冲剂配制成22价肺炎球菌多糖-蛋白缀合物组合物。
在一些实施方式中,可以(例如,无菌)过滤所述22价肺炎球菌多糖-蛋白缀合物组合物。
可以将本公开的组合物配制成单位剂量,例如,单位剂量小瓶,配制成多次剂量,例如,多次剂量小瓶,或者预填充注射器。本公开的组合物还可以包含一种或多种防腐剂,其选自硫柳汞、2-苯氧乙醇等,防腐剂的量可以在约4mg/ml至约20mg/ml的范围内。
在一些实施方式中,本公开还提供了作为约0.5ml单一剂量施用的免疫原性组合物(例如,疫苗),如肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:约2.2至4.4μg的两种或更多种肺炎球菌多糖血清型,每种血清型约1μg至约10μg的psaa,每种血清型约1μg至约10μg的crm197,约0.2mg至约1mg的佐剂(例如,磷酸铝)和一种或多种赋形剂(例如,氯化钠和/或缓冲剂)。
在其他实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的13价免疫原性组合物(例如,疫苗),如13价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:分别单独缀合至psaa或者psaa和crm197的组合的肺炎球菌多糖血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f和33f。
13价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的13种血清型中的每一种,约25μg至约30μg的psaa和crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
在一些实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的14价免疫原性组合物(例如,疫苗),如14价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:分别单独缀合至psaa或者psaa和crm197的组合的肺炎球菌多糖血清型1、3、4、5、6b、7f、9v、14、18c、19a、19f、22f、23f和33f。
在一些实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的14价免疫原性组合物(例如,疫苗),如14价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:分别单独缀合至psaa或者psaa和crm197的组合的肺炎球菌多糖血清型1、3、4、5、6a、7f、9v、14、18c、19a、19f、22f、23f和33f。
14价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的14种血清型中的每一种,约20μg至约35μg的psaa和crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
在其他实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的15价免疫原性组合物(例如,疫苗),如15价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、14、18c、19a、19f、22f、23f和33f,其中至少血清型3、6a和6b分别单独缀合至psaa,并且血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f中的一种或多种分别单独缀合至crm197。
15价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的15种血清型中的每一种,约5μg至约20μg的psaa,约20μg至40μg的crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
在其他实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的17价免疫原性组合物(例如,疫苗),如17价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b,其中至少血清型3、6a和6b分别单独缀合至psaa,并且血清型1、4、5、7f、9v、12f、14、18c、19a、19f、22f、23f、33f和35b中的一种或多种分别单独缀合至crm197。
17价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的17种血清型中的每一种,约5μg至约20μg的psaa,约20μg至40μg的crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
在一些实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的20价免疫原性组合物(例如,疫苗),如20价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45,其中至少血清型3、6a和6b分别单独缀合至psaa,并且血清型1、4、5、7f、9v、11a、12f、14、15b、18c、19a、19f、22f、23f、33f、35b和45中的一种或多种分别单独缀合至crm197。
20价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的20种血清型中的每一种,约5μg至约20μg的psaa,约20至50μg的crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
在一些实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的22价免疫原性组合物(例如,疫苗),如22价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38,其中至少血清型3、6a和6b分别单独缀合至psaa,并且血清型1、4、5、7f、9v、10a、12f、14、15a、15b、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种分别单独缀合至crm197。
22价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的22种血清型中的每一种,约5μg至约20μg的psaa,约20μg至50μg的crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
在一些实施方式中,本公开还提供了作为约0.5ml的单一剂量施用的处于无菌液体制剂的24价免疫原性组合物(例如,疫苗),如24价肺炎球菌多糖-蛋白缀合物组合物,其经配制以包含至少以下各项:肺炎球菌多糖血清型1、3、4、5、6a、6b、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38,其中至少血清型3、6a和6b分别单独缀合至psaa,并且血清型1、4、5、7f、8、9v、10a、12f、14、15a、15b、16f、18c、19a、19f、22f、23f、33f、34、35b和38中的一种或多种分别单独缀合至crm197。
24价疫苗还可以配制成约0.5ml剂量的一种或多种剂量,每0.5ml剂量包含约2.2μg至约4.4μg的22种血清型中的每一种,约5μg至约20μg的psaa,约20μg至50μg的crm197,约0.125mg的佐剂(例如,元素铝,如约0.5mg磷酸铝)、氯化钠和l-组氨酸缓冲液。
可以通过在疫苗领域中使用的多种常规途径向对其有需要的受试者施用本公开的组合物。例如,可以全身施用本公开的组合物,如肠胃外(例如,皮下、肌内、皮内和/或静脉内)或者粘膜(例如,口腔和/或鼻腔)施用。
在一些实施方式中,本公开还提供了在对其有需要的受试者中引起对缀合至一种或多种载体蛋白的一种或多种肺炎链球菌(s.pneumoniae)荚膜多糖的免疫应答的方法。引起免疫应答的方法包括向对其有需要的受试者施用免疫有效量的本文所描述的组合物。
根据本公开的方法,本文所描述的组合物的受试者为人,如婴儿(年龄小于约1岁)、幼儿(年龄约12个月至约24个月)、低龄儿童(年龄约2岁至约5岁)、较大儿童(年龄约5岁至约13岁)、青少年(年龄约13岁至约18岁)、成年人(年龄约18岁至约65岁)或者老年人(年龄大于约65岁)。
如本文所使用的,本公开中所描述的组合物的“有效量”是指在施用所述组合物的受试者中引起免疫应答所需的量。免疫应答的特征在于宿主中一种或多种肺炎链球菌(s.pneumoniae)抗原-特异性抗体的存在,其显著减少后续激发(challenge)期间肺炎链球菌(s.pneumoniae)感染的可能性或严重性。
实施例
提供以下实施例以说明本公开并且它们仅是出于说明的目的并且不应视为对本公开范围的限制。
实施例1:单种肺炎球菌多糖与载体蛋白的缀合以形成多糖-psaa缀合物
a)psaa的制备:
从肺炎链球菌(streptococcuspneumoniae)血清型4pcr扩增psaa基因,但是不含其疏水性前导肽序列。对该基因序列验证并使用自有(in-house)构建的载体(pbe66)将其克隆至大肠杆菌(e.coli)中用于更高的表达。
在150ml锥形烧瓶中、在含有1ml甘油贮存液的20ml的lb培养基上复苏编码psaa基因的甘油贮存液培养物。将培养物在37℃,200rpm下培育约6小时至最终od600nm达到3.5od。将复苏的培养物转移至5l锥形烧瓶中的1l种子培养物中。将培养物在37℃,200rpm下生长约10小时至最终od600nm达到3。
将种子培养物无菌转移至含有以下培养基组分的20l发酵罐中:hypeptone6g/l、酵母提取物12g/l、磷酸氢二钾13.5g/l、磷酸氢二铵4g/l、柠檬酸1.7g/l、mgso4.7h2o1.2g/l、葡萄糖4g/l、盐酸硫胺10mg/l以及1ml/l微量元素(例如,用于100ml组合物的微量元素,fecl32.7g、zncl20.2g、cocl2.6h2o0.2g、na2moo4.2h2o0.2g、cuso4.5h2o0.1g、硼酸0.05g、cacl2.2h2o0.1g、浓盐酸10ml)。初始发酵从od600nm为0.2od开始。在发酵期间,用20%的磷酸和12.5%的氢氧化铵将ph保持在7±0.2。
当葡萄糖水平降低至低于0.5g/l时,以3-4g/l/hr的稳定速率起始分批补料,在发酵期间用富氧(oxygenenrichment)将do%维持>20%。
使细胞在发酵罐中生长并通过离心收获细胞颗粒。使用破环细胞的装置(panda)裂解细胞。将裂解液在10000g离心,并对澄清的上清液进行纯化。
类似于在larentis等人,2011(proteinexpressionandpurification78(2011)38)中所描述的程序进行psaa纯化。在deae之后使用混合模式色谱(ii型陶瓷羟基磷灰石)进一步优化纯化以获得更高纯度的psaa。
阴离子交换色谱:将30ml的deaesepharose(ge)树脂装填至xk16/20柱。用5倍柱体积的无菌蒸馏水,然后用10倍柱体积的20mmtris,1mmedta,ph8.0(平衡缓冲液)清洗树脂。用平衡缓冲液将30ml上清液稀释至100ml,并加载至柱上,收集流过液。用5倍体积的平衡缓冲液清洗柱。用12倍体积的(0-100%b)的线性梯度洗脱psaa。(缓冲液a含有20mmtris,1mmedta,ph8.0;缓冲液b含有20mmtris,1mmedta,250mmnacl,ph8.0)。在此之后,用20mmtris,1mmedta,1mnaclph8.0清洗柱。
混合模式色谱:将25mlii型陶瓷羟基磷灰石(cht-ii)装柱。用大量无菌蒸馏水,然后用10体积的20mmtrisph6.8清洗树脂。将在sdspage上显示出良好浓度的、约37kd的清晰的主可见条带的来自deae树脂的洗脱级分汇集并加载至cht-ii树脂。收集流过液并用5倍柱体积的平衡缓冲液清洗柱。用5倍柱体积的分步梯度(15%b、20%b、50%b和100%b)洗脱蛋白。缓冲液a含有20mmtrisph6.8,而缓冲液b含有250mm磷酸盐缓冲液ph6.8。
将在psaa预期尺寸显示出清晰条带的所有洗脱级分混合,通过10kdamwco盒浓缩并对20mm磷酸盐缓冲液ph7.5进行渗滤。将纯化的蛋白加载至sds-page凝胶以评价纯度。
b)肺炎球菌多糖血清型3的激活和与psaa的缀合
将尺寸减少的血清型3多糖(浓度5mg/ml)和1.5ml的cdap(100mg/ml的乙腈溶液(w/v))在玻璃瓶中以1:0.5(ps:cdap)的比例混合并搅拌1min。用3.5ml的0.2m三乙胺将多糖溶液的ph调至9.0,并在室温下(rt)搅拌1min。将210mgpsaa(14.0ml,15.0mg/ml浓度)以1:0.7(ps:载体蛋白)的比例缓慢添加至激活的多糖。
用0.7ml的0.2m三乙胺将反应ph调至约9.01,并且边搅拌,边在室温下继续反应5小时,然后通过添加过量浓度的甘氨酸(100mm)使反应淬灭。在反应的每个小时,使用sec-hplc监控缀合反应动力学。
使用100kdamwcotff膜渗滤和浓缩反应混合物。通过尺寸-排阻色谱纯化浓缩物。通过sec-malls、蒽酮法分析各级分,并将含有缀合物的级分汇集并使用0.2μm过滤器无菌过滤。
c)肺炎球菌多糖血清型6a的激活和与psaa的缀合
将尺寸减小的6a型多糖(浓度14.6mg/ml)和400μl的cdap(100mg/ml的乙腈溶液(w/v))在玻璃瓶中以1:1(ps:cdap)的比例混合并搅拌1min。用800μl的0.2m三乙胺将多糖溶液的ph调至9.5,并在室温下(rt)搅拌1min。将40mgpsaa(3.78ml,11.0mg/ml浓度)以1:1(ps:载体蛋白)的比例缓慢添加至激活的多糖。
用0.7ml的0.2m三乙胺将反应ph调至约9.01,并且边搅拌,边在室温下继续反应5小时,然后通过添加过量浓度的甘氨酸(100mm)使反应淬灭。在反应的每个小时,使用sec-hplc监控缀合反应动力学。
使用100kdamwcotff膜渗滤和浓缩反应混合物。通过尺寸-排阻色谱纯化浓缩物。通过sec-malls、蒽酮法分析各级分,并将含有缀合物的级分汇集并使用0.2μm过滤器无菌过滤。
d)肺炎球菌多糖血清型6b的激活和与psaa的缀合
将尺寸减小的6b型多糖(浓度14.97mg/ml)和4.0ml的cdap(100mg/ml的乙腈溶液(w/v))在玻璃瓶中以1:2(ps:cdap)的比例混合并搅拌1min。用8.0ml的0.2m三乙胺将多糖溶液的ph调至9.1,并在室温下(rt)搅拌1min。将340mgpsaa(22.66ml,15.0mg/ml浓度)以1:1.7(ps:载体蛋白)的比例缓慢添加至激活的多糖。
用0.7ml的0.2m三乙胺将反应ph调至约9.01,并且边搅拌,边在室温下继续反应5小时,然后通过添加过量浓度的甘氨酸(100mm)使反应淬灭。在反应的每个小时,使用sec-hplc监控缀合反应动力学。
使用100kdamwcotff膜渗滤和浓缩反应混合物。通过尺寸-排阻色谱纯化浓缩物。通过sec-malls、蒽酮法分析各级分,并将含有缀合物的级分汇集并使用0.2μm过滤器无菌过滤。
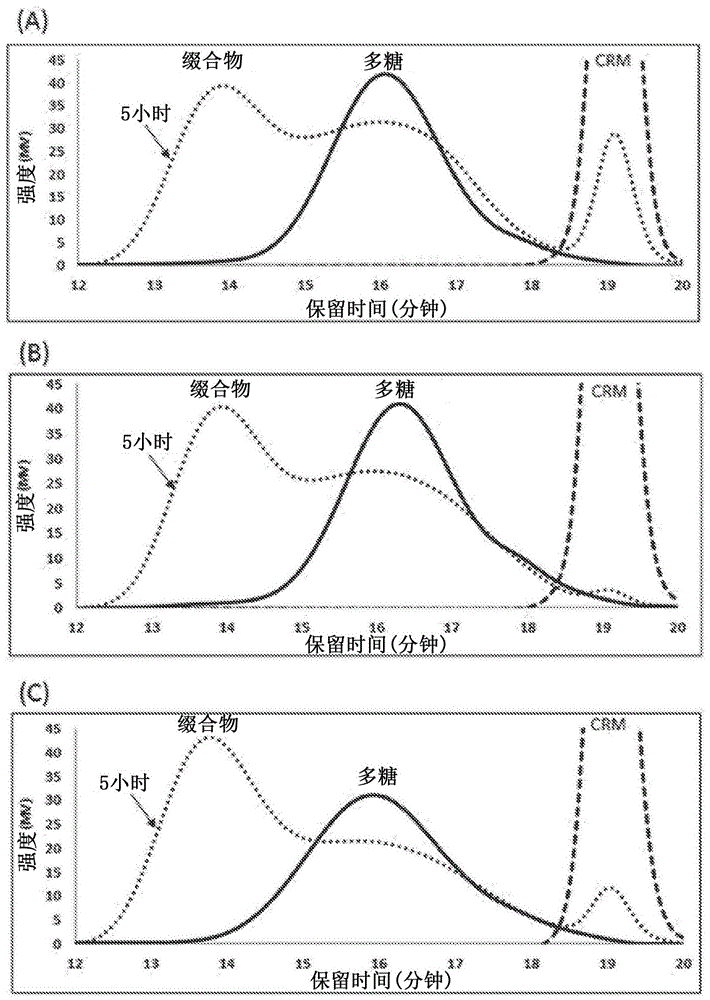
对于血清型3(d)、6a(e)和6b(f)的缀合反应动力学实施了sec-hplc色谱。将以下符号用于全部三个色谱;多糖(实线)、psaa(虚线)、3或5小时反应(点线)。对于全部色谱图,如图2所示,基于在约19分钟的保留时间处属于psaa的峰值的减小或消失表明了psaa的消耗。基于在约13.5分钟至约14分钟处新的峰的形成确认了缀合。
使用类似于如上所描述的程序制备了来自血清型5、9v、12f、10a、15b、18c和45的肺炎球菌多糖与psaa的缀合物。对于血清型5(a)、9v(b)和18c(c)的缀合反应动力学实施了sec-hplc色谱。如图2全部三个色谱图所示,多糖(实线)、psaa(虚线)、3或5小时反应(点线)。在全部色谱图中,基于在约19分钟的保留时间处属于psaa的峰的减小或消失表明了psaa的消耗。基于约13.5分钟至约14分钟处的新的峰的形成确认了缀合。
实施例2:肺炎球菌荚膜多糖-crm197缀合物的制备
a)多糖的激活以及与载体蛋白的缀合
将尺寸分级的多糖(6.0ml的ps,浓度10mg/ml)和cdap(100mg/ml的乙腈溶液(w/v))在玻璃小瓶中以1:1的比例混合并搅拌1min。用0.2m三乙胺将多糖溶液的ph调至9.25,并在室温下(rt)搅拌3min。将crm197(4.0ml,15.0mg/ml浓度)以1:1(ps:载体蛋白)的比例缓慢添加至激活的多糖。
用0.2m三乙胺将反应的ph调至约9.05,并且在室温下随着搅拌继续反应5小时,并且最终通过添加过量浓度的甘氨酸使反应淬灭。
使用100kmwco膜渗滤反应混合物并通过尺寸-排阻色谱纯化。通过sec-malls、蒽酮法分析各级分,并将含有缀合物的级分汇集并使用0.2μm过滤器无菌过滤。该材料被称为一价缀合物主体(bulk)。
做出了从血清型7f(a)、14(b)和19f(c)与crm197制备的缀合物的反应动力学,并且在图1中显示了所述反应动力学。在全部三个色谱图中,显示了多糖(实线)、crm197(虚线)、5小时反应(点线)。在全部色谱图中,基于约19分钟的保留时间处属于crm197的峰值的减小或消失表明了crm197的消耗。基于约13.5分钟至约14分钟处新的峰的形成确认了缀合。
做出了从血清型3(d)、6a(e)和6b(f)与crm197制备的缀合物的反应动力学,并且在图1中显示了所述反应动力学。在全部三个色谱图中,显示了多糖(实线)、crm197(虚线)、5小时反应(点线)。在全部色谱图中,基于约19分钟的保留时间处属于crm197的峰值的减小或消失表明了crm197的消耗。基于约13.5分钟至约14分钟处新的峰的形成确认了缀合。
实施例3:肺炎球菌荚膜多糖-蛋白缀合物疫苗的配制
将15价缀合疫苗配制为0.5ml剂量,其含有缀合至~28μg的crm197蛋白的2.2μg来自血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f的每种肺炎球菌多糖和缀合至约7μg的psaa蛋白的2.2μg来自血清型3、6a和6b的每种多糖。对于每个0.5ml剂量,将所有缀合物吸附到相当于0.5mgal3+的磷酸铝凝胶上。将0.9%w/v盐水用作配制的稀释剂和媒介物,并且使用1n盐酸将最终制剂ph调节至ph6。对于调节ph后的有效吸附,将制剂在恒定搅拌下混合2小时。在共混2小时之后,将所配制的共混物以每小瓶0.58ml填充体积无菌填充至3ml无菌非硅化小瓶中,用13mm橡皮塞无菌封闭并用13mm无菌粉红色翻盖铝密封盖密封,然后对填充小瓶进行光学检验和标记。从该批次,将随机挑取的一些小瓶送去分析外观、ph、渗透压、总多糖和蛋白含量(μg/shd)、%吸附、铝含量(mg/shd)。
实施例4:肺炎球菌荚膜多糖-蛋白缀合物疫苗的配制
将15价缀合疫苗配制为0.5ml剂量,其含有缀合至~28μg的crm197蛋白的2.2μg来自血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f&33f的每种多糖和缀合至~14μg的psaa蛋白的4.4μg来自血清型3、6a和6b的每种多糖。对于每0.5ml剂量,将所有缀合物吸附到相当于0.5mgal3+的磷酸铝凝胶上。将0.9%w/v盐水用作配制的稀释剂和媒介物,并且使用1n盐酸将最终制剂ph调节至ph6。对于调节ph后的有效吸附,将制剂在恒定搅拌下混合2小时。在共混2小时之后,将所配制的共混物以每小瓶0.58ml填充体积无菌填充至3ml无菌非硅化小瓶,用13mm橡皮塞无菌封闭并用13mm无菌粉红色翻盖铝密封盖密封,然后对填充小瓶进行光学检验和标记。从该批次,将随机挑取的一些小瓶送去分析外观、ph、渗透压、总多糖和蛋白含量(μg/shd)、%吸附、铝含量(mg/shd)。
a)用配制疫苗使兔免疫
将1.5至2kg的健康兔在无特异病原的机构中繁殖和饲养。按照以下时间表,用上述制剂使兔免疫。
第1组由7只用15价缀合物疫苗(实施例3)免疫的兔组成。所述15价疫苗由缀合至crm197的2.2μg血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f、33f的每种肺炎链球菌(s.pneumoniae)多糖和缀合至psaa的2.2μg血清型3、6a和6b的每种肺炎链球菌(s.pneumoniae)多糖组成。在第1、15和29天使兔免疫;在第0、15和36天采集血液样品。从血液样品分离血清并储存在-80℃。
第2组由7只用13价缀合物疫苗-
第3组由7只用15价缀合物疫苗(实施例4)免疫的兔组成。所述15价疫苗含有缀合至~28μg的crm197蛋白的2.2μg来自每种血清型1、4、5、7f、9v、14、18c、19a、19f、22f、23f和33f的多糖和缀合至~14μg的psaa蛋白的4.4μg来自血清型3、6a和6b的每种多糖。在第1、15和29天使兔免疫;在第0、15和36天采集血液样品。从血液样品分离血清并储存在-80℃。使用elisa,对得自免疫兔的血清分析血清型特异性免疫应答。
根据who建议的规程进行elisa。简要地,用给定血清型的pncps(1μg/50μl/孔,使用pbs;无菌不含内毒素,添加0.02%叠氮化钠)涂覆maxisorptmelisa板。将板置于具有用于加湿的湿纸巾的盒中并在37℃±2℃培育5小时,然后将板在5℃±3℃储存直至使用。
将测试血清预吸附至cwpsmltitm以消除来源于细胞壁多糖的背景反应性。为了实现该2μl测试,使用998μl预吸附溶液(1ml-1μlcwpsmultitm加入999μl10%superblocktm在pbst中的溶液)稀释阳性对照血清以获得1:500的最终稀释。通过连续振荡,将稀释样品在室温下(25℃±5℃)培育1小时。通过轻打所述板除去未结合的pncps,并且通过添加200μl封闭剂(20%superblocktm在pbs中的溶液)封闭所述孔中的游离位点。在不振荡的情况下,将板在室温下(25℃±5℃)培育1小时。
b)测试样品和对照的添加
除了a1至a12以外,将50μl稀释剂(10%superblocktm在pbst中的溶液)加入至所有孔中。在将该100μl/孔预吸附的测试血清样品加入至a1至a10之后,将对照血清样品加入至a11和a12。通过将50μl从第1转移至第2,即从a1-a10至h1-h10对测试样品进行两倍连续稀释。类似地,实施了从a11和12至e11和e12的对照样品(007sp)的连续稀释。将未稀释的f11和f12至h11和h12设置为空白。
在不振荡的情况下,将板在室温下(25℃±5℃)培育2小时。在培育步骤之后,弃去内容物并用pbst(250μl/孔)手动或用板清洗器清洗板三次。
c)第一抗体的添加
将50μl/孔的重组蛋白a/g过氧化物酶(使用10%superblocktm在pbst中的溶液1:20000稀释)加入至所有孔中,并且在不振荡的情况下,将所述板在室温下(25℃±5℃)培育1小时。在此之后,用pbst(250μl/孔)手动或用板清洗器清洗板三次。
d)显色和读数
通过添加50μl/孔tmb底物并在不振荡的情况下,在室温下(25℃±5℃)培育15min来进行显色反应。通过添加50μl/孔的1.25m硫酸终止反应。测量450nm处的od。
e)滴度估计
将经免疫的动物中的抗体滴度指定为稀释系数的倒数。将示出为免疫前滴度(约0.2)两倍的od450nm的最大稀释报告为滴度。将血清抗体对每种血清型的滴度作图并与不同处理组相比较。
第1组动物的免疫应答数据显示血清抗体滴度中血清型特异性升高中的剂量依赖性升高,即抗体滴度水平随接种动物中的每个后续剂量而升高。当用含有4.4μg多糖的psaa缀合物(第3组)免疫动物时,对血清型3的免疫应答(图5)为约1:10000。此外,当与得自
除非另外明确表明,否则本发明申请中所指明的数值的使用是作为所述范围内所指明的最小值至最大值的近似说明的并且之前放置单词“约”。范围的公开旨在作为连续范围,其包括所列最小值和最大值之间的每个值以及通过这些值可以形成的任何范围。本发明申请中所存在的数值表示本公开的多个实施方式。
在整个发明公开中,除非上下文中明确规定,否则单数术语“一个(a)”、“一种(an)”和“该(the)”包括复数对象。类似地,除非单词“或者”明确限制于对于两个或更多个项目的列表,仅表示排斥其他项目的单一项目,否则在该列表中“或者”的使用将被理解为包括(a)列表中的任何单一项目,(b)列表中的所有项目,或者(c)列表中项目的任何组合。另外,在本公开中使用术语“包括”等来表示包括至少所列举的特征,从而不排除任何更大数目的相同特征和/或一种或多种其他类型的特征。在本文中,对于“一个实施方式”、“实施方式”或类似陈述的提及表示结合实施方式所述的组合物的具体特征、组成、方法或特征可以包含在本技术的至少一种实施方式中。因此,在本文中这些短语或陈述的出现不必需全部涉及相同实施方式。此外,可以在一个或多个实施方式中以任何适合的方式组合多种具体特征、组成、方法或特征。
本公开不意欲是穷举的或者将本技术限制于本文所公开的精确形式。尽管出于说明性目的,在本文中公开了具体实施方式,但是在不背离本技术的情况下,多种等价改变是可能的,如相关领域的常规技术人员将认识到的。在一些情况下,未详细显示和/或描述熟知的结构和功能以避免对本技术实施方式描述的不必要模糊。尽管在本文中以具体顺序提供了方法步骤,但是在替代性实施方式中,所述步骤可以具有另一种适合的顺序。类似地,可以在其他实施方式中组合或去除在特定实施方式的背景中公开的本技术的某些实施方式。此外,尽管可以在那些实施方式的背景中公开与某些实施方式有关的优势,但是其他实施方式也可以显示出这些优势,并且并非所有实施方式需要必需显示出本文所公开的这些优势或者其他优势以处于本技术的范围内。因此,本公开和相关技术可以涵盖在本文中未明确显示和/或描述的其他实施方式。
根据上述内容,应理解尽管本文已出于说明目的描述了本公开的具体实施方式,但是在不背离本公开的范围情况下,可以进行多种改变。因此,除所附权利要求之外,本公开是不受限制的。
- 还没有人留言评论。精彩留言会获得点赞!