p53分解诱导分子和药物组合物的制作方法
本发明涉及p53分解诱导分子和药物组合物。
背景技术:
p53蛋白是与细胞老化、细胞周期的停止、凋亡的诱导等相关的蛋白质,响应引起dna损伤的应激(活性氧、辐射线等)等而被活化。
目前已知在阿尔茨海默氏病、帕金森氏病等神经系统疾病或脑中风等缺血性损伤中,p53蛋白的表达亢进,诱导神经细胞死亡。另外,已知由于p53蛋白的表达亢进而使心脏中的血管新生功能降低等,由此促进心脏功能障碍的发病。另外,已知p53蛋白的表达增强而使胰岛β细胞中的线粒体功能降低等,由此使胰岛素分泌功能降低,促进糖尿病的发病。
进而,已知在制作再生医疗中使用的多能干细胞(例如,ips细胞(inducedpluripotentstemcell,诱导多能干细胞))时,需要抑制p53基因的表达。
因此,在各种疾病的治疗和再生医疗中,研究了减少p53蛋白的量(表达)的方法论。
另外,可认为通过使p53蛋白活化,而诱发已癌变的细胞的增殖抑制和凋亡的诱导,从而可抑制癌症。然而,已知人的癌症中p53蛋白以50%以上的比例突变,癌细胞的增殖抑制和凋亡的诱导这样的功能有所降低。
因此,在癌症治疗中,研究了减少突变型p53蛋白的量(表达)的方法论。
一直以来,作为在rna水平操控靶蛋白的量的技术,已知有使用sirna(smallinterferingrna,小干扰rna)分解靶蛋白的mrna的rnai(rnainterference,rna干扰)技术。
另外,作为在蛋白质水平操控靶蛋白的量的技术,已知使用将与靶蛋白结合的分子和与泛素连接酶(e3)结合的分子连接而成的复合物的技术(例如,参照专利文献1~2、非专利文献1~3)。该技术借助上述复合物将靶蛋白与泛素连接酶连结而使靶蛋白特异性地泛素化,从而引导对靶蛋白进行由蛋白酶体导致的分解。上述复合物有时也被称为sniper(specificandnongeneticiap-dependentproteineraser,特定和非遗传依赖的蛋白质橡皮擦,)、protac(proteolysistargetingchimera,针对嵌合体的蛋白质分解,)等。
现有技术文献
专利文献
专利文献1:日本特开2013-056837号公报
专利文献2:美国专利第7208157号说明书
非专利文献
非专利文献1:itoh,y.etal.,"developmentoftargetprotein-selectivedegradationinducerforproteinknockdown.",bioorg.med.chem.,2011,19,3229-3241
非专利文献2:demizu,y.etal.,"designandsynthesisofestrogenreceptordegradationinducerbasedonaproteinknockdownstrategy.",bioorg.med.chem.lett.,2012,15,1793-1796
非专利文献3:hines,j.etal.,"posttranslationalproteinknockdowncoupledtoreceptortyrosinekinaseactivationwithphosphoprotacs.",proc.natl.acad.sci.u.s.a.,2013,110(22),8942-8947
技术实现要素:
发明要解决的问题
然而,rnai技术有脱靶效应(targetoff)问题,难以特异性地控制靶蛋白的量。另外,rnai技术中,sirna的递送困难,应用于药物时问题较多。
另一方面,使用将与靶蛋白结合的分子和与泛素连接酶结合的分子连接而成的复合物的技术、与rnai技术相比容易应用于药物中。然而,将靶蛋白泛素化的方法存在如下问题点。
(1)泛素连接酶有很多种类,具有靶特异性。因此,为了将特定的靶蛋白泛素化,例如,需要根据靶蛋白来设计分子等分别进行对应。
(2)较难控制泛素化信号。例如,已知蛋白质的泛素化除了蛋白质的分解以外、与分化、癌变等的信号相关。另外,已知蛋白质的泛素化具有组织特异性和时间特异性。因此,推测出有时靶蛋白的泛素化成为其它信号而不是靶蛋白的分解的信号。
(3)有时泛素或泛素化酶存在问题。例如,有时由于突变等而使泛素、泛素化酶无法正常发挥作用(发生故障)而成为疾病原因的情况也较多。因此,推测出有时靶蛋白的泛素化不诱导靶蛋白的分解。
目前通常作为药品设计了抑制剂、活化剂等。然而,p53蛋白是作为无成药性的靶标(undruggabletarget)而出名的转录因子,至今尚未实现创制。
鉴于上述情况,本发明的目的在于提供能诱导p53蛋白或p53复合物分解的p53分解诱导分子、及包含该p53分解诱导分子的药物组合物。
用于解决问题的方案
上述课题用于解决的具体的手段包括以下的实施方式。
<1>一种p53分解诱导分子,其能诱导p53蛋白或p53复合物的分解,所述p53分解诱导分子是p53亲和性分子与蛋白质分解诱导标签的缀合物,所述p53亲和性分子对p53蛋白或p53复合物具有亲和性,所述蛋白质分解诱导标签对蛋白酶具有亲和性且不抑制由蛋白酶导致的蛋白质分解。
<2>根据<1>所述的p53分解诱导分子,其其能非泛素依赖性地诱导所述p53蛋白或p53复合物的分解。
<3>根据<1>或<2>所述的p53分解诱导分子,其中,所述蛋白质分解诱导标签具有使蛋白酶抑制剂的蛋白酶抑制活性失活的结构。
<4>根据<1>~<3>中任一项所述的p53分解诱导分子,其中,所述蛋白酶为蛋白酶体。
<5>根据<4>所述的p53分解诱导分子,其中,所述蛋白质分解诱导标签具有使蛋白酶体抑制剂的蛋白酶体抑制活性失活的结构。
<6>根据<5>所述的p53分解诱导分子,其中,所述蛋白酶体抑制活性为对选自胱天蛋白酶样活性、胰蛋白酶样活性和胰凝乳蛋白酶样活性中的至少1种的抑制活性
<7>一种药物组合物,其包含<1>~<6>中任一项所述的p53分解诱导分子。
<8>根据<7>所述的药物组合物,其用于p53蛋白所介导的疾病或症状的预防或治疗。
<9>根据<8>所述的药物组合物,其中,所述p53蛋白所介导的疾病或症状为癌症、细胞老化、神经系统疾病、神经细胞死亡、糖尿病或心脏功能障碍。
<10>根据<9>所述的药物组合物,其中,所述p53蛋白所介导的疾病或症状为细胞老化。
发明的效果
根据本发明,可以提供能诱导p53蛋白或p53复合物分解的p53分解诱导分子、及包含该p53分解诱导分子的药物组合物。
附图说明
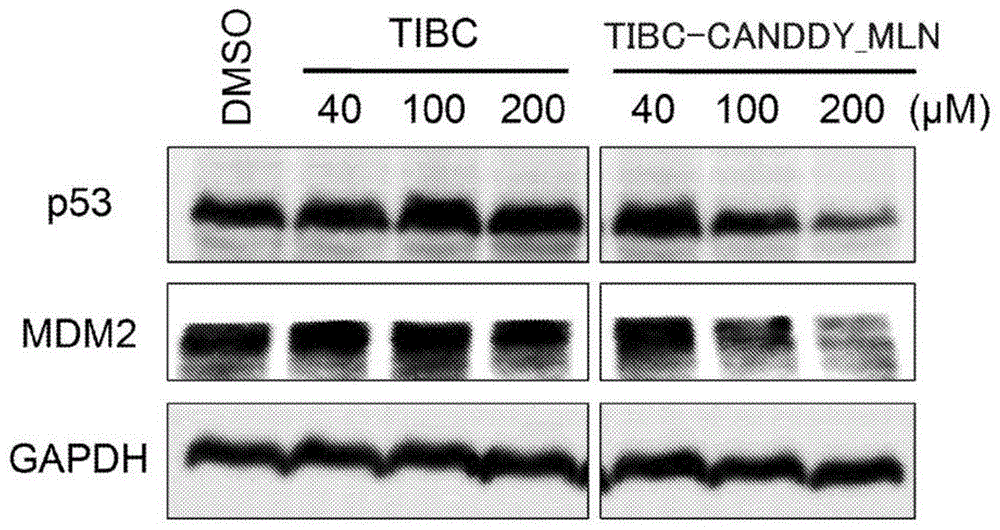
图1是示出对于添加了tibc-canddy_mln的hct116细胞中的内源的野生型p53蛋白和mdm2蛋白的分解(敲低),通过免疫印迹分析进行评价的结果的图。
图2是示出对于添加了tibc-canddy_mln的hela细胞中的内源的野生型p53蛋白的分解(敲低),通过免疫印迹分析进行评价的结果的图。
图3是示出对于对小鼠个体给予tibc-canddy_mln时的肝脏中的野生型p53蛋白和mdm2蛋白的分解(敲低),通过免疫印迹分析进行评价的结果的图。
图4是示出对于添加了tibc-canddy_mln的老化相关酸性β-半乳糖苷酶(sa-β-gal)诱导tig3细胞中的抗老化作用,通过facs(fluorescenceactivatedcellsorting,荧光激活细胞分选术)解析进行评价的结果的图。
图5a是示出tmp-canddy_dmt和mg-132对蛋白酶体的催化亚基β1的抑制活性的图。
图5b是示出tmp-canddy_dmt和mg-132对蛋白酶体的催化亚基β2的抑制活性的图。
图5c是示出tmp-canddy_dmt和mg-132对蛋白酶体的催化亚基β5的抑制活性的图。
图6是示出对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_dmt的分解(敲低),通过facs解析进行评价的结果的图。
图7a是示出对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_dmt的分解(敲低),通过免疫印迹分析进行评价的结果的图。
图7b是示出对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_dmt的分解(敲低),通过免疫印迹分析进行评价的结果的图。
图8a是示出tmp-canddy_alln和alln对蛋白酶体的催化亚基β1的抑制活性的图。
图8b是示出tmp-canddy_alln和alln对蛋白酶体的催化亚基β2的抑制活性的图。
图8c是示出tmp-canddy_alln和alln对蛋白酶体的催化亚基β5的抑制活性的图。
图9是示出对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_alln的分解(敲低),通过facs解析进行评价的结果的图。
具体实施方式
以下详细说明本发明的实施方式。但是,本发明不受以下实施方式限定。
本说明书中用“~”示出的数值范围表示将记载于“~”的前后的数值分别作为最小值和最大值而包含的范围。
本说明书中氨基酸用本技术领域中公知的一个字母(例如,甘氨酸为“g”)标记或三个字母(例如,甘氨酸为“gly”)标记。
<p53分解诱导分子>
本发明的p53分解诱导分子能够诱导p53蛋白或p53复合物的分解,所述p53分解诱导分子是p53亲和性分子与蛋白质分解诱导标签的缀合物,所述p53亲和性分子对p53蛋白或p53复合物具有亲和性,所述蛋白质分解诱导标签对蛋白酶具有亲和性且不抑制由蛋白酶导致的蛋白质分解。利用本发明的p53分解诱导分子,不通过p53蛋白或p53复合物的泛素化(即,非泛素依赖性)、而够引导通过蛋白酶(例如,蛋白酶体)进行的p53蛋白或p53复合物的分解(敲低)。
需要说明的是,四泛素链(ub4)等多聚泛素链或泛素样结构域(ubl)有作为蛋白质分解诱导标签发挥作用的可能性,但将多聚泛素链或泛素样结构域作为蛋白质分解诱导标签的情况下,通过p53亲和性分子使p53蛋白或p53复合物间接地泛素化。本说明书中,这种p53蛋白或p53复合物的间接性泛素化也包含在p53蛋白或p53复合物的泛素化中。
(p53亲和性分子)
构成本发明的p53分解诱导分子的p53亲和性分子是对p53蛋白或p53复合物具有亲和性的分子。
作为p53复合物,可没有特别限制地列举出:p53/mdm2复合物(p53蛋白与mdm2蛋白的复合物。以下同样)、p53/e6复合物、p53/hdm2复合物、p53/aicd复合物、p53/runx2复合物、p53/runx3复合物等、和已知与p53蛋白相互作用的公知的分子的复合物。
在此,对p53复合物具有亲和性的分子包含如下分子:对与p53蛋白形成复合物的分子(mdm2蛋白等)具有亲和性的分子、及对所形成的复合物具有亲和性的分子。
p53蛋白可以是野生型或突变型。作为突变型,例如可列举出:r175h突变型(从n末端起第175位的氨基酸残基的精氨酸(r)突变为组氨酸(h)。以下同样)、r110l和r248w突变型、v157f突变型、s166y突变型、l194f突变型、r213q和m237h突变型、g245v突变型、g245s突变型、r248q突变型、r248w突变型、i254d突变型、l264l突变型、r273h和p309s突变型、r273c突变型、r280k突变型、r282w突变型、r273h突变型、s176y和r248w突变型、v173a突变型、r249s突变型、y220c突变型、v272m突变型、g266q突变型、g175e突变型、s241f突变型等。
目前已知在阿尔茨海默氏病、帕金森氏病等神经系统疾病或脑中风等缺血性损伤中,p53蛋白的表达亢进,诱导神经细胞死亡。
另外,已知在心脏功能障碍、糖尿病等疾病中,心脏组织、胰脏组织等中的p53蛋白的表达量增加,已知通过给予对p53蛋白的抑制剂来改善这些疾病。
另外,还指出p53蛋白作为老化因子与起因于生活习惯病的动脉硬化、代谢异常等相关。
进而,已知在制作再生医疗中使用的多能干细胞(例如,ips细胞)时,需要抑制p53基因的表达。
因此,作为优选的p53亲和性分子的一例,可列举出:与野生型(正常型)p53蛋白或野生型(正常型)p53复合物(野生型p53蛋白与对野生型p53蛋白具有亲和性的分子的复合物)具有亲和性的物质。由于p53亲和性分子与野生型p53蛋白或野生型p53复合物具有亲和性,因此能够引导对该野生型p53蛋白或野生型p53复合物进行由蛋白酶(例如,蛋白酶体)导致的分解(敲低)。作为结果,可认为包含对野生型p53蛋白或野生型p53复合物具有亲和性的p53亲和性分子的p53分解诱导分子在预防或治疗神经系统疾病(包括由脑中风等导致的神经细胞死亡)、心脏功能障碍、糖尿病等各种疾病及制作前述的多能干细胞中是有用的。
另外,已知p53蛋白在人的癌症中高频率地突变,突变型p53蛋白抑制野生型p53蛋白的作用,抑制由野生型p53蛋白导致的癌细胞的增殖抑制和凋亡的诱导。
因此,作为优选的p53亲和性分子的其它例,可列举出:与突变型p53蛋白或突变型p53复合物(突变型p53蛋白与对突变型p53蛋白具有亲和性的分子的复合物)具有亲和性的物质。由于p53亲和性分子对突变型p53蛋白或突变型p53复合物具有亲和性,因此能够引导对该突变型p53蛋白或突变型p53复合物进行由蛋白酶(例如,蛋白酶体)导致的分解(敲低)。作为结果,可认为包含对突变型p53蛋白或突变型p53复合物具有亲和性的p53亲和性分子的p53分解诱导分子在癌症等各种疾病的预防或治疗中是有用的。
需要说明的是,对于将前述的靶蛋白泛素化的方法,可认为仅使构成p53复合物的1个蛋白泛素化,p53复合物分裂为各种蛋白质后,仅使经泛素化的蛋白质分解。相对于此,包含对p53复合物具有亲和性的p53亲和性分子的p53分解诱导分子在能够分解p53复合物本身方面是非常有用的。
本说明书中“对p53蛋白或p53复合物具有亲和性”是指例如能够与p53蛋白或p53复合物通过共价键、氢键、疏水键、范德华力等结合。已知与p53蛋白或p53复合物相互作用的其它分子(蛋白质、肽、抗体、dna、rna、代谢产物、低分子化合物等)与p53蛋白或p53复合物的相互作用在由于某分子而浓度依赖性地受到影响时,可以判断该分子对p53蛋白或p53复合物具有亲和性。
作为p53亲和性分子,可列举出低分子化合物、天然物、肽、抗体等。需要说明的是,本发明中,抗体除了包含2条h链和2条l链的所谓免疫球蛋白(ig)以外,还包含ig的fab片段、f(ab’)片段等包含抗体中的可变部位的片段等。对于p53亲和性分子的分子量,低分子化合物的情况例如优选50~5000的范围。
p53亲和性分子的结构只要对p53蛋白或p53复合物具有亲和性就没有特别限制。作为p53亲和性分子,可以使用对p53蛋白具有亲和性的p53抑制剂或p53活化剂、对p53/mdm2复合物具有亲和性的mdm2抑制剂、p53/mdm2复合物的ppi(蛋白质间相互作用)抑制剂等。另外,p53亲和性分子还可以从候补分子中通过筛选而得到。
将p53亲和性分子的一例示于以下的表1~表7。其中,能用于本发明的p53分解诱导分子的p53亲和性分子不限定于这些例子。对于p53亲和性分子,根据需要可以参照现有的数据库(bindingdb(https://www.bindingdb.org/bind/index.jsp)、pcidb(http://www.tanpaku.org/pci/pci_home.html)、protchemsi(http://pcidb.russelllab.org/)等)的信息。
[表1]
[表2]
[表3]
[表4]
[表5]
[表6]
[表7]
(蛋白质分解诱导标签)
构成本发明的p53分解诱导分子的蛋白质分解诱导标签是对蛋白酶具有亲和性且不抑制由蛋白酶导致的蛋白质分解的分子。以下,也将该蛋白质分解诱导标签称为cikd(chemicalinteractionsandknockdown,化学相互作用和敲低)标签或canddy(chemicalaffinitiesanddegradationdynamics,化学亲和性和降解动力学)标签。
作为蛋白酶,没有特别限定,可以列举具有蛋白酶活性的所有分子。例如,可以是蛋白酶体之类的复合物型蛋白酶,也可以是除了蛋白酶体以外的蛋白酶。另外,只要具有蛋白酶活性则也可以是蛋白酶体的一部分。
作为蛋白酶体,可以列举例如26s蛋白酶体、免疫蛋白酶体和胸腺蛋白酶体。
26s蛋白酶体是在20s蛋白酶体结合有2个19s蛋白酶体而成的物质。20s蛋白酶体呈现出由α1~α7的7个亚基构成的α环与由β1~β7的7个亚基构成的β环按照αββα的顺序堆叠而成的筒状结构,β1、β2和β5分别发挥胱天蛋白酶样活性、胰蛋白酶样活性和胰凝乳蛋白酶样活性这样的催化活性。
免疫蛋白酶体是催化亚基β1、β2和β5分别被置换为β1i、β2i和β5i而成的蛋白酶体(science,1994,265,1234-1237)。
胸腺蛋白酶体是与β1i和β2i一起还组入了在胸腺皮质上皮细胞(ctec)所特异性表达的β5t的蛋白酶体(science,2007,316,1349-1353)。
另外,作为除了蛋白酶体以外的蛋白酶,可以列举:β-分泌酶、γ-分泌酶、氨肽酶、血管紧张素转化酶、菠萝蛋白酶、钙蛋白酶i、钙蛋白酶ii、羧肽酶a、羧肽酶b、羧肽酶p、羧肽酶y、胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶5、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、胱天蛋白酶13、组织蛋白酶b、组织蛋白酶c、组织蛋白酶d、组织蛋白酶g、组织蛋白酶l、胰凝乳蛋白酶、梭菌蛋白酶、胶原酶、补体c1r、补体c1s、补体b因子、补体d因子、二肽基肽酶i、二肽基肽酶ii、二肽基肽酶iv、分散酶、弹性蛋白酶、内切蛋白酶arg-c、内切蛋白酶glu-c、内切蛋白酶lys-c、无花果蛋白酶、粒酶b、激肽释放酶、亮氨酸氨肽酶、基质金属蛋白酶、金属蛋白酶、木瓜蛋白酶、胃蛋白酶、纤溶酶、胱天蛋白酶原3、链霉蛋白酶e、蛋白酶k、肾素、嗜热菌蛋白酶、凝血酶、胰蛋白酶、细胞质丙氨酰氨肽酶、脑啡肽酶、神经内肽酶等。
本说明书中,“对蛋白酶具有亲和性”是指例如能够与蛋白酶通过共价键、氢键、疏水键、范德华力等结合。在某分子的存在下蛋白酶的热稳定性改变时,可以判断该分子对蛋白酶具有亲和性。
另外,本说明书中,“不抑制由蛋白酶导致的蛋白质分解”是指例如不与蛋白酶的分解活性位点形成共价键。即便在某分子的存在下蛋白质也会被蛋白酶分解,进而在蛋白酶抑制剂共存时蛋白质分解受到抑制的情况下,可以判断为该分子不抑制由蛋白酶导致的蛋白质分解。
作为蛋白质分解诱导标签,可以列举低分子化合物、天然物质、肽等。蛋白质分解诱导标签的分子量例如优选50~200000的范围。蛋白质分解诱导标签为低分子化合物时,蛋白质分解诱导标签的分子量例如优选50~5000的范围。
就蛋白质分解诱导标签的结构而言,只要对蛋白酶具有亲和性且不抑制由蛋白酶导致的蛋白质分解则没有特别限制。蛋白质分解诱导标签例如可以从候补分子中通过筛选而得到。另外,还可以通过使蛋白酶抑制剂(例如,蛋白酶体抑制剂)的蛋白酶抑制活性(例如,蛋白酶体抑制活性)失活而制造。
在某些方式中,蛋白质分解诱导标签例如可以为下述式(i)所示的结构。确认了下述式(i)所示的化合物对蛋白酶具有亲和性且不抑制由蛋白酶导致的蛋白质的分解(例如,参照后述的参考例1~4)
式(i)中,r1和r2分别独立地表示碳数1~20的烃基、碳数1~20的烷氧基、碳数6~20的芳氧基、羟基、羧基、氨基或卤代基。
作为烃基,可以列举烷基、烯基、芳基、它们的组合等。具体可以列举:甲基、乙基等碳数1~20的烷基;乙烯基、烯丙基等碳数2~20的烯基;苯基、萘基等碳数6~20的芳基;苄基、苯乙基等碳数7~20的芳烷基;甲苯基、二甲苯基等碳数7~20的烷芳基;等。
作为卤代基,可以列举氟基、氯基、溴基等。
在另一方式中,蛋白质分解诱导标签可以制成为使蛋白酶体抑制剂的蛋白酶体抑制活性失活的结构。作为蛋白酶体抑制活性,更具体而言,可以列举对选自胱天蛋白酶样活性、胰蛋白酶样活性和胰凝乳蛋白酶样活性中的至少1种的抑制活性。
在此,“使蛋白酶体抑制活性失活的结构”除了包含使蛋白酶体抑制活性完全消失的结构以外,还包括使蛋白酶体抑制活性减弱的结构。在某些方式中,蛋白质分解诱导标签对选自胱天蛋白酶样活性、胰蛋白酶样活性和胰凝乳蛋白酶样活性中的至少1种的50%抑制浓度(ic50)为原蛋白酶体抑制剂的50%抑制浓度(ic50)的2倍以上。
作为蛋白酶体抑制剂,可以使用具有蛋白酶体抑制活性的所有化合物。蛋白酶体抑制剂是对蛋白酶体(复合物型蛋白酶)具有亲和性且抑制由蛋白酶体导致的蛋白质分解的化合物。因此,通过将蛋白酶体抑制剂的活性部位置换为其它结构部分而使蛋白酶体抑制活性失活,从而可以得到蛋白质分解诱导标签。
蛋白酶体抑制剂一直在作为抗癌剂等进行研究,存在多种已得到药品许可的化合物和处于临床试验中的化合物。另外,蛋白酶体抑制剂大多分子量较小、疏水性也低,也不易产生细胞膜透过性、细胞毒性等问题。因此,以蛋白酶体抑制剂为基础来合成蛋白质分解诱导标签是非常合理且有效的。
将蛋白酶体抑制剂的一例示于以下的表8和表9。表8和表9所示的蛋白酶体抑制剂均为对20s蛋白酶体的活性中心部具有亲和性的20s蛋白酶体抑制剂。另外,表8和表9所示的蛋白酶体抑制剂当然也对26s蛋白酶体具有亲和性。其中,能用于制造蛋白质分解诱导标签的蛋白酶体抑制剂不限定于这些例子。
[表8]
[表9]
例如,已知作为硼酸型蛋白酶体抑制剂的硼替佐米(bortezomib)通过如下述式所示那样由作为活性部位的硼羰基与20s蛋白酶体的分解活性位点形成共价键,从而抑制蛋白酶体活性(kisselev,a.f.etal.chemistry&biology,2012,19,99-115)。
另外已知:作为硼酸型蛋白酶体抑制剂的mln9708和mln2238通过如下述式所示那样由作为活性部位的硼酸酯部位或硼羰基与20s蛋白酶体的分解活性位点形成共价键,从而抑制蛋白酶体活性(kisselev,a.f.etal.chemistry&biology,2012,19,99-115)。
因此,通过将硼替佐米、mln9708和mln2238的作为活性部位的硼羰基或硼酸酯部位置换为其它结构部分(羧基、烷基、芳基、氨基、羟基等)而使蛋白酶体抑制活性失活,从而可以得到蛋白质分解诱导标签。
需要说明的是,对于cep-18770等其它硼酸型蛋白酶体抑制剂,也可以通过将活性部位置换为其它结构部分(羧基、烷基、芳基、氨基、羟基等)而得到蛋白质分解诱导标签。
另外已知:作为醛型蛋白酶体抑制剂的alln通过如下述式所示那样由作为活性部位的甲酰基与20s蛋白酶体的分解活性位点形成共价键,从而抑制蛋白酶体活性(kisselev,a.f.etal.chemistry&biology,2012,19,99-115)。
因此,通过将alln的作为活性部位的甲酰基置换为其它结构部分(羧基、烷基、芳基、氨基、羟基等)而使蛋白酶体抑制活性失活,从而可以得到蛋白质分解诱导标签。
需要说明的是,对于mg-132、bsc-2118、psi等其它醛型蛋白酶体抑制剂,也可以通过将作为活性部位的甲酰基置换为其它结构部分(羧基、烷基、芳基、氨基、羟基等)而得到蛋白质分解诱导标签。
将具有使蛋白酶体抑制剂的蛋白酶体抑制活性失活的结构的蛋白质分解诱导标签的一例示于以下的表10和表11。作为表中的r所示的1价基团,可以列举羧基、碳数1~20的烷基、碳数6~20的芳基、氨基、羟基等。
[表10]
[表11]
将蛋白酶体抑制剂的其它例示于以下的表12~表17。对于这些蛋白酶体抑制剂,也可以与上述同样地通过使蛋白酶体抑制活性失活而得到蛋白质分解诱导标签。
[表12]
[表13]
[表14]
[表15]
[表16]
[表17]
在另一方式中,蛋白质分解诱导标签可以为使蛋白酶抑制剂(除前述蛋白酶体抑制剂以外)的蛋白酶抑制活性失活的结构。
在此,“使蛋白酶抑制活性失活的结构”除了包含使蛋白酶抑制活性完全消失的结构以外,还包括使蛋白酶抑制活性减弱的结构。在某些方式中,蛋白质分解诱导标签对成为蛋白酶抑制剂的抑制对象的蛋白酶的50%抑制浓度(ic50)为原蛋白酶抑制剂的50%抑制浓度(ic50)的2倍以上。
作为蛋白酶抑制剂,可以使用具有蛋白酶抑制活性的所有化合物。蛋白酶抑制剂是对蛋白酶具有亲和性且抑制由蛋白酶导致的蛋白质分解的化合物。因此,可以通过将蛋白酶抑制剂的活性部位置换为其它结构部分而使蛋白酶抑制活性失活,从而可以得到蛋白质分解诱导标签。
将蛋白酶抑制剂的一例示于以下的表18~表85。通过将这些蛋白酶抑制剂的活性部位置换为其它结构部分而使蛋白酶抑制活性失活,从而可以得到蛋白质分解诱导标签。但是,能够用于制造蛋白质分解诱导标签的蛋白酶抑制剂不限于这些例子。关于蛋白酶和蛋白酶抑制剂,根据需要可以参照已有的数据库(merops-thepeptidasedatabase(http://merops.sanger.ac.uk/index.shtml)等)的信息。
[表18]
[表19]
[表20]
[表21]
[表22]
[表23]
[表24]
[表25]
[表26]
[表27]
[表28]
[表29]
[表30]
[表31]
[表32]
[表33]
[表34]
[表35]
[表36]
[表37]
[表38]
[表39]
[表40]
[表41]
[表42]
[表43]
[表44]
[表45]
[表46]
[表47]
[表48]
[表49]
[表50]
[表51]
[表52]
[表53]
[表54]
[表55]
[表56]
[表57]
[表58]
[表59]
[表60]
[表61]
[表62]
[表63]
[表64]
[表65]
[表66]
[表67]
[表68]
[表69]
[表70]
[表71]
[表72]
[表73]
[表74]
[表75]
[表76]
[表77]
[表78]
[表79]
[表80]
[表81]
[表82]
[表83]
[表84]
[表85]
需要说明的是,在以上的说明中,为了方便而将蛋白酶体抑制剂和蛋白酶体抑制剂以外的蛋白酶抑制剂进行了区别,但已知有能够抑制蛋白酶体和除了蛋白酶体以外的蛋白酶两者的活性的化合物。因此,通过使用这样的化合物,可以得到对蛋白酶体和除了蛋白酶体以外的蛋白酶两者具有亲和性的蛋白质分解诱导标签。
将能够抑制蛋白酶体和除了蛋白酶体以外的蛋白酶两者的活性的化合物的一例示于以下的表86。但是,能够抑制蛋白酶体和除了蛋白酶体以外的蛋白酶两者的活性的化合物不限于这些例子。
[表86]
在另一方式中,可以使用蛋白酶体活化剂作为蛋白质分解诱导标签。蛋白酶体活化剂是对蛋白酶体(复合物型蛋白酶)具有亲和性且不抑制由蛋白酶体导致的蛋白质分解的化合物,可以作为蛋白质分解诱导标签来使用。
将蛋白酶体活化剂的一例示于以下的表87~表89。但是,能够用于制造蛋白质分解诱导标签的蛋白酶体活化剂不限定于这些例子。
[表87]
[表88]
[表89]
如以上所示例的蛋白质分解诱导标签当中,特别优选对26s蛋白酶体具有亲和性的物质。细胞内的蛋白酶体通常以在20s蛋白酶体结合有2个19s蛋白酶体而成的26s蛋白酶体的状态存在。因此,通过使用对26s蛋白酶体具有亲和性的蛋白质分解诱导标签,从而能够引导细胞内的p53蛋白或p53复合物更有效地分解。
(p53亲和性分子与蛋白质分解诱导标签的缀合物的样式)
p53亲和性分子与蛋白质分解诱导标签的缀合物的样式只要可维持p53亲和性分子的与p53蛋白或p53复合物的亲和性、以及蛋白质分解诱导标签的与蛋白酶的亲和性,就没有特别限制。需要说明的是,p53亲和性分子和蛋白质分解诱导标签均为蛋白质时,能够合成融合了两者的融合蛋白,但这样的融合蛋白不包含在“缀合物”中。
p53分解诱导分子例如可以是将至少1个p53亲和性分子与至少1个蛋白质分解诱导标签连接而成的结构。p53分解诱导分子可以是1个p53亲和性分子与1个蛋白质分解诱导标签连接而成的结构,可以是1个p53亲和性分子与多个蛋白质分解诱导标签连接而成的结构,可以是多个p53亲和性分子与1个蛋白质分解诱导标签连接而成的结构,可以是多个p53亲和性分子与多个蛋白质分解诱导标签连接而成的结构。在某些方式中,p53分解诱导分子是1个p53亲和性分子与1个蛋白质分解诱导标签连接而成的结构。
p53亲和性分子中的与蛋白质分解诱导标签的连接位置只要可维持与p53蛋白或p53复合物的亲和性就没有特别限制。
另一方面,蛋白质分解诱导标签的与p53亲和性分子的连接位置只要可维持与蛋白酶的亲和性则没有特别限制。例如,蛋白质分解诱导标签为如前所述将蛋白酶抑制剂(例如蛋白酶体抑制剂)的活性部位置换为其它结构部分的结构时,可以在该置换后的其它结构部分与p53亲和性分子进行连接。具体而言,在将蛋白酶抑制剂的活性部位置换为羧基后,可以借助羧基与p53亲和性分子连接。
需要说明的是,p53亲和性分子和蛋白质分解诱导标签也可以是能够相互连接而成的结构。在难以将p53亲和性分子与蛋白质分解诱导标签直接连接的情况下,也可考虑将能够相互连接而成的结构导入到p53亲和性分子和蛋白质分解诱导标签中的至少一者中。
例如,可以使用与p53蛋白或p53复合物具有亲和性的已知分子作为p53亲和性分子,但也考虑到难以将该已知的分子与蛋白质分解诱导标签直接连接的情况。这种情况下,可以将能够与蛋白质分解诱导标签连接而成的结构导入到该已知分子作为p53亲和性分子而使用。
<药物组合物>
本发明的药物组合物包含本发明的p53分解诱导分子。如前所述,根据本发明的p53分解诱导分子,不借助p53蛋白或p53复合物的泛素化(即,非泛素依赖性)也能够引导对p53蛋白或p53复合物进行由蛋白酶(例如,蛋白酶体)导致的分解(敲低)。因此,包含p53分解诱导分子的本发明的药物组合物能够用于p53蛋白所介导的疾病或症状的预防或治疗。根据本发明,还提供p53蛋白所介导的疾病或症状的预防或治疗方法,所述方法包括将包含p53分解诱导分子的药物组合物给药。
需要说明的是,多数情况较难进行以复合物作为靶标的药剂设计,本发明的药物组合物在还能以p53复合物作为靶标使其分解方面是非常有用的。
作为p53蛋白所介导的疾病或症状,只要可期待通过p53蛋白或p53复合物的分解而具有预防效果或治疗效果就没有特别限制。将p53蛋白所介导的疾病或症状的一例示于以下的表90。其中,p53蛋白所介导的疾病或症状不限定于这些例子。
[表90]
在某些方式中,本发明的药物组合物用于细胞老化、脂肪老化、神经系统疾病(神经细胞死亡)、糖尿病、心脏功能障碍等预防或治疗。
目前已知由于端粒长度缩短或dna损伤而抑制细胞增殖而引起细胞老化。另一方面,报道了:早年衰老综合症的小鼠模型(zmpste24蛋白酶缺损小鼠)中缺失p53基因时,利用β-半乳糖苷酶法等可确认老化特质的改善,并且还观察到寿命的延长(nature,2005,437,564-568)。根据本发明的药物组合物,通过使p53蛋白或p53复合物分解,从而可推测出同样能够预防或改善细胞老化和延长寿命。
需要说明的是,细胞老化已知还会成为心肌梗塞、动脉粥样硬化症、肺慢性阻塞性疾病等各种疾病的病因(nature,2017,16,718-735)。根据本发明的药物组合物,通过使p53蛋白或p53复合物分解,从而可推测出能够预防或治疗细胞老化相关的疾病或症状。
另外,报道了:阿尔茨海默氏病(ad)、帕金森氏病(pd)、肌萎缩侧索硬化症(als)、angelman综合征等神经系统疾病中高表达了p53蛋白,成为诱导神经细胞死亡的主要因子(biochemicalandbiophysicalresearchcommunications,1997,17,418-21;thefasebjournal,2005,19,255-257;thejournalofneuroscience,2006,26,6377-6385;thejournalofbiologicalchemistry,2002,277,50980-58984;journalofneurochemistry,2007,100,1626-1635;naturecellbiology,2009,11,1370-1375;neurobiologyofdisease,2000,7,613-622;neuron,1998,21,799-811)。另外,报道了:对于脑中风等缺血性损伤,通过再灌注后的氧化应激,p53蛋白蓄积在线粒体基质中,该p53蛋白与亲环蛋白d形成复合物,由此使线粒体膜透过性转换孔开放,从而诱导神经细胞死亡(cell,2012,149,1536-1548)。根据本发明的药物组合物,通过使p53蛋白或p53复合物分解,从而可推测出能够预防或治疗神经系统疾病(神经细胞死亡)。
另外,对于心力衰竭的非代偿期(症状加剧的时期),由于dna损伤、端粒长度缩短、低氧等而使p53基因活化。若p53基因活化,则使hif-1(对于血管新生因子的诱导重要的转录因子)活性和血管新生因子的表达降低,诱导心脏功能障碍。另一方面,报道了:对于p53敲低小鼠,通过侧主动脉瓣狭窄(tac)制作的心脏压力负荷模型中,血管数增加,心功能得以维持(nature,2007,446,444-448)。根据本发明的药物组合物,通过使p53蛋白或p53复合物分解,从而可推测出同样能够预防或治疗心脏功能障碍。
另外,对于端粒酶缺损小鼠的脂肪组织,会出现脂肪的老化(β-半乳糖苷酶阳性)、p53基因的活化、不良脂肪因子(tnfα等)产生的增加。若不良脂肪因子增加则成为胰岛素抗性,血糖值变得难以降低,由此得上糖尿病。另一方面,报道了:由于脂肪组织的p53基因的缺失,而使不良脂肪因子的产生降低,改善了胰岛素抗性(naturemedicine,2009,15,996-997;naturemedicine,2009,15,1082-1088)。根据本发明的药物组合物,通过使p53蛋白或p53复合物分解,从而可推测出同样能够预防或治疗糖尿病。
进而,已知mdm2缺损小鼠虽然显示出胚胎致死,但可以通过缺损p53基因来缓和。例如,p53基因和mdm2基因的双敲低小鼠正常发育(nature,1995,378,203-206;nature,1995,378,206-208)。通过将本发明的药物组合物给予母体并使p53蛋白或p53复合物分解,从而可推测出能够避免mdm2缺损的胎儿的胚胎致死。
作为用于这些用途的本发明的药物组合物,优选包含p53分解诱导分子的药物组合物,所述p53分解诱导分子是p53亲和性分子与蛋白质分解诱导标签的缀合物,所述p53亲和性分子对野生型(正常型)p53蛋白或野生型(正常型)p53复合物具有亲和性。
在另一方式中,本发明的药物组合物用于癌症的预防或治疗。
目前已知p53蛋白为突变型的癌症对化学疗法和辐射线治疗显示出抗性。另外,已知p53蛋白在众多的癌症中突变。由于p53基因为抑癌基因,因此一直以来进行了使野生型p53基因活化的药剂设计。然而,若p53基因突变,则本应作为抑癌基因的p53基因变得有利于癌变。由此,使突变型p53蛋白分解的方案够期期待有助于下一代的癌症治疗。
另外,已知在进行癌症的辐射线治疗时通过恢复野生型p53蛋白的功能,从而使治疗效果得到改善。通过组合使用辐射线治疗与使用了本发明的药物组合物的治疗,从而还能够期待使辐射线治疗在具有突变型p53蛋白的癌症中的效果得到改善。
作为用于这些用途的本发明的药物组合物,优选是包含p53分解诱导分子的药物组合物,所述p53分解诱导分子是p53亲和性分子与蛋白质分解诱导标签的缀合物,所述p53亲和性分子对突变型p53蛋白或突变型p53复合物具有亲和性。需要说明的是,作为p53亲和性分子,还可以使用与野生型p53蛋白或野生型p53复合物相比对突变型p53蛋白或突变型p53复合物具有更高亲和性的物质。
药物组合物可以包含除了p53分解诱导分子以外的成分。例如,药物组合物可以包含作为制剂原材料而惯用的有机载体或无机载体。该载体在固态制剂中以赋形剂、润滑剂、结合剂、崩解剂等的形式来配合,在液状制剂中以溶剂、助溶剂、悬浮化剂、等渗剂、缓冲剂等的形式来配合。另外,药物组合物还可以包含防腐剂、抗氧化剂、着色剂、甜味剂等制剂添加物。
对药物组合物的剂型没有特别限制。作为药物组合物的剂型,可以列举:片剂、胶囊剂、颗粒剂、散剂、锭剂、糖浆剂、乳剂、悬浮剂、薄膜剂等口服制剂;注射剂、点滴剂、外用剂、栓剂、丸剂(pellet)、经鼻剂、经肺剂(吸入剂)、滴眼剂等非口服制剂;等。
药物组合物的给药量可以根据给药对象、给药途径、对象疾病、症状等适宜决定。
实施例
以下通过实施例具体说明本发明,但本发明不受实施例限定。以下的实施例和参考例中,室温表示20℃~30℃的范围。
以下的实施例和参考例中使用的化合物等的缩写如上所述。
h-gly-otbu·hcl:l-甘氨酸叔丁酯盐酸盐
dmf:n,n-二甲基甲酰胺
dipea:n,n-二异丙基乙胺
pybop:1h-苯并三唑-1-基氧基-三(吡咯烷基)鏻六氟磷酸盐
tfa:三氟乙酸
h-leu-otbu·hcl:l-亮氨酸叔丁酯盐酸盐
d-mem:dulbecco改进eagle培养基
dmso:二甲基亚砜
pbs:磷酸盐缓冲盐
edta:乙二胺四乙酸
sds:十二烷基硫酸钠
page:聚丙烯酰胺凝胶电泳
bpb:溴酚兰
pvdf:聚偏氟乙烯
tbs:三乙醇胺缓冲盐
gapdh:甘油醛3-磷酸脱氢酶
pmsf:苯甲基磺酰氟
dtt:二硫苏糖醇
depc:焦碳酸二乙酯
sa-β-gal:老化相关β-半乳糖苷酶
fitc:异硫氰酸荧光素
ec:大肠杆菌(escherichiacoli)
dhfr:二氢叶酸还原酶
tmp:甲氧苄啶
dmt-mm:4-(4,6二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉氯化物n-水合物
amc:7-氨基-4-甲基香豆素
ha:血细胞凝集素
gfp:绿色荧光蛋白
dsred:香菇珊瑚(discosomasp.)红色荧光蛋白
fbs:胎牛血清
<实施例1>
实施例1中,通过连接p53亲和性分子与蛋白质分解诱导标签,从而合成了作为p53分解诱导分子的tibc-canddy_mln。
作为p53亲和性分子,使用下式所示的tibc-nh2。tibc-nh2是在下式所示的tibc中加成了h2n-(ch2)6-cooh而成的化合物。tibc对p53/mdm2复合物具有亲和性。
作为蛋白质分解诱导标签,使用将作为蛋白酶体抑制剂的mln9708和mln2238的活性部位(硼酸酯部位或硼羰基)置换为羧基的化合物(canddy_mln)。
tibc-canddy_mln的合成方法的详情如下所述。
(canddy_mln的合成)
依据下述合成方案合成了canddy_mln。
首先,向带分支的茄形烧瓶中投入h-gly-otbu·hcl(286.8mg,1.69mmol,1eq),进行氮气置换。在氮气气流下加入脱水dmf10ml和dipea5ml,在室温下进行搅拌。将2,5-二氯苯甲酸(309.3mg,1.62mmol,1eq)溶解于1ml的脱水dmf和1ml的dipea中后,加入反应溶液中,在室温下搅拌20分钟。将pybop(1.02g,1.96mmol,1.2eq)溶解于1ml的脱水dmf中后,加入反应溶液中,在室温下搅拌3小时。用水及碳酸氢钠水溶液稀释反应溶液,用乙酸乙酯/己烷(=4/1)萃取2次。用无水硫酸钠进行干燥后,减压馏去了溶剂。通过使用了硅胶色谱(己烷/氯仿=1/1~0/1,梯度)的分离纯化处理,得到了化合物s1(531.0mg,1.75mmol,103%)。
然后,向茄形烧瓶中投入化合物s1(212.4mg,0.70mmol),加入二氯甲烷5ml。在室温下搅拌5分钟后,加入5ml的tfa,在室温下搅拌1小时。减压馏去溶剂后,进行真空干燥,得到了化合物s2(190.7mg,quant.)。
然后,向带分支的茄形烧瓶中投入化合物s2(190.7mg,0.77mmol,1eq)和h-leu-otbu·hcl(175.8mg,0.79mmol,1eq),进行氮气置换。在氮气气流下加入脱水dmf5ml和dipea5ml,在室温下搅拌20分钟。将pybop(886.7mg,1.70mmol,2.2eq)溶解于1.5ml的脱水dmf中后,加入反应溶液中,在室温下搅拌3小时。用水及碳酸氢钠水溶液稀释反应溶液,用乙酸乙酯/己烷(=4/1)萃取2次。用无水硫酸钠进行干燥后,减压馏去了溶剂。通过使用了硅胶色谱(己烷/氯仿=1/1~0/1,梯度)的分离纯化处理,得到了化合物s3(244.2mg,0.58mmol,76%)。
然后,向茄形烧瓶中投入化合物s3(240.8mg,0.58mmol),加入二氯甲烷5ml。在室温下搅拌5分钟后,加入5ml的tfa,在室温下搅拌1小时。减压馏去溶剂后,进行真空干燥,得到了canddy_mln(214.7mg,0.59mmol,100%)。
(tibc-canddy_mln的合成)
依据下述合成方案合成了tibc-canddy_mln。
向茄形烧瓶中投入canddy_mln(21.7mg,0.06mmol,1eq)和另行合成的tibc-nh2(29.3mg,0.06mmol,1eq),加入脱水dmf5ml。在室温下搅拌5分钟后,加入5mldipea使溶液呈中性。在室温下搅拌20分钟后,将pybop(46.8mg,0.09mmol,1.5eq)直接加入反应溶液中,在室温下搅拌16小时。在冷却下加入饱和碳酸氢钠水溶液,将有机层分离后,用乙酸乙酯萃取水层。收集有机层,用无水硫酸钠进行干燥。减压馏去溶剂后,通过使用了硅胶色谱(氯仿/甲醇=20/1~4/1,梯度)的分离纯化处理,得到了tibc-canddy_mln(10.8mg,0.013mmol,22%,分离产率)。得到的tibc-canddy_mln使用制备薄层色谱(氯仿/甲醇=10/1)进行进一步纯化处理。
以下示出tibc-canddy_mln的物性数据。
hrms-fab(m/z):[m+h]+calcdfor(计算值)c37h42cl2n4o5i,819.1577;found(实验值),819.1577.
<实施例2>
实施例2中,对于添加了tibc-canddy_mln的hct116细胞(人结肠癌细胞)中的内源的野生型p53蛋白和mdm2蛋白的分解(敲低),通过免疫印迹分析进行评价。
(细胞接种)
将hct116细胞以8×104个/孔的细胞密度接种在24孔板中,然后在37℃、5体积%co2的条件下培养16小时。
(向hct116细胞中添加tibc-canddy_mln或tibc)
在细胞接种起16小时后,如下所示进行,向hct116细胞中添加了tibc-canddy_mln或tibc。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃)。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。含有tibc-canddy_mln或tibc的dmso溶液以dmso浓度成为1体积%的方式与培养基混合,每孔各添加500μl,在37℃、5体积%co2的条件下进行培养。使用dmso作为对照。
(借助tibc-canddy_mln的内源的野生型p53蛋白和mdm2蛋白的分解(敲低)的评价(免疫印迹分析))
在添加tibc-canddy_mln或tibc48小时后去除培养基,添加pbs来洗涤细胞。去除pbs后,每孔各添加27μl的细胞溶解缓冲液(cellyticm,sigma)与蛋白酶抑制剂(completemini,edta-free,roche)的混合溶液。在4℃下静置15分钟后,使用移液管尖端在冰上剥离了细胞。将细胞溶液回收于1.5ml管中,用液氮瞬时冷冻,然后在冰上使其融解。融解后,进行离心分离(13800rpm×20分钟、4℃),回收了上清液(细胞提取物)。
对于所回收的细胞提取物,进行免疫印迹分析。sds-page凝胶使用tgxfastcastacrylamidekit,12%(bio-rad)来制作。电泳样品利用6×sds-page样品缓冲液(62.5mmtris-hclph6.8,2%sds,5%2-巯基乙醇,10%甘油,0.25%bpb)来制备,在95℃下进行4分钟用加热器(heatblock)的处理。电泳在160v下进行65分钟(电泳缓冲液;195mm甘氨酸,25mmtris)。
电泳后,使用槽式印迹装置和转印缓冲液(25mmtris-hcl,195mm甘氨酸、0.01%sds,15%甲醇),在100v、2小时的条件下将蛋白质转印到pvdf膜(immobion-p,millipore)上。将转印后的膜在5%脱脂乳/tbs-t(100mmtris-hcl,150mmnacl,0.1%tween-20,ph7.6)中在室温下振荡30分钟,从而进行封闭。封闭后,在5%脱脂乳/tbs-t中进行初次抗体反应。作为初次抗体,使用抗p53抗体(do-1,santacruz,1500倍稀释)、抗mdm2抗体(smp14,santacruz,500倍稀释)和抗gapdh抗体(6c5,santacruz,20000倍稀释)。在4℃下振荡一夜后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。初次抗体反应后,在2%脱脂乳/tbs-t中进行二次抗体反应。作为二次抗体,使用抗小鼠igg(h+l)抗体(a90-116p-33,bethyl,20000倍稀释)。在室温下振荡45分钟后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。进而,将膜用tbs(100mmtris-hcl,150mmnacl,ph7.6)洗涤5分钟。然后,将膜用化学发光试剂immobilonwestern(millipore)处理后,用luminescentimageanalyzerlas-3000(fujifilmcorporation)检测化学发光。
将免疫印迹分析结果示于图1。如图1所示,添加了tibc-canddy_mln时,内源的野生型p53蛋白和mdm2蛋白的量减少。另一方面,添加了tibc时,内源的野生型p53蛋白和mdm2蛋白的量未减少。
<实施例3>
实施例3中,对于添加了tibc-canddy_mln的hela细胞(人宫颈癌细胞)中的内源的野生型p53蛋白的分解(敲低),通过免疫印迹分析进行评价。同时评价了蛋白酶体抑制剂(mln2238)对p53蛋白分解的缓和(rescue)。
(细胞接种)
将hela细胞以4×104个/孔的细胞密度接种在24孔板中,然后在37℃、5体积%co2的条件下培养16小时。
(向hela细胞中的tibc-canddy_mln的添加)
在细胞接种起16小时后,如下所示进行,向hela细胞添加了tibc-canddy_mln。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃)。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。含有tibc-canddy_mln的dmso溶液以dmso浓度成为1体积%的方式与培养基混合,每孔各添加500μl,在37℃、5体积%co2的条件下进行培养。使用dmso作为对照。另外,除了准备添加含有tibc-canddy_mln的dmso溶液的实验组之外,还准备了添加含有tibc-canddy_mln和mln2238这两者的dmso溶液的实验组或添加含有mln2238的dmso溶液的实验组。
(借助tibc-canddy_mln的内源的野生型p53蛋白的分解(敲低)的评价(免疫印迹分析))
在添加tibc-canddy_mln或mln223824小时后去除培养基,添加pbs来洗涤细胞。去除pbs后,每孔各添加27μl的细胞溶解缓冲液(cellyticm,sigma)与蛋白酶抑制剂(completemini,edta-free,roche)的混合溶液。在4℃下静置15分钟后,使用移液管尖端在冰上剥离了细胞。将细胞溶液回收于1.5ml管中,用液氮瞬时冷冻,然后在冰上使其融解。融解后,进行离心分离(13800rpm×20分钟、4℃),回收了上清液(细胞提取物)。
对于所回收的细胞提取物,进行免疫印迹分析。sds-page凝胶使用tgxfastcastacrylamidekit,12%(bio-rad)来制作。电泳样品利用6×sds-page样品缓冲液(62.5mmtris-hclph6.8,2%sds,5%2-巯基乙醇,10%甘油,0.25%bpb)来制备,在95℃下进行4分钟用加热器的处理。电泳在160v下进行65分钟(电泳缓冲液;195mm甘氨酸,25mmtris)。
电泳后,使用槽式印迹装置和转印缓冲液(25mmtris-hcl,195mm甘氨酸、0.01%sds,15%甲醇),在100v、2小时的条件下将蛋白质转印到pvdf膜(immobion-p,millipore)上。将转印后的膜在5%脱脂乳/tbs-t(100mmtris-hcl,150mmnacl,0.1%tween-20,ph7.6)中在室温下振荡30分钟,从而进行封闭。封闭后,在5%脱脂乳/tbs-t中进行初次抗体反应。作为初次抗体,使用抗p53抗体(do-1,santacruz,1000倍稀释)和抗gapdh抗体(6c5,santacruz,10000倍稀释)。在4℃下振荡一夜后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。初次抗体反应后,在2%脱脂乳/tbs-t中进行二次抗体反应。作为二次抗体,使用抗小鼠igg(h+l)抗体(a90-116p-33,bethyl,10000倍稀释)。在室温下振荡30分钟后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。进而,将膜用tbs-t(100mmtris-hcl,150mmnacl,ph7.6)洗涤5分钟。然后,将膜用化学发光试剂immobilonwestern(millipore)处理后,用luminescentimageanalyzerlas-3000(fujifilmcorporation)检测化学发光。
将免疫印迹分析结果示于图2。如图2所示,添加了tibc-canddy_mln时,内源的野生型p53蛋白的量减少。另外,添加了tibc-canddy_mln和mln2238这两者时,与对照(dmso)相比野生型p53蛋白的量增加。该结果证实了通过tibc-canddy_mln诱导了野生型p53蛋白利用蛋白酶体的分解。
<实施例4>
实施例4中,对于给予了tibc-canddy_mln的小鼠个体中的内源的野生型p53蛋白和mdm2蛋白的分解(敲低),通过免疫印迹分析进行评价。
(向小鼠给予tibc-canddy_mln)
在即将给药前,将tibc-canddy_mln溶解于dmso中后,以dmso的浓度成为10体积%的方式溶解于玉米油(codeno.25606-55,nacalaitesque)中,以50mg/kg体重或100mg/kg体重的给药量、对c57bl/6j野生型小鼠(7~8周龄、雄)(cleajapan,inc.)进行腹腔内给药(n=3)。作为对照,使用注射液的载体(含有10体积%dmso的玉米油)。小鼠在可自由摄取饲料和水的环境下进行饲养。给药48小时后,在利用戊巴比妥钠(共立制药株式会社)的深度麻醉下解剖小鼠。开腹后摘出肝脏,用液氮瞬时冷冻。用液氮冷冻后的组织在-80℃的深冷制冷器中保管。
(小鼠组织的免疫印迹分析)
将冷冻的组织(0.04g)粉碎后,加入980μl的1×tkm组织溶解缓冲液(50mm三乙醇胺(ph7.8),50mmkcl,5mmmgcl2,0.25m蔗糖,1mmpmsf,蛋白抑制剂cocktail-edtafree(codeno.03969-21,nacalaitesque),1mmdtt,重组rnase抑制剂5ul/ml(40u/μl,catno.2313a,lotno.k8402da,takarabio)),旋转(1rpm、25℃)15分钟使其溶解。然后,进行离心分离(3000rpm×15分钟、4℃),回收了上清液(组织提取物)。用depc处理水将组织提取物稀释20倍后使用,用分光光度计对组织提取物中的蛋白质浓度进行定量。
对回收的组织提取物进行免疫印迹分析。sds-page凝胶使用tgxfastcastacrylamidekit,12%(bio-rad)来制作。电泳样品利用6×sds-page样品缓冲液(62.5mmtris-hclph6.8,2%sds,5%2-巯基乙醇,10%甘油,0.25%bpb)来制备,在95℃下进行5分钟用加热器的处理。对于制备的电泳样品,gapdh的检测用的情况各进样50μg/孔,除此以外的检测用的情况各进样100μg/孔。电泳在160v下进行60分钟(电泳缓冲液;195mm甘氨酸,25mmtris)。
电泳后,使用槽式印迹装置和转录缓冲液(25mmtris-hcl,195mm甘氨酸,0.01%sds,15%甲醇),在100v、1.5小时的条件下将蛋白质转印到pvdf膜(immobion-p,millipore)上。将转印后的膜在5%脱脂乳/tbs-t(100mmtris-hcl,150mmnacl,0.1%tween-20,ph7.6)中在室温下振荡30分钟,从而进行封闭。封闭后,在5%脱脂乳/tbs-t中进行初次抗体反应。作为初次抗体,使用抗p53抗体(mab1355,r&dsystems,inc.,500倍稀释)、抗mdm2抗体(sc-965,santacruz,500倍稀释)和抗gapdh抗体(sc-32233,santacruz,20000倍稀释)。在室温下振荡60分钟后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。初次抗体反应后,在1%脱脂乳/tbs-t中进行二次抗体反应。在室温下振荡30分钟后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。进而,将膜用tbs(100mmtris-hcl,150mmnacl,ph7.6)洗涤10分钟。然后,将膜用化学发光试剂immobilonwestern(millipore)处理后,用luminescentimageanalyzerlas-3000(fujifilmcorporation)检测化学发光。检测到的条带的定量中,使用图像处理软件imagej(nih)。
将免疫印迹分析结果示于图3。如图3所示,将tibc-canddy_mln以50mg/kg体重或100mg/kg体重对小鼠给予时,给药48小时后的肝脏中的内源的野生型p53蛋白和mdm2蛋白的量减少。
<实施例5>
实施例5中,对于添加了tibc-canddy_mln的老化相关酸性β-半乳糖苷酶(sa-β-gal)诱导tig3细胞(人胎儿成纤维细胞)中的抗老化作用,通过facs解析进行评价。
(细胞接种)
将作为正常细胞的tig3细胞以8×104个/孔的细胞密度接种在24孔板中,然后在37℃、5体积%co2的条件下培养16小时。
(向tig3细胞中添加阿霉素所致的sa-β-gal的诱导)
在细胞接种起16小时后,以每孔150nm的方式各添加阿霉素,诱导了细胞老化。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃)。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。添加阿霉素后,在37℃、5体积%co2的条件下培养24小时。
(向经老化诱导的tig3细胞中添加tibc-canddy_mln)
在老化诱导起24小时后,如下所示进行,向tig3细胞中添加了tibc-canddy_mln。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃)。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。含有tibc-canddy_mln的dmso溶液以dmso浓度成为1体积%的方式与培养基混合,每孔各添加500μl,在37℃、5体积%co2的条件下培养48小时。使用dmso作为对照。
(通过tibc-canddy_mln的老化抑制作用的评价(facs解析))
作为老化标记物的sa-β-gal的定量使用市售的试剂盒(cellularsenescencedetectionkit-spider-βgal(同仁化学研究所株式会社))。
在添加tibc-canddy_mln48小时后去除培养基,添加d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)1ml来洗涤细胞。在每孔中各添加200μl的试剂盒随附的巴佛洛霉素a1操作溶液,在37℃、5体积%co2的条件下培养1小时。然后,在每孔中各添加200μl的试剂盒随附的spider-βgal操作溶液,在37℃、5体积%co2的条件下培养30分钟。溶液的去除后,添加d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)1ml来洗涤细胞。去除培养基,在每孔中各添加200μl的37℃的胰蛋白酶(0.25w/v%胰蛋白酶-1mmol/ledta·4na带有酚红的溶液)(和光纯药工业株式会社),在37℃、5体积%co2的条件下培养1分钟。培养后,每孔各添加300μl的在d-mem(lowd-glucose,l-glutamine,phenolred,低d-葡萄糖,l-谷氨酰胺,酚红)(和光纯药工业株式会社)中添加了10质量%fbs和1质量%penstrep(100u/ml青霉素钠and100μg/ml硫酸链霉素)(和光纯药工业株式会社)的培养基并使其悬浮,将细胞溶液回收在15ml管中。
流式细胞仪使用bdfacscantoii(bdbiosciences),检测了被fitc标识的sa-β-gal。在即将进行facs分析前,使细胞溶液通过孔径32μm的筛网而转移到facs管中。通过解析软件flowjo(tomydigitalbiologyco.,ltd.)制作fitc强度的直方图,基于直方图的偏移评价了通过tibc-canddy_mln的老化抑制作用。
将facs解析结果示于图4。如图4所示,添加了阿霉素(150nm)时,与未添加阿霉素时相比,可观察到向sa-β-gal(老化标记物)阳性的偏移。另一方面,添加阿霉素(150nm)后,添加了tibc-canddy_mln(50μm)时,几乎未观察到向sa-β-gal(老化标记物)阳性的偏移。由该结果能够确认tibc-canddy_mln的细胞老化抑制作用(约80%)。
<参考例1>
参考例1中,通过连接蛋白质亲和性分子与蛋白质分解诱导标签,从而合成了作为蛋白质分解诱导分子的tmp-canddy_dmt。
作为蛋白质亲和性分子,使用向作为与ecdhfr蛋白结合的二氢叶酸还原酶抑制剂的tmp中导入了包含氨基的官能团的tmp衍生物(tmp-nh2)。
另外,作为蛋白质分解诱导标签,使用前述的式(i)中r1和r2均为甲氧基的化合物(dmt)。dmt虽然不源自蛋白酶体抑制剂,但为对蛋白酶体具有亲和性的化合物。
tmp-canddy_dmt的合成方法的详情如下述合成方案所述。
向茄形烧瓶中投入tmp-nh2(long,m.j.etal.,chem.biol.,2012,19(5),629-637)(31.7mg,0.073mmol),加入脱水dmf0.3ml。在室温下搅拌10分钟后,加入dipea0.1ml,在室温下搅拌10分钟。将dmt-mm(33.6mg,0.12mmol,1.6eq,和光纯药工业株式会社)直接加入反应溶液中,在室温下搅拌18小时。用水及碳酸氢钠水溶液稀释反应溶液,用氯仿萃取5次。用无水硫酸钠进行干燥后,减压馏去了溶剂。通过使用了硅胶色谱(氯仿/甲醇=92/8)的分离纯化处理,得到了tmp-canddy_dmt(25.8mg,0.045mmol,62%,分离产率)。
<参考例2>
参考例2中,评价了tmp-canddy_dmt的蛋白酶体抑制活性与蛋白酶体的亲和性。作为阳性对照,使用作为蛋白酶体抑制剂的mg-132。
评价中使用20sproteasomestressxpressassaykitgold(bioscience),通过multi-detection酶标仪(synergyht,bio-tek)测定对20s蛋白酶体的β5(胰凝乳蛋白酶样活性)、β2(胰蛋白酶样活性)和β1(胱天蛋白酶样活性)的各β亚基具有特异性的结合了amc的蛋白酶体荧光底物的c末端被切断而生成的amc。关于测定波长,将激发光(ex.)设为360nm、荧光(em.)设为460nm。
将β1(胱天蛋白酶样活性)、β2(胰蛋白酶样活性)和β5(胰凝乳蛋白酶样活性)的各蛋白酶体活性示于图5a~图5c。
如图5a~图5c所示,可以确认tmp-canddy_dmt与mg-132相比蛋白酶体抑制活性显著低。另外,对于β1、β2和β5中的任意者,抑制活性均呈tmp-canddy_dmt浓度依赖性提高,由此启示出tmp-canddy_dmt与蛋白酶体具有稳定的亲和性。即,dmt评价为虽然与蛋白酶体具有亲和性,但不抑制分解。
<参考例3>
参考例3中,对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_dmt的分解(敲低),通过facs解析进行评价。
(质粒的准备)
用大肠杆菌扩增表达ecdhfr蛋白的质粒(pmir-dsred-ires-ecdhfr-ha-gfp)后,用miniprepkit(qiagen)进行纯化。
(向hela细胞中导入质粒和细胞接种)
通过向hela细胞中导入质粒,从而在细胞内使作为靶蛋白的ecdhfr蛋白(详细而言,借助ha标签的ecdhfr蛋白与gfp的融合蛋白)或比较用的dsred蛋白瞬时地过量表达。
向hela细胞中的质粒导入使用作为转染试剂的screenfecta(和光纯药工业株式会社)并利用常规方法来进行。将导入质粒后的hela细胞以6×104个/孔的细胞密度接种在24孔板中,然后在37℃、5体积%co2的条件下培养40小时。
(向hela细胞中添加tmp-canddy_dmt)
导入质粒后培养40小时,然后如下所示进行,向hela细胞中添加了tmp-canddy_dmt。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃),每孔各添加297μl。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。每孔各添加3μl的含有tmp-canddy_dmt的dmso溶液,在37℃、5体积%co2的条件下进行培养。作为对照,使用含有tmp的dmso溶液或dmso。
(借助tmp-canddy_dmt的ecdhfr蛋白的分解(敲低)的评价(facs解析))
在添加tmp-canddy_dmt24小时后去除培养基,添加pbs来洗涤细胞。去除pbs后,每孔各添加300μl的37℃的胰蛋白酶(0.25w/v%胰蛋白酶-1mmol/ledta·4na带有酚红的溶液)(和光纯药工业株式会社),在37℃、5体积%co2的条件下培养1分钟。培养后,每孔各添加500μl的在d-mem(lowd-glucose,l-glutamine,phenolred,低d-葡萄糖,l-谷氨酰胺,酚红)(和光纯药工业株式会社)中添加了10质量%fbs和1质量%penstrep(100u/ml青霉素钠and100μg/ml硫酸链霉素)(和光纯药工业株式会社)的培养基并使其悬浮,将细胞溶液回收在15ml管中。
将所回收的细胞溶液离心分离(1000rpm×5分钟、4℃),除去上清后,用2ml的pbs(37℃)进行悬浮。将悬浮后的细胞溶液离心分离(1000rpm×5分钟、4℃),除去上清后,添加4℃的facs缓冲液(1质量%fbs/pbs)500μl,在冰上静置。
流式细胞仪使用bdfacscantoii(bdbiosciences),对细胞中的gfp和dsred蛋白的表达进行了定量。在即将进行facs分析前,使细胞溶液通过孔径32μm的筛网而转移到facs管中。利用解析软件flowjo(tomydigitalbiologyco.,ltd.)计算出每一个细胞的gfp/dsred比,基于曲线偏移确认了通过tmp-canddy_dmt的ecdhfr蛋白的分解(敲低)。
将facs解析结果示于图6。如图6所示,添加了tmp-canddy_dmt时,曲线浓度依赖性地向左偏移,可以确认通过tmp-canddy_dmt诱导了ecdhfr蛋白的分解。另一方面,添加了tmp时,与对照(dmso)曲线重合,可以确认ecdhfr蛋白未被分解。
<参考例4>
参考例4中,对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_dmt的分解(敲低),通过免疫印迹分析进行评价。
(质粒的准备)
与参考例3同样地制作了表达ecdhfr蛋白的质粒。
(向hela细胞中导入质粒和细胞接种)
与参考例3同样地通过向hela细胞中导入质粒,从而在细胞内使ecdhfr蛋白或比较用的dsred蛋白瞬时地过量表达。将导入质粒后的hela细胞以4×104个/孔的细胞密度接种在24孔板中,然后在37℃、5体积%co2的条件下培养40小时。
(向hela细胞中添加tmp-canddy_dmt)
导入质粒后培养40小时,然后如下所示进行,向hela细胞中添加了tmp-canddy_dmt。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃)。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。含有tmp-canddy_dmt的dmso溶液以dmso浓度成为1体积%的方式与培养基混合,每孔各添加300μl,在37℃、5体积%co2的条件下进行培养。另外,除了准备添加含有tmp-canddy_dmt的dmso溶液的实验组之外,还准备了添加含有tmp-canddy_dmt和硼替佐米(bortezomib)的dmso溶液的实验组。在添加tmp-canddy_dmt12小时后,将作为蛋白质合成抑制剂的放线菌酮以成为50μg/ml的浓度的方式添加至培养基中。需要说明的是,作为对照,使用含有tmp的dmso溶液或dmso。
(借助tmp-canddy_dmt的ecdhfr蛋白的分解(敲低)的评价(免疫印迹分析))
在添加tmp-canddy_dmt24小时后去除培养基,添加pbs来洗涤细胞。去除pbs后,每孔各添加55μl的细胞溶解缓冲液(cellyticm,sigma)与蛋白酶抑制剂(completemini,edta-free,roche)的混合溶液。在4℃下静置15分钟后,使用移液管尖端在冰上剥离了细胞。将细胞溶液回收于1.5ml管中,用液氮瞬时冷冻,然后在冰上使其融解。重复3次冷冻融解后,进行离心分离(13000rpm×20分钟、4℃),回收了上清液(细胞提取物)。
对于所回收的细胞提取物,进行免疫印迹分析。sds-page凝胶使用tgxfastcastacrylamidekit,12%(bio-rad)来制作。电泳样品利用6×sds-page样品缓冲液(62.5mmtris-hclph6.8,2%sds,5%2-巯基乙醇,10%甘油,0.25%bpb)来制备,在95℃下进行4分钟用加热器的处理。电泳在150v下进行50分钟(电泳缓冲液;195mm甘氨酸,25mmtris)。
电泳后,使用槽式印迹装置和转印缓冲液(25mmtris-hcl,195mm甘氨酸、0.01%sds,15%甲醇),在100v、40分钟的条件下将蛋白质转印到pvdf膜(immobion-p,millipore)上。将转印后的膜在5%脱脂乳/高盐tbs-t(100mmtris-hcl,500mmnacl,0.2%tween-20,ph7.6)中在室温下振荡30分钟,从而进行封闭。封闭后,将膜用高盐tbs-t淋洗,在1%脱脂乳/高盐tbs-t中进行抗体反应。作为抗体,将抗-ha-过氧化物酶,高亲和性(3f10)兔单克隆抗体(25u/ml)(roche)稀释1000倍后使用。在室温下振荡1小时后,将膜用高盐tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。进而,将膜用高盐tbs(100mmtris-hcl,500mmnacl,ph7.6)洗涤5分钟。然后,将膜用化学发光试剂immobilonwestern(millipore)处理后,用luminescentimageanalyzerlas-3000(fujifilmcorporation)检测化学发光。
然后,使用同一膜,进行作为对照的gapdh的检测反应。将膜用tbs-t(100mmtris-hcl,150mmnacl,0.1%tween-20,ph7.6)洗涤,在5%脱脂乳/tbs-t中在室温下振荡30分钟,从而进行封闭。封闭后,在5%脱脂乳/tbs-t中进行初次抗体反应。作为初次抗体,使用抗gapdh抗体(6c5,santacruz,20000倍稀释)。在室温下振荡60分钟后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。初次抗体反应后,在2%脱脂乳/tbs-t中进行二次抗体反应。作为二次抗体,将抗小鼠igg(h+l)抗体(a90-116p-33,bethyl)稀释20000倍后使用。在室温下振荡30分钟后,将膜用tbs-t洗涤5分钟。需要说明的是,进行了3次洗涤。进而,将膜用tbs-t(100mmtris-hcl,150mmnacl,ph7.6)洗涤5分钟。然后,将膜用化学发光试剂immobilonwestern(millipore)处理后,用luminescentimageanalyzerlas-3000(fujifilmcorporation)检测化学发光。检测到的条带的定量中,使用图像处理软件imagej(nih)。
将免疫印迹分析结果示于图7a和图7b。如图7a和图7b所示,添加了tmp-canddy_dmt时,ecdhfr蛋白的量减少,但添加了tmp时,ecdhfr蛋白的量未减少。另外,添加了tmp-canddy_dmt和硼替佐米这两者时,与添加了tmp-canddy_dmt时相比ecdhfr蛋白的分解得到抑制。该结果证实了通过tmp-canddy_dmt诱导了ecdhfr蛋白通过蛋白酶体的分解。
<参考例5>
参考例5中,通过连接蛋白质亲和性分子与蛋白质分解诱导标签,从而合成了作为蛋白质分解诱导分子的tmp-canddy_alln。
作为蛋白质亲和性分子,与参考例1同样地使用tmp-nh2。
另外,作为蛋白质分解诱导标签,使用将作为蛋白酶体抑制剂的alln的活性部位(甲酰基)置换为羧基的化合物(canddy_alln)。
tmp-canddy_alln的合成方法的详情如下述合成方案所述。
(canddy_alln的合成)
向茄形烧瓶中投入alln(87.2mg,0.23mmol,1eq,codeno.07036-24,nacalaitesque,inc.),加入脱水dmf2ml。在室温下搅拌5分钟后,过氧单磺酸钾(oxone)(212.1mg,0.69mmol,3eq,codeno.228036,sigma-aldrich)直接加入反应溶液中,在室温下搅拌5小时。用水稀释反应溶液后,用氯仿萃取3次。用无水硫酸钠进行干燥后,减压馏去了溶剂。通过使用了硅胶色谱(codeno.30511-35,nacalaitesque,inc.)(氯仿/甲醇=20/1~10/1,梯度)的分离纯化处理,得到了canddy_alln(27.0mg,0.068mmol,30%)。
(tmp-canddy_alln的合成)
向茄形烧瓶中投入canddy_alln(26.8mg,0.067mmol,1eq)和另行合成的tmp-nh2(long,m.j.etal.,chem.biol.,2012,19(5),629-637)(26.0mg,0.060mmol,0.9eq),加入脱水dmf2ml。在室温下搅拌5分钟后,加入dipea0.1ml使溶液呈中性。在室温下搅拌5分钟后,将dmt-mm(30.0mg,0.11mmol,1.6eq,codeno.329-53751,和光纯药工业株式会社)直接加入反应溶液中,在室温下搅拌2小时。在冷却下加入10ml的10质量%盐水/0.1n盐酸水溶液,用乙酸乙酯提取3次。用0.5n盐酸水溶液、接着用盐水洗涤后,用无水硫酸钠进行干燥。减压馏去溶剂后,通过使用了硅胶色谱(codeno.30511-35,nacalaitesque,inc.)(氯仿/甲醇=10/1)的分离纯化处理,得到了tmp-canddy_alln(8.2mg,0.010mmol,15%,分离产率)。
<参考例6>
参考例6中,与参考例2同样地评价了tmp-canddy_alln的蛋白酶体抑制活性与蛋白酶体的亲和性。
将β1(胱天蛋白酶样活性)、β2(胰蛋白酶样活性)和β5(胰凝乳蛋白酶样活性)的各蛋白酶体活性示于图8a~图8c。
如图8a~图8c所示,对于β2和β5的活性,tmp-canddy_alln的情况,与单独使用alln相比抑制活性减弱,可以确认alln的抑制活性已经失活。对于β1,据报道在alln的情况下不那么受到抑制(kaiser,m.etal.,chem.bio.chem.,2004,5,1256-1266),结果与该报告不矛盾。
另外,对于β1、β2和β5中的任意者,抑制活性均呈tmp-canddy_alln的度依赖性提高,因此确认了tmp-canddy_alln与蛋白酶体的亲和性。
<参考例7>
参考例7中,对于在hela细胞中强制表达的ecdhfr蛋白借助tmp-canddy_alln的分解(敲低),通过facs解析进行评价。
(质粒的准备)
与参考例3同样地准备了表达ecdhfr蛋白的质粒(pmir-dsred-ires-ecdhfr-ha-gfp)。
(向hela细胞中导入质粒和细胞接种)
与参考例3同样地通过向hela细胞中导入质粒,从而在细胞内使ecdhfr蛋白或比较用的dsred蛋白瞬时地过量表达。将导入质粒后的hela细胞以4×104个/孔的细胞密度接种在24孔板中,然后在37℃、5体积%co2的条件下培养40小时。
(向hela细胞中添加tmp-canddy_alln)
导入质粒后培养40小时,然后如下所示进行,向hela细胞中添加了tmp-canddy_alln。作为培养基,使用在d-mem(highd-glucose,phenolred,sodiumpyruvate,高d-葡萄糖,酚红,丙酮酸钠)(和光纯药工业株式会社)中添加了1质量%l-谷氨酰胺溶液(sigma-aldrich)的无血清培养基(37℃),每孔各添加300μl。需要说明的是,在即将使用前添加了l-谷氨酰胺溶液。每孔各添加3μl的含有tmp-canddy_alln的dmso溶液,在37℃、5体积%co2的条件下进行培养。作为对照,使用含有tmp的dmso溶液或dmso。
(借助tmp-canddy_alln的ecdhfr蛋白的分解(敲低)的评价(facs解析))
在添加tmp-canddy_alln24小时后去除培养基,添加pbs来洗涤细胞。去除pbs后,在每孔中各添加200μl的37℃的胰蛋白酶(0.25w/v%胰蛋白酶-1mmol/ledta·4na带有酚红的溶液)(和光纯药工业株式会社),在37℃、5体积%co2的条件下培养1分钟。培养后,每孔各添加300μl的在d-mem(lowd-glucose,l-glutamine,phenolred,低d-葡萄糖,l-谷氨酰胺,酚红)(和光纯药工业株式会社)中添加了10质量%fbs和1质量%penstrep(100u/ml青霉素钠and100μg/ml硫酸链霉素)(和光纯药工业株式会社)的培养基并使其悬浮,将细胞溶液回收在15ml管中。
将所回收的细胞溶液离心分离(1000rpm×5分钟、4℃),除去上清后,用2ml的pbs(37℃)进行悬浮。将悬浮后的细胞溶液离心分离(1000rpm×5分钟、4℃),除去上清后,添加4℃的facs缓冲液(1质量%fbs/pbs)500μl,在冰上静置。
流式细胞仪使用bdfacscantoii(bdbiosciences),对细胞中的gfp和dsred蛋白的表达进行了定量。在即将进行facs分析前,使细胞溶液通过孔径32μm的筛网而转移到facs管中。利用解析软件flowjo(tomydigitalbiologyco.,ltd.)计算出每一个细胞的gfp/dsred比,基于曲线偏移确认了通过tmp-canddy_alln的ecdhfr蛋白的分解(敲低)。
将facs解析结果示于图9。如图9所示,添加了tmp-canddy_alln时,与对照(dmso)相比曲线向左大幅偏移,可以确认通过tmp-canddy_alln诱导了ecdhfr蛋白的分解。另一方面,添加了tmp时,与对照(dmso)曲线重合,可以确认ecdhfr蛋白未被分解。
2016年11月15日提出的日本申请2016-222681的发明的全部内容通参照而引入本说明书中。
本说明书记载的全部文献、专利申请和技术标准,与通过参照具体且逐一地引入各文献、专利申请和技术标准时同等程度通过参照而引入本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!