一种用于唾液腺再生的脱细胞支架材料及其制备方法与流程
本发明属于再生医学领域,具体涉及一种用于唾液腺再生的脱细胞支架材料及其制备方法。
背景技术:
唾液是人体一种重要的体液,主要由3对大涎腺(腮腺、颌下腺、舌下腺,其分泌量约占唾液总量的90%)以及分布于口腔粘膜下的数量众多的小涎腺分泌形成。唾液腺在维持口腔和上消化道正常生理稳态中发挥重要作用。各种原因如放射损伤、干燥综合征以及增龄性改变等都会造成唾液腺功能减退,可引起唾液分泌量下降,导致明显的口干,从而引起咀嚼、吞咽、言语困难。同时,由于唾液分泌总量减少,降低了抗细菌能力、对口腔酸性环境的缓冲能力、口腔自洁能力与再矿化能力,这些将导致龋齿快速进展和牙齿硬组织丧失,形成猖獗龋,从而进一步削弱患者的口腔与全身功能,严重影响患者的生活质量。然而,目前还没有特别有效的治疗口干恢复唾液腺功能的方法。目前的治疗方法主要包括应用药物和物理疗法刺激剩余腺体分泌,或者直接提供口腔润滑剂和唾液替代品的对症治疗。近年来,基因治疗和干细胞治疗的研究提示对唾液腺机能减退有着积极作用,并可能会在未来提供一种治疗的选择。但目前仍缺乏有效手段能够从器官组织再生角度,恢复唾液腺功能,并应用于临床中。
随着再生医学的进步,器官再生成为一种潜在的对器官功能衰竭的有效治疗手段。通过组织工程的方法再生唾液腺可能在未来也是一种治疗和替代腺体功能低下的方式。组织工程器官再生是一个复杂的过程,特别是支架材料的选择尤为重要。唾液腺是一个比较复杂的器官,它有着复杂的导管和腺泡系统,如何获得适合唾液腺再生的支架材料是唾液腺再生的难点。最近的研究表明,经过脱细胞处理的天然的器官细胞外基质(ecm,extracellularmatrix)是一种理想的支架材料。ecm主要由胶原、层粘连蛋白、纤连蛋白和弹性蛋白构成,研究表明它在生理器官发育,修复和再生中发挥核心作用。ecm支架即经过脱细胞处理的细胞外基质支架材料,它保留了天然器官的解剖构造,在再生过程中,细胞外基质不仅提供了天然的器官空间结构,而且还会引导正确的细胞相互作用,释放分子信号。
最近研究报道,包括心脏、肺、肾脏、肝脏、气管、膀胱和乳腺都可以成功运用脱细胞处理的器官特异性细胞外基质支架材料成功再生(参照现有技术文献1-4)。
现有脱细胞支架技术较少有人用于唾液腺再生方面,部分学者使用水凝胶、plga纤维、壳聚糖、羊膜、聚-l-乳酸(plla)、聚乙醇酸(pga)、pga/plla和聚(乙二醇)对苯二甲酸酯(peft)/聚(对苯二甲酸丁二醇酯(pbt)等将唾液腺细胞和生物材料简单组合,也获得了支架材料,但他们使用的聚合物必须预涂基质蛋白,如纤连蛋白和胶原蛋白i等,再生的组织仍具有免疫源性,而我们通过脱细胞除去异种或同种异体细胞成分可以产生一个基本上没有免疫原性并保存天然完好结构的支架材料。虽然现有技术表明这种脱细胞的器官支架材料广泛用于心脏、肾脏、肺脏、胰腺等器官的研究,而目前为止还没有关于基于此的唾液腺再生的报道。
现有技术文献
1.songjj,guyettejp,gilpinse,gonzalezg,vacantijp,otthc.“regenerationandexperimentalorthotopictransplantationofabioengineeredkidney”.《naturemedicine》2013;19:646-51.
2.mirmalek-sanish,orlandog,mcquillingjp,paretar,mackdl,salvatorimetal.,“porcinepancreasextracellularmatrixasaplatformforendocrinepancreasbioengineering”.《biomaterials》2013;34:5488-95.
3.gohsk,berteras,olsenp,candielloje,halfterw,uechig,etal.,“perfusion-decellularizedpancreasasanatural3dscaffoldforpancreatictissueandwholeorganengineering”.《biomaterials》2013;34:6760-72.
4.totonellig,maghsoudloup,garribolim,rieglerj,orlandog,burnsaj,etal.,“aratdecellularizedsmallbowelscaffoldthatpreservesvillus-cryptarchitectureforintestinalregeneration”.《biomaterials》2012;33:3401-10.
技术实现要素:
发明要解决的问题
本发明通过特定的培养步骤,并选择12.5%浓度的sds对颌下腺进行脱细胞处理,从而获得一种脱细胞的支架材料,该支架材料能够广泛用于腮腺、下颌下腺、颌下腺等唾液腺再生,治疗由于放射性损伤、干燥综合征以及增龄性改变引起的唾液腺功能减退,改善唾液分泌量,减少由于患者口干所导致的咀嚼、吞咽、言语困难以及龋坏尤其是猖獗龋发生的概率,从而进一步提高患者生活质量。
用于解决问题的方案
本发明涉及一种用于唾液腺再生的脱细胞支架材料的制备方法,其特征在于,所述方法包括以下步骤:(1)雄性大鼠颌下腺脱细胞处理;(2)雄性大鼠颌下腺细胞分离;(3)脱细胞颌下腺的再细胞化和三维培养;其中所述步骤(1)中使用12.5%的sds对大鼠的颌下腺进行脱细胞处理。
所述制备方法中的步骤(1)的具体操作为:
(a)取8周龄雄性大鼠,水合氯醛注射腹腔麻醉后,颈部t形切开暴露双侧颌下腺,去除包膜切取颌下腺并尽可能保留颌下腺导管;浸入肝素化的pbs,摇床振荡15min以去除血液;
(b)加入1000倍样品体积的12.5%sds水溶液,放入摇床中,室温200rpm振荡培养32小时,每隔8小时更换一次sds水溶液;
(c)加入无菌去离子水,振荡4小时除去残留的sds;
(d)加入1%tritonx-100,培养2小时;
(e)加入0.02mg/ml的dnaasei和20mg/ml的rnaase,在37℃的条件下,处理1小时;
(f)加入1000倍样品体积的pbs振荡培养摇动2小时,重复3次;
(g)加入10mg/ml的链霉素、10,000u/ml的青霉素g和25μg/ml两性霉素b浸泡12小时进行灭菌。
所述制备方法中的步骤(2)的具体操作为:
(a)取3-4周龄雄性大鼠,腹腔注射麻醉后,颈部切开后剥离包膜,分离摘取颌下腺,无菌操作台内将颌下腺组织剪碎;
(b)将上述组织置于含3mg/ml的i型胶原酶和4mg/ml的中性蛋白水解酶的消化液中,37℃下消化1小时,期间不断摇晃振荡;消化完成后过70μm细胞筛收集细胞,1200rpm离心5min,弃上清用megm培养液重新悬浮成单细胞悬液。
所述制备方法中的步骤(3)的具体操作为:
(a)用1ml注射器通过颌下腺导管将步骤(2)中所述的单细胞悬液缓慢注入脱细胞的支架材料之上完成再细胞化过程;
(b)将细胞支架复合体静置于培养液中放入培养箱12小时,以利于细胞粘附;
(c)最后将细胞支架复合物复合体放入50ml规格旋转式三维器官培养系统中,加入megm培养基,调整旋转速度为10rpm,保证细胞支架复合体处于悬浮状态,并置于37℃,5%co2培养箱中,每2天更换一次培养基,培养时间为14天。
本发明还涉及一种根据所述的方法制备得到的用于唾液腺再生的脱细胞支架材料。
本发明还涉及一种所述的脱细胞支架材料在制备唾液腺再生组织中的应用。
发明的效果
1、本发明与现有技术相比,本发明的脱细胞支架材料具有器官特异性。本发明能够为患者唾液腺的再生提供可能性,包括腮腺、下颌下腺、颌下腺等,因为上述唾液腺的细胞组织结构基本相似,而且我们提供的是细胞支架材料,具体再生哪种具体的唾液腺,可以培养该种唾液腺的细胞来实现。目前现有的脱细胞器官支架材料并没有用于唾液腺再生领域。
2、与其他器官支架材料相比,本发明无免疫排异反应,经过脱细胞处理的天然的器官细胞外基质(ecm)主要由胶原、层粘连蛋白、纤连蛋白和弹性蛋白构成,并且不含有具有特异免疫源性的蛋白,该效果是以往的支架材料无法相比的。
附图说明
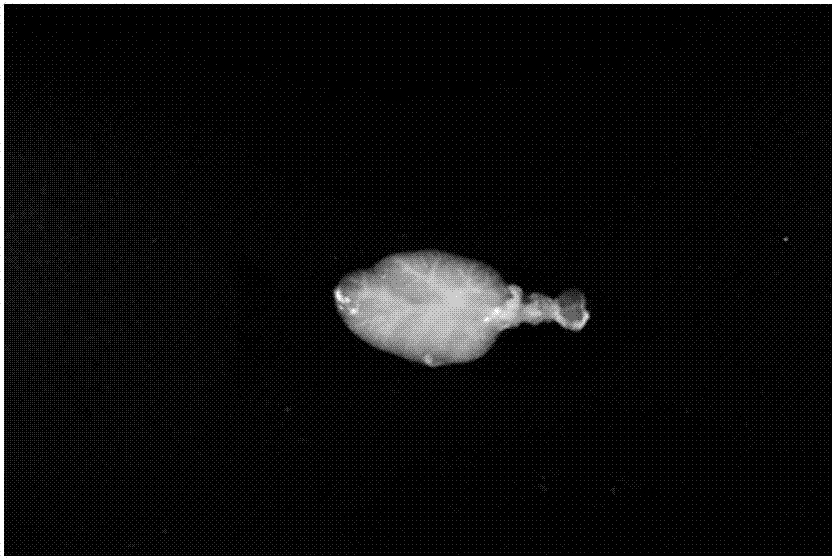
图1为正常的大鼠颌下腺组织的示意图;
图2为试验组的大鼠颌下腺组织的示意图;
图3a为5%sds对照组的大鼠颌下腺组织的示意图;图3b为20%sds对照组的大鼠颌下腺组织的示意图;
图4a为试验组脱细胞支架材料的he染色图;图4b为试验组细胞支架材料经he染色后出现导管状结构;图4c为试验组细胞支架材料经he染色后出现腺泡状结构;
图5为5%sds对照组脱细胞支架材料的he染色图;
图6为试验组脱细胞支架材料的电子显微镜扫描图;
图7为5%sds对照组脱细胞支架材料的电子显微镜扫描图。
具体实施方式
为了更清楚地理解本发明,现参照下例实施例及附图进一步描述本发明。实施例仅用于解释而不以任何方式限制本发明。实施例中未注明的具体条件的实验方法为所属领域熟知的常规方法和常规条件,或按照试剂盒及仪器制造商所建议的条件。
实施例1:颌下腺脱细胞处理
<试验组>
(1)取8周龄雄性大鼠,水合氯醛注射腹腔麻醉后,颈部t形切开暴露双侧颌下腺,去除包膜切取颌下腺并尽可能保留颌下腺导管;浸入0.01mol/l肝素化的pbs(磷酸盐缓冲液,肝素浓度25μg/ml),摇床振荡15min以去除血液;
(2)加入1000倍样品体积的12.5%sds(十二烷基硫酸钠)水溶液,放入摇床中,室温200rpm振荡培养32小时,每隔8小时更换一次sds溶液;
(3)加入无菌去离子水,振荡4小时除去残留的sds;
(4)加入1%tritonx-100(聚乙二醇辛基苯基醚),静置培养2小时;
(5)加入0.02mg/ml的dnaasei(脱氧核糖核酸酶i)和20mg/ml的rnaase(核糖核酸酶),在37℃的条件下,处理1小时;
(6)加入1000倍样品体积的pbs(0.01mol/l)振荡培养2小时,重复3次;
(7)加入10mg/ml的链霉素、10,000u/ml的青霉素g和25μg/ml两性霉素b浸泡12小时进行灭菌,支架使用前再次用pbs进行清洗。
<比较组>
(1)取8周龄雄性大鼠,水合氯醛注射腹腔麻醉后,颈部t形切开暴露双侧颌下腺,去除包膜切取颌下腺并尽可能保留颌下腺导管;浸入0.01m肝素化的pbs(磷酸盐缓冲液,肝素浓度25μg/ml),15min摇床振荡以去除血液;
(2)加入1000倍样品体积的5%和20%sds(十二烷基硫酸钠)水溶液,放入摇床中,室温200rpm振荡培养32小时,每隔8小时更换一次sds溶液;
(3)加入无菌去离子水,振荡4小时除去残留的sds;
(4)加入1%tritonx-100(聚乙二醇辛基苯基醚),静置培养2小时;
(5)加入0.02mg/mldnaasei(脱氧核糖核酸酶i)和20mg/mlrnaase(核糖核酸酶)在37℃的条件下,处理1小时;
(6)加入1000倍样品体积pbs(0.01mol/l)振荡培养2小时,重复3次;
(7)加入10mg/ml的链霉素,10,000u/ml的青霉素g和25μg/ml两性霉素b浸泡12小时进行灭菌,支架使用前再次用pbs清洗。
实施例2:大鼠颌下腺细胞的分离
(1)取3-4周龄雄性大鼠,腹腔注射麻醉后,颈部切开后剥离包膜,分离摘取颌下腺,无菌操作台内将颌下腺组织剪碎;
(2)将上述组织置于含3mg/ml的i型胶原酶和4mg/ml的dispase(中性蛋白水解酶)的消化液中,37℃下消化1小时,期间不断摇晃振荡。消化完成后过70μm细胞筛收集细胞,1200rpm离心5min,弃上清用megm培养液重新悬浮成单细胞悬液。
实施例3:脱细胞颌下腺的再细胞化和三维培养
(1)用1ml注射器通过颌下腺导管将实施例2中所述的单细胞悬液缓慢注入脱细胞的支架材料之上完成再细胞化过程;
(2)将细胞支架复合体静置于megm培养液中,并放入培养箱中培养12小时,以利于细胞粘附;
(3)最后将细胞支架复合体放入50ml规格旋转式三维器官培养系统中,加入megm培养基,调整旋转速度为10rpm,保证细胞支架复合体处于悬浮状态,并置于37℃,5%co2培养箱中。每2天更换一次培养基,培养时间为14天。
实施例4:脱细胞支架材料的结构观察和组织学分析
1,在实施例1的试验组中,随时间推移大鼠颌下腺由正常的粉红色逐渐变为白色,直至最终的半透明色,并且脱细胞后腺体的大小与自然的大鼠颌下腺相比未见明显减小(图1、2);
在5%sds的对照组中,可见大鼠颌下腺由正常粉红色变为接近白色,但与试验组相比未能达到半透明状态(图3a)。
在20%sds的对照组中,大鼠颌下腺组织处于已经崩解的状态(图3b),该结果证明20%的sds浓度过高,即20%浓度的sds不再适宜对大鼠颌下腺组织进行脱细胞处理。
2,对脱细胞支架材料进行he染色,组织学分析表明,脱细胞腺体的细胞成分被完全去除,而细胞外基质的结构,包括导管和腺泡结构则被保留(图4a)。he染色可见回植后的唾液腺出现血液循环、并出现充满分泌物的导管状结构(图中4b箭头所示)以及腺泡状结构(图4c中箭头所示);以上结构的出现,代表唾液腺行使分泌唾液、排除唾液的功能单元。
在5%sds的对照组中,he染色显示组织内仍含有大量腺上皮细胞,但大多聚集在中部,说明采用5%sds的浓度不足以解决本发明的技术问题并达到预期的技术效果(图5)。在20%sds对照组中,由于腺体已经基本崩解,无法形成完整的脱细胞支架,因此未做相关he染色。
3,为了进一步证实保存的组织结构,扫描电子显微镜可以观察到试验组中脱细胞后的颌下腺具有纤维样的胶原结构,腺小叶结构消失,说明作为唾液腺发挥功能的基本单元已经不存在,因此该种细胞支架材料回植后再次形成的腺泡、腺小叶等均是组织再生的功能单位,同时也表明该种支架材料有良好的非特异性(图6)。而5%sds的对照组中,由于细胞与纤维仍粘连包裹,尚无完整的纤维样结构(图7);20%sds对照组,腺体已经基本崩解,无法形成完整的脱细胞支架,因此未做扫描电镜观察。
实施例5:脱细胞颌下腺作为支架材料介导唾液腺再生潜力的评价
将实施例1中的试验组培养得到的脱细胞smg(颌下腺)作为支架被重新植入同种异体的smg混合细胞,并回植到同种异体的sd大鼠上。为了便于观察,用1%甲苯胺蓝染料与细胞混合注射显示均匀的细胞递送可以沿着管道系来实现。再细胞化的细胞支架复合体放入三维培养系统进行培养,可见复合体呈悬浮状态。经过14天的培养,he染色显示植入的细胞可以粘附并在细胞外基质支架内生长,植入的腺泡细胞能重建极性和组织形成腺泡状结构,这意味着一个分泌器官的基本功能单元可以再生。此外,有类似充满分泌物的导管状结构中也可以观察到(图4b)。另外,透射电镜扫描再生组织表明,腺泡上皮细胞的分泌功活跃,表现为细胞内的丰富分泌颗粒,腺泡上皮之间的紧密连接结构也可以观察到。这些结果表明,再生的smg可能有潜在的分泌功能。
对此相对,实施例1対照组(5%sds)培养得到的脱细胞smg(颌下腺),虽然组织结构较为完整,但经过he染色后组织内仍然含有腺上皮细胞,而透射电镜观察仍未见明显的纤维样结构,并含有细胞及胶原包裹的团块,因此5%sds作为培养脱细胞smg的浓度条件略低;对照组中20%sds作为能够使组织完整性得到破坏的临界浓度,经培养得到的脱细胞smg(颌下腺),在初期组织已经发生了崩解,因此作为脱细胞smg的浓度调节略高。经过以上实验表明12.5%sds可作为唾液腺再生脱细胞支架的理想浓度条件。
- 还没有人留言评论。精彩留言会获得点赞!