一种美白的外用组合物及其制备方法和用途与流程
本发明涉及一种美白的外用组合物及其制备方法和用途。
背景技术:
随着科学技术的发展和人民生活水平的不断提高,化妆品在人们生活中占据着越来越重要的地位。近年来,化妆品的品种不断增多,其功能性也越来越强,同时科技含量也越来越高。护肤品作为化妆品的代表性产品之一,也得到了长足的发展。
目前,市场上的护肤品主要有两种,一种是以化学合成物质为主要成分,虽然功效明显,但可能含有重金属或荧光粉等有害成分,长期使用会对皮肤产生一定的副作用;另一种为中药护肤品,作用缓和,毒副作用小。
目前,未见本发明外用组合物的相关报道。
技术实现要素:
本发明的目的在于提供一种美白的外用组合物及其制备方法和用途。
本发明首先提供了一种美白的外用组合物,它是由下述重量配比的原料药制备而成:
白及37~65份、白茯苓42~67份、人参25~40份、玉竹25~42份、丹参24~38份。
进一步地,它是由下述重量配比的原料药制备而成:
白及50份、白茯苓50份、人参33份、玉竹33份、丹参33份。
进一步地,它是由原料药的粉末、水或有机溶剂的提取物为活性成分,加上化妆品中可接受的辅料制备而成的制剂。
进一步地,所述辅料选自保湿剂、稳定剂、乳化剂、润滑剂、增溶剂、防腐剂、香精中的一种或多种;所述制剂为乳剂、膜剂、凝胶剂;
优选地,所述保湿剂选自甘油、玻尿酸、山梨醇、聚乙二醇、丙二醇、丁二醇、甜菜碱、聚谷氨酸;所述稳定剂选自黄原胶、卡波姆、纤维素、硅酸铝镁;所述乳化剂选自吐温-80、羊毛脂、PEG-40硬脂酸脂、乙酰化羊毛脂、司盘-80、甘油硬脂酸酯;所述润滑剂选自丙二醇、异三十烷、乙二醇单硬脂酸脂、月桂基硫酸三乙醇胺;所述增溶剂选自棕榈酸异丙酯、椰油酰胺丙基甜菜碱;所述防腐剂选自山梨酸钾、苯氧乙醇、双咪唑烷基脲、乙二胺四乙酸二钠、乙二胺四乙酸三钠、羟苯乙酯、羟苯丁酯。
优选地,它是由下述重量配比的组分组成:
原料药的水提醇沉物5~17份、保湿剂10~30份、防腐剂0.01~0.3份,和/或稳定剂0.01~0.5份,和/或润滑剂4~20份,和/或乳化剂5~10份,和/或香精0.3~0.6份,和/或增溶剂10~15份。
优选地,它是由下述重量配比的组分组成:
原料药的水提醇沉物10份、甘油10份、1%V/V的玻尿酸水溶液10份、黄原胶0.2份、山梨酸钾0.2份、水69.6份。
优选地,它是由下述重量配比的组分组成:
原料药的水提醇沉物10份、甘油10份、丙二醇8份、异三十烷10份、吐温-80 5份、羊毛脂2份、山梨酸钾0.2份、香精0.5份、水54.3份。
优选地,它是由下述重量配比的组分组成:
原料药的水提醇沉物8份、甘油8份、棕榈酸异丙酯8份、椰油酰胺丙基甜菜碱4份、月桂基硫酸三乙醇胺3份、乙二醇单硬脂酸脂1.5份、PEG-40硬脂酸脂3.8份、乙酰化羊毛脂1.2份、山梨酸钾0.2份、香精0.5份、水61.8份。
进一步地,所述外用组合物中原料药的含量为0.1~0.3g/ml,优选为0.2g/ml。
本发明还提供了上述外用组合物的制备方法,它包括以下步骤:按重量配比称取白及、白茯苓、人参、玉竹和丹参,水提醇沉后,加入化妆品中可接受的辅料即可。
本发明还提供了上述外用组合物在制备美白、抗氧化的药品或化妆品中的用途。
实验结果证明,本发明的外用组合物温和无刺激,适合长期使用,并且具有优良的美白、抗氧化作用,具有广阔的市场应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1为试验例1中豚鼠试验区域的划分:1、2区域为敷贴组区;3、4区域为不敷贴组区。
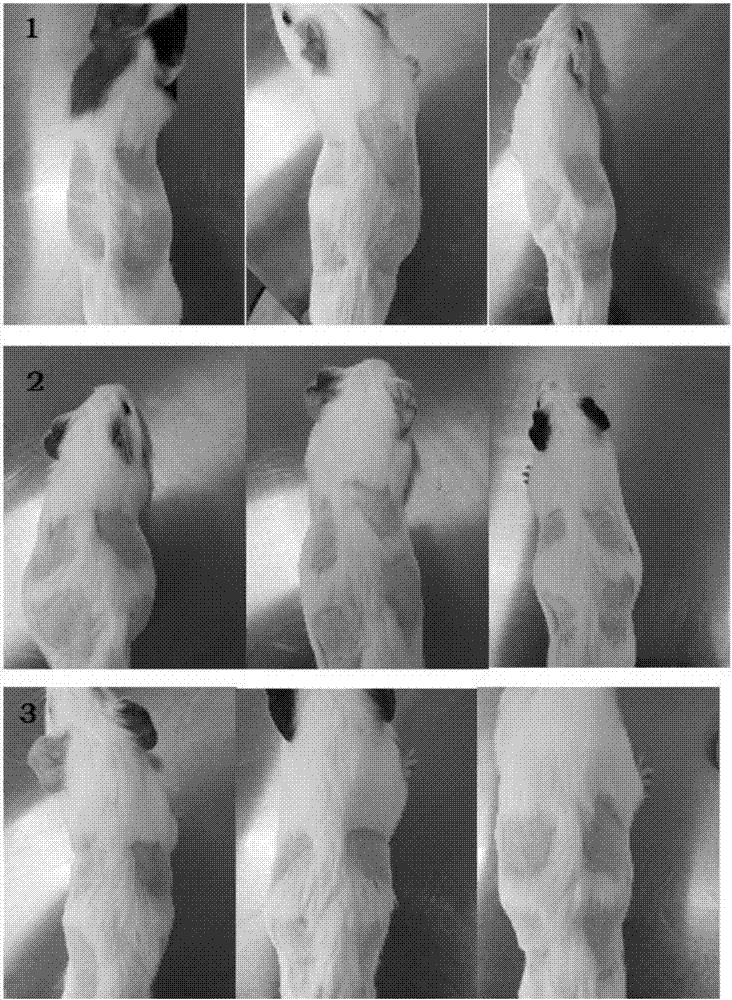
图2为本发明试验例1光过敏试验中各组豚鼠间光照射后背部皮肤对比,1为空白组,2为阳性组,3为受试组。
具体实施方式
本发明所用原料和仪器均可通过市场购买获得。
实施例1、本发明面膜的制备
1、中药提取物的制备
1)处方:白及50g,白茯苓50g,人参33g,玉竹33g,丹参33g。
2)制备方法:取处方量白及、白茯苓、人参、玉竹,加10倍量水浸泡0.5h后,回流提取2次,每次1.5h,滤过,合并滤液;取处方量丹参,粉碎至粗粉(过20目),加10倍量水50℃温浸1.5h,提取2次,滤过,合并滤液。将上述滤液进行合并,减压浓缩至滤液的1/10,加95%乙醇使含醇量达到75%,静置过夜,滤过,滤液减压浓缩至无醇味,制得100ml,备用。
2、面膜的制备
1)处方:见表1
表1
2)制备方法:
取处方量甘油与黄原胶混合均匀,作为A相;取处方量中药提取物、1%V/V玻尿酸溶液,加入山梨酸钾使溶解均匀,加水至300ml,作为B相;将A相均匀添加至B相中,加水至1000ml,搅匀,分装至铝箔袋中,每袋25ml,密封,即得。
3)使用方法:敷贴。一次一片,一日两次。
感官评价:本品为均匀液体;有一定粘稠度;浅棕色;气香。
理化指标:PH值:5.5~7.0;汞<0.2μg/g;砷<2.0μg/g;铅<5.0μg/g;苯酚<90μg/g;氢醌<180μg/g。
微生物指标:菌落总数:≤1000;粪大肠菌群:不得检出;金黄色葡萄球菌:不得检出;铜绿假单胞菌:不得检出;霉菌和酵母菌:≤100。
实施例2、本发明乳液的制备
1、中药提取物的制备
1)处方:白及37g,白茯苓42g,人参25g,玉竹25g,丹参24g。
2)制备方法:同实施例1。
2、乳液的制备:
1)处方:见表2
表2
2)制备方法:
取处方量丙二醇与中药提取物溶于热水,保持70℃,作为水相;使其它成分混合,加热溶解保持75℃,作为油相。在搅拌下慢慢将水相加入油相,一边搅拌,一边降温,温度降至38-42℃,加入香精和防腐剂,由均质器乳化,然后搅拌冷却至室温。
3)使用方法:于早晚洁面后,取适量的乳液涂抹于面部,轻轻按摩至充分吸收。
感官评价:本品为均匀液体;有一定粘稠度;浅棕色;气香。
理化指标:PH值:5.5~7.0;汞<0.2μg/g;砷<2.0μg/g;铅<5.0μg/g;苯酚<90μg/g;氢醌<180μg/g。
微生物指标:菌落总数:≤1000;粪大肠菌群:不得检出;金黄色葡萄球菌:不得检出;铜绿假单胞菌:不得检出;霉菌和酵母菌:≤100。
实施例3、本发明洁面乳的制备
1、中药提取物的制备
1)处方:白及65g,白茯苓67g,人参40g,玉竹42g,丹参38g。
2)制备方法:同实施例1。
2、洁面乳的制备:
1)处方:见表3
表3
2)制备方法:取处方量甘油、中药提取物和椰油酰胺丙基甜菜碱溶于热水,保持70℃,作为水相;使其它成分混合,加热溶解保持75℃,作为油相。在搅拌下慢慢将水相加入油相,一边搅拌,一边降温,温度降至38-42℃,加入香精和防腐剂,然后搅拌冷却至室温。
3)使用方法:洁面时,取适量本品于手心抹开后,将其均匀地涂抹于面部轻轻按摩,用温水清洗干净即可。
感官评价:本品为均匀液体;有一定粘稠度;浅棕色;气香。
理化指标:PH值:5.5~7.0;汞<0.2μg/g;砷<2.0μg/g;铅<5.0μg/g;苯酚<90μg/g;氢醌<180μg/g。
微生物指标:菌落总数:≤1000;粪大肠菌群:不得检出;金黄色葡萄球菌:不得检出;铜绿假单胞菌:不得检出;霉菌和酵母菌:≤100。
以下通过实验的方式来说明本发明的有益效果。
试验例1、本发明外用组合物的安全性评价
1、完整皮肤多次给药刺激性实验
1.1试验材料
(1)样品:实施例1制备的面膜。
(2)实验动物:日本大耳白兔,普通级,5只,体重2.12~2.45kg,3只雌2只雄。由四川省实验动物专委会养殖场提供,实验动物生产许可证号:SCXK(川)2013-14。
1.2试验方法
取大耳朵白兔5只,采用动物同体自身对照法,在给药前24h,将兔背部去毛,去毛范围沿兔头部向尾部方向,将家兔背部划分为2个区域,左右侧分别为空白对照组区、受试组区,各个区域之间留有适当距离,每个区域去毛面积为3cm×3cm。
给药:按组别分别于各区域敷贴相应的样品:受试组为实施例1制备的面膜,对照组为蒸馏水,然后用保鲜膜覆盖,用纱布及绷带固定,保持4h。4h后,温水洗净各区域皮肤。每天给药1次,连续7天。给药剂量见表4
表4给药剂量表
肉眼观察:每次给药前1h及给药后1h,在自然光线下进行观察并记录各区域有无红斑及水肿、涂布部位是否有色素沉着、出血点、皮肤粗糙或皮肤菲薄情况及其发生时间和消退时间,并对红斑及水肿按表5的皮肤刺激反应评分标准评分,计算各组皮肤总分的平均分值;按表6的皮肤刺激强度评分标准评价。
末次给药后,分别于1h、24h、48h和72h,在自然光线下进行观察并记录各区域有无红斑及水肿,并进行评分评价。
恢复期内每日,在自然光线下进行观察并记录各区域有无红斑及水肿,并进行评分评价。
表5皮肤刺激反应评分标准
表6皮肤刺激强度评价标准
1.3试验结果
敷贴每天观察结果见表7。
表7多次皮肤刺激积分值及结果
末次给药后1h、24h、48h、72h观察结果见表8。
表8多次皮肤刺激积分值及结果
从表7可以看出,连续给药7天,受试组积分值小于0.49,无刺激。从表8可以看出,停药后第二天受试组完全恢复正常。
2、多次给药眼刺激性实验
2.1试验材料
(1)样品:实施例1制备的面膜。
(2)实验动物:日本大耳白兔,普通级,3只,体重2.18~2.35kg,1只雌2只雄。由四川省实验动物专委会养殖场提供,实验动物生产许可证号:SCXK(川)2013-14。
(3)实验试剂配制:取水合氯醛,加0.9%氯化钠注射液制成10%的溶液备用。取荧光素钠,加0.9%氯化钠注射液制成3%的溶液备用。
2.2试验方法
给药前24h,对白兔双眼进行检查,眼部应无损伤。于每只白兔的左眼滴入面膜液0.1ml,于右眼滴入蒸馏水0.1ml。给药后轻合眼睑10秒,以保证药液与局部有充分的接触。给药周期:每天给药1次,连续1周。给药剂量剂量表见表9
表9多次给药眼刺激性试验给药剂量表
于每天给药前以及末次给药后1、24、48和72小时,于白兔耳缘静脉注射10%水合氯醛,注射体积为5ml/kg,待白兔麻醉后,于白兔左右眼分别滴入3%的荧光素钠溶液,使用裂隙灯观察结膜、角膜、虹膜,肉眼观察上下眼睑是否有刺激性,依据表10眼刺激反应分值标准评分,将每个观察时间点每只动物的眼角膜、虹膜和结膜的刺激反应分值相加得总积分,将每组的积分总和除以动物数,即得最后分值。按表11眼刺激强度评分标准评价。
给药结束后,用温水去除残留药物,观察1h、24h、48h、72h到一周眼刺激情况,以及刺激的恢复情况及时间。
表10眼刺激反应分值标准
表11眼刺激性评价标准
2.3试验结果
眼部给药每天观察结果见表12
表12眼刺激积分值及结果
末次给药后1h、24h、48h、72h观察结果见表13。
表13眼刺激积分值及结果
从表12可以看出,经连续给药7天,受试组积分小于4,无刺激。从表13可以看出,停药后受试组无刺激。
3、皮肤光过敏性试验
3.1试验材料
(1)样品:
受试品:实施例1制备的面膜。
阳性对照品:8-甲氧基补骨脂(8-MOP),批号:J0813A,规格:100mg,美仑生物。
(2)实验动物:白色豚鼠,体重258.4~289.3g,雌雄各半。由四川省实验动物专委会养殖场提供,实验动物生产许可证号:SCXK(川)2013-14。
3.2试验方法
于试验前24h,在动物背部去毛,去毛范围沿动物头部向尾部方向,将动物背部划分为4个区域(见图1),去毛范围为脊柱右侧两个区域,左侧两个区域,各个区域之间留有适当距离,每个区域去毛面积为3cm×3cm。去毛时用电动理发器去毛后,用温水洗净皮肤。皮肤应完好无损伤及异常。
固定动物,按组别分别于每组动物的去毛区域(1和2)敷贴8-MOP 0.2ml、蒸馏水0.2ml、面膜0.2ml;去毛区域(3和4)不敷贴。给药后30min后,所有动物右侧区域(2和4)用铝箔覆盖,胶带固定,左侧(1和3)置于UVA进行照射。照射区域距光源垂直距离为10cm范围内。照射剂量为10J/cm2,根据所测光强度计算得出照射时间。照射完毕后用37℃灭菌水擦拭供试品。给药剂量见表14。
表14皮肤光敏性试验给药剂量
首次致敏至试验结束期间,每日按表15指标观察每只豚鼠的症状。
表15豚鼠致敏期间一般情况观察表
给药结束后1h、24h、48h、72h,按表16详细观察每只动物皮肤红斑、焦痂形成和水肿的反应症状。
表16豚鼠皮肤光过敏试验皮肤反应的评分标准
评价分值=分值总和/动物数
分值为1~4分的动物判定为光致敏阳性,受试品的光致敏率以及分级见表17。
致敏率(%)=(阳性动物数/动物数)×100%
表17豚鼠光过敏试验皮肤反应评价标准
每天观察结果见表18、19、20。
表18空白组光过敏积分值及结果
表19阳性组光过敏积分值及结果
表20受试组光过敏积分值及结果
表18、19、20显示,空白组与受试组的24h、48h、72h皮肤红肿积分≥2的实验动物数为0,光致敏率为0。阳性组的24h、48h、72h皮肤红肿积分≥2的实验动物数为6,光致敏率为100%。
4、皮肤变态反应试验
4.1试验材料
(1)样品:
受试品:实施例1制备的面膜。
阳性对照品:2.4-二硝基氯苯,批号:2017062901,规格:AR 100g,用乙醇配成0.1%的溶液和1%的溶液备用。
(2)实验动物:白色豚鼠,体重259.2~289.7g,雌雄各半。由四川省实验动物专委会养殖场提供,实验动物生产许可证号:SCXK(川)2013-14。
4.2试验方法
取适应性观察合格白色豚鼠40只,空白组10只,受试组20只,阳性组10只,雌雄各半。
诱导给药:致敏前约24h,将豚鼠背部右侧去毛约3cm×3cm。将受试药品0.2ml涂在豚鼠去毛区3cm×3cm的皮肤上,用两层纱布和一层玻璃纸覆盖,再以无刺激性胶布封闭固定6h后拆去胶布并用温水洗净。第7天和第14天按同样的方法重复一次。阳性对照(1%2.4-二硝基氯苯溶液)和空白对照以同样的方式给药。给药剂量见下表19。
激发给药:激发前约24h,将豚鼠背部左侧去毛约3cm×3cm。在末次诱导后14d,将0.2ml受试药品涂于豚鼠背部左侧约2cm×2cm去毛区,然后用两层纱布和一层玻璃纸覆盖,再用无刺激胶布封闭固定6h,6h后去除供试品。阳性对照(0.1%2.4-二硝基氯苯溶液)和空白对照以同样的方式给药。给药剂量见下表21。
表21皮肤变态反应试验给药剂量表
注:阳性组1%为诱导给药浓度,阳性组0.1%为激发给药浓度。
给药前及每次致敏后的6h、24h观察皮肤红斑、水肿和其他异常反应,按表20对红斑和水肿进行评分。激发给药后,于6h、24h、48h、72h观察观察皮肤红斑、水肿和其他异常反应,按表22红斑和水肿进行评分。出现皮肤反应积分≥2时,判为该动物出现皮肤变态反应阳性,按表23判定受试药品的致敏率。
表22皮肤变态反应试验皮肤反应评分
注:致敏率(%)=(阳性动物数/动物数)×100%
4.3试验结果
表24豚鼠局部皮肤变态试验反应结果
注:*为皮肤红斑和水肿强度积分总分。
由表24显示,本试验受试组豚鼠皮肤变态反应实验结果红斑水肿总分≥2的豚鼠为0例,致敏率为0;阳性组豚鼠皮肤变态反应实验结果红斑水肿总分≥2的豚鼠为7例,致敏率为70%。
试验例2、本发明外用组合物的功效试验
1、试验材料
(1)试剂
酪氨酸酶,批号:35P16228,规格:1800u/mg,上海源叶
左旋多巴(L-DOPA),批号:O25M8K32143,规格:100g,上海源叶
磷酸二氢钠,批号:20071111,规格:500g,成都科龙
磷酸氢二钠,批号:110406,规格:500g,四川西陇
1,1-二苯基-2-三硝基苯肼(DPPH),批号:W10A8E33599,规格:1g,上海源叶
乙醇,批号:161008,规格500ml,四川西陇
水合氯醛,批号:2015090601,规格250g,成都科龙
氯化钠注射液,批号:c117022705,规格100ml:0.9g,山东科伦
(2)受试材料
实施例1制备的中药提取物(YYMB)
熊果苷,批号:227B021,规格:5g,上海源叶
维生素C,批号:J07N7R24305,规格100g,上海源叶
(3)试验动物
昆明种小鼠,SPF级,雌雄各半,32只,4-7周龄,体重18-22g;由成都达硕实验动物有限公司提供,实验动物生产许可证号:SCXK(川)2015-030。
2、皮肤微血管血流量试验
2.1给药药液配制
空白对照组给药药液:蒸馏水,直接取用。
YYMB低剂量组给药药液:称取YYMB 0.6667g,加入蒸馏水50ml,配置成浓度为0.1g生药材/ml的溶液(0.1g生药材/ml=0.6667g提取物×7.5g生药材/g提取物÷50ml)。
YYMB中剂量组给药药液:称取YYMB 1.3333g,加入蒸馏水50ml,配置成浓度为0.2g生药材/ml的溶液(0.2g生药材/ml=1.3333g提取物×7.5g生药材/g提取物÷50ml)。
YYMB高剂量组给药药液:称取YYMB 2.0000g,加入蒸馏水50ml,配置成浓度为0.3g生药材/ml的溶液(0.3g生药材/ml=2.0000g提取物×7.5g生药材/g提取物÷50ml)。
所述7.5g生药材/g提取物是指每7.5g生药材制备得到1g提取物。
2.2试验方法
小鼠用7%的水合氯醛麻醉后,各组按表25给药一次。将小鼠耳廓平铺于微循环观测系统的显微镜下,观察并记录血流状态,分别在给药前5min,给药后5、10、20、40、80min时间点记录血流速。
表25给药剂量表
2.3试验结果
表26小鼠耳廓皮肤血流速度表(um/s,)
注:
1.同一组不同时间点与给药前比较,1P<0.05,2P<0.01,3P<0.001。
2.同一时间点不同组与空白对照组对比,aP<0.05,bP<0.01,cP<0.001。
3.同一时间点不同组与YYMB低剂量组比较,dP<0.05,eP<0.01,fP<0.001。
4.同一时间点不同组与YYMB中剂量组比较,gP<0.05,hP<0.01,iP<0.001。
5.同一时间点不同组与YYMB高剂量组比较,jP<0.05,kP<0.01,mP<0.001。
由表26显示,YYMB低剂量组给药后5、10、20min和YYMB中剂量组给药后5、10、20、40min的耳廓皮肤血流速度极显著高于给药前,差异有统计学意义(P<0.001);YYMB低剂量组给药后40min和YYMB高剂量组给药后5、10min的耳廓皮肤血流速度明显高于给药前,差异有统计学意义(P<0.01);YYMB低剂量组80min和YYMB高剂量组20min的耳廓皮肤血流速度高于给药前,差异有统计学意义(P<0.05)。
YYMB低剂量组和YYMB中剂量组给药后5、10、20、40、80min的耳廓皮肤血流速度极显著高于空白组,差异有统计学意义(P<0.001);YYMB高剂量组给药后5、10min的耳廓皮肤血流速度明显高于空白组,差异有统计学意义(P<0.01);YYMB高剂量组给药后20、40min的耳廓皮肤血流速度高于空白组,差异有统计学意义(P<0.05)。
给药后YYMB低剂量组和YYMB中剂量组给药后5、10、20、40、80min的耳廓皮肤血流速度均无差异;给药后YYMB低剂量组给药后5、10、20min的耳廓皮肤血流速度明显高于YYMB高剂量组给药后5、10、20min的耳廓皮肤血流速度,差异有统计学意义(P<0.01);给药后YYMB低剂量组给药后40、80min的耳廓皮肤血流速度极显著高于YYMB高剂量组给药后40、80min的耳廓皮肤血流速度,差异有统计学意义(P<0.001)。给药后YYMB中剂量组给药后80min的耳廓皮肤血流速度明显高于YYMB高剂量组给药后80min的耳廓皮肤血流速度,差异有统计学意义(P<0.01);给药后YYMB中剂量组5、10、20、40min的耳廓皮肤血流速度极显著高于YYMB高剂量组给药后5、10、20、40min的耳廓皮肤血流速度,差异有统计学意义(P<0.001)。
结果显示本发明面膜的中药提取液能明显加快小鼠耳廓皮肤毛细血管血流速度,改善血液循环;YYMB低剂量组和YYMB中剂量组比YYMB高剂量组加快小鼠耳廓皮肤毛细血管血流速度的效果好。
3、酪氨酸酶活性测定
3.1试剂配制
磷酸缓冲液(PBS):称取磷酸二氢钠15.6003g加蒸馏水溶解成500mL,配成甲液;称取磷酸氢二钠35.8207g加蒸馏水溶解成500mL,配成乙液液。分别取甲液51ml和乙液49ml,均匀混合得0.2mol/L,PH=6.8的溶液,备用。
酪氨酸酶溶液:取样品0.0115g,加入0.2mol/LPBS溶液50ml,配成200U/ml的溶液,备用。
L-DOPA:称取样品0.0751g,加入0.02mol的盐酸50ml,配成0.15%的溶液,密封,备用。
熊果苷水溶液:称取样品2.5003g,加入蒸馏水50ml,加热40℃溶解,配成5%的溶液,避光保存,备用。
3.2分组
阳性对照组:熊果苷水溶液。
空白对照组:蒸馏水。
YYMB低剂量组:称取YYMB 2.6667g,加入蒸馏水50ml,配置成浓度为0.4g生药材/ml的溶液(0.4g生药材/ml=2.6667g提取物×7.5g生药材/g提取物÷50ml)。
YYMB中剂量组:称取YYMB 5.3333g,加入蒸馏水50ml,配置成浓度为0.8g生药材/ml的溶液(0.8g生药材/ml=5.3333g提取物×7.5g生药材/g提取物÷50ml)。
YYMB高剂量组:称取YYMB 8.0000g,加入蒸馏水50ml,配置成浓度为1.2g生药材/ml的溶液(1.2g生药材/ml=8.0000g提取物×7.5g生药材/g提取物÷50ml)。
所述7.5g生药材/g提取物是指每7.5g生药材制备得到1g提取物。
由于各组药液与总反应液比值为1:4,因此本发明面膜中药提取物在反应液中的终浓度分别为0.1g生药材/ml、0.2g生药材/ml、0.3g生药材/ml。
3.3试验方法
按表27取各个组分混合均匀,25℃孵育10min,加入L-DOPA0.5ml,继续孵育10min,立即于分光光度计475nm处测定吸光度值A。酪氨酸酶活性抑制率计算公式:抑制率I(%)=[(C-D)-(A-B)]/(C-D)×100%
表27酪氨酸酶活性检测的反应液组成
3.4试验结果
表28酪氨酸活性抑制率(%,)
注:
1.与阳性对照组对比,aP<0.05,bP<0.01,cP<0.001。
2.与空白对照组对比,dP<0.05,eP<0.01,fP<0.001。
3.与YYMB低剂量组比较,gP<0.05,hP<0.01,iP<0.001。
4.与YYMB中剂量组比较,jP<0.05,kP<0.01,lP<0.001。
5.与YYMB高剂量组比较,mP<0.05,nP<0.01,oP<0.001。
由表28显示,阳性对照组酪氨酸活性抑制率极显著高于空白对照组,差异具有统计学意义(P<0.001)。
YYMB中剂量组和YYMB高剂量组酪氨酸活性抑制率极显著高于阳性对照组,差异具有统计学意义(P<0.001);YYMB低剂量组酪氨酸活性抑制率高于阳性对照组,无差异。
YYMB中剂量组和YYMB高剂量组酪氨酸活性抑制率极显著高于空白对照组,差异具有统计学意义(P<0.001);YYMB低剂量组酪氨酸活性抑制率明显高于空白对照组,差异具有统计学意义(P<0.01)
YYMB高剂量组酪氨酸活性抑制率明显高于YYMB中剂量组酪氨酸活性抑制率,差异具有统计学意义(P<0.01);YYMB中剂量组酪氨酸活性抑制率明显高于YYMB低剂量组酪氨酸活性抑制率,差异具有统计学意义(P<0.01)
各剂量组中,YYMB高剂量组的酪氨酸活性抑制率最高。
4、DPPH自由基清除率测定
4.1试剂配制
DPPH溶液:准确称取DPPH试剂0.1288g,用95%乙醇溶解定容至500ml容量瓶中,得浓度为257.7mg/lDPPH溶液,摇匀至冰箱中冷藏备用。
维生素C溶液:取样品0.0400g,加入蒸馏水100ml,配成0.4mg/ml的水溶液,再加入无水乙醇100ml稀释至0.2mg/ml的溶液,备用。
4.2分组
阳性对照组:维生素C溶液。
YYMB低剂量组:称取YYMB 2.6667g,加入蒸馏水50ml,配置成浓度为0.4g生药材/ml的溶液(0.4g生药材/ml=2.6667g提取物×7.5g生药材/g提取物÷50ml)。
YYMB中剂量组:称取YYMB 5.3333g,加入蒸馏水50ml,配置成浓度为0.8g生药材/ml的溶液(0.8g生药材/ml=5.3333g提取物×7.5g生药材/g提取物÷50ml)。
YYMB高剂量组:称取YYMB 8.0000g,加入蒸馏水50ml,配置成浓度为1.2g生药材/ml的溶液(1.2g生药材/ml=8.0000g提取物×7.5g生药材/g提取物÷50ml)。
所述7.5g生药材/g提取物是指每7.5g生药材制备得到1g提取物。
由于各组药液与总反应液比值为1:4,因此面膜中药提取物在反应液中的终浓度分别为0.1g生药材/ml、0.2g生药材/ml、0.3g生药材/ml。
4.3试验方法
在比色皿中依次加入表29中的各组分,混匀,待反应稳定后,以95%乙醇为参比,在波长517nm处测吸光值,记为A。自由基清除率计算公式:Y(%)=[1-(A-B)/C]×100%
表29酪氨酸酶活性检测的反应液组成
4.4试验结果
表30自由基清除率(%,)
注:
1.与阳性对照组对比,aP<0.05,bP<0.01,cP<0.001。
2.与YYMB低剂量组比较,dP<0.05,eP<0.01,fP<0.001。
3.与YYMB中剂量组比较,gP<0.05,hP<0.01,iP<0.001。
4.与YYMB高剂量组比较,jP<0.05,kP<0.01,lP<0.001。
YYMB低剂量组的自由基清除率比阳性对照组低,差异有统计学意义(P<0.05);YYMB中剂量组和YYMB高剂量组自由基清除率与阳性对照组比较无差异。
结果显示YYMB中剂量组和YYMB高剂量组自由基清除率与阳性组相近,YYMB中剂量组和YYMB高剂量组均具有较好的抗氧化作用。
通过本次试验测定小鼠耳廓皮肤毛细血管血流速度、酪氨酸酶活性抑制率和DPPH自由基消除率,考察了本发明面膜中药提取物三个剂量组的美白功效。试验结果显示各剂量组均能加快小鼠耳廓皮肤毛细血管血流速度,改善血液循环,其中YYMB低剂量组和YYMB中剂量组改善血液循环效果较好;各剂量组均能抑制酪氨酸酶活性,减少黑色素合成,其YYMB高剂量组酪氨酸活性抑制效果最好;各剂量组均有较好的抗氧化作用,其中YYMB中剂量组和YYMB高剂量组抗氧化作用较好。YYMB中剂量组(0.2g生药材/ml)的美白功效最为明显。
综上,本发明的外用组合物温和无刺激,适合长期使用,并且具有优良的美白、抗氧化作用,具有广阔的市场应用前景。
- 还没有人留言评论。精彩留言会获得点赞!