汉黄芩素在制备抗轮状病毒药物的应用的制作方法
本发明涉及汉黄芩素技术领域,具体涉及汉黄芩素在制备抗轮状病毒药物的应用。
背景技术
轮状病毒(rotavirus,rv)是导致婴幼儿急性腹泻的主要病原体,每年约有60万名婴幼儿因rv感染死亡,主要在秋冬季流行,其发生流行不受卫生状况影响。发达国家发病率与发展中国家相差不多,但发展中国家的死亡率却远远高于发达国家。rv一般通过粪-口途径传播,潜伏期2~4天。以前认为rv主要侵犯小肠细胞绒毛,病人最主要的症状是腹泻,起病急,日十余次到数十次,可伴有发热,感染后血液中很快出现特异性lgm、lgg抗体,肠道局部出现分泌型lga,可中和病毒,对同型病毒感染有作用。病程3~5天或一周左右。最近的研究表明rv感染不仅限于肠道,还可侵犯其他的系统,引起许多并发症,如休克、脑病、心脏损害和肝外胆管阻塞。
目前尚无治疗rv感染的特效药物。而有关rv疫苗方面,国内尚处于研究阶段,国外上市rv疫苗价格昂贵,rv毒株的多样性使其预防范围有限。现临床多采用who推荐的口服补液以缓解症状。因此,发现、开发安全有效的药物防治轮状病毒感染非常重要。
汉黄芩素(结构式如下)是来源于中药唇形科黄芩属多年生草本植物黄芩(scutellariabaicalensisgeorgi)根的提取分离达到的黄酮类化合物,具有镇静、保肝、利胆、抗菌、消炎等作用,已有研究表明,汉黄芩素对流感病毒、单纯胞疹病毒、柯萨奇病毒、呼吸道合胞病毒、丙型肝炎病毒等有抑制作用,但汉黄芩素对rv是否有作用尚未报道。
汉黄芩素的结构式。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供汉黄芩素在制备抗轮状病毒药物的应用。
为了实现上述目的,本发明采用如下技术方案:
提供汉黄芩素在制备抗轮状病毒药物的应用。
所述抗轮状病毒的药物中,所述汉黄芩素的摩尔浓度为2.5umol/l~80umol/l。
所述抗轮状病毒的药物中,所述汉黄芩素对细胞产生毒性的摩尔浓度为大于160umol/l。
所述抗轮状病毒的药物为片剂、颗粒剂、散剂、胶囊、微丸、液体制剂、半固体制剂、纳米、微乳或脂质体的制剂。
所述抗轮状病毒的药物包括以汉黄芩素作为组份的组合物或复方制剂。
本发明与现有技术相比较,有益效果在于:
本发明的汉黄芩素在制备抗轮状病毒药物的应用,是申请人首次研究发现汉黄芩素具有抗轮状病毒的作用,填补了抗轮状病毒药物的空白,具有深远的意义和价值。
附图说明
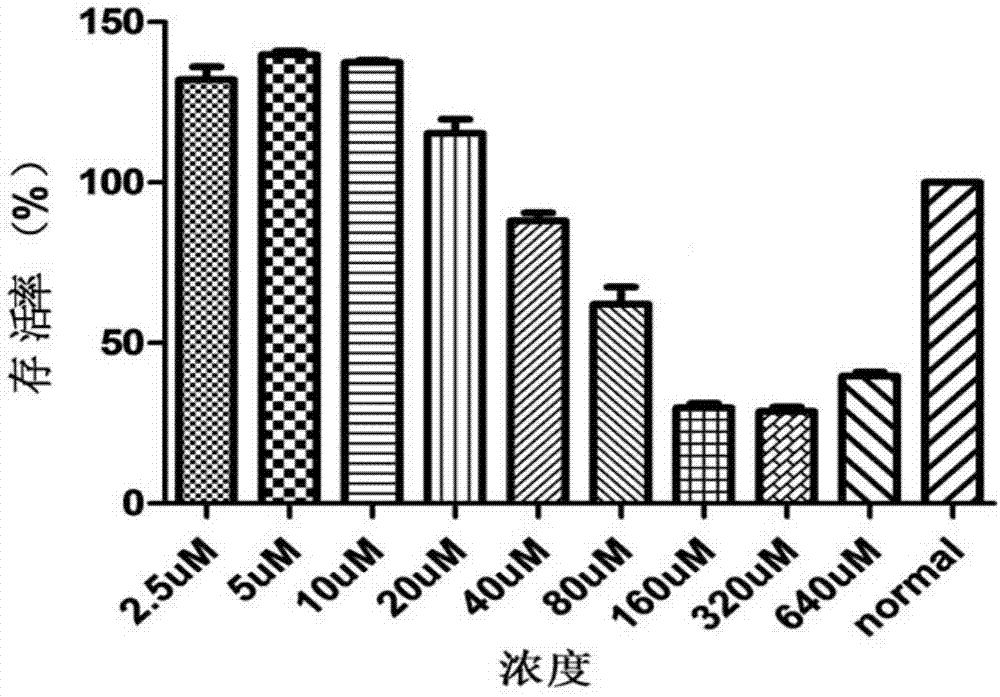
图1是汉黄芩素的细胞毒性实验结果图。
具体实施方式
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图和实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1。
本实施例的汉黄芩素在制备抗轮状病毒药物的应用,是申请人首次研究发现汉黄芩素具有抗轮状病毒的作用,填补了抗轮状病毒药物的空白,具有深远的意义和价值。
实施例2。
本实施例的汉黄芩素在制备抗轮状病毒药物的应用,其中,抗轮状病毒的药物中,汉黄芩素的摩尔浓度为2.5umol/l~80umol/l。
实施例3。
本实施例的汉黄芩素在制备抗轮状病毒药物的应用,其中,抗轮状病毒的药物中,汉黄芩素对细胞产生毒性的摩尔浓度为大于160umol/l。
实施例4。
本实施例的汉黄芩素在制备抗轮状病毒药物的应用。其中,抗轮状病毒的药物为片剂、颗粒剂、散剂、胶囊、微丸、液体制剂、半固体制剂、纳米、微乳或脂质体的制剂。
实施例5。
本实施例的汉黄芩素在制备抗轮状病毒药物的应用。其中,抗轮状病毒的药物包括以汉黄芩素作为组份的组合物或复方制剂。
实验:
一、实验材料
实验药品:
汉黄芩素(上海源叶生物科技有限公司,纯度98%,批号:c19a8q34235)。
实验试剂:
dmem培养液、胎牛血清均为gibco公司提供;
mtt(4,5,二甲基噻唑-2,5,二苯基四唑溴化物),m1124amresco公司提供;
青霉素-链霉素混合溶液、胰蛋白酶、pbs、二甲基亚砜均为solarbio公司提供。
试剂的配制和分装:
(1)胎牛血清分装在灭菌的50ml离心管中,-20℃保存。
(2)胰蛋白酶分装在灭菌的10ml离心管中,-20℃保存。
(3)霉素-链霉素混合溶液分装在灭菌的10ml离心管中,-20℃保存。
(4)mtt应用液:
mtt粉50mg,pbs10ml,搅拌溶解,0.22μm滤膜滤过除菌,分装后-20℃避光保存备用。
实验器材:
96孔细胞培养板、可调式微量加样器、细胞培养瓶、滤器、吸管、恒温箱、消毒锅;
洁净操作台sik-202型,安徽蚌埠净化设备厂提供;
olympμs倒置光学显微镜ckx41;
酶联免疫检测仪dg3022a;
二氧化碳孵育箱,美国thermo公司提供;
细胞与病毒;
caco-2细胞(结肠癌细胞),ma104(恒河猴肾细胞),wa株轮状病毒。
二、实验方法
(一)细胞和病毒:
caco-2细胞在含10%胎牛血清,100μ/ml青霉素,100μg/ml链霉素的dmem培养液中生长和传代。感染病毒为适应细胞培养增殖的人wa株轮状病毒。
(二)药物的细胞毒性实验:
黄芩苷溶液配制:称取黄芩苷样品2mg,先用dmso(二甲基亚砜)溶解后加入用适量dmem溶解,以dmso终浓度不超过0.5%为标准,并设置溶剂对照组。洁净台内无菌操作用一次性滤头过滤除菌。计算初浓度。各种药物终浓度25umol/l~200umol/l。
细胞毒性实验:将caco-2细胞以6×103个/ml的细胞密度,加入在96孔细胞培养板上每孔100μl。37℃5%co2孵育至细胞生长成单层。吸出生长液,先按照1:1、1:10、1:100、1:1000的比例用不含血清的dmem培养液进行稀释得到一系列浓度的药液,然后100μl/孔加入到96孔板内,每个浓度重复6孔。正常对照只加入等体积不含血清的dmem维持液。37℃5%co2孵育,光学显微镜连续观察,48小时之内若药物的第一、第二浓度之间有细胞毒性变化之外的其余三个药物浓度的细胞均正常。这表明有效浓度在1:1与1:100之间。按照1:1,1:2、1:4、1:8、1:16、1:32、1:64的比例得到一系列浓度药液,重复上述操作,光学显微镜下发现72小时以内高于1:4的药物浓度出现细胞毒性变化。
37℃5%co2孵育,光学显微镜连续观察2d后,将药液吸出,避光,加入5mg/ml的mtt25μl/孔(用不含血清的dmem培养基配制,避光放置),37℃5%co2孵育4h后,800r/ml离心,弃上清,加入dmso50μl/孔,室温下振荡约10min,待结晶溶解后,混匀,在酶标仪上检测490nm波长下每孔的光密度(opticaldensity,od)值。按下列公式求出细胞存活率:
细胞存活率%=药物组平均吸光度值/细胞对照组平均吸光度值×100%。
(三)病毒增殖和滴度测定:
wa株rv的增殖和滴度测定在ma104上进行。当细胞在培养瓶中生长至单层时接种rv。接种病毒前,细胞单层先用磷酸盐缓冲液(pbs,ph7)洗一次,用无血清dmem培养液洗两次。接种前,将原始病毒液从-80℃冰箱中取出,4℃溶解,37℃与10μg/ml的胰酶作用30min,将长成单层的ma104细胞用pbs冲洗两次。随后加入与胰酶孵育后的病毒液,接种病毒后的细胞维持液为无胎牛血清,含1μg/ml胰酶的dmem培养液。接种病毒后的细胞放37℃二氧化碳培养箱(含5%二氧化碳)中孵育,至病毒感染ma104细胞病变(cpecytopathiceffect)达到+++时,将培养瓶放入-20℃冻存,再4℃融解,如此反复冻融三次,低温高速12000r/min离心取上清收获病毒液,再同上法重复一次病毒在细胞中传代实验,收获病毒。分装,-80℃保存。
病毒感染性滴度测定用ma104细胞在96孔培养板中进行(微量滴定法)。在用不含血清的dmem培养液将其按照1:10稀释成10-110-210-3…10-6等系列浓度,将培养成单层ma104细胞的96孔板用pbs冲洗2次,再将不同稀释度的病毒加入到96孔细胞培养板中,25μl/孔每个浓度重复8孔。设置正常对照细胞,37℃5%co2孵育2h后吸取出病毒液,加入不含血清的细胞培养液,200μl/孔。37℃5%co2孵育,连续观察。当能够出现细胞病变cpe的最低稀释度的病毒孔中不再继续出现cpe时,计数每个稀释度出现cpe的细胞孔数,按照reed-mμnch方法计算病毒的tcid50(tissuecultureinfectivedose)。
(四)药物抗rv作用:
在实验中我们首先选择药物tc90-95的浓度进行以下抗rv实验,然后将筛选出的有抗rv作用的药物后,用dmem培养液(不含血清)倍比稀释,考察不同浓度抗rv作用。
(五)药物对病毒吸附细胞的作用:
在生长成单层的caco-2细胞的96孔培养板内加入药液,每个药液重复6孔,100μl/孔。设置正常细胞对照组,病毒对照组均只加入等体积dmem培养液(不含血清)。37℃5%co2孵育2h。
将药液吸出,除正常对照组以外加入100tcid50的病毒(病毒与10μg/ml浓度的胰酶37℃作用30min)100μl/孔,37℃5%co2孵育2h,将病毒吸出,加入细胞维持液200μl/孔,37℃5%co2孵育连续观察。
待细胞出现cpe在++-+++间时将维持液吸出,加入5mg/ml的mtt50μl/孔,孵育2h后弃上清。加入dmso25μl/孔,室温下震荡混匀约10min。随后490nm下酶联免疫检测仪读取吸光度值。
按照下列公式计算药物对病毒抑制率和治疗指数:
药物对病毒抑制率=(药物组平均吸光度值—病毒对照组平均吸光度值)/(正常细胞对照组平均吸光度值—病毒对照组平均吸光度值)×100%,重复实验三次。
采用治疗指数(treatmentindex,ti)作为评价指标,衡量药物对rv的抑制效力,ti=cc50/ic50。
注:在光学显微镜下观察,无cpe,记作:—;25%的细胞出现cpe,记作:+;25%-50%的细胞出现cpe,记作:++;50%-75%的细胞出现cpe,记作:+++;75%-100%的细胞出现cpe,记作:++++。
(六)药物对病毒的直接灭活作用:
将药物与100tcid50的病毒液(病毒与10μg/ml浓度的胰酶作用30min)等体积混合作用2h。
将其加入到生长成单层caco-2细胞的96孔培养板内,之前用pbs将细胞冲洗2次。设置正常细胞对照组,病毒对照组均只加入等体积dmem。37℃5%co2孵育2h,然后将混合液吸出,加入细胞维持液100μl/孔,37℃5%co2孵育连续观察,待细胞出现cpe在++—+++间时同上法做mtt检测,并计算药物对病毒的抑制率和治疗指数。
(七)药物对病毒生物合成的作用:
(1)将100tcid50的病毒液(病毒与10μg/ml浓度的胰酶作用30min)加入到生长成单层的caco-2细胞96孔培养板内100μl/孔,之前用pbs将细胞冲洗2次。设细胞正常对照,加入等体积dmem培养液。37℃5%co2孵育2h,然后将病毒液吸出,加入药液100μl/孔,设病毒对照,只加入等体积dmem培养液。
(2)37℃5%co2孵育2h,之后将药液吸出,加入细胞维持液100μ/孔,37℃5%co2孵育连续观察。
(3)即细胞cpe在++—+++间时按照上法做mtt检测,并计算药物对病毒的抑制率和治疗指数。
(八)统计分析
采用spss13.0软件,选择one-wayanova法,将用药组od值与模型组od值进行均数比较。选择probit回归法,将药物浓度与细胞存活率,药物浓度与药物对病毒的抑制率进行回归分析。得到药物的细胞半数存活浓度cc50,药物对病毒感染细胞半数的抑制浓度ic50,并按照治疗指数ti=细胞半数存活药物浓度/抑制半数病毒药物浓度,计算治疗指数。
三、实验结果
(一)汉黄芩素细胞毒性实验结果:
汉黄芩素对caco-2的细胞毒性作用(n=3)实验结果见附图1所示,结果表明汉黄芩素在浓度2.5~80umol/l均未出现细胞毒性,当浓度大于160umol/l出现明显的细胞毒性。
(二)汉黄芩素预防轮状病毒入侵细胞的实验结果:
表1汉黄芩素预防轮状病毒入侵细胞作用(n=3)
由表1的结果表明,在30~60umol范围内随着汉黄芩素浓度的提高,其抗rv吸附的作用越大,表明汉黄芩素(在一定范围内)抗rv吸附的作用随浓度增加而增强,在60umol浓度下,其抗rv的吸附作用开始减弱。
(三)汉黄芩素直接灭活轮状病毒的实验结果:
表2汉黄芩素对rv生物直接灭活作用(n=3)
由表2的结果表明,在30~70umol范围内汉黄芩素具有直接灭活rv的作用,汉黄芩素灭活rv的作用与汉黄芩素的浓度无线性关系。
(四)汉黄芩素对病毒生物合成的作用:
mtt显示各药物浓度组od值与病毒对照组相比较差异无显著性,p>0.05(n=3)。结果表明,药物对病毒合成作用无明显效果。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!