人β-防御素3的新用途及其制备方法与流程
本发明涉及一种活性小分子蛋白质的新用途及其制备方法,特别是人β-防御素3的新用途及其制备方法。
背景技术
近年来,随着广谱抗生素、激素、免疫抑制剂的广泛应用,以及aids的蔓延、器官移植和介入技术的推广应用,使真菌感染的发病率呈现上升趋势,2014年的真菌感染率为20世纪90年代的数倍,念珠菌属和曲霉属是目前最常见的真菌感染的病原菌,某些真菌引起的系统性感染致死率高达90%。对于艾滋病患者(aids),真菌感染是最常见的机会性感染,其发病率和死亡率均较高。虽然不同作用机制的抗真菌药物在治疗真菌感染中发挥了重要作用,但随着感染菌种逐渐发生变化,有关耐药菌株的报道逐渐增多,使得真菌感染的治疗面临着严峻的挑战。人β-防御素广泛分布于人、鼠、牛、羊、猪的多种器官上皮细胞内,包括皮肤、呼吸道、尿道、肠道和口腔粘膜上皮细胞等。关于人β-防御素的抗微生物活性,已证实人工合成的人β-防御素具有抗金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌和白色念珠菌的作用。但关于人β-防御素3抗丝状真菌的作用未见相关报道。人工合成的人β-防御素,造价昂贵、产量少且不易保证多肽的生物学活性。
目前,已经运用生物信息学方法发现了大约30种人β-防御素基因。β-防御素的基因上游启动子有前nf-κb、il-6和stat等的结合位点,当病原体相关模式分子(pamp)与上皮细胞表面的模式识别受体(包括cd14,tlrs等)结合后,在多种促炎因子(tnf-α,il-1)参与下,激活nf-κb等转录因子,再与启动子区的nf-κb、il-6结合位点结合,使其基因激活并转录和翻译,属于诱导性表达。
因此,现有技术中未发现人β-防御素3抗真菌相关的应用,尤其是抗丝状真菌相关的应用。现有的人β-防御素3的合成方法,存在造价昂贵、产量少且不易保证多肽的生物学活性的问题。
技术实现要素:
本发明的目的,是提供人β-防御素3的新用途及其制备方法。本发明提出了人β-防御素3在制备治疗真菌感染性疾病药物中的应用,尤其是在制备治疗丝状真菌感染性疾病药物中的应用。本发明提供了一种重组人β-防御素3多肽(recombinanthumanbeta-defensin3,rhbd3)的制备方法。本发明中重组人β-防御素3多肽的制备方法具有造价低廉、产量多且容易保证多肽的生物学活性的特点。
本发明的技术方案:人β-防御素3的新用途,人β-防御素3在制备治疗真菌感染性疾病药物中的应用。
前述的人β-防御素3的新用途中,所述真菌感染性疾病为丝状真菌感染性疾病。
前述的人β-防御素3的新用途中,所述的人β-防御素3为重组人β-防御素3多肽。
前述的人β-防御素3的新用途中,取人β-防御素3,加入一种或多种药学上可接受的载体或赋形剂,制备成各种治疗真菌感染的药物制剂。
前述的人β-防御素3的新用途中,所述的治疗真菌感染的药物制剂为口服制剂:片剂、胶囊剂、口服液、混悬液;或者注射制剂:可注射的溶液、混悬液、粉针剂;或者外用制剂:乳膏剂或溶液。
前述的人β-防御素3的新用途中,所述重组人β-防御素3多肽的制备方法,根据genbank提供的hbd3基因序列,合成hbd3成熟肽基因;将hbd3成熟肽基因插入pet32a(+)质粒;将构建正确的重组质粒转入大肠杆菌rossetta-gami(2),获得表达工程菌rosseta-gami(2)-pet32a(+)/hbd3;诱导培养表达工程菌rosseta-gami(2)-pet32a(+)/hbd3表达hbd3融合蛋白,收集菌细胞内容物;通过镍亲和层析将细胞内容物中的hbd3融合蛋白纯化,利用凝血酶酶切hbd3融合蛋白中由pet32a(+)质粒所赋予的标签蛋白,再经镍亲和层析纯化、脱盐、浓缩获得重组人β-防御素3多肽。
前述的重组人β-防御素3多肽的制备方法中,所述hbd3成熟肽基因插入pet32a(+)质粒,是先将hbd3成熟肽基因和pet32a(+)质粒用bamhⅰ和xholⅰ分别进行酶切反应,再在t4dna连接酶的作用下将酶切后的hbd3成熟肽基因和酶切后的pet32a(+)进行连接反应。
前述的重组人β-防御素3多肽的制备方法中,所述连接反应中,酶切后的hbd3成熟肽基因与酶切后的pet32a(+)质粒的分子摩尔数比为(3~10):1。
前述的重组人β-防御素3多肽的制备方法中,所述表达工程菌rosseta-gami(2)-pet32a(+)/hbd3经iptg诱导表达hbd3融合蛋白。
前述的重组人β-防御素3多肽的制备方法中,所述工程菌rosseta-gami(2)-pet32a(+)/hbd3表达hbd3融合蛋白,最优表达条件为,最佳iptg浓度为0.5mm,最佳诱导时间为6h,最佳温度为34℃。
与现有技术比较,本发明得出人β-防御素3可破坏菌细胞结构,对单细胞真菌和多细胞真菌均具有抑制或杀灭作用。本发明提出了人β-防御素3在制备治疗真菌感染性疾病药物中的应用,尤其是在制备治疗丝状真菌感染性疾病药物中的应用,扩大了人β-防御素3的应用范围。本发明提供了一种人β-防御素3(重组人β-防御素3多肽)的制备方法。该制备方法将hbd3成熟肽基因插入pet32a(+)质粒,将构建正确的重组质粒转入大肠杆菌rossetta-gami(2)获得表达工程菌rosseta-gami(2)-pet32a(+)/hbd3,诱导培养表达工程菌rosseta-gami(2)-pet32a(+)/hbd3表达hbd3融合蛋白,最后再通过镍亲和层析、凝血酶酶切、纯化、浓缩获得重组人β-防御素3多肽(recombinanthumanbeta-defensin3,rhbd3)。本发明为人β-防御素3多肽的制备提供了新途径。该制备方法具有造价低廉、产量多且容易保证多肽的生物学活性的特点。
附图说明
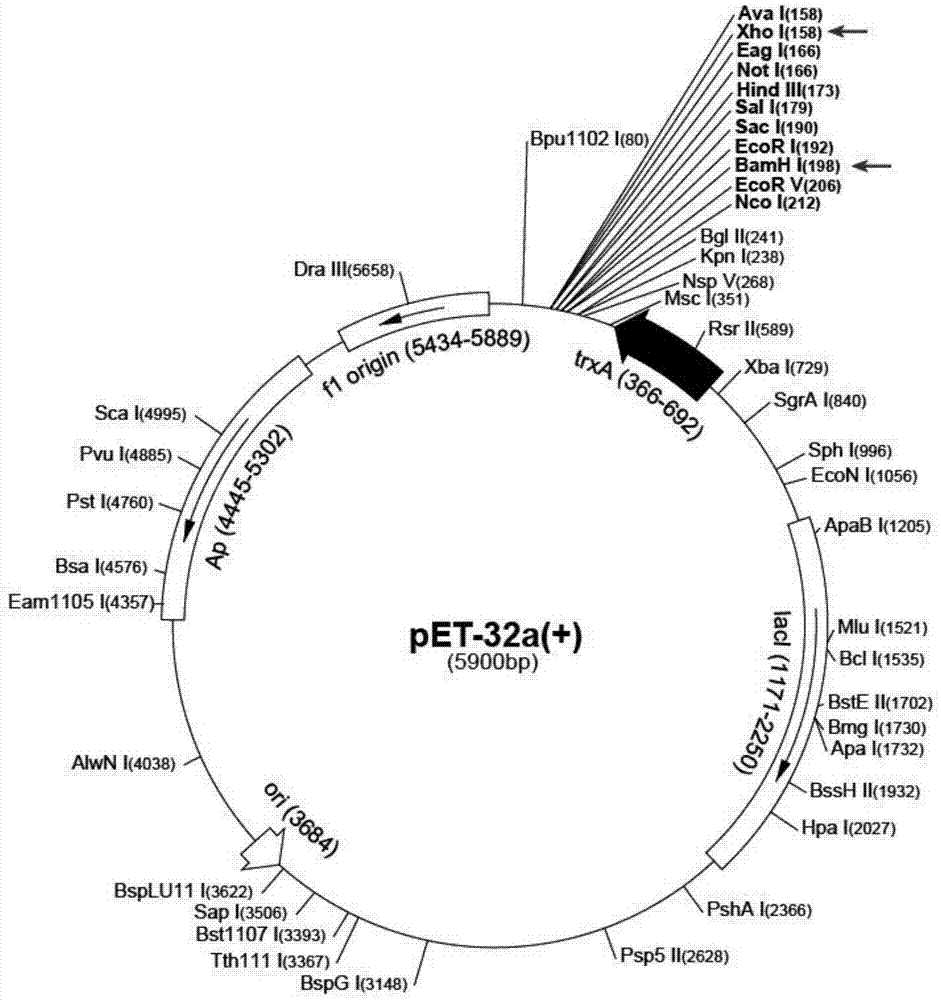
图1为pet32a(+)质粒结构示意图;
图2为pet32a(+)/hbd3原核重组质粒结构示意图;
图3为pet32a(+)/hbd3重组质粒的双酶切鉴定结果,图中的标记为:1-pet32a(+)/hbd3重组质粒(未酶切),2-pet32a(+)/hbd3重组质粒xhol和apal双酶切产物,m-dna标准分子量marker;
图4为pet32a(+)/hbd3重组质粒的测序结果;
图5为hbd3融合蛋白诱导表达sds-page凝胶电泳结果,图中的标记为:m-蛋白质标准分子量marker,1-rossetta-gami(2)-pet32a(+)/hbd3诱导产物,2-rossetta-gami(2)-pet32a(+)/hbd3未诱导产物;
图6为hbd3融合蛋白的westernblot鉴定结果,图中的标记为:1-rossetta-gami(2)-pet32a(+)未经iptg诱导,2-rossetta-gami(2)-pet32a(+)/hbd3经iptg诱导;
图7为重组hbd3多肽的sds-page电泳结果,图中的标记为:m-蛋白质标准分子量marker,1-酶切产物穿透液,2-elutionbuffer洗柱的穿透液,3-酶切产物;
图8为重组hbd3多肽的westernblot鉴定结果,图中的标记为:1-重组hbd3融合蛋白,2-纯化的rhbd3,3-rossetta-gami(2)-pet32a(+)。
具体实施方式
下面结合附图对本发明作进一步的说明,但并不作为对本发明限制的依据。
以下是本发明的实验例:
实验例1:表达工程菌rosseta-gami(2)-pet32a(+)/hbd3的构建实验
1.pet32a(+)/hbd3重组质粒的构建
⑴质粒pet32a(+)的抽提:用lb培养基振摇培养大肠杆菌jm109(含pet32a(+)质粒),收集菌细胞,用质粒抽提试剂盒进行操作,获得pet32a(+)质粒(pet32a(+)质粒的结构示意图见图1)。
⑵限制性内切酶反应:将合成的hbd3成熟肽基因和pet32a(+)质粒用bamhⅰ和xholⅰ,在适宜条件下,分别进行酶切反应,反应产物经琼脂糖电泳后行胶回收获得酶切产物。
⑶连接反应:上述酶切产物经胶回收纯化后再进行连接反应。在t4dna连接酶反应作用下进行,插入片段与载体在连接反应中的分子摩尔数比按(3~10):1的原则进行(pet32a(+)/hbd3原核重组质粒结构示意图见图2)。
⑷转化感受态细胞:用cacl2法将大肠杆菌jm109制备成感受态细胞,常规方法将连接产物转化大肠杆菌jm109感受态细胞,将转化产物接种于含有氨苄青霉素的lb平板上培养过夜第二天挑取阳性菌落培养后进行pcr和限制性内切酶酶切鉴定。
2.构建表达工程菌rosseta-gami(2)-pet32a(+)/hbd3
⑴制备感受态细胞:用cacl2法将大肠杆菌rosseta-gami(2)制备成感受态细胞。
⑵质粒pet32a(+)/hbd3的抽提:用lb培养基振摇培养大肠杆菌jm109(含pet32a(+)/hbd3质粒),收集菌细胞,用质粒抽提试剂盒进行操作,获得pet32a(+)/hbd3质粒。
⑶转化实验:常规方法将pet32a(+)/hbd3质粒转化大肠杆菌rosseta-gami(2)感受态细胞,将转化产物接种于含有氨苄青霉素的lb平板上培养过夜第二天挑取阳性菌落培养后进行pcr和限制性内切酶酶切鉴定。
3.实验结果
⑴pet32a(+)/hbd3重组质粒的双酶切和测序鉴定结果
pet32a(+)/hbd3重组质粒经核酸限制性内切酶xhol和apal双酶切,酶切产物用琼脂糖凝胶电泳后可见4000+bp和2000±bp大小的条带(见图3),与预期产物大小相符。将pet32a(+)/hbd3重组质粒的测序结果(见图4)进行blast比对,质粒中插入的hbd3成熟肽序列正确,无突变,阅读框架正确。
实验例2:hbd3融合蛋白的诱导表达、鉴定和诱导条件优化
1.hbd3融合蛋白的诱导表达和鉴定
⑴hbd3融合蛋白的诱导表达:将甘油保存的表达菌株rossetta-gami(2)-pet32a(+)/hbd3和rossetta-gami(2)-pet32a(+)分别接种于5mllb/amp液体培养基中,37℃振荡培养过夜,取50μl菌液以1:100的接种量重新接种于5mllb/amp液体培养基中,37℃、200rpm振荡培养4h,至菌体达到对数生长期(a600≈0.6),作为阳性对照的不加iptg,其余的添加iptg至终浓度为0.5mm,然后37℃继续培养4h,离心去上清后用0.01mol/lpbs缓冲液1ml洗涤菌细胞两次后,加入0.5mlpbs重悬菌细胞。
⑵sds聚丙烯酰胺凝胶电泳(sds-page)分析:将上述样品加入5×sds蛋白上样缓冲液,100℃,沸煮10min,冷却备用。制备5%浓缩胶和14%分离胶,7)将制备好的15μl蛋白样品和3μl蛋白分子marker上样于加样孔中。电泳条件为:样品在浓缩胶中电压为80v,样品进入分离胶后电压为120v,电泳时间约为2h。电泳结束后,剥下凝胶,加入考马斯亮蓝染色液,染色1h左右。ddh2o漂洗数次后用洗脱液(甲醇30ml+冰醋酸10ml+ddh2o60ml)在摇床上进行2~3次脱色,直到蛋白质条带清晰。采用凝胶成像仪记录电泳结果。
⑶免疫蛋白印迹(westernblot)鉴定:将收集的rossetta-gami(2)-pet32a(+)菌悬液和加入iptg诱导得到的菌悬液各取50μl加入10μl5×sds蛋白电泳上样缓冲液沸煮10min,行sds-page电泳,电泳结束后将凝胶上的蛋白质条带转移到pvdf膜上,先后分别与山羊多克隆抗体hbd3(1:2000)、兔抗羊igg抗体(1:4000)孵育,用ecl发光液显影,留存图像。
2.hbd3融合蛋白的诱导条件优化
⑴诱导时间和iptg浓度的优化:将rosetta-gami(2)-pet32a(+)/hbd3新鲜培养液按照1:100的比例转种于氨苄青霉素(终浓度100μg/ml)的lb培养基中扩增培养至a600≈0.6,分别加入终浓度为0.5、1.0、1.5、2.0mmiptg诱导hbd3融合蛋白的表达;37℃诱导培养,每个iptg浓度的培养物分别在培养4、6、8、12h后取1ml样品行14%sds-page电泳;采用凝胶成像仪记录电泳结果并采用bandscan4.3软件分析hbd3融合蛋白表达量。
⑵培养温度的优化:将rosetta-gami(2)-pet32a(+)/hbd3新鲜培养液按照1:100的比例转种于氨苄青霉素(终浓度100μg/ml)的lb培养基中扩增培养至a600≈0.6,加入终浓度为0.5mmiptg诱导hbd3融合蛋白的表达,分别在38、34、30、26℃诱导培养6h后取1ml样品行14%sds-page电泳;采用凝胶成像仪记录电泳结果并采用bandscan4.3软件分析hbd3融合蛋白表达量。
3.实验结果
⑴hbd3融合蛋白的诱导表达结果
sds-page凝胶电泳结果显示(见图5),rosetta-gami(2)-pet32a(+)/hbd3原核表达工程菌未经iptg诱导和经iptg诱导表达之后在约25kda处出现一条hbd3融合蛋白表达条带,并且经iptg诱导表达后的目的蛋白的表达量及蛋白表达量显著增加。
⑵hbd3融合蛋白的westernblot鉴定结果:免疫蛋白印迹实验结果显示(见图6),以山羊多克隆抗体hbd3为一抗时rossetta-gami(2)-pet32a(+)/hbd3约有25kda的蛋白印迹条带,rossetta-gami(2)-pet32a(+)菌细胞诱导后的裂解产物中未见到蛋白印迹条带。
⑶诱导表达hbd3融合蛋白的最优条件:不同iptg浓度及相应的诱导时间下检测产生的hbd3融合蛋白占菌体蛋白的比例,各培养物中hbd3融合蛋白占菌体总蛋白的百分比结果见表1,其中,以0.5mmiptg诱导6小时产生的hbd3融合蛋白最多(hbd3融合蛋白占菌体总蛋白的50.5%),因此选择0.5mm作为iptg最佳诱导浓度,6小时为最佳诱导时间。在不同的培养温度下检测产生的hbd3融合蛋白占菌体蛋白的比例,在34℃培养时产生的hbd3融合蛋白最多(hbd3融合蛋白占菌体总蛋白的51.4%),因此选择34℃作为诱导温度。即诱导表达hbd3融合蛋白的最优条件是在34℃以0.5mmiptg诱导6小时。
表1hbd3融合蛋白诱导条件优化结果
实验例3:重组hbd3多肽的纯化获得
1.hbd3融合蛋白的亲和层析纯化
⑴将甘油保存的表达菌株rossetta-gami(2)-pet32a(+)/hbd3接种于5mllb/amp液体培养基中,37℃振荡培养过夜,取50μl菌液以1:100的接种量重新接种于1llb/amp液体培养基中,37℃、200rpm振荡培养4h,至菌体达到对数生长期(a600≈0.6),添加iptg至终浓度为0.5mm,然后34℃继续培养6h,离心去上清后用0.01mol/lpbs缓冲液1ml洗涤菌细胞两次后,菌细胞按10ml培养物加入1mlbindingbuffer的比例加入bindingbuffer缓冲液,重悬菌细胞。
⑵将上清置于冰上超声破碎(6号探头,100功率,超声3s,间隔3s,作用30min),4℃、10000rpm离心20min,收集上清。
⑶参照ge公司histraptmff镍纯化柱说明书对表达的hbd3融合蛋白进行纯化,收集洗脱液。
2.凝血酶酶切反应
⑴收集到的洗脱液用超滤离心管(10kda)进行浓缩除盐:将收集到的纯化后的hbd3融合蛋白,经超滤离心管4000×g离心20-40min,弃套管内液体,用无菌ddh2o补足内管液体,重复离心2-3次,以除去盐分,最后收集内管液体,用bca蛋白定量试剂盒进行定量。
⑵凝血酶酶切反应:用0.1mol/lpbs缓冲液将hbd3融合蛋白稀释为1mg/ml,加入凝血酶(终浓度10u/ml)混匀,25℃水浴14h。
⑶重组蛋白酶切后的纯化:参照ge公司histraptmff镍纯化柱说明书对表达的hbd3融合蛋白进行纯化,收集洗脱液。
3.重组hbd3多肽的获得和鉴定
⑴重组蛋白酶切后的纯化:参照ge公司histraptmff镍纯化柱说明书对表达的hbd3融合蛋白进行纯化,收集洗脱液。
⑵收集到的洗脱液用超滤离心管(3kda)进行浓缩除盐:方法同前,用bca蛋白定量试剂盒进行定量。
⑶将定量的重组hbd3多肽行sds-page电泳和westernblot鉴定。
4.实验结果
⑴重组hbd3多肽的sds-page电泳结果:见图7所示,经凝血酶酶切后,标签蛋白被完全切除(大约18kda)。酶切产物经纯化及脱盐、浓缩处理,得到rhbd3(大约6kda)。
⑵重组hbd3多肽的westernblot鉴定结果:hbd3融合蛋白和rhbd3的westernblot实验结果显示有6kda和25kda约左右的蛋白印迹条带(见图8),其分子量大小与理论值相符,而rossetta-gami(2)-pet32a(+)菌诱导后的裂解产物中未见到蛋白印迹条带。
实验例4:重组hbd3多肽的抗真菌活性及与抗真菌药物的联合抗真菌作用检测
1.真菌的准备
复苏保存的真菌菌种,包括白假丝酵母菌(atcc24433)、白假丝酵母菌(临床分离株)、新生隐球菌(临床分离株)、黑曲霉(临床分离株)、犬小孢子菌(临床分离株)、红色毛癣菌(临床分离株)、絮状表皮癣菌(临床分离株),用ypg培养基将单细胞真菌菌细胞稀释为1×105cfu/ml,用pda培养基将多细胞真菌孢子稀释为1×105cfu/ml,吹匀制备成菌悬液。
2.rhbd3多肽和抗真菌药物的准备
用10mmpbs将rhbd3多肽稀释为2000、1000、500、250、125、62.6、31.25、15.625、7.8mg/ml。阳性药物为伊曲康唑(itrac)、两性霉素b(ampho)、5-氟胞嘧啶(5-flu),分别用注射用水进行稀释。
3.mic、mfc的检测
采用液体微量稀释法观察rhbd3多肽的体外抗真菌作用,在96孔培养板中每孔加入菌悬液90μl,再加入不同浓度的rhbd3多肽,或不同的抗真菌药物,或相应缓冲液。单细胞真菌在37℃培养2天,多细胞真菌在28℃培养5天。以未见真菌生长现象的rhbd3多肽最小稀释度作为最小抑菌浓度(mic)。从未见菌细胞生长的孔中吸取10ul培养物接种相应空白培养基,提供适宜培养条件,以未见菌细胞生长现象的rhbd3多肽最小稀释度作为最小杀菌浓度(mbc/mfc)。
4.联合抗真菌作用检测
在96孔板中每孔加入80ul真菌菌悬液和10ul不同浓度的rhbd3多肽以及10ul一种不同浓度抗真菌药物,用棋盘格法测得rhbd3多肽与4种抗菌药联合用药的mic,从而计算出fic指数。rhbd3多肽与抗真菌药物配伍的作用效果通过fic指数为判定依据。fic指数=甲药联合时mic/甲药单用时mic+乙药联合时mic/乙药单用时mic。判断标准:fic指数≤0.5为协同作用;fic指数>0.5~1为相加作用;fic指数>1~2为无关作用;fic指数>2为拮抗作用。
5.实验结果
⑴rhbd3多肽的体外抗真菌作用:rhbd3多肽对单细胞真菌和多细胞真菌均有较强的抑菌作用,对多细胞真菌还显示了极强的杀菌作用(见表2)。
表2rhbd3多肽抗真菌活性实验结果
⑵rhbd3多肽与抗真菌药物的联合抗真菌作用:rhbd3多肽与抗真菌药物伊曲康唑(itrac)、两性霉素b(ampho)、5-氟胞嘧啶(5-flu)联合作用,对常见病原性单细胞真菌,包括白假丝酵母菌、新生隐球菌均表现为协同作用(见表3)。
表3rhbd3多肽与抗真菌药物的联合抗真菌作用
本发明的实施例。
实施例1:注射剂。
取重组人β-防御素3多肽5克,加入制备注射剂的相应辅料,制成1000支注射剂,用于防治真菌感染,特别是丝状真菌感染。每支5ml,含重组人β-防御素3多肽5mg。成人静脉注射,配成25μg/ml使用,每次1-3支,一日1-3次。
实施例2:乳膏剂。
取重组人β-防御素3多肽5克,加入制备乳膏剂的相应辅料,混匀,制成100支乳膏剂,用于治疗丝状真菌皮肤感染。每支5g,含人β-防御素3多肽50mg。外用,涂抹患处,一日3-5次。
实施例3:重组人β-防御素3多肽的制备方法。
根据genbank提供的hbd3基因序列,合成hbd3成熟肽基因;将hbd3成熟肽基因插入pet32a(+)质粒;将构建正确的重组质粒转入大肠杆菌rossetta-gami(2),获得表达工程菌rosseta-gami(2)-pet32a(+)/hbd3;诱导培养表达工程菌rosseta-gami(2)-pet32a(+)/hbd3表达hbd3融合蛋白,收集菌细胞内容物;通过镍亲和层析将细胞内容物中的hbd3融合蛋白纯化,利用凝血酶酶切hbd3融合蛋白中由pet32a(+)质粒所赋予的标签蛋白,将酶切后的hbd3融合蛋白经镍亲和层析纯化、脱盐、浓缩获得重组人β-防御素3多肽。
所述hbd3成熟肽基因插入pet32a(+)质粒,是先将hbd3成熟肽基因和pet32a(+)质粒用bamhⅰ和xholⅰ分别进行酶切反应,再在t4dna连接酶的作用下将酶切后的hbd3成熟肽基因和酶切后的pet32a(+)进行连接反应。
所述连接反应中,酶切后的hbd3成熟肽基因与酶切后的pet32a(+)质粒的分子摩尔数比为6:1。
所述表达工程菌rosseta-gami(2)-pet32a(+)/hbd3经iptg诱导表达hbd3融合蛋白。
所述工程菌rosseta-gami(2)-pet32a(+)/hbd3表达hbd3融合蛋白,最优表达条件为,最佳iptg浓度为0.5mm,最佳诱导时间为6h,最佳温度为34℃。
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员当可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!