多系分化持续应激细胞在制备镇痛药物中的应用的制作方法
本发明属于干细胞生物学和生物医药领域,具体涉及多系分化持续应激细胞在制备镇痛药物中的应用
背景技术:
疼痛是一种令人不快的感觉和情绪上的感受,伴有实质上的或潜在的组织损伤,患者往往同时有抑郁、焦虑等负性情绪反应,严重影响患者的日常生活,也给家庭和社会带来沉重的负担。世界成年人口的30%罹患慢性痛,根据美国的统计数据,慢性痛患者的人数已经超过了糖尿病、心血管疾病和癌症病人的总和,美国疼痛学会2014年统计美国每年因为慢性痛引起的经济损失高达5000-6000亿美元。保守估计,在我国就有二亿以上的疼痛患者。目前对于慢性疼痛治疗药物的研究主要集中在传统镇痛药如阿片类受体药物的改良以及钠通道阻滞剂、缓激肽阻滞剂、5-ht阻滞剂、生长因子抑制剂、谷氨酸抑制剂、腺苷抑制剂等的开发。然而,这些药物的作用时间短暂,长期使用会产生严重的副作用,如出现耐受、成瘾、干扰神经系统和其他系统的正常生理功能等,甚至会影响生命的安全。现阶段还没有任何药物可以彻底的、长效的、无副作用的治疗慢性疼痛。患者急需更有效的治疗方法。为了缓解和治疗疼痛病人这一医学问题和由此带来的社会问题,我国已将“疼痛”研究作为目前国家自然科学发展规划重点支持领域之一。因此,寻找和开发新的镇痛药物具有重要的医学意义和深远的社会意义。
技术实现要素:
多系分化持续应激细胞是2010年在成人骨髓和真皮组织中新发现的一种成体干细胞,具备如下特性:1)特异性表达阶段特异性胚胎抗原3(stagespecificembryonicantigen一3,ssea3)和cdl05;2)有应激耐受力;3)单细胞能形成细胞球,具备很强的自我更新能力;4)能分化为内、中、外三个胚层的细胞,但在裸鼠体内不形成畸胎瘤。本发明研究发现,多系分化持续应激细胞能够有效治疗各种急慢性疼痛。注射多系分化持续应激细胞可以显著治疗痛觉异常,并且作用时间长久,对包括神经病理性疼痛、炎性痛、癌症痛、化疗痛,糖尿病痛觉过敏和痛觉障碍等在内的多种疾病和症状都有显著地治疗效果,具有极大的临床应用价值。
本发明的目的是提供一种多系分化持续应激细胞在制备镇痛药物中的应用,为临床镇痛药物提供一种新的选择。
为了解决上述技术问题,本发明具体技术方案如下:
本发明提供一种多系分化持续应激细胞在制备镇痛药物中的应用。优选的,所述镇痛药物为治疗慢性疼痛的药物。
进一步,本发明所述疼痛选自包括神经病理性疼痛、炎性痛、癌症痛、化疗痛,糖尿病痛觉过敏和痛觉障碍等在内的的一种或几种。
进一步,本发明所述多系分化持续应激细胞来源于骨髓、脂肪、脐带、真皮等间充质组织,可以悬浮成球生长也可以贴壁生长,表达ssea-3,oct3/4,sox2,cd105,cd90,不表达cd34,cd45,cd11b。本发明一个具体的实施例使用的多系分化持续应激细胞来源于骨髓。
本发明所述多系分化持续应激细胞可采用如文献(kuroda,etal.,uniquemultipotentcellsinadulthumanmesenchymalcellpopulations.pnas,2010,107:8639-8643.)所述的方法制备得到。
本发明一个具体的多系分化持续应激细胞制备方法如下:
参考文献(kuroda,etal.,pnas,2010,107:8639-8643.)公开的方法制备得到骨髓细胞,利用多系分化持续应激细胞表达ssea-3+/cd105+/cd45-的特性采用流式细胞分选技术对骨髓细胞进行分选,对分选出的多系分化持续应激细胞进行悬浮培养,使用a-mem+0.9%methoculth4100+20%fbs培养基,培养1d后细胞开始聚集,单个细胞聚集成团形成细胞集落,之后细胞集落又分裂生长,形成干细胞球,3-5d细胞数目逐渐增多,细胞球逐渐增大,呈现大而透亮的形态。多系分化持续应激细胞传代培养后的成球时间要比第1代细胞明显缩短,从第2代开始,一般2d即可形成细胞球。采用多能干细胞标记物ssea-3、nanog、oct4和sox2对多系分化持续应激细胞做鉴定。
采用本发明所述方法制备得到的多系分化持续应激细胞传代稳定性好,研究表明传代60代之后细胞性状仍保持稳定,体现为1)仍能形成细胞球悬浮生长;2)和传代5代之内的muse细胞具有相同的镇痛效果;3)蛋白质谱分析显示和传代5代的muse细胞相比,在细胞因子、趋化因子和受体等多方面蛋白表达都没有统计差异。本发明所述的多系分化持续应激细胞稳定的传代特性,对要求提供大量、标准化的细胞产品来制备镇痛药物极其有利。
进一步,本发明所述多系分化持续应激细胞以细胞悬液的形式给药,所述细胞悬液按如下方法制备:将培养的多系分化持续应激细胞用0.25%trypsin-edta进行消化制成单细胞悬液,生理盐水洗涤后,再用生理盐水悬浮,即为多系分化持续应激细胞悬液。
进一步,本发明所述多系分化持续应激细胞悬液中细胞浓度为1~10×107个/ml。
进一步,本发明所述多系分化持续应激细胞悬液的药物用量是以多系分化持续应激细胞个数计数为5~10×106个/kg体重,局部注射(鞘内注射、关节腔内注射、皮下注射,肌肉注射等)1次;或5~10×107个/kg体重,静脉输注1次。
本发明所述的药物,进一步还可以含有药学上可接受的辅料。
本发明利用各种急慢性疼痛的小鼠模型,首次证明通过鞘内注射的方式移植多系分化持续应激细胞可以长时间的显著抑制各种疼痛模型小鼠的机械痛和热痛过敏,并且可以纠正糖尿病模型小鼠的痛觉障碍。
附图说明
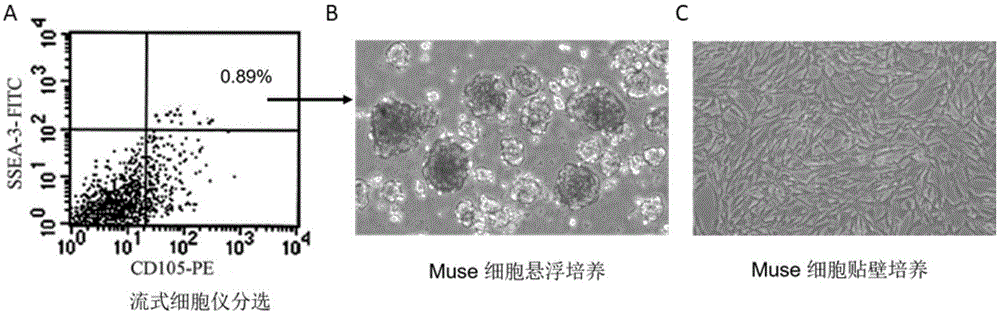
图1为人多系分化持续应激细胞(muse细胞)的制备和鉴定结果。(其中,图a:是收集培养到第3代的人骨髓细胞,利用多系分化持续应激细胞ssea-3+/cd105+的特性采用流式细胞分选技术进行分选的结果。图b是分选出的多系分化持续应激细胞在悬浮培养下可由分选得到的单细胞形成细胞球。图c是将多系分化持续应激细胞的悬浮细胞球消化成单细胞后,进行贴壁培养时的细胞形态)。
图2为人muse细胞对坐骨神经慢性压迫性损伤模型小鼠的机械痛和热痛过敏的镇痛作用。(其中图a为鞘内注射人muse细胞的坐骨神经慢性压迫性损伤模型小鼠的机械缩足反射阈值,图b为鞘内注射人muse细胞的坐骨神经慢性压迫性损伤模型小鼠的热缩足反射潜伏期)。
图3为人muse细胞对糖尿病模型小鼠的镇痛作用。(其中图a为鞘内注射人muse细胞糖尿病模型小鼠的机械缩足反射阈值,图b为鞘内注射人muse细胞对糖尿病模型小鼠的热缩足反射潜伏期)。
图4为人muse细胞对化疗药物紫杉醇(ptx)注射模型小鼠的机械痛过敏的镇痛作用。
图5为muse细胞(ssea-3positive)和非muse细胞对坐骨神经慢性压迫性损伤模型小鼠的机械痛的镇痛作用。
具体实施方式
以下通过实施例说明本发明的具体步骤,但不受实施例限制。
在本发明中使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。
下面结合具体实施例并参照数据进一步详细描述本发明,应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
实施例1:多系分化持续应激细胞的制备和鉴定
由专业医生在捐献者的髂前上棘后上方行骨髓穿刺术,抽取1ml骨髓。将骨髓与磷酸缓冲盐溶液按1∶1混合加入到淋巴细胞分离液上层,离心后液体分为四层,最上层约占液柱的1/2,为淡红色的血浆层;第三层约占液柱的1/4,为澄清的淋巴细胞分离液层;在两层的交界处为高约5mm的乳白色云雾状层,为单核细胞层(此层为所要提取的细胞层);最底层紧附试管壁,呈深红色,主要为密度较大的红细胞层。取第二层的细胞,使用含15%fbs的dmem/f12完全培养基,于37℃、5%co2。的恒温培养箱中培养24h后,可见有散在单个细胞贴壁;2-3d后贴壁细胞开始分裂增殖,由最初的圆形逐渐伸展开,细胞两极朝向不规律,形态不规则,周围有混杂细胞;4-7d后细胞呈集落样生长,以梭形居多;1w后细胞扁平,多突起,胞体互相融合。至第3代后,细胞形态基本单一,呈梭形,流式细胞仪检测约有95%的细胞为cd90+/cd45-/cd11b-。收集培养到第3代的细胞,利用muse细胞ssea-3+/cd105+的特性采用流式细胞分选技术进行分选,对分选出的muse细胞进行悬浮培养,使用a-mem+0.9%methoculth4100+20%fbs培养基,1d后细胞开始聚集,单个细胞聚集成团形成细胞集落,之后细胞集落又分裂生长,形成干细胞球,3-5d细胞数目逐渐增多,细胞球逐渐增大,呈现大而透亮的形态。muse细胞传代培养后的成球时间要比第1代细胞明显缩短,从第2代开始,一般2d即可形成细胞球。采用多能干细胞标记物ssea-3、nanog、oct4和sox2对muse细胞做鉴定。结果见图1,其中图a是收集培养到第3代的人骨髓细胞,利用多系分化持续应激细胞ssea-3+/cd105+的特性采用流式细胞分选技术进行分选的结果。该结果表明在培养的骨髓细胞中有大约0.89%的细胞是多系分化持续应激细胞。图b是分选出的多系分化持续应激细胞在悬浮培养下可由分选得到的单细胞形成细胞球。该结果表明在多系分化持续应激细胞可以在体外大量扩增。图c是将多系分化持续应激细胞的悬浮细胞球消化成单细胞后,进行贴壁培养时的细胞形态。该结果表明多系分化持续应激细胞也可以进行贴壁培养,且细胞形态一致。可用来做进一步的实验。
实施例2:多系分化持续应激细胞的镇痛活性检测
1)小鼠疼痛模型:
①坐骨神经慢性压迫性损伤模型(cci):小鼠在手术平台上用异氟烷气体持续麻醉,剃毛消毒后,在股骨外侧上方纵向切开皮肤,顺肌纹钝性分离肌肉,暴露坐骨神经,游离周围组织,在坐骨神经三叉分支的近端约5mm处,用6.0的手术缝合线做三道结扎,间距约1mm,以不影响神经外膜的血运为度,关闭切口后缝合皮肤。
②坐骨神经分支选择性神经损伤模型(sni):小鼠在手术平台上用异氟烷气体持续麻醉,剃毛消毒后,在股骨外侧上方纵向切开皮肤,顺肌纹钝性分离肌肉,暴露坐骨神经,游离周围组织,在坐骨神经三叉分支处结扎并切断腓总神经及胫神经,保留腓肠神经,关闭切口后缝合皮肤。
③链脲霉素(stz)注射诱导的糖尿病神经病理性痛模型:腹腔注射stz60mg/kg,连续给药5天。第5次给药后20天,检测血糖值,血糖值大于25mm/l的小鼠用以实验。
④紫杉醇(ptx)注射引起的神经病理性痛模型:腹腔注射ptx2mg/kg,隔天给药,共给药4次。
2)小鼠痛觉行为检测:所有行为学实验采取“双盲”的实验设计方案。
①机械痛觉异常实验用vonfrey纤维丝以up-down法推算50%缩足阈值:将一有机透明玻璃箱置于金属筛网上,待小鼠在有机玻璃箱中适应30min后,用vonfrey纤维丝垂直刺激小鼠后肢足底中部,持续时间1-2s,小鼠出现抬足或舔足行为视为阳性反应,否则视为阴性反应。
②热痛觉过敏实验将有机玻璃箱置于3mm厚玻璃板上,按hargreaves法用热辐射刺激以照射小鼠足底紧贴玻璃板部位。记录照射开始至小鼠出现抬足时间,截止时间为20s。
多系分化持续应激细胞的对小鼠疼痛模型的镇痛活性检测结果如图2-5所示。图2为人muse细胞对坐骨神经慢性压迫性损伤模型小鼠的机械痛和热痛过敏的镇痛作用。(其中图a为鞘内注射人muse细胞的坐骨神经慢性压迫性损伤模型小鼠的机械缩足反射阈值,图b为鞘内注射人muse细胞的坐骨神经慢性压迫性损伤模型小鼠的热缩足反射潜伏期。结果表明单次鞘内注射人muse细胞可以长时间显著抑制坐骨神经慢性压迫性损伤模型小鼠的机械痛和热痛过敏。
图3为人muse细胞对糖尿病模型小鼠的镇痛作用。(其中图a为鞘内注射人muse细胞糖尿病模型小鼠的机械缩足反射阈值,结果显示鞘内注射人muse细胞可以显著抑制糖尿病模型小鼠的病程早期的机械痛过敏和晚期的机械痛不敏感(痛觉障碍)现象。图b为鞘内注射人muse细胞对糖尿病模型小鼠的热缩足反射潜伏期,结果显示鞘内注射人muse细胞可以显著抑制糖尿病模型小鼠的热痛不敏感(痛觉障碍)现象。以上实验结果表明单次鞘内注射人muse细胞可以促进糖尿病模型小鼠的痛觉恢复正常。
图4为人muse细胞对化疗药物紫杉醇(ptx)注射模型小鼠的机械痛过敏的镇痛作用(机械缩足反射阈值)。结果表明单次鞘内注射人muse细胞可以长时间抑制化疗药物紫杉醇(ptx)注射模型小鼠的机械痛过敏。
图5为muse细胞(ssea-3positive)和非muse细胞对坐骨神经慢性压迫性损伤模型小鼠的机械痛的镇痛作用(机械缩足反射阈值)。结果表明,单次鞘内注射相同数目的muse细胞(ssea-3positive)和非muse细胞(ssea-3negative,来源于流式细胞仪分选的骨髓细胞培养中的ssea-3阴性细胞)对坐骨神经慢性压迫性损伤模型小鼠的机械痛的影响,muse细胞有更好的镇痛效果。
综上所述,鞘内注射的方式移植多系分化持续应激细胞可以长时间的显著抑制各种疼痛模型小鼠的机械痛和热痛过敏,并且可以纠正糖尿病模型小鼠的痛觉障碍。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!