海藻酸在制备治疗自身性免疫糖尿病药物中的新用途的制作方法
本发明涉及自身性免疫糖尿病即1型糖尿病治疗药物技术领域,具体涉及一种海藻酸在制备治疗自身性免疫糖尿病药物中的新用途。
背景技术
糖尿病是当代社会健康重大问题之一。据国际糖尿病联合会统计,2015年全球已有超过5亿糖尿病患者,其中超过1亿在我国。糖尿病可大致分为1型和2型糖尿病两种。其中1型糖尿病属于自身性免疫糖尿病,其发病主要源于自身免疫系统因各种因素对胰岛素分泌细胞(胰岛β-细胞)进行攻击引发的胰岛细胞慢性坏死,最终导致胰岛素水平下降、血糖升高。1型糖尿病发病较早,多发于儿童及青少年,因此患病时间较长,如血糖控制不当会引发包括心脏、肾脏、肝脏、神经及眼部等多重器官并发症,严重影响患者的生活质量并对社会及家庭造成巨大经济负担。
1型糖尿病患者的胰岛大多被self-reactivet细胞浸润,这些活化后的t细胞可识别胰岛内可分泌胰岛素的β-细胞并将其为作为抗原予以清除。尽管导致t细胞对自身胰岛β-细胞攻击的具体机制尚未查明,目前已知的是t细胞对胰岛β-细胞的识别过程需要t细胞以及呈递抗原细胞之间的相互作用。现有治疗1型糖尿病的方法局限于外源性注射胰岛素配合血糖监控,但这种每日测量止血并皮下注射的方案给1型糖尿病患者带来日常生活中极大的不便。更重要的是,定期定量注射胰岛素的治疗方式完全不同于正常机体内在高糖刺激下由胰岛β细胞按需分泌胰岛素的模式,因此,体外注射胰岛素从根本上无法准确并动态调控血糖变化。另外,长期服用胰岛素也会造成体重增加,不利于进行血糖检测及对其他心血管并发症的调控。
治疗1型糖尿病的终极目标是抑制自身免疫性攻击并避免全身性副作用,同时促进胰岛再生和修复。但现有治疗方法,无论胰岛移植还是胰岛素,都无法实现这一目的。因此使用免疫手段调控自身免疫系统引发免疫耐受可成为预防并治疗1型糖尿病的创新手段。
海藻酸是天然多糖中的一种,主要从海藻中提取获得。其化学成分主要包括guluronic(g)及mannuronic(m)两种单体,不同比例的g和m单体以及各类聚合物嵌段、异质聚合物可组合成分子量不同的聚合物。目前,海藻酸作为生物材料在治疗糖尿病中的应用主要为包封胰岛用于胰岛移植。胰岛移植式理论上可以根治糖尿病的治疗手段之一,而使用海藻酸对胰岛包封后再进行胰岛移植是目前可提高临床疗效的最常见手段。然而胰岛移植手术自身存在极大问题,术后90%病人5年内会重新发病,另外移植手术也受到供体紧缺的影响,不能够满足社会对糖尿病治疗的巨大需求。
现有1型糖尿病治疗方式,如胰岛移植、体外注射胰岛素,均无法有效的预防糖尿病发病。作为自身性免疫疾病,现有治疗手段采用的治疗药物中没有一种可通过调控免疫系统预防或治疗1型糖尿病发病。
技术实现要素:
针对现有技术中的缺陷,本发明目的在于提供一种海藻酸在制备治疗自身性免疫糖尿病药物中的新用途,采用甘露糖修饰海藻酸钠,然后负载效应抗原胰岛素b段9-23肽段,制备得到的海藻酸微球通过皮下注射,可激活体内调节性t细胞增殖及其功能,诱导免疫耐受,从而有效防止或延缓1型糖尿病发病。
为实现上述目的,本发明提供的技术方案为:
本发明提供了一种海藻酸的药物新用途,海藻酸或其作为疫苗佐剂药物有效成分在制备治疗自身性免疫疾病的药物中的应用。
优选地,自身性免疫疾病为糖尿病,优选为1型糖尿病。
本发明还提供一种负载/包裹效应抗原的海藻酸微球/海藻酸囊,效应抗原为胰岛素肽段,优选为胰岛素b段肽段,更优选为胰岛素b段9-23肽段。
优选地,负载效应抗原的海藻酸微球的粒径为500~2000nm。
本发明还保护负载/包裹效应抗原的海藻酸微球/海藻酸囊在制备治疗自身性免疫疾病的药物中的应用。
本发明还保护负载/包裹效应抗原的海藻酸微球/海藻酸囊在制备治疗糖尿病尤其是1型糖尿病的药物中的应用。
本发明还提供了一种负载效应抗原的海藻酸微球的制备方法,包括将表面修饰的海藻酸钠负载效应抗原的步骤。
将表面修饰的海藻酸钠负载效应抗原具体包括步骤:将表面修饰的海藻酸钠和效应抗原混合,然后溶于水中,得到混合溶液;向混合溶液中加入氯化钙水溶液,搅拌后离心,收集沉淀物;将沉淀物干燥,得到负载效应抗原的海藻酸微球。
优选地,表面修饰的海藻酸钠和效应抗原的质量比为1:(0.10~0.30);优选地,混合溶液中表面修饰的海藻酸钠的质量浓度为0.5%~2%;优选地,氯化钙水溶液的浓度为200~600mm,氯化钙水溶液的体积和水的体积的比值为(0.1~1)ml:(5~20)ml;优选地,搅拌的时间为1~24小时;优选地,离心之后收集沉淀物之前还包括步骤:将离心后收集的固体物质进行清洗;其中,清洗采用的清洗液为水,优选为双蒸水,清洗的次数为多次,优选为2次;优选地,干燥为冷冻干燥。
表面修饰的海藻酸钠是甘露糖修饰海藻酸钠,甘露糖修饰海藻酸钠是甘露糖海藻酸铵。
表面修饰的海藻酸钠的制备方法包括步骤:s101:将海藻酸四丁基盐溶于二甲基甲酰胺中;s102:在无氧低温条件下,在s101得到的混合物中加入2-氯-1-甲基吡啶鎓碘化物和4-氨基苯基-α-d-吡喃甘露糖苷进行反应,反应结束后加入氯化钠溶液溶解,再用无水乙醇凝结沉淀,收集固体;s103:将s102得到的产物置于水中透析,得到表面修饰的海藻酸钠。需要说明的是,本发明采用的海藻酸四丁基盐可以通过文献frédéricvallée,christophemüller,alaindurand,sarahschimchowitsch,edithdellacherie,christiankelche,jeanchristophecassel,michèleleonard,synthesisandrheologicalpropertiesofhydrogelsbasedonamphiphilicalginate-amidederivatives,carbohydrateresearch,2009,344:223-228.提供的方法制备得到,也可以通过购买途径得到。
优选地,s101中,海藻酸四丁基盐的质量和二甲基甲酰胺的体积的比值为(1~2)g:(100~200)ml;优选地,s102中,无氧低温条件为氮气冰浴条件,2-氯-1-甲基吡啶鎓碘化物和海藻酸四丁基盐结构单元的摩尔比为(0.05~0.3):(0.5~5);4-氨基苯基-α-d-吡喃甘露糖苷和海藻酸四丁基盐结构单元的摩尔比为(0.05~0.3):(0.5~5);反应的时间为24~72小时,优选为24~36小时;氯化钠溶液的浓度为2.5m,优选依次重复s102中的溶解和沉淀步骤多次,多次优选为3次;优选地,s103中,水为无离子水,透析的时间为1~7天。
本发明提供的技术方案,具有如下的有益效果:
(1)本发明针对自身性免疫1型糖尿病治疗,开发了经表面修饰后负载效应抗原的海藻酸微球,即甘露糖修饰后负载胰岛素b段9-23肽段的海藻酸微球,其通过皮下注射诱导体内,可激活体内调节性t细胞增殖及其功能,诱导免疫耐受,从而有效防止或延缓1型糖尿病发病,是缓解或治疗自身免疫性1型糖尿病的新产品;
(2)将本发明提供的海藻酸微球皮下注射治疗自发性1型糖尿病模型小鼠(non-obesediabetic,nod小鼠),通过检测小鼠血糖发现经治疗的小鼠注射30周后,70%小鼠血糖仍保持正常水平,未有糖尿病病发;而未治疗组小鼠30周后全部血糖升高,糖尿病病发;并且,通过海藻酸微球治疗后小鼠血清中炎症及细胞因子指标可看出,海藻酸微球或可缓解类似1型糖尿病的其他自身性免疫疾病;
(3)本发明提供的海藻酸微球的制备方法简单,治疗操作简便易行,具有很广的应用前景。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
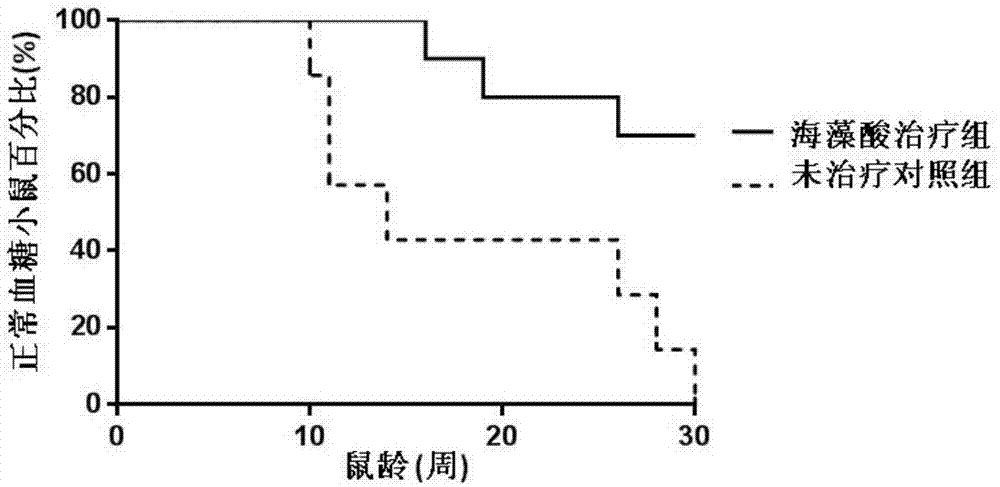
图1为本发明实施例2中海藻酸治疗组与未治疗对照组小鼠30周内糖尿病发病比例结果图;
图2为本发明实施例2中海藻酸治疗组与未治疗对照组小鼠(cd4+/tcrβ+)t细胞中羟基荧光素二醋酸盐琥珀酰亚胺脂的平均荧光强度结果图;
图3为本发明实施例2中海藻酸治疗组与未治疗对照组小鼠血清中转化生长因子(tgf-β)的浓度结果图;
图4为本发明实施例2中海藻酸治疗组与未治疗对照组小鼠血清中白介素10(il-10)的浓度结果图;
图5为本发明实施例2中海藻酸治疗组与未治疗对照组小鼠血清中肿瘤坏死因子(tnf-α)的浓度结果图;
图6为本发明实施例2中海藻酸治疗组与未治疗对照组小鼠血清中白介素17a(il-17a)的浓度结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只是作为示例,而不能以此来限制本发明的保护范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,数据为三次重复实验的平均值或平均值±标准差。本发明实施例采用的胰岛素b段9-23肽段购买自合肥国肽生物科技有限公司公司,型号为gt60029-0419。
本发明提供一种海藻酸微球的制备方法,包括制备表面修饰的海藻酸钠和负载效应抗原的步骤:
步骤一:表面修饰的海藻酸钠的制备
s101:将海藻酸四丁基盐溶于二甲基甲酰胺中;其中,海藻酸四丁基盐的质量和二甲基甲酰胺的体积的比值为(1~2)g:(100~200)ml;
s102:在氮气冰浴(无氧低温条件)下,在s101得到的混合物中加入2-氯-1-甲基吡啶鎓碘化物和4-氨基苯基-α-d-吡喃甘露糖苷,室温反应24~36小时,反应结束后加入2.5m氯化钠溶液溶解,再用无水乙醇凝结沉淀,依次重复s102中的溶解和沉淀步骤多次,优选3次,收集固体;其中,2-氯-1-甲基吡啶鎓碘化物和海藻酸四丁基盐结构单元的摩尔比为(0.05~0.3):(0.5~5);4-氨基苯基-α-d-吡喃甘露糖苷和海藻酸四丁基盐结构单元的摩尔比为(0.05~0.3):(0.5~5);
s103:将s102得到的产物置于无离子水中透析1~7天,得到表面修饰的海藻酸钠。
步骤二:将表面修饰的海藻酸钠负载效应抗原
s201:将步骤一制备得到的表面修饰的海藻酸钠和效应抗原胰岛素b段9-23肽段混合,然后溶于水中,室温搅拌至充分溶解,得到混合溶液;其中,表面修饰的海藻酸钠和效应抗原的质量比为1:(0.10~0.30),混合溶液中表面修饰的海藻酸钠的质量浓度为0.5%~2%;
s202:向混合溶液中加入氯化钙水溶液,室温搅拌1~24小时后离心,将离心后收集的固体物质采用双蒸水清洗2次,收集沉淀物;其中,氯化钙水溶液的浓度为200~600mm,氯化钙水溶液的体积和水的体积的比值为(0.1~1)ml:(5~20)ml;
s203:将沉淀物冷冻干燥,得到粒径为500~2000nm的海藻酸微球。
下面结合具体实施例对本发明提供的技术方案作进一步说明。
实施例1
本实施例提供一种海藻酸微球的制备方法,包括制备表面修饰的海藻酸钠和负载效应抗原的步骤:
步骤一:表面修饰的海藻酸钠的制备
s101:将1.5g海藻酸四丁基盐溶于150ml无水二甲基甲酰胺中;
s102:在氮气冰浴条件下,在s101得到的混合物中加入2-氯-1-甲基吡啶鎓碘化物和4-氨基苯基-α-d-吡喃甘露糖苷,室温反应24小时,反应结束后加入45ml2.5m氯化钠溶液溶解,再用无水乙醇凝结沉淀,依次重复溶解和沉淀步骤3次,收集固体;其中,2-氯-1-甲基吡啶鎓碘化物和海藻酸四丁基盐结构单元的摩尔比为0.15:3;4-氨基苯基-α-d-吡喃甘露糖苷和海藻酸四丁基盐结构单元的摩尔比为0.15:3;
s103:将s102得到的产物置于无离子水中透析1天,得到表面修饰的海藻酸钠。
步骤二:将表面修饰的海藻酸钠负载效应抗原
s201:将步骤一制备得到的表面修饰的海藻酸钠和效应抗原胰岛素b段9-23肽段混合,然后溶于水中,室温搅拌至充分溶解,得到混合溶液;其中,表面修饰的海藻酸钠和效应抗原的质量比为1:0.20,混合溶液中表面修饰的海藻酸钠的质量浓度为1%;
s202:向混合溶液中加入氯化钙水溶液,室温搅拌1小时后离心,将离心后收集的固体物质采用双蒸水清洗2次,收集沉淀物;其中,氯化钙水溶液的浓度为500mm,氯化钙水溶液和水的体积比为1:5;
s203:将沉淀物冷冻干燥,得到粒径为500~2000nm的海藻酸微球。
实施例2
将本发明实施例1制备得到的海藻酸微球通过皮下注射自发性1型糖尿病模型小鼠(non-obesediabetic,nod小鼠),检测疗效。
1、实验方法
取离乳雌性non-obesediabetic(nod)小鼠,随机分为两组,且两组小鼠间无统计学差异。经体重、血糖测量正常后,皮下注射本发明实施例1制备得到的海藻酸微球(海藻酸治疗组),每周一次,每次100μg,共4次,并且设置未治疗对照组(注射等量的磷酸盐生理盐水,即pbs溶液)。注射治疗后观察小鼠至30周龄,每周自鼠尾静脉测量小鼠血糖。
30周后取小鼠脾脏,研磨分离出脾脏细胞,使用羟基荧光素二醋酸盐琥珀酰亚胺脂(一种可穿透细胞膜的荧光染料),标记脾脏细胞。标记后重新加入海藻酸微球刺激培养3天后,标记t细胞表面cd4及t细胞抗原受体(tcrβ),观察抗原重新刺激后cd4阳性(即可诱导免疫耐受的)t细胞亚群增值情况。同时取小鼠血清,用于测量血清中炎症因子水平,主要包括促炎因子(肿瘤坏死因子α)、白介10、白介17a及转化生长因子β等。
2、实验结果
(1)通过皮下注射治疗nod小鼠,并对其进行血糖监控发现,经海藻酸微球治疗小鼠糖尿病防治比例达70%,大大优于现有糖尿病防控手段。
具体结果如图1所示,图1为海藻酸治疗组与未治疗对照组小鼠30周内糖尿病发病比例结果图。从图1中可以明显看出未治疗组(虚线)小鼠11周开始就有血糖升高现象,比海藻酸治疗组最早发病小鼠提前5周。在小鼠16周龄时,海藻酸治疗组只有一只小鼠发病,而对照组发病率已达60%(未治疗组血糖正常小鼠在15周时只有40%)。到小鼠30周龄时,未治疗组小鼠全部血糖升高发病,而海藻酸治疗组只有30%小鼠发病(血糖正常小鼠30周龄时占总比例的70%),p<0.01。可明显看出海藻酸治疗组小鼠1型糖尿病发病时间显著延迟,而且发病率显著低于未治疗组。
(2)经海藻酸微球治疗小鼠脾脏t细胞表面抗原cd4及t细胞受体双阳(cd4+/tcrβ+)t细胞明显增殖,小鼠血清内调节性t细胞因子转化生长因子(tgf-β)及白介素10(il-10)水平以及th17相关细胞因子白介素17a(il-17a)水平也明显高于未治疗组,说明海藻酸微球是通过激活体内调节性t细胞,诱导免疫耐受实现的。具体结果如图2-图6所示。
图2为海藻酸治疗组与未治疗对照组小鼠(cd4+/tcrβ+)t细胞中羟基荧光素二醋酸盐琥珀酰亚胺脂的平均荧光强度结果图。从30周龄海藻酸治疗组及未治疗小鼠中提取脾脏并研磨获得脾脏t细胞后,使用羟基荧光素二醋酸盐琥珀酰亚胺脂标记t细胞,再使用负载抗原肽段的海藻酸微球对t细胞进行刺激,培养3天后标记t细胞表面抗原cd4和t细胞受体tcrβ,使用流式细胞仪测定海藻酸微球对cd4/tcrβ双阳t细胞增殖的影响。从图2中可以看出,海藻酸治疗组平均荧光强度比未治疗组显著降低,代表海藻酸治疗组t细胞分裂更加频繁,因此在t细胞中滞留的羟基荧光素二醋酸盐琥珀酰亚胺脂荧光分子更少,荧光强度更低。此图说明海藻酸微球对于t细胞,特别是cd4阳性th2t细胞增殖有促进作用。
图3为海藻酸治疗组与未治疗对照组小鼠血清中转化生长因子(tgf-β)的浓度结果图。从图3中可以看出,海藻酸治疗组的小鼠血清中转化生长因子(tgf-β)水平比未治疗组显著升高。tgf-β可促进效应性t细胞treg的分化及功能。效应性t细胞的生成依赖于tgf-β和il-10,treg可有效诱导机体免疫耐受,降低机体排异反应及体内炎症。
图4为海藻酸治疗组与未治疗对照组小鼠血清中白介素10(il-10)的浓度结果图。从图4中可以看出,海藻酸治疗组的小鼠血清中白介素10(il-10)水平比未治疗组显著升高。il-10是一种抗炎因子,是效应性t细胞treg形成的必要因子之一。效应性t细胞可有效诱导机体免疫耐受,降低机体排异反应及体内炎症。
图5为海藻酸治疗组与未治疗对照组小鼠血清中肿瘤坏死因子(tnf-α)的浓度结果图。从图5中可以看出,海藻酸治疗组的小鼠血清中肿瘤坏死因子(tnf-α)水平比未治疗组显著降低。tnf-α是一种促炎因子,抑制免疫耐受,提高机体排异反应及体内炎症,其水平降低糖尿病发病、降低体内炎症有良性作用。
图6为海藻酸治疗组与未治疗对照组小鼠血清中白介素17a(il-17a)的浓度结果图。从图6中可以看出,海藻酸治疗组的小鼠血清中白介素17a(il-17a)水平比未治疗组显著降低。il-17a在自身性免疫疾病(如类风湿性关节炎、多发性硬化)中有至关重要的作用,临床治疗会选用抗il-17手段,具有显著疗效。白介素17a可直接活化介导t17细胞功能,促进体内炎症及排异反应。因此,海藻酸治疗后,小鼠血清中白介素17水平下调,也可说明其体内免疫炎症有所缓解,对缓解自身性免疫疾病有良性作用。
需要注意的是,除非另有说明,本申请使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对步骤、数字表达式和数值并不限制本发明的范围。在这里示出和描述的所有示例中,除非另有规定,任何具体值应被解释为仅仅是示例性的,而不是作为限制,因此,示例性实施例的其他示例可以具有不同的值。
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个以上,除非另有明确具体的限定。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的保护范围当中。
- 还没有人留言评论。精彩留言会获得点赞!