能识别肿瘤胞外pH的聚合物纳米胶束及其制备方法和应用与流程
本发明涉及控释纳米药物载体,特别是一种能识别肿瘤胞外ph的聚合物纳米胶束及其制备方法和应用。
背景技术
刺激响应性聚合物药物传递系统在药物传递系统界一直备受关注,它不仅能将药物特异性的送至肿瘤部位,而且能在靶点快速释放药物。其中,基于ph敏感的聚合物胶束已发展用于癌症治疗。在细胞摄取以后,系统在内涵体内显示出ph依赖的失稳,从而释放出药物。然而,这种传递系统对癌细胞的胞内ph并不具有特异性,因为正常细胞与肿瘤细胞具有相同的细胞内ph(低于6.5)。与细胞内ph不同,肿瘤组织的细胞外ph值(ph为6.8-7.2)低于相应的正常组织(ph7.4),这种较低的细胞外ph值已被用作抗癌药物传递系统设计的靶标。例如,文献pullulanderivative/sulfonamideconjugate:characterization,aggregation,andadriamycinreleaseinvitro报道了一种由普鲁兰糖衍生物/磺酰胺共轭物组成的高ph敏感的纳米系统,该系统在低于ph7.2时聚集,并触发负载的抗癌药物释放。但是系统在ph6.8、24小时内的最大累积释放量仅比ph7.4时增加了27%,在ph7.4时的累积释放量高达33.0%表明该系统难以避免在体循环中泄漏大量药物。minkh等人在文献tumoralacidicph-responsivempeg-poly(beta-aminoester)polymericmicellesforcancertargetingtherapy报道了ph敏感的mpeg-聚(β-氨基酯)胶束用于癌症靶向治疗,其在酸性ph值(ph6.4)下显示出高度ph依赖的胶束化/去胶束化转换,但其载药系统在ph7.4、3小时内存在22%的快速累积释放。为了促进胞外靶向,ph/温敏聚合物胶束也被开发出来。zhang等在文献thermoandphdual-responsivenanoparticlesforanti-cancerdrugdelivery中制备了基于聚(n-异丙基丙烯酰胺-co-丙烯酸)-b-(己内酯)的ph/温敏核壳纳米粒子;该系统在体温下能响应弱酸性肿瘤胞外ph(ph6.9和7.2)释放包封药物,然而,与血液和正常组织中的释放介质(ph7.4)相比,仅观察到轻微的释放差异,因而在药物到达靶向部位之前仍不能避免大量的泄漏。另外,更关键的是这种温度敏感系统是由不可降解聚合物构成的。
ph敏感的传递系统很难精准识别肿瘤胞外ph的主要原因是:大多数肿瘤的胞外ph只与正常组织和血液存在轻微差异。所以我们设想:如果一个ph敏感的传递系统具有释放质子的功能,有望能扩大这种差异,达到促进肿瘤胞外ph靶向的目的。
羧甲基壳聚糖作为水溶性聚合物具有良好的ph敏感性、生物相容性、可生物降解性和低毒性。采用羧甲基壳聚糖及其衍生物自组装的纳米载体一般带负电,而据报道带负电的纳米载体可以抵抗蛋白质的吸附,有些已显示可以长时间的循环。
本发明先以光扳机化合物1-芘甲醇和琥珀酸酐反应得到中间产物1-芘甲基琥珀单酯,然后将其接枝到羧甲基壳聚糖骨架上形成两亲性聚合物,随后在水溶液超声自组装形成ph敏感和光响应性聚合物胶束。该胶束载药用于人体癌症治疗,能通过体循环到达肿瘤部位,响应体外光照刺激释放药物和质子。当细胞外ph降低到一定值时,随后到达的胶束能迅速聚集并再次引发药物释放。另外,由于采用的光扳机化合物1-芘甲醇具有荧光性,使得载药纳米胶束也显示荧光,因此该系统不仅可用于抗癌药物的控制释放,还可用于药物的传递追踪。
技术实现要素:
本发明所要解决的技术问题是:为了解决现有技术中存在的问题,提供一种新型的能识别肿瘤胞外ph的聚合物纳米胶束及其制备方法和应用。该方法不仅工艺简单,操作简便,而且制备的纳米胶束具有较好的肿瘤胞外ph识别能力和光响应性,在抗肿瘤药物控释领域具有广阔的应用前景。
本发明解决其技术问题采用以下的技术方案:
本发明提供的光响应性纳米胶束,其有效成分为光响应基团1-芘甲基琥珀单酯(pms)与羧甲基壳聚糖(cmcs)反应制得的两亲性缀合物(pms-cmcs)。
所述羧甲基壳聚糖的取代度是80%~100%,脱乙酰度为70%-90.1%;1-芘甲基琥珀单酯在羧甲基壳聚糖分子链上的取代度是9%~20%。
本发明提供的光响应性纳米胶束的制备方法,具体是采用包括以下步骤方法:
(1)1-芘甲基琥珀单酯(pms)的合成:
1-芘甲醇(pym)溶解在氯仿中,然后向该溶液中加入琥珀酸酐和4-(n,n-二甲基氨基)吡啶(dmap),55℃下搅拌回流反应20小时。反应完成后,配制hcl(1.0m)溶液洗涤反应后的混合液,以除去dmap,再将现配的饱和碳酸氢钠溶液倒入反应液,进行萃取,再用乙醚洗涤水相,然后加hcl(1.0m)酸化至ph4.0,有固体粉末析出,过滤,并将滤饼于50℃条件下真空干燥,收集得到的白色粉末状产物备用。所有上述反应条件均为避光,得到所述1-芘甲基琥珀单酯。
(2)两亲性缀合物(pms-g-cmcs)的制备:
1-芘甲基琥珀单酯用nhs和edc·hcl活化后,按照1-芘甲基琥珀单酯与羧甲基壳聚糖的糖单元摩尔比为1:3~7加入到羧甲基壳聚糖水溶液中,于去离子水中透析48h,再冷冻干燥透析液,得到所述两亲性缀合物(pms-g-cmcs),其中1-芘甲基琥珀单酯在羧甲基壳聚糖分子链上的取代度是9%~20%。
(3)光响应性纳米胶束的制备:
将两亲性缀合物(pms-g-cmcs)分散于水中,超声分散后,即得光响应性纳米胶束,粒径大小范围为(177-300)nm。
本发明提供的上述方法制备的光响应性纳米胶束,可用于疏水性抗癌药物的负载。所得载药纳米胶束经体循环作用于靶组织或靶细胞,能响应体外光刺激释放药物和质子,引发后续胶束聚集并进一步释放抗癌药物。
本发明与现有技术相比具有以下主要的优点:
1.具有释放质子的功能:
由于大多数肿瘤胞外ph只与正常组织和血液存在轻微差异,所以ph敏感的传递系统很难精准识别肿瘤胞外ph,本发明设计一个ph敏感的传递系统,具有释放质子的功能,有望能扩大这种差异,达到促进肿瘤胞外ph靶向的目的。
2.本发明以光扳机化合物1-芘甲醇和琥珀酸酐反应得到中间产物1-芘甲基琥珀单酯,然后将其接枝到羧甲基壳聚糖骨架上形成两亲性聚合物,随后在水溶液超声自组装形成ph敏感和光响应性聚合物胶束。采用的光扳机化合物1-芘甲醇具有荧光性,使得载药纳米胶束也显示荧光,因此该系统不仅可用于抗癌药物的控制释放,还可用于药物的传递追踪。
3.该方法不仅工艺简单,操作简便,而且制备的纳米胶束具有较好的肿瘤胞外ph识别能力和光响应性,在抗肿瘤药物控释领域具有广阔的应用前景。在用于治疗人体癌症过程中,能通过体循环到达肿瘤部位,响应体外光照刺激释放药物和质子。当细胞外ph降低到一定值时,随后到达的胶束能迅速聚集并再次引发药物释放。
附图说明
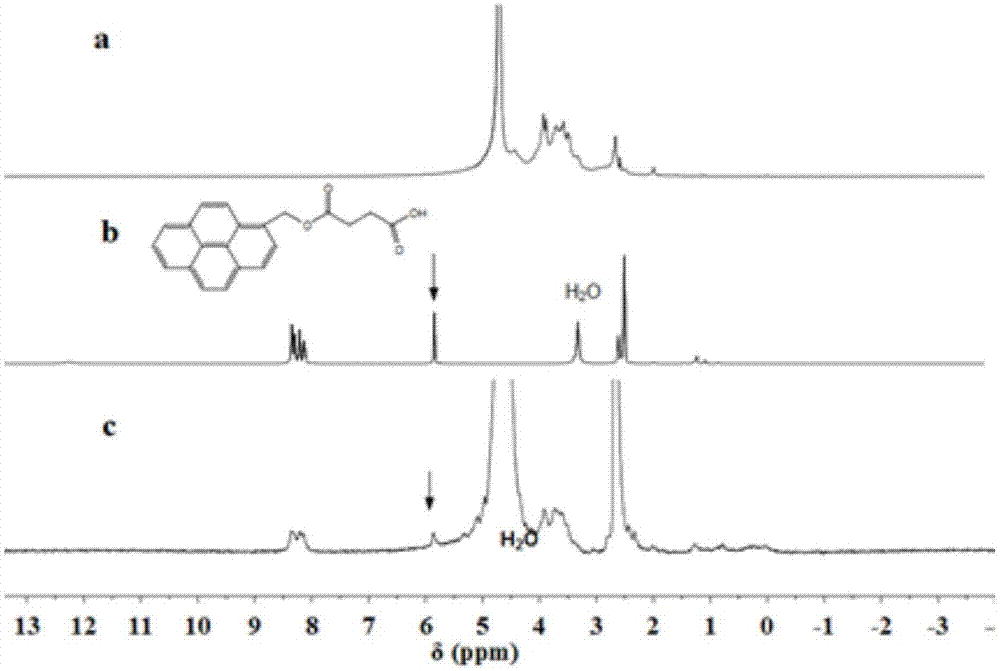
图1为本发明实施案例1制备的各物质的核磁图谱:其中a为pms在dmso-d6中的1h-nmr图谱;b为cmcs在d2o中的1h-nmr图谱;c为pms-g-cmcs在dmso-d6/d2o(1:3,v/v)中的1h-nmr图谱。
图2为本发明实施案例4制备的pms-g-cmcs在dmso-d6/d2o(1:3,v/v)中光照20min后的1h-nmr图谱。
图3为本发明实施案例5制备的cmcs、pms、pms-g-cmcs的红外图谱。
图4为本发明实施案例3制备的pms-g-cmcs在紫外光(275-375)nm下辐射不同时间段的紫外吸收曲线。
图5为本发明实施案例3制备的pms-g-cmcs在340nmuv光照前后的透射电镜图。
图6为本发明实施案例2制备的pms-g-cmcs在紫外光(400-600)nm照射下的荧光光谱图。
图7为本发明实施2、3制备的pms-g-cmcs的光响应质子释放图。
图8和表1为本发明实施案例1、2、3制备的pms-g-cmcs的ph敏感图。
图9为本发明制备的光响应性载药纳米胶束的体外释药曲线图。该图反映了实施案例2制备的光响应性载药纳米胶束在ph7.4、ph6.8、ph6.0的缓冲溶液中有光照或无光照条件下药物释放曲线图(以紫杉醇为疏水性抗癌药模型)。作为控制样品,无光辐射的条件下,负载紫杉醇的两种载药纳米胶束在ph7.4、ph6.8、ph6.0的缓冲溶液中12h内分别只有3.35%、5.12%和46.2%的紫杉醇释放;而在具有紫外光照射的ph6.8培养基中,ptx释放显着增强,在12小时时累积释放率高达93.6%。图9中:▼模拟太阳光照射(200-2500nm光谱输出,50w辐射输出)。
具体实施方式
本发明是一种能识别肿瘤胞外ph的聚合物纳米胶束及其制备方法和应用,该胶束有效成分为1-芘甲基琥珀单酯(pms)与羧甲基壳聚糖(cmcs)反应制得的两亲性缀合物(pms-cmcs)。该胶束的制备方法包括pms和pms-cmcs的合成及pms-cmcs在水溶液中的自组装。该胶束能用于负载疏水性抗癌药物;在体内通过体循环到达肿瘤细胞或组织能响应体外光刺激释放包载药物和质子;释放出的质子可降低肿瘤胞外ph,引发后续载药胶束聚集并进一步释放药物。该胶束能显示荧光,可用于抗癌药物体内传送过程中的追踪观察。
下面结合实施例和附图对本发明作进一步说明,但不限定本发明。
实施例1:
(1)1-芘甲基琥珀单酯(pms)的制备:
1-芘甲醇(pym)与琥珀酸酐摩尔比为1:0.56溶于氯仿,加入为原物质的量的0.13倍的量的催化剂4-(n,n-二甲基氨基)吡啶(dmap),氮气保护下,回流反应20小时,停止反应后,再将饱和碳酸氢钠溶液倒入反应液,进行萃取,再用体积比为1:2的纯乙醚洗涤水相,以除去残余的氯仿,然后加hcl(1.0m)酸化至ph4.0,有固体粉末析出,过滤,并将滤饼于50℃条件下真空干燥,即得到1-芘甲基琥珀单酯(pms),所有上述反应条件均为避光。
(2)两亲性缀合物(pms-g-cmcs)的制备:
取羧甲基取代度为80%、脱乙酰度为90.1%,重量百分比浓度为2.0%的羧甲基壳聚糖水溶液,将1-芘甲基琥珀单酯(经nhs和edc·hcl活化)的dmso溶液加入到羧甲基壳聚糖水溶液(羧甲基壳聚糖单元与1-芘甲基琥珀酸酯摩尔比为1:0.7),于室温、避光和氮气保护下反应24h,用去离子水透析至中性,冷冻干燥,得到光响应聚合物,命名为pms-g-cmcs-1,pms的取代度9%。
(3)光响应性纳米胶束的制备:
取10.0mgpms-g-cmcs-1溶解在ph为7.4磷酸盐缓冲溶液中,超声自主装得到光响应性纳米胶束,命名为pm-1,其粒径大小为177nm。
实施例2:
(1)1-芘甲基琥珀单酯的制备:
同实施例2。
(2)两亲性缀合物(pms-g-cmcs)的制备:
取羧甲基取代度为90%、脱乙酰度为89.4%,重量百分比浓度为2.0%的羧甲基壳聚糖水溶液,将1-芘甲基琥珀单酯(经nhs和edc·hcl活化)的dmso溶液加入到羧甲基壳聚糖水溶液(羧甲基壳聚糖单元与1-芘甲基琥珀酸酯摩尔比为1:0.5),于室温、避光和氮气保护下反应24h,用去离子水透析至中性,冷冻干燥,得到光响应聚合物,命名为pms-g-cmcs-2,pms的取代度是13%。
(3)光响应性纳米胶束的制备:
取10.0mgpms-g-cmcs-2溶解在ph为7.4的磷酸盐缓冲溶液中,超声自主装得到光响应性纳米胶束,命名为pm-2,其粒径大小为198nm。
实施例3:
(1)1-芘甲基琥珀单酯的制备:
同实施例2。
(2)两亲性缀合物(pms-g-cmcs)的制备:
取羧甲基取代度为100%、脱乙酰度为70%,重量百分比浓度为2.0%的羧甲基壳聚糖水溶液,将1-芘甲基琥珀单酯(经nhs和edc·hcl活化)的dmso溶液加入到羧甲基壳聚糖水溶液(羧甲基壳聚糖单元与1-芘甲基琥珀单酯摩尔比为1:0.5),于室温、避光和氮气保护下反应24h,用去离子水透析至中性,冷冻干燥,得到光响应聚合物,命名为pms-g-cmcs-2,pms的取代度是20%。
(3)光响应性纳米胶束的制备:
取10.0mgpms-g-cmcs-3溶解在ph为7.4的磷酸盐缓冲溶液中,超声自主装得到光响应性纳米胶束,命名为pm-3,其粒径大小为210nm。
实施例4:
(1)1-芘甲基琥珀单酯的制备:
同实施例2。
(2)两亲性缀合物(pms-g-cmcs)的制备:
取羧甲基取代度为85%、脱乙酰度为89.5%,重量百分比浓度为5.0%的羧甲基壳聚糖水溶液,将1-芘甲基琥珀单酯(经nhs和edc·hcl活化)的dmso溶液加入到羧甲基壳聚糖水溶液(羧甲基壳聚糖单元与1-芘甲基琥珀单酯摩尔比为1:0.6),于室温、避光和氮气保护下反应24h,用去离子水透析至中性,冷冻干燥,得到光响应聚合物,命名为pms-g-cmcs-4,pms的取代度是11.5%。
(3)光响应性纳米胶束的制备:
取10.0mgpms-g-cmcs-4溶解在ph为7.4的磷酸盐缓冲溶液中,超声自主装得到光响应性纳米胶束,命名为pm-4,其粒径大小为210nm。
实施例5:
(1)1-芘甲基琥珀单酯的制备:
同实施例2。
(2)两亲性缀合物(pms-g-cmcs)的制备:
取羧甲基取代度为95%、脱乙酰度为75.6%,重量百分比浓度为5.0%的羧甲基壳聚糖水溶液,将1-芘甲基琥珀单酯(经nhs和edc·hcl活化)的dmso溶液加入到羧甲基壳聚糖水溶液(羧甲基壳聚糖单元与1-芘甲基琥珀单酯摩尔比为1:0.4),于室温、避光和氮气保护下反应24h,用去离子水透析至中性,冷冻干燥,得到光响应聚合物,命名为pms-g-cmcs-5,其中pms的取代度是15%。
(3)光响应性纳米胶束的制备:
取10.0mgpms-g-cmcs-5溶解在ph为7.4的磷酸盐缓冲溶液中,超声自主装得到光响应性纳米胶束,命名为pm-5,其粒径大小为189nm。
胶束的表征实验:
为了证明pms-g-cmcs的成功合成,我们采用核磁和红外表征该化合物的结构(见图1、3)。
为了证明pms-g-cmcs能在水溶液中自组装形成核壳胶束,我们取实例3中制备的胶束pm-3,采用透射电镜观察uv的辐射前后的形态变化,表征其光响应行为(见图5),并采用动态光散射仪表征了实施案例1、2、3制备的胶束的粒径(见表1)。
为了证明胶束在光刺激作用下的质子释放行为,我们将实例3中制备的胶束pm-3置于(275-375)nm的uv光下辐射,测定胶束随不同紫外照射时间的光谱吸收曲线(见图4)。结果显示芘甲基在312nm,325nm和342nm的特征吸收强度随uv照射时间逐渐减弱,表明pms-g-cmcs在uv刺激下发生光解反应。
为了证明胶束能发射荧光,我们将实例2制备的胶束pm-2溶液在发射波长(400-600)nm范围内扫描(见图6)。结果显示胶束溶液的主要发射峰约在470nm处(芘甲基的聚集和疏水核的形成)。为了进一步证明胶束的光解性,将胶束溶液进行紫外光照射处理20min,然后再进行荧光扫描。结果显示胶束在470nm处的荧光发射强度明显减弱;而在380-410nm(1-芘甲醇单体的发射峰)范围内的发射强度明显增加,表明胶束发生了光解反应。
为了表征胶束对ph的识别能力,我们测定了实例1、2、3中制备的胶束在不同ph缓冲溶液中的粒径变化(见图7)。结果显示pms-g-cmcs胶束在ph5.5-6.5范围内粒径明显增大,表明胶束发生了聚集,即胶束的ph识别范围为5.5-6.5。
应用部分:
(1)载药胶束制备:
取实例1-3中制备的pms-g-cmcs-1、pms-g-cmcs-2、pms-g-cmcs-3分别溶解在磷酸缓冲溶液中(ph=7.4,0.02m),分别取重量百分比浓度为100%的pms-g-cmcs溶液,分别加入占其质量40%、50%、60%的紫杉醇,搅拌6h,超声(2-5)min,即得光响应性载药纳米胶束,采用hplc测得实例1、实例2和实例3的载药率分别为13.9%、18.6%、23.2%。
(2)聚集与释放实验:
为考察所得胶束用于在光照条件下药物控制释放可行性,研究了包封ptx的胶束在不同刺激条件下的释药行为。由于体循环液和正常组织中的细胞外液的ph为7.4,在癌组织中的细胞外液是微酸性(ph6.8-7.2)。当载药胶束通过体循环到达被外界光刺激的肿瘤细胞位点时,由于光解释放质子而导致细胞外ph降低。所以选取如下三种不同ph的缓冲液作为释放介质:ph7.4的磷酸缓冲溶液,ph6.8的氯化钠水溶液和ph6.0氯化钠水溶液。我们将一定量的载药胶束分散于释放介质中,然后投入透析袋(截止分子量:14000),使用hplc来检测药物释放。
为了更真实模拟体内过程,使用没有光照射的ph7.4、6.8和6.0中分散的胶束作为对照,而将ph6.8中的胶束分成两等份:一份用uv光照射4分钟后,立即与另一份未光照的试样混合,随后用于测量药物释放。图9显示了在不同刺激情况下,负载ptx的pm-2的药物释放行为曲线。在未经紫外光照射的ph7.4、6.8和6.0介质中,12小时内载药pm-2释药率分别为3.35%、5.12%和46.2%,表明ph6.0刺激能提高药物的释放率;而在具有半份光照的ph6.8介质中,来自载药胶束的ptx释放显着增加,在12小时内累积释放率高达93.6%,表明光解不仅能加速药物释放,而且光解释放出的质子因降低了介质中的ph协同促进了药物释放。另外,在有半份光照的ph6.8释放介质中,我们检测到ph约为6.0,且与未光照ph6.0介质一样,观测到了胶束的聚集。
表1
- 还没有人留言评论。精彩留言会获得点赞!