烟曲霉酸在制备治疗骨质疏松药物方面的应用的制作方法
本发明属于骨疾病治疗技术领域,尤其涉及烟曲霉酸在制备治疗骨质疏松药物方面的应用。
背景技术
在生命发育生长过程中,骨骼作为一个高度活跃的器官持续不断地经历着骨吸收和骨形成这两个彼此独立又相互偶联的事件,两者之间的动态平衡维持了骨骼的结构和功能。其中,破骨细胞作为骨吸收的主要参与者,介导了正常生理情况下以极个别骨吸收相关的疾病发生,如过度的破骨细胞分化和活化是导致绝经期妇女骨质疏松症的主要原因。随着老龄化的日益加剧,骨质疏松症现已成为了一个世界性的健康问题。骨质疏松症是一种表现为骨量减少和骨显微结构退化为特征的骨代谢性疾病。根据国际骨质疏松组织报告,全世界有近2亿人口患有骨质疏松症,每年有超过890万人口因骨质疏松导致骨折。然而,目前临床上常用的抗骨松药物都有各种不同程度的副反应。因此,寻找有效的破骨细胞形成及活化的干预手段进而防治骨质疏松症具有重大意义。
破骨细胞是由造血干细胞中的单核/巨噬细胞系分化而来的多核细胞,通过局部密封形成封闭区域、泌酸及释放骨基质降解酶实现骨的吸收和降解。核因子受体激活因子κb配体(rankl)是促进破骨细胞分化和活化的重要因子,是破骨细胞分化和活化必不可少的一环,rankl缺陷小鼠表现为破骨细胞形成受阻导致的严重骨硬化症。它通过与破骨细胞前提细胞胞膜上的受体rank结合引起下游如erk磷酸化、c-fos信号、钙离子信号及氧化应激等过程,最终通过激活破骨细胞最重要的转录因子nfatc1而调控其下游破骨细胞特征性基因如acp5,ctr,ctsk和atpgv0d2的表达。因此,有效抑制破骨细胞的形成和骨吸收功能是治疗骨质疏松症的关键。
烟曲霉酸(helvolicacid)是一种四环三萜类化合物,分子式为c33h44o8,分子量568.6,最早是从烟曲霉(aspergillusfumigatus)的代谢产物中分离得到,近年来的研究中报道了该化合物具有良好的抗菌活性和抗癌效果。然而,烟曲霉酸对骨代谢的影响,特别是对破骨细胞的作用,国内外至今未见任何报道。
技术实现要素:
本发明要解决的技术问题是提供一种烟曲霉酸在制备治疗骨质疏松药物方面的应用,这为骨质疏松治疗提供了新的方案,也为深入开发烟曲霉及其代谢物开辟了新途径。
为解决上述技术问题,本发明采用以下技术方案:
烟曲霉酸在制备治疗骨质疏松药物方面的应用。
上述骨质疏松由破骨细胞过度活动引起。
目前,烟曲霉酸在骨质疏松中的作用还没有被报道。本发明首次在国内外发现烟曲霉菌主要代谢产物中的烟曲霉酸可以通过抑制rankl诱导的破骨细胞下游的nfatc1信号进而抑制破骨细胞的形成和功能。发明人通过抗酒石酸酸性染色法发现烟曲霉酸可以有效抑制破骨细胞的形成,并且呈剂量依赖性;功能鉴定显示,破骨细胞在羟基磷灰石板中骨吸收功能也明显受药物作用而被有效抑制。此外,实时定量pcr检测结果表明破骨细胞特征性的基因如calcitoninreceptor(ctr),tracp(acp5),cathepsink(ctsk)和v-atpase-d2(atp6v0d2)均被烟曲霉酸抑制。基于上述现象,发明人进一步机制研究提示,烟曲霉酸通过影响erk磷酸化、c-fos信号通路、钙离子震荡及抗氧化应激作用最终影响nfatc1信号进而影响破骨细胞的形成和功能。因此,本发明表明烟曲霉酸作为抑制破骨细胞的有效药物在骨质疏松症的治疗中具备极大潜力。
附图说明
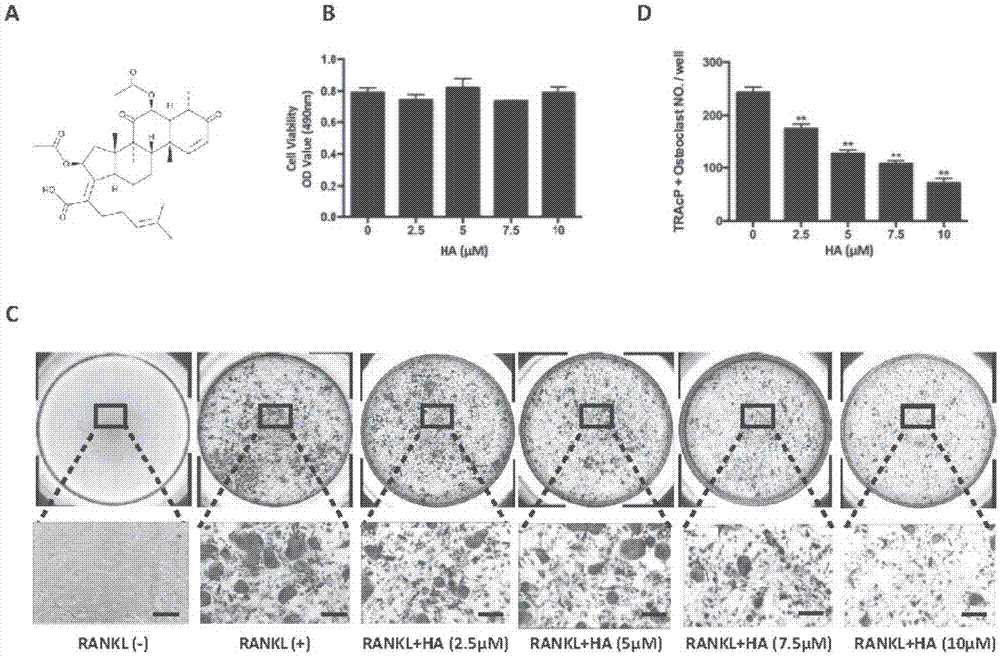
图1是烟曲霉酸显著抑制rankl诱导的破骨细胞形成并且具有剂量依赖性的试验结果图,图中:a烟曲霉酸的化学结构式,b烟曲霉酸对细胞的毒性测试结果,c烟曲霉酸作用于破骨细胞分化分化后的抗酒石酸酸性磷酸酶(tracp)染色结果,d图ctracp染色后破骨的定量统计结果。
图2是烟曲霉酸有效抑制破骨细胞的骨吸收功能的试验结果图,图中:a烟曲霉酸在骨吸收板(羟基磷灰石板)中对破骨细胞分化作用的tracp染色,b图a中破骨细胞的定量统计结果,c烟曲霉酸在骨吸收板(羟基磷灰石板)中对破骨细胞骨吸收功能的抑制作用,d图c中骨吸收区域面积的定量统计结果。
图3是烟曲霉酸抑制rankl诱导的破骨细胞分化过程中的钙离子振荡且有效清除分化过程中产生的氧自由基的试验结果图,图中:a阴性对照组(不加rankl,不加烟曲霉酸)中细胞的钙离子振荡信号强度波形图,b阳性对照组(加rankl,不加烟曲霉酸)中细胞的钙离子振荡信号强度波形图,c实验组(加rankl,加烟曲霉酸)中细胞的钙离子振荡信号强度波形图,d图a-c中钙离子信号强度差值的定量统计结果,e氧自由基在烟曲霉酸干预下的氧自由基的荧光信号图,f不同组中随机氧自由基荧光强度的定量统计结果,g不同组中随机平均每个细胞的氧自由基荧光强度定量统计结果。
图4是烟曲霉酸有效抑制破骨细胞的特征基因表达的试验结果图,图中:a破骨细胞特征性基因c-fos的表达水平在烟曲霉酸干预后的定量统计结果,b破骨细胞特征性基因acp5的表达水平在烟曲霉酸干预后的定量统计结果,c破骨细胞特征性基因nfatcl的表达水平在烟曲霉酸干预后的定量统计结果,d破骨细胞特征性基因atp6v0d2的表达水平在烟曲霉酸干预后的定量统计结果,e破骨细胞特征性基因ctr的表达水平在烟曲霉酸干预后的定量统计结果,f破骨细胞特征性基因ctsk的表达水平在烟曲霉酸干预后的定量统计结果。
图5是烟曲霉酸通过影响erk磷酸化和c-fos信号最终影响nfatc1活化的试验结果图,图中:a烟曲霉酸干预erk磷酸化蛋白印迹试验结果,b图a中蛋白印迹条带强度的定量统计结果,c,烟曲霉酸干预下nfatcl荧光素酶报告基因测定结果,d烟曲霉酸干预下破骨细胞特征性蛋白c-fos、nfatc1和cathepsink的蛋白印迹试验结果,ec-fos蛋白印迹条带强度的定量统计结果,fnfatc1蛋白印迹条带强度的定量统计结果,gcathepsink蛋白印迹条带强度的定量统计结果。
图6是烟曲霉酸抑制破骨细胞分化和功能的分子机制示意图。
具体实施方式
一、材料
烟曲霉酸购自上海臻准生物科技有限公司,在磷酸盐缓冲盐水(pbs)中的浓度为1mmol/l时制备。d-最小必需培养基(α-mem),胎牛血清(fbs),破骨细胞f环染剂rhodaminephalloidin,活性氧(ros)探针(fluo-4and2’,7’-dichlorodihydrofluoresceindiacetate,h2dcfda)购自澳大利亚赛默飞世尔科技公司。蛋白印迹(westernblot)实验中的nfatc1、cathepsink、c-fos、iκb-α、erk、磷酸化erk和β-actin等抗体购自美国santacruzbiotechnology。mts试剂盒、荧光素酶检测试剂盒购自promega(悉尼,澳大利亚)。实验所应用重组rankl蛋白的表达和纯化于西澳大学医学院徐家科教授实验室完成。巨噬细胞集落刺激因子(m-csf)购自r&d公司。
二、方法
1.烟曲霉酸抑制破骨细胞分化实验
将取自c57bl/6小鼠新鲜分离的骨髓巨噬细胞(bmms)以6×103个细胞/孔的密度种入96孔培养板中。用包含m-csf(50ng/ml)和rankl(100ng/ml)的完整培养基(含α-mem和10%胎牛血清)培养,同时予以用不同梯度浓度(0,2.5,5,7.5,10μmol/l)的烟曲霉酸对细胞进行处理。细胞培养液每2天更换一次直到破骨细胞形成。用4%多聚甲醛固定10min,用pbs洗涤3次,对细胞进行抗酒石酸酸性磷酸酶(tracp)的染色(37℃孵育30分钟),其中tracp阳性多核细胞(>3核)鉴定为破骨细胞并对各个不同梯度浓度烟曲霉酸作用下的破骨细胞数量进行计数、比较。
2.烟曲霉酸细胞毒性测试
将bmms以6×103个/孔接种于96孔板中,留置过夜使细胞贴壁。次日,按上述浓度将烟曲霉酸加入细胞培养基共同孵育48小时。孵育结束后加入20μl/孔的mts溶液,与细胞共孵育2h后在用全自动定量酶标仪(bmg,德国)在490nm分光光度处读读取吸光度。比较吸光度值分析烟曲霉酸对细胞有无毒性作用。
3.烟曲霉酸对破骨细胞骨吸收功能抑制实验
采用羟基磷灰石板吸收法评价破骨细胞骨吸收功能。
首先,将bmms(1×105细胞/孔)在6孔胶原包被板(bdbiocoat,thermofisher,score,澳大利亚)中培养。用50ng/mlrankl和50ng/mlm-csf刺激细胞,直至破骨细胞形成早期阶段(少量多核细胞)。然后,使用细胞解离溶液(sigma-aldrich,symmid,澳大利亚)将细胞轻轻地从平板上分离。将相同数量的成熟破骨细胞接种到羟基磷灰石涂层96孔板中的各个孔中(corning,美国),继续予m-csf和rankl刺激并予不同浓度(0,5,10μmol/l)烟曲霉酸干预直至对照孔(未加烟曲霉酸组)形成成熟破骨细胞。将每组一半的孔进行tracp以用于破骨细胞计数,其余一般除去细胞以测量羟基磷灰石吸收区域,拍照并用imagej软件分析破骨细胞吸收面积并进行组间比较。
4.细胞内钙离子振荡试验
用钙结合染料fluo4-am研究细胞内钙离子振荡的测定。
将bmms以1×104细胞/孔接种到48孔板中,用含10μmol/l烟曲霉酸+rankl和m-csf的完整培养基换液培养24小时后用试验缓冲液(hanks平衡盐溶液+1mm丙磺舒+1%fbs)洗涤细胞,接着用4mmfluo4染色液将细胞在37℃下孵育45min,之后用试验缓冲液中洗涤细胞一次,室温下孵育20min。最后用倒置荧光显微镜(nikon,日本)在488nm的激发波长下检测细胞的荧光变化,拍摄时间持续3分钟,每2秒采集1次图像并用nikon基础研究软件分析荧光强度变化即为钙离子振荡信号改变。
5.烟曲霉酸抗氧化试验
将bmms以5×103细胞/孔接种于96孔板后予以50ng/mlrankl刺激并以不同浓度(0,5,10μmol/l)烟曲霉酸干预24小时后使用细胞内氧自由基探针2’,7’-二氯二氢荧光素二乙酸酯(h2dcfda,20μmol/l)孵育30分钟后使用hanks平衡盐溶液洗涤细胞3次,通过nikonalsi共聚焦显微镜在488nm的激发波长和538nm的发射波长下测量荧光强度,并进行分析比较不同组别之间的荧光信号强度以比较细胞内氧自由基水平。
6.nfatc1荧光素酶报告基因检测
为了检测nfatc1转录激活情况,使用raw264.7细胞稳定转染nfatc1应答荧光素酶报告结构。转染细胞在密度为1.5×105个/孔的48孔板中培养,用不同浓度的烟曲霉酸预处理1h后用rankl(50ng/ml)刺激细胞24小时,最后根据制造商提供的说明书使用荧光素酶报告系统检测荧光素酶活性(promega,澳大利亚悉尼)。
7.实时定量聚合酶链式反应(pcr)分析
将bmms以1×105细胞/孔接种于6孔板,细胞贴壁后用50ng/mlrankl和50ng/mlm-csf刺激细胞加以烟曲霉酸干预,直至成熟破骨细胞形成。使用trizol试剂从细胞中分离出总rna并用1μgrna模板和具有寡核苷酸引物的逆转录酶逆转录单链cdna。
聚合酶链式反应扩增特异性序列采用以下程序:94℃连续5min,94℃30次,40s,60℃40s,72℃40s,72℃最后延伸5min,72℃,最后延伸5min。
破骨细胞相关基因的特异性引物序列如下:
atpgv0d2
forward:5’-gtgagaccttggaagacctgaa-3’,
reverse:5’-gagaaatgtgctcaggggct-3’;
acp5
forward:5’-tgtggccatctttatgct-3’,
reverse:5’-gtcatttctttggggctt-3’;
ctr
forward:5’-tggttgaggttgtgccca-,
reverse:5’-ctcgtgggtttgcctcatc-3’;
nfatc1
forward:5’-caacgccctgaccaccgatag-3’,
reverse:5’-ggctgccttccgtctcatagt-3’:
c-fos
forward:5’-gcgagcaactgagaagac-3’,
reverse:5’-ttgaaacccgagaacatc-3’:
ctsk
forward:5’-gggagaaaaacctgaagc-3’,
reverse:5’-attctggggactcagagc-3’:
hprt1
forward:5’-tcagtcaacgggggacataaa-3’,
reverse:5’-ggggctgtactgcttaaccag-3’。
使用hprt1归一化法计算相对mrna水平。
8.蛋白质印迹分析试验
用放射免疫沉淀法(ripa)裂解缓冲液溶解细胞提取蛋白。蛋白质经sds-聚丙烯酰胺凝胶电泳分离后,转入聚偏氟乙烯(pvdf)膜(gehealthcare,澳大利亚)。在5%脱脂乳中封闭1小时后,在4℃下用各种特异性初级抗体在4℃孵育过夜,然后用辣根过氧化物酶(hrp)结合的次级抗体孵育膜。最后用增强化学发光试剂检测抗体反应性(美国药典生物技术公司),使用imagequantlas4000(gehealthcare,澳大利亚)成像。
9.统计
上述研究数据以平均值±标准偏差(sd)表示,比较采用单因素方差分析(anova)和两两比较检验后确定结果间差异的显著性,检验p值小于0.05认为比较存在显著性差异。
三、结果
1.烟曲霉酸可以显著抑制rankl诱导的破骨细胞形成并且具有剂量依赖性。
如图1所示,为了明确烟曲霉酸对破骨细胞分化的影响,烟曲霉酸抑制破骨细胞分化实验中,予rankl和m-csf共同刺激诱导bmms分化破骨细胞的同时加入了不同浓度的烟曲霉酸(2.5、5、7.5、10μmol/l)干预,结果显示烟曲霉酸在浓度为2.5μmol/l时即出现对破骨细胞分化的抑制作用,tracp染色后可见加药组多核细胞明显减少,并且该抑制作用呈现计量依赖性(图1b,c)。同时,为了确定烟曲霉酸有无细胞毒性作用,将其加入bmms孵育培养后进行mts试验,结果表明烟曲霉酸在对破骨细胞分化的起效浓度下均未见毒性作用(图1c)。
2.烟曲霉酸有效抑制破骨细胞的骨吸收功能。
为了评价烟曲霉酸对破骨细胞的骨吸收功能影响,本发明采用羟基磷灰石板检测破骨细胞的骨吸收活性。如图2所示,在烟曲霉素的干预下,tracp染色后可见成熟破骨细胞数量较对照组减少(图2a,b),相应的骨吸收面积也明显减少(图2c)并且平均每个破骨细胞的骨吸收区域面积也减少(图2d)。因此,烟曲霉酸在抑制破骨细胞形成和分化的同时也抑制了破骨细胞的骨吸收功能。
3.烟曲霉酸抑制rankl诱导的破骨细胞分化过程中的钙离子振荡并且可以有效清除分化过程中产生的氧自由基。
rankl诱导bmms过程中产生的钙离子振荡和氧自由基是重要的破骨细胞分化的信号。细胞内钙离子振荡试验中,与对照组相比,烟曲霉酸有效地抑制了钙离子振荡的幅度(图3a,b,c,d)。此外,烟曲霉酸抗氧化试验显示,rankl诱导产生的氧自由基也被烟曲霉酸显著抑制(图3e),表现为随机视野中氧自由基的荧光信号总强度(图3f)和平均单个细胞的氧自由基荧光信号强度(图3g)。结果证实,烟曲霉酸抑制了rankl诱导的钙离子振荡及氧自由基的产生。
4.烟曲霉酸有效抑制破骨细胞的特征基因表达。
为了进一步研究烟曲霉酸在破骨细胞形成过程中对rankl诱导的基因表达的影响。本发明用实时定量聚合酶链式反应rt-pcr方法分析了不同剂量的烟曲霉酸对rankl和m-csf作用5天后bmms的基因表达水平。如图4所示,烟曲霉酸干预后,破骨细胞分化相关基因如c-fos,acp5,nfatc1,atpv0d2,ctr和ctsk的mrna表达水平明显下调。该研究结果与烟曲霉酸对破骨细胞分化和骨吸收的抑制作用相一致。
5.烟曲霉酸通过影响erk磷酸化和c-fos信号最终影响nfatc1活化。
nfatc1作为已知的破骨细胞分化和功能中最重要的转录因子,本发明研究了烟曲霉酸抑制破骨细胞分化和功能是否与其相关。
首先,发明人研究了nfatc1上游的erk磷酸化和c-fos信号情况。在蛋白印迹试验中,选取ranklbmms的不同时间点(0,10,20,30,60分钟),裂解后提取蛋白进行分析。如图5所示,结果表明,经过烟曲霉酸预刺激后的实验组中,erk磷酸化水平受到了抑制(图5a),该抑制作用存在显著性差异(图5b)。同样地,在破骨细胞分化的过程中,选取了第0,1,3,5天作为观察时间点,c-fos的蛋白表达水平与对照组相比也受到了明显的抑制(图5d,e)。在荧光素酶报告基因测定结果中发现,转染了nfatc1荧光酶报告基因的细胞系在受到烟曲霉酸干预后,rankl刺激下的nfatc1转录活性受到抑制(图5c)。蛋白印迹试验也证明了nfatc1在破骨细胞分化过程中的蛋白表达水平也受到了抑制(图5d,f)。最后,破骨细胞发挥功能的关键性蛋白金属蛋白酶k(cathepsink)的蛋白水平在烟曲霉酸的干预下表达受抑制。
以上结果表明,烟曲霉酸通过干预erk磷酸化和c-fos的信号传递显著影响了nfatc1的正常活化,最后抑制了破骨细胞的分化和功能。
6.烟曲霉酸抑制破骨细胞分化和功能的分子机制示意图。
根据上述研究的结果,发明人绘制了烟曲霉酸抑制破骨细胞分化和功能的分子机制示意图。图6展示,烟曲霉酸通过干预rankl介导的erk磷酸化、c-fos信号、钙离子振荡和氧化应激信号抑制了转录因子-nfatc1的活化和表达,最终影响了破骨细胞形成发生以及骨吸收功能实现。
序列表
<110>广西医科大学
<120>烟曲霉酸在制备治疗骨质疏松药物方面的应用
<160>14
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>1
gtgagaccttggaagacctgaa22
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
gagaaatgtgctcaggggct20
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
tgtggccatctttatgct18
<210>4
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>4
gtcatttctttggggctt18
<210>5
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>5
tggttgaggttgtgccca18
<210>6
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctcgtgggtttgcctcatc19
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>7
caacgccctgaccaccgatag21
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>8
ggctgccttccgtctcatagt21
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>9
gcgagcaactgagaagac18
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
ttgaaacccgagaacatc18
<210>11
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>11
gggagaaaaacctgaagc18
<210>12
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>12
attctggggactcagagc18
<210>13
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>13
tcagtcaacgggggacataaa21
<210>14
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>14
ggggctgtactgcttaaccag21
- 还没有人留言评论。精彩留言会获得点赞!