一种特异性核酸适配体键合的PEG-PLGA纳米粒及其制备方法与流程
本发明属于化学药物技术领域,涉及一种使生物分子核酸适配体成功键合在高分子材料上的方法,使高分子纳米粒具有主动靶向性的制备方法。
背景技术:
适配体是一些寡核酸或肽,其对几种类型的靶分子,包括蛋白质,核苷酸,肽,抗生素,小分子和细胞有高度的敏感性和良好的选择性。小核酸适配体在严苛的条件下表现出良好的稳定性,肽适配体具有与靶分子相互作用的合适结构。所有类型的适配体含有结合到靶分子的特定袋的可变环和茎区。适配体与抗体具有不同的优点,包括较小的尺寸,易于修饰和在苛刻的物理和化学环境中的高稳定性,以及快速和经济的生产,无批次间变化,低免疫原性和高度可变性。因此,适配体在医学目标和成像期间被认为是抗体的极好替代物,并且用于各种领域。核酸适配体的筛选技术被称为指数富集的配体系统进化技术(selex)技术,原理是首先构建容量巨大的随机寡核苷酸序列库,然后经过多轮结合和洗脱,从中获得能够和靶标物质高度亲和的寡核苷酸。selex是四个主要步骤的重复:与编码随机序列的适配体文库,通常为30-50mer,和引物结合位点;结合文库的洗脱;用聚合酶链反应扩增;和单链寡核苷酸分离。该过程通常重复10-15次,然后使用克隆技术分析所选择的适配体候选物。
许多纳米材料的开发加速了诊断和治疗的进展。各种纳米材料,如水凝胶,金属纳米颗粒,二氧化硅纳米颗粒和碳材料,具有理想的特性,包括可控的物理和化学性质,较大的表面积,强大的生物相容性并具有突出的稳定性。尽管纳米材料本身可用作诊断和治疗剂,但它们缺乏选择性靶向能力。因此,适配体-纳米材料复合物的设计与产生已应用在多个区域。
技术实现要素:
本发明的目的是通过特定的方法使核酸适配体能够成功与peg-plga纳米粒结合在一起,使peg-plga纳米粒具有主动靶向性,同时提高核酸适配体在体内的生物活性。
本发明技术方案如下。
该发明中使用的物质是复乳法制备的peg-plga纳米粒(plga(50/50)分子量为17k,peg的分子量为3.4k)表面具有羧基,而靶向cd30的核酸适配体通过已知序列合成后在3’端修饰氨基,由31个碱基组成,分子量为10315.09。
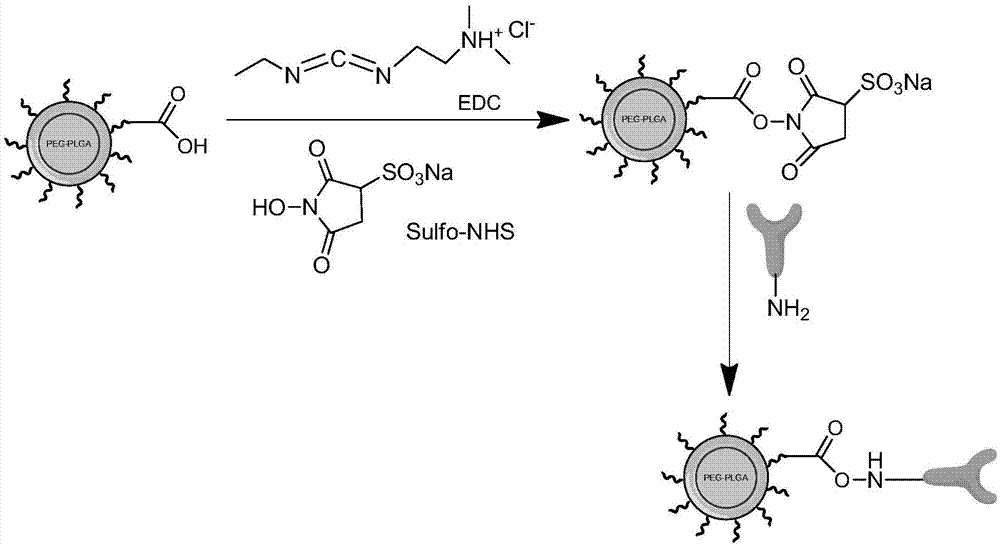
一种特异性核酸适配体键合的peg-plga纳米粒的制备方法,先将纳米粒上的羧基与交联剂edc/nhs反应后形成活化的羧基,再与核酸适配体上的氨基反应形成酰胺键,则能使核酸适配体成功键合在纳米粒上。
上述方法中,采用的活化体系为edc和nhs,所用的溶剂为ph=5-6之间的mes,反应时间为8-14h。
上述方法中,所述纳米粒与核酸适配体的反应摩尔比为1:1.2~1:1.5,而使用的交联剂edc与nhs之间的摩尔比2:1~1.5:1。
一种特异性核酸适配体键合的peg-plga纳米粒的制备方法,包括如下步骤:
(1)取0.1g-0.4g的peg-plga溶于4-5ml的二氯甲烷中,溶解后加入100-400μl的10mg/ml的dox溶液,120w-160w超声30s-1分钟后,逐滴加入到15-25ml的0.5%-1.2%胆酸钠溶液中,150w-250w冰浴下超声5-7分钟后,获得粉红色乳液,即载dox的peg-plga纳米粒;
(2)将步骤(1)中的乳液加入到旋转蒸发仪中,除去二氯甲烷,去离子水清洗3遍后,用ph=5.5的mes重悬;
(3)将步骤(2)中的溶液中加入350mm-450mm的edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),常温下磁力搅拌10-15分钟,其中纳米粒表面的羧基与edc发生交联,形成中间产物;
(4)在步骤(3)中加入200mm的sulfo-nhs(n-羟基硫代琥珀酰亚胺),nhs中羟基会与纳米粒上的-cooh偶合形成一个o-异酰基脲结构,该结构为一种活化的中间产物,磁力搅拌下充分反应30-60分钟;
(5)加入10-20μl的β-巯基乙醇灭活未反应的edc与nhs,使用无酶水清洗纳米粒,由于edc、nhs均为水溶性物质,所以很容易被水冲洗除去;
(6)使用无酶水溶解合成的c2np核酸适配体,配置成0.5-1mg/ml的适配体溶液,放入85-95℃的水浴中加热10-15分钟后,迅速取出,放置冰浴水中10-15分钟迅速冷却,致使核酸适配体变性,恢复其本身的特异型结构;
(7)使用ph=7.4的pbs缓冲液重悬5中得到的产物,使反应条件稳定在ph=7.4的环境下,加入1-2ml的步骤(6)所得的核酸适配体,搅拌反应8-12h,其中核酸适配体上的氨基(-nh2)基团将会进攻活化的中间产物部分,形成酰胺交联,而活化的中间物将会被消除;
(8)反应后使用超滤装置过滤掉未反应的核酸适配体,无酶水清洗后,重悬于无酶水,4℃下储存备用,得到特异性核酸适配体键合的peg-plga纳米粒。收集滤液和清洗液,用于间接测量核酸适配体与纳米粒的键合率;
(9)取部分步骤(8)所得的纳米粒离心干燥成粉末,用于检测核磁、红外、x射线电子能谱。检测是否键合成功。
一种将cd30核酸适配体——c2np通过edc/nhs交联剂的作用下,c2np上的氨基成功键合在peg-plga纳米粒的羧基上的特殊方法,其特性在于能使得更多的核酸适配体结合在纳米粒上,不被体液轻易分解,生物相容性好,并且使纳米粒具有主动靶向特性。
本发明中靶向恶性淋巴瘤上的特征物质cd30的核酸适配体c2np的结构为:
c2np5'-actgggcgaaacaagtctattgactatgagc-3'
5’-actgggcgaaacaagtctattgactatgag
c-nh2-3’;在3’端修饰上氨基之后,并不会对核酸适配体的结构产生影响,但是却可以将核酸适配体通过共价结合与其他物质结合发挥其特性。
一种表面具有羧基peg-plga纳米粒,纳米粒具有与核酸适配体相结合的必备条件。
本发明中需要设计正交试验,将edc/nhs的摩尔比、纳米粒与核酸适配体的摩尔比、溶剂条件、edc与核酸适配体的摩尔比等因素作为反应条件的最优化。可通过将目标产物干燥后,经过核磁、红外、x射线电子能谱表征,验证核酸适配体成功键合在peg-plga纳米粒上,并且计算出核酸适配体与纳米粒的键合率。
与现有技术相比,本发明的优势在于:
这是一种特殊的方法使得特异型核酸适配体与纳米粒上的-nh2能充分结合在一起,结合效率高并且结合之后效果稳定,并且在将核酸适配体活化的过程中,不会将其灭活失去效应。
附图说明
图1核酸适配体与纳米粒反应过程流程图;
图2不同纳米粒与细胞结合率的示意图;
图3核酸适配体-纳米粒复合物与细胞结合图。
具体实施方式
下面结合具体实施例对本发明作进一步地具体详细描述,但本发明的实施方式不限于此,对于未特别注明的工艺参数,可参照常规技术进行。
实施例1
一、合成具有主动靶向性的peg-plga纳米粒分子
(1)0.2g的peg-plga溶于4ml的二氯甲烷中,溶解后加入400μl的10mg/ml的dox溶液(多柔比星溶液),150w超声1分钟后,逐滴加入到20ml的1%胆酸钠溶液中,200w冰浴下超声5分钟后,获得粉红色乳液,即载dox的peg-plga纳米粒。
(2)将步骤(1)中的乳液加入到旋转蒸发仪中,除去二氯甲烷。去离子水清洗3遍后,用ph=5.5的mes重悬。
(3)将步骤(2)中的溶液中加入过量的400mm的edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),常温下磁力搅拌10分钟,其中纳米粒表面的羧基与edc发生交联,形成中间产物。
(4)在步骤(3)中加入200mm的sulfo-nhs(n-羟基硫代琥珀酰亚胺),nhs中羟基会与纳米粒上的-cooh偶合形成一个o-异酰基脲结构,该结构为一种活化的中间产物,磁力搅拌下充分反应30分钟。
(5)加入10μl的β-巯基乙醇灭活未反应的edc与nhs,防止edc与nhs自身反应,影响后续实验。使用无酶水清洗纳米粒三遍,由于edc、nhs均为水溶性物质,所以很容易被水冲洗除去。
(6)使用无酶水溶解合成的c2np核酸适配体,配置成0.5mg/ml的适配体溶液,放入85℃的水浴中加热10分钟后,迅速取出,放置冰浴水中10分钟迅速冷却。致使核酸适配体变性,恢复其本身的特异型结构。
(7)使用ph=7.4的pbs缓冲液重悬步骤(5)中得到的产物,使反应条件稳定在ph=7.4的环境下,加入1ml的步骤(6)所得的核酸适配体,搅拌反应12h,其中核酸适配体上的氨基(-nh2)基团将会进攻活化的中间产物部分,形成酰胺交联,而活化的中间物将会被消除。
(8)反应后使用超滤装置过滤掉未反应的核酸适配体,无酶水清洗3遍后,重悬于无酶水,4℃下储存备用。收集滤液和清洗液,可用于间接测量核酸适配体与纳米粒的键合率。
(9)取部分步骤(8)所得的纳米粒离心干燥成粉末,用于检测核磁、红外、x射线电子能谱。检测是否键合成功。
实施例2
(1)0.2g的peg-plga溶于4ml的二氯甲烷中,溶解后加入400μl的10mg/ml的dox溶液(多柔比星溶液),150w超声1分钟后,逐滴加入到20ml的1%胆酸钠溶液中,200w冰浴下超声5分钟后,获得粉红色乳液,即载dox(多柔比星)的peg-plga纳米粒。
(2)将步骤(1)中的乳液加入到旋转蒸发仪中,除去二氯甲烷。去离子水清洗3遍后,用ph=7.4的pbs重悬。
(3)将步骤(2)中的溶液中加入过量的400mm的edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),常温下磁力搅拌10分钟,其中纳米粒表面的羧基与edc发生交联,形成中间产物。
(4)在步骤(3)中加入200mm的sulfo-nhs(n-羟基硫代琥珀酰亚胺),nhs中羟基会与纳米粒上的-cooh偶合形成一个o-异酰基脲结构,该结构为一种活化的中间产物,磁力搅拌下充分反应30分钟。
(5)加入10μl的β-巯基乙醇灭活未反应的edc与nhs,防止edc与nhs自身反应,影响后续实验。使用无酶水清洗纳米粒三遍,由于edc、nhs均为水溶性物质,所以很容易被水冲洗除去。
(6)使用无酶水溶解合成的c2np核酸适配体,配置成0.5mg/ml的适配体溶液,放入85℃的水浴中加热10分钟后,迅速取出,放置冰浴水中10分钟迅速冷却。致使核酸适配体变性,恢复其本身的特异型结构。
(7)使用ph=7.4的pbs缓冲液重悬步骤(5)中得到的产物,使反应条件稳定在ph=7.4的环境下,加入1ml的步骤(6)所得的核酸适配体,搅拌反应12h,其中核酸适配体上的氨基(-nh2)基团将会进攻活化的中间产物部分,形成酰胺交联,而活化的中间物将会被消除。
(8)反应后使用超滤装置过滤掉未反应的核酸适配体,无酶水清洗3遍后,重悬于无酶水,4℃下储存备用。收集滤液和清洗液,可用于间接测量核酸适配体与纳米粒的键合率。
(9)取部分步骤(8)所得的纳米粒离心干燥成粉末,用于检测核磁、红外、x射线电子能谱。检测是否键合成功。
实施例3
(1)0.2g的peg-plga溶于4ml的二氯甲烷中,溶解后加入400μl的10mg/ml的dox溶液(多柔比星溶液),150w超声1分钟后,逐滴加入到20ml的1%胆酸钠溶液中,200w冰浴下超声5分钟后,获得粉红色乳液,即载dox(多柔比星)的peg-plga纳米粒。
(2)将步骤(1)中的乳液加入到旋转蒸发仪中,除去二氯甲烷。去离子水清洗3遍后,用无酶水重悬。
(3)将步骤(2)中的溶液中加入过量的400mm的edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),常温下磁力搅拌10分钟,其中纳米粒表面的羧基与edc发生交联,形成中间产物。
(4)在步骤(3)中加入200mm的sulfo-nhs(n-羟基硫代琥珀酰亚胺),nhs中羟基会与纳米粒上的-cooh偶合形成一个o-异酰基脲结构,该结构为一种活化的中间产物,磁力搅拌下充分反应30分钟。
(5)加入10μl的β-巯基乙醇灭活未反应的edc与nhs,防止edc与nhs自身反应,影响后续实验。使用无酶水清洗纳米粒三遍,由于edc、nhs均为水溶性物质,所以很容易被水冲洗除去。
(6)使用无酶水溶解合成的c2np核酸适配体,配置成0.5mg/ml的适配体溶液,放入85℃的水浴中加热10分钟后,迅速取出,放置冰浴水中10分钟迅速冷却。致使核酸适配体变性,恢复其本身的特异型结构。
(7)使用ph=7.4的pbs缓冲液重悬步骤(5)中得到的产物,使反应条件稳定在ph=7.4的环境下,加入1ml的步骤(6)所得的核酸适配体,搅拌反应12h,其中核酸适配体上的氨基(-nh2)基团将会进攻活化的中间产物部分,形成酰胺交联,而活化的中间物将会被消除。
(8)反应后使用超滤装置过滤掉未反应的核酸适配体,无酶水清洗3遍后,重悬于无酶水,4℃下储存备用。收集滤液和清洗液,可用于间接测量核酸适配体与纳米粒的键合率。
(9)取部分步骤(8)所得的纳米粒离心干燥成粉末,用于检测核磁、红外、x射线电子能谱。检测是否键合成功。
实施例4
不同溶液中反应后与细胞的结合率对比
在实施例1、例2、例3中分别使用不同ph的溶液重悬纳米粒,分别为ph=5.5的mse溶液、ph=7.4的pbs溶液、无酶水。取得不同形式的载核酸适配体的纳米粒后,与细胞培育30分钟后,收集细胞做流式检测细胞与纳米粒的结合率。不同形式的纳米粒与细胞的结合效率如下图(图2)所示。由图2可知,实例1中使用ph=5.5的mes溶液与细胞的结合率最高,说明本方法效果最佳。
实施例5
纳米粒的表征检测
根据实施例4中,在ph=5.5的mes溶液中纳米粒与特异型核酸适配体反应后,与细胞结合效率最佳。图3中是实施例1中载核酸适配体纳米粒与细胞的结合效果图,能明显发现结合效率良好。
采用实施例1中的纳米粒粉末,使用xps(x射线光电子能谱)检测纳米粒的表面元素,根据表面元素检测特异型核酸适配体能否成功与纳米粒相结合。如表1所示,在载核酸适配体纳米粒(apt-dox-np)中检测到了属于核酸适配体中独有的氮元素(n)与磷元素(p),说明核酸适配体成功与纳米粒键合。
表1xps结果分析dox-np与apt-dox-np
本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
序列表
<110>华南理工大学
<120>一种特异性核酸适配体键合的peg-plga纳米粒及其制备方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>31
<212>prt
<213>cd30核酸适配体(cd30aptamer)
<400>1
alacysthrglyglyglycysglyalaalaalacysalaalaglythr
151015
cysthralathrthrglyalacysthralathrglyalaglycys
202530
- 还没有人留言评论。精彩留言会获得点赞!