一种角质类中药有效部位及其制备方法与应用与流程
本发明涉及中药提取
技术领域:
,尤其涉及角质类动物药有效部位及其制备方法与应用。
背景技术:
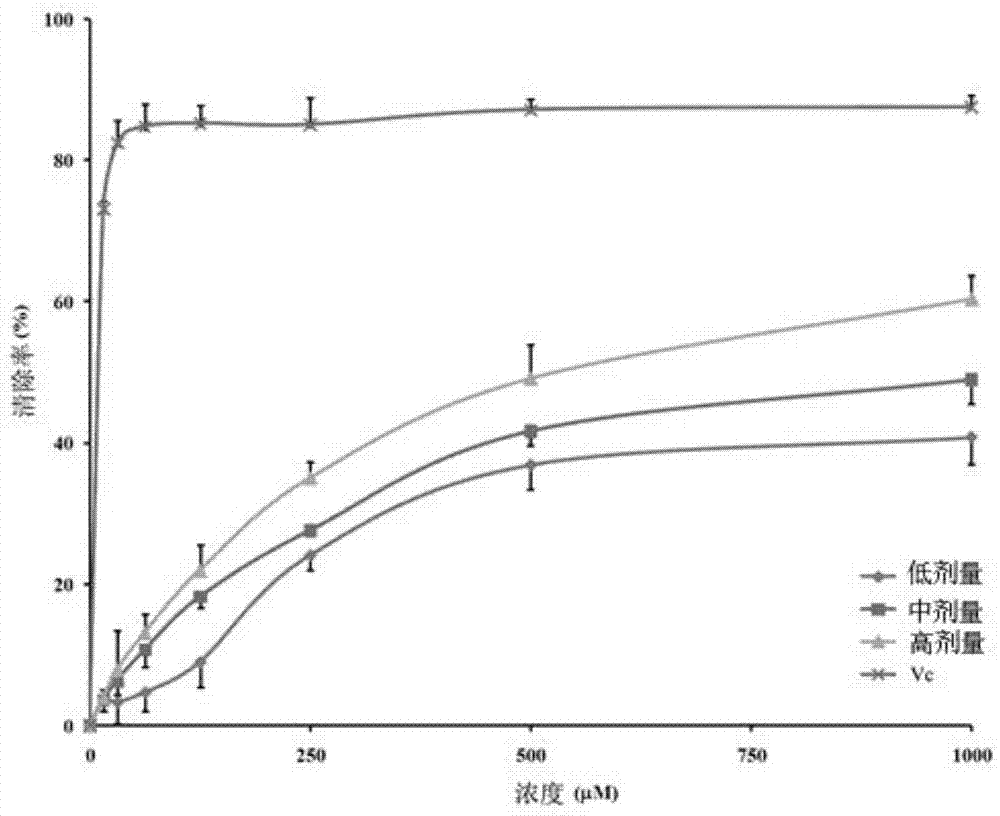
角类动物药,如犀角、羚羊角、水牛角、山羊角等,在中医临床具有重要作用,其功效确切,作用特点突出,一直广泛用于临床与制药行业,由于犀角被禁用,羚羊角资源紧缺,临床常以水牛角、山羊角分别替代犀角、羚羊角,并取得较好效果。如犀角地黄汤目前均以水牛角替代犀角入药,疗效确切;根据传统民间儿科验方“羚羊清肺散”开发的现代中药“金振口服液”,具有清热解毒、祛痰止咳的功效,工业生产均以山羊角替代羚羊角制备金振口服液,解热与抗炎的功效与羚羊角制备的金振口服液相当。随着现代分析化学、药理药效学、分子生物学等学科的技术手段更新发展,多学科交叉带来了角类动物药发展的新时机,角类动物药物质基础研究,生物效应研究等方面取得了一系列进展,角类动物药中主要含有蛋白质类、肽类、核苷类等成分。蛋白质、肽类成分的复杂性与多样性,基于蛋白质组、多肽组学的思路与方法,对水牛角、山羊角中的蛋白质类成分,及其提取液中混合多肽类成分进行了分析鉴定,初步分析表明,水牛角、山羊角中含有丰富的角蛋白类成分,其提取液中所含的多肽类物质,可能从一些角蛋白的特定片段中经“溶出”、“释放”至提取液中,这些经非特异性降解的角质肽段与其解热、抗炎、抗氧化应激等生物效应密切相关。角类动物药中主要成分为角蛋白,而角蛋白的空间结构及理化性质与其分子中大量的二硫键(-s-s-)有关,然而,这些含丰富-s-s-的蛋白质在一定条件下会发生降解及-s-s-断裂,形成含有暴露的-sh基团的多肽类物质,而肽类成分因分子量小、亲水性好等特点,易于在机体内转运。-sh是一种活泼基团,与多种生物效应相关,近年来,-sh及活性硫簇受到广泛关注,如hs·,h2sn,h2s等与多种生物效应与疾病相关。在惊厥动物模型中,血浆-sh的含量显著降低,而-s-s-的含量显著升高,-sh与-s-s-的比例(-sh/-s-s-)与病理模型密切相关。有研究发现,正常机体血浆中-sh/-s-s-水平维持在相对稳定的水平,病理状态下机体的-sh/-s-s-水平会发生不同程度的上调或下调。另有研究表明,大鼠口服山羊角提取物后,其血浆中-sh的含量显著提高。不仅是角类动物药,角质类中药,如蹄甲类、鳞片类中药均含有丰富的角蛋白,其提取物或降解物中,丰富的含-sh肽段可能为重要的物质基础。本专利通过大量实验筛选出富集与纯化角质类中药中含-sh多肽类成分的方法,可提高角类动物药的生物效应,并促进珍稀角类动物药替代资源寻找与评价。技术实现要素:发明目的:本发明的目的是通过大量实验筛选出富集与纯化角质类中药中含-sh多肽类成分的方法,从角质类中药中提取、富集、纯化含-sh多肽类成分,获得角质类中药效应部位。本发明制备得到的角质类中药效应部位具有很好的解热、抗炎、抗氧化、抗惊厥等功效。技术方案:为了实现以上目的,本发明采取的技术方案为:一种角质类中药有效部位,它是通过以下方法制备得到的:(1)将角质类中药加水或者乙醇提取,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)角质类提取物,通过巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂分离,将角质类提取物上样后,先用1~5倍柱体积的缓冲液洗脱除杂,再用5~10倍柱体积的25mm碳酸氢铵溶液洗脱,25mm碳酸氢铵溶液中含有10~40mm的二硫苏糖醇,收集洗脱液;(3)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位;步骤(2)中的缓冲液为ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液,其中含有2m~8m尿素或者为1mmedta缓冲液,其中含有2m~8m尿素。所述的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂柱的径高比为1:3~1:20,角质类中药提取物的上样量为800μmol/ml。一种角质类中药有效部位的制备方法,包括以下步骤:(1)将角质类中药加水或者乙醇提取,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)角质类提取物,通过巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂分离,将角质类提取物上样后,先用1~5倍柱体积的缓冲液洗脱除杂,再用5~10倍柱体积的25mm碳酸氢铵溶液洗脱,25mm碳酸氢铵溶液中含有10~40mm的二硫苏糖醇,收集洗脱液;(3)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位;步骤(2)中的缓冲液为ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液,其中含有2m~8m尿素或者为1mmedta缓冲液,其中含有2m~8m尿素。所述的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂柱的径高比为1:3~1:20,角质类中药提取物的上样量为800μmol/ml。作为优选方案,以上所述的角质类中药有效部位的制备方法,步骤(1)将角质类中药加水或者乙醇提取,固液比为1:2~1:30,采用回流提取、浸渍提取2~15小时。一种角质类中药有效部位,它是通过以下方法制备得到的:(1)将角质类中药浸泡于ph3.0~9.0的缓冲液中,采用生物酶进行酶解,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)角质类提取物,通过巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂分离,将角质类提取物上样后,先用1~5倍柱体积的缓冲液洗脱除杂,再用5~10倍柱体积的25mm碳酸氢铵溶液洗脱,25mm碳酸氢铵溶液中含有10~40mm的二硫苏糖醇,收集洗脱液;(3)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位;步骤(2)中的缓冲液为ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液,其中含有2m~8m尿素或者为1mmedta缓冲液,其中含有2m~8m尿素。所述的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂柱的径高比为1:3~1:20,角质类中药提取物的上样量为800μmol/ml。一种角质类中药有效部位的制备方法,包括以下步骤:(1)将角质类中药浸泡于ph3.0~9.0的缓冲液中,采用生物酶进行酶解,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)角质类提取物,通过巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂分离,将角质类提取物上样后,先用1~5倍柱体积的缓冲液洗脱除杂,再用5~10倍柱体积的25mm碳酸氢铵溶液洗脱,25mm碳酸氢铵溶液中含有10~40mm的二硫苏糖醇,收集洗脱液;(3)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位;步骤(2)中的缓冲液为ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液,其中含有2m~8m尿素或者含有2m~8m尿素的1mmedta缓冲液。所述的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂柱的径高比为1:3~1:20,角质类中药提取物的上样量为800μmol/ml。作为优选方案,以上所述的角质类中药有效部位的制备方法,步骤(1)将角质类中药镑片、颗粒或粉末浸泡于ph3.0~9.0的缓冲液(pbs或或tris缓冲液)中,采用胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、酸性蛋白酶或风味蛋白酶进行酶解。本发明所述的角质类中药有效部位的制备方法,步骤(1)酶解的具体条件如下表1:表1酶解的具体条件酶的种类酶解ph酶解温度(℃)胃蛋白酶1.8-2.030-65胰蛋白酶7.0-9.055凝乳酶3.2-4.535-45木瓜蛋白酶5-755-60碱性蛋白酶10-1140-50中性蛋白酶7.0-7.545-55酸性蛋白酶2.5-4.040链霉蛋白酶7-935-60一种角质类中药有效部位,它是通过以下方法制备得到的:(1)将角质类中药加水或者乙醇提取,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)角质类中药提取物采用生物酶进行酶解,过滤除去药渣后,浓缩得到酶解角质类中药提取物;(3)取步骤(2)酶解角质类中药提取物,通过巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂分离,将角质类提取物上样后,先用1~5倍柱体积的缓冲液洗脱除杂,再用5~10倍柱体积的25mm碳酸氢铵溶液,其中含有10~40mm的二硫苏糖醇洗脱,收集洗脱液;(4)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位;步骤(2)中的缓冲液为ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液,其中含有2m~8m尿素或者含有2m~8m尿素的1mmedta缓冲液。所述的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂柱的径高比为1:3~1:20,角质类中药提取物的上样量为800μmol/ml。一种角质类中药有效部位的制备方法,包括以下步骤:(1)将角质类中药加水或者乙醇提取,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)角质类中药提取物采用生物酶进行酶解,过滤除去药渣后,浓缩得到酶解角质类中药提取物;(3)取步骤(2)酶解角质类中药提取物,通过巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂分离,将角质类提取物上样后,先用1~5倍柱体积的缓冲液洗脱除杂,再用5~10倍柱体积的25mm碳酸氢铵溶液,其中含有10~40mm的二硫苏糖醇洗脱,收集洗脱液;(4)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位;步骤(2)中的缓冲液为ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液,其中含有2m~8m尿素或者含有2m~8m尿素的1mmedta缓冲液。巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂柱的径高比为1:3~1:20,角质类中药提取物的上样量为800μmol/ml。本发明所述的角质类中药包括水牛角、山羊角、牦牛角、牛蹄甲、猪蹄甲、羊蹄甲、穿山甲鳞片等。工艺筛选实验:1、上样量考察取预处理好的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂0.5ml,装入1ml的移液器吸嘴中,缓慢滴入山羊角提取物(-sh含量为50mmol/l),吸嘴下端用1ml的ep管收集样品,每1ml收集1管,采用ellman法测定样品中-sh的含量。结果见表2,在上样量到9ml后,树脂开始泄漏,11ml时达到吸附饱和,可确定树脂的上样量约为400μmol/0.5ml,即800μmol/ml。表2-sh的漏出曲线考察2、洗脱液种类的考察取预处理好的巯丙基琼糖凝胶6b或活化巯基琼脂糖凝胶4b树脂0.5ml,装入1ml的移液器吸嘴中,缓慢滴入水牛角提取物5ml(-sh含量为50mmol/l),用5ml的25mm羟乙基哌嗪乙硫磺酸缓冲液(其中含有2m尿素)洗脱除杂,分别用含有20mm二硫苏糖醇(dtt)的25mm碳酸氢铵(nh4hco3)缓冲液与含有40mmβ-巯基乙醇(β-me)的25mm碳酸氢铵(nh4hco3)缓冲液进行洗脱,吸嘴下端用1ml的ep管收集样品,每1ml收集1管,采用ellman法测定样品中-sh的含量。结果见表3,在5倍柱体积后,dtt洗脱液可开始洗脱含-sh的多肽,且洗脱曲线呈较好的峰形,约10个柱体积后,样品基本被洗脱完全;而β-me洗脱液在约9倍柱体积开始洗脱含-sh的多肽,洗脱峰形不佳,且20倍柱体积后仍有含-sh的多肽在树脂上未被洗脱。因此,确定洗脱剂为含有dtt的碳酸氢铵缓冲液,洗脱体积约为5~10个柱体积。表3不同洗脱液比较本发明所述的角质类中药有效部位在制备抗氧化制剂中的应用。本发明所述的角质类中药有效部位在角质类中药有效部位在制备解热制剂中的应用。本发明所述的角质类中药有效部位在角质类中药有效部位在制备抗炎制剂中的应用。本发明所述的角质类中药有效部位在角质类中药有效部位在制备镇静制剂中的应用。本发明所述的角质类中药有效部位在制备抗惊厥制剂中的应用。有益效果:本发明通过大量实验筛选,采用提取和/或酶解,然后通过hiopropylsepharose6b树脂分离,采用特定的缓冲液洗脱除杂,再用二硫苏糖醇溶液洗脱,可以分离纯化得到高纯度的含-sh多肽类成分。并且经过活性筛选实验结果表明,本发明制备得到的含-sh多肽类成分具有显著的生活活性,包括解热、抗炎、抗氧化、抗惊厥等多种功效,取得了非常好的技术效果!附图说明图1为山羊角有效部位对dpph自由基清除活性的曲线图。图2为山羊角有效部位对氧自由基清除活性的曲线图。具体实施方式下面结合具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。实施例1一种角质类中药提取物的制备方法,包括如下步骤:(1)将山羊角经过镑片、粉碎后得到粉末,加20倍水,煎煮提取3次,每次4小时,合并提取液,浓缩至适当浓度,得山羊角水提取液;(2)取山羊角提取液通过巯丙基琼糖凝胶6b树脂分离,树脂柱径高比为1:10,将角质类提取物上样后,上样量为800μmol/ml,用5倍柱体积ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液(其中含有2m尿素)洗脱除杂,再用10倍柱体积的25mm碳酸氢铵(nh4hco3)溶液(其中含有20mm的二硫苏糖醇)洗脱,收集洗脱液。(3)收集的洗脱液经反相色谱(c8或c18)脱盐后,干燥,得角质类中药有效部位。实施例2一种角质类中药有效部位的制备方法,包括以下步骤:(1)将山羊角浸泡于ph6的pbs缓冲液中,采用胃蛋白酶,在ph值为1.8-2.0,温度为50~60℃下进行酶解,过滤除去药渣后,浓缩得到角质类中药提取物;(2)取步骤(1)酶解的角质类提取物,通过巯丙基琼糖凝胶6b树脂分离,树脂柱径高比为1:10,将角质类提取物上样后,上样量为800μmol/ml,,先用5倍柱体积ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液(其中含有2m尿素),洗脱除杂,再用10倍柱体积的25mm碳酸氢铵溶液(其中含有20mm的二硫苏糖醇)洗脱,收集洗脱液;(3)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位。实施例3一种角质类中药提取物的制备方法,包括如下步骤:(1)将山羊角经过镑片、粉碎后得到粉末,加20倍水,煎煮提取3次,每次4小时,合并提取液,浓缩至适当浓度,得山羊角水提取物;(2)将山羊角提取物,浸泡于ph6的pbs缓冲液中,采用胃蛋白酶,在ph值为1.8-2.0,温度为50~60℃下进行酶解,过滤除去药渣后,浓缩得到角质类中药提取物;(3)取步骤(2)酶解的角质类提取物,通过巯丙基琼糖凝胶6b树脂分离,树脂柱径高比为1:10,将角质类提取物上样后,上样量为800μmol/ml,先用5倍柱体积ph7.4的25mm羟乙基哌嗪乙硫磺酸缓冲液(其中含有2m~8m尿素)洗脱除杂,再用10倍柱体积的25mm碳酸氢铵溶液(其中含有20mm的二硫苏糖醇)洗脱,收集洗脱液;(4)收集的洗脱液经反相色谱脱盐后,干燥,得角质类中药有效部位。实施例4角质类中药的有效部位中含有-sh的多肽类成分的分析与表征基于shotgun技术的混合蛋白质/多肽的鉴定技术,将含有-sh的多肽类部位注入nanolc-ms/ms分析其中多肽类成分,选择双电荷以上的母离子,以collisioninduceddissociation(cid)或electroncapturedissociation(ecd)裂解方式获ms/ms碎片信息,通过搜索蛋白质库进行比对,搜库软件为peaks8.5,搜库方式为trypsin(胰蛋白酶酶切)或非酶切(nonenzyme),将每个ms/ms碎片信息进行比对,鉴定含有-sh的多肽类部位中每个肽类成分的氨基酸序列,分析所有含-sh肽段的分子量分布,计算肽段的亲水性平均系数(grandaverageofhydropathicity,gravy)预测肽段的亲疏水性。1、比色法测定角质类中药的有效部位中-sh的含量1.1实验方法考察1.1.1线性:精密吸取硼氢化钠溶液15μl与浓度分别为50、25、12.5、6.25与3.125mmol/l的l-半胱氨酸对照品溶液至96孔细胞培养板中,振摇混合均匀后,依次加入165μl的edta溶液和15μl的5,5'-二硫代双-2-硝基苯甲酸(dtnb)溶液,于412nm处测定吸光度,以-sh的摩尔浓度(1mol的l-半胱氨酸中含有1mol的-sh)为横坐标,吸光度为纵坐标,绘制标准曲线,每个浓度平行测定3次。1.1.2精密度:分别精密吸取浓度为50、12.5与6.25mmol/l的l-半胱氨酸对照品溶液15μl,按照“线性”项下操作测定吸光度,每个浓度平行测定6次,计算吸光度的rsd值。1.1.3重复性:精密吸取实施例3角质类中药的有效部位加水稀释样品15μl,按照“线性”项下操作测定吸光度,平行测定6次,计算吸光度的rsd值。1.1.4稳定性:精密吸取实施例3角质类中药的有效部位加水稀释样品15μl,分别于配制后的0、0.5、1、1.5、2、2.5、3小时取样,按照“线性”项下操作测定每次取样样品的吸光度,计算rsd值。1.1.5加样回收率:精密称取适量已知-sh浓度的角质类中药样品粉末,加入等摩尔量的l-半胱氨酸样品,平行6份,测定样品吸光度,计算回收率及其rsd值。1.2供试品中游离-sh的测定精密吸取氯化钠溶液15μl与实施例3角质类中药的有效部位制成的供试品15μl至96孔细胞培养板中,振摇混合均匀后,依次加入165μl的edta溶液和15μl的dtnb溶液,于412nm处测定吸光度,以吸光度计算供试品中-sh的摩尔浓度。1.3供试品中总-sh的测定精密吸取硼氢化钠溶液15μl与实施例3角质类中药的有效部位制成的供试品15μl至96孔细胞培养板中,振摇混合均匀后,依次加入165μl的edta溶液和15μl的dtnb溶液,于412nm处测定吸光度,以吸光度计算供试品中-sh的摩尔浓度。2、实验结果:2.1富含-sh的多肽类成分的角质类中药有效部位的含量测定以山羊角富含-sh多肽的有效部位为例:线性范围:以-sh浓度(mmol/l)为横坐标,吸光度为纵坐标,制备的标准曲线,回归方程为:a=0.0795c-0.2851(r2=0.9991),其中c表示l-半胱氨酸中-sh的浓度,a表示测定的吸光度值,结果表明,-sh的含量与吸光值呈线性关系,线性良好,且线性范围为3.125~50mmol/l。精密度:不同浓度游离-sh测定的精密度分别为0.70%,1.25%与1.36%,不同浓度总-sh测定的精密度为1.44%,1.01%与1.74%,测定方法的精密度良好。重复性:山羊角有效部位样品中-sh测定重复性的rsd值为1.26%,测定方法重复性良好。稳定性:山羊角有效部位样品中-sh测定稳定性的rsd值为1.11%,表明处理后的样品在3小时内稳定。准确性:山羊角中-sh测定的平均回收率为96.29%,rsd值为1.79%,表明该测定方法准确性好。并且测定结果表明,山羊角有效部位中-sh的含量(以半胱氨酸计)为40mmol/g固含,相较于单纯山羊角水提取物的2.1mmol/g固含的含量,-sh的含量显著提高了约20倍,表明本发明对于富集-sh类多肽取得了非常好的技术效果。实施例5角质类中药的有效部位的活性评价1、解热活性评价大鼠解热实验(酵母法):sd大鼠,雄性,体重180-220g,编号,称重。测肛温2次,选用体温范围36-38.5℃,且体温波动小于0.5℃者用于实验,随机分组,设空白组、给药组(实施例3角质类中药的有效部位低剂量为5mm-sh/kg,中剂量为10mm-sh/kg,高剂量为20mm-sh/kg)和阳性药组(阿司匹林80mg/kg),每组8只。造模前测体温作为“基础体温”。给药量为5ml/kg。各组大鼠均背部皮下注射20%酵母-ns溶液10ml/kg,造发热模型。造模后6h,每组大鼠均分别灌胃给予实施例3角质类中药的有效部位,于给药后0h、0.5h、1h、1.5h、2h、3h复测大鼠肛温。分别以各时间点的体温绝对值和体温变化值作组间比较,实验结果数据以平均值±标准偏差表示。实验结果见表1,表2,山羊角有效部位中剂量与高剂量组对大鼠原始体温和体温增减值给药后1h、1.5h、2h与模型组比较有显著性差异(p<0.01,p<0.05),表明山羊角有效部位具有良好的解热作用。表1山羊角有效部位对发热大鼠体温的影响(mean±sdn=8)与同时刻模型组比较*p<0.05**p<0.01表2山羊角有效部位对发热大鼠体温增减值的影响(mean±sdn=8)与同时刻模型组比较*p<0.05**p<0.012、抗炎活性评价二甲苯所致小鼠耳廓肿胀实验:取icr雄性小鼠,体重20±2g,随即分组,每组10只小鼠。分组情况见下表3,阳性对照药为阿司匹林(180mg/kg),给药各组按剂量灌胃给予实施例3角质类中药的有效部位(低剂量为5mm-sh/kg,中剂量为10mm-sh/kg,高剂量为20mm-sh/kg),模型组给予生理盐水。连续给药7天,每日1次,末次给药1小时后于小鼠右耳涂抹二甲苯30μl,左耳不做任何处理。1小时后处死小鼠,沿耳廓基线剪下两耳,用0.8cm打孔器在同一部位打成圆耳片,电子天平即时称重,以左、右耳片重量之差作肿胀度计算。肿胀度抑制率=(给药组肿胀度-模型组肿胀度)/模型组肿胀度×100%。小鼠棉球肉芽肿炎症模型:取icr雄性小鼠,体重20±2g,随机分组,每组10只小鼠。分组情况见下表4,阳性对照药为阿司匹林(180mg/kg),每只小鼠胸部剪一小口,用镊子将10mg高温灭菌棉球(青霉素浸泡、烘干),从切口处植入左侧腋下。自手术当日起,各给药组按剂量灌胃给予实施例3角质类中药的有效部位,模型组给予生理盐水,连续给药7天,末次给药24小时后处死,打开切口,将棉球连同周围结缔组织一同取出,剔除脂肪组织,在恒温70℃烘箱内干燥12小时后,应用分析天平称重,将称得的重量减去棉球的重量。即得肉芽肿重量。验结果见表3与表4,结果表明山羊角有效部位能够抑制二甲苯所致小鼠耳廓肿胀,与模型组比较有显著性差异(p<0.01,p<0.05)。山羊角有效部位能抑制小鼠棉球肉芽肿的形成,与模型组比较有显著性差异(p<0.01,p<0.05)。表3山羊角有效部位对二甲苯所致小鼠耳廓肿胀的影响(mean±sdn=10)同模型组比较*p<0.05**p<0.01表4山羊角有效部位对小鼠棉球肉芽肿的影响(mean±sdn=10)组别肉芽肿重量(mg)抑制率(%)模型组17.8±1.6-阿司匹林组8.2±1.5*53.9低剂量组11.9±1.2*33.1高剂量组9.0±0.9*49.0同模型组比较*p<0.053、抗氧化活性评价d-氨基半乳糖造成小鼠衰老模型:取icr雄性小鼠,体重20±2g,随机分组,每组10只。除正常对照组外,小鼠颈背部皮下注射d-半乳糖(用生理盐水配制)用量按每次200mg/kg体重计。正常对照组10只同样部位注射等剂量生理盐水,每天1次,连续6周。从第2周开始,按剂量灌胃给予实施例3角质类中药的有效部位(低剂量为5mm-sh/kg,中剂量为10mm-sh/kg,高剂量为20mm-sh/kg),阳性组每天以200mg/kg剂量灌抗坏血酸,模型组和正常对照组分别灌等体积的生理盐水。末次给药后24h,取血及肝脏。常规方法分离血清,肝脏在无菌条件下制备成10%的肝组织匀浆,离心后取上清液备用,严格按照试剂盒方法测定血清及肝组织中的sod、mda、gsh-px、cat等指标。对dpph自由基的清除作用:将不同质量浓度的样品各1ml分别加入到干净的10ml具塞试管中,每管中再加入0.6mmol/ldpph甲醇溶液0.5ml,然后以甲醇补充体积至5ml,30min室温避光反应后于515nm处测定吸光值。对超氧自由基的清除作用:采用邻苯三酚自氧化法进行测定。量取50mmol/l,ph8.20tris-hcl缓冲液4.7ml,加入0.1ml样品,置于25℃水浴保温20分钟,然后加入25℃预温的3mmol/l的邻苯三酚溶液(用10mmol/lhcl配制)0.2ml,迅速摇匀后倒入比色皿中,在319nm下每隔1分钟测定吸光值一次,共反应9分钟,用10mmol/lhcl溶液为空白调零,对照组以等体积去离子水代替样品。作吸光度随时间变化曲线的回归方程,其斜率为邻苯三酚的自氧化速率v。实验结果:衰老模型组小鼠皮下连续注射d-半乳糖4周后逐渐出现毛色暗淡,松散无光泽,形体瘦弱,行动缓慢,自发性活动减少,精神萎靡不振,反应不灵敏等衰老征象,且随给药时延长,表现愈加明显。山羊角有效部位各剂量组小鼠体征状况介于模型组和正常对照组之间,但随着剂量增高,小鼠毛色、光泽、反应灵敏度等情况逐渐得以改善。模型组与正常对照组比较,sod、gsh-px、cat活力均显著降低(p<0.05),mda水平显著升高(p<0.05);各给药组与模型组比较不论高低剂量组的gsh-px活力都有显著性变化(p<0.05);sod、cat活性有不同程度的降低;mda水平也有升高;与空白组相比山羊角有效部位高剂量组对小鼠肝组织sod、gsh-px、mda及cat的质量浓度均有显著性的影响(p<0.05),显著对抗由d-半乳糖导致肝组织sod降低,使sod升高,增加gsh-px、cat的活性,降低mda的含量,结果见表5与表6。表5山羊角有效部位对衰老小鼠肝组织各指标的影响(mean±sdn=10)与正常对照组比较,#p<0.05;##p<0.01,与模型组相比:*p<0.05;**p<0.01。表6山羊角有效部位对衰老小鼠血清各指标的影响(mean±sdn=10)组别mdasodgsh-px(nmol/ml)(u/ml)(u/ml)正常7.39±1.0392.94±13.34162.35±38.72模型9.44±1.01##73.41±16.93#91.07±27.99##阳性7.10±1.54**116.96±13.57**212.45±53.88**高剂量8.79±1.05*102.11±9.35*150.90±43.61**低剂量8.81±1.04*89.83±10.31101.74±34.82*中剂量7.75±1.25**123.81±15.34**169.94±34.30**与正常对照组比较,#p<0.05;##p<0.01,与模型组相比:*p<0.05;**p<0.01。4、抗惊厥活性评价戊四氮致小鼠惊厥实验:取icr小鼠,体重20±2g,随机分组,每组20只,♀♂各半,分别为空白对照组、舒乐安定(阳性药)对照组及实施例3角质类中药的有效部位(低剂量为5mm-sh/kg,中剂量为10mm-sh/kg,高剂量为20mm-sh/kg)。小鼠预先给药2天,给药剂量同前。第3天给药后1h,腹腔注射腹戊四氮0.09g/kg。记录小鼠从注射戊四氮到发生惊厥的时间(潜伏期),统计5h后每组小鼠的死亡数。比较给药组与对照组的潜伏期及死亡率。实验结果:由图1与图2可知,本发明制备得到的山羊角有效部位具有较强的清除dpph自由基与氧自由基的能力,且随质量浓度增加而增强。按照同样的方法,本发明检测了实施例1和实施例2制备得到的山羊角有效部位在解热、抗炎、抗氧化、抗惊厥等方面活性,实验结果表明,也具有良好的解热、抗炎、抗氧化、抗惊厥等方面功效,但是以实施例3制备的得到的山羊角有效部位最佳。应当指出的是,以上具体实施方式只是本发明比较有代表性的例子,显然本发明的技术方案不限于上述实施例。本领域的普通技术人员,根据此文件中所公开提到或是联想到的,均应认为是本专利所要保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1