杀线虫性真菌与驱虫药联合制剂的制作方法
本发明属于动物生物技术领域,具体涉及一种用于牲畜的寄生虫感染防控制剂。
背景技术:
目前生物防控在我国兽医寄生性线虫病防治领域,发展的还比较缓慢,尤其是对其临床应用的研究还比较少。线虫是动物体内最常见、种类最多、危害最大的一类寄生虫,它的反复感染是人们在动物寄生虫防控中最难解决的一个问题,因为一般来说驱虫药只能驱除家畜体内的成虫,而对成虫被杀死后子宫崩解所排出的虫卵基本是无济于事的,其随着家畜驱虫后的放牧,粪便到处污染草场,其中的虫卵可以继续发育为幼虫来持续感染动物。
杀线虫性真菌是一种自然界广泛存在的真菌,能够将其营养菌丝特化为捕食器,来捕获杀死线虫幼虫。该类真菌对于植物性寄生线虫和动物性寄生线虫都具有很好的捕杀能力。在动物寄生性线虫防治方面,利用真菌进行生物控制的起步较晚。最早利用杀线虫性真菌做临床试验,是将其直接喷洒于草场,虽然取得一定的效果,但是不切合实际,无法应用到生产实践中。后来,丹麦等国科学家研究将真菌与饲料或饮水混合饲喂试验动物,真菌厚垣孢子通过消化道随粪便一同排出,在粪便中萌发,捕食其中由线虫虫卵发育而来的感染性幼虫,以减轻对草场的污染。该方法可以有效的降低牧场中线虫幼虫种群的数量,降低动物再感染的机率,但需要时间较长,不适于在我们这样的发展中国家推广应用。
经试验证实众多杀线虫性真菌中仅有几个种类能够安全通过动物消化道而不被灭活。1997年,fernand等证实杀线虫性真菌dudingtoniaflagrans能够通过消化道的原因是其可以产生抵抗能力较强的厚垣孢子。此后,世界各国的科学家开始关注这种杀线虫性真菌并进行了大量的研究工作,为杀线虫性真菌在生物防治领域的应用做出了巨大的贡献。
在我国,内蒙古农业大学杨晓野教授团队多年来致力于研究杀线虫性真菌防控家畜寄生虫病的研究,对杀线虫性真菌的临床应用做了大量的研究工作,为实施安全可靠的生物防控寄生性线虫病技术的开发和应用做出了努力。本团队的研究发现,dudingtoniaflagrans与驱虫药联合应用已经被证实是是杀线虫性真菌最有效的临床应用方法,可以实现既杀灭家畜体内线虫成虫,又减少驱虫后动物排出粪便中的虫卵再孵化为幼虫持续感染家畜的情况;但是在临床实施时,要分别喂食驱虫药和真菌悬液两种制剂,增加了人工和时间成本,给畜牧业生产带来诸多不便。另外,d.flagrans厚垣孢子悬液保存和运输中,容易造成真菌孢子的萌发,影响它的使用效果。
技术实现要素:
针对本领域存在的问题,本发明的目的是提出一种杀线虫性真菌与驱虫药的联合制剂。
本发明的目的之一是提出一种方便于农牧民使用,既可以治疗、又可以预防,防控效果好的杀线虫性真菌与驱虫药的联合制剂。
本发明的第二个目的是提出所述联合制剂的应用。
实现本发明目的的技术方案为:
一种杀线虫性真菌与驱虫药联合制剂,所述联合制剂的有效成分为杀线虫性真菌(duddingtoniaflagrans)的厚垣孢子和驱虫药,其中驱虫药为伊维菌素或阿苯达唑,所述联合制剂的剂型为片剂或者胶囊剂。
进一步地,所述联合制剂的杀线虫性真菌(duddingtoniaflagrans)是以冻干厚垣孢子粉的形式提供,每单位剂量联合制剂内的冻干孢子粉的重量为35~55mg。
其中,所述冻干孢子粉是杀线虫性真菌在培养基中培养了15~25天后,经洗脱液洗脱及冻干得到的,优选每克所述冻干孢子粉中含有厚垣孢子(1.0~1.5)×108个。
可选地,所述杀线虫性真菌(duddingtoniaflagrans)厚垣孢子的制备方法为:在无菌条件下,将在玉米粒培养基中培养了三周的杀线虫性真菌d.flagrans厚垣孢子用洗脱液洗脱下来,混匀后等量分装于灭菌的西林瓶中,然后将其放置于真空冷冻干燥机中,待样品呈干燥粉末状后,取出置于-4℃保存备用。
本发明的一种优选技术方案为,所述联合制剂的有效成分为杀线虫性真菌的厚垣孢子和伊维菌素,所述联合制剂的剂型为胶囊剂,优选所述胶囊剂的长度为15~16mm,优选单粒胶囊剂重0.10±0.01g。
本发明的另一种优选技术方案为,所述联合制剂的有效成分为杀线虫性真菌(duddingtoniaflagrans)的厚垣孢子和阿苯达唑,所述联合制剂的剂型为片剂。
其中,所述片剂中含有润滑剂,所述润滑剂为硬脂酸镁。
优选地,所述润滑剂占联合制剂总质量的比例为0.1~0.5%。
其中,所述片剂中含有稀释剂,所述稀释剂为糊精、α-乳糖、蔗糖、糊精-蔗糖-淀粉(质量比1:1:7)混合物中的一种或多种。
优选地,所述稀释剂为α-乳糖,稀释剂与原料的质量比例为1:(1~4)。所述原料为冻干孢子粉和驱虫药。
α-乳糖的主要功能是作为稀释剂(也称为填充剂),具有易压缩成形和吸水性低的特点,主要起赋形的作用,而且其价格也相对低廉,且具有适口性好的矫味功能,易于被动物食用。
本发明的一个进一步优选的技术方案为,所述联合制剂的剂型为胶囊剂,由胶囊壳、杀线虫性真菌的冻干孢子粉和伊维菌素组成,每单位剂量含有:伊维菌素0.8~1.2mg;冻干孢子粉35~45mg。
本发明另一个进一步优选的技术方案为,所述联合制剂的剂型为片剂,由杀线虫性真菌的冻干孢子粉、阿苯达唑、硬脂酸镁、α-乳糖组成,每单位剂量含有:阿苯达唑70~80mg,硬脂酸镁0.4~0.6mg,α-乳糖30~45mg;冻干孢子粉50~60mg。
本发明所述的联合制剂在防治家畜线虫感染中的应用。
本发明的有益效果在于:
在家畜寄生性线虫病控制中,配合应用杀线虫性真菌,对于伊维菌素或阿苯达唑的最终杀虫效果有显著的提高作用。但该真菌冻干制剂在给药的时候,需配成悬浮液灌服动物,不便给药,且配置后需立即使用,不能保存。现有的这种驱虫药与杀线虫性真菌(duddingtoniaflagrans)冻干制剂的联合应用方式是一次施药需要给动物喂服两次。因此,生产中需要有更便捷的方式来完成。
针对这个问题,本申请将杀线虫性真菌与化学驱虫药联合在一起制作成稳定的联合制剂,解决了给药和给真菌步骤繁琐的问题,达到了化学驱虫药治疗和捕食性真菌预防双管齐下的目的。
试验表明,杀线虫性真菌-伊维菌素胶囊组和杀线虫性真菌-阿苯达唑片剂组的幼虫减少率分别为97.0%和98.4%。而单独用驱虫药时,幼虫减少率分别是伊维菌素组60.7%,阿苯达唑组66.0%;尽管联合制剂组及单独用药组与空白对照组相比,幼虫减少率均有下降,但其原因和幅度是不一样的。单独用药组的减少,是由于药物杀虫后,排出虫卵减少所致;而联合制剂组的减少,是由于药物杀虫后排出虫卵减少再叠加上杀线虫性真菌对虫卵发育形成的线虫幼虫的捕杀作用所导致,其降低的幅度更大。说明,与单独用驱虫药组相比,在联合制剂组中,驱虫药驱虫后排出动物体外的虫卵发育形成的幼虫,显然是被杀线虫性真菌所杀灭。这样就减少了家畜再感染这些幼虫,在体内发育为成虫,进而造成危害的可能性;从而起到逐步减少驱虫药的使用频率,它有利于动物性食品的安全性和生态环境的平衡,其经济效益和社会效益是可观的。因此,这种真菌和驱虫药联合防控寄生虫感染模式的优势是显而易见的。
杀线虫性真菌d.flagrans-伊维菌素胶囊和杀线虫性真菌d.flagrans-阿苯达唑片剂的研制成功,在临床应用时非常方便使用,更益于此模式的推广及应用。在当前我国畜牧业可持续快速发展形势下,将杀线虫性真菌和化学驱虫药联合制剂模式应用于我国家畜寄生性线虫病防控,其意义重大,具有非常好的应用前景。
附图说明
图1为试验例3各组虫卵平均epg比较结果。
图2为试验例3各组幼虫平均lpg比较结果。
图3为试验例3各组幼虫平均减少率比较结果。
图4为试验例7各组幼虫平均lpg比较结果。
图5为试验例7各组幼虫平均减少率比较结果。
具体实施方式
现以下述实施例来说明本发明,但不用来限制本发明的范围。实施例中使用的手段,如无特别说明,均使用本领域常规的手段。
本发明使用的杀线虫性真菌(duddingtoniaflagrans)菌株(菌株名称为cim1)的保藏号为:cgmccno.9201,保藏日期:2014年5月5日。所述菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码100101,电话:(010)64807355。
冻干真菌孢子剂量经本实验室前期试验确定为:绵羊口服冻干制剂的剂量是8.04mg/kg体重。
胶囊中真菌和伊维菌素混合物的净重计算:
胶囊中真菌和伊维菌素混合物的净重=胶囊的重量–胶囊衣重量(1)
胶囊中伊维菌素含量检测:根据《中华人民共和国兽药典》规定的伊维菌素标准检测方法,取制备好的胶囊,充分捣碎研磨,至100ml容量瓶中,加甲醇稀释至刻度,混匀后过滤,取滤液5ml加入甲醇至50ml容量瓶内刻度处,摇匀取滤液进样,用waterse2695高效液相色谱仪进行检测,回收率均在90%-110%为合格。
片剂中阿苯达唑含量检测:参照《中华人民共和国兽药典》(2015版)中检测阿苯达唑有效成分含量的方法,取制备好的片剂,充分捣碎研磨,置100ml容量瓶中,加入甲醇溶解,震荡摇匀,过滤,取滤液5ml至50ml容量瓶内,加入甲醇溶液至刻度,摇匀后过滤,取滤液进样,用waterse2695高效液相色谱仪进行检测,平均回收率在90%-110%为合格。
实施例中,杀线虫性真菌(duddingtoniaflagrans)的厚垣孢子由以下制备方法提供:在无菌条件下,将在玉米粒培养基中培养了三周的杀线虫性真菌厚垣孢子用洗脱液多次洗脱下来,混匀后等量分装于灭菌的西林瓶中,置-80℃冰箱中预冻2h以上,然后将其放置于真空冷冻干燥机中,待样品呈干燥粉末状时,取出盖紧盖子,用封口膜封住瓶口,置于-4℃保存备用。检测所得冻干粉中含厚垣孢子数量为1.24×108个/g。
实施例1:真菌d.flagrans-伊维菌素联合制剂胶囊的制备
一种胶囊剂,包括胶囊壳、杀线虫性真菌(duddingtoniaflagrans)的厚垣孢子(以冻干孢子粉的形式提供)和伊维菌素。每单位剂量含有杀线虫性真菌冻干孢子粉40.1mg,伊维菌素含量为1.0mg。
胶囊壳型号为3#,长约15mm,直径约为5mm。将胶囊壳分成三组,每组三个平行样本,分别精密称重,质量在0.0622±0.0166g/粒范围内。
经公式(1)计算,每粒胶囊剂中真菌与伊维菌素混合物的净重约为0.04g/粒。
本实施例同时提供了上述胶囊剂的制备方法,具体如下:
胶囊剂的制备:将3#胶囊体和胶囊帽排列在体板和帽板上,然后把伊维菌素与冻干孢子混合物倒在体板上,用刮粉板将其刮在体板上,一直刮满胶囊体,将帽板放在体板上,向下使劲按压到底,胶囊灌装完毕。
试验例1:稳定性试验
实施例1胶囊剂的稳定性试验:在室温和4℃的条件下,放置1个月、6个月和1年,再次测定伊维菌素含量和厚垣孢子萌发率。结果表明,伊维菌素回收率均在90%-110%以内;真菌厚垣孢子萌发率在测试的第三天均达到90%以上,活性很好。说明联合制剂的稳定性至少在1年以上。
表1联合制剂真菌厚垣孢子萌发率测定结果
注:同列肩标字母相同相同表示差异不显著(p>0.05)。
表2联合制剂药物检测结果
试验例2:胶囊崩解释放实验
考虑到反刍动物特有的复胃系统,为了考察真菌-药物联合制剂胶囊进入动物体内的联合制剂崩解和内容物释放的时间,我们特地进行了杀线虫性真菌-伊维菌素胶囊在临床动物体内的崩解和有效成分释放试验。即将15个杀线虫性真菌-伊维菌素胶囊,通过人工饲喂,给1只6月龄的健康羔羊投入体内,之后30分钟将该羊剖杀,在消化道中寻找投入的胶囊,发现已全部被溶解,药物已释放,难以寻到胶囊踪迹。
试验例3:杀线虫性真菌-伊维菌素联合制剂临床杀虫试验
试验前三天,每天同一时间,对试验羊直肠采粪后,对粪便中线虫虫卵计数,综合3天虫卵计数结果,以每组9头绵羊的均等数量分组。选取其中3组(a组、b组、c组)作为本次试验动物。其中a组为伊维菌素组;b组为真菌-伊维菌素胶囊组;c组为空白对照组。将每组羊按顺序分别编号。a组羊口服伊维菌素,剂量为0.2mg/kg体重;b组羊按(2粒/10kg体重)口服联合制剂(实施例1制真菌d.flagrans-伊维菌素胶囊);c组羊为空白对照组。
在给药或投喂真菌前(0h)以及给药或投喂真菌后的1d、2d、3d和6d时,分别对试验绵羊进行直肠采粪10g,采用mcmaster氏法进行虫卵计数,计算克粪便虫卵数(epg);然后将同组粪便混合,均匀地分成3份,分别放置于一次性餐盒中,每天加适量蒸馏水并翻动,以保持空气流通和适宜湿度。培养15d后,采用改良贝尔曼法对粪便中的线虫第3期幼虫进行分离,得出克粪便幼虫数(lpg)。再利用下述公式,计算出试验后线虫幼虫的减少率(如下式),对杀线虫性真菌-伊维菌素联合制剂的临床杀虫模式效果进行比较评价。
幼虫减少率(%)=(空白对照组lpg-试验组lpg)/(空白对照组lpg)×100%(2)
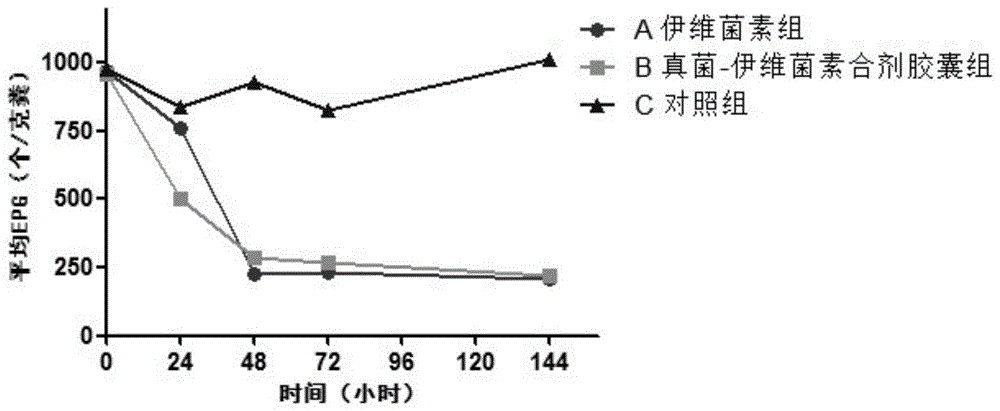
杀线虫性真菌-伊维菌素胶囊联合制剂临床杀虫试验结果如下,表3为试验后epg值的变化。
表3各组虫卵平均epg比较结果
注:a组为伊维菌素组;b组为真菌-伊维菌素联合制剂胶囊组;c组为空白对照组。平均epg值是各组每克粪便中虫卵数。同列肩标字母相同表示差异不显著(p>0.05);同列肩标字母相邻表示差异显著(p<0.05);同列肩标字母相间表示差异极显著(p<0.01)。
由表3和图1可知,a组(伊维菌组)和b组(真菌-伊维菌素胶囊组)在给予伊维菌素驱虫药或给予杀线虫性真菌duddingtoniaflagrans-伊维菌素联合制剂胶囊后,在0~48h(2d)期间内,粪便中虫卵数有一个急速下降的趋势;之后基本保持在一个平稳变动的过程中。统计学分析显示,a、b两组差异不显著(p>0.05)。说明伊维菌素药物驱虫后,还是有相当数量的虫卵排出,药物对虫卵基本不起杀灭作用;而杀线虫真菌是对虫卵将来孵化出的幼虫起作用。而空白对照的c组粪便中虫卵数始终维持在较高水平上,只随时间变化有微小波动。从a组和b组与c组之间比较,前二组和后组区别还是很大,差异显著(p<0.05)或极显著(p<0.01)。
表4各组幼虫平均lpg比较结果
注:a组为伊维菌素组;b组为真菌-伊维菌素联合制剂胶囊组;c组为空白对照组。平均lpg值是各组每克粪便中虫卵发育形成的第三期幼虫平均数量。同列肩标字母相同表示差异不显著(p>0.05);同列肩标字母相邻表示差异显著(p<0.05);同列肩标字母相间表示差异极显著(p<0.01)。
真菌和驱虫药联合制剂应用对虫卵孵化后三期幼虫数量lpg值的影响可见表4和图2。从表中可以看出,真菌-伊维菌素联合制剂胶囊组的线虫感染性幼虫数量最低,平均仅为近18%;而单独伊维菌素组平均40%多;对照组近80%。可见真菌对感染性幼虫发挥了重要的捕杀作用。而这仅仅是1克粪便统计出的数据,我们统计过,每只羊每天排出的粪便大约为1000-1500克,那么仅在6天实验期间内,真菌可杀灭的感染性幼虫数就已很可观。而对照单独用驱虫药驱虫时所排出的虫卵,它们可以继续在草场上发育,进而再次感染家畜,这就是造成我们目前年年驱虫,年年有虫现状的重要原因之一。
表5和图3平均幼虫减少率统计结果显示,经统计学分析,b组(真菌-伊维菌素胶囊组)和其余各组之间相互比较均差异极显著。而且对24~48h试验期间粪便中虫卵孵化出的幼虫的捕获率,达到了100%。而a组(伊维菌素组)平均幼虫减少率约为61%。在整个试验期间不同时间点,幼虫减少率均未达到100%。
表5各组幼虫减少率比较结果
注:a组为伊维菌素组;b组为伊维菌素联合d.flagrans组;c组为空白对照组。同列肩标字母相同表示差异不显著(p>0.05);同列肩标字母相邻表示差异显著(p<0.05);同列肩标字母相间表示差异极显著(p<0.01)。
试验例4联合制剂片剂的辅料选择试验
(1)稀释剂的选择和用量
稀释剂也称为填充剂,实验首先对糊精、α-乳糖、蔗糖、糊精-蔗糖-淀粉(1:1:7)四种常用稀释剂进行了比较。按辅料:原料为1:1的比例,将稀释剂和原料(真菌厚垣孢子冻干粉和药物),进行了充分混合,然后喷少量蒸馏水制软材,挤压制粒,干燥后加入4%peg4000,混匀,进行压片。
由表6结果可知,由糊精作为稀释剂制得的颗粒和片剂外观均不符合要求;蔗糖及糊精-蔗糖-淀粉制得的片剂外观也不符合预期要求;仅α-乳糖作为稀释剂制得的颗粒外观及片剂外观均符合本发明要求,而且其价格相对低廉;另外,α-乳糖微甜,也具有适口性好的矫味功能,易于被动物自主食用。因此最终选择α-乳糖作为稀释剂,其功能主要起赋形的作用。
表6不同稀释剂对颗粒及片剂外观的影响
之后,又对α-乳糖稀释剂的用量进行了实验,由表7结果可知,α-乳糖与原料(冻干孢子粉和驱虫药)的质量比例为1:1、1:2和1:3时,均能得到合格的颗粒和片剂,在保证片剂可压性和外观较好的前提下,从减少用量的角度考虑,应该选择用量较小的α-乳糖比例,故选择α-乳糖与原料的比例为1:3为最佳。
表7不同α-乳糖用量对颗粒和片剂外观的影响
(2)润滑剂的选择和用量
为了保证在压片时,使压出的片剂滑润、光洁、完整且均匀,不发生粘附,对不同润滑剂及其用量进行了比较和选择(表8)。润滑剂用量是基于片剂总重量计算。
由表8结果可知,0.3%硬脂酸镁、0.5%的硬脂酸镁和4%peg4000均可制得基本符合要求的片剂;但4%peg4000虽然可制得符合要求的片剂,但其成本相对较高,因此优先考虑选用硬脂酸镁。在片剂中硬脂酸镁主要保证药片的滑润度和释放作用,硬脂酸镁含量过高会影响片剂的崩解和释放,在保证制得成品符合要求的片剂情况下,选择用量较少的更为合适,故选择用0.3%的硬脂酸镁作为润滑剂。
表8不同润滑剂的用量及压片情况比较
实施例2:
一种片剂,由杀线虫性真菌的冻干孢子、阿苯达唑、硬脂酸镁、a-乳糖组成,每单位剂量约含有杀线虫性真菌冻干孢子粉53.0mg、阿苯达唑79.00mg,硬脂酸镁0.53mg,a-乳糖44.00mg。
本实施例同时提供了片剂的制备方法,具体如下:按照上述确定好的原料及辅料的比例,称取有效成分的原粉和乳糖,充分混合均匀后,过筛制粒;然后加入硬脂酸镁,再混匀;用压片机压片。考虑到顺利喂服的问题,片剂的规格尺寸尽量做的小一点,其直经约7mm,厚度为4.5mm。
试验例5杀线虫性真菌-阿苯达唑片片剂的崩解释放试验
为了考察反刍动物特有的复胃系统是否会延长片剂药物的崩解和有效成分的释放时间,本发明人进行了杀线虫性真菌-阿苯达唑片剂在临床动物体内的崩解释放试验。即将15个杀线虫性真菌-阿苯达唑片剂,通过人工饲喂,给1只6月龄的健康绵羊投入体内,之后15分钟将该羊剖杀,在消化道中寻找投入的药片,发现已全部被溶解释放,难以寻到踪迹。
试验例6稳定性试验
实施例2的片剂在室温(约20℃)和4℃的条件下,放置1个月、6个月和1年,再次测定阿苯达唑含量和厚垣孢子的萌发率。结果表明,药物回收率均在90%-110%以内;真菌萌发率在第三天均达到90%以上。说明该种片剂的稳定性最少在1年以上(表9,表10)。
表9联合制剂真菌萌发率的测定结果
注:同列肩标字母相同表示差异不显著(p>0.05)。
表10联合制剂药物检测结果
试验例7杀线虫性真菌-阿苯达唑联合制剂临床杀虫试验
在各试验组中,其中a组为阿苯达唑组;b组为真菌-阿苯达唑片剂组;c组为空白对照组。将每组羊按顺序分别编号。试验动物分组和操作方法同试验例3。喂药方法是口服。
a组羊按15mg/kg体重口服阿苯达唑;b组羊按剂量2片/10kg体重口服联合制剂(实施例2制备真菌d.flagrans-阿苯达唑片剂);c组羊为空白对照组。
其余步骤同杀线虫性真菌-伊维菌素联合制剂杀虫试验;利用前述公式(2),对真菌-d.flagrans-阿苯达唑联合制剂杀虫模式效果进行比较评价。
杀线虫性真菌-阿苯达唑片剂临床杀虫试验结果:杀线虫性真菌-阿苯达唑片剂临床试验,对epg值的影响与杀线虫性真菌-伊维菌素胶囊组试验相似。该片剂试验对lpg值的影响如下表。
表11各组幼虫平均lpg比较结果
注:其中a组为阿苯达唑组;b组为真菌-阿苯达唑片剂组;c组为空白对照组。
平均lpg值是各组每克粪便中虫卵发育形成的第三期幼虫平均数量。同列肩标字母相同表示差异不显著(p>0.05);同列肩标字母相邻表示差异显著(p<0.05);同列肩标字母相间表示差异极显著(p<0.01)。
试验结果如表11和图4显示,单独阿苯达唑药物的a组与杀线虫性真菌d.flagrans-阿苯达唑联合制剂的b组lpg值相比较,不同时间点所采集的粪便培养发育而来的幼虫数量lpg有明显不同,经spss统计分析表明,两个组的lpg有显著性差异(p<0.05);而与对照组(c组)相比,差异极显著(p<0.01)。
由表12和图5平均幼虫减少率统计结果可知,a组(阿苯达唑组)在整个试验期间,幼虫减少率均未达到100%,24h之后幼虫减少率有所增加;而b组(真菌-阿苯达唑片剂组)在24h-48h期间,幼虫减少率均达到100%,此后稍有所减少。而c组(空白对照组)幼虫减少率一直为0。通过比较各试验组(a组、b组、c组)平均幼虫减少率,可看出,b组平均幼虫减少率达到98%,高于a组或c组;经统计学分析显示,b组与上述二组相比较,差异极显著。
表12各组幼虫减少率统计结果
注:其中a组为阿苯达唑组;b组为真菌-阿苯达唑片剂组;c组为空白对照组。同列肩标字母相同表示差异不显著(p>0.05);同列肩标字母相邻表示差异显著(p<0.05);同列肩标字母相间表示差异极显著(p<0.01)。
综上所述:无论是杀线虫性真菌-伊维菌素胶囊联合制剂,还是杀线虫性真菌-阿苯达唑联合片剂,其临床杀虫试验结果都证明,它们不仅杀虫效果优越,而且和原来驱虫药及杀线虫性真菌制剂分别需二次单独喂服相比较,节省了时间和人工各1倍。并且,还降低了运输和储存成本。因为本试验需要非常精确,所以,本次对联合制剂进行了人工饲喂。但以后在临床中应用时,还可以考虑将上述二种联合制剂,拌在饲料中饲喂给动物,那么给药就会更加方便,那样就会节约更多的经济成本。
如果根据常规驱虫方法,每年在寄生性线虫感染高峰期,给予本联合制剂二次,即可有效控制家畜线虫病感染,并可逐步降低使用驱虫药的次数,这种与驱虫药结合性生物防控新技术,对于减少耐药性的发生和环境污染,保障动物性食品安全,意义重大。
实施例3:
采用实施例2的片剂,在畜牧生产中,直接掺入饲料中,羊很容易进食,不需要单独耗费人力喂药。在内蒙古地区,针对春季和冬季两个寄生虫感染的高峰期,各给联合制剂一次,有效地提高和改善了线虫感染防控的实际效果。
以上的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变型和改进,均应落入本发明的权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!