一种伪狂犬病毒囊膜糖蛋白gD基因mRNA疫苗的制作方法
本发明涉及疫苗技术领域,具体涉及一种伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗。
背景技术:
伪狂犬病是由伪狂犬病毒也称为猪1型疱疹病毒引起的一种猪为唯一自然宿主,也可以感染多种家畜(牛、羊、犬等)、家禽(鸡、火鸡等)和野生动物的急性传染病。猪作为唯一自然宿主长期贮存病毒并排毒,引起成年猪呼吸道症状、高热,怀孕母猪严重并发症致流产、死胎和木乃伊胎,断奶仔猪中枢神经症状明显且发病率和死亡率很高。在其他动物体上以发热、奇痒及脑脊髓炎主要症状。以往的研究认为伪狂犬病毒不会感染高等灵长类动物,但是现已在中国上海报道发现第一例人类感染伪狂犬病毒且表现出了类似于人类疱疹病毒症状造成眼角膜炎症损伤和眼部结构坏死,且在人群的酶联免疫吸附测定中也有发现血清样品为阳性。
近年来rna分子领域相关技术突破性进展,mrna疫苗在流感病毒、埃博拉病毒和寨卡病毒等多种传染病上取得了一定的研究成果,mrna疫苗将mrna传递至细胞,表达产生蛋白,从而使机体获得免疫保护。mrna作为疫苗分子相对于dna分子具有突出的优点:它不需要任何的核定位信号、体内无需转录使突变风险大大降低且不存在整合到基因组的可能。猪伪狂犬病是当今危害养猪业最重要的传染病之一,疫苗免疫仍是防控伪狂犬病的最主要方式。然而2012年起,伪狂犬病毒变异株在全国多地流行,造成了养猪业的巨大经济损失。本研究以囊膜糖蛋白gd其分子和功能特性为基础,创新地研究prv囊膜糖蛋白gd基因mrna疫苗作为候选疫苗对prv的防治有着重要的潜在价值。猪伪狂犬病毒xj株为病毒模板,扩增克隆囊膜糖蛋白gd基因,扩增后的囊膜糖蛋白gd基因构建mrna克隆载体、真核表达载体,实现体外转录mrna后再与真核表达载体分别进行免疫原性相关研究。
技术实现要素:
本发明的目的在于针对现有技术的缺陷和不足,提供一种伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗。
本发明所述的一种伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗,采用如下步骤制备:
步骤1:构建prv-gd基因mrna克隆质粒和真核质粒;
(1)质粒:pmd19-t线性化质粒;(2)毒株及细胞:伪狂犬病毒xj株,bhk21细胞、vero细胞;
步骤2:伪狂犬病毒增殖与细胞培养;
步骤3:抽提伪狂犬病毒dna;
步骤4:设计特异性引物:
p1:cccggatccggccccaggttcccatacactca
p2:cccctcgagctacggaccgggctgcgcttt
p3:
p4:cccctcgagtttggatccctacggaccgggctgcgcttt
上游单划线部分为限制性酶切位点bamhi,下游单划线部分为限制性酶切位点xhoi,双划线部分为t7启动子;扩增片段为分别为1286bp和1305bp;
步骤5:pcr扩增伪狂犬病毒囊膜糖蛋白gd基因;
(1)用抽提的prv-xj株病毒dna作为模板;
(2)加入p3、p4特异性引物;
(3)扩增囊膜糖蛋白gd基因;pcr扩增产物的电泳鉴定以及电泳鉴定;
步骤6:回收后目的片段与pmd19-t载体连接;
将琼脂糖凝胶回收的pcr产物与pmd19-t载体相连接,连接体系总体积10μl,16℃过夜连接;
步骤7:dh5α大肠杆菌感受态细胞的制备以及连接产物的转化;
步骤8:转化菌落的鉴定:
(1)从转化氨苄青霉素琼脂lb平板上挑取多个转化子接种于6ml氨苄青霉素液体lb培养基中,37℃,剧烈震荡过夜培育;
(2)按照赛默飞世尔小量质粒抽提试剂盒的说明进行操作;
(3)将抽提备用的克隆载体命名为pmd19-gd,用bamhi和xhoi进行双酶切鉴定,37℃反应5-20min;酶切产物在0.8%琼脂糖凝胶进行电泳,成像鉴定;
步骤9:苷酸片段测序分析与鉴定:
将全质粒以通用引物的方式送擎科生物有限公司进行测序,测序结果用snap-gene生物学软件和blast对比分析;
步骤10:真核表达载体的构建:
(1)用抽提的prv-xj株病毒dna作为模板;
(2)加入p1、p2特异性引物,扩增囊膜糖蛋白gd基因;
(3)pcr扩增产物电泳鉴定后进行琼脂糖凝胶回收,在进行线性pcr产物的双酶切;
(4)两个酶切体系均为37℃,5-20min反应时间,在0.8%琼脂糖凝胶进行电泳后再凝胶成像系统中观察。琼脂糖凝胶dna回收试剂盒进行操作。酶切回收的pcr产物与pvax酶切回收产物的定向连接。连接总体积15μl,混匀后16℃过夜;
(5)将连接产物转化到感受态细胞中培养保存,筛选阳性质粒后,用bamhi和xhoi双酶切重组质粒,后测序鉴定,质粒命名为pvax-gd;
步骤11:疫苗与小鼠:
(1)伪狂犬病毒基因工程缺失疫苗sa215疫苗;(2)balb/cspf小鼠;
步骤12:溶液备存:
(1)30%聚丙烯酰胺溶液;
(2)5*page缓冲液;
(3)2*sds上样缓冲液转印缓冲液;
(4)tbst洗脱液;封闭缓冲液/抗体稀释液;
(5)ecl化学发光显色液;
步骤13:质粒抽提;
步骤14:体外转录:
(1)将无内毒素抽提的pmd19-gd克隆质粒进行双酶切,后回收得到线性化无内毒素片段;
(2)混匀后加入4μle-pap轻柔混匀37℃反应45min。
(3)获得具有活性的mrna片段;
步骤15:转染:将获得的mrna和pvax-gd转染bhk21细胞;
步骤16:样品制备:
(1)在转染细胞24-48h后收集细胞,制备sds-page样品;
(2)按照《分子克隆实验指南》第四版中介绍的实验方法,使用垂直立式电泳槽进行sds-page电泳进行操作;
(3)样品先经12%浓度的sds-page电泳,电泳分离后,转印至pvdf膜,进行westernblot实验;
(4)病毒半数组织培养感染剂量tcid50的测定;
(5)中和抗体检测:使用固定病毒-血清稀释法进行实验测定;按照reed-muench方法计算中和抗体滴度及数值;
(6)病毒半数致死量ld50的测定:接种病毒后每天观察记录小鼠临床症状和死亡情况,连续观察15d后,按照reed-muench方法计算ld50;
步骤17:mrna包被。
进一步地,步骤1中的pmd19-t线性化质粒购置于宝日医中国有限公司,pvax质粒由本实验室保存。
进一步地,步骤1中的伪狂犬病毒xj株,bhk21细胞、vero细胞,均由四川农业大学动物生物技术中心保存。
进一步地,步骤11中的伪狂犬病毒基因工程缺失疫苗sa215疫苗购置于四川华神兽用生物制品有限公司;balb/cspf小鼠购置于成都达硕生物科技有限公司。
进一步地,步骤14中的将无内毒素抽提的pmd19-gd克隆质粒进行双酶切,后回收得到线性化无内毒素片段,参考ambion公司专利技术进行体外转录操作。
进一步地,步骤15中的将获得的mrna和pvax-gd转染bhk21细胞,参考lipofectamine3000和lipofectaminetmmessengermax说明进行操作。
进一步地,步骤17中的mrna包被,按照西格玛奥德里奇生物技术公司技术说明进行操作,包被后4℃保存备用。
本发明有益效果为:本发明所述的一种伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗,制备了伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗。向spf级balb/c小鼠肌肉注射mrna疫苗,通过测定特异性抗体、病毒中和抗体、细胞因子、流式细胞仪测定t淋巴细胞亚群和攻毒保护试验,表明mrna疫苗可以给小鼠提供良好的保护性,为成为候选prv疫苗奠定了基础。
本发明构建了伪狂犬病毒囊膜糖蛋白gd基因真核表达载体pvax-gd。向spf级balb/c小鼠肌肉注射真核表达载体pvax-gd,结果显示,可以刺激机体产生免疫反应并产生特异性抗体和中和抗体,与空白对照有显著的差异。攻毒保护试验表明,真核表达载体具有良好的免疫原性。
【附图说明】
此处所说明的附图是用来提供对本发明的进一步理解,构成本申请的一部分,但并不构成对本发明的不当限定,在附图中:
图1为本发明的囊膜糖蛋白gd基因扩增示意图;
图2为本发明的mrna克隆载体的酶切鉴定及测序结果示意图;
图3为本发明的真核表达载体pvax-gd酶切鉴定及测序结果示意图;
图4为本发明的mrna、pvax-gd转染bhk21细胞免疫印迹图;
图5为本发明的elisa检测特异性抗体结果示意图;
图6为本发明的各组动物病毒中和抗体水平的示意图;
图7为本发明的各组动物cd4+/cd8+t淋巴细胞亚群分选图;
图8为本发明的各组动物cd4+/cd8+t淋巴细胞比例变化图;
图9为本发明的各组动物细胞因子il-2elisa检测结果示意图;
图10为本发明的各组动物细胞因子ifn-γelisa检测结果示意图;
图11为本发明的小鼠攻毒保护试验中的各组攻毒后生存情况示意图。
【具体实施方式】
下面将结合附图以及具体实施例来详细说明本发明,其中的示意性实施例以及说明仅用来解释本发明,但并不作为对本发明的限定。
如图1-图11所示,本具体实施方式所述的一种伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗,采用如下步骤制备:
步骤1:构建prv-gd基因mrna克隆质粒和真核质粒;
(1)质粒:pmd19-t线性化质粒购置于宝日医中国有限公司,pvax质粒由本实验室保存;
(2)毒株及细胞:伪狂犬病毒xj株,bhk21细胞、vero细胞,均由四川农业大学动物生物技术中心保存;
步骤2:伪狂犬病毒增殖与细胞培养;
步骤3:抽提伪狂犬病毒dna;
步骤4:设计特异性引物:
p1:cccggatccggccccaggttcccatacactca
p2:cccctcgagctacggaccgggctgcgcttt
p3:
p4:cccctcgagtttggatccctacggaccgggctgcgcttt
上游单划线部分为限制性酶切位点bamhi,下游单划线部分为限制性酶切位点xhoi,双划线部分为t7启动子;扩增片段为分别为1286bp和1305bp;
步骤5:pcr扩增伪狂犬病毒囊膜糖蛋白gd基因;
(1)用抽提的prv-xj株病毒dna作为模板;
(2)加入p3、p4特异性引物;
(3)扩增囊膜糖蛋白gd基因;pcr扩增产物的电泳鉴定以及电泳鉴定;
步骤6:回收后目的片段与pmd19-t载体连接;
将琼脂糖凝胶回收的pcr产物与pmd19-t载体相连接,连接体系总体积10μl,16℃过夜连接;
步骤7:dh5α大肠杆菌感受态细胞的制备以及连接产物的转化;
步骤8:转化菌落的鉴定:
(2)从转化氨苄青霉素琼脂lb平板上挑取多个转化子接种于6ml氨苄青霉素液体lb培养基中,37℃,剧烈震荡过夜培育;
(2)按照赛默飞世尔小量质粒抽提试剂盒的说明进行操作;
(3)将抽提备用的克隆载体命名为pmd19-gd,用bamhi和xhoi进行双酶切鉴定,37℃反应5-20min;酶切产物在0.8%琼脂糖凝胶进行电泳,成像鉴定;
步骤9:苷酸片段测序分析与鉴定:
将全质粒以通用引物的方式送擎科生物有限公司进行测序,测序结果用snap-gene生物学软件和blast对比分析;
步骤10:真核表达载体的构建:
(3)用抽提的prv-xj株病毒dna作为模板;
(4)加入p1、p2特异性引物,扩增囊膜糖蛋白gd基因;
(3)pcr扩增产物电泳鉴定后进行琼脂糖凝胶回收,在进行线性pcr产物的双酶切;
(4)两个酶切体系均为37℃,5-20min反应时间,在0.8%琼脂糖凝胶进行电泳后再凝胶成效系统中观察。琼脂糖凝胶dna回收试剂盒进行操作。酶切回收的pcr产物与pvax酶切回收产物的定向连接。连接总体积15μl,混匀后16℃过夜;
(5)将连接产物转化到感受态细胞中培养保存,筛选阳性质粒后,用bamhi和xhoi双酶切重组质粒,后测序鉴定,质粒命名为pvax-gd;
步骤11:疫苗与小鼠:
(1)伪狂犬病毒基因工程缺失疫苗sa215疫苗购置于四川华神兽用生物制品有限公司;(2)balb/cspf小鼠购置于成都达硕生物科技有限公司;
步骤12:溶液备存:
(1)30%聚丙烯酰胺溶液;
(2)5*page缓冲液;
(3)2*sds上样缓冲液转印缓冲液;
(4)tbst洗脱液;封闭缓冲液/抗体稀释液;
(5)ecl化学发光显色液;
步骤13:质粒抽提;
步骤14:体外转录:
(1)将无内毒素抽提的pmd19-gd克隆质粒进行双酶切,后回收得到线性化无内毒素片段,参考ambion公司专利技术进行体外转录操作;
(2)混匀后加入4μle-pap轻柔混匀37℃反应45min。
(3)获得具有活性的mrna片段;
步骤15:转染:
将获得的mrna和pvax-gd转染bhk21细胞,参考lipofectamine3000和lipofectaminetmmessengermax说明进行操作;
步骤16:样品制备:
(1)在转染细胞24-48h后收集细胞,制备sds-page样品;
(2)按照《分子克隆实验指南》第四版中介绍的实验方法,使用垂直立式电泳槽进行sds-page电泳进行操作;
(3)样品先经12%浓度的sds-page电泳,电泳分离后,转印至pvdf膜,进行westernblot实验;
(4)病毒半数组织培养感染剂量tcid50的测定;
(5)中和抗体检测:使用固定病毒-血清稀释法进行实验测定;按照reed-muench方法计算中和抗体滴度及数值;
(6)病毒半数致死量ld50的测定:接种病毒后每天观察记录小鼠临床症状和死亡情况,连续观察15d后,按照reed-muench方法计算ld50;
步骤17:mrna包被:按照西格玛奥德里奇生物技术公司技术说明进行操作,包被后4℃保存备用。
本发明中,1989年rna作为疫苗概念首次被提出开始研究,1990年,wolff等证明直接注射mrna或pdna到小鼠的骨骼肌导致编码蛋白的表达,首次证明了mrna作为疫苗可在体内表达,drewweissman研究发现mrna疫苗可以抵抗寨卡病毒。一般的疫苗是通过病原体本身或其中的一部分抗原分子,注射机体,引起免疫反应来保护机体。而mrna疫苗是将mrna传递至细胞,表达产生蛋白,从而使机体获得免疫保护。mrna作为疫苗分子相对于dna作为疫苗分子有突出的优点:它不需要任何的核定位信号、转录让突变风险大大降低且不存在整合到基因组的可能。
本发明最关键的部分就是进行体外转录获得mrna分子,并且在大量生产mrna疫苗过程中,需要确定mrna的核糖核苷酸序列即可进行大规模的生产、复制。
本发明的形成结果如下:
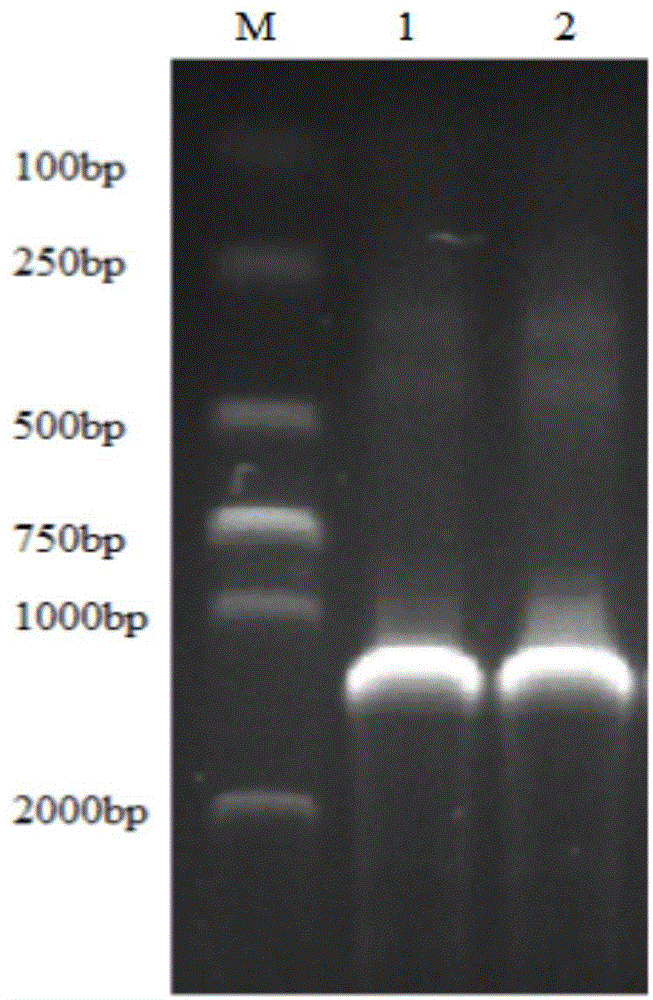
一、如图1所示,2.2.3.1囊膜糖蛋白gd基因扩增,其中:
(1)p1/p2和p3/p4特异性扩增囊膜糖蛋白gd基因;
(2)m:dl2000marker;
(3)1:p1/p2引物扩增囊膜糖蛋白gd基因;
(4)2:p3/p4引物扩张囊膜糖蛋白gd基因。
二、如图2所示,mrna克隆载体的酶切鉴定及测序结果:
(1)pmd19-gd质粒双酶切鉴定;
(2)m:markerⅲ;
(3)1:目的片段1305bp和质粒2692bp。
三、如图3所示,真核表达载体pvax-gd酶切鉴定及测序结果:
(1)pvax-gd质粒双酶切鉴定;
(2)m:markerⅲ;
(3)1:目的片段1268bp和质粒片段2931bp。
四、本发明中,pmd19-gd克隆载体酶切线性化体外转录,mrna疫苗及真核表达载体免疫原性相关研究。
1、疫苗与小鼠:(1)伪狂犬病毒基因工程缺失疫苗sa215疫苗购置于四川华神兽用生物制品有限公司;(2)balb/cspf小鼠购置于成都达硕生物科技有限公司;
2、溶液备存:(1)30%聚丙烯酰胺溶液;(2)5*page缓冲液;(3)2*sds上样缓冲液转印缓冲液;(4)tbst洗脱液;封闭缓冲液/抗体稀释液;(5)ecl化学发光显色液;
3、质粒抽提;
4、体外转录:(1)将无内毒素抽提的pmd19-gd克隆质粒进行双酶切,后回收得到线性化无内毒素片段,参考ambion公司专利技术进行体外转录操作;(2)混匀后加入4μle-pap轻柔混匀37℃反应45min;(3)获得具有活性的mrna片段;
5、转染:将获得的mrna和pvax-gd转染bhk21细胞,参考lipofectamine3000和lipofectaminetmmessengermax说明进行操作;
6、样品制备:(1)在转染细胞24-48h后收集细胞,制备sds-page样品;(2)按照《分子克隆实验指南》第四版中介绍的实验方法,使用垂直立式电泳槽进行sds-page电泳进行操作;(3)样品先经12%浓度的sds-page电泳,电泳分离后,转印至pvdf膜,进行westernblot实验;(4)病毒半数组织培养感染剂量tcid50的测定;(5)中和抗体检测:使用固定病毒-血清稀释法进行实验测定;按照reed-muench方法计算中和抗体滴度及数值;(6)病毒半数致死量ld50的测定:接种病毒后每天观察记录小鼠临床症状和死亡情况,连续观察15d后,按照reed-muench方法计算ld50;
7、mrna包被:按照西格玛奥德里奇生物技术公司技术说明进行操作,包被后4℃保存备用;
8、动物分组及免疫:动物分组:从成都达硕生物公司购买6-8周龄balb/c小鼠,随机分成5组,每组10只,分别为空白对照组、mrna疫苗组、mrna疫苗+保护剂组、pvax-gd质粒组和sa215疫苗组。
9、接种小鼠:接种balb/c小鼠大腿外侧四头肌,每70μg/只。
10、接种剂量:mrna和pvax-gd为70μg/只,sa215为100μl/只,免疫两次间隔两周。在首次免疫的0、2、4、6、8周眼底丛静脉采血检测分析。
11、攻毒保护:在第8周采血后进行攻毒保护实验,小鼠脚掌皮下接种10*ld50,攻毒后每天记录临床症状和死亡情况。
12、淋巴细胞检测:在接种后第四周采血进行流式细胞仪t淋巴细胞相关分选检测。
13、elisa检测:balb/c小鼠il-2的elisa检测参考联科生物相关说明进行操作。然后进行balb/c小鼠ifn-γ的elisa检测参考联科生物相关说明进行操作。最后按照balb/c小鼠特异性抗体gd的elisa检测参考绿诗源生物相关说明进行操作。
14、实验数据分析:实验所取得数据使用spss统计软件进行分析。
15、westernblot结果分析如图4所示,为mrna、pvax-gd转染bhk21细胞免疫印迹图;
16、elisa检测特异性抗体结果:如图5所示为各组动物特异性抗体elisas/n值(p<0.05)。
17、病毒中和抗体检测:如图6所示为各组动物病毒中和抗体水平。
18、淋巴细胞亚群数量分析和elisa测定细胞因子:如图7所示为各组动物cd4+/cd8+t淋巴细胞亚群分选图。如图8所示为各组动物cd4+/cd8+t淋巴细胞比例变化图(p<0.05)。如图9所示为各组动物细胞因子il-2elisa检测结果(p<0.05)。如图10所示为il-2elisatestresultsforvariousgroupsofanimals(p<0.05),各组动物细胞因子ifn-γelisa检测结果(p<0.05)。
19、小鼠攻毒保护试验:如图11所示为各组攻毒后生存情况。
20、mrna疫苗诱导动物的免疫保护:
用10*ld50的伪狂犬病毒xj株在第8周对balb/c小鼠进行攻毒,在10天内,所有注射为pbs免疫的阴性对照小鼠全部死亡,免疫sa215疫苗为阳性对照小鼠全部存活,mrna疫苗+保护剂组实验小鼠、pxav-gd组实验小鼠全部存活,mrna疫苗组实验小鼠存活率90%。阴性对照小鼠在攻毒后第1天、第2天未有明确症状各有一只死亡,认为是注射给药操作或者是本身小鼠在严重应激下的死亡。第3天开始死亡的小鼠可以明显观察到prv造成其奇痒症状以至于皮肤啃咬等严重症状。实验各组小鼠表现出了轻微的瘙痒、被毛杂乱和精神不振,但很快就恢复正常。
21、mrna的体外转录及包被:
mrna疫苗中最关键的部分就是如何进行体外转录获得mrna分子。体外转录操作中获得单一的dna对提高转录效率具有十分重要的作用,现在科研中的线性化质粒dna使用噬菌体rna聚合酶转录,则残余的细菌dna和异质性的dna并不会影响mrna的转录,噬菌体所必须识别的t7启动子、t3启动子或是sp6启动子都是非常严格启动rna聚合方向的。
体外转录操作所获得mrna分子含有转录所需的复杂混合物,包括各种核苷酸包括各种核苷酸、寡核苷酸,短转录本和蛋白,副产物可以通过沉淀和萃取等步骤除去。由于依赖rna的rna聚合酶噬菌体聚合酶的活性,也会有非预期的转录片段产生。进一步对mrna疫苗的开发和研究,mrna可以进一步纯化以去除其他非有效成分等物质,单一层析法分离mrna可以根据大小去除短和长的转录本,也可以在使用高效液相色谱法(hplc)纯化,获得纯化单一的mrna分子。通过此操作纯净的mrna分子在体内蛋白表达活性且呈指数提高,蛋白质表达量大大提高,超高纯度的mrna分子用于注射可延长半衰期的同时大幅度提高效果。本实验制备mrna疫苗使用脂质体进行包被。
本发明有益效果为:本发明所述的一种伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗,制备了伪狂犬病毒囊膜糖蛋白gd基因mrna疫苗。向spf级balb/c小鼠肌肉注射mrna疫苗,通过测定特异性抗体、病毒中和抗体、细胞因子、流式细胞仪测定t淋巴细胞亚群和攻毒保护试验,表明mrna疫苗可以给小鼠提供良好的保护性,为成为候选prv疫苗奠定了基础。
本发明构建了伪狂犬病毒囊膜糖蛋白gd基因真核表达载体pvax-gd。向spf级balb/c小鼠肌肉注射真核表达载体pvax-gd,结果显示,可以刺激机体产生免疫反应并产生特异性抗体和中和抗体,与空白对照有显著的差异。攻读保护试验表明,真核表达载体具有良好的免疫原性。
以上所述仅是本发明的较佳实施方式,故凡依本发明专利申请范围所述特征及原理所做的等效变化或修饰,均包括于本发明专利申请范围内。
- 还没有人留言评论。精彩留言会获得点赞!