金属-ICG配合物及制备方法、金属-ICG配合物白蛋白纳米颗粒及制备方法和应用与流程
本发明涉及纳米药物
技术领域:
,尤其是涉及一种金属-icg配合物及制备方法、金属-icg配合物白蛋白纳米颗粒及制备方法和应用。
背景技术:
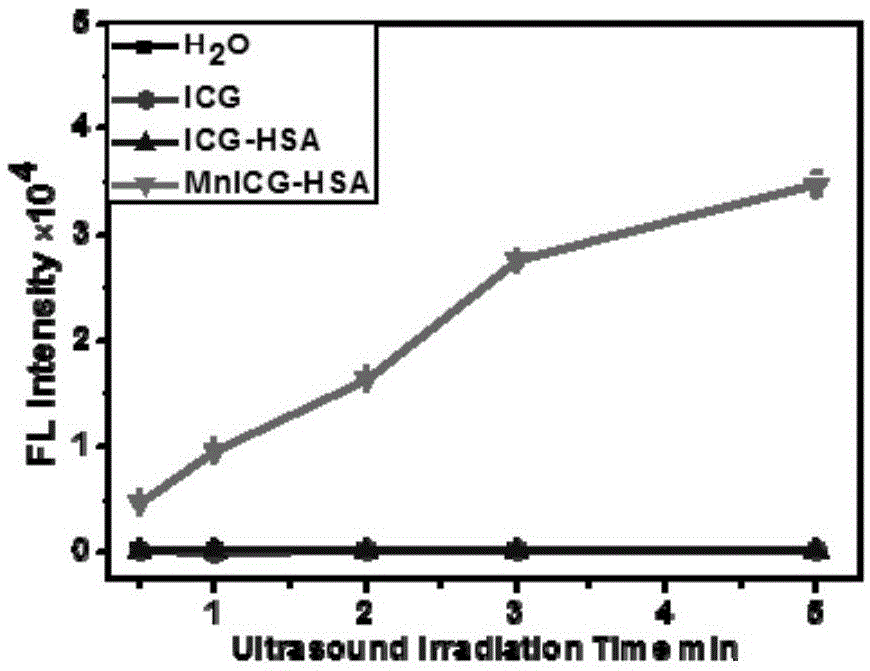
:声动力疗法(sdt),分别是通过声敏剂在超声激发下,通过与环境中的水分子或氧分子发生化学反应,产生单线态氧和自由基等活性氧物种(ros),来杀伤肿瘤细胞,而达到治疗肿瘤目的。sdt是在光动力疗法基础上发展起来的一种深度治疗肿瘤的新方法。与光动力疗法相比,sdt具有深层穿透性、无创等优点。目前,声敏剂还存在种类少、最大照射波长短和治疗窗口窄等缺点。因此,有必要开发波长较长的新型声敏剂来推动声动力治疗的发展。有鉴于此,特提出本发明。技术实现要素:本发明的目的之一在于提供一种金属-icg配合物,以改善现有的声敏剂种类少、最大照射波长短和治疗窗口窄的技术问题。此金属-icg配合物的制备方法,包括如下步骤:将icg溶液和金属盐溶液混合均匀,超声,得到金属-icg配合物;优选地,所述金属盐选自锌盐、铜盐、钴盐、铁盐、镍盐、铂盐、金盐和锰盐中的至少一种,优选为锰盐。进一步的,所述icg和金属盐的摩尔比为(1-2):(1-2),优选为(1-2):1。进一步的,超声温度为55-65℃,超声时间为1-2h;优选地,超声后注入饱和食盐溶液,使金属-icg配合物析出。本发明的目的之二在于提供一种金属-icg配合物白蛋白纳米颗粒,包括金属-icg配合物和血清白蛋白,所述金属-icg配合物包载于所述血清白蛋白中;优选地,所述金属-icg配合物白蛋白纳米颗粒的粒径为50-500nm,优选为100-200nm。优选地,所述血清白蛋白选自人血清白蛋白、动物血清白蛋白或生物发酵方式获得的重组人血清白蛋白中的至少一种,优选为人血清白蛋白;优选地,所述动物血清白蛋白为牛血清白蛋白。本发明的目的之三在于提供一种金属-icg配合物白蛋白纳米颗粒的制备方法,包括如下步骤:将金属-icg配合物溶液和血清白蛋白溶液混合,超声破碎,得到金属-icg配合物白蛋白纳米颗粒;进一步的,所述金属-icg配合物和血清白蛋白的质量比为(1-5):(1-20),优选为1:(15-20)。优选地,血清白蛋白溶液中,血清白蛋白的浓度为1-20mg/ml;优选地,金属-icg配合物溶液的浓度为1-5mg/ml。进一步的,超声破碎的时间为3-10min,优选为4-6min。本发明的目的之四在于提供本发明提供的金属-icg配合物或本发明提供的金属-icg白蛋白纳米颗粒在声动力治疗肿瘤中的应用。本发明的目的之五在于提供一种治疗肿瘤的声敏剂,包括本发明提供的金属-icg配合物或本发明提供的金属-icg白蛋白纳米颗粒。本发明提供的金属-icg配合物白蛋白纳米颗粒,通过将金属-icg包载于血清白蛋白中,有效提高了金属-icg在体内的稳定性和对肿瘤细胞的靶向性能,从而提高了金属-icg对肿瘤细胞的光热和声动力疗效。本发明提供的金属-icg配合物的制备方法通过超声实现了金属离子和icg以配位键络合,工艺简单,操作方便,适用于规模化大生产,能够显著提高配合物的制备效率,降低制备成本,制备得到的金属-icg配合物拓宽了照射波长,扩大了治疗窗口,兼具光敏和声敏双重功能,能够有效推动光热和声动力治疗的发展。本发明提供的金属-icg配合物白蛋白纳米颗粒的制备方法通过超声实现了金属-icg配合物和血清白蛋白的自组装,无需任何辅助化学连接剂,工艺简单,操作方便,适用于规模化大生产,能够显著提高配合物的制备效率,降低制备成本。附图说明图1为实施例5提供的mn-icg-hsa纳米颗粒、对比例1提供的icg-hsa纳米颗粒、icg溶液及去离子水在不同超声时间荧光强度的曲线图;图2为本发明实施例5提供的mn-icg-hsa纳米颗粒、对比例1提供的icg-hsa纳米颗粒及icg对照组分别与细胞作用后的细胞存活率柱状图。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。需要说明的是:本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。本发明中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。本发明中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。本发明中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“6~22”表示本文中已经全部列出了“6~22”之间的全部实数,“6~22”只是这些数值组合的缩略表示。本发明所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。本发明中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行。优选地,本文中的反应方法是顺序进行的。除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。吲哚菁绿染料(icg)是一种具有近红外特征吸收峰的三碳花菁染料,是唯一一种被美国食品药品监督管理局(fda)批准的可用于临床诊断的近红外荧光染料。但是icg的稳定性很差,在水溶液会迅速聚集并分解,对肿瘤细胞的杀伤效果不理想。根据本发明的第一个方面,本发明提供了一种兼具声敏和光敏双重功能的金属-icg配合物,以提高icg的稳定性和对肿瘤细胞的杀伤效果。金属离子与医学、生命科学、环境科学等领域有着密不可分的联系。在生物体内,金属离子广泛参与生命过程。本发明提供的金属-icg配合物,金属离子和icg络合连接,有效扩大了声敏剂种类,拓宽了照射波长,扩大了治疗窗口,能够有效推动光热和声动力治疗的发展。根据本发明的第二个方面,本发明提供了一种金属-icg配合物的制备方法,包括如下步骤:将icg溶液和金属盐溶液混合均匀,超声,得到金属-icg配合物。在本发明中,金属-icg配合物中的“-”代表“和”。本发明通过将金属盐和icg溶液混合后进行超声,金属离子与icg即以配位键络合,工艺简单,操作方便,在优化了icg的结构的同时还能够发挥金属离子在生物体内的生理功能,从而不仅提高了icg在体内的稳定性,而且拓宽了照射波长,扩大了治疗窗口,兼具光敏和声敏双重功能,能够有效推动光热和声动力治疗的发展。在本发明中,金属盐为能够离解出金属离子的盐。在本发明的一种优选实施方式中,金属盐选自锌盐、铜盐、钴盐、铁盐、镍盐、铂盐、金盐和锰盐中一种或几种,优选为锰盐。当选用锰盐时,制备得到的锰-icg配合物不仅具有优异的声敏性和光敏性,而且能够在核磁下成像,实现光热、声动力和示踪三种功能。在本发明的一种优选实施方式中,icg和金属盐的摩尔比为(1-2):(1-2)。通过控制icg和金属盐的摩尔比,以提高金属-icg配合物的产率。典型但非限制性的,当icg和金属盐的摩尔比为(1-2):1时,金属-icg配合物的产率更高。典型但非限制性的,icg和金属盐的摩尔比如为1:2、1:1或2:1。在本发明的一种优选实施方式中,超声温度为55-65℃,超声时间为1-2h。通过控制超声温度和超声时间,以促进金属盐和icg溶液更好的络合,从而促进金属-icg配合物的产率。典型但非限制性的超声温度如为55、56、57、58、59、60、61、62、63、64或65℃;超声时间如为1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2h。在本发明的一种优选实施方式中,超声后注入饱和食盐溶液,使金属-icg配合物析出,从而得到金属-icg配合物。根据本发明的第三个方面,本发明提供了一种金属-icg配合物白蛋白纳米颗粒,包括金属-icg配合物和血清白蛋白,金属-icg配合物包载于血清白蛋白中。本发明提供的金属-icg配合物白蛋白纳米颗粒,包括金属-icg配合物和血清白蛋白,金属-icg配合物包载于血清白蛋白中。本发明提供的金属-icg配合物白蛋白纳米颗粒,通过将金属-icg包载于血清白蛋白中,有效提高了金属-icg在体内的稳定性和对肿瘤细胞的靶向性能,从而提高了金属-icg对肿瘤细胞的光热和声动力疗效。在本发明的一种优选实施方式中,金属-icg配合物白蛋白纳米颗粒的粒径为50-500nm,优选为100-200nm。金属-icg配合物白蛋白纳米颗粒的粒径为50-500nm。通过控制金属-icg配合物白蛋白纳米颗粒的粒径,以便于其穿透细胞膜,提高其对肿瘤细胞的靶向性,尤其是当粒径为100-200nm时,其更有利于穿透细胞膜,提高对肿瘤细胞的靶向性,增强肿瘤细胞对金属-icg配合物的摄取,增强声动力疗效。典型但非限制性的,金属-icg配合物白蛋白纳米颗粒的粒径如为50、100、150、200、250、300、350、400、450或500nm。在本发明的一种优选实施方式中,血清白蛋白选自人血清白蛋白、动物血清白蛋白或生物发酵方式获得的重组人血清白蛋白中的一种或一种,优选为人血清白蛋白。当选用人血清白蛋白时,制成的金属-icg配合物白蛋白纳米颗粒的生物相容性更好。在本发明的一种优选实施方式中,动物血清白蛋白为鸡血清白蛋白或牛血清白蛋白,尤其是当动物血清白蛋白为牛血清白蛋白时,制成的金属-icg配合物白蛋白纳米颗粒的生物相容性更好。根据本发明的第四个方面,本发明提供的金属-icg配合物白蛋白纳米颗粒的制备方法,包括如下步骤:将金属-icg配合物溶液和血清白蛋白溶液混合,超声破碎,得到金属-icg配合物白蛋白纳米颗粒。本发明提供的金属-icg配合物白蛋白纳米颗粒的制备方法通过超声实现了金属-icg配合物和血清白蛋白的自组装,无需任何辅助化学连接剂,工艺简单,操作方便,适用于规模化大生产,能够显著提高配合物的制备效率,降低制备成本。在本发明的一种优选实施方式中,金属-icg配合物中的金属离子选自金、铂、锌、铜、钴、铁、镍和锰中的一种或几种,优选为锰。当金属离子为锰时,制备得到的锰-icg配合物不仅具有优异的声敏性和光敏性,而且能够在核磁下成像,实现光热、声动力和示踪三种功能。在本发明的一种优选实施方式中,血清白蛋白选自人血清白蛋白、动物血清白蛋白或生物发酵方式获得的重组人血清白蛋白中的一种或几种,尤其是当血清白蛋白为人血清白蛋白时,成的金属-icg配合物白蛋白纳米颗粒的生物相容性更好。在本发明的一种优选实施方式中,动物血清白蛋白为鸡血清白蛋白或牛血清白蛋白,尤其是当动物血清白蛋白为牛血清白蛋白时,制成的金属-icg配合物白蛋白纳米颗粒的生物相容性更好。在本发明的一种优选实施方式中,金属-icg配合物和血清白蛋白的质量比为(1-5):(1-20)。通过控制金属icg配合物和血清白蛋白的质量比,以提高金属-icg配合物白蛋白纳米颗粒的药物包载率。尤其是当金属-icg配合物和血清白蛋白的质量比为1:15-20时,制备得到的金属-icg配合物白蛋白纳米颗粒的药物包载率更高。典型但非限制性的,金属-icg配合物和血清白蛋白的质量比如为1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19或1:20在本发明的一种优选实施方式中,血清白蛋白溶液中,血清白蛋白的浓度为1-20mg/ml。通过控制血清白蛋白的浓度为1-20mg/ml,以利于血清白蛋白对金属-icg配合物的包载。典型但非限制性的,血清白蛋白浓度如为1、2、5、10、12、15、18或20mg/ml。在本发明的一种优选实施方式中,金属-icg配合物溶液的浓度为1-5mg/ml。通过控制金属-icg配合物溶液的浓度,以利于提高金属-icg配合物白蛋白纳米颗粒的药物包载率。典型但非限制性的,金属-icg配合物溶液的浓度如为1、1.5、2、2.5、3、3.5、4、4.5或5mol/l。在本发明的一种优选实施方式中,超声破碎的时间为3-10min,优选为4-6min。通过控制超声破碎的时间,以在提高金属-icg白蛋白纳米颗粒药物包载率的基础上减少能源的浪费。典型但非限制性的,超声破碎的时间为3、4、5、6、7、8、9或10min,尤其是当超声破碎的时间为4-6min时,更利于提高金属-icg白蛋白纳米颗粒药物的包载率。根据本发明的第五个方面,本发明提供了金属-icg配合物或金属-icg白蛋白纳米颗粒在制备治疗肿瘤药物中的应用。上述肿瘤包括但不限于卵巢癌、子宫内膜癌、肾癌、乳腺癌、肺癌、结肠癌和鼻咽癌。根据本发明的第六个方面,本发明提供了一种治疗肿瘤的药物,包括本发明提供的金属-icg配合物或本发明提供的金属-icg白蛋白纳米颗粒。上述肿瘤包括但不限于卵巢癌、子宫内膜癌、肾癌、乳腺癌、肺癌、结肠癌和鼻咽癌。本发明提供的治疗肿瘤的药物兼具光热和声敏双重功能,能够有效提高治疗效果。下面结合实施例和对比例对本发明提供的技术方案做进一步的描述。实施例1本实施例提供了一种mn-icg配合物,其按照如下步骤制备得到:(1)将10mgicg溶解于10mln,n-二甲基甲酰胺(dnf)中,得到icg溶液;(2)将5mg四水合醋酸锰溶解于5ml甲醇溶液,得到醋酸锰溶液;(3)将醋酸锰溶液加入icg溶液中,紫外(uv)监测反应进行情况,1.5h后停止反应,向反应体系中加入50-60ml饱和食盐水,冷藏过夜后,收集沉淀,冻干得到mn-icg配合物。实施例2本实施例提供了一种mn-icg配合物,其与实施例1的不同之处在于,步骤(2)中,四水合醋酸锰的用量为2.5mg。实施例3本实施例提供了一种mn-icg配合物,其与实施例1的不同之处在于,步骤(2)中,四水合醋酸锰的用量为7.5mg。实施例4本实施例提供了一种mn-icg配合物,其与实施例1的不同之处在于,步骤(2)中,四水合醋酸锰的用量为10mg。实施例5本实施例提供了一种mn-icg配合物-白蛋白(mn-icg-hsa)纳米颗粒,其按照如下步骤制备得到:(1)称取实施例1提供的mn-icg配合物1mg溶解于200ul分析纯的氯仿中,得到mn-icg配合物溶液;(2)称取人血清白蛋白20mg溶解于4ml去离子水中,轻摇至全溶,得到人血清白蛋白溶液;(3)将mn-icg配合物溶液加入人血清白蛋白溶液中,超声破碎5min,去除有机溶剂,得到纳米体系;(4)在纳米体系中加入0.1mol/l的碳酸钠水溶液100μl,超声清洗5min,得到透明澄清纳米颗粒水溶液,超滤去除游离小分子,再用0.22μm的过滤筛过滤后,得到mn-icg白蛋白纳米颗粒,闭光保存备用。实施例6本实施例提供了一种mn-icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,步骤(2)中,人血清白蛋白的用量为1mg。实施例7本实施例提供了一种mn-icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,步骤(2)中,人血清白蛋白的用量为5mg。实施例8本实施例提供了一种mn-icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,步骤(2)中,人血清白蛋白的用量为15mg。实施例9本实施例提供了一种mn-icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,步骤(2)中,人血清白蛋白的用量为10mg。实施例10本实施例提供了一种mn-icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,步骤(2)中,人血清白蛋白的用量为0.5mg。实施例11本实施例提供了一种mn-icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,步骤(2)中,人血清白蛋白的用量为30mg。对比例1本对比例提供了一种icg-hsa纳米颗粒,其制备方法与实施例5的不同之处在于,采用icg代替mn-icg。试验例1分别测定实施例1-4提供的mn-icg配合物的产率,结果如表1所示。表1mn-icg配合物原料用量及产率数据表醋酸锰(mg)icg(mg)mn-icg配合物(mg)产率(%)实施例15101280实施例22.5101188实施例37.51013.577实施例410101575从表1中实施1-2和实施例3-4的对比可以看出,当icg和四水合醋酸锰的摩尔比为(1-2):1时,得到的mn-icg配合物的产率更高,能够达到80%以上。试验例2分别取实施例5-11提供的mn-icg-hsa纳米颗粒5ml于100kd的超滤管内,在5000rpm下离心5min,重复3次,分别收集滤液。分别精密量取上述7组滤液适量,分别用二甲基亚砜(dmso)稀释到适当的浓度后,在分别用紫外分光光度计分析,计算药物含量。另外分别精密亮区实施例5-11提供的mn-icg-hsa纳米颗粒0.5ml,分别用dmso稀释到适当浓度后,再分别用紫外分光光度剂分析,计算总药物含量,并计算包封率。同时分别精密量取实施例5-11提供的mn-icg-hsa纳米颗粒5ml,分别冻干后,分别称量7组纳米颗粒的重量,并计算7组纳米颗粒的载药率,结果见表2。表2mn-icg-hsa纳米颗粒数据表从表2可以看出实施例5和实施例9提供的mn-icg-hsa纳米颗粒在具有75%以上包封率的同时,具有高于4%的载药率,这说明,在制备mn-icg-hsa纳米颗粒时,mn-icg和人血清白蛋白的质量比为1:(15-20)时,制备得到的mn-icg-hsa纳米颗粒的药物包封率更高。试验例3分别将实施例5提供的mn-icg-hsa纳米颗粒及对比例1提供的icg-hsa纳米颗粒配置成能浓度为50μg/ml的水分散液,同时设置icg的水分散液和去离子水,其中以icg的浓度50μg/ml为定量;然后将上述4组溶液供分别与10μmol/l的2′,7′-二氯荧光素二乙酸盐(dcfh-da)荧光探针混合后,超声不同时间并取样。将超声后的4组不同时间段的样品溶液稀释相同倍数后,分别用多功能酶标仪检测活性氧的荧光强度,并记录4组水分散液超声不同时间点的荧光强度,图1为实施例5提供的mn-icg-hsa纳米颗粒、对比例1提供的icg-hsa纳米颗粒、icg溶液及去离子水在不同超声时间荧光强度的曲线图,其中,h2o代表去离子水;icg代表icg水分散液;icg-hsa代表对比例1提供的icg-hsa纳米颗粒溶液;mn-icg-hsa代表实施例5提供的mn-icg-hsa纳米颗粒的水分散液,flintensity代表荧光强度;ultrasoundirradiationtime代表超声时间。如图1所示,随着超声时间的延长,实施例5提供的mn-icg-hsa纳米颗粒产生的荧光强度明显增强,而去离子水溶液、icg溶液和对比例1提供的icg-hsa纳米颗粒随着超声时间的延长,仍无法检测到荧光强度,这说明实施例5提供的mn-icg-hsa纳米颗粒能够在超声作用下,产生活性氧簇(ros),且ros的数量随着超声时间的延长而明显增加,从而能够实现高效的声动力治疗。试验例2将处于对数生长期的乳腺癌细胞4t1,以5×103个/孔接种于96孔板中,每孔加入0.2ml细胞悬液,于37℃培养箱中(含5%co2)孵育24小时后,将实施例5提供的mn-icg-hsa纳米颗粒及对比例1提供的icg-hsa纳米颗粒分别用培养基稀释到10μg/ml、20μg/ml、30μg/ml、40μg/ml或50μg/ml浓度后,分别加入到细胞中,同时将icg溶液作为对照组也加入细胞中,继续孵育24小时后,加入cck8,1小时后在多功能酶标仪检测od(450)值,进而计算纳米颗粒的体外安全性。结果如图2所示,其中,icg代表icg水分散液;icg-hsa代表对比例1提供的icg-hsa的纳米颗粒的水分散液;mn-icg-hsa代表实施例5提供的mn-icg-hsa纳米颗粒的水分散液,cellviability代表细胞存活率;concentration代表浓度。从图2中可以看出,实施例5提供的mn-icg-hsa纳米颗粒的水分散液对细胞没有明显杀伤性,这说明实施例5提供的mn-icg-hsa纳米颗粒具有良好的安全性,不会对细胞造成损伤。试验例3将处于对数生长期的乳腺癌细胞4t1,以5×103个/孔接种于96孔板中,每孔加入0.2ml细胞悬液,于37℃培养箱中(含5%co2)孵育24小时后,将实施例5提供的mn-icg-hsa纳米颗粒及对比例1提供的icg-hsa纳米颗粒分别用培养基分别稀释到20μg/ml浓度后,加入到细胞中,同时将icg溶液作为对照组也加入细胞中,继续孵育24小时后,加入cck8,1小时后在多功能酶标仪检测od(450)值,以检测产生活性氧簇(ros)的数量,结果显示,实施例5提供的mn-icg-hsa纳米颗粒产生的ros的数量显著高于其它组,这说明实施例5提供的mn-icg-hsa纳米颗粒具有显著的声动力抗肿瘤效果,能够用于作为肿瘤的声动力治疗中的声敏剂。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1