心肌细胞制剂及其制备方法和应用与流程
本发明涉及细胞制剂技术领域,具体涉及一种心肌细胞制剂及其制备方法和应用。
背景技术:
心力衰竭是各种心脏疾病发展到晚期导致的心功能不全的病理现象,由于心脏的收缩功能或舒张功能发生障碍导致心室充盈或射血能力受损的一组临床综合症,临床表现为射血分数和心室短轴缩短率降低,心肌壁压力增加,心腔内径增大,左心室舒张期和收缩期的容积变大。
acc/aha将心力衰竭分为a、b、c、d四个阶段,a和b阶段指患者缺乏心衰早期症状,但存在有风险因素或心脏的异常,这些异常包括心脏形态和结构上的改变;c阶段指患者目前或既往有过心衰的症状,如气短等;d阶段是心力衰竭的严重阶段,称为终末期心力衰竭或难治性心力衰竭。
中国心力衰竭流行病学调查显示目前我国男性发病率为0.7%,女性发病率为1%,并且随着年龄的增长,心衰的发病率逐渐增高,如果出现心衰,患者会形成恶性循环,这也是老年人致死率极高的病症,随着中国老龄化社会现象的日益严重,心力衰竭会成为严重危害我国国民身体素质的原因之一。
目前治疗心力衰竭(心衰)的方法主要利用化学药物通过降低神经内分泌系统活性、阻断或改善因at1r过渡兴奋导致的不良作用或者消除心衰时的水钠潴留等手段来发挥治疗心衰的作用,但是临床实践表明,这些化学药物在治疗心衰的过程中均存在不同的不良反应,如低血压或肾功能恶化等。
随着干细胞技术的发展,该领域学者致力于研究如何通过干细胞移植治疗各种心脏疾病导致的终末期心力衰竭,但是对心功能的改善效果不明显,并且在后续安全性研究中发现注射机体后的干细胞存在成瘤性,不适于临床研究、治疗。
技术实现要素:
有鉴于此,本发明的目的一方面是提供了一种能有效增强心衰患者心脏功能并且安全可靠的心肌细胞制剂,所述心肌细胞制剂包括由多能干细胞分化的心肌细胞和成纤维细胞,其中,所述心肌细胞制剂中的心肌细胞浓度为0.75×107~1.0×109细胞/ml,所述心肌细胞含量高于80%且所述成纤维细胞含量不高于20%。
所述心肌细胞可以是由多能干细胞直接分化的心肌细胞,也可以是经由冻存复苏后的心肌细胞。
本发明实施例提供的心肌细胞制剂中心肌细胞浓度限定为0.75×107~1.0×109细胞/ml,该浓度不仅可以提高心肌细胞制剂中的细胞存活率,同时也使得所述心肌细胞制剂能够有效增强心衰患者的射血分数和左心室缩短分数,增加心室壁厚度,改善心衰患者心脏功能。另外,本发明研究者通过大量实验发现心肌细胞制剂中含有一定量的成纤维细胞有助于改善心衰患者的心脏功能,当心肌细胞制剂中成纤维细胞的含量不高于20%,所述心肌细胞制剂能有效提高心脏的射血分数,当成纤维细胞的含量高于20%时,射血分数的改善不明显甚至随着成纤维细胞含量的增加而降低。
由于本发明实施例限定了心肌细胞制剂中心肌细胞的含量高于80%,因此在一定程度上限缩了心肌细胞制剂中多能干细胞的含量,降低多能干细胞的成瘤性,在保证心肌细胞制剂提高心衰患者心脏功能的同时也提高细胞制剂的安全性。
优选的是,所述心肌细胞制剂中,所述心肌细胞的浓度为0.5×108~1.2×108细胞/ml。当心肌细胞制剂中的心肌细胞浓度在该范围内时,所述心肌细胞制剂具备更好的改善心衰患者心脏功能的作用。
优选的是,所述心肌细胞制剂中,多能干细胞残留量不高于1%,具体表现为所述心肌细胞制剂中阳性表达nanog、ssea4和oct3/4的细胞含量不高于1%。
本发明实施例提供的多能干细胞残留量超过30%的心肌细胞制剂可能具有成瘤性,为了消除心肌细胞制剂在使用过程中存在的安全隐患,根据大量体内体外实验数据,将心肌细胞制剂中多能干细胞的含量控制在1%以内则能够有效消除心肌细胞制剂的成瘤性。
进一步优选的是,所述心肌细胞制剂中,多能干细胞残留量不高于0.3%,具体表现为所述心肌细胞制剂中阳性表达nanog、ssea4、oct3/oct4的细胞含量不高于0.3%。
另一方面,本发明实施例提供了一种所述的心肌细胞制剂的制备方法,所述心肌细胞由多能干细胞经以下步骤制备而成:
多能干细胞预处理步骤:将所述多能干细胞以0.9×105~3.0×105细胞/cm2接种至多能干细胞培养基中,并在5%co2、37℃条件下培养至密度超过40%以上;
心肌细胞分化的步骤:吸除所述多能干细胞培养基,加入含有浓度为0.01~0.09mm的chir99021的心肌细胞分化培养基培养48h,将培养基更换为含有浓度为0.01~0.05mm的iwr-1的心肌细胞分化培养基继续培养48h,再用心肌细胞分化培养基继续培养,并且根据细胞生长状态更换心肌细胞分化培养基;
心肌细胞纯化的步骤:经心肌细胞分化步骤的细胞继续培养至出现可观察到的跳动时,将细胞以6.0×105~9.0×105细胞/cm2的密度接种在心肌细胞分化培养基中,用心肌细胞纯化液将成纤维细胞的含量调整至小于20%。
优选的是,所述心肌细胞制剂的制备方法中,所述多能干细胞包括诱导多能干细胞和胚胎干细胞。
进一步优选的是,所述心肌细胞制剂的制备方法中,所述心肌细胞纯化的步骤还包括将细胞在含有浓度为0.75~5μm的stf-31的心肌细胞培养基中培养2~5天。stf-31可以去除心肌细胞分化步骤中未分化的多能干细胞,提高心肌细胞的纯度,通过改变stf-31的浓度或纯化时间可以控制细胞中多能干细胞的含量。
更进一步优选的是,所述心肌细胞制剂的制备方法中,心肌细胞纯化步骤得到的细胞和生理盐水在无菌条件下配制成心肌细胞浓度为0.75×107~1.0×109细胞/ml的细胞悬液。
由多能干细胞制备的心肌细胞分别经心肌细胞、多能干细胞以及成纤维细胞含量检测后可根据实际需要来选择生理盐水的添加量以控制心肌细胞的浓度。
另一方面,本发明实施例还提供了一种心肌细胞制剂在制备用于治疗心力衰竭药物方面的应用。
优选的是,所述心肌细胞制剂在制备用于治疗心力衰竭药物方面的应用中,所述心肌细胞制剂用于治疗hfref。本发明实施例提供的心肌细胞制剂对于hfref型心衰患者心脏功能的改善优于其对hfpef型心衰患者心脏功能的改善。
进一步优选的是,所述心肌细胞制剂在制备用于治疗心力衰竭药物方面的应用中,所述心肌细胞制剂通过注射器经心外膜注射至瘢痕或心肌壁薄弱区。
本发明实施例提供的心肌细胞制剂具有以下有益效果:在本发明实施例提供的浓度范围内的心肌细胞制剂能够有效缓解心衰患者心脏射血分数下降程度、提高左心室缩短分数、增加心室壁厚度,改善心功能,并且所述心肌细胞制剂不存在成瘤性;本发明实施例提供的心肌细胞制剂的制备方法步骤简单,重复率高,适用于大规模生产。
附图说明
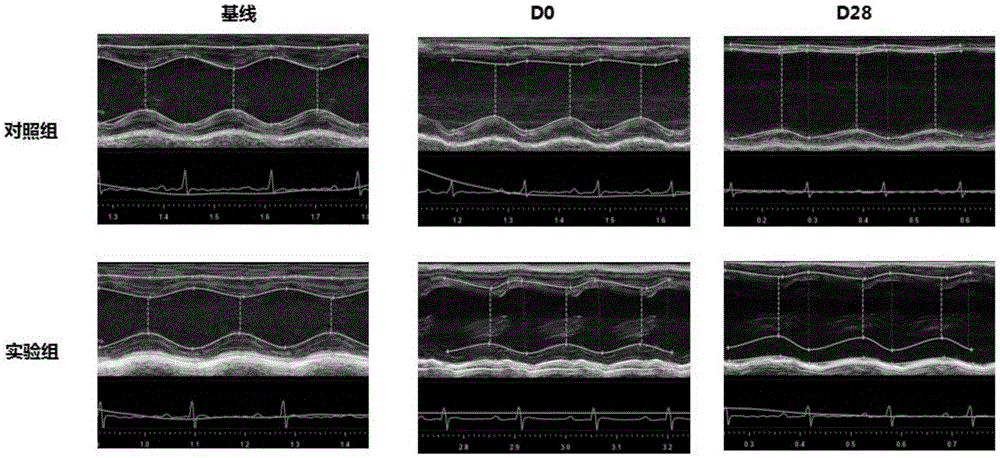
图1为实施例3的对照组和实验组分别在建立心衰模型前(基线)、d0和d28的左室短轴m型超声结果,其中对照组心衰模型随着时间的延长,左心室前壁变薄,实验组在d28的左心室前壁厚度大于对照组d28的左心室前壁厚度;
图2为实施例3的心肌细胞制剂相对于对照组对心衰模型射血分数的影响及射血分数变化量,其中图2a为实施例3的对照组和实验组分别在心衰模型建立之前(基线)、d0和d28三个时期的射血分数,图2b分别为实验组和对照组d28的射血分数相对于d0射血分数的变化量,实验组中d28的射血分数相对于d0升高,射血分数变化量为8.31%;
图3为实施例3的对照组和实验组分别在心衰模型建立之前(基线)、d0和d28三个时期的左心室短轴缩短率,实验组相对于对照组在d28的左心室短轴缩短率升高;
图4为实施例3的心肌细胞制剂相对于对照组对心衰模型左心室收缩末期内径和左心室收缩末期容积的影响,其中图4a为实施例3的对照组和实验组分别在心衰模型建立之前(基线)、d0和d28三个时期的左心室收缩末期内径,图4b为实施例3的对照组和实验组分别在心衰模型建立之前(基线)、d0和d28三个时期的的左心室收缩末期容积,实验组的左心室收缩末期内径和左心室收缩期容积相对于对照组在d0到d28的过程中没有继续增加,心力衰竭程度得到遏制;
图5为实施例3的对照组和实验组分别在心衰模型前(基线)、d0和d28三个时期的收缩末期左心室前壁厚度,对照组d28的收缩末期左心室前壁厚度相对于d0变薄,而实验组d28的收缩末期左心室前壁厚度相对于d0增加;
图6为实施例7的对照组和实验组分别在心衰模型建立之前(基线)、d0和d28三个时期的射血分数,其中对照组d28的射血分数相对于d0降低,而实验组中d28的射血分数相对于d0升高,射血分数变化量为22.99%。
本发明实施例中所述及的基线是大鼠在心衰建模前的心功能状况,其反映了大鼠正常的心功能状态;
d0是对照组或实验组的心衰模型接受注射前的数据,其反映了心衰模型大鼠的心功能;
d28是对照组或实验组心衰模型接受注射28天后的数据,其反映了心衰模型大鼠的心功能,结合d0的数据用以评估心衰模型心功能变化情况。
具体实施方式
除非另有定义,否则本文所使用的所有技术和科学术语具有如本发明实施例所属领域的普通技术人员通常理解的相同含义。本文所使用的术语仅用于描述特定的实施例,并非旨在对本发明进行限制。
为了更清楚地理解本发明,规定以下术语:
多能干细胞培养基是指用于培养、扩增多能干细胞(包括诱导多能干细胞和胚胎干细胞)的培养基。多能干细胞最初采用的培养条件需要明胶包被还需要小鼠胚胎成纤维细胞(mef)作为饲养层,传统培养基还采用成分复杂的敲除血清替代品(kosr)作为主要的培养基添加剂;随着技术的不断优化,基础培养基和添加剂被组合用来培养多能干细胞,基础培养基包括但不限于dmem/f12,其他含有一定葡萄糖浓度并且具有干细胞生长所需的必须氨基酸的培养基也可以作为基础培养基,添加剂包括但不限于碳酸氢钠、重组人碱性成纤维细胞生长因子、重组人乳铁蛋白、胰岛素、抗坏血酸、重组人转化生长因子等;本发明实施例采用的多能干细胞培养基不限于以上所述的各种培养基,本领域技术人员所熟知的一切能够用于培养多能干细胞的培养基均应包括在本发明的保护范围内。
心肌细胞培养基是指用于给心肌细胞提供营养并能维持心肌细胞功能的培养基。
心肌细胞在本发明中指的是由多能干细胞分化而来的能特异性表达ctnt的细胞。
多能干细胞残留量在本发明中指是在由多能干细胞分化心肌细胞的细胞产物中,未分化的多能干细胞的数量占细胞总量的百分比。
射血分数(ef)是指心室每博输出量占心室舒张末期容积量的比例,从容积的角度反映心室的射血功能,可通过心脏彩超进行检查,射血分数与心肌的收缩能力有关,心肌收缩能力越强,射血分数也越大。
本发明实施例中每只心衰模型鼠在注射心肌细胞制剂时心功能状态(选择射血分数为评价指标)各异,为了客观评价心肌细胞制剂对心功能的影响,引入射血分数变化量的概念:
射血分数变化量=心肌细胞制剂治疗后的射血分数—注射心肌细胞制剂之前的射血分数
hfref是指射血分数下降的心衰,该类型的心衰患者根据体征和左室射血分数(lvef)作为主要诊断指标,其lvef≤40。
hfpef是指射血分数保留的心衰,左室舒张期主动松弛能力受损和心肌顺应性降低,导致左室舒张期充盈受损,心博量减少,左室舒张末压增高而发生心衰的症状和体征,左室射血分数(lvef)大致正常,其lvef≥50。
下面结合说明书附图进一步描述本发明的具体实施方式,然而,本发明可以体现为不同形式,且不应该被理解为限于本文所阐述的实施例。相反,提供这些实施例使得本发明更加完整,且将本发明的范围完全传达至本领域技术人员。
一、心肌细胞制剂的制备方法
1、多能干细胞分化为心肌细胞的方法;
多能干细胞预处理步骤:将胚胎干细胞(esc)或诱导多能干细胞(ipsc)分别以0.9×105细胞/cm2、1.5×105细胞/cm2以及3.0×105细胞/cm2接种到多能干细胞培养基中,并于5%co2、37℃条件下培养至密度超过40%以上。其中多能干细胞培养基为tesrtm-e8tm培养基。多能干细胞的接种密度影响多能干细胞的生长速度,为了整体提高多能干细胞的分化效率,本发明实施例采用0.9×105~3.0×105的接种密度。
多能干细胞培养基还可以是在dmem/f12基础培养基里添加适量的重组人胰岛素、重组转铁蛋白、人白蛋白、柠檬酸铁、bfgf、egf、tgf-β、l-抗坏血酸和β-巯基乙醇以制备成适合多能干细胞生长的环境。
心肌细胞分化步骤:多能干细胞密度超过40%以上时,吸除多能干细胞培养基,加入含有chir99021的心肌细胞分化培养基培养48h后,将培养基更换为含有iwr-1的心肌细胞分化培养基,培养48h后用心肌细胞分化培养基继续培养,并每隔48h换液,细胞培养至可观察到跳动时检测其心肌细胞及成纤维细胞的含量,其中本发明实施例提供的心肌细胞分化培养基为rpmi1640培养基中添加无胰岛素的b27(rpmi1640培养基和b27的量为100:2),本发明实施例中的心肌细胞培养基也可以为其他可用于将多能干细胞分化为心肌细胞的培养基。
当chir99021的终浓度为0.01~0.09mm时且iwr的终浓度为0.01~0.05mm时,心肌细胞的分化效率相对较高;为了进一步提高心肌细胞的分化效率,在心肌细胞分化6天以后可以添加促成熟的因子如含胰岛素的b27。多能干细胞培养密度超过40%时,对心肌细胞的分化效率没有显著影响,为了降低生产成本,本发明实施例可采用多能干细胞培养密度达到40%时进行心肌细胞分化步骤。
心肌细胞纯化步骤:随着细胞在心肌细胞分化培养基中培养时间的延长,多能干细胞的含量减少,而心肌细胞及成纤维细胞的含量增加。为了进一步控制成纤维细胞的含量则需要对上述步骤制备的细胞进行纯化:用accutase消化上述步骤制备的细胞并离心后加入以上步骤中的心肌细胞分化培养基制备成浓度为6.0×106~9.0×106细胞/ml的细胞悬液,以6.0×105~9.0×105细胞/cm2的密度接种至含有心肌细胞分化培养基并且用matrigel包被的细胞培养皿中,用心肌细胞纯化液进行纯化,每隔48h更换心肌细胞纯化液,其中心肌细胞纯化液为含有终浓度分别为1μm的胞嘧啶β-d-呋喃阿拉伯糖苷和0.02m的乳酸钠的dmem无糖培养基,随着纯化时间的延长,成纤维细胞的含量逐渐降低,当成纤维细胞的含量满足本发明实施例的心肌细胞制剂的要求时,可终止纯化。
以上纯化步骤还包括根据多能干细胞的含量将心肌细胞分化步骤或心肌细胞纯化步骤中制备的细胞在含有浓度为0.75~5μm的stf-31的心肌细胞培养基中培养2~5天,随着在含有stf-31的心肌细胞培养基中纯化时间的延长,多能干细胞的含量逐渐降低,根据实际需要选择合适的stf-31的浓度和纯化时间。
利用免疫荧光法对制备的细胞进行鉴定,以上操作均在无菌条件下进行。
其他为本领域技术人员所知的多能干细胞分化为心肌细胞的方法以及纯化心肌细胞中多能干细胞或成纤维细胞的方法同样适用于本发明。
2、心肌细胞制剂的制备方法
本发明实施例采用注射液将多能干细胞分化的细胞配制成不同心肌细胞浓度的心肌细胞制剂,具体方法如下:
通过心肌细胞分化步骤和纯化步骤中对心肌细胞纯度、成纤维细胞纯度及多能干细胞残留量的检测,根据实际需要控制心肌细胞分化和纯化步骤的参数以调整心肌细胞及成纤维细胞的含量,并尽可能减少残留多能干细胞的数量,本发明实施例采用流式细胞技术检测以上三种细胞的含量:
心肌细胞纯度的检测:待测细胞经过计数后用4%pfa固定,再以dpbs制备成100μl浓度为1×107细胞/ml的细胞悬液,离心后加入70μl浓度为1%的bsa和20μl的fcrblockingreagent于室温条件下封闭30分钟后,加入10μl的anti-cardiactroponint-fitc混匀后于室温条件下避光孵育30分钟,dpbs清洗离心后进行流式细胞仪分析。其中对照组用80μl浓度为1%的bsa和20μl的fcrblockingreagent进行孵育。
成纤维细胞纯度的检测:待测细胞经过计数后用4%pfa固定,再以dpbs制备成100μl浓度为1×107细胞/ml的细胞悬液,离心后加入75μl浓度为1%的bsa和20μl的fcrblockingreagent于室温条件下封闭30分钟后,加入5μl的anti-humanvimentinalexa488混匀后于室温条件下避光孵育30分钟,dpbs清洗离心后进行流式细胞仪分析,其中对照组用80μl浓度为1%的bsa和20μl的fcrblockingreagent进行孵育。
多能干细胞残留量的检测:待测细胞经过计数后用4%pfa固定,再以dpbs制备成100μl浓度为1×107细胞/ml的细胞悬液,离心并封闭后分别用稀释后的抗体:anti-ssea-4-pe、pemouseanti-humannanog和pemouseanti-oct3/4孵育后,用流式细胞仪进行分析。
根据本发明实施例提供的心肌细胞纯化步骤,在心肌细胞纯化液中纯化第7天的心肌细胞纯度为71.49%,成纤维细胞的纯度为22.38%,多能干细胞残留量为4.2%,延长细胞在心肌细胞纯化液中的纯化时间至12天并将纯化后的细胞在含有浓度为0.75~5μm的stf-31的心肌细胞培养基中培养2天,用流式细胞技术分别检测心肌细胞纯度、成纤维细胞纯度及多能干细胞残留量,其中,心肌细胞的纯度为94.42%,成纤维细胞的含量为3.15%,诱导多能干细胞的残留量为0.53%。
用注射级的生理盐水将上述细胞制备成细胞悬液并对细胞悬液中的心肌细胞进行计数,通过调整生理盐水的添加量以控制细胞悬液中心肌细胞的浓度,选择合适心肌细胞浓度的细胞悬液作为心肌细胞制剂。
本发明实施例除了用生理盐水作为注射液,还分别提供以下注射液用作心肌细胞制剂的配制:
(1)浓度为5%的人血清白蛋白;
(2)dmso,has,15%葡萄糖,右旋糖酐40葡萄糖注射液,和生理盐水以7.5:20:30:10:32.5的体积比混匀的混合溶液。
其中本发明实施例使用的人血白蛋白购于baxter,dmso购于sigma,has购于贵州邦泰,右旋糖酐40葡萄糖注射液购于四川科伦。无论心肌细胞制剂采用何种溶液配制,心肌细胞均作为制剂的主要有效成分。
3、不同浓度心肌细胞制剂中细胞的活率
心肌细胞制剂样品的制备:将由上述分化步骤的细胞制备成细胞悬液后进行心肌细胞、多能干细胞和成纤维细胞的含量检测,将符合心肌细胞含量高于80%,成纤维细胞含量不高于20%且多能干细胞残留量不高于1%的细胞根据心肌细胞的数量以生理盐水在无菌条件下制备成以下心肌细胞浓度(细胞/ml)的心肌细胞制剂:0.5×107,0.75×107,0.3×108,0.5×108,1.2×107,0.75×109,1.0×109以及3.0×109。
细胞活率的检测:分别取5ml上述浓度的心肌细胞制剂用0.2%的台盼蓝染色后利用countstar进行细胞活率测定,将上述浓度的心肌细胞制剂在4℃冰箱保存4h后采用同样的方法测定细胞活率,结果如表1所示。
表1:心肌细胞浓度对细胞活率的影响
表1分别列出制备的不同浓度的心肌细胞制剂的细胞活率以及不同浓度的心肌细胞制剂在4℃保存4h后的细胞活率,由表1可以看出心肌细胞的浓度会影响细胞的活率,浓度越高,细胞的活率降低幅度越大,根据心肌细胞制剂在四个小时内的细胞活率,考虑心肌细胞制剂从制备到使用的过程,心肌细胞的浓度应选择1.0×109以下以尽量避免心肌细胞的损失。
二、动物实验
1、大鼠心衰模型的建立
大鼠心梗后心衰模型的制备原理是通过使大鼠心肌坏死,室壁运动及顺应性减弱,心功能由代偿转为失代偿并最终形成心力衰竭的过程,现阶段应用较多的方法是冠状动脉结扎法,其中,结扎位置过高容易引起大鼠死亡,结扎过低则梗死面积较小。
本发明实施例通过以下操作进行心衰模型的建立:大鼠麻醉后,经口插管连接小动物呼吸机,开胸视野下结扎冠状动脉左前降支。术后需每天经由腹腔注射青霉素160iu/kg,连续注射3~5天。
超声心动图是一种无创的评价心功能的手段,可以动态观察动物心功能,本发明实施例选择左室收缩末期内径(lvesd)、左室收缩末期容积(lvesv)、收缩末期左心室前壁厚度(lvaw)、左室射血分数(ef)和左室短轴缩短率(fs)作为心功能评价指标。
冠状动脉结扎后的大鼠饲养2~6周后,利用超声心动图检测其左室射血分数(ef),ef<40%的大鼠符合实验入选标准,可作为成功的心衰模型。
2、不同浓度心肌细胞制剂对心功能改善的结果
本发明所述的心肌细胞制剂根据心衰对象优选由同种异体来源的多能干细胞制备而成,经研究发现,在心衰模型中注射相同数量的心肌细胞的前提下,心功能的改善程度随着心肌细胞制剂中心肌细胞的浓度变化而呈现不同的结果,为了进一步了解心肌细胞的浓度对治疗效果的影响,根据如上所述的由生理盐水制备心肌细胞制剂的方法选择如表2所示的心肌细胞制剂经大鼠心外膜注射至瘢痕区或心肌壁薄弱区,并在注射后每天通过灌胃的方式给予大鼠15mg/kg的环孢素a和2mg/kg的甲强龙以抗免疫排斥,利用超声心动图观测心衰模型的心功能恢复情况。
本发明实施例中心肌细胞制剂可以由诱导多能干细胞分化也可以由胚胎干细胞分化,两种来源的心肌细胞制剂对心衰模型心功能的改善没有显著差异,以下实施例采用由诱导多能干细胞分化的心肌细胞制备心肌细胞制剂。
表2:不同心肌细胞制剂对心衰模型射血分数变化量的影响情况
其中,以相同注射方式在心衰模型大鼠心脏中注射和实验组(实施例1~12)相同剂量的生理盐水并以相同方式给予抗免疫排斥药物作为对照组,对照组和实验组同时利用超声心动图观测反映心功能的各参数,本发明实施例中射血分数变化量选择d28射血分数和d0射血分数的差值。
其中实验组中各实施例注射细胞总量相同,并且根据各实施例中心肌细胞的浓度选择合适的注射剂量,例如各实施例注射细胞总量为1.2×106个细胞,实施例6中心肌细胞浓度为1.2×108细胞/ml,在实施例6中注射10μl的心肌细胞制剂以达到1.2×106个细胞的总注射量。
表2中的射血分数变化量是注射心肌细胞总量为1.2×107个细胞的实验组在心肌细胞制剂注射28天后的射血分数和心肌细胞注射之前射血分数的差值,图1显示了对照组随着时间的延长左心室前壁变薄,左心室内径和左心室容积随着时间的延长均有一定程度的增大,心功能衰退;而实验组相d28的心功能优于对照组d28的心功能。本发明实施例提供的心肌细胞制剂能有效的降低心功能衰退程度。
图2和图6分别为表2中实施例3和实施例7的心肌细胞制剂对射血分数的影响,表2显示不同浓度的心肌细胞制剂对心功能的改善程度不同,其中,实施例7中心肌细胞浓度在1.2×108个细胞/ml且成纤维细胞的含量为10%的心肌细胞制剂对射血分数的改善效果最好。图3显示对照组的左室短轴缩短率随着时间的延长而下降,而实验组在注射心肌细胞28天后的左室短轴缩短率高于心肌细胞注射前,可说明心肌细胞制剂注射后心功能得到恢复。
图4和图5分别显示了未接受细胞治疗的心衰模型随着时间的延长左心室收缩末期内径和左心室收缩末期容积变大,收缩末期左心室前壁厚度变薄,而实验组在接受心肌细胞制剂治疗28天后左心室收缩末期内径和左心室收缩末期容积未继续扩增,且收缩末期左心室前壁厚度在细胞治疗后有一定程度的增加,因此根据对评价心功能各指标的观测可以说明心肌细胞制剂可以在一定程度上提高心肌收缩力,增加心室壁张力,改善心功能,
本发明实施例还分别研究了在给予心衰模型心肌细胞总量为7.5×106个心肌细胞以及心肌细胞总量为2.0×108个心肌细胞的实验中心肌细胞浓度对心功能的影响。其中在保证每组实验中每只心衰模型注射总量确定的前提下(注射相同心肌细胞总量的实施例为一组),心肌细胞制剂的注射方式可以一次注射,也可以多次注射,多组实验结果均表明心肌细胞的浓度影响心功能的改善程度,不同组实验中心功能改善程度随着心肌细胞浓度的变化和在注射心肌细胞总量为1.2×107个心肌细胞实验组的结果一致,在实际治疗心力衰竭过程中,需要根据心衰对象及心衰的严重程度选择合适的注射剂量及合适心肌细胞浓度的心肌细胞制剂。
三、心肌细胞制剂成瘤性检测
成瘤性是指细胞接种动物后,接种细胞在动物体内形成肿瘤的过程,本发明实施例分别采用裸鼠体内成瘤性实验和软琼脂克隆实验来评价心肌细胞制剂的成瘤性,本发明实施例分别研究了诱导多能干细胞来源的心肌细胞制剂和胚胎干细胞来源的心肌细胞制剂的成瘤性检测,其中用hela细胞作为阳性对照。成瘤性检测样本的参数分别如表3、表4所示。
表3:诱导多能干细胞来源的心肌细胞制剂成瘤性检测的样本参数
胚胎干细胞来源的心肌细胞制剂中多能干细胞残留也可能有成瘤性,表4列出了心肌细胞制剂中不同残留量的多能干细胞的成瘤性检测样本。
表4:胚胎干细胞来源的心肌细胞制剂成瘤性检测的样本参数
以上实施例中心肌细胞制剂中成纤维细胞的含量均为10%。
1、裸鼠成瘤实验
将裸鼠随机分为检测组、空白对照组和阳性对照组,根据表3和标4列出的检测样本作为检测组、生理盐水作为空白对照组以及用浓度为1.8×106细胞/ml的hela作为阳性对照,于裸鼠颈后背部皮下进行细胞接种,接种量均为0.2ml,每组实施例做5组平行试验,定期观察接种裸鼠接种部位情况。
结果显示,空白对照组和实施例13~22,实施例24~33在接种后六个月内均未见肿瘤形成,接种部位没有结节形成,成瘤率为0,实施例23的五组平行试验中,其中一只裸鼠于接种的第28天在接种部位触摸到质韧的小结节,在接种两个月后,该裸鼠背部可见明显肿块,该心肌细胞制剂的成瘤率为1/5。
2、软琼脂克隆形成实验
将1.2%琼脂糖与多能干细胞培养液按1:1混合,向6cm培养皿加入5ml作为底层琼脂,将0.5%琼脂糖与多能干细胞培养液按1:1混合作为上层琼脂,对实施例13~33的心肌细胞制剂进行细胞计数及活细胞检测,分别取1ml实施例13~33的心肌细胞制剂加入5ml上层琼脂后缓缓注入培养皿中,设置空白对照和浓度为1.8×106细胞/ml的hela细胞作为阳性对照,将双层软琼脂培养皿至于37℃、5%co2的孵箱中培养30天,于显微镜下观察细胞克隆形成的情况,并计算细胞集落克隆率。
细胞集落克隆率=(细胞集落数÷每孔中加入的细胞数)×100%
软琼脂细胞克隆形成实验是模拟活体内细胞外基质的半固体生长环境,进行体外检测细胞集落生长潜力的常用的实验方法,肿瘤细胞能无限增殖,表现出很强的克隆能力,而成熟分化的细胞则不能形成集落。根据这一特点,本发明实施例通过对比不同多能干细胞残留量的心肌细胞制剂的细胞集落克隆率来评价心肌细胞制剂的成瘤性。
阳性对照组的细胞集落克隆率为5.1%,空白对照组以及实施例16、17、21、22、26、27、31、32、33没有集落形成,而其余实施例均存在不同细胞集落数,并且细胞集落克隆率随着多能干细胞残留量的增加而变大。
综合裸鼠成瘤实验和软琼脂克隆形成实验,心肌细胞制剂中多能干细胞的残留量应控制在1%以内以确保心肌细胞制剂的安全性。
需要指出的是,以上实施例仅用于对本发明做进一步的说明,但本发明的实施方式并不受上述实施例的限制,其他任何在本发明基础上做出和本发明本质上相同的改变、修饰、替换、组合应视为等同的置换手段,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!