确定心脏介入治疗后血液动力功能不全的风险的系统和方法与流程
本发明涉及经导管结构心脏介入治疗的手术前计划领域,例如像瓣膜植入和/或修复这样的瓣膜治疗。更具体的,本发明涉及在手术前预测经导管瓣膜治疗后患者产生血液动力功能不全的风险。
背景技术:
心脏的左心室将血液经主动脉瓣膜泵入到主动脉中。当主动脉瓣膜由于瓣叶钙化、变厚和变硬不能完全打开时,产生主动脉(瓣膜)狭窄的病症,结果导致从心脏流入体循环的血流减少。主动脉狭窄主要出现在年纪大的人群中,在65岁以上人群中患病率在1.3%以上,在85岁以上人群中患病率在4%以上。如今其在西方世界已成为最常见的心脏瓣膜疾病之一,而且其患病率在老年人中不断增加。
传统的主动脉狭窄治疗是外科主动脉瓣膜置换术(savr),其目的在于用植入的瓣膜再现原生瓣膜的精确功能。这种侵入性的手术需要完全麻醉,胸骨切开术(心脏切开手术)和心肺分流术(泵入血浆并用外部机器充氧),并且伴随有在65岁以上老年患者中大约6%的住院死亡率。此外,患有严重主动脉狭窄的患者中至少有三分之一由于手术伴随风险过高而拒绝瓣膜手术治疗。
经导管主动脉瓣膜植入术(tavi)或经导管主动脉瓣膜置换术(tavr)是一种用于治疗主动脉狭窄的微创手术:(1)瓣膜(例如由缝合在金属支架上的猪心包制成的要造生物瓣膜)被卷曲置入导管中,(2)导管被插入,例如,股动脉中,(3)沿主动脉向上游推动到主动脉瓣环并且(4)新的瓣膜被放置到有病症的原生瓣膜中。使用可以在例如80分钟之内完成的微创介入治疗(无需心脏切开手术或心肺分流术),tavi具有治疗高风险患者并取代savr的潜能。tavi的主要并发症是血管损伤、中风、心脏损伤(心脏传导阻滞、冠状动脉阻塞、心脏穿孔)、主动脉回流、心脏传导异常和瓣膜异位。精确的手术前计划对于选择最佳装置尺寸并预测潜在困难是至关重要的。
减少瓣膜植入体的尺寸会导致瓣周主动脉回流,而增大尺寸会导致主动脉环破裂或植入体表现次优功能(例如:中央回流)或传导紊乱或者冠状动脉阻塞。目前可用的计划工具(飞利浦、西门子、派医疗、paeion)提供进入患者体内的检查并且可以,例如,用于确定主动脉环的尺寸,或者测量瓣膜平面与冠状动脉口之间的距离。这些工具的一个问题是它们不能提供某个植入体装置和特定患者人体之间的相互作用的手术前检测,从而也不能用于预测诸如回流的并发症。这种检测对于介入心脏病医生来说是非常重要的。
文件us2011/0153286a1公开了一种虚拟经皮瓣膜植入的方法和系统。在该申请的一个实施例中基于3d心脏医学图像数据估算出了心脏瓣膜的患者特异解剖模型。代表瓣膜植入体的植入体模型被虚拟地放置到心脏瓣膜的患者特异解剖模型中。可保持植入体模型资料库,其中每一个模型对相应的瓣膜植入体的几何特性进行建模。资料库中保持的植入体模型可以被虚拟的放置到心脏瓣膜的患者特异解剖模型中从而在可植入体模型中选择一个用于经皮瓣膜植入手术。
us2011/0153286a1没有提供患者特异主动脉根、升主动脉和主动脉瓣膜小叶的机械特性以及它们与瓣膜植入体放置之间的相互作用的预测。该文件也未考虑主动脉瓣膜小叶钙化。还未提供被放置到主动脉瓣膜中的植入体的血液动力表现的研究方法。气球膨胀装置的展开是基于金属的永久塑性变形,因此无法建模。需要获得更精确的瓣膜尺寸和位置。问题在于主动脉环不是圆环,主动脉环会发生变形并且钙化沉积物会使得瓣膜支架变形。另一个问题是tavi后通过计算机断层(ct)成像显现出的主动脉根会发生形状和尺寸的变化。并且经导管主动脉瓣膜(tav)支架框架的几何尺寸会受到主动脉根的硬度、钙化区域硬度和装置实际位置的影响。
次优的治疗方案会有两个社会经济影响。一方面会使得医疗系统成本上升。如果选择了不正确的tav的装置/尺寸,第一次tavi手术会失败并需要额外的治疗,包括第二次tavi手术(瓣膜内瓣膜)、savr,或者需要再次住院治疗,这造成每个患者的医疗费用都显著增加。作为参考,单独的tavi手术花费大概是40k欧元并且支架瓣膜本身的花费大概是20k欧元。另一方面会导致预后较差。次优治疗方案可能会导致围手术期的并发症,这些对患者的生活质量和寿命预期都会产生影响。尺寸过大的瓣膜可能会使得主动脉环破裂或者使主动脉裂开而尺寸过小的瓣膜会移动并移位或者可能造成瓣周回流。
在wo2013/171039a1中,其发明人描述了一个能克服至少部分上述缺点的解决方案。wo2013/171039a1提供了一种改进方法,所述方法用于在手术前检测植入体装置和患者特异解剖结构的相互作用,用于更好地预测例如回流的并发症,更好地预测放置到主动脉瓣膜中的植入体的血液动力表现,并更好的进行患者选择和分化。并且,文件wo2013/171039a1提供一种基于网络的tavi手术前计划服务,利用计算机模拟来预测支架框架变形和框架的不完全同位,允许进行回流和其他并发症的风险评估,其中其他并发症例如冠状动脉阻塞和介入治疗前的传导异常。
在wo2016/177647a1中,其发明人描述了用于确定由于经导管结构心脏介入治疗引起的患者产生心脏传导异常和/或障碍的风险的量值,其中心脏传导异常和/或障碍例如左束支传导阻滞(lbbb),经导管结构心脏介入治疗例如经导管心脏瓣膜植入/置换或修复。
技术实现要素:
经导管二尖瓣膜置换,tmvr,可能导致左心室流出道lvot阻塞,使得流向主动脉的血液可显著地减少。tmvr还可能导致冠状动脉左旋支lcx的压缩/阻塞,和/或冠状动脉窦。据发现有二尖瓣膜瓣环钙化的患者经过tmvr后发生lvot阻塞的大概占患者的10%。由于钙化的原生小叶向冠状动脉口的移动或者由于tav本身的存在,tavi可能导致冠状动脉阻塞。经过tavi后产生冠状动脉阻塞的情况占病例的0.5-1%。
这样,经导管心脏瓣膜植入/置换或修复可导致血液动力功能不全。所述血液动力功能不全可以是瓣膜植入其中的主要血液流动路径的阻塞。所述阻塞能导致植入装置上的血压的降低(梯度下降)。所述血液动力功能不全可以是与主要血液流动路径连通的次级血液流动路径的阻塞,例如在植入装置的位置。所述血液动力功能不全可以是主要血液流动路径中发生的渗漏(或回流)。
因此,需要预测因瓣膜治疗引起的血液动力功能不全,例如阻塞和/或者渗漏。因此,医生可以在手术前预测例如瓣膜置换的手术是否会导致诸如相邻血液流动路径的阻塞这样的并发症,以及并发症的程度如何,其中相邻血液流动路径例如lvot、lcx、冠状动脉窦或冠状动脉。
根据所提供的方法的一个方面,所述方法是用于预测因例如经导管心脏瓣膜治疗的经导管结构心脏介入治疗引起的血液动力功能不全的量值。所述治疗可以是经导管瓣膜植入/置换或经导管瓣膜修复。所述经导管心脏瓣膜可以例如是经导管主动脉瓣膜或二尖瓣膜或三尖瓣膜。所述方法包括提供代表心脏植入体之三维表征的植入体模型,所述心脏植入体例如心脏瓣膜植入体,该心脏瓣膜植入体例如主动脉瓣膜植入体或者二尖瓣膜植入体。所述植入体模型可代表经导管二尖瓣膜,tmv,或者经导管主动脉瓣膜,tav,或者经导管三尖瓣膜的三维表征。所述植入体模型可以是心脏植入体的有限元件代表。所述方法包括提供代表例如患者特异心脏瓣膜区域的患者特异解剖模型,该模型包括心脏植入体在第一血液流动路径和第二血液流动路径中的部署点和,所述第二血液流动路径例如lvot或主动脉。所述患者特异解剖模型可代表患者特异左心室和/或心房和/或主动脉或其部分。患者特异解剖模型可包括有限元件网孔。所述植入体模型虚拟地,例如在电脑中模拟,放入,例如放置,进入所述患者特异解剖模型的放置位置处。植入体模型放置后患者特异解剖模型的变形可以被计算出来。从植入体模型的虚拟放置和变形的患者特异解剖模型,可以计算出所述变形的患者特异解剖模型中血液动力功能不全的量值。基于所述确定的血液动力功能不全的量值,可以确定如果将对应于植入体模型的实际植入体实际部署到对应于患者特异解剖模型的患者解剖区域后,患者产生并发症的风险程度。
所述方法可用来预测第二血液流动路径的阻塞。之后,从虚拟放置的植入体模型和变形的患者特异解剖模型,可确定所述变形的患者特异解剖模型中第二血液流动路径的阻塞量值。基于所述确定的阻塞量值,可以确定如果将对应于植入体模型的实际植入体实际部署到对应于患者特异解剖模型的患者解剖区域后,患者产生并发症的风险程度
所述方法可用来预测第一血液流动路径的阻塞。例如,由于如瓣膜没有展开好或放置好,可能随着瓣膜小叶打开使得瓣膜打开区域变小。这可引起流经瓣膜的血液压力降低(梯度下降)。之后,从虚拟放置的植入体模型和变形的患者特异解剖模型,可确定所述变形的患者特异解剖模型中第一血液流动路径的阻塞量值。基于所述确定的阻塞量值,可以确定如果将对应于植入体模型的实际植入体实际部署到对应于患者特异解剖模型的患者解剖区域后,患者产生并发症的风险程度。
所述方法可用来预测第一血液流动路径的渗漏。例如,可能随着瓣膜小叶闭合,血液在瓣膜和周围组织之间围绕植入体瓣膜的周边渗漏。可选择的,或额外的,所述瓣膜小叶在闭合位置处不能完全的闭合,使得血液通过过植入体的瓣膜渗漏。之后,从虚拟放置的植入体模型和变形的患者特异解剖模型,可确定所述变形的患者特异解剖模型中第一血液流动路径的渗漏量值。基于所述确定的渗漏量值,可以确定如果将对应于植入体模型的实际植入体实际部署到对应于患者特异解剖模型的患者解剖区域后,患者产生并发症的风险程度。
可理解的是所述方法包括计算机执行步骤。可理解的是上述全部步骤可以是计算机执行步骤。
患者的心脏瓣膜植入体和心脏瓣膜区域是本发明的一个重要示例。尽管如此,本发明也可用于其他植入体,例如支架。虽然下文具体用患者的心脏瓣膜植入体和心脏瓣膜区域来做参考,可以理解的是特征和优点也可用于心脏的其他植入体。因此,为了理解本发明,这里用心脏瓣膜植入体和心脏瓣膜部署区域作为参考,本发明同样用于其他心脏植入体和/或其他心脏区域,包括laa,心房或心室隔膜缺损闭合。
可选择的,本方法包括提供在心动周期期间的多个时刻的患者特异解剖模型,并且确定在多个时刻的血液动力功能不全的量值。可以理解的是在心动周期期间心脏的几何特性显著发生变化。因此,血液动力功能不全的量值可能也会显著变化。于是确定在心动周期的多个时刻的血液动力功能不全的量值允许确定血液动力功能不全的最小值和最大值。
可选择的,所述第二血液流动路径的阻塞的量值是第二血液流动路径上的横截面面积。比如,例如基本上垂直于血液流动的方向的横截面面积已被证明是可靠的阻塞量值。被放置了植入体模型以后的第二血液流动路径的横截面面积可与没放置植入体模型的患者特异解剖模型的第二血液流动路径的横截面面积进行比较。这可使人了解在植入体放置后可用于血液流动的横截面的预测变化。而且第二血液流动路径的节段的流量减少可以是很好地量化阻塞的量值。
可选择的,第二血液流动路径阻塞的量值是当植入体模型被放置后第二血液流动路径横截面面积除以植入体模型未放置时患者特异解剖模型中第二血液流动路径横截面面积的比率。这需要将解剖体模型的变形和现有的装置考虑在内,解剖体模型的变形例如tmvr装置挤靠lvot减小了lvot的区域,例如剩余的区域等于变形的区域减去被装置占据的区域。从所述比率可了解由于植入体的放置而引起的横截面面积的预测变化。
可选择的,所述第一血液流动路径的阻塞的量值是第一血液流动路径上的横截面面积,例如,考虑到瓣膜小叶位置。比如,例如基本上垂直于血液流动的方向的横截面面积已被证明是可靠的阻塞量值。被放置了植入体模型的第一血液流动路径的横截面面积可与没放置植入体模型的患者特异解剖模型的第一血液流动路径的横截面面积进行比较。这可使人了解在植入体放置后可用于血液流动的横截面的预测变化。第一血液流动路径的节段的流量减少也可以是很好地量化阻塞的量值。
可选择的,第一血液流动路径阻塞的量值是当植入体模型被放置后第一血液流动路径横截面面积除以植入体模型未放置时患者特异解剖模型中第一血液流动路径横截面面积的比率。从所述比率可了解由于植入体的放置而引起的横截面面积的预测变化。
可选择的,患者特异解剖模型还包括心脏区域的流体压力。因此,所述患者特异解剖模型的变形可以通过考虑流体压力计算得出。也可以利用计算流体力学,cfd。这样,阻塞和/或渗漏可以被确定。
可选择的,所述方法包括模拟心脏瓣膜植入体至少一个瓣膜小叶的位移的步骤。那么,所述血液动力功能不全的量值,例如,第二血液流动路径的阻塞的量值,也可基于所述瓣膜小叶的位移被确定。
可选择的,所述方法包括模拟至少一个瓣膜原生小叶由于装置-解剖体相互作用和可选择的流体动力而引起的位移的步骤。那么,所述血液动力功能不全的量值,例如,第二血液流动路径的阻塞的量值,也可基于所述小叶的位移被确定。
可选择的,所述瓣膜小叶(植入体的和/或原生瓣膜)的位移可利用cfd,或液体结构相互作用fsi计算得出。例如,由于tmvr,二尖瓣膜前叶朝向lvot移动,但其可能在心缩期由于血液流动继续移动。这可以按照建议进行建模。
可选择的,第二血液流动路径的阻塞的量值是第二血液流动路径的压力梯度。可选择的,第一血液流动路径的阻塞的量值是第一血液流动路径的压力梯度。可选择的,第一血液流动路径的阻塞量值是整个植入体,例如瓣膜,上的压力梯度(即,当瓣膜打开时,整个瓣膜上的非零压力差)。
可选择的,第二血液流动路径的阻塞量值是在第二血液流动路径处的流动量值。可选择的,所述流动量值是在第二血液流动路径或者是在流速值大于阈值时第二血液流动路径的截面延伸部分的最大速度。可选择的,第一血液流动路径的阻塞量值是在第一血液流动路径处的流动量值。可选择的,所述流动量值是在第一血液流动路径或者是在流速值大于阈值时第一血液流动路径的截面延伸部分的最大速度。
应当理解,所述方法的优点是可以在手术之前,预测患者经过经导管心脏瓣膜手术后产生血液动力功能不全的风险的量值。因此,可以预测例如,计划的tavi或tmvr手术后导致血液动力问题的可能性。
可选择的,确定血液动力功能不全的量值包括确定在部署的过程中血液动力功能不全随时间的发展变化。可以在第一时刻和第二时刻确定血液动力功能不全的量值。所述第一时刻可以是在植入体模型完全部署到患者特异解剖模型中之前。所述第二时刻可以是在植入体模型已经完全被部署到患者特异解剖模型中之后。还可以在多个第一时刻确定血液动力功能不全的量值。因此,可以确定在植入体模型部署过程中血液动力功能不全随时间的发展变化。可选择的,也可以确定部署后血液动力功能不全随时间的发展变化。因此,因为心脏解剖结构由于植入体的长期存在发生变化,可以考虑对心脏重新建模。例如,可以确定手术后一星期、一个月、一年的血液动力功能不全。
可选择的,确定血液动力功能不全的量值可包括确定植入体模型在部署到患者特异解剖模型过程中的一系列情况。所述情况可能随着部署的预定量和比率逐渐的变化。所述部署包括将植入体模型插入患者特异解剖模型中。所述插入可包括折叠的植入体模型沿着血管行进。所述一系列的情况可包括直到计划部署位置的插入位置逐渐变化的情况。所述部署可包括所述植入体模型在所述患者特异解剖模型中展开。所述一系列情况可包括所述植入体模型展开的各阶段逐渐变化情况。对于所述一系列情况中的每一种情况,血液动力功能不全的量值可通过上述方法确定。因此,部署的每一个阶段都可被建模。所述处理单元可被设置从而在所述一系列情况中确定出所确定的血液动力功能不全最严重例如最高阻塞值的那种情况。所述处理单元可被设置从而在所述一系列情况中确定出所确定的用于预测血液动力问题的所确定的机械相互作用是最显著的例如最大的那种情况中的血液动力功能不全的量值。所述一系列情况可针对多个不同的部署点产生。所述处理单元可被设置从而选择出最佳部署点。
应当理解,患者产生血液动力问题的风险可通过结合上述测定而量化。
可选择的,所述方法包括最好在手术前基于心血管2d或3d或4d医学图像信息,例如x光、ct扫描、mri成像、超声心动图成像等或其结合来预估患者特异解剖模型。
可选择的,所述方法包括基于解剖学测量方法例如利用参数心脏模型来预估患者特异解剖模型。
可选择的,所述植入体模型包括有限元件网孔。所述网孔的每个元件可用一组节点来表现。所述元件的相邻元件可包括与所述元件相互共用的节点。所述元件可用材料相关参数来表现。所述网孔的每个元件可与所述网孔所述元件相邻元件的材料相关参数不同。
可选择的,为解剖模型的网孔的多个节点提供硬度元件。硬度元件在所述网孔的相应节点上引起反作用力,其中所述力取决于所述节点的位移或者所述节点和一固定位置间的距离,所述固定位置等于或非常接近所述节点的初始位置。
可选择的,将植入体虚拟部署到患者特异解剖模型中的步骤包括三维有限元分析。因此,植入体部署到患者特异解剖模型中可被计算机三维模拟。
可选择的,所述方法包括将植入体模型虚拟地部署患者特异解剖模型的多个位于或接近部署点的不同位置,并针对多个不同位置的每个位置确定第二血液流动路径的阻塞的量值。因此,可以评估植入体在上述多个不同位置处的血液动力问题的风险。因此,也可以选出产生血液动力阻塞问题风险最低的那个植入体位置。所述选择的位置可用于tavi或tmvr手术的术前计划。
可选择的,虚拟地部署植入体模型的步骤包括提供多个植入体模型,其中每个依照相应植入体的几何特征和/或材料特性进行建模;并且将每个植入体模型虚拟地部署到患者特异解剖模型中,并确定每个植入体模型的血液动力功能不全的量值。因此,可以得到多个植入体模型中的每个的血液动力问题风险。因此,可以选择出产生血液流动阻塞问题风险最小的植入体模型。上述选择出的植入体模型可被用于tavi或tmvr或ttvr手术的术前计划。所述方法可以包括为经皮植入手术选择对应于多个植入体模型中的一个的心脏瓣膜植入体。与所选择的植入体模型相关联的心脏瓣膜植入体可用于经皮植入手术从而将患者产生血液动力问题的风险减到最小。应当理解,也可以将上述多个植入体模型中的每一个虚拟地部署患者特异植入体模型中的多个不同位置,所述多个位置位于和/或接近部署点。这样,上述植入体模型的每一个可在其最佳位置被比较。
可选择的,所述方法包括向使用者报告血液动力功能不全的量值。所述血液动力功能不全的量值,例如阻塞和/或渗漏的量值,可以例如在显示器上显示,在纸上打印出或类似方式。也可以向使用者报告患者产生血液动力问题风险的迹象。
根据一个方面,提供了一种用于确定例如预测由经皮心脏瓣膜手术所引起的血液动力功能不全的量值的系统。所述系统包括处理器。所述处理器被设置为接收植入体模型,所述植入体模型代表心脏瓣膜植入体的三维表征。所述处理器被设置为接收代表患者特异心脏区域的患者特异解剖模型,所述模型包括心脏植入体在第一血液流动路径和第二血液流动路径中的部署点。所述患者特异解剖模型可以包括有限元件网孔。所述处理器被设置成虚拟地将所述植入体模型在部署点部署到所述患者特异解剖模型中。所述处理器被设置成计算由植入体模型部署引起的患者特异解剖模型的变形。从虚拟地被部署的植入体模型和变形的患者特异解剖模型,所述处理器被设置用于确定变形的患者特异解剖模型中的血液动力功能不全的量值。所述处理器被设置用于基于确定的血液动力功能不全的量值确定患者产生血液动力问题的风险程度。因此,所述系统可被用来执行上述方法。
根据一个方面,提供了一种包括计算机可执行指令的计算机程序产品。所述计算机程序产品可被存储在非瞬态数据载体上。当被可编程计算机执行时,所述指令使计算机检索代表心脏瓣膜植入体三维表征的植入体模型。当被可编程计算机执行时,所述指令使计算机检索代表患者特异心脏区域的患者特异解剖模型,所述模型包括心脏植入体在第一血液流动路径和第二血液流动路径中的部署点。所述患者特异解剖模型可包括有限元件网孔。当被可编程计算机执行时,所述指令使计算机虚拟地将所述植入体模型在部署点部署到所述患者特异解剖模型中。当被可编程计算机执行时,所述指令使计算机计算由植入体模型部署所引起的患者特异解剖模型的变形。当被可编程计算机执行时,所述指令使计算机从虚拟地被部署的植入体模型和变形的患者特异解剖模型,确定变形的患者特异解剖模型中的血液动力功能不全的量值。当被可编程计算机执行时,所述指令可使计算机基于确定出的血液动力功能不全的量值确定患者产生血液动力问题风险的程度。因此,所述计算机程序产品可以被用来执行上述方法。
可以理解,上述方法中提及的所有特点和选择都同样适用于所述系统和所述计算机程序产品。还将清楚的是,可以组合上述一个或多个方面、特点和选项。
附图说明
本发明的实施例将参考附图详细描述,附图中:
附图1是系统的示意图;
附图2是表示植入体模型和患者特异解剖模型的示意性示例;和
附图3a,3b,3c是所述植入体模型在多个不同的位置部署到所述患者特异解剖模型中的示例。
具体实施方式
经导管二尖瓣膜置换手术(tmvr)后的左心室流出道(lvot)阻塞是一种常见的并发症。在患有二尖瓣环钙化的患者中,tmvr后lvot阻塞大约会占所述患者的10%。这导致手术后一年的死亡率增加。然而利用本技术,可以预测lvot阻塞或其他血液动力功能不全的发生。
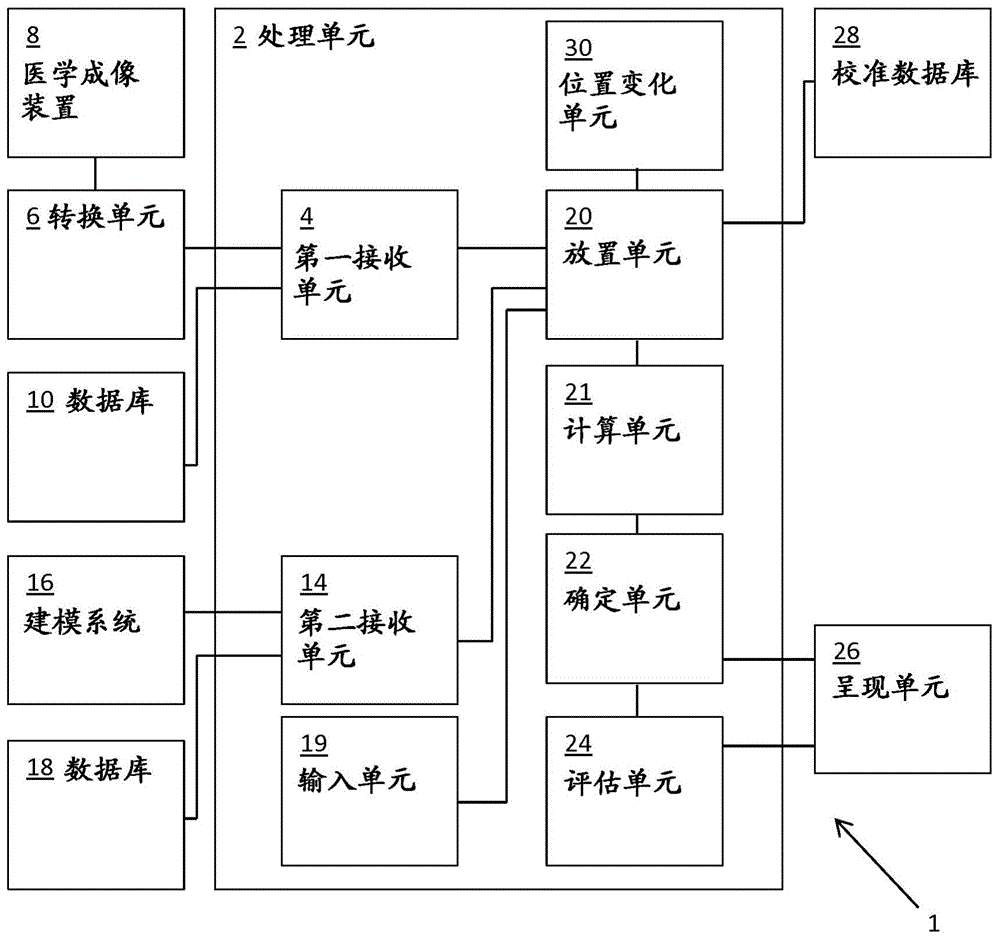
附图1显示了系统1示例的示意图,系统1用于预测经导管心脏瓣膜治疗造成的血液动力功能不全的量值,所述血液动力功能不全例如血液流动路径的阻塞。系统包括处理单元2。处理单元2包括第一接收单元4用于接收患者特异解剖模型。这里的患者特异解剖模型代表患者特异心脏瓣膜区域。
在这个示例中,患者特异解剖模型被提供为包括有限元网孔的三维(3d)有限元模型。在这个示例中从转换单元6接收患者特异解剖模型。转换单元6被设置从医学成像装置8接收医学成像数据。医学成像数据可以是2d、2.5d(堆叠2d)、3d或4d成像数据。医学成像数据可以是手术前的成像数据。医学成像装置8可以例如是x射线扫描仪、计算机断层扫描(ct)装置、超声心动图装置或磁共振成像(mri)装置。在所述示例中,转换单元6被设置用来基于医学成像信息创建患者特异3d有限元模型。替代地或附加地,可以从数据库10接收患者特异解剖模型。
处理单元2进一步包括第二接收单元14,所述接收单元被设置用于接收代表心脏瓣膜植入体的3d表示的植入体模型,这里是有限元表示。心脏瓣膜植入体3d表示可以例如从3d建模系统16接收。替代地或附加地,心脏瓣膜植入体3d表示可以从数据库18接收。
附图2显示了心脏瓣膜区域患者特异解剖模型40的示意性示例。附图2也显示了植入体模型42的示意性示例。在这个示例中植入体模型42代表二尖瓣膜植入体。患者特异解剖模型40包括在第一血液流动路径46中心脏瓣膜植入体42的部署点44。患者特异解剖模型40还包括第二血液流动路径48。第一血液流动路径46可例如是延伸通过二尖瓣膜的血液流动路径,而第二血液流动路径48是lvot。在另一个示例中,第一血液流动路径可例如是延伸通过主动脉瓣膜的血液流动路径,而第二血液流动路径是冠状动脉。
回到附图1,处理单元2包括放置单元20,其被设置用于将所述植入体模型虚拟地部署到所述患者特异解剖模型中。放置单元将植入体模型42放置到患者特异解剖模型40中。放置单元20可被设置将植入体模型和患者特异解剖模型带到共同的模型空间。处理单元2可被设置用于在患者特异解剖模型40的第一血液流动路径46中为植入体模型40限定部署点44。处理单元可包括输入单元19,其被设置用于接收与部署点44相关的信息。输入单元19可与图形使用者界面相关联,所述界面允许使用者,例如外科医生,在患者特异解剖模型40中为植入体模型42输入期望的部署点44。处理单元2也可被设置用于自主地确定或者建议部署点44。所确定的或所建议的部署点44可以是基于规则的。所述规则可与患者特异解剖模型40中的解剖结构的预定位置相关联。放置单元20可采用三维有限元分析。
由放置单元20进行的放置还包括虚拟地将植入体模型42扩展进入患者特异解剖模型40。扩展的植入体模型42将抵靠患者特异解剖模型40。可以理解,由于(例如扩展的)植入体模型42的存在,,患者特异解剖模型40可能会(例如局部地)变形。
处理单元2在此包括计算单元21,其被设置用于计算因植入体模型42的部署而造成的患者特异解剖模型40的变形。应当理解,与植入体模型和患者特异解剖模型均相关联的物理特性,例如硬度,将决定扩展的植入体模型42的形状,变形的患者特异解剖模型40的相应形状,和植入体模型与患者特异解剖模型之间的机械相互作用。机械相互作用可包括植入体模型和患者特异解剖模型之间的力、压力、应力和应变中的一个或多个。
处理单元2进一步包括确定单元22,其被设置为从被虚拟部署的植入体模型42和变形的患者特异解剖模型40,确定出血液动力功能不全的量值的预测值。在这个示例中,确定单元22确定变形的患者特异解剖模型40中第二血液流动路径48的阻塞的量值的预测值。在这个示例中,确定单元22被设置用于确定在植入体模型42部署后第二血液流动路径48的横截面面积。此外,确定单元22可以确定由于部署引起的植入体模型42和患者特异解剖模型40的变形,和可能的后展开。两个模型40,42的变形结合模型40,42的模型弹性允许确定一个模型施加到另一个模型上的力。模型弹性可被建模为各个模型节点之间的硬度。
另外,确定单元22可被操作用于确定在植入体模型42部署之前,第二血液流动路径48的横截面面积。因此,可以确定在植入体模型42部署之前和之后横截面面积的差。所述差可以是由于植入体模型42的存在和患者特异解剖模型40的变形引起的第二血液流动路径48阻塞的量值。可选地或附加地,第二血液流动路径48的阻塞的量值可被确定为一个比率,所述比率是当植入体模型42被部署后的第二血液流动路径48的横截面面积除以植入体模型42未被部署时患者特异解剖模型40中第二血液流动路径48的横截面面积。
在上述示例中,所确定的血液动力功能不全包括第二血液流动路径48的阻塞。可选地或附加地,所确定的血液动力功能不全包括第一血液流动路径46的阻塞。应当理解,第一血液流动路径46可由于植入体的存在受到一定量值阻塞。因此,计算单元21可计算因植入体模型42部署而引起的患者特异解剖模型40的变形。确定单元22可被操作用于确定第一血液流动路径46的横截面面积。这可以例如,和植入体模型42部署之前第一血液流动路径46的横截面面积进行比较。因此,确定单元22可确定第一血液流动路径阻塞的量值。应当理解,植入体部署到第一血液流动路径46中的方式可能影响植入体模型42的小叶43的定位。小叶43可能没有完全打开。此外,确定单元22可计算在打开位置的小叶43的位置。因此,确定单元22可以考虑小叶43的定位用于确定第一血液流动路径46的打开区域从而确定阻塞的量值。
可选地或附加地,确定单元22可确定沿着植入体模型42的第一血液流动路径46中的压降。所述压降也可代表由于植入体模型42引起的第一血液流动路径46的阻塞。
可选地或附加地,所确定的血液动力功能不全包括第一血液流动路径中血液的渗漏。例如,在植入体瓣膜小叶43闭合情况下,血液在瓣膜和周围组织之间围绕部署的瓣膜外侧渗漏。之后,从虚拟地部署的植入体模型42和变形的患者特异解剖模型40,确定单元22可确定变形的患者特异解剖模型中第一血液流动路径的渗漏的量值。此外,确定单元22可以使用计算出的心脏区域中的流体压力。也可使用计算流体动力学cfd。
植入瓣膜小叶43也可能由于植入体被部署第一血液流动路径46的方式没有完全闭合。这也可导致在小叶43的闭合位置的血液渗漏。此外,确定单元22可确定小叶43在闭合位置的位置。因此,确定单元22可计算渗漏。
处理单元2可进一步包括评估单元24,其被设置用于基于确定的模型40,42的变形确定患者产生血液动力问题的风险程度,所述问题例如第二血液流动路径阻塞。确定的风险可以是,例如被表示为百分比、数字、等级等。处理单元2能够通信地连接到呈现单元26。在这个示例中呈现单元26是显示器,向使用者显示患者产生血液动力功能不全的风险程度。应当理解,呈现单元也可向使用者呈现阻塞的表示,例如数字和/或图形表示。可以使用替代的或附加的呈现单元,例如硬拷贝打印机、电子邮件服务器、信息服务、扬声器装置等。
应当理解,处理单元2可被设置于采用校准。此外,处理单元2可包括校准单元28。可选择的,为多个患者确定预测的血液动力功能不全的量值。对于这些患者中的每一个,预测的血液动力功能不全和实际上发生或没发生血液动力问题都存储在校准数据库中。从校准数据库中预测的血液动力功能不全的量值和实际生活中发生血液动力问题的相关性可被确定。基于所述相关性,基于确定的血液动力功能不全,患者产生血液动力问题的风险的程度可被确定。可以理解,校准数据库可随时更新。
附图3a,3b,3c示出了一示例,其中植入体模型42被放置进患者特异解剖模型40的多个不同位置处。在这个示例中患者特异解剖模型40包括围绕着二尖瓣膜50的区域。这里,第一血液流动路径44延伸通过二尖瓣膜50。第二血液流动路径46由lvot形成并延长进主动脉。原生的瓣膜小叶52可在附图3a-3c中被识别。在这个示例中从附图3a到3b到3c,植入体模型42被放置在三个位置,这三个位置沿着二尖瓣膜依次移动几个毫米。此外,处理单元2包括位置变化单元30。可以看出,在附图3a的示例中,原生瓣膜小叶52的末端53自由地悬垂在植入体模型42之上。在3c中,原生瓣膜小叶52,包括它们的末端53,被压靠在lvot上。因此,从附图3a到附图3c阻塞逐渐增加。评估单元24确定每个不同位置的阻塞的量值。通过这个分析,使用者可以了解植入体在哪个位置可以使患者产生血液动力问题的风险最低。这个信息可被用于计划tmvr手术。处理单元2也可以选择提供最低血液动力问题风险的植入体位置。处理单元可将选择的位置显示为部署点44的优选位置。
可以理解,也可提供多个不同植入体模型42。植入体模型42的每一个可表示相应真实植入体的几何和/或材料特性。这些植入体模型42可在尺寸、品牌、结构、材料等方面不同。植入体模型的每一个随后可被放入患者特异解剖模型40中。之后,对植入体模型42中每一个确定血液动力功能不全的量值和/或患者产生血液动力问题的风险。从这个分析可以确定多个植入体模型中的哪一个和最低的血液动力功能不全和/或患者产生血液动力问题风险最低相关联。然后,对应于与血液动力功能不全和/或患者产生血液动力问题风险有最低相关性的植入体模型42的心脏瓣膜植入体可被选取用于实际经皮植入手术。应当理解,也可以将植入体模型42中的每一个放置到患者特异解剖模型40中的多个不同位置。因此,对每个植入体模型可以确定产生最低血液动力功能不全和/或风险的位置。然后,可以比较每个植入体模型42的最低功能不全和/或风险从而为实际经皮植入选择心脏瓣膜植入体。
患者特异模型40还可包括时间信息。患者特异模型可包括多个视图,其中每个对应心动周期的不同时刻。可以对每个视图确定植入体模型的血液动力功能不全的量值。因此,可以确定在心动周期期间在不同时刻的血液动力功能不全的量值。
可以理解,也可将植入体模型42的每一个放置到患者特异解剖模型40中的多个不同位置,并针对多个视图的每一个进行分析。因此,对于每一个植入体模型,可在心动周期期间在不同位置中确定最低血液动力功能不全的量值和/或风险。对于每一个植入体模型,也可在心动周期期间在不同位置中确定最高血液动力功能不全的量值和/或风险。然后,每个植入体模型42的最低和最高血液动力功能不全和/或风险可被比较从而为实际经皮植入选择心脏瓣膜植入体。如在附图2和3a-3d所示,心脏区域解剖结构的部分也可能会引起阻塞。例如,流经第一血液流动路径和/或第二血液流动路径的血液的压力可影响部分解剖结构的位置,所述部分解剖结构例如(钙化的)原生瓣膜小叶。根据一个方面,计算单元21计出因植入体模型部署和流体压力而引起的患者特异解剖模型的变形。流体和患者特异解剖模型的结构之间的相互作用(流体结构相互作用,fsi)可被包括在变形的患者特异解剖模型的计算中。计算流体力学cfd也可被用于确定患者特异解剖模型40的变形,变形是植入体模型42部署和血液流动路径中流体力学的结果。
在此,参考本发明具体实施例来描述本发明。然而,显而易见的是,在不脱离本发明实质情况下,可在其中进行各种修改和改变。出于清晰和简明的目的,这里将特征作为相同或单独实施例的一部分来描述,然而,通过结合这些单独实施例中描述的特征的部分或全部形成的替代实施例也是容易想到的。
应当理解,在每一个示例中,并且通常,确定血液动力功能不全的量值可包括确定植入体模型部署到患者特异解剖模型过程中的多个情况。这些多个情况可随着部署的预定的量或比率逐渐变化。部署可包括将植入体模型插入患者特异解剖模型。插入可包括沿着血管传送压缩的植入体模型。这些情况可以包括到达预期部署点过程中逐渐不同的插入位置。部署可包括植入体模型在患者特异解剖模型中的展开。这些情况可包括植入体模型逐渐展开过程中的不同阶段。对于这些情况的每一种,血液动力功能不全的量值可根据之前描述确定出。因此,部署的全部阶段可以被建模。处理单元可被设置用于确定多种情况中确定的血液动力功能不全最不重要(例如最小)或最重要(例如最高)的情况。处理单元可被设置用于确定多种情况中的一种情况的血液动力功能不全的量值,其中所确定血液动力功能不全是对预测血液动力问题最不重要或最重要的。
应当理解,多种情况的所述确定模拟了在部署过程中植入体模型和患者特异解剖模型之间血液动力功能不全的量值随时间演变的确定。
应当理解,模拟血液动力功能不全的量值随时间的演变,也可在部署后的一段时间执行,例如部署后数天、数星期、数月或甚至数年。因此,由于心脏解剖结构因植入体持续的存在发生改变,可考虑心脏重新建模。
在示例中,植入体模型包括有限元模型。应当理解,植入体模型也可包括无网格模型。在示例中,患者特异解剖模型包括有限元模型。应当理解,患者特异解剖模型也可包括无网格模型。应当理解,处理单元、第一接收单元、转换单元、第二接收单元、输入单元、建模系统,放置单元、计算单元、确定单元、评估单元、呈现单元和/或位置变化单元可实施为专用电子电路,也可包括软件代码部分。处理单元,第一接收单元、转换单元、第二接收单元、输入单元、建模系统、放置单元、计算单元、确定单元、评估单元、呈现单元和/或位置变化单元也可被实施为软件代码部分,所述软件代码部分在例如计算机、平板电脑或智能电话等可编程设备上被执行,并且例如存储在例如计算机、平板电脑或智能电话等可编程设备的存储器中。
尽管参考附图描述的本发明实施例包括计算机装置和在计算机装置中执行的进程,本发明也扩展到计算机程序,特别是在载体上或载体中适于将本发明付诸实践的计算机程序。程序可以是源代码或目标代码的形式,或者其他适于本发明进程的执行的任何其他形式。载体可以是任何实体或者可携载程序的装置。
例如,载体可包括存储介质,例如rom,例如、cdrom或、半导体rom,或、磁记录介质,例如软盘或硬盘。此外,载体可以是可传输载体,例如电或光信号,其可通过电线或光缆或通过无线电或其他方式传输,其他方式例如通过互联网或云。
当程序包含在可被缆线或其他装置或方式直接传送的信号中时,载体可被这样的缆线或其他装置或方式构成。或者,载体可以是嵌入程序的集成电路,集成电路适于执行或用于执行相关进程。
然而,其他修改,变化和替代也是可以的。因此,详细说明、附图和示例均被视为说明意义而非限制意义。
出于清晰和简明的目的,这里将特征做为相同或单独实施例的一部分来描述,然而,应当理解,本发明的范围可包括具有全部或部分特征的组合的实施例。
在权利要求中,括号内的任何参考符号不应被解释为对权利要求的限制。“包括”一词不排除除权利要求中列出的那些之外的其他特征或步骤。此外,词语“一(a)”和“一(an)”不应被解释为限于“仅一个”,而应用于表示“至少一个”,并不排除多个。在不同的权利要求中列举的特定措施的事实不表示这些措施的组合不能用于获益。
- 还没有人留言评论。精彩留言会获得点赞!