用于免疫疗法的PDE5组合物和方法与流程
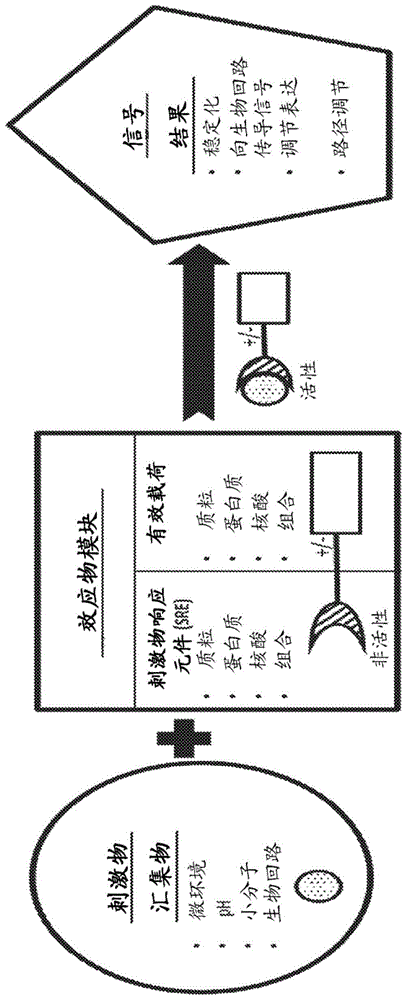
相关申请的交叉引用本申请要求2017年6月12日提交的题为pde5tunableproteinregulation的62/518,078、2017年6月23日提交的题为pde5tunableproteinregulation的62/523,850、2017年6月23日提交的题为pde5compositionsandmethodsforimmunotherapy的62/523,862、2017年9月7日提交的题为pde5tunableproteinregulation的62/555,313的优先权,其各自的内容以引用的方式整体并入本文。序列表的引用本申请连同电子格式的序列表一起提交。所述序列表以2018年6月12日创建,题为2095_1003pct_sl.txt的文件形式提供,所述文件的大小是18,074,972字节。电子格式的序列表中的信息以引用的方式整体并入本文。发明领域本发明涉及用于开发受控制和/或受调控的治疗系统的可调谐生物回路系统。特定来说,公开了含有源于突变人cgmp特异性5型磷酸二酯酶(pde5)的去稳定结构域(dd)的可调控生物回路。本发明也涉及用于免疫疗法的组合物和方法。在本发明中提供的包括生物回路系统、效应物模块、刺激物响应元件(sre)和免疫治疗剂的多肽;编码所述多肽的多核苷酸;含有所述多肽和/或多核苷酸的载体和细胞,用于癌症免疫疗法中。在一个实施方案中,组合物包含调谐蛋白质稳定性的去稳定结构域(dd)。发明背景安全和有效的基因疗法要求治疗性转基因产物(例如蛋白质产物)的表达受严密调控。类似地,对发育、细胞分化和其他生理活动中基因功能的分析要求所探究蛋白质的表达可控。然而,当前技术不允许滴定经诱导靶标蛋白质的水平或诱导动力学。不充分的外源性和/或内源性基因控制是包括离体和体内基因疗法在内的众多设置中的关键问题。这个可调谐性缺乏也使得难以安全地表达具有狭窄或不确定治疗窗的蛋白质或要求以更大程度进行滴定、控制或短暂表达的那些蛋白质。一种用以达成受调控的蛋白质表达或功能的方法是使用去稳定结构域(dd)。去稳定结构域是可附接于有效载荷诸如目标蛋白质(poi)的小型蛋白质结构域。dd致使相连的目标蛋白质(poi)在不存在dd结合配体下不稳定以使所述蛋白质由细胞的泛素-蛋白酶体系统快速降解(stankunas,k.等,(2003).mol.cell12,1615–1624;banaszynski,l.a.等,(2006)cell;126(5):995–1004;综述于banaszynski,l.a.和wandless,t.j.(2006)chem.biol.13,11–21中;iwamoto,m.等(2010).chembiol.17(9):981-8;egeler,e.l.等(2011).jbiolchem.286(36):31328-36;以及rakhitr,navarror,wandlesstj(2014)chembiol.9月18日;21(9):1238-52;navarro,r.等(2016)acschembiol.11(8):2101–2104)。在一些情况下,目标蛋白质不被完全加工,并且在不存在dd结合配体下可不被分泌或呈递在膜上(sellmeyer等,(2012),doi.org/10.1371/journal.pone.0043297;其内容以引用的方式整体并入本文)。然而,当特异性小分子配体结合它的作为配体结合配偶体的预定dd时,不稳定性得以逆转,并且蛋白质功能得以恢复,或在一些情况下,加工得以恢复,并且目标蛋白质被呈递在膜上或被分泌。此类系统在本文中被称为生物回路,其中上述典型含dd生物回路是原型模型生物回路。据信包括含有dd的那些生物回路的生物回路的改进可形成采用可调谐和时序控制基因表达和功能的一类新型细胞和基因疗法的基础。此类新型部分被本发明者描述为刺激物响应元件(sre),其在效应物模块的情形下起使由刺激物产生并且最终产生信号或结果的生物回路完整的作用。当用多肽有效载荷加以适当形式化时,以及当由特定刺激物例如小分子活化时,生物回路系统可用于通过使致稳定信号或去稳定信号永存来向上或向下调控转基因和/或蛋白质水平。这个方法具有超过现有调控蛋白质功能和/或表达的方法的许多优势,所述现有方法当前集中于通过诱导型启动子来进行顶层转录调控。本发明提供显示小分子依赖性稳定性的新型蛋白质结构域,特定来说是源于突变人cgmp特异性5型磷酸二酯酶(pde5)的去稳定结构域(dd),特别是人pde5的催化结构域,以及包含此类dd的生物回路系统和效应物模块。也提供用于使用上述各物来调谐转基因功能的方法。癌症免疫疗法旨在通过使主要是t细胞的肿瘤反应性免疫细胞的杀肿瘤功能复原来根除癌细胞。可使抗肿瘤免疫效应细胞增加的癌症免疫疗法策略,包括开发新近对检查点阻断、过继性细胞转移(act)和癌症疫苗,已在若干肿瘤的情况下产生显著结果。宿主抗肿瘤免疫性和癌症免疫疗法的影响受阻于三个主要障碍:1)由于克隆缺失,所以肿瘤抗原特异性t细胞的数目较低;2)先天性免疫细胞的活化不良以及致耐受性抗原呈递细胞在肿瘤微环境中的积累;和3)形成免疫抑制性肿瘤微环境。特定来说,在实体肿瘤的情况下,由于在免疫抑制性肿瘤微环境中缺乏有效抗肿瘤应答,所以免疫治疗方案的治疗功效仍然不令人满意。肿瘤细胞经常诱导免疫耐受性或抑制,并且所述耐受性是获得性的,因为即使真正外来肿瘤抗原也将变得被耐受。此类耐受性也是主动的和显性的,因为癌症疫苗和过继性转移预活化免疫效应细胞(例如t细胞)会经受由肿瘤微环境(tme)中的抑制因子达成的抑制。此外,施用经工程化的t细胞可产生中靶/脱靶毒性以及细胞因子释放综合征(由teyclin.transl.immunol.,2014,3:e1710.1038综述)。在不利事件的情况下需要开发可开启或关闭转基因免疫治疗剂表达的可调谐开关。举例来说,过继性细胞疗法可具有极其长久和不定的半衰期。因为毒性可具有进行性,所以需要安全性开关来消除所输注的细胞。可以高度灵活性调谐转基因蛋白质水平和表达窗的系统和方法可使治疗益处增强,并且使潜在副作用降低。为试图开发用于疾病疗法、特别是癌症免疫疗法的可调控治疗剂,本发明提供用以控制免疫治疗剂的表达的生物回路系统。生物回路系统包含刺激物和至少一个对所述刺激物起响应的效应物模块。效应物模块可包括结合刺激物并对刺激物起响应的刺激物响应元件(sre)和可操作地连接于所述sre的免疫治疗剂。在一个实例中,sre是去稳定结构域(dd),其在不存在它的特异性配体下去稳定并且可通过结合至它的特异性配体而稳定。技术实现要素:本发明提供用于免疫疗法的组合物和方法。组合物涉及在细胞中或在受试者中诱导抗癌免疫应答的可调谐系统和药剂。可调谐系统和药剂可为包含至少一个对至少一种刺激物起响应的效应物模块的生物回路系统。生物回路系统可为但不限于去稳定结构域(dd)生物回路系统、二聚化生物回路系统、受体生物回路系统和细胞生物回路系统。这些系统进一步教导于共同拥有的美国临时专利申请号62/320,864(2016年4月11日提交)、62/466,596(2017年3月3日提交)和国际公布wo2017/180587中(所述专利各自的内容以引用的方式整体并入本文)。本发明提供用于在细胞或受试者中诱导免疫应答的组合物。在一些实施方案中,组合物可包括刺激物响应元件(sre)和至少一个有效载荷。在一些实施方案中,有效载荷可与sre相连、附接或缔合。sre可包括去稳定结构域(dd)。在一些实施方案中,dd可完全地或部分地包含cgmp特异性3',5'-环状磷酸二酯酶(hpde5;seqidno.1)。在一些实施方案中,有效载荷可附接于sre。在一些实施方案中,dd可包含hpde5的催化结构域(seqidno.3)。在一些方面,催化结构域可包括hpde5(seqidno.1)的氨基酸535-860。在一些实施方案中,dd可包括在seqidno.1的位置732处的氨基酸(r732)的突变。在位置r732处的突变可包括但不限于r732l、r732a、r732g、r732v、r732i、r732p、r732f、r732w、r732y、r732h、r732s、r732t、r732d、r732e、r732q、r732n、r732m、r732c和r732k。在一些方面,dd可选自包括但不限于以下的组:hpde5(wt的氨基酸535-860,r732l)(seqidno.12);hpde5(wt的氨基酸535-860,r732a)(seqidno.384);hpde5(wt的氨基酸535-860,r732g)(seqidno.383);hpde5(wt的氨基酸535-860,r732v)(seqidno.385);hpde5(wt的氨基酸535-860,r732i)(seqidno.386);hpde5(wt的氨基酸535-860,r732p)(seqidno.387);hpde5(wt的氨基酸535-860,r732f)(seqidno.388);hpde5(wt的氨基酸535-860,r732w)(seqidno.389);hpde5(wt的氨基酸535-860,r732y)(seqidno.390);hpde5(wt的氨基酸535-860,r732h)(seqidno.391);hpde5(wt的氨基酸535-860,r732s)(seqidno.392);hpde5(wt的氨基酸535-860,r732t)(seqidno.393);hpde5(wt的氨基酸535-860,r732d)(seqidno.394);hpde5(wt的氨基酸535-860,r732e)(seqidno.395);hpde5(wt的氨基酸535-860,r732q)(seqidno.396);hpde5(wt的氨基酸535-860,r732n)(seqidno.397);hpde5(wt的氨基酸535-860,r732m)(seqidno.398);hpde5(wt的氨基酸535-860,r732c)(seqidno.399);和hpde5(wt的氨基酸535-860,r732k)(seqidno.400)。在一些实施方案中,在位置r732处的氨基酸的突变可为r732l。在一个实施方案中,dd可包含氨基酸序列seqidno.12。在一些实施方案中,在位置r732处的氨基酸的突变可为r732a。在一个实施方案中,dd可包含氨基酸序列seqidno.384。在一些实施方案中,在位置r732处的氨基酸的突变可为r732g。在一个实施方案中,dd可包含氨基酸序列seqidno.383。本发明的dd可进一步包含一个或多个独立地选自由以下组成的组的突变:h653a、f736a、d764a、d764n、y612f、y612w、y612a、w853f、i821a、y829a、f787a、d656l、y728l、m625i、e535d、e536g、q541r、k555r、f559l、f561l、f564l、f564s、k591e、n587s、k604e、k608e、n609h、k630r、k633e、n636s、n661s、y676d、y676n、c677r、h678r、d687a、t712s、d724n、d724g、l738h、n742s、a762s、d764g、d764v、s766f、k795e、l797f、i799t、t802p、s815c、m816a、i824t、c839s、k852e、s560g、v585a、i599v、i648v、s663p、l675p、t711a、f744l、l746s、f755l、l804p、m816t和f840s。在一个实施方案中,dd可包括突变h653a。在一个实施方案中,dd可包含氨基酸序列seqidno.509。在一个实施方案中,dd可包括突变f736a。在一个实施方案中,dd可包含氨基酸序列seqidno.227。在一个实施方案中,dd可包含突变d764a。在一个实施方案中,dd包含氨基酸序列seqidno.510。在一个实施方案中,dd可包括突变y612f。在一个方面,dd可包含氨基酸序列seqidno.506。在一个实施方案中,dd可包括y612w突变。在一个方面,dd可包括氨基酸序列seqidno.507。在一个实施方案中,dd可包括突变y612a。在一个实施方案中,dd可包含氨基酸序列seqidno.508。在一个实施方案中,dd可包括突变d64n。在一些方面,dd可包含氨基酸序列seqidno.505。在一些实施方案中,本发明的sre可附接于有效载荷。在一些方面,有效载荷可为免疫治疗剂。在一些方面,免疫治疗剂可选自嵌合抗原受体(car)和细胞因子-细胞因子受体融合多肽。在一些实施方案中,car可包括细胞外靶标部分、铰链和跨膜结构域、细胞内信号传导结构域;以及任选地,一个或多个共刺激性结构域。在一些实施方案中,car可为标准car、拆分car、关闭开关car、开启开关car、第一代car、第二代car、第三代car或第四代car。car的细胞外靶标部分可对癌细胞的表面上的靶标分子具有亲和力或结合所述靶标分子。在一些方面,car的细胞外靶标部分可为scfv。在一个方面,靶标分子可为cd19。在一些实施方案中,car的细胞外靶标部分是cd19scfv(seqidno.8233)。在一些实施方案中,其中car的铰链和跨膜结构域可为配对的。配对的铰链和跨膜结构域可源于cd8a、cd5、cd4、cd9、cd16、cd22、cd33、cd28、cd37、cd45、cd64、cd80、cd86、cd148、dap10、epori、gitr、lag3、icos、her2、ox40(cd134)、4-1bb(cd137)、cd152、cd154、pd-1或ctla-4。在一些实施方案中,配对的结构域可源于t细胞受体的α、β或ζ链的跨膜区域;或选自igg1、igd、igg4和igg4fc区的免疫球蛋白;或t细胞受体的cd3ε链。在一个实施方案中,car的配对的铰链和跨膜结构域可源于cd8a。在一个方面,配对的铰链和跨膜结构域可包含氨基酸序列seqidno.8235。在一些实施方案中,本发明的car可包括细胞内结构域。细胞内结构域可源于cd3ζ或选自由以下组成的组的细胞表面分子:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d。在一些实施方案中,可存在共刺激性结构域。共刺激性结构域可源于4-1bb(cd137)2b4、hvem、icos、lag3、dap10、dap12、cd27、cd28、ox40(cd134)、cd30、cd40、icos(cd278)、糖皮质素诱导的肿瘤坏死因子受体(gitr)、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c和b7-h3。在一个方面,细胞内结构域可源于cd3ζseqidno.8236。在一些实施方案中,car可包括源于4-1bb的共刺激性结构域(seqidno.8237)。在一些方面,car进一步也可包括信号序列。信号序列可源于cd8α。在一些方面,信号序列可包含氨基酸序列seqidno.278。在一些实施方案中,免疫治疗剂可为细胞因子-细胞因子受体融合多肽。细胞因子-细胞因子受体融合多肽可包括完整或一部分il15融合于完整或一部分il15ra以产生il15-il15ra融合多肽。在一个实施方案中,细胞因子-细胞因子受体融合多肽可包括氨基酸序列seqidno.8324融合于氨基酸序列seqidno.8324以产生融合多肽。在一些实施方案中,本发明的效应物模块可为dd-cd19car融合多肽。融合多肽可包含氨基酸序列seqidno.8283;8271-8282或8284。在一些实施方案中,本发明的效应物模块可为dd-il15-il15ra融合多肽(seqidno.8338;8334-8337或8339-8343)。在一些实施方案中,sre可对一种或多种刺激物起响应。刺激物可为小分子,诸如但不限于他达那非(tadalafil)、伐地那非(vardenafil)、西地那非(sildenafil)、阿伐那非(avanafil)、罗地那非(lodenafil)、米罗那非(mirodenafil)、乌地那非(udenafil)、本扎那非(benzamidenafil)、达生他非(dasantafil)和贝米那非(beminafil)。在一个方面,小分子可为他达那非。本发明也提供一种药物组合物,其可包括本文所述的组合物和药学上可接受的赋形剂。本发明也提供编码本文所述的组合物和药物组合物的多核苷酸。本文也提供用于过继性转移的免疫细胞。免疫细胞可表达本文所述的组合物、药物组合物、多核苷酸或载体。本发明也提供在细胞中诱导免疫应答的方法。所述方法可包括向细胞施用治疗有效量的任何药物组合物以及向细胞施用治疗有效量的刺激物以调节免疫治疗剂的表达。在一些实施方案中,刺激物可为配体。在一些方面,免疫治疗剂可能够响应于刺激物而在细胞中诱导免疫应答。也提供使用本文所述的组合物来使肿瘤负荷降低的方法。所述方法可包括向受试者施用治疗有效量的本文所述的免疫细胞以及向受试者施用治疗有效量的刺激物。在一些实施方案中,刺激物可为配体。在一些实施方案中,刺激物可能够调节免疫治疗剂的表达,由此使肿瘤负荷降低。在一些实施方案中,配体是他达那非。在一些方面,他达那非可在处于每kg受试者体重约0.1mg至约100mg的范围内的剂量下向受试者施用。在一些方面,他达那非可在每kg受试者体重10mg的剂量下向受试者施用。在一些方面,他达那非可在每kg受试者体重30mg的剂量下向受试者施用。在一些方面,他达那非可在每kg受试者体重100mg的剂量下向受试者施用。附图说明先前以及其他目标、特征和优势将根据对本发明的特定实施方案的以下描述而显而易知,如附图中所说明。附图不一定是按比例绘制的;而是将重点放在说明本发明的各种实施方案的原理上。图1显示本发明的生物回路系统的概要图解。生物回路包含刺激物和至少一个对刺激物起响应的效应物模块,其中对刺激物的响应产生信号或结果。效应物模块包含至少一个刺激物响应元件(sre)和一个有效载荷。图2显示携带一个有效载荷的代表性效应物模块。信号序列(ss)、sre和有效载荷可在无(a至f)或有(g至z,以及aa至dd)裂解位点下以各种排列加以定位或安置。任选接头可插入在效应物模块的各组分之间。图3显示在无裂解位点下携带两个有效载荷的代表性效应物模块。两个有效载荷可直接彼此连接或加以分隔。图4显示在有裂解位点下携带两个有效载荷的代表性效应物模块。在一个实施方案中,ss位于构建体的n末端,而其他组分:sre、两个有效载荷和裂解位点可位于不同位置处(a至l)。在另一实施方案中,裂解位点位于构建体的n末端(m至x)。任选接头可插入在效应物模块的各组分之间。图5显示本发明的携带两个有效载荷的效应物模块,其中sre位于构建体的n末端(a至l),而ss、两个有效载荷和裂解位点可呈任何构型。任选接头可插入在效应物模块的各组分之间。图6显示本发明的携带两个有效载荷的效应物模块,其中两个有效载荷(a至f)或两个有效载荷中的一者(g至x)位于构建体的n末端(a至l),而ss、sre和裂解位点可呈任何构型。任选接头可插入在效应物模块的各组分之间。图7描绘生物回路系统内刺激物和效应物模块的代表性构型。跨膜效应物模块由结合sre的游离刺激物(a)或膜结合型刺激物(b)活化。对刺激物的响应导致细胞内信号/有效载荷的裂解,所述细胞内信号/有效载荷使下游效应物/有效载荷活化。图8描绘双重刺激物-双重呈递者生物回路系统,其中来自两个不同呈递者(例如不同细胞)的两个结合型刺激物(a和b)同时结合单一接受者(例如另一单一细胞)中的两个不同效应物模块,并且产生朝向下游有效载荷的双重信号。图9描绘双重刺激物-单一呈递者生物回路系统,其中来自同一呈递者(例如单一细胞)的两个结合型刺激物(a和b)同时结合另一单一细胞中的两个不同效应物模块,并且产生双重信号。图10描绘单一刺激物-桥接接受者生物回路系统。在这个构型中,结合型刺激物(a)结合桥接细胞中的效应物模块,并且产生信号以使有效载荷活化,所述有效载荷是最终接受者(例如另一细胞)中的另一效应物模块的刺激物(b)。图11描绘单一刺激物-单一接受者生物回路系统,其中单一接受者含有由单一刺激物依序活化的两个效应物模块。图12描绘需要双重活化的生物回路系统。在这个实施方案中,一个刺激物必须首先结合跨膜效应物模块以对正由另一刺激物活化的接受细胞进行初免。接受者仅在它感测到两种刺激物时才进行活化(b)。图13描绘嵌合抗原受体(car)系统的标准效应物模块,其包含作为sre的抗原结合结构域和作为有效载荷的信号传导结构域。图14描绘可调控car系统的结构设计,其中跨膜效应物模块包含感测抗原的抗原结合结构域和第一转换结构域,并且细胞内模块包含第二转换结构域和信号传导结构域。刺激物(例如二聚化小分子)可使第一转换结构域和第二转换结构域二聚化,并且组装经活化car系统。图15显示具有一个(a)或两个(b和c)并入效应物模块中的sre的car系统的图示。图16描绘用以通过双重刺激物(例如抗原和小分子)来控制t细胞活化的拆分car设计。(a)显示正常t细胞活化,此必然伴有对tcr和共刺激性受体的双重活化。常规car设计(b)使抗原识别结构域与tcr信号传导基序和共刺激性基序组合在单一分子中。拆分car系统将常规car的组分分开至两个单独效应物模块中,所述效应物模块可在致异二聚化小分子(刺激物)存在时加以重新组装。图17描绘对经car工程化t细胞活化的正性和负性调控。不存在或存在第二刺激物可负性(a)或正性(b)控制t细胞活化。图18显示经car工程化t细胞的门控活化的图示。如果正常细胞不具有刺激物(例如抗原)(a),或具有不能结合跨膜效应物模块的抗原(b),或仅具有使跨膜效应物模块活化,并且对接受t细胞进行初免以表达第二效应物的抗原(c),那么接受t细胞仍然是非活性的。当结合跨膜效应物模块的两种刺激物(例如两种抗原)以及所引发的效应物存在于呈递细胞(例如癌细胞)上时,t细胞被活化(d)。图19a显示以用不同体积的与car构建体相关的病毒转导的细胞获得的car阳性细胞的百分比。图19b显示在伐地那非处理的情况下,car阳性细胞的百分比。图19c显示在用cd3/cd28珠粒再刺激的情况下,car的表达。图19d显示在不同浓度的病毒的情况下以及在存在或不存在cd3/cd28珠粒再刺激下,car阳性细胞的百分比。图19e显示cd19car构建体对西地那非、伐地那非和他达那非的剂量响应。图19f显示cd19car构建体对不同配体以及在改变配体处理的持续时间的情况下的响应。图19g显示在伐地那非存在下从效应细胞和靶标细胞的共培养物的上清液获得的il2和ifnγ水平。图19h显示以他达那非处理获得的car阳性t细胞的百分比。图19i显示在他达那非存在下从效应细胞和靶标细胞的共培养物的上清液获得的il2和ifnγ水平。图19j显示由car表达性t细胞在伐地那非存在下达成的靶标细胞杀灭。图19k显示与car表达性t细胞在伐地那非存在下共培养的靶标细胞的增殖。图20a显示在他达那非存在下,小鼠中nalm6luc细胞的总通量。图20b和图20c显示在所指示剂量下注射配体之后,伐地那非和他达那非在小鼠的血浆中的药物动力学。具体实施方式在以下随附描述中阐述本发明的一个或多个实施方案的细节。尽管与本文所述的那些材料和方法类似或等效的任何材料和方法都可用于实施或测试本发明,但现时描述优选材料和方法。本发明的其他特征、目标和优势将根据描述而显而易知。在描述中,除非上下文另外明确规定,否则单数形式也包括复数形式。除非另外定义,否则本文所用的所有技术和科学术语都具有与由本发明所属领域中的普通技术人员通常理解相同的含义。在起冲突的情况下,将以本描述为准。i.引言蛋白质调控条件性控制蛋白质水平的能力是基因和细胞疗法中的强效工具。已广泛研究用以在遗传水平上控制蛋白质表达的技术。cre-lox技术提供一种适用于使基因活化或失活的方法。组织或细胞特异性启动子可用于控制目标基因的空间和时序表达。然而,这个系统由于扰动的不可逆性质而在应用方面受限制。目标基因的转录可使用诸如多西环素(doxycycline,dox)诱导型系统的工具来加以条件性调控。或者,mrna的稳定性可使用rna干扰技术来调控。然而,靶向dna或rna的方法是缓慢起作用的,不可逆的,并且具有低效率。在蛋白质水平上直接操纵活性提供在灵活性、可逆性和速度方面的重大优势。已开发直接触发细胞的天然降解系统的策略。szostak和同事显示可使小肽序列融合于目标蛋白质的n末端以调节蛋白质稳定性(park,e-c.等,proc.natl.acad.sci.u.s.a.1992,89:1249-1252)。varshavsky和合作者分离了在非容许温度下使二氢叶酸还原酶(dhfr)的半衰期极大降低的温度敏感性肽序列(dohmen等science1994,263:1273-1276)。这些突变体已被广泛用于在酵母中研究蛋白质功能(labib等science2000,288:1643-1646;以及kanemaki等nature2003,423:720-724)。随后,开发了采用雷帕霉素(rapamycin)衍生物的可逆系统,所述雷帕霉素衍生物用于调控融合于frb结构域的不稳定三重突变体(frb*)的gsk-3β激酶。雷帕霉素衍生物诱导frb*-gsk-3β和内源性fkbp12的二聚化,并且使frb*融合物稳定,由此恢复所融合激酶的功能。(stankunas等,molcell.2003;12:1615–1624以及liu等,nature.2007;446:79–82)。建立在frb*结构域系统上,banaszynski等人使用fkbp12蛋白的被工程化来在不存在高亲和力配体shield-1下不稳定的突变体开发了细胞可透性配体系统。(banaszynski等,cell.2006;126:995–1004)。他们将这些不稳定结构域称为去稳定结构域(dd)。fkbp/shield-1调谐系统已在若干研究中成功用于控制靶标蛋白质。举例来说,dettwier等人用fkbp进行融合以调谐nadphp450氧化还原酶(por)的表达(dettwier等,plosone,2014,9(11):e113540)。fkbpdd-shield系统已在细胞系、转基因小鼠、原虫溶组织内阿米巴(entamoebahistolytica)、扁形虫秀丽隐杆线虫(caenorhabditiselegans)、青鳉(medaka)和转基因异种移植物中用于探究目标蛋白质的活性(maynard-smith等,jbiolchem.2007,282(34):24866–24872;liu等,intjparasitol.2014,44(10):729–735;cho等,plosone.2013,8(8):e72393);banaszynski等natmed.2008,14(10):1123–1127;rodriguez和wolfgang,chembiol.2011,19(3):391–398;以及froschauer等,plosone,2015,10(7):e0131252),用于ipsc重新编程(sui等,stemcellreports.,2014,2(5):721-733)。此外,去稳定结构域已用于条件性敲低或剔除与去稳定结构域融合的靶标基因。park等人通过crispr/cas9介导的同源性重组以及编码抗性盒和dd标签化tcof1序列的供体模板来实现这个基因组工程化(park等,plosone.2014,9(4):e95101)。更新近地,已公开适用作生物传感器的蛋白质开关以及新型嵌合抗原受体和其他小分子稳定化框架(anw等plosone,2015,10(12):e0145783.doi:10.1371/journal.pone.0145783;nicholes等,proteinengineering,design&selection,2016,第29卷第2期,第77–85页;nath等,biochemicalandbiophysicalresearchcommunications,2016,470:411e416);stevers等,pnas,2016,第119卷,第9期,第e112-1161页;juillerat,a.等,sci.rep.2016,6:18950;roybal,cell,2016,第164卷,第1-10页;以及morsut,cell,2016,第164卷,第1-12页)。fkbp/shield-1的一个缺点是shield-1是一种新型药物,其生物分布未被完全表征,并且不知道shield-1在什么程度上穿过血脑屏障。其他各对dd配体包括可由若干雌激素受体拮抗剂调控的雌激素受体结构域(miyazaki等,jamchem.soc.,2012,134(9):3942-3945)以及源于胆红素(bilirubin)诱导型荧光蛋白unag的荧光去稳定结构域(fdd)。fdd和它的同源配体胆红素(br)可诱导融合于fdd的蛋白质的降解(navarro等,acschembiol.,2016年6月6日,电子出版)。其他已知dd以及它们在蛋白质稳定性方面的应用包括美国专利号8,173,792和美国专利号8,530,636中所述的那些,所述专利的内容各自以引用的方式整体并入本文。在一正交方法中,探究了细菌二氢叶酸还原酶(ecdhfr)的去稳定结构域。(iwamoto等,chembiol.2010,17(9):981–988;以及tai等,plosone.2012,7(9):e46269)。dhfr的众多抑制剂已作为药物加以开发,并且一种所述抑制剂甲氧苄啶(tmp)比提供相互作用特异性的哺乳动物dhfr更加强效抑制ecdhfr。另外,tmp可商购获得,并且具有合乎需要的药理学性质,从而使得这对蛋白质-配体对于进行开发以用作生物回路来说是理想的(iwamoto等,chembiol.(2010)9月24日;17(9):981–988)。本发明提供显示小分子依赖性稳定性的新型蛋白质结构域。所述蛋白质结构域被称为去稳定结构域(dd)。在不存在它的结合配体下,dd具有去稳定性,并且导致融合于dd的有效载荷(例如目标蛋白质(poi))的降解,而在它的结合配体存在下,融合的dd和有效载荷可得以稳定,并且它的稳定性是剂量依赖性的。也提供用于使用本发明的dd、效应物模块、生物回路系统和组合物来调谐目标蛋白质的表达水平和活性的方法。在一些实施方案中,sre可为去稳定结构域(dd)。在一些实例中,dd可为人蛋白质pde5的部分或区域。在这个情形下,生物回路系统是dd生物回路系统。本发明详细叙述使用源于人pde5蛋白的新型去稳定结构域来调谐蛋白质稳定性的技术。目标蛋白质例如用于基因疗法的转基因的去稳定化和稳定化可通过具有去稳定或致稳定性质的pde5突变dd和它们的特异性结合所述蛋白质结构域的配体例如西地那非和伐地那非来控制。小分子配体的存在和/或不存在可调谐可操作地连接于去稳定结构域的有效载荷(例如目标蛋白质)的活性。免疫疗法癌症免疫疗法旨在诱导或恢复免疫系统对癌症的反应性。在免疫疗法研究中的重大进步已导致开发各种策略,所述策略可宽泛地分类成主动免疫疗法和被动免疫疗法。一般来说,这些策略可用于直接杀灭癌细胞或对抗免疫抑制性肿瘤微环境。主动免疫疗法旨在诱导内源性持久肿瘤抗原特异性免疫应答。应答可进一步通过非特异性刺激免疫应答调节剂诸如细胞因子来增强。相比之下,被动免疫疗法包括其中向宿主施用免疫效应物分子诸如肿瘤抗原特异性细胞毒性t细胞或抗体的方法。这个方法是短暂的,并且需要多次施加。尽管取得重大进步,但当前免疫疗法策略的功效受限于相关毒性。这些毒性经常和与免疫疗法关联的狭窄治疗窗相关,所述狭窄治疗窗部分地从需要将治疗剂量推进至潜在致命性毒性的边缘以得到临床有意义的治疗作用加以显现。此外,剂量会在体内扩增,因为过继性转移的免疫细胞在患者内继续增殖,所述增殖经常以不可预测方式进行。免疫疗法中涉及的一主要风险是由应答于肿瘤相关抗原(taa)的正常组织表达的t细胞活化所致的中靶但脱肿瘤副作用。利用表达针对特定taa的t细胞受体的t细胞进行的临床试验报告了响应于免疫疗法的皮疹、结肠炎和听力丧失。免疫疗法也可产生在肿瘤细胞响应于免疫疗法而被杀灭时显现的中靶中肿瘤毒性。不利作用包括肿瘤溶解综合征、细胞因子释放综合征和相关巨噬细胞活化综合征。重要的是,这些不利作用可在对肿瘤的破坏期间出现,因此,即使成功的中肿瘤免疫疗法可能也产生毒性。因此,用以可调控地控制免疫疗法的方法是高度合乎需要的,因为它们有可能使毒性降低以及使功效最大化。本发明提供用于癌症免疫疗法的系统、组合物、免疫治疗剂和方法。这些组合物在免疫疗法中提供对基因表达和功能的可调谐调控。本发明也提供生物回路系统、效应物模块、刺激物响应元件(sre)和有效载荷、以及编码前述各物中的任一者的多核苷酸。在一个方面,本发明的系统、组合物、免疫治疗剂和其他组分可通过单独添加的刺激物来控制,此提供用以调控癌症免疫疗法的重大灵活性。此外,本发明的系统、组合物和方法也可与治疗剂诸如化学治疗剂、小分子、基因疗法和抗体组合。本发明的系统和组合物的可调谐性质有可能使免疫疗法的效能和功效持续时间改进。使用本发明组合物来以可逆方式使过继性转移的细胞的生物活性沉默允许使细胞疗法的潜力最大化而不以不可挽回方式进行杀灭以及终止疗法。特定来说,本发明提供用于在向患者施用之后对免疫疗法进行精细调谐的方法。这转而使免疫疗法的安全性和功效改进,并且使可受益于免疫疗法的受试者群体增加。ii.本发明组合物可直接控制蛋白质例如转基因表达和功能的多种策略是可用的。本发明提供显示小分子依赖性稳定性的新型蛋白质结构域。所述蛋白质结构域被称为去稳定结构域(dd)。在不存在它的结合配体下,dd导致可操作地连接于dd的有效载荷诸如目标蛋白质(poi)的降解,而在它的结合配体存在下,融合的dd和有效载荷可得以稳定,并且它的稳定性是剂量依赖性的。根据本发明,提供源于人hpde5(cgmp特异性5型磷酸二酯酶;也被称为cgmp特异性3',5'-环状磷酸二酯酶)蛋白的新型去稳定结构域。去稳定结构域(dd)突变体源于包含氨基酸序列seqidno.1(由核酸序列seqidno.2编码)的人pde5蛋白。hpde5dd突变体也可包含在人pde5的由核酸序列seqidno.339编码的催化结构域(seqidno.3)中的超过一个突变,例如两个、三个、四个、五个或更多个突变。这些hpde5dd可结合西地那非和/或伐地那非,并且得以稳定。在一些实施方案中,hpde5dd可包括甲硫氨酸附接于催化结构域的n末端(seqidno.237),由seqidno.4编码。根据本发明,提供生物回路系统,其在它们的核心处包含至少一个效应物模块系统。所述效应物模块系统包含至少一个具有与其缔合或整合的一个或多个刺激物响应元件(sre)的效应物模块。本发明的生物回路系统的总体构造说明于图1中。一般来说,可使刺激物响应元件(sre)可操作地连接于可为任何目标蛋白质(poi)(例如免疫治疗剂)的有效载荷构建体,以形成效应物模块。sre在由特定刺激物例如小分子活化时可产生信号或结果,以通过使致稳定信号或去稳定信号永存或任何其他类型的调控来向上或向下调控所连接有效载荷的转录和/或蛋白质水平。对生物回路系统的更加详细描述可见于共同拥有的美国临时专利申请号62/320,864(2016年4月11日提交)、62/466,596(2017年3月3日提交)和国际公布wo2017/180587中(所述专利各自的内容以引用的方式整体并入本文)。根据本发明,提供调谐用于免疫疗法的任何药剂的表达水平和活性的生物回路系统、效应物模块、sre和组分。特定来说,提供包含本文讨论的新型hpde5去稳定结构域的生物回路系统和效应物模块。如本文所用,“生物回路”或“生物回路系统”定义为生物系统内或适用于生物系统中的包含刺激物和至少一个对刺激物起响应的效应物模块的回路,其中对所述刺激物的响应产生在生物系统内,在生物系统之间,作为对生物系统的指示,或在生物系统上的至少一个信号或结果。生物系统通常应理解为任何细胞、组织、器官、器官系统或生物体,无论是动物性的、植物性的、真菌性的、细菌性的还是病毒性的。也应了解生物回路可为采用由本发明教导的刺激物或效应物模块,并且在诸如采用诊断性报告子系统、装置、测定或试剂盒的无细胞环境中实现信号或结果的人工回路。人工回路可与一个或多个电子、磁性或放射性部件或零件相关联。根据本发明,生物回路系统可为去稳定结构域(dd)生物回路系统、二聚化生物回路系统、受体生物回路系统和细胞生物回路系统。这些系统中的任一者都可充当朝向这些生物回路系统中的任何其他生物回路系统的信号。在一些实施方案中,本发明提供包含本发明的dd的生物回路系统、效应物模块和组合物。在一个方面,生物回路系统是dd生物回路系统。在本发明的一个方面,生物回路系统是dd生物回路系统。dd是hpde5源性dd。用于免疫疗法的效应物模块和sre根据本发明,提供调谐用于免疫疗法的任何药剂的表达水平和活性的生物回路系统、效应物模块、sre和组分。作为非限制性实例,免疫治疗剂可为抗体及其片段和变体、癌症特异性t细胞受体(tcr)及其变体、抗肿瘤特异性嵌合抗原受体(car)、嵌合转换受体、共抑制性受体或配体的抑制剂、共刺激性受体和配体的激动剂、细胞因子、趋化因子、细胞因子受体、趋化因子受体、可溶性生长因子、代谢因子、自杀基因、归巢受体、或在细胞和受试者中诱导免疫应答的任何药剂。如所陈述,本发明的生物回路包括至少一个效应物模块作为效应物模块系统的组分。如本文所用,“效应物模块”是包含至少(a)一个或多个刺激物响应元件(sre)和(b)一个或多个有效载荷(即目标蛋白质(poi))的单组分或多组分构建体或复合物。在本发明的情形下,sre是源于人pde5蛋白的dd。如本文所用,“刺激物响应元件(sre)”是效应物模块的组分,其与效应物模块的一个或多个有效载荷接合、相连、连接或缔合,并且在一些情况下,导致效应物模块对一种或多种刺激物的响应性质。如本文所用,sre对刺激物的“响应”性质可通过与刺激物的共价或非共价相互作用、直接或间接缔合、或结构或化学反应来表征。此外,任何sre对刺激物的响应都可为关于程度或种类的问题。响应可为部分响应。响应可为可逆响应。响应可最终导致受调控的信号或输出。所述输出信号可具有与刺激物相关的性质,例如产生在1%与100%之间的调节作用,或倍数化增加或降低,诸如2倍、3倍、4倍、5倍、10倍或更多倍。在一些实施方案中,本发明的生物回路系统包含刺激物和本发明的效应物模块。效应物模块的dd结合刺激物,并且调控所连接有效载荷的稳定性。dd可以在0与0.09之间的去稳定化比率来使目标蛋白质去稳定,其中所述去稳定化比率包括目标蛋白质在不存在对dd具有特异性的刺激物下的表达、功能或水平与以组成性方式以及在不存在对dd具有特异性的刺激物下表达的所述目标蛋白质的表达、功能或水平的比率。在一些实施方案中,dd可以1或更大的稳定化比率来使目标蛋白质稳定,其中所述稳定化比率包括目标蛋白质在存在刺激物下的表达、功能或水平与所述目标蛋白质在不存在刺激物下的表达、功能或水平的比率。在一些实施方案中,本发明提供用于调节蛋白质表达、功能或水平的方法。在一些方面,调节蛋白质表达、功能或水平是指以至少约20%,诸如以至少约30%、40%、50%、60%、70%、80%、85%、90%、95%和100%、或至少20-30%、20-40%、20-50%、20-60%、20-70%、20-80%、20-90%、20-95%、20-100%、30-40%、30-50%、30-60%、30-70%、30-80%、30-90%、30-95%、30-100%、40-50%、40-60%、40-70%、40-80%、40-90%、40-95%、40-100%、50-60%、50-70%、50-80%、50-90%、50-95%、50-100%、60-70%、60-80%、60-90%、60-95%、60-100%、70-80%、70-90%、70-95%、70-100%、80-90%、80-95%、80-100%、90-95%、90-100%或95-100%来调节表达、功能或水平。根据本发明,本发明的生物回路系统和效应物模块可用于响应于存在或不存在特异性结合整合在生物回路系统和效应物模块内的dd的配体来调控有效载荷的表达和活性。在一些方面,本发明的dd、效应物模块和生物回路系统可用于调控有效载荷在细胞或受试者中的表达、功能和活性。调控是指以至少约10%、或至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约85%、或至少约90%、或至少约95%、或至少约100%、或至少20-30%、20-40%、20-50%、20-60%、20-70%、20-80%、20-90%、20-95%、20-100%、30-40%、30-50%、30-60%、30-70%、30-80%、30-90%、30-95%、30-100%、40-50%、40-60%、40-70%、40-80%、40-90%、40-95%、40-100%、50-60%、50-70%、50-80%、50-90%、50-95%、50-100%、60-70%、60-80%、60-90%、60-95%、60-100%、70-80%、70-90%、70-95%、70-100%、80-90%、80-95%、80-100%、90-95%、90-100%或95-100%的水平来改变它的表达、功能和活性。在一些实施方案中,作为一种评估dd调节蛋白质表达、功能或水平的能力的方式,也可测量本发明的生物回路的突变系数。如本文所用,“突变系数”是指附接于特定dd突变体的目标蛋白质在不存在对sre具有特异性的刺激物下的表达、功能或水平相对于附接于所述特定dd突变体所源于的相应野生型序列以及在不存在刺激物下的所述目标蛋白质的蛋白质表达、功能或水平。突变系数指示去稳定突变对蛋白质的基础表达的影响,而与相应野生型蛋白质是否可在无任何突变下去稳定无关。在一些方面,突变系数比率是至少0,诸如至少0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、或至少0-0.1、0-0.2、0-0.3、0-0.4、0-0.5、0-0.6、0-0.7、0-0.8、0-0.9、0.1-0.2、0.1-0.3、0.1-0.4、0.1-0.5、0.1-0.6、0.1-0.7、0.1-0.8、0.1-0.9、0.2-0.3、0.2-0.4、0.2-0.5、0.2-0.6、0.2-0.7、0.2-0.8、0.2-0.9、0.3-0.4、0.3-0.5、0.3-0.6、0.3-0.7、0.3-0.8、0.3-0.9、0.4-0.5、0.4-0.6、0.4-0.7、0.4-0.8、0.4-0.9、0.5-0.6、0.5-0.7、0.5-0.8、0.5-0.9、0.6-0.7、0.6-0.8、0.6-0.9,0.7-0.8、0.7-0.9或0.8-0.9。在一些实施方案中,本发明提供用于通过测量稳定化比率、去稳定化比率和/或去稳定突变系数来调节蛋白质表达、功能或水平的方法。如本文所用,“稳定化比率”是目标蛋白质响应于刺激物的表达、功能或水平与所述目标蛋白质在不存在对sre具有特异性的刺激物下的表达、功能或水平的比率。在一些方面,稳定化比率是至少1,诸如至少1-10、1-20、1-30、1-40、1-50、1-60、1-70、1-80、1-90、1-100、20-30、20-40、20-50、20-60、20-70、20-80、20-90、20-95、20-100、30-40、30-50、30-60、30-70、30-80、30-90、30-95、30-100、40-50、40-60、40-70、40-80、40-90、40-95、40-100、50-60、50-70、50-80、50-90、50-95、50-100、60-70、60-80、60-90、60-95、60-100、70-80、70-90、70-95、70-100、80-90、80-95、80-100、90-95、90-100或95-100。如本文所用,“去稳定化比率”是目标蛋白质在不存在对效应物模块具有特异性的刺激物下的表达、功能或水平与以组成性方式以及在不存在对sre具有特异性的刺激物下表达的所述目标蛋白质的表达、功能或水平的比率。如本文所用,“组成性”是指未连接于sre的目标蛋白质的表达、功能或水平,因此在存在针对sre的刺激物下以及在不存在针对sre的刺激物下均表达。如本文所用,“去稳定突变系数”可定义为附接于dd的目标蛋白质在不存在对效应物模块具有特异性的刺激物下的表达或水平与附接于所述dd所源于的野生型蛋白质的所述蛋白质的表达、功能或水平的比率。在一些方面,去稳定化比率和/或去稳定突变系数是至少0,诸如至少0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、或至少0-0.1、0-0.2、0-0.3、0-0.4、0-0.5、0-0.6、0-0.7、0-0.8、0-0.9、0.1-0.2、0.1-0.3、0.1-0.4、0.1-0.5、0.1-0.6、0.1-0.7、0.1-0.8、0.1-0.9、0.2-0.3、0.2-0.4、0.2-0.5、0.2-0.6、0.2-0.7、0.2-0.8、0.2-0.9、0.3-0.4、0.3-0.5、0.3-0.6、0.3-0.7、0.3-0.8、0.3-0.9、0.4-0.5、0.4-0.6、0.4-0.7、0.4-0.8、0.4-0.9、0.5-0.6、0.5-0.7、0.5-0.8、0.5-0.9、0.6-0.7、0.6-0.8、0.6-0.9,0.7-0.8、0.7-0.9或0.8-0.9。效应物模块的sre可选自但不限于肽、肽复合物、肽-蛋白质复合物、蛋白质、融合蛋白、蛋白质复合物、蛋白质-蛋白质复合物。sre可包含一个或多个源于任何天然或突变蛋白质或抗体的区域。在这个方面,sre是在响应于刺激物时可调谐有效载荷的细胞内定位、分子内活化和/或降解的元件。在一些实施方案中,本发明的效应物模块可包含有助于效应物模块的表达和调控的额外特征,诸如一个或多个信号序列(ss)、一个或多个裂解和/或加工位点、一个或多个靶向肽和/或穿透肽、一个或多个标签和/或一个或多个接头。另外,本发明的效应物模块可进一步包含其他调控性部分诸如诱导型启动子、增强子序列、微小rna位点和/或微小rna靶向位点。各个方面或受调谐模态可为效应物模块或生物回路带来以差异性方式受调谐的特征。举例来说,sre可代表去稳定结构域,而蛋白质有效载荷中的突变可改变它的裂解位点或二聚化性质或半衰期,并且对一个或多个微小rna或微小rna结合位点的包括可赋予细胞去靶向或迁移特征。因此,本发明包括在它们的合理性方面是多因素性的生物回路。所述生物回路可被工程化来含有一个、两个、三个、四个或更多个受调谐特征。如图2中所示,对包含一个有效载荷即一个免疫治疗剂的代表性效应物模块实施方案进行说明。效应物模块的各组分可在无(a至f)或有(g至z,以及aa至dd)裂解位点下以各种排列加以定位或安置。任选接头可插入在效应物模块的各组分之间。图3至图6说明包含两个有效载荷即两个免疫治疗剂的代表性效应物模块实施方案。在一些方面,超过两个免疫治疗剂(有效载荷)可被包括在效应物模块中,受同一sre(例如同一dd)调控。两个或更多个药剂可直接彼此连接或加以分隔(图3)。sre可被安置在构建体的n末端、或构建体的c末端、或内部位置中。在一些方面,两个或更多个免疫治疗剂可为相同类型诸如两个抗体,或不同类型诸如car构建体和细胞因子il12。利用所述效应物分子的生物回路和组分在图7-图12中给出。如本文所用,“有效载荷”或“靶标有效载荷”定义为其功能待改变的任何蛋白质或核酸。有效载荷可包括任何编码或非编码基因或任何蛋白质或其片段、或融合构建体、或抗体。有效载荷经常与一个或多个sre(例如dd)缔合,并且可在本发明的多核苷酸中单独或与一个或多个dd组合编码。有效载荷自身可被改变(在蛋白质或核酸水平上),由此提供效应物模块的一层附加合理性。举例来说,有效载荷可被工程化或被设计来含有单一或多个影响有效载荷的稳定性或它对降解、裂解或迁移的易感性的突变。可对刺激物具有一定响应范围的dd与被改变来展现多种响应或多种等级的输出信号例如表达水平的有效载荷的组合产生优于本领域中的那些生物回路的生物回路。举例来说,突变或取代性设计,诸如其内容以引用的方式整体并入本文的wo2016048903中(具体来说在其中实施例1中)对于il12所创建的那些,可与本发明的dd联合用于任何蛋白质有效载荷中以创建双重可调谐生物回路。独立调谐dd与有效载荷两者的能力使本发明的效应物模块的使用范围极大增加。效应物模块可被设计来包括一个或多个有效载荷、一个或多个dd、一个或多个裂解位点、一个或多个信号序列、一个或多个标签、一个或多个靶向肽、以及一个或多个额外特征,包括存在或不存在一个或多个接头。本发明的代表性效应物模块实施方案说明于图2-图6中。在一些方面,dd可被安置在效应物模块构建体的n末端、或c末端、或内部。效应物模块的不同组分诸如dd、有效载荷和额外特征以线性方式组织在一个构建体中,或单独构建在单独构建体中。另外,本发明的效应物模块可进一步包含提供关于控制有效载荷的活性的灵活性的其他调控性部分诸如诱导型启动子、增强子序列、微小rna位点和/或微小rna靶向位点。本发明的有效载荷可为任何天然蛋白质和它们的变体、或融合多肽、抗体及其变体、转基因和治疗剂。生物回路系统的刺激物可为但不限于配体、小分子、环境信号(例如ph、温度、光照和亚细胞位置)、肽或代谢物。在本发明的一个方面,刺激物是hpde5dd结合配体,包括西地那非和伐地那非。本发明中提供dd、包含所述dd和有效载荷构建体的生物回路系统和效应物模块、其他组分的多肽;编码这些多肽及其变体的多核苷酸;包含这些多核苷酸的载体。载体可为质粒或病毒载体,包括但不限于慢病毒载体、逆转录病毒载体、重组aav载体和溶瘤性病毒载体。在sre内有效载荷相对于dd的位置可加以改变以实现最优dd调控。在一些实施方案中,有效载荷可融合于dd的n末端。在另一实施方案中,有效载荷可融合于dd的c末端。可将编码甲硫氨酸的任选起始密码子核苷酸序列添加至dd和/或有效载荷中。在一些实施方案中,超过一个生物回路系统可在同一细胞或生物体中组合用于控制各种蛋白质功能,所述生物回路系统各自使用不同对dd和配体,并且可加以单独调控。在一些实施方案中,本发明的生物回路可被修饰来使它们的免疫原性降低。免疫原性是对被视为外来的物质的一系列复杂应答的结果,并且可包括产生中和和非中和抗体,形成免疫复合物,补体活化、肥大细胞活化、炎症、过敏性应答和过敏性反应。若干因素可促进蛋白质免疫原性,包括但不限于蛋白质序列、施用途径和频率以及患者群体。在一优选实施方案中,蛋白质工程化可用于使本发明组合物的免疫原性降低。在一些实施方案中,用以使免疫原性降低的修饰可包括使源于本发明组合物的序列的经加工肽与mhc蛋白的结合降低的那些。举例来说,可对氨基酸进行修饰以使实际上无免疫表位或最小数目的免疫表位存在于本发明组合物中,所述免疫表位被预测会结合任何普遍mhc等位基因。用以鉴定已知蛋白质序列的mhc结合表位的若干方法在本领域中是已知的,并且可用于对本发明组合物中的表位评分。所述方法公开于美国专利公布号us20020119492、us20040230380和us20060148009中;所述专利各自的内容以引用的方式整体并入本文。表位鉴定和后续序列修饰可应用于使免疫原性降低。对免疫原性表位的鉴定可以实际方式或以计算方式实现。表位鉴定的实际方法可包括例如质谱测定法和组织培养/细胞技术。也可利用计算方法,其利用与抗原加工、装载和展示、结构和/或蛋白质组学数据相关的信息来鉴定可由抗原加工产生,并且可能具有在mhc的沟槽中达成良好结合的特征的肽。可将一个或多个突变引入本发明的生物回路中以致使所鉴定的表位的免疫原性较小或无免疫原性,同时维持功能性。在一些实施方案中,被工程化至本发明组合物的结构中以干扰抗原加工和肽装载的蛋白质修饰诸如糖基化和聚乙二醇化也可适用于本发明中。本发明组合物也可被工程化来包括非经典氨基酸侧链。国际专利公布号wo2005051975中讨论的用于使免疫原性降低的任何方法都可适用于本发明中(所述专利的内容以引用的方式整体并入本文)。在一个实施方案中,患者也可根据由他们的免疫细胞呈递的免疫原性肽加以分层,并且可作为参数用于确定可在治疗上受益于本发明组合物的患者群组。在一些实施方案中,可通过限制免疫蛋白酶体加工来实现免疫原性降低。蛋白酶体是一种以以下两种形式得见的重要细胞蛋白酶:组成性蛋白酶体,其在所有细胞类型中表达,并且其含有催化亚单位;以及免疫蛋白酶体,其在具有造血谱系的细胞中表达,并且其含有不同活性亚单位,所述活性亚单位被称为低分子量蛋白质(lmp),即lmp-2、lmp-7和lmp-10。免疫蛋白酶体展现改变的肽酶活性和裂解位点偏好,此导致更高效释放许多i类mhc表位。免疫蛋白酶体的一充分描述功能是产生具有疏水性c末端的肽,所述疏水性c末端可被加工以在i类mhc分子的沟槽中进行配合。deolp等人已显示免疫蛋白酶体可导致频繁裂解特定肽键,并且由此导致某一肽更快出现在抗原呈递细胞的表面上;以及肽数量得以提高(deolp等(2007)jimmunol178(12)7557-7562;其内容以引用的方式整体并入本文)。这个研究指示免疫蛋白酶体加工降低可伴有免疫原性降低。在一些实施方案中,本发明组合物的免疫原性可通过修饰编码本发明组合物的序列以阻止免疫蛋白酶体加工来降低。本发明的生物回路也可与免疫蛋白酶体选择性抑制剂组合来实现相同作用。适用于本发明中的抑制剂的实例包括uk-101(b1i选择性化合物)、ipsi-001、onx0914(pr-957)和pr-924(ipsi)。在一些实施方案中,本发明的效应物模块可包括一个或多个降解决定子来调谐表达。如本文所用,“降解决定子”是指蛋白质内足以达成由蛋白水解系统识别和降解的最小序列。降解决定子的一重要性质是它们是可转移的,也就是说,使降解决定子附接于序列会赋予对所述序列的降解。在一些实施方案中,降解决定子可附接于去稳定结构域、有效载荷或两者。在本发明的效应物模块内并入降解决定子会对效应物模块赋予额外蛋白质不稳定性,并且可用于使基础表达降低。在一些实施方案中,降解决定子可为n-降解决定子、磷酸降解决定子、热诱导型降解决定子、光敏性降解决定子、氧依赖性降解决定子。作为一非限制性实例,降解决定子可为鸟氨酸脱羧酶降解决定子,如由takeuchi等人(takeuchij等(2008).biochemj.2008年3月1日;410(2):401-7;其内容以引用的方式整体并入本文)所述。适用于本发明中的降解决定子的其他实例包括国际专利公布号wo2017004022、wo2016210343和wo2011062962中所述的降解决定子,所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,本发明的效应物模块可在它们的c末端包括降解决定子。降解决定子可包含-gg、-rg、-kg、-qg、-wg、-pg和-ag作为sre的倒数第二个和最终氨基酸。此外,某些-2氨基酸(d、e、v、i和l)可更加富含于效应物模块的c末端。其他降解决定子包括但不限于rxxg基序,其中x是任何氨基酸;c末端双谷氨酸(ee)基序;以及包含在-3位置处的精氨酸的基序。降解决定子也可选自r-3基序、g-末端、r在-3位置处、a-末端、a在-2位置处、v在-2位置处。koren等,2018,cell173,1–14中所述的任何降解决定子都可适用于本发明中(所述文献的内容以引用的方式整体并入本文)。在一些方面,效应物模块的表达可通过改变它的总体氨基酸组成来调谐。在一些方面,可调谐效应物模块的氨基酸组成以使基础表达降低。在一些实施方案中,基础表达可通过使效应物模块中大体积芳族残基诸如色氨酸(w)、苯丙氨酸(f)和酪氨酸(y)的数目增加来调谐。已知所述大体积氨基酸会使蛋白质稳定性降低。在一些实施方案中,如果需要sre的基础表达增加,那么sre的氨基酸组成可用酸性残基诸如但不限于天冬氨酸(d)和谷氨酸(e)、以及带正电荷赖氨酸(k)来丰富。在一些实施方案中,内质网相关的降解(erad)路径可用于使本文所述的有效载荷例如分泌型运载物和膜运载物的降解最优化。在一个实施方案中,可通过使用衔接蛋白或蛋白质结构域来将本发明的效应物模块导向ere3连接酶。内质网具有专门化机构来确保被配置至远端分泌路径的蛋白质正确折叠和组装成天然寡聚复合物。未能满足这个构象标准的蛋白质由erad路径降解,所述erad路径是折叠缺陷性蛋白质被选择以及最终由泛素蛋白酶体系统降解所经由的过程。erad通过涉及底物选择、跨越er膜进行转位、与聚泛素共价缀合、以及蛋白酶体降解的四个主要步骤来进行。可调节这些步骤中的任一者以使对本文所述的有效载荷和效应物模块的降解最优化。er膜内的蛋白质衔接头使底物识别与erad机构(在本文中被称为“转位通道”)相关联,此导致蛋白质从er进行转位。可用于使erad路径降解最优化的蛋白质衔接头的非限制性实例包括但不限于sel1l(使聚糖识别与转位通道相关联的衔接头)、erlins(膜间底物衔接头)、insigs(客户特异性衔接头)、f-box蛋白(充当细胞质中经转位糖蛋白的衔接头)和病毒编码的衔接头。根据本发明,提供源于人hpde5(cgmp特异性5型磷酸二酯酶)蛋白的新型去稳定结构域。去稳定突变体源于包含氨基酸序列seqidno.1(由核酸序列seqidno:2编码)的人pde5蛋白。hpde5dd突变体也可包含在人pde5的具有seqidno.3(由核酸序列seqidno.339编码)的催化结构域中的超过一个突变,例如两个、三个、四个、五个或更多个突变。这些hpde5dd可结合西地那非和/或伐地那非,并且得以稳定。去稳定结构域(dd)如本文所用,术语“去稳定结构域(dd)”是指在不存在配体下不稳定并且被降解,但其稳定性通过与高亲和力细胞可透性配体结合而得以挽救的蛋白质结构域。去稳定结构域(dd)可附接于靶标目标蛋白质(poi),并且可将它的去稳定性质传给目标蛋白质,从而导致蛋白质降解。与dd结合或相互作用的小分子配体的存在、不存在或数量可在所述结合或相互作用后调节有效载荷的稳定性,并且因此调节有效载荷的功能。当任何目标蛋白质与去稳定结构域融合时,具有去稳定性质的蛋白质结构域(例如dd)与细胞可透性配体联合用于调控所述任何目标蛋白质。dd致使相连的目标蛋白质在不存在dd结合配体下不稳定以使所述蛋白质由细胞的泛素-蛋白酶体系统快速降解。然而,当特异性小分子配体结合它的作为配体结合配偶体的预定dd时,不稳定性得以逆转,并且蛋白质功能得以恢复。dd稳定性的有条件性质允许从稳定蛋白质向不稳定底物进行快速和非扰动转换以达成降解。此外,它对它的配体的浓度的依赖性进一步提供对降解速率的可调谐控制。视结合和/或相互作用的程度而定,有效载荷的功能改变可变化,因此提供对有效载荷功能的“调谐”。归因于它的可逆性、特异性以及快速和易于调控蛋白质水平,所以转录后调谐系统提供一种适用于基因调控的系统。此外,调控可为剂量依赖性的,由此改变蛋白质转换速率以将短寿命或不可检测的蛋白质转变成持续一段受精确控制的时期来起作用的蛋白质(iwamoto等,chem.biol.2010,17:981–988)。在一些实施方案中,dd的所需特征可包括但不限于在不存在dd的配体下蛋白质水平较低(即低基础稳定性),大动态范围,稳健和可预测的剂量-响应特性,以及快速降解动力学。结合所需配体而非内源性分子的候选dd可为优选的。可使从已知野生型蛋白质的蛋白质结构域(作为模板)鉴定的候选去稳定结构域序列突变以产生基于模板候选结构域序列的突变体的文库。用于产生dd文库的诱变策略可包括例如通过使用结构引导的信息达成的定点诱变,或例如使用易出错pcr达成的随机诱变,或两者组合。在一些实施方案中,使用随机诱变鉴定的去稳定结构域可用于鉴定候选dd的可为去稳定化所需的结构性质,其可接着用于使用定点诱变来进一步产生突变文库。在一些实施方案中,新型dd可通过使候选去稳定结构域中的一个或多个氨基酸突变成邻近于突变位点的氨基酸来鉴定。如本文所用,邻近氨基酸是指在候选去稳定结构域的线性序列和/或晶体结构中位于突变位点的上游或下游1、2、3、4、5个或更多个氨基酸处的氨基酸。在一些实施方案中,邻近氨基酸可为保守氨基酸(与在突变位点处的氨基酸具有类似物理化学性质)、半保守氨基酸(例如从带负电荷氨基酸变为带正电荷氨基酸)或非保守氨基酸(相比于在突变位点处的氨基酸,具有不同物理化学性质)。在一些实施方案中,dd突变体文库可关于相较于野生型蛋白质,对配体具有改变的,优选是更高的结合亲和力的突变加以筛选。dd文库也可使用两种或更多种配体来筛选,并且可优先选择由一些配体稳定,但不由其他配体稳定的dd突变。也可选择相较于天然存在的蛋白质,优先结合配体的dd突变。所述方法可用于使dd的配体选择和配体结合亲和力最优化。另外,所述方法可用于使由脱靶配体结合引起的有害影响最小化。在一些实施方案中,适合dd可通过使用条形码筛选突变体文库来鉴定。所述方法可用于检测、鉴定和定量异质突变体文库内的个别突变体克隆。文库内的各dd突变体可具有(相对于彼此)独特的条形码序列。在其他情况下,多核苷酸也可具有关于2、3、4、5、6、7、8、9、10个或更多个核酸碱基而不同的条形码序列。文库内的各dd突变体也可包含多个条形码序列。当使用时,可使用多个条形码以使各条形码相对于任何其他条形码都是独特的。或者,所用各条形码可不是独特的,但所用条形码的组合可创建可加以个别地追踪的独特序列。条形码序列可被放置在sre的上游、sre的下游,或在一些情况下,可被放置在sre内。dd突变体可使用测序方法诸如sanger测序和下一代测序,但也采用聚合酶链式反应和定量聚合酶链式反应,通过条形码来鉴定。在一些实施方案中,扩增各条形码的不同大小产物的聚合酶链式反应引物可用于在琼脂糖凝胶上鉴定各条形码。在其他情况下,各条形码可具有使得能够对各条形码进行靶向扩增的独特定量聚合酶链式反应探针序列。本发明的发明者探究了若干人蛋白质,并且鉴定了新型人dd,所述dd可将它的不稳定性特征赋予所融合有效载荷,并且在不存在它的配体下有助于融合多肽快速降解,但响应于与它的配体的结合来使所融合有效载荷稳定。具体来说,新型dd源于人pde5蛋白。人pde5突变体在一些实施方案中,本发明的dd可源于人cgmp特异性5型磷酸二酯酶(pde5);基因名称:pde5a(在本文中被称为“hpde5”)。hpde5(磷酸二酯酶5)是3,5′-环状核苷酸磷酸二酯酶家族的成员,其使环状gmp(cgmp)降解/水解成它的非活性形式gmp,并且调控cgmp信号传导。cgmp/pde5信号传导促进在血管结构、中枢神经系统和肾中显现高血压。已知hpde5会结合小分子,诸如西地那非、伐地那非、他达那非、阿伐那非、罗地那非、米罗那非、乌地那非、本扎那非、达生他非、贝米那非、slx-2101、las34179、uk-343,664、uk-357903、uk-371800和bms-341400。西地那非、伐地那非、阿伐那非和他达那非是在临床上被核准用于治疗勃起功能异常的hpde5抑制剂。特定来说,这些小分子与hpde5的结合发生在催化结构域内。在一些实施方案中,本发明的dd可源于hpde5的包括hpde5(seqidno.1;genbank登录号076074.2)的残基535至860的催化结构域(seqidno.3),所述hpde5可由配体诸如hpde5的小分子抑制剂例如西地那非和伐地那非加以稳定。如本文所用,术语“pde5wt”或“hpde5wt”是指人野生型pde5蛋白质序列,其被定义为seqidno.1,具有genbank登录号076074.2。在一些实施方案中,本发明的dd可通过利用hpde5抑制剂的混合物来鉴定。在其他情况下,适合dd可通过首先用一种hpde5抑制剂进行筛选,并且随后用第二hpde5抑制剂进行筛选来鉴定。在一个实施方案中,hpde5源性dd可包含uniprotid:o76074的氨基酸序列(seqidno.1)或其部分或片段。在另一实施方案中,hpde5源性dd可包含uniprotid:o76074的从氨基酸位置535跨越至位置860的催化结构域(seqidno.3);由seqidno.339编码。除催化结构域之外,hpde5源性dd也可包含一个或多个gaf结构域和/或延伸超出催化结构域的c末端部分。在某一实施方案中,hpde5源性dd可通过测试由对hpde5的5'和/或3'末端进行截断所产生的构建体来鉴定。在一个实施方案中,hpde5源性dd可为截短的,并且可鉴定基于hpde5的最小dd。在另一实施方案中,hpde5源性dd可包括从seqidno.1的位置535至836的氨基酸,此移除c末端螺旋。在另一实施方案中,hpde5源性dd可由从uniprotid:o76074(seqidno.1)的位置567至860,或从uniprotid:o76074(seqidno.1)的位置590至860的氨基酸组成,此移除n末端结构域的一部分。在另一实施方案中,hpde5源性dd可由从uniprotid:o76074(seqidno.1)的位置590至836的氨基酸组成,此移除n末端结构域的一部分和c末端螺旋。dd可包括从uniprotid:o76074(seqidno.1)的位置535至位置875的氨基酸。在另一实施方案中,hpde5源性dd可由从uniprotid:o76074(seqidno.1)的位置466至875,或从uniprotid:o76074(seqidno.1)的位置420至875的氨基酸组成。根据本发明,若干hpde5去稳定突变通过使用定点诱变达成的对野生型人pde5的催化结构域的定点诱变来发现。测试突变体在不存在它的结合配体下的去稳定化。测试与人pde5的hpde5配体西地那非、他达那非和伐地那非的结合,并且表征配体依赖性稳定化。基于对结合于西地那非的hpde5的结构分析,选择若干残基用于诱变。在一些实施方案中,可对一个或多个本文所述的残基进行诱变以获得hpde5源性dd。可使在seqidno.1的位置853处的色氨酸突变成苯丙氨酸以诱导在结合位点附近的疏水性堆积,同时维持与在位置772处的邻近色氨酸的π键。可使在位置821处的异亮氨酸突变成缬氨酸或丙氨酸,此导致在结合位点附近的疏水性堆积。可使在位置829处的酪氨酸突变成异亮氨酸、缬氨酸或丙氨酸,此导致在结合位点附近的疏水性堆积。可使在位置656处的天冬氨酸突变成天冬酰胺或亮氨酸以破坏电荷以及环/螺旋上的盐桥。可使在位置728处的酪氨酸突变成苯丙氨酸或亮氨酸以破坏在位置732处的盐桥以及影响疏水性堆积。或者,可使在位置732处的精氨酸突变成赖氨酸或亮氨酸以产生使在位置728处的酪氨酸突变的相反作用。可使在位置625处的甲硫氨酸突变成亮氨酸或异亮氨酸以改变远离结合位点的堆积。在一些实施方案中,可优先选择不影响配体结合的去稳定突变。在一些实施方案中,本发明的新型去稳定结构域源于人pde5蛋白的包含氨基酸序列seqidno.3的催化结构域。在一些方面,去稳定突变结构域可包含一个、两个、三个、四个、五个或更多个突变,诸如但不限于m625i、d656l、y728l、r732l、f736a、f787a、i821a、y829a和w853f。本发明的dd可进一步包括额外突变,例如e535d、e536g、q541r、k555r、s560g、f559l、f561l、f564l、f564s、s766f、v585a、n587s、k591e、i599v、k604e、k608e、n609h、k630r、k633e、n636s、i648v、n661s、s663p、l675p、y676d、y676n、c677r、h678r、d687a、t711a、t712s、d724n、l738h、n742s、f744l、l746s、f755l、a762s、d764v、d764n、d764g、k795e、l797f、i799t、l804p、t802p、s815c、m816a、m816t、i824t、c839s、f840s和k852e。在一些实施方案中,可使任何本文公开的突变位点突变成任何已知氨基酸,诸如组氨酸、丙氨酸、异亮氨酸、精氨酸、亮氨酸、天冬氨酸、赖氨酸、半胱氨酸、甲硫氨酸、谷氨酸、苯丙氨酸、谷氨酰胺、苏氨酸、甘氨酸、色氨酸、脯氨酸、缬氨酸、丝氨酸、酪氨酸、天冬酰胺、硒代半胱氨酸、吡咯赖氨酸。在一些实施方案中,本发明的dd可由配体诸如西地那非、伐地那非、他达那非、阿伐那非、罗地那非、米罗那非、乌地那非、本扎那非、达生他非和贝米那非加以稳定。本发明中涵盖的去稳定结构域的氨基酸序列与其中阐述的氨基酸序列具有至少约40%、50或60%同一性,进一步具有至少约70%同一性,优选具有至少约75%或80%同一性,更优选具有至少约85%、86%、87%、88%、89%或90%同一性,并且进一步优选具有至少约91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。同一性百分比可例如通过以下方式来确定:使用可从美国国立卫生研究院(nationalinstitutesofhealth)获得的高级blast计算机程序,包括magic-blast1.2.0版本,将序列信息进行比较。blast程序基于karl和altschul(1990)proc.natl.acad.sciusa,87:2264-68(其内容以引用的方式整体并入本文)中讨论的比对方法。鉴定了若干hpde5去稳定突变体,并且提供于表1中。表1中所列的突变氨基酸的位置是关于具有seqidno.1的全长hpde5。表1中所述的结构域包括hpde5的催化结构域(例如seqidno.1的535-860)。在一些实施方案中,表1中所述的hpde5dd可包括在hpde5的催化结构域即pde5wt的氨基酸535-860的n末端的甲硫氨酸。在表1中,突变氨基酸用粗体表示并加下划线。表1:hpde5dd在一些实施方案中,源于hpde5的dd可包括一个、两个、三个、四个、五个或更多个在先前表(表1)中所述的突变。在一些实施方案中,源于hpde5的dd可进一步包含一个、两个、三个、四个、五个或更多个对hpde5的催化结构域的突变,并且所述突变可选自e535d、e536g、q541r、k555r、s560g、f559l、f561l、f564l、f564s、s766f、v585a、n587s、k591e、i599v、k604e、k608e、n609h、k630r、k633e、n636s、i648v、n661s、s663p、l675p、y676d、y676n、c677r、h678r、d687a、t711a、t712s、d724n、l738h、n742s、f744l、l746s、f755l、a762s、d764v、d764n、d764g、k795e、l797f、i799t、l804p、t802p、s815c、m816a、m816t、i824t、c839s、f840s和k852e(如表2中所列)。突变氨基酸的位置是关于具有seqidno.1的hpde5。在表2中,突变氨基酸加下划线并用粗体表示。表2中所列的突变氨基酸的位置是关于具有seqidno.1的全长hpde5。表2:额外hpde5dd在一些实施方案中,源于hpde5的dd可包括至少一个、两个、三个、四个或五个在表1中所列的突变与至少0、1、2、3、4、5个或更多个在表2中所列的突变的组合。在一些实施方案中,dd可通过使一个或多个在人pde5(seqidno.1)的催化结构域的位置530-550、550-570、570-590、590-610、620-640、640-660、660-680、680-700、710-730、730-750、750-770、770-790、790-810-830、830-850、850-860之间的氨基酸残基突变来由hpde5获得(seqidno.3)。在一些实施方案中,突变可为保守的(与在突变位点处的氨基酸具有类似物理化学性质)、半保守的(例如从带负电荷氨基酸变为带正电荷氨基酸)或非保守的(相比于在突变位点处的氨基酸,氨基酸具有不同物理化学性质)。在一些实施方案中,可使氨基酸赖氨酸突变成谷氨酸或精氨酸;可使氨基酸苯丙氨酸突变成亮氨酸;可使氨基酸亮氨酸突变成苯丙氨酸;或可使氨基酸天冬酰胺突变成丝氨酸。野生型蛋白质的区域或部分或结构域可完全地或部分地用作sre/dd。它们可加以组合或重排以创建新的肽、蛋白质、区域或结构域,其中任一者都可用作sre/dd或用作用于设计其他sre和/或dd的起始点。在一些实施方案中,dd可通过使在pde家族的所有成员内都保守的氨基酸残基突变来由hpde5获得。示例性保守残基包括但不限于全长人pde5(seqidno.1)的e682、h613、h617、h653、d654和h657残基,并且教导于sung等nature(2003)425,98-102(其内容以引用的方式整体并入本文)中。在其他实施方案中,可使对于与金属诸如锌和镁的结合至关重要的残基突变以鉴定新型hpde5dd。在一些实施方案中,hpde5源性dd可从hpde5催化结构域的突变体的文库鉴定,所述文库使用易出错pcr和通过随机诱变达成的核苷酸类似物诱变的组合所产生。通过定点诱变鉴定的任何突变都可与通过随机诱变鉴定的突变组合。在一些实施方案中,本文所述的dd可通过使hpde5(seqidno.1)的y612氨基酸突变来获得。在一些实施方案中,对y612氨基酸的突变可与任何本文所述的突变组合。hpde5与伐地那非以及hpde5与西地那非的独立共晶体已显示两种配体的一个环与hpde5的y612相互作用,所述y612是位于hpde5的催化位点内的氨基酸。相互作用通过与水分子的氢键以及通过疏水键而发生。消除氢键合潜力的y612f突变使由两种配体对hpde5活性的抑制增加。已显示导致消除氢键合潜力与疏水性键合潜力两者的y612a突变会使由伐地那非对hpde5催化活性的抑制减弱,以及在较小程度上使由西地那非对hpde5催化活性的抑制减弱。这些研究表明相比于对于西地那非来说,涉及y612的疏水性键合对于伐地那非来说更强烈(corbin等2006,internationaljournalofimpotenceresearch18,251-257;其内容以引用的方式整体并入本文)。本文所述的去稳定化结构域也可包括不影响稳定性的氨基酸和核苷酸取代,包括保守性、非保守性取代和/或多态性。在一些实施方案中,本文所述的hpde5dd也可为以上去稳定结构域的片段,包括含有变异氨基酸序列的片段。优选片段在不存在刺激物下不稳定,而在添加刺激物后得以稳定。优选片段保留以与本文所述的dd类似的效率与刺激物相互作用的能力。在一个实施方案中,hpde5突变体通过接头序列来在融合构建体的n末端或c末端融合于acgfp。具有uniprotidbae93141的acgfp(seqidno.363)可用作gfp模板,并且被称为acgfp的野生型或“wt”形式。在一些实施方案中,本文所述的hpde5突变体也可以可操作方式连接于荧光素酶(luc)基因,诸如萤火虫荧光素酶(fluc)或海肾荧光素酶(rluc)。本文所述的fluc蛋白质序列中的突变的位置基于seqidno.223与包含氨基酸序列seqidno.364的北美萤火虫(photinuspyralis)野生型荧光素酶序列(uniprotid:p08659.1)或“flucwt”的比较。融合蛋白的去稳定和配体依赖性稳定化性质可通过诸如蛋白质印迹和facs的方法来评估。融合于gfp的n末端的hpde5突变体提供于表3中。所有构建体都可克隆至本领域中已知和/或本文所述的任何载体诸如但不限于plvx.irespuro载体中。ot-hpde5c-036(ot-001232)被置于ef1a启动子的转录控制下,而表3中所述的其他构建体被置于cmv启动子的转录控制下。在表3中,星号指示终止密码子的翻译。表3也提供给定构建体标识符的替代性别名。这些别名由前缀ot标识。表3:hpde5-acgfp构建体除人pde5之外,其他磷酸二酯酶也可用于产生新型去稳定结构域。人pde超家族包括11个在结构上相关,但在功能上独特的基因家族(hpde1至hpde11)。这些基因家族在它们的细胞功能、一级结构、对camp和cgmp的亲和力、催化性质以及对特定活化剂、抑制剂、效应物和调控机理的响应方面不同。作为模块化蛋白质,hpde展现具有相异氨基末端调控区和保守羧基末端催化核心的共同结构组织。hpde家族蛋白质含有n末端调控区和c末端催化区。n末端调控区含有使个别hpde靶向不同亚细胞位置,并且允许个别hpde对不同翻译后修饰起特异性响应的结构决定簇。结构元件包括二聚化结构域、自抑制模块、对配体和变构效应物的结合位点。相比之下,x射线晶体结构分离的九个hpde家族(hpde1至hpde5以及hpde7至hpde10)的催化结构域已显示hpde的催化结构域共有由约350个氨基酸折叠成16个螺旋组成的类似地形图。遍及hpde家族,活性位点形成深度疏水性口袋,其含有hpde特有的含组氨酸特征基序hd(x2)h(x4)n(seqidno:8377)和对为催化功能所必需的两个二价金属离子的结合位点。在家族内,hpde对特定环状核苷酸的亲和力不同-一些hpde特异性水解camp(hpde4、hpde7和hpde8),而其他hpde水解cgmp(hpde5、hpde6和hpde9),并且一些hpde水解camp与cgmp两者(hpde1、hpde2、hpde3、hpde10和hpde11)。类似于hpde5,任何hpde家族成员的催化结构域或其他功能性结构域都可加以诱变以及关于去稳定突变加以筛选。各hpde蛋白的已知抑制剂也可关于配体依赖性稳定化加以测试。在一些实施方案中,磷酸二酯酶中影响蛋白质稳定性的已知突变可用于鉴定新型hpde源性dd。先前鉴定的突变包括但不限于hpde5(i778t)、或hpde6c(h602l)、hpde6c(e790k)、hpde6c(r104w)、hpde6c(y323n)和hpde6c(p391l)、或hpde4d(s752a)、hpde4d(s754a)、hpde4d(s752a、s754a)和hpde4d(e757a、e758a、d759a)(zhu等(2010)molcellbiol.4379-4390;alexandre等(2015).endocr.relat.cancer22(4):519-30;chegurup.等(2015)molcellneurosci;64:1–8;其各自的内容以引用的方式整体并入本文)。在一些实施方案中,新型dd可从也称为钙和钙调蛋白(calmodulin)依赖性磷酸二酯酶的hpde1产生。它具有三个亚型,即hpde1a、hpde1b和hpde1c。所述酶含有三个功能性结构域;保守催化核心、调控性n末端以及c末端。hpde1的催化结构域具有三个螺旋子结构域;n末端周期素(cyclin)折叠区、接头区和c末端螺旋束。长春西汀(vinpocetine)是hpde1的一种已知抑制剂。在一些实施方案中,新型dd可从作为水解camp与cgmp两者的双底物酶的hpde2产生。这个hpde的区别性特征是它由cgmp结合它的一个gaf结构域加以变构刺激。hpde2gaf-b结构域的晶体结构揭示gaf-b结构域以高亲和力和选择性结合cgmp。示例性hpde2抑制剂包括ehna(赤式-9-(2-羟基-3-壬基)腺嘌呤)、羟吲哚(oxindole)、pdp和bay60-7550。也可使用选择性抑制hpde2亚型的抑制剂,例如具有hpde2a选择性抑制作用的经取代吡啶并(2,3-b)吡嗪(参见例如美国专利号:9,527,841;其内容以引用的方式整体并入本文)。在一些实施方案中,新型dd可从优先水解camp的hpde3产生。如同其他hpde家族成员一样,它包含三个功能性结构域、保守催化核心、调控性末端以及c末端。hpde的催化核心的特征在于具有44个氨基酸的独特插入物。氨利酮(amrinone)、西洛他唑(cilostazol)、米力农(milrinone)、依诺昔酮(enoximone)和匹莫苯丹(pimobendan)是hpde3酶的抑制剂。在一些实施方案中,新型dd可从作为用于免疫应答调控的主要第二信使,并且负责水解camp的hpde4产生。存在hpde4的四个亚型,其中各亚型具有通过介导与骨架化蛋白质的相互作用来指定细胞定位的独特n末端区域,所述n末端区域可进一步包含上游保守区(ucr)。所有亚型都共有不变催化结构域。催化口袋衬有高度保守和不变的残基,包括与底物形成关键氢键的不变谷氨酰胺(q369)。对hpde-抑制剂复合物的晶体结构的分析表明两个保守残基为抑制剂结合所必需。与不变谷氨酰胺的氢键的形成决定抑制剂的定向,并且保守疏水性残基(i336和f340)形成使抑制剂锚定在口袋中的疏水性钳夹。许多小分子可抑制hpde4活性,其中一些经fda核准,诸如an2728(4-[(1-羟基-1,3-二氢-2,1-苯并氧杂硼杂环戊烯-5-基)氧基]苯甲腈)、阿普司特(apremilast)/cc10004(n-{2-[(1s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲基磺酰基)乙基]-1,3-二氧代-2,3-二氢-1h-异吲哚-4-基}乙酰胺)和罗氟司特(roflumilast)。抑制hpde4的其他小分子也包括e6005/rvt501、西洛司特(cilomilast)/sb-207,499、异丁司特(ibudilast)(av-411或mn-166)、松叶菊酮碱(mesembrenone)、吡拉米司特(piclamilast)/rp73401、咯利普兰(rolipram)、阿替唑兰(atizoram)/cp-80633、阿罗茶碱(arofylline)、cc-1088、卡曲司特(catramilast)、cgh-2466、西潘茶碱(cipamfylline)、屈他维林(drotaverine)、非明司特(filaminast)/way-pda641、ht-0712、dns-001、ici-63197、英米司特(indimilast)、伊索拉定(irsogladine)/mn1695、利米司特(lirimilast)/bay19-8004、奥米司特(oglemilast)、瑞米司特(revamilast)、ro20-1724、罗米司特(ronomilast)、gsk256066、dc-ta-46、awd12–281和ym-976。在一些实施方案中,新型dd可从hpde6产生。这个全酶包括hpde6α、hpde6β和/或两个相同抑制性亚单位hpde6γ。hpde6α和β形式包含三个结构域:两个n末端gaf结构域和一个c末端催化结构域。非催化gaf结构域负责进行cgmp结合。在一些实施方案中,新型dd可从作为由两个基因即hpde7a和hpde7b组成的camp特异性hpde的hpde7产生。如对于大多数其他hpde家族所确定,在n末端上不存在已知调控性结构域,但共有pka磷酸化位点存在于这个区域中。若干小分子可抑制pde7,包括brl-50481(n,n,2-三甲基-5-硝基苯磺酰胺)和asb16165(1-环己基-n-(6-(4-羟基-1-哌啶基)-3-吡啶基)-3-甲基-1h-噻吩并(2,3-c)吡唑-5-甲酰胺)。在一些实施方案中,新型dd可从hpde8产生。存在hpde8的两个亚家族,并且它们两者均对底物camp具有极高亲和力,并且对非特异性pde抑制剂ibmx不敏感。各蛋白质含有催化核心、pas(per、arnt和sim)和rec(接受)结构域。hpde8的催化核心的晶体结构将tyr748残基鉴定为对hpde8抑制剂结合和其他hpde蛋白与抑制剂的结合进行区分的独特残基。pf-04957325(pfizer)是hpde8的一种小分子抑制剂。在一些实施方案中,新型dd可从对cgmp具有最高亲和力的hpde9产生。hpde9a的一级结构是简单的,因为它似乎不含有见于其他hpde中的任何gaf结构域或其他n末端调控序列。催化口袋衬有高度保守和不变的残基,包括hpde9a2中与底物形成关键氢键的不变谷氨酰胺gln453。与不变谷氨酰胺的氢键的形成决定抑制剂的定向,并且保守疏水性残基形成使抑制剂锚定在口袋中,并且使它们的环结构抵靠hpde9a中的f456进行楔入的疏水性钳夹。经测试hpde9抑制剂可包括bay73-6691(1-(2-氯苯基)-6-[(2r)-3,3,3-三氟-2-甲基丙基]-1,5-二氢-4h-吡唑并[3,4-d]嘧啶-4-酮)、pf-04447943(6-[(3s,4s)-4-甲基-1-(嘧啶-2-基甲基)吡咯烷-3-基]-1-(噁烷-4-基)-2h-吡唑并[3,4-d]嘧啶-4-酮)和wyq-c28l。在一些实施方案中,新型dd可从可水解camp与cgmp两者的hpde10产生。如同一些其他hpde家族蛋白质一样,hpde10包含2个在n末端区域中的gaf结构域、蛋白质激酶a磷酸化位点和催化结构域。催化口袋衬有高度保守和不变的残基,包括hpde10a2中与底物形成关键氢键的不变谷氨酰胺q726。若干pde10抑制剂处于临床试验中,包括oms824、罂粟碱(papaverine)和pf-2545920(2-(4-(1-甲基-4-吡啶-4-基-1h-吡唑-3-基)苯氧基甲基)喹诺酮)。在一些实施方案中,新型dd可从hpde11产生。如同hpde10一样,新近发现的hpde11可水解camp与cgmp两者。它仅包含一个基因,具有四个亚型变体。最长变体hpde11a4具有两个n末端gaf结构域,而其他变体是这个变体的具有不同长度的截短形式。在一些实施方案中,与本文所述的hpde5相关的任何去稳定突变都可于其他磷酸二酯酶上加以结构定位以产生去稳定结构域。在一个实施方案中,使hpde5去稳定,并且随后导致在西地那非和/或伐地那非存在下达成稳定化的突变可被工程化于hpde6上。在一个实施方案中,使hpde5去稳定,并且随后导致在他达那非存在下达成稳定化的突变可被工程化于hpde11上。可用于获得新型dd的全长hpde和它们的催化结构域列于表4中。表4:人pde蛋白和它们的催化结构域的序列在一些实施方案中,hpde5源性去稳定结构域可源于hpde5的变体和/或亚型。三个亚型hpde5亚型1、hpde5亚型2和hpde5亚型3在它们的n末端区域处不同,并且所有3者都具有独特第一外显子继之以823个氨基酸的共同序列。因此,hpde5源性dd可源于hpde5亚型1(seqidno.1;由核苷酸序列seqidno.2编码)、hpde5亚型2(seqidno.147;由核苷酸序列seqidno.148的核苷酸113-2611或核苷酸序列seqidno.380编码)和/或hpde5亚型3(seqidno.149;由核苷酸序列seqidno.150的核苷酸95-2563或seqidno.381编码)。在一些实施方案中,hpde5dd可源于hpde5亚型x1(seqidno.382)。在一些实施方案中,本文鉴定的dd突变可向回定位于hpde5序列以鉴定dd热点。如本文所用的dd热点是指具有seqidno.1的hpde5内的其突变会导致从hpde5产生的刺激物响应性元件的“响应”性质的氨基酸。dd特征可通过饱和诱变来改进,所述饱和诱变涉及使在热点位置处的氨基酸突变成任何已知氨基酸,包括但不限于赖氨酸、天冬氨酸、谷氨酸、谷氨酰胺、天冬酰胺、组氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、甲硫氨酸、色氨酸、丙氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸、脯氨酸和甘氨酸。在一些情况下,热点突变的文库可通过定点诱变来产生,并且文库中的各突变体都通过接头诸如sg来融合于报告子蛋白质例如acgfp(seqidno.79)。可分析dd在存在以及不存在配体诸如西地那非、伐地那非和他达那非下的性质。在一些实施方案中,可使在具有seqidno.1的hpde5的位置732处的精氨酸(也被称为r732)突变成任何已知氨基酸,并且提供于表5a中。氨基酸r732的突变可包括但不限于r732l、r732a、r732g、r732v、r732i、r732p、r732f、r732w、r732y、r732h、r732s、r732t、r732d、r732e、r732q、r732n、r732m、r732c和r732k。在n末端或c末端融合于接头和gfp的hpde5突变体提供于表6中。在表5a中,突变用粗体表示。表5b提供可与表5a中所列的突变体组合以产生表6中所述的构建体的额外组分。在表6中,星号指示终止密码子的翻译。表6也提供给定构建体标识符的替代性别名。这些别名由前缀ot标识。表5a:hpde5r732突变体表5b:额外hpde5r732构建体组分表6:hpde5r732构建体在一些实施方案中,表1、表2和表5a中教导的任何突变都可加以组合。在一个实施方案中,组合突变提供于表7中。组合突变可连接于由核苷酸序列seqidno.372编码的acgfp(wt的氨基酸2-239)(seqidno.79);由核苷酸序列seqidno.94编码的acgfp(wt的氨基酸1-239)(seqidno.365);或由核苷酸序列seqidno.224编码的萤火虫荧光素酶fluc(n50d、n119g、s548i、k549a、l550v)(seqidno.223)。在一些实施方案中,构建体的各部分可通过接头例如由核苷酸序列(agtggt)编码的sg接头来连接。在一些实施方案中,表7中所述的构建体可包含由核苷酸序列tctaga编码的xbai限制位点sr。表7提供包含组合突变的构建体。在表7中,终止密码子的翻译由星号指示。表7中也提供给定构建体标识符的替代性别名。这些别名由前缀ot标识。表7:hpde5组合突变在一些实施方案中,任何本文所述的突变都可在截短hpde5结构域的情形下加以测试。如本文所用,截短hpde5结构域是指具有seqidno.1的hpde5的区域和/或部分,并且例示于表8中。表8中也提供利用hpde5的通过接头来融合于acgfp的区域或部分的构建体。在表8中,终止密码子的翻译由星号指示。表8也提供给定构建体标识符的替代性别名。这些别名由前缀ot标识。表8:hpde5截短构建体和它的组分刺激物本发明的生物回路由一种或多种刺激物触发。刺激物可选自配体、外部添加或内源性代谢物、确定配体的存在或不存在、ph、温度、光照、离子强度、放射性、细胞位置、主题位点、微环境、一种或多种金属离子的存在或浓度。在一些实施方案中,刺激物是配体。配体可为基于核酸的配体、基于蛋白质的配体、基于脂质的配体、有机配体,无机配体或前述各物的任何组合。在一些实施方案中,配体选自由以下组成的组:蛋白质、肽、核酸、脂质、脂质衍生物、固醇、类固醇、代谢物衍生物和小分子。在一些实施方案中,刺激物是小分子。在一些实施方案中,小分子是细胞可透性的。适用于本发明中的配体包括不限于共同拥有的美国临时专利申请号62/320,864(2016年4月11日提交)、62/466,596(2017年3月3日提交)和国际公布wo2017/180587(所述专利各自的内容以引用的方式整体并入本文)的表2中教导的那些配体中的任一者。在一些实施方案中,小分子是fda核准的安全和口服施用小分子。在一些实施方案中,配体结合磷酸二酯酶。在一些实施方案中,配体结合磷酸二酯酶并抑制磷酸二酯酶功能,并且在本文中被称为磷酸二酯酶抑制剂。在一些实施方案中,配体是结合磷酸二酯酶5的小分子。在一个实施方案中,小分子是hpde5抑制剂。hpde5抑制剂的实例包括但不限于西地那非、伐地那非、他达那非、阿伐那非、罗地那非、米罗那非、乌地那非、本扎那非、达生他非、贝米那非、slx-2101、las34179、uk-343,664、uk-357903、uk-371800和bms-341400。在一些实施方案中,配体包括西地那非衍生配体,其含有所述配体的已知会介导与hpde5的结合的部分。配体也可被修饰来使与磷酸二酯酶的脱靶结合降低,并且使与hpde5的特异性结合增加。hpde5抑制剂覆盖关于核准剂量和它们的作用持续时间的广泛药物动力学空间,并且描述于表9中。在表9中,po代表口服(即经口);qd代表每天(即每日);iv代表静脉内;tid代表每日三次(即一天三次);并且cmax代表药物在它的施用之后达到的峰值血清浓度。表9:hpde5抑制剂的药物动力学在一些实施方案中,使用表9中所述的pk参数,根据本发明的效应物模块的表达的量值和持续时间来决定配体选择。在一些实施方案中,可需要有效载荷持续短暂持续时间进行高水平表达。在所述情况下,伐地那非可选作配体。在一些实施方案中,可需要有效载荷持续长久持续时间进行高水平表达。在所述情况下,可选择配体他达那非。在一些实施方案中,可需要有效载荷持续长久持续时间进行低水平表达。在所述情况下,西地那非可选作配体。在一些实施方案中,可开发额外hpde5抑制剂以显示对特定磷酸二酯酶蛋白质的选择性;使以配体进行处理的持续时间降低或增加;以及使配体的起效速率改进。也可通过结构活性关系(sar)研究,根据对已知hpde5配体的活性对它的分子/化学结构的依赖性的分析来选择配体。本领域中已知的任何与sar相关的方法都可用于鉴定本发明的致稳定配体。sar可用于改进配体的性质,诸如特异性、效能、药物动力学、生物可用度和安全性。对已知hpde5抑制剂的sar分析也可与hpde5与配体复合的高分辨率x射线结构组合。已研究hpde5与西地那非、他达那非和伐地那非共结晶的x射线结构,并且已鉴定抑制剂的结合模式(zhang,k.y.j.等(2004)mol.cell.,15,279;card,g.l.等(2004)structure.12,2233;其各自的内容以引用的方式整体并入本文)。存在经描述的若干类别的hpde5抑制剂。这些类别包括具有不同骨架结构的芳基、联芳、杂芳基或杂联芳类别。芳基类别包括经取代硝基苯胺,并且联芳类别包括经取代萘。杂联芳和杂三芳基基于它的稠合系统被进一步再分类成吡唑并嘧啶酮、三唑并嘧啶酮、咪唑并三嗪、嘌呤、吡咯并嘧啶酮、三唑并三嗪酮、异噁唑并嘧啶酮、β-咔啉、吡咯并喹诺酮、异喹啉、喹唑啉、咪唑并喹唑啉酮、吡唑并吡啶、吡唑并吡啶并嘧啶酮。这些广泛不同的化学结构被表明在hpde5酶的结合位点中具有不同定向。西地那非具有三个主要化学基团,即吡唑并嘧啶酮环、乙氧基苯基环和甲基哌嗪环。吡唑并嘧啶酮基团负责药物与它的在hpde5中的活性结合位点的结合。许多hpde抑制剂通过与底物cgmp竞争酶的催化位点来起作用。西地那非和伐地那非在用于模拟cgmp的嘌呤环的杂环系统方面不同。它们也在哌嗪侧链的取代基(乙基/甲基)方面不同。尽管这些是仅有的结构差异,但伐地那非比西地那非更强效。在一些实施方案中,hpde的不同已知抑制剂之间的结构差异可用于设计更好的基于hpde抑制剂的配体。举例来说,corbin等人合成了西地那非的含有西地那非环系统,但具有见于伐地那非中的附接乙基的类似物;并且也产生了伐地那非的含有伐地那非环系统,但具有见于西地那非中的附接甲基的类似物(二甲基-伐地那非)。这些研究认明环系统在伐地那非的效能高于西地那非方面起关键作用(corbinjd等(2004)neurochemint;45(6):859-63;其内容以引用的方式整体并入本文)。基于hpde与西地那非复合的x射线晶体结构,活性位点区域被确定为在离参照配体西地那非6.5埃内的球体。可基于这个信息来产生hpde5活性位点的表面疏水性(亲脂性)电势物理化学性质图。西地那非的乙氧基苯基配合至由phe786、ala783、leu804和val782形成的疏水性口袋中,并且吡唑并嘧啶酮环也与结合口袋中的val782、tyr612和phe820的侧链形成疏水性相互作用。也可使用已知hpde5抑制剂的一系列类似物来开发新型hpde5抑制剂。3d定量结构活性分析(qsar)、comfa(比较分子场分析)和comsia(比较分子类似性指数分析)可出于这个目的加以执行。在一个实施方案中,hpde5抑制剂的结构可优先并有在n5位置处在吡咯并嘧啶酮环中的n乙基;和携带取代基的丙氧基苯基;相较于西地那非的相应位置,分别加长一个亚甲基单元。由kooj等人教导的对西地那非结构的任何修饰都可适用于本发明中(kooj等(2007)bioorg.&med.chemlett17;4271–4274;其内容以引用的方式整体并入本文)。在一些实施方案中,刺激物可为结合超过一种磷酸二酯酶的配体。在一个实施方案中,刺激物是可结合两种或更多种hpde的全磷酸二酯酶抑制剂,诸如氨茶碱(aminophyline)、副黄嘌呤(paraxanthine)、己酮可可碱(pentoxifylline)、可可碱(theobromine)、双嘧达莫(dipyridamole)、茶碱(theophyline)、扎普司特(zaprinast)、淫羊藿苷(icariin)、cdp-840、依地唑酯(etazolate)和海罂粟碱(glaucine)。在一些实施方案中,配体是hpde1抑制剂。在一些情况下,示例性hpde1抑制剂长春西汀可用作本发明中的配体。在一些实施方案中,配体是hpde2抑制剂。示例性hpde2抑制剂包括ehna(赤式-9-(2-羟基-3-壬基)腺嘌呤)、羟吲哚、pdp和bay60-7550。也可使用选择性抑制hpde2亚型的抑制剂,例如具有hpde2a选择性抑制作用的经取代吡啶并(2,3-b)吡嗪(参见例如美国专利号:9,527,841;其内容以引用的方式整体并入本文)。在一些实施方案中,配体是hpde3抑制剂。适用于本发明中的hpde3抑制剂包括但不限于氨利酮、西洛他唑、米力农、依诺昔酮和匹莫苯丹。在一些实施方案中,配体是hpde4抑制剂。示例性hpde4抑制剂包括fda核准的小分子,诸如但不限于an2728(4-[(1-羟基-1,3-二氢-2,1-苯并氧杂硼杂环戊烯-5-基)氧基]苯甲腈)、阿普司特/cc10004(n-{2-[(1s)-1-(3-乙氧基-4-甲氧基苯基)-2-(甲基磺酰基)乙基]-1,3-二氧代-2,3-二氢-1h-异吲哚-4-基}乙酰胺)和罗氟司特。其他示例性hpde4抑制剂包括抑制hpde4的其他小分子,所述其他小分子也包括e6005/rvt501、西洛司特/sb-207,499、异丁司特(av-411或mn-166)、松叶菊酮碱、吡拉米司特/rp73401、咯利普兰、阿替唑兰/cp-80633、阿罗茶碱、cc-1088、卡曲司特、cgh-2466、西潘茶碱、屈他维林、非明司特/way-pda641、ht-0712、dns-001、ici-63197、英米司特、伊索拉定/mn1695、利米司特/bay19-8004、奥米司特、瑞米司特、ro20-1724、罗米司特、gsk256066、dc-ta-46、awd12–281和ym-976。国际专利公布号wo2014078220a1和美国专利公布号us20170129887a1中所述的任何hpde4抑制剂都可适用于本发明中(所述专利各自的内容以引用的方式整体并入本文)。在一些实施方案中,配体是hpde6抑制剂。在一些实施方案中,配体是hpde7抑制剂。示例性hpde7抑制剂包括brl-50481(n,n,2-三甲基-5-硝基苯磺酰胺)和asb16165(1-环己基-n-(6-(4-羟基-1-哌啶基)-3-吡啶基)-3-甲基-1h-噻吩并(2,3-c)吡唑-5-甲酰胺)。在一些实施方案中,配体是hpde8抑制剂诸如pf-04957325(pfizer)。在一些实施方案中,配体是hpde9抑制剂。示例性hpde9抑制剂包括但不限于bay73-6691(1-(2-氯苯基)-6-[(2r)-3,3,3-三氟-2-甲基丙基]-1,5-二氢-4h-吡唑并[3,4-d]嘧啶-4-酮)、pf-04447943(6-[(3s,4s)-4-甲基-1-(嘧啶-2-基甲基)吡咯烷-3-基]-1-(噁烷-4-基)-2h-吡唑并[3,4-d]嘧啶-4-酮)和wyq-c28l。在一些实施方案中,配体是hpde10抑制剂。示例性pde10抑制剂包括但不限于oms824、罂粟碱和pf-2545920(2-(4-(1-甲基-4-吡啶-4-基-1h-吡唑-3-基)苯氧基甲基)喹诺酮)以及gs-5759(gilead)。在一个实施方案中,本发明的刺激物可为fda核准的能够结合特定dd或靶向dd内的区域的配体。在其他实施方案中,fda核准的配体可用于筛选人蛋白质中的潜在结合剂。dd可基于来自筛选的阳性命中物,使用蛋白质的结合配体的部分来设计。在一个实施方案中,作为脱靶相互作用结合fda核准的配体的蛋白质可用于设计本发明的dd。在一些实施方案中,可优选选择在不存在sre下不影响免疫细胞和/或嵌合抗原受体的活性的配体。致稳定结构域在一些实施方案中,刺激物响应元件可在不存在刺激物下稳定,但由刺激物去稳定。在一些实施方案中,sre可源于包含至少一种蛋白质-蛋白质相互作用的蛋白质复合物。在其他方面,sre可与细胞内的天然蛋白质形成蛋白质-蛋白质相互作用。蛋白质复合物通过使游离单体状态的浓度降低来使组成蛋白质对非所需寡聚化风险的暴露降低。附接于所述sre的有效载荷可在不存在刺激物下稳定。在一些方面,刺激物可为能够打断或破坏与sre相关的蛋白质-蛋白质相互作用的小分子。在所述情况下,添加刺激物会导致有效载荷的表达和/或功能降低。在一些实施方案中,可利用诱导sre的构象变化的刺激物。在一个方面,sre可通过构象变化而稳定。在另一方面,sre可通过构象变化而去稳定。刺激物也可为破坏对sre的翻译后修饰的小分子,所述破坏可导致对与sre相关的蛋白质-蛋白质相互作用的破坏。在一些实施方案中,sre可使用本领域中已知的蛋白质相互作用组学技术来鉴定。所述方法可使得能够鉴定在治疗上相关的蛋白质相互作用。国际专利公布号wo2017210427a1、wo2016196994a9和wo2014200987a3中所述的任何大规模定量蛋白质组学方法都可适用于本发明中(所述专利各自的内容以引用的方式整体并入本文)。有效载荷在一些实施方案中,有效载荷可为生物体基因组中的任何天然蛋白质、融合多肽、抗体或其变体、突变体和衍生物。在一些实施方案中,本发明的效应物模块是包含本发明的dd可操作地连接于至少一个有效载荷的融合构建体。在一个方面,有效载荷可为任何天然目标蛋白质(poi)或其变体、抗体或其片段、治疗剂、或任何人工肽或多肽。在一些实施方案中,本发明的有效载荷可为免疫治疗剂。如本文所用,免疫治疗剂是在生物体中诱导免疫应答的任何药剂。免疫治疗剂可为生物体中的天然蛋白质,或它可为人工蛋白质诸如融合蛋白或抗体。免疫治疗剂可为但不限于抗体及其片段和变体、mhc分子、抗原及其片段、t细胞受体(tcr)诸如肿瘤特异性tcr及其变体、嵌合抗原受体(car)、嵌合转换受体、共刺激性分子、共抑制性分子、共抑制性受体或配体的抑制剂、共刺激性受体和配体的激动剂、细胞因子、趋化因子、细胞因子受体、趋化因子受体、可溶性生长因子、代谢因子、归巢受体、安全性开关(例如自杀基因)、或诱导免疫应答的任何药剂。在一个实施方案中,免疫治疗剂在细胞中或在受试者中诱导抗癌免疫应答。在一些方面,免疫治疗剂使受试者中的肿瘤负荷降低。有效载荷可为用于癌症免疫疗法的任何免疫治疗剂,诸如t细胞受体(tcr)、靶向肿瘤细胞的任何分子的嵌合剂受体(car)诸如cd19car、抗体、抗原结合结构域或抗原结合结构域的组合、细胞因子诸如il2、il12、il15或il15/il15ra融合物,免疫检查点的拮抗剂、共刺激性分子的激动剂、嵌合转换受体、安全性开关、代谢因子、生长因子、趋化因子、趋化因子受体、归巢受体、或可诱导免疫应答的任何药剂。sre和有效载荷可通过一个或多个接头来可操作地连接,并且效应物模块内各组分的位置可变化。1.目标蛋白质在一些实施方案中,本发明的有效载荷可为生物体基因组中的天然蛋白质、或其变体、突变体、衍生物。天然蛋白质可来自例如哺乳动物生物体、细菌和病毒。在一个实例中,有效载荷可为目标蛋白质或来自人基因组的多肽。2.抗体在一些实施方案中,抗体、其片段和变体是本发明的有效载荷。抗体可为完整抗体、抗体轻链、抗体重链、抗体片段、抗体变体或抗体衍生物。在一些实施方案中,本发明的有效载荷可为抗体或其片段。适用于这个方法中的抗体包括不限于共同拥有的美国临时专利申请号62/320,864(2016年4月11日提交)、62/466,596(2017年3月3日提交)和国际公布wo2017/180587(所述专利各自的内容以引用的方式整体并入本文)中教导的那些抗体中的任一者。抗体片段和变体在一些实施方案中,抗体片段和变体可包含来自完整抗体的抗原结合区。抗体片段和变体的实例可包括但不限于fab、fab'、f(ab')2和fv片段;微型双功能抗体;线性抗体;单链抗体分子诸如单链可变片段(scfv);和由抗体片段形成的多特异性抗体。用木瓜蛋白酶消化抗体会产生两个相同抗原结合片段,称为“fab”片段,各自具有单一抗原结合位点。也产生残余“fc”片段,其名称反映它能够易于结晶。胃蛋白酶处理会产生具有两个抗原结合位点,并且仍然能够与抗原交联的f(ab')2片段。本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷可包含这些片段中的一者或多者。出于本文目的,“抗体”可包含重可变结构域和轻可变结构域以及fc区。如本文所用,术语“天然抗体”通常是指具有约150,000道尔顿(dalton),由两个相同轻(l)链和两个相同重(h)链组成的异四聚糖蛋白。编码抗体重链和轻链的基因是已知的,并且组成各者的区段已加以充分表征和描述(matsuda等,thejournalofexperimentalmedicine.1998,188(11):2151-62以及li等,blood,2004,103(12):4602-4609;其各自的内容以引用的方式整体并入本文)。各轻链通过一个共价二硫键连接于重链,而在不同免疫球蛋白同种型的重链之间,二硫键的数目有变化。各重链和轻链也具有规则间隔的链内二硫桥。各重链在一端具有可变结构域(vh),继之以许多恒定结构域。各轻链具有在一端的可变结构域(vl)和在它的另一端的恒定结构域;轻链的恒定结构域与重链的第一恒定结构域对准,而轻链可变结构域与重链的可变结构域对准。如本文所用,术语“可变结构域”是指见于抗体重链与轻链两者上的特定抗体结构域,其在各抗体之间在序列方面广泛不同,并且用于达成各特定抗体对它的特定抗原的结合和特异性。可变结构域包含高变区。如本文所用,术语“高变区”是指可变结构域内包含负责抗原结合的氨基酸残基的区域。存在于高变区内的氨基酸决定变为抗体的抗原结合位点的一部分的互补决定区(cdr)的结构。如本文所用,术语“cdr”是指抗体的包含互补于它的靶标抗原或表位的结构的区域。可变结构域的不与抗原相互作用的其他部分被称为框架(fw)区。抗原结合位点(antigen-bindingsite)(也称为抗原结合位点(antigencombiningsite)或互补位)包含为与特定抗原相互作用所必需的氨基酸残基。组成抗原结合位点的确切残基通常通过与所结合抗原一起进行共晶体照相术来阐明,然而,也可使用基于与其他抗体的比较的计算评估(strohl,w.r.therapeuticantibodyengineering.woodheadpublishing,philadelphiapa.2012.第3章,第47-54页,其内容以引用的方式整体并入本文)。对组成cdr的残基进行确定可包括使用编号流程,包括但不限于由kabat(wu等,jem,1970,132(2):211-250以及johnson等,nucleicacidsres.2000,28(1):214-218,其各自的内容以引用的方式整体并入本文)、chothia(chothia和lesk,j.mol.biol.1987,196,901,chothia等,nature,1989,342,877,以及al-lazikani等,j.mol.biol.1997,273(4):927-948,其各自的内容以引用的方式整体并入本文)、lefranc(lefranc等,immunomeres.2005,1:3)和honegger(honegger和pluckthun,j.mol.biol.2001,309(3):657-70,其内容以引用的方式整体并入本文)教导的那些。vh结构域和vl结构域各自具有三个cdr。vlcdr在本文中被称为cdr-l1、cdr-l2和cdr-l3,按照沿可变结构域多肽从n末端向c末端移动时的出现顺序。vhcdr在本文中被称为cdr-h1、cdr-h2和cdr-h3,按照沿可变结构域多肽从n末端向c末端移动时的出现顺序。各cdr具有有利的典型结构,例外之处是cdr-h3,其包含可在各抗体之间在序列和长度方面高度可变的氨基酸序列,从而导致在抗原结合结构域中具有多种三维结构(nikoloudis等,peerj.2014,2:e456)。在一些情况下,可分析一组相关抗体之中的cdr-h3以评估抗体多样性。确定cdr序列的各种方法在本领域中是已知的,并且可应用于已知抗体序列(strohl,w.r.therapeuticantibodyengineering.woodheadpublishing,philadelphiapa.2012.第3章,第47-54页,其内容以引用的方式整体并入本文)。如本文所用,术语“fv”是指包含抗体上为形成完整抗原结合位点所需的最小片段的抗体片段。这些区域由紧密非共价缔合的一个重链可变结构域和一个轻链可变结构域的二聚体组成。fv片段可通过蛋白水解裂解来产生,但基本上是不稳定的。用于产生稳定fv片段的重组方法在本领域中是已知的,通常通过在轻链可变结构域与重链可变结构域之间插入柔性接头(以形成单链fv(scfv))或通过在重链可变结构域与轻链可变结构域之间引入二硫桥(strohl,w.r.therapeuticantibodyengineering.woodheadpublishing,philadelphiapa.2012.第3章,第46-47页,其内容以引用的方式整体并入本文)。如本文所用,术语“轻链”是指来自任何脊椎动物物种的抗体的基于恒定结构域的氨基酸序列而被指定为称为κ(kappa)和λ(lambda)的两种明确不同类型中的一者的组分。视它们的重链的恒定结构域的氨基酸序列而定,抗体可被指定为不同类别。存在完整抗体的五个主要类别:iga、igd、ige、igg和igm,并且这些类别中的若干可进一步分成子类(同种型),例如igg1、igg2、igg3、igg4、iga和iga2。如本文所用,术语“单链fv”或“scfv”是指vh抗体结构域和vl抗体结构域的融合蛋白,其中这些结构域由柔性肽接头连接在一起成为单一多肽链。在一些实施方案中,fv多肽接头使得scfv能够形成抗原结合所需的结构。在一些实施方案中,scfv与噬菌体展示、酵母展示或其他展示方法联合加以利用,其中它们可与表面成员(例如噬菌体外壳蛋白)联合表达,并且用于鉴定对给定抗原具有高亲和力的肽。使用分子遗传学,两个scfv可被串联工程化成由接头结构域分隔的单一多肽,称为“串联scfv”(tascfv)。用两个不同scfv的基因构建tascfv会产生“双特异性单链可变片段”(双scfv)。仅有两种tascfv已由商业公司在临床上加以开发;两者均是处于由micromet进行的活跃早期阶段开发中的针对肿瘤学适应症的双特异性药剂,并且被描述为“双特异性t细胞衔接物(bite)”。博纳吐单抗(blinatumomab)是一种处于2期中的使对b细胞非霍奇金淋巴瘤的t细胞应答增强的抗cd19/抗cd3双特异性tascfv。mt110是一种处于1期中的使对实体肿瘤的t细胞应答增强的抗ep-cam/抗cd3双特异性tascfv。双特异性四价“tandab”也正由affimed(nelson,a.l.,mabs.,2010年1月-2月;2(1):77–83)加以研究。也可包括大抗体(maxibody)(融合于igg的fc(ch2-ch3结构域)的氨基末端的二价scfv)。如本文所用,术语“双特异性抗体”是指能够结合两种不同抗原的抗体。所述抗体通常包含来自至少两种不同抗体的区域。双特异性抗体可包括riethmuller,g.cancerimmunity.2012,12:12-18,marvin等,2005.actapharmacologicasinica.2005,26(6):649-658以及schaefer等,pnas.2011,108(27):11187-11192中所述的那些双特异性抗体中的任一者,所述文献各自的内容以引用的方式整体并入本文。在一些方面,双特异性抗体可为三功能性抗体(3funct)和bite(双特异性t细胞衔接物)。如本文所用,术语“微型双功能抗体”是指具有两个抗原结合位点的小抗体片段。微型双功能抗体是功能性双特异性单链抗体(bscab)。微型双功能抗体包含在同一多肽链中重链可变结构域vh连接于轻链可变结构域vl。通过使用太短以致不允许在同一链上的两个结构域之间进行配对的接头,结构域被迫与另一链的互补结构域配对,并且产生两个抗原结合位点。微型双功能抗体更充分描述于例如ep404,097;wo93/11161;以及hollinger等人的(hollinger,p.等,“diabodies”:smallbivalentandbispecificantibodyfragments.pnas,1993.90:6444-6448)中;所述专利和文献各自的内容以引用的方式整体并入本文。术语“胞内抗体”是指一种不从它在其中产生的细胞分泌,而是靶向一种或多种细胞内蛋白质的抗体形式。胞内抗体可用于影响众多细胞过程,包括但不限于细胞内迁移、转录、翻译、代谢过程、增殖信号传导和细胞分裂。在一些实施方案中,本发明方法可包括基于胞内抗体的疗法。在一些所述实施方案中,本文公开的可变结构域序列和/或cdr序列可并入一个或多个构建体中以达成基于胞内抗体的疗法。如本文所用,术语“单克隆抗体”是指从大致上同质的细胞(或克隆)的群体获得的抗体,即除可在单克隆抗体的产生期间产生的可能变体(所述变体通常少量存在)之外,构成所述群体的个别抗体是相同的和/或结合相同表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相比,各单克隆抗体针对抗原上的单一决定簇。修饰语“单克隆”将抗体的特性指示为从大致上同质抗体群体获得,并且不应解释为需要通过任何特定方法来产生抗体。本文单克隆抗体包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分与源于特定物种或属于特定抗体类别或子类的抗体中的相应序列相同或同源,而一个或多个链的其余部分与源于另一物种或属于另一抗体类别或子类的抗体中的相应序列相同或同源;以及所述抗体的片段。如本文所用,术语“人源化抗体”是指包含来自一个或多个非人(例如鼠)抗体来源的最小部分,而其余部分源于一个或多个人免疫球蛋白来源的嵌合抗体。在很大程度上,人源化抗体是人免疫球蛋白(接受者抗体),其中来自接受者的抗体的高变区的残基被来自诸如小鼠、大鼠、兔或非人灵长类动物的非人物种的抗体(供体抗体)的高变区的具有所需特异性、亲和力和/或能力的残基置换。在一个实施方案中,抗体可为人源化全长抗体。作为一非限制性实例,抗体可已使用美国专利公布号us20130303399中教导的方法加以人源化,所述专利的内容以引用的方式整体并入本文。如本文所用,术语“抗体变体”是指经修饰抗体(相对于天然或起始抗体)或在结构和/或功能方面类似于天然或起始抗体的生物分子(例如抗体模拟物)。相较于天然抗体,抗体变体可在它们的氨基酸序列、组成或结构方面加以改变。抗体变体可包括但不限于具有改变的同种型(例如iga、igd、ige、igg1、igg2、igg3、igg4或igm)的抗体、人源化变体、最优化变体、多特异性抗体变体(例如双特异性变体)和抗体片段。在一些实施方案中,本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷可为抗体模拟物。如本文所用,术语“抗体模拟物”是指模拟抗体的功能或作用,并且以特异性方式以及以高亲和力结合它们的分子靶标的任何分子。在一些实施方案中,抗体模拟物可为单域抗体(monobody),其被设计来并有iii型纤维连接蛋白结构域(fn3)作为蛋白质骨架(us6,673,901;us6,348,584)。在一些实施方案中,抗体模拟物可为本领域中已知的那些,包括但不限于亲和体分子、affilin、affitin、抗运载蛋白(anticalin)、亲合多聚体、centyrin、darpinstm、fynomer以及库尼茨(kunitz)和结构域肽。在其他实施方案中,抗体模拟物可包括一个或多个非肽区域。在一个实施方案中,抗体可包含经修饰fc区。作为一非限制性实例,经修饰fc区可通过美国专利公布号us20150065690中所述的方法来制备,或可为美国专利公布号us20150065690中所述的任何区域,所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可编码结合超过一个表位的多特异性抗体。如本文所用,术语“多抗体”或“多特异性抗体”是指其中两个或更多个可变区结合不同表位的抗体。表位可在同一或不同靶标上。在一个实施方案中,多特异性抗体可通过国际专利公布号wo2011109726和美国专利公布号us20150252119中所述的方法来产生和优化,所述专利各自的内容以引用的方式整体并入本文。这些抗体能够以高特异性和高亲和力结合多个抗原。在某些实施方案中,多特异性抗体是识别同一或不同抗原上的两个不同表位的“双特异性抗体”。在一个方面,双特异性抗体能够结合两种不同抗原。所述抗体通常包含来自至少两种不同抗体的抗原结合区。举例来说,双特异性单克隆抗体(bsmab、bsab)是由两种不同单克隆抗体的片段组成,由此允许bsab结合两种不同类型的抗原的人工蛋白质。双特异性抗体框架可包括riethmuller,g.,2012.cancerimmunity,2012,12:12-18;marvin等,actapharmacologicasinica.2005,26(6):649-658;以及schaefer等,pnas.2011,108(27):11187-11192中所述的那些双特异性抗体框架中的任一者,所述文献各自的内容以引用的方式整体并入本文。已开发新生代bsmab,称为“三功能性双特异性”抗体。这些抗体由两个重链和两个轻链组成,各自来自两种不同抗体,其中两个fab区(臂)针对两种抗原,并且fc区(足)包含两个重链并形成第三结合位点。在一些实施方案中,有效载荷可编码包含单一抗原结合结构域的抗体。这些分子是极小的,具有是对于全尺寸mab观察到的那些分子量的约十分之一的分子量。其他抗体可包括源于在骆驼和美洲驼中得见的缺乏轻链的重链抗体的抗原结合可变重链区(vhh)的“纳米体”(nelson,a.l.,mabs.2010年1月-2月;2(1):77–83)。在一些实施方案中,抗体可为“小型化的”。在mab小型化的最佳实例之中的是来自trubionpharmaceuticals的小模块化免疫药物(smip)。可为单价或二价的这些分子是含有一个vl、一个vh抗原结合结构域、以及一个或两个恒定“效应”结构域的重组单链分子,所述结构域全都由接头结构域加以连接。据推测,这种分子可能提供通过片段而获得的组织或肿瘤穿透增加,同时保留由恒定结构域赋予的免疫效应物功能的优势。至少三种“小型化”smip已进入临床开发。tru-015作为一种与wyeth合作开发的抗cd20smip是得以最大程度推进的项目,已进展至针对类风湿性关节炎(ra)的2期。在全身性红斑狼疮(sle)和b细胞淋巴瘤的情况下的较早尝试最终被中止。trubion和facetbiotechnology正合作开发作为用于治疗cll和其他淋巴细胞性赘瘤形成的抗cd37smip的tru-016,这是一个已达到2期的项目。wyeth已许可用于治疗包括ra、sle以及有可能包括多发性硬化症的自体免疫疾病的抗cd20smipsbi-087,但这些项目仍然处于临床测试的最早阶段。(nelson,a.l.,mabs,2010年1月-2月;2(1):77–83)。小型化抗体的一个实例被称为“单抗体(unibody)”,其中铰链区已从igg4分子移除。尽管igg4分子不稳定,并且可彼此交换轻链-重链异二聚体,但使铰链区缺失会完全阻止重链-重链配对,从而留下高度特异性单价轻/重异二聚体,同时保留fc区以确保体内稳定性和半衰期。这个构型可使免疫活化或致癌性生长的风险最小化,因为igg4与fcr进行不良相互作用,并且单价单抗体未能促进细胞内信号传导复合物形成(参见例如nelson,a.l.,mabs,2010年1月-2月;2(1):77–83)。在一些实施方案中,本发明的有效载荷可编码单结构域抗体(sdab或纳米体),其是由单一单体可变抗体结构域组成的抗体片段。如同完整抗体一样,它能够选择性结合特定抗原。在一个方面,sdab可为“骆驼ig”或“骆驼科动物vhh”。如本文所用,术语“骆驼ig”是指重链抗体的最小已知抗原结合单元(koch-nolte等,fasebj.,2007,21:3490-3498)。“重链抗体”或“骆驼科动物抗体”是指含有两个vh结构域,并且不含有轻链的抗体(riechmannl.等,j.immunol.methods,1999,231:25-38;国际专利公布号:wo1994/04678和wo1994/025591;以及美国专利号6,005,079)。在另一方面,sdab可为“免疫球蛋白新抗原受体”(ignar)。如本文所用,术语“免疫球蛋白新抗原受体”是指来自鲨鱼免疫谱系的抗体的类别,所述抗体由一个可变新抗原受体(vnar)结构域和五个恒定新抗原受体(cnar)结构域的同二聚体组成。ignar代表一些基于免疫球蛋白的最小已知蛋白质骨架,并且是高度稳定的并具有高效结合特征。固有稳定性可归因于以下两者:(i)下伏性ig骨架,相较于在鼠抗体中得见的常规抗体vh结构域和vl结构域,所述骨架呈现可观数目的带电荷和亲水性表面暴露残基;和(ii)互补决定区(cdr)环中的致稳定结构特征,包括环间二硫桥以及各种样式的环内氢键。在一些实施方案中,本发明的有效载荷可编码胞内抗体。胞内抗体是一种不从它在其中产生的细胞分泌,而是靶向一种或多种细胞内蛋白质的抗体形式。胞内抗体在细胞内表达和起作用,并且可用于影响众多细胞过程,包括但不限于细胞内迁移、转录、翻译、代谢过程、增殖信号传导和细胞分裂。在一些实施方案中,本文所述的方法包括基于胞内抗体的疗法。在一些所述实施方案中,本文公开的可变结构域序列和/或cdr序列被并入一个或多个构建体中以达成基于胞内抗体的疗法。举例来说,胞内抗体可靶向一种或多种经糖化细胞内蛋白质,或可调节一种或多种经糖化细胞内蛋白质与替代性蛋白质之间的相互作用。胞内抗体在哺乳动物细胞的不同区室中的细胞内表达允许阻断或调节内源性分子的功能(biocca等,emboj.1990,9:101-108;colby等,proc.natl.acad.sci.u.s.a.2004,101:17616-17621)。胞内抗体可改变蛋白质折叠、蛋白质-蛋白质相互作用、蛋白质-dna相互作用、蛋白质-rna相互作用和蛋白质修饰。它们可通过直接结合靶标抗原,通过使靶标抗原的细胞内迁移转向,或通过抑制靶标抗原与结合配偶体的缔合来诱导表型剔除以及充当中和剂。由于对靶标抗原具有高特异性和亲和力,胞内抗体具有阻断特定靶标分子的某些结合相互作用,同时使其他分子免受影响的优势。来自供体抗体的序列可用于开发胞内抗体。胞内抗体经常在细胞内被重组表达为单结构域片段诸如分离的vh结构域和vl结构域,或表达为单链可变片段(scfv)抗体。举例来说,胞内抗体经常被表达为单一多肽以形成包含由柔性接头多肽接合的重链的可变结构域和轻链的可变结构域的单链抗体。胞内抗体通常缺乏二硫键,并且能够通过它们的特异性结合活性来调节靶标基因的表达或活性。单链胞内抗体经常从重组核酸分子表达,并且被工程化来保留在细胞内(例如保留在细胞质、内质网或周质中)。胞内抗体可使用本领域中已知的方法来产生,诸如以下中公开和综述的那些方法:(marasco等,pnas,1993,90:7889-7893;chen等,hum.genether.1994,5:595-601;chen等,1994,pnas,91:5932-5936;maciejewski等,1995,naturemed.,1:667-673;marasco,1995,immunotech,1:1-19;mhashilkar等,1995,emboj.14:1542-51;chen等,1996,hum.genetherap.,7:1515-1525;marasco,genether.4:11-15,1997;rondon和marasco,1997,annu.rev.microbiol.51:257-283;cohen等,1998,oncogene17:2445-56;proba等,1998,j.mol.biol.275:245-253;cohen等,1998,oncogene17:2445-2456;hassanzadeh等,1998,febslett.437:81-6;richardson等,1998,genether.5:635-44;ohage和steipe,1999,j.mol.biol.291:1119-1128;ohage等,1999,j.mol.biol.291:1129-1134;wirtz和steipe,1999,proteinsci.8:2245-2250;zhu等,1999,j.immunol.methods231:207-222;arafat等,2000,cancergenether.7:1250-6;dermaur等,2002,j.biol.chem.277:45075-85;mhashilkar等,2002,genether.9:307-19;以及wheeler等,2003,fasebj.17:1733-5;以及其中引用的参考文献)。在一些实施方案中,本发明的有效载荷可编码如美国专利号5,091,513中所述的生物合成抗体,所述专利的内容以引用的方式整体并入本文。所述抗体可包括一个或多个构成充当生物合成抗体结合位点(babs)的区域的氨基酸序列。位点包含1)以非共价方式缔合或以二硫键键合的合成vh和vl二聚体,2)vh-vl或vl-vh单链,其中vh和vl由多肽接头相连,或3)个别vh结构域或vl结构域。结合结构域包含可源于单独免疫球蛋白的连接的cdr区和fr区。生物合成抗体也可包括例如充当酶、毒素、结合位点、或与固定介质或放射性原子的相连位点的其他多肽序列。公开了用于产生生物合成抗体,用于设计具有可通过在体内产生抗体来引发的任何特异性的babs,以及用于产生其类似物的方法。在一些实施方案中,有效载荷可编码具有美国专利号8,399,625中教导的抗体接受体框架的抗体。所述抗体接受体框架可特别良好适合于接受来自目标抗体的cdr。在一个实施方案中,抗体可为条件性活性生物蛋白质。抗体可用于产生在野生型正常生理条件下被可逆地或不可逆地失活的条件性活性生物蛋白质,以及提供了所述条件性活性生物蛋白质和所述条件性活性生物蛋白质的用途。所述方法和条件性活性蛋白质在例如国际公布号wo2015175375和wo2016036916以及美国专利公布号us20140378660中教导,所述专利各自的内容以引用的方式整体并入本文。抗体制备无论是单克隆还是多克隆的抗体的制备在本领域中都是已知的。用于产生抗体的技术在本领域中是熟知的,并且例如描述于harlow和lane"antibodies,alaboratorymanual",coldspringharborlaboratorypress,1988;harlow和lane“usingantibodies:alaboratorymanual”coldspringharborlaboratorypress,1999以及“therapeuticantibodyengineering:currentandfutureadvancesdrivingthestrongestgrowthareainthepharmaceuticalindustry”woodheadpublishing,2012中。如本文所述的抗体及其片段和变体可使用重组多核苷酸来产生。在一个实施方案中,多核苷酸具有模块化设计以编码抗体、其片段或变体中的至少一者。作为一非限制性实例,多核苷酸构建体可编码任何以下设计:(1)抗体的重链,(2)抗体的轻链,(3)抗体的重链和轻链,(4)由接头分隔的重链和轻链,(5)vh1、ch1、ch2、ch3结构域、接头和轻链,或(6)vh1、ch1、ch2、ch3结构域、vl区和轻链。这些设计中的任一者都也可包含在任何结构域和/或区域之间的任选接头。使用本文所述的抗体或它的任何组成部分作为起始分子,本发明的多核苷酸可被工程化来产生任何标准类别的免疫球蛋白。用于免疫疗法的抗体在一些实施方案中,本发明的有效载荷可为对肿瘤特异性抗原(tsa)和肿瘤相关抗原(taa)具有特异性的抗体、其片段和变体。抗体在全身进行循环,直至它们发现并附着于tsa/taa。一旦附着,它们即募集免疫系统的其他部分,从而使adcc(抗体依赖性由细胞介导的细胞毒性)和adcp(抗体依赖性由细胞介导的吞噬)增加以破坏肿瘤细胞。如本文所用,术语“肿瘤特异性抗原(tsa)”意指在肿瘤细胞中产生的抗原物质,其可在宿主生物体中触发抗肿瘤免疫应答。在一个实施方案中,tsa可为肿瘤新抗原。肿瘤抗原特异性抗体介导针对表达同一抗原的肿瘤细胞的补体依赖性细胞毒性应答。受到特别关注的是作为以下抗原的tsa:乳腺癌抗原、卵巢癌抗原、前列腺癌抗原、子宫颈癌抗原、胰腺癌抗原、肺癌抗原、膀胱癌抗原、结肠癌抗原、睾丸癌抗原、胶质母细胞瘤癌症抗原、与b细胞恶性肿瘤相关的抗原、与多发性骨髓瘤相关的抗原、与非霍奇金淋巴瘤相关的抗原、或与慢性淋巴细胞性白血病相关的抗原。可以免疫活性方式结合tsa的适合抗体可包括但不限于对以下各物具有特异性的那些:5t4、707-ap、a33、afp(α-胎蛋白(α-fetoprotein))、akap-4(a激酶锚定蛋白4)、alk、α5β1整合素、雄激素受体、膜联蛋白ii(annexinii)、α-辅肌动蛋白-4(alpha-actinin-4)、art-4、b1、b7h3、b7h4、bage(b黑素瘤抗原)、bcma、bcr-abl融合蛋白、β-连环蛋白(beta-catenin)、bkt抗原、btaa、ca-i(碳酸酐酶i)、ca50(癌症抗原50)、ca125、ca15-3、ca195、ca242、钙网膜蛋白(calretinin)、caix(碳酸酐酶)、camel(细胞毒性t淋巴细胞识别的于黑素瘤上的抗原)、cam43、cap-1、胱天蛋白酶-8/m(caspase-8/m)、cd4、cd5、cd7、cd19、cd20、cd22、cd23、cd25、cd27/m、cd28、cd30、cd33、cd34、cd36、cd38、cd40/cd154、cd41、cd44v6、cd44v7/8、cd45,cd49f、cd56、cd68\kp1、cd74、cd79a/cd79b、cd103、cd123、cd133、cd138、cd171、cdc27/m、cdk4(周期素依赖性激酶4)、cdkn2a、cds、cea(癌胚抗原)、ceacam5、ceacam6、嗜铬粒蛋白(chromogranin)、c-met、c-myc、coa-1、csap、ct7、ct10、亲环蛋白b(cyclophilinb)、周期素b1、细胞质酪氨酸激酶、细胞角蛋白(cytokeratin)、dam-10、dam-6、dek-can融合蛋白、肌间线蛋白(desmin)、depdc1(含有dep结构域的蛋白1)、e2a-prl、ebna、egf-r(表皮生长因子受体)、egp-1(上皮糖蛋白-1)(trop-2)、egp-2、egp-40、egfr(表皮生长因子受体)、egfrviii、ef-2、elf2m、emmprin、epcam(上皮细胞粘附分子)、epha2、艾伯斯坦巴尔病毒(epsteinbarrvirus)抗原、erb(erbb1;erbb3;erbb4)、eta(上皮肿瘤抗原)、etv6-aml1融合蛋白、fap(纤维母细胞活化蛋白)、fbp(叶酸结合蛋白)、fgf-5、叶酸受体α、fos相关抗原1、海藻糖基gm1、g250、gage(gage-1;gage-2)、催乳激素(galactin)、gd2(神经节苷脂(ganglioside))、gd3、gfap(神经胶质原纤维酸性蛋白)、gm2(免疫原性癌胚抗原-1;ofa-i-1)、gnt-v、gp100、h4-ret、hage(解旋酶抗原)、her-2/neu、hif(缺氧诱导因子)、hif-1α、hif-2α、hla-a2、hla-a*0201-r170i、hla-all、hmwmaa、hom/mel-40、hsp70-2m(热激蛋白70)、hst-2、htgp-175、htert(或htrt)、人乳头状瘤病毒-e6/人乳头状瘤病毒-e7和e6、ice(免疫捕集eia)、igf-1r、igh-igk、il2r、il5、ilk(整合素连接的激酶)、imp3(胰岛素样生长因子iimrna结合蛋白3)、irf4(干扰素调控因子4)、kdr(激酶插入结构域受体)、kiaa0205、krab锌指蛋白(kid)-3;kid31、ksa(17-1a)、k-ras、lage、lck、ldlr/fut(ldlr-海藻糖基转移酶as融合蛋白)、ley(路易斯y(lewisy))、mad-ct-1、mage(酪氨酸酶,黑素瘤相关抗原)(mage-1;mage-3)、melan-a肿瘤抗原(mart)、mart-2/ski、mc1r(黑皮质素1受体(melanocortin1receptor))、mdm2、间皮素(mesothelin)、mphosph1、msa(肌肉特异性肌动蛋白)、mtor(哺乳动物雷帕霉素靶标)、muc-1、muc-2、mum-1(黑素瘤相关抗原(突变型)1)、mum-2、mum-3、肌球蛋白/m(myosin/m)、myl-rar、na88-a、n-乙酰氨基葡萄糖转移酶、neo-pap、nf-kb(核因子-κb)、神经丝、nse(神经元特异性烯醇酶)、notch受体、numa、n-ras、ny-br-1、ny-co-1、ny-eso-1、制瘤素m(oncostatinm)、os-9、oy-tes1、p53突变体、p190次要bcr-abl、pl5(58)、pl85erbb2、pl80erbb-3、page(前列腺相关基因)、pap(前列腺酸性磷酸酶)、pax3、pax5、pdgfr(血小板源性生长因子受体)、哌啶和吡咯烷利用中涉及的细胞色素p450(pipa)、pml-rarα融合蛋白、pr-3(蛋白酶3)、psa(前列腺特异性抗原)、psm、psma(前列腺干细胞抗原)、prame(黑素瘤的优先表达抗原)、ptprk、rage(肾肿瘤抗原)、raf(a-raf、b-raf和c-raf)、ras、受体酪氨酸激酶、rcas1、rgss、ror1(受体酪氨酸激酶样孤儿受体1)、ru1、ru2、sage、sart-1、sart-3、scp-1、sdccag16、sp-17(精子蛋白17)、src家族、ssx(滑膜肉瘤x断裂点)-1、ssx-2(hom-mel-40)、ssx-3、ssx-4、ssx-5、stat-3、stat-5、stat-6、stead、stn、存活素(survivin)、syk-zap70、ta-90(mac-2结合蛋白\亲环蛋白c相关蛋白)、taal6、tacstd1(肿瘤相关钙信号转导物1)、tacstd2、tag-72-4、tage、tarp(t细胞受体γ选择性阅读框蛋白)、tel/aml1融合蛋白、tem1、tem8(内皮唾液酸蛋白(endosialin)或cd248)、tgfβ、tie2、tlp、tmprss2ets融合基因、tnf受体(tnf-α受体、tnf-β受体;或tnf-γ受体)、转铁蛋白(transferrin)受体、tps、trp-1(酪氨酸相关蛋白1)、trp-2、trp-2/int2、tsp-180、vegf受体、wnt、wt-1(韦尔姆斯氏肿瘤抗原)和xage。在一个实施方案中,本发明的有效载荷可为抗cd47抗体。cd47是一种遍在表达的免疫调控性蛋白质,其阻止由免疫系统对健康细胞的吞噬性移除。cd47在许多类型的癌细胞的表面上表达,由此破坏抗癌免疫应答。cd47也涉及于各种其他重要细胞过程中,诸如血管生成、癌细胞死亡和对t细胞免疫性的调控。抗cd47抗体在若干临床前研究中已显示在实体癌以及最特别是在b细胞恶性肿瘤的情况下具有治疗益处。在一个实施方案中,本发明的有效载荷可为抗cd22抗体。作为一非限制性实例,抗cd22抗体是美国专利公布号us20150086562中所述的任何抗体、其片段或变体。抗cd22抗体可包含us20150086562中的具有氨基酸序列seqidno:49-64的重链可变区和/或us20150086562中的具有氨基酸序列seqidno:17-32的轻链可变区;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可为可特异性阻断免疫抑制性信号的抗体、其片段和变体。这些阻断抗体(也被称为拮抗剂)结合共抑制性受体,因此阻断它们的信号转导。作为非限制性实例,阻断抗体可对ctla-4、pd-1和pd-l1/l2具有特异性。在一个实施方案中,抗ctla-4抗体是易普利单抗(ipilimumab)。在另一实施方案中,抗pd-1抗体是尼鲁单抗(nivolumab)。结合pd-l1,并且使t细胞免疫应答增强的抗体可包括美国专利公布号:2016/0108123中教导的抗体;所述专利的内容以引用的方式整体并入本文。其他抑制性免疫调节性靶标可包括b7-h3,其可使癌细胞代谢诸如葡萄糖摄取和乳酸产生增加(lim等,cancerres.,2016,76(8):1-12)。阻断b7-h3的抗体公开于美国专利号:9,150,656中;所述专利的内容以引用的方式整体并入本文。在一个方面,本发明的有效载荷可为美国专利公布号:us2016/0159927中的对包含氨基酸序列seqidno:1、2和3的vsig8(含有v组和免疫球蛋白结构域的蛋白8)具有特异性的拮抗性抗体;所述专利的内容以引用的方式整体并入本文。拮抗性抗体也可包括嵌合il2受体(cd25)抗体(巴利昔单抗(basiliximab))(美国专利公布号:20080171017;其内容以引用的方式整体并入本文),以及结合人tim-3(美国专利公布号:us2015/0218274;其内容以引用的方式整体并入本文)、btla、vista和lag-3(参见例如美国专利公布号:us2015/0259420;其内容以引用的方式整体并入本文)的拮抗抗体。在一个方面,本发明的有效载荷可为抗csf-ir抗体,其特征在于结合人csf-ir的细胞外结构域的二聚化结构域d4至d5。这个抗体抑制剂可抑制csf-ir配体依赖性和csf-1配体非依赖性csf-ir表达性肿瘤细胞、单核细胞和浸润性巨噬细胞的细胞增殖和存活(参见例如国际专利公布号:wo2013/132044;其内容以引用的方式整体并入本文)。在另一方面,本发明的有效载荷可为针对cxcl12的拮抗性抗体。抗cxcl12抗体阻断cxcl12与它的受体cxcr4的相互作用,由此抑制cxcr4信号传导。cxcr4信号传导抑制剂使t细胞在肿瘤组织中的癌细胞之中的邻近性或频率增加(参见国际专利公布号:wo2015/019284;其内容以引用的方式整体并入本文)。在一些实施方案中,本发明的有效载荷可为触发免疫应答的激动性抗体、其片段和变体,包括对包括但不限于4-1bb(cd137)、ox40(cd134)、cd40、gitr和cd27的共刺激性分子具有特异性的抗体。在一个实施方案中,本发明的有效载荷可为激动性cd40抗体。在另一实施方案中,对4-1bb(cd137)具有特异性的激动性抗体可为优瑞单抗(uremab),其是一种特异性结合并活化4-1bb(cd137)表达性免疫细胞,从而刺激针对肿瘤细胞的免疫应答特别是细胞毒性t细胞应答的完全人igg4单克隆抗体;或优米鲁单抗(utomilumab),其是一种完全人igg2单克隆抗体;或国际专利公布号:wo2006/088447中所述的抗cd137抗体;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可为针对双调蛋白(amphiregulin)的拮抗性抗体。双调蛋白(areg)是一种egf样生长因子,其结合egfr受体,并且使t调控性细胞功能增强。areg在具有独特t细胞受体(tcr)谱系,并且表达il33r的在表型上以及在功能上独特的cd4+调控性t细胞(treg)亚型中产生。areg促进肿瘤环境中的免疫抑制。抗双调蛋白抗体可包含美国专利号7,223,393中的具有氨基酸序列seqidno.:2、4和12的重链可变区和/或美国专利号7,223,393中的具有氨基酸序列seqidno.:3、5和14的轻链可变区;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,对共抑制性分子和共刺激性分子具有特异性的抗体可为分泌型scfv抗体。在一些实施方案中,本发明的抗体有效载荷可为t细胞双特异性抗体(例如t细胞啮合性bitetm抗体cds-cd19、cd3-epcam和cd3-egfr)。用于免疫疗法的其他双特异性抗体也可作为本发明的有效载荷加以包括,例如双特异性抗tnf-α和抗il6抗体(ep3062818)、针对免疫细胞抗原和tag-72的双特异性抗体(wo2016/089610)、美国专利号7,262,276中的抗卵巢和d3双特异性抗体;wo2014/128185中的针对cd133和cd3的双特异性抗体;us2016/0145355中讨论的针对ctla-4和pd-1的双特异性抗体、wo2015/006749以及美国专利号7,635,472;7,112,324中公开的针对cd3和cd19的双特异性抗体;us2014/0170149中的针对her2和cd3的双特异性抗体;us2005/0089519中的针对cd19和cd16的双特异性抗体;所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,可选择相对于对相同抗原具有高亲和力的抗体,具有降低的亲和力的抗体。所述低亲和力抗体更有效区分表达高水平的抗原的肿瘤与在较低水平下表达相同抗原的正常组织,同时维持类似抗肿瘤应答。在一些实施方案中,本发明的靶向部分可包括包含选自表10中的那些氨基酸序列的氨基酸序列的可变重链和可变轻链。表10:可变重链和轻链序列胞内抗体在一些实施方案中,本发明的有效载荷可为针对对免疫细胞进行调控的参与者的胞内抗体。胞内抗体是被设计来在细胞内表达,并且可通过与细胞内迁移/定位肽序列同框融合来针对存在于各种亚细胞位置中的特定靶标抗原的抗体,所述亚细胞位置包括胞质液、核、内质网(er)、线粒体、过氧化物酶体、质膜和反面高尔基体网络(tgn)。最通常使用的形式是通过以下方式来创建的单链抗体(scfv):用在可变重(vh)链与可变轻(vl)链之间的接头使重链的抗原结合可变结构域和轻链的抗原结合可变结构域接合,所述接头最经常是15个氨基酸的接头(例如(ggggs)3(seqidno:307))。细胞内胞内抗体正被开发来结合、中和癌症相关靶标或调节所述靶标的功能或定位,并且由此影响恶性表型。调节免疫细胞(例如t细胞)的参与者可为任何细胞内信号传导检查点。示例性参与者可包括共抑制性配体、casitasb谱系淋巴瘤原致癌基因-b(cbl-b)(一种e3连接酶)、蛋白质酪氨酸磷酸酶(ptp)诸如含有src同源区2结构域的蛋白质酪氨酸磷酸酶1(shp-1)和ras。举例来说,胞内抗体可为pct专利公布号:wo2004/046186中公开的针对ras的致癌性形式的胞内抗体;所述专利的内容以引用的方式整体并入本文。治疗性抗体在一些实施方案中,本发明的抗体有效载荷可为治疗性抗体。作为非限制性实例,抗体及其片段和变体可对肿瘤相关抗原或肿瘤特异性抗原或病原体抗原具有特异性。在一些方面,抗体可为阻断抗体(也被称为拮抗性抗体),例如针对pd-1、pd-l1、pd-l2、ctla-4和其他抑制性分子的阻断抗体。在其他方面,抗体可为激动剂抗体诸如对刺激性分子例如4-1bb(cd137)、ox40(cd134)、cd40、gitr和cd27具有特异性的激动性抗体。其他示例性治疗性抗体可包括但不限于阿巴伏单抗(abagovomab)、阿昔单抗(abcxmab)、阿妥珠单抗(abituzumab)、阿瑞鲁单抗(abrilumab)、阿克托单抗(actoxumab)、阿达木单抗(adalimumab)、阿德木单抗(adecatumumab)、阿非西维单抗(afasevikumab)、阿非莫单抗(afelimomab)、阿夫妥珠单抗(afutuzumab)、阿拉赛珠单抗(alacizumab)、阿来珠单抗(alemtuzumab)、阿里库单抗(alirocumab)、阿妥莫单抗(altumomab)、阿玛妥昔单抗(amatuximab)、阿内图单抗(anetumab)、阿尼福鲁单抗(anifrolumab)、阿泊珠单抗(apolizumab)、阿西莫单抗(arcitumomab)、阿斯瓦库单抗(ascrinvacumab)、阿塞利珠单抗(aselizumab)、阿特珠单抗(atezolizumab)、阿堤努单抗(atinumab)、阿利珠单抗(atlizumab)、阿托木单抗(atorolimumab)、阿维鲁单抗(avelumab)、巴匹珠单抗(bapineuzumab)、巴利昔单抗、巴维昔单抗(bavituximab)、贝妥莫单抗(bectumomab)、贝戈罗单抗(begelomab)、贝利木单抗(belimumab)、贝那珠单抗(benralizumab)、柏替木单抗(bertilimumab)、贝索单抗(besilesomab)、贝伐单抗(bevacizumab)、贝兹托单抗(bezlotoxumab)、比西单抗(biciromab)、比玛鲁单抗(bimagrumab)、比莫克珠单抗(bimekizumab)、比伐单抗(bivatuzumab)、布勒鲁单抗(bleselumab)、博纳吐单抗、博纳吐单抗、布索珠单抗(blosozumab)、博克珠单抗(bococizumab)、布妥昔单抗(brentuximab)、布瑞克努单抗(briaknumab)、布罗鲁单抗(brodalumab)、布罗鲁珠单抗(brolucizumab)、布罗替妥珠单抗(brontictuzumab)、卡比莱利珠单抗(cabiralizumab)、卡那单抗(canakinumab)、坎妥珠单抗(cantuzumab)、卡普赛珠单抗(caplacizumab)、卡罗单抗(capromab)、卡鲁单抗(carlumab)、卡罗妥昔单抗(carotuximab)、卡妥索单抗(catumaxomab)、cbr96-多柔比星免疫缀合物(cbr96-doxorubicinimmunoconjugate)、西利珠单抗(cedelizumab)、昔谷妥珠单抗(cergutuzumab)、聚乙二醇赛妥珠单抗(certolizumabpegol)、西妥昔单抗、西他珠单抗(citatuzumab)、西妥木单抗(cixutumumab)、克拉扎珠单抗(clazakizumab)、克立昔单抗(clenoliximab)、克利维珠单抗(clivatuzumab)、可瑞妥珠单抗(codrituzumab)、可妥昔单抗(coltuximab)、坎塔妥木单抗(contatumumab)、坎昔珠单抗(concizumab)、克雷内珠单抗(crenezumab)、克洛特单抗(crotedumab)、cr6261、达西妥单抗(dacetumab)、达利珠单抗、达洛妥珠单抗(dalotuzumab)、聚乙二醇达皮利珠单抗(dapirolizumabpegol)、达拉妥木单抗(daratumumab)、地曲库单抗(dectrekumab)、地美西珠单抗(demcizumab)、地尼妥珠单抗(denintuzumab)、地诺单抗(denosumab)、生物素德罗妥昔单抗(derlotuximabbiotin)、地莫单抗(detumomab)、迪努妥昔单抗(dinutuximab)、迪达夫单抗(diridavumab)、多玛格珠单抗(domagrozumab)、阿托度单抗(dorlimomabaritox)、卓齐珠单抗、度利戈妥单抗(duligotumab)、度匹鲁单抗(dupilumab)、度伐鲁单抗(durvalumab)、杜斯吉妥单抗(dusigitumab)、伊美昔单抗(ecromeximab)、依库珠单抗(eculizumab)、埃巴单抗(edobacomab)、依决洛单抗(edrecolomab)、依法珠单抗(efalizumab)、依夫单抗(efungumab)、依德鲁单抗(eldelumab)、依格妥单抗(elgemtumab)、伊罗妥珠单抗(elotuzumab)、伊斯利莫单抗(elsilimomab)、伊玛妥珠单抗(emactuzumab)、依米妥珠单抗(emibetuzumab)、依米西珠单抗(emicizumab)、恩凡妥珠单抗(enavatuzumab)、维多汀恩夫妥单抗(enfortumabvedotin)、聚乙二醇恩莫单抗(enlimomabpegol)、恩波妥珠单抗(enoblituzumab)、恩克珠单抗(enokizumab)、恩替库单抗(enoticumab)、恩司妥昔单抗(ensituximab)、西伊匹莫单抗(epitumomabcituxetan)、依帕珠单抗、厄利珠单抗(erlizumab)、厄马索单抗(ertumaxomab)、埃达珠单抗(etaracizumab)、伊特利珠单抗(etrolizumab)、依维那库单抗(evinacumab)、依伏库单抗(evolocumab)、艾韦单抗(exbivirumab)、法索单抗(fanolesomab)、法拉莫单抗(faralimomab)、法妥珠单抗(farletuzumab)、法司努单抗(fasinumab)、fbta05、非维珠单抗(felvizumab)、非扎努单抗(fezakinumab)、菲巴妥珠单抗(fibatuzumab)、芬克拉妥珠单抗(ficlatuzumab)、芬妥木单抗(figitumumab)、菲瑞伏单抗(firivumab)、弗兰妥单抗(flanvotumab)、弗勒替库单抗(fletikumab)、芳妥珠单抗(fontolizumab)、佛拉鲁单抗(foralumab)、福拉韦单抗(foravirumab)、夫苏木单抗(fresolimumab)、弗拉努单抗(fulranumab)、弗妥昔单抗(futuximab)、加卡珠单抗(galcanezumab)、加利昔单抗(galiximab)、加尼妥单抗(ganitumab)、甘特如单抗(gantenerumab)、加韦莫单抗(gavilimomab)、奥佐米星吉妥单抗(gemtuzumabozogamicin)、吉沃珠单抗(gevokizumab)、吉瑞昔单抗(girentuximab)、维多汀格勒巴木单抗(glembatumumabvedotin)、戈利木单抗(golimumab)、鲁昔单抗(gomiliximab)、古塞库单抗(guselkumab)、伊巴珠单抗(ibalizumab)、替坦异贝莫单抗(ibritumomabtituxetan)、伊克卢库单抗(icrucumab)、伊达昔珠单抗(idarucizumab)、伊戈伏单抗(igovomab)、imab362、伊马鲁单抗(imalumab)、英西单抗(imciromab)、英加妥珠单抗(imgatuzumab)、英克勒库单抗(inclacumab)、英达妥昔单抗(indatuximab)、英度萨妥单抗(indusatumab)、英比利珠单抗(inebilizumab)、英夫利昔单抗(infliximab)、英特妥木单抗(intetumumab)、伊诺莫单抗(inolimomab)、伊诺妥珠单抗(inotuzumab)、易普利单抗、伊妥木单抗(iratumumab)、伊萨妥昔单抗(isatuximab)、伊托利珠单抗(itolizumab)、伊赛珠单抗(ixekizumab)、凯利昔单抗(keliximab)、拉贝妥珠单抗(labetuzumab)、兰博利珠单抗(lambrolizumab)、兰帕利珠单抗(lampalizumab)、兰纳德鲁单抗(lanadelumab)、兰多格珠单抗(landogrozumab)、拉普妥昔单抗(laprituximab)、勒比奇珠单抗(lebrikizumab)、来马索单抗(lemalesomab)、棱达利珠单抗(lendalizumab)、棱泽鲁单抗(lenzilumab)、乐德木单抗(lerdelimumab)、来沙木单抗(lexatumumab)、利韦单抗(libivirumab)、利伐妥珠单抗(lifastuzumab)、利格利珠单抗(ligelizumab)、利洛托单抗(lilotomab)、林妥珠单抗(lintuzumab)、立鲁单抗、罗戴西珠单抗(lodelcizumab)、洛克弗单抗(lokivetmab)、洛妥珠单抗(lorvotuzumab)、鲁卡妥木单抗(lucatumumab)、聚乙二醇鲁利珠单抗(lulizumabpegol)、鲁西单抗(lumiliximab)、鲁姆妥珠单抗(lumretuzumab)、马帕妥木单抗(mapatumumab)、马格妥昔单抗(margetuximab)、马斯利莫单抗(maslimomab)、马利木单抗(mavrilimumab)、马妥珠单抗(matuzumab)、美泊利单抗(mepolizumab)、美特利木单抗(metelimumab)、米拉珠单抗(milatuzumab)、明瑞莫单抗(minretumomab)、米弗妥昔单抗(mirvetuximab)、米妥莫单抗(mitumomab)、莫木利珠单抗(mogamulizumab)、莫纳利珠单抗(monalizumab)、莫洛利木单抗(morolimumab)、莫维珠单抗(motavizumab)、帕西妥莫单抗(moxetumomabpasudotox)、莫罗莫那-cd3(muromonab-cd3)、他那可单抗(nacolomabtafenatox)、那米鲁单抗(namilumab)、那妥莫单抗(naptumomab)、纳妥昔单抗(naratuximab)、纳那妥单抗(narnatumab)、那他珠单抗(natalizumab)、那西昔珠单抗(navicixizumab)、纳弗单抗(navivumab)、奈巴库单抗(nebacumab)、奈西木单抗(necitumumab)、奈莫利珠单抗(nemolizumab)、奈瑞利莫单抗(nerelimomab)、奈弗库单抗(nesvacumab)、尼妥珠单抗(nimotuzumab)、尼鲁单抗、诺非妥莫单抗(nofetumomab)、奥比托昔单抗(obiltoxaximab)、奥滨尤妥珠单抗、奥卡珠单抗(ocaratuzumab)、奥瑞珠单抗(ocrelizumab)、奥度莫单抗(odulimomab)、奥法木单抗、奥拉妥单抗(olaratumab)、奥拉妥单抗、奥洛珠单抗(olokizumab)、奥马珠单抗(omalizumab)、奥纳珠单抗(onartuzumab)、奥妥昔珠单抗(ontuxizumab)、奥皮西努单抗(opicinumab)、莫奥珠单抗(oportuzumabmonatox)、奥戈伏单抗(oregovomab)、奥替库单抗(orticumab)、奥特利昔珠单抗(otelixizumab)、奥特妥珠单抗(otlertuzumab)、欧西鲁单抗(oxelumab)、奥扎尼珠单抗(ozanezumab)、奥左拉珠单抗(ozoralizumab)、帕吉巴昔单抗(pagibaximab)、帕利珠单抗(palivizumab)、帕莫鲁单抗(pamrevlumab)、帕尼单抗(panitumumab)、潘考单抗(pankomab)、帕诺库单抗(panobacumab)、帕萨妥珠单抗(parsatuzumab)、帕考珠单抗(pascolizumab)、帕索妥昔珠单抗(pasotuxizumab)、帕特利珠单抗(pateclizumab)、帕曲妥单抗(patritumab)、帕母单抗、佩姆莫单抗(pemtumomab)、培拉珠单抗(perakizumab)、培妥珠单抗(pertuzumab)、培克珠单抗(pexelizumab)、匹迪珠单抗(pidilizumab)、皮那妥珠单抗(pinatuzumab)、平妥莫单抗(pintumomab)、普拉库鲁单抗(placulumab)、帕洛利珠单抗(plozalizumab)、泊加利珠单抗(pogalizumab)、珀拉妥珠单抗(polatuzumab)、泊尼珠单抗(ponezumab)、普扎利珠单抗(prezalizumab)、普立昔单抗(priliximab)、普立托昔单抗(pritoxaximab)、普立木单抗(pritumumab)、pro140、奎利珠单抗(quilizumab)、雷妥莫单抗(racotumomab)、雷得妥单抗(radretumab)、瑞非韦单抗(rafivirumab)、拉潘西珠单抗(ralpancizumab)、雷莫芦单抗(ramucirumab)、雷珠单抗(ranibizumab)、雷西库单抗(raxibacumab)、瑞凡珠单抗(refanezumab)、瑞加韦单抗(regavirumab)、瑞利珠单抗(reslizumab)、利妥木单抗(rilotumumab)、利努库单抗(rinucumab)、利莎珠单抗(risankizumab)、利妥昔单抗、聚乙二醇利巴珠单抗(rivabazumabpegol)、罗妥木单抗(robatumumab)、罗度单抗(roledumab)、罗莫索珠单抗(romosozumab)、罗利珠单抗(rontalizumab)、罗皮妥珠单抗(rovalpituzumab)、罗维利珠单抗(rovelizumab)、卢利珠单抗(ruplizumab)、沙希妥珠单抗(sacituzumab)、沙马利珠单抗(samalizumab)、沙皮利珠单抗(sapelizumab)、沙里鲁单抗(sarilumab)、喷地肽沙妥莫单抗(satumomabpendetide)、苏金单抗(secukinumab)、司里班妥单抗(seribantumab)、色托昔单抗(setoxaximab)、司韦单抗(sevirumab)、西罗珠单抗(sibrotuzumab)、sgn-cd19a、sgn-cd33a、西法木单抗(sifalimumab)、司妥昔单抗(siltuximab)、斯姆珠单抗(simtuzumab)、希普利珠单抗(siplizumab)、斯如库单抗(sirukumab)、维多汀索非妥珠单抗(sofituzumabvedotin)、苏兰珠单抗(solanezumab)、索利托单抗(solitomab)、松匹珠单抗(sonepcizumab)、松妥珠单抗(sontuzumab)、司他木鲁单抗(stamulumab)、硫索单抗(sulesomab)、苏韦珠单抗(suvizumab)、他巴鲁单抗(tabalumab)、他卡珠单抗(tacatuzumab)、他度珠单抗(tadocizumab)、他利珠单抗(talizumab)、他姆弗单抗(tamtuvetmab)、他尼珠单抗(tanezumab)、他莫单抗(taplitumomab)、他瑞妥单抗(tarextumab)、替非珠单抗(tefibazumab)、阿替莫单抗(telimomabaritox)、替妥莫单抗(tenatumomab)、替奈昔单抗(teneliximab)、替利珠单抗(teplizumab)、替妥木单抗(teprotumumab)、替多鲁单抗(tesidolumab)、替托洛单抗(tetulomab)、替培鲁单抗(tezepelumab)、tgn1412、替西木单抗(ticilimumab)、替拉珠单抗(tildrakizumab)、替加珠单抗、替莫鲁单抗(timolumab)、维多汀替索妥单抗(tisotumabvedotin)、tnx-650、托珠单抗(tocilizumab)、托利珠单抗(toralizumab)、托萨托单抗(tosatoxumab)、托西莫单抗(tositumomab)、托维妥单抗(tovetumab)、特拉罗鲁单抗(tralokinumab)、曲妥珠单抗(trastuzumab)、trbs07、曲加珠单抗(tregalizumab)、曲美木单抗(tremelimumab)、曲弗格卢单抗(trevogrumab)、图考珠单抗(tucotuzumab)、妥韦单抗(tuvirumab)、优利妥昔单抗(ublituximab)、优克普鲁单抗(ulcocuplumab)、乌瑞鲁单抗(urelumab)、乌珠单抗(urtoxazumab)、优特克单抗(ustekinumab)、塔里林维达昔单抗(vadastuximabtalirine)、维多汀凡多珠单抗(vandortuzumabvedotin)、凡替妥单抗(vantictumab)、凡努西珠单抗(vanucizumab)、伐利昔单抗(vapaliximab)、瓦利鲁单抗(varlilumab)、伐特珠单抗(vatelizumab)、维多珠单抗(vedolizumab)、维妥珠单抗、维帕莫单抗(vepalimomab)、维森库单抗(vesencumab)、维利珠单抗(visilizumab)、伏巴利珠单抗(vobarilizumab)、伏洛昔单抗(volociximab)、伏司妥珠单抗(vorsetuzumab)、伏妥莫单抗(votumumab)、泽妥珠单抗(xentuzumab)、扎鲁木单抗(zalutumumab)、扎木单抗(zanolimumab)、扎妥昔单抗(zatuximab)、齐拉木单抗(ziralimumab)和阿佐莫单抗(zolimomabaritox)。双顺反子和/或假双顺反子抗体有效载荷根据本发明,双顺反子有效载荷是在单一多核苷酸链上编码双蛋白质链抗体的多核苷酸。假双顺反子有效载荷是在单一多核苷酸链上间断地编码单链抗体的多核苷酸。对于双顺反子有效载荷,编码的两个链或两个部分/区域和/或结构域(如在假双顺反子的情况下)由至少一个不编码链或结构域的核苷酸分隔。更经常地,分隔部分包含裂解信号或位点或非编码核苷酸区域。所述裂解位点包括例如在所得多肽中的编码为“rkr”位点的弗林蛋白酶(furin)裂解位点,或经修饰弗林蛋白酶裂解位点,或本文教导的裂解位点中的任一者。根据本发明,单结构域有效载荷包含一个或两个编码单一单体可变抗体结构域的多核苷酸。通常,单结构域抗体包含重链抗体的一个可变结构域(vh)。根据本发明,单链fv有效载荷是编码至少两个编码区以及接头区的多核苷酸。scfv有效载荷可编码免疫球蛋白的重链的可变区(vh)和轻链的可变区(vl)的融合蛋白,所述可变区用10至约25个氨基酸的短接头肽加以连接。接头通常富含用于达成柔性的甘氨酸以及用于达成溶解性的丝氨酸或苏氨酸,并且可使vh的n末端与vl的c末端连接,或反之亦然。其他接头包括本领域中已知以及本文公开的那些。根据本发明,双特异性有效载荷是编码两种不同抗体的部分或区域的多核苷酸。双特异性有效载荷编码可结合两种不同抗原的多肽。本发明的多核苷酸也可编码对三种抗原具有亲和力的三特异性抗体。3.肿瘤和病原体特异性抗原在一些实施方案中,本发明的有效载荷可为肿瘤特异性抗原(tsa)、肿瘤相关抗原(taa)、病原体相关抗原、或其片段。抗原可以肽形式或以完整蛋白质或其部分形式表达。完整蛋白质或其一部分可为天然的或经诱变的。如本文所述的与癌症或病毒诱发的癌症相关的抗原在本领域中是熟知的。这种tsa或taa可先前与癌症相关,或可通过本领域中已知的任何方法来鉴定。肿瘤特异性抗原(tsa)可为肿瘤新抗原。新抗原是由于会改变蛋白质编码序列,因此产生新型外来抗原的遗传突变或转录改变而仅由肿瘤细胞表达的突变抗原。遗传变化由遗传取代、插入、缺失或天然同源蛋白质(即在正常细胞中表达的分子)的任何其他遗传变化所致。作为非限制性实例,新抗原可包括源于以下的突变新肽:α-辅肌动蛋白-4、artc1、bcr-abl融合蛋白(b3a2)、b-raf、casp-5、casp-8、β-连环蛋白、cdc27、cdk4、cdkn2a、clpp、cml-66、coa-1、连接蛋白37、dek-can融合蛋白、eftud2、延伸因子2、etv6-aml1融合蛋白、纤维连接蛋白、flt3-itd、fn1、gpnm8、ldlr-海藻糖基转移酶as融合蛋白、hla-a2、hla-a11、hsp-70-1b、mart-2、me1、mum-1、mum-2、mum-3、i类肌球蛋白、nfyc、neo-pap、ogt、os-9、p53、pml-rarα融合蛋白、prdx5、ptprk、k-ras、n-ras、rbaf600、去乙酰化酶-2(sirtuin-2)、snrpd1、syt-ssx1/ssx2融合蛋白、tgf-β受体ii等。额外新抗原肽可包括美国专利公布号:20110293637中公开的sf3b1肽、myd肽、tp53肽、abl肽、fbxw7肽、mapk肽和gnb1肽,所述专利的内容以引用的方式整体并入本文。也可包括通过大规模测序和算法计算来鉴定的新型新抗原。参见例如国际专利公布号:wo2014/168874;nishimura等,cancersci.2015,106(5):505-511;以及linnemann等,nat.med.,2015,21(1):81-85;其各自的内容以引用的方式整体并入本文。肿瘤相关抗原(taa)可为由正常组织与赘生性组织两者表达的过度表达或累积抗原,其中在癌症组织中的表达水平高度升高。在肿瘤组织中,众多蛋白质(例如致癌基因)得以上调,包括但不限于亲脂素(adipophilin)、aim-2、aldh1a1、bclx(l)、bing-4、calca、cd45、cd274、cpsf、周期素d1、dkk1、enah、epcam、epha3、ezh2、fgf5、g250、her-2/neu、hla-dob、丝氨酸蛋白酶(hepsin)、ido1、igfb3、il13rα2、肠羧基酯酶、激肽释放酶4(kallikrein4)、kif20a、含谷氨酰胺合成酶结构域晶体蛋白(lengsin)、m-csf、mcsp、mdm-2、meloe、肝素结合细胞因子(midkine)、mmp-2、mmp-7、muc-1、muc5ac、p53、pax5、pbf、prame、psma、rage-1、rgs5、rhoc、rnf43、ru2a5、分离蛋白1(secernin1)、sox10、steap1、存活素(survivin)、端粒酶(telomerase)、tpbg、vegf和wt1。taa可为通常仅在胎儿发育期间的不同阶段以及在癌性体细胞中表达的癌胚抗原。许多蛋白质在胎儿发育期间正常表达,但在出生之后或在婴儿期早期受到转录阻遏,因此是不存在的,或在相应正常成人组织中以显著较低水平表达。这些发育蛋白质中的一些在某些肿瘤细胞中被再表达,并且变为癌胚抗原。癌胚抗原的实例可包括但不限于结肠直肠癌中的cea(癌胚抗原)、肾细胞癌(rcc)中的ilrp/ofa(不成熟层粘连蛋白受体蛋白质/癌胚抗原)、前列腺癌中的tag-72(肿瘤相关糖蛋白-72)、肝细胞癌(hcc)中的afp(α-胎蛋白)、许多恶性细胞诸如脑肿瘤中的ror1(一种受体酪氨酸激酶)、卵巢癌中的精子蛋白17、hmga2(高迁移率族蛋白a2),hcc中的癌胚h19、cr-1(cripto-1,表皮生长因子(egf)-cfc家族的成员)、滋养层糖蛋白前体和gpc-3(磷脂酰肌醇蛋白聚糖-3,硫酸乙酰肝素蛋白聚糖的成员)。taa可为仅由癌细胞和成人生殖组织诸如睾丸和胎盘表达的癌症-睾丸抗原,包括但限于来自bage家族、cage家族、hage家族、gage家族、mage家族(例如mage-a1、mage-a2、mage-a3、mage-a6和mage-a13)、sage家族、xage家族、mcak、na88-a(癌症/睾丸抗原88)、psad1、ssx-2和sllp-1的抗原。taa可为主要由单一癌症组织型表达的谱系限定的抗原,诸如黑素瘤中的melan-a/mart-1、gp100/pmel17、酪氨酸酶、trp-1/-2、p.多肽、mc1r;以及前列腺癌中的前列腺特异性抗原(psa)。taa可为由致肿瘤性转化病毒(也称为致癌病毒)编码的致癌病毒性抗原。致癌病毒在它们感染宿主细胞时可将它们自身的dna(或rna)插入宿主细胞的dna中。当病毒dna或rna影响宿主细胞的基因时,它可将细胞推向变为癌。致癌病毒包括但不限于rna病毒和dna病毒。通常已知的致癌病毒的一些实例包括是子宫颈癌的主要病因的人乳头状瘤病毒(hpv),可导致鼻咽癌、某些类型的快速生长性淋巴瘤(例如伯基特淋巴瘤(burkittlymphoma))和胃癌的艾伯斯坦-巴尔病毒(ebv),在肝细胞癌(hcc)的情况下的乙型、丙型和丁型肝炎病毒(hbv、hcv和hdv),使获得许多类型的癌症(例如肝癌、肛门癌和霍奇金癌)的风险增加的人免疫缺陷病毒(hiv),与淋巴瘤相关联的卡波西肉瘤(kaposisarcoma)疱疹病毒(kshv;也称为人疱疹病毒8(hhv8)),人嗜t淋巴细胞病毒(htlv-1)和梅克尔(merkel)细胞多瘤病毒(mcv)。病毒抗原可为病毒的与人的癌症相关的任何确定抗原。举例来说,来自ebv的抗原可包括但不限于艾伯斯坦-巴尔核抗原-1(ebna1)、潜活膜蛋白1(lmp1)或潜活膜蛋白2(lmp2)。taa可为从高度多态性基因产生的个体基因型抗原,其中肿瘤细胞表达特定“克隆型”,即如在由克隆异常所致的b细胞淋巴瘤/白血病、t细胞淋巴瘤/白血病的情况下,所述个体基因型抗原诸如免疫球蛋白和t细胞受体(tcr)。个体基因型抗原是一类非病原体相关新抗原。举例来说,恶性b细胞表达经重排和经多重突变的表面免疫球蛋白(ig)。肿瘤特异性个体基因型(例如免疫球蛋白个体基因型)被视为可通过免疫疗法来成功靶向的特别具有吸引力的肿瘤特异性抗原(例如alejandro等,frontoncol.,2012,2:159)。4.t细胞受体(tcr)在一些实施方案中,本发明的有效载荷可为t细胞受体(tcr)。tcr可对癌症抗原具有特异性,具有一起形成tcrαβ异二聚体的特定α链和β链,或具有一起形成tcrγδ异二聚体的特定γ链和δ链。tcr可为重组抗原特异性t细胞受体。α链和β链的可变区决定t细胞对由i类和ii类主要组织相容性复合物(mhc)分子呈递的抗原性肽的特异性。由tcr对由mhc分子呈递的于肿瘤细胞的表面上的肿瘤抗原进行的tcr识别会触发t细胞活化。使用tcr基因疗法可用所需特异性对受试者的自身t细胞进行装备,并且产生足够数目的t细胞来根除肿瘤细胞。在一些实施方案中,可将包含肿瘤特异性tcr的生物回路或效应物模块转导至t细胞中,并且经tcr工程化t细胞将被输注至由于化学疗法或照射而患有淋巴细胞减少症或淋巴球减少症的癌症患者中,从而允许进行高效移入,但同时抑制免疫抑制作用。编码肿瘤抗原识别性tcr链的序列可从肿瘤反应性t细胞(例如从患者的肿瘤分离的肿瘤浸润性淋巴细胞)获得。根据本发明,对肿瘤细胞具有特异性的tcr可通过国际专利公布号:wo2014/083173中所述的方法来产生;所述专利的内容以引用的方式整体并入本文。对表达已知或推测能够呈递突变肿瘤特异性抗原(tsa)的某一人白细胞抗原(hla)类型的转基因的宿主生物体进行转导以表达未重排人tcr基因座。优选地,这些基因座编码tcrα和β链,并且优选包含人tcrv、d、j和/或c基因中的多者,理想地是全部。宿主生物体用癌症特异性tsa或源于所述tsa的肽表位免疫,并且分离和克隆表达特异性针对所述tsa的重排tcr的t细胞。对来自经克隆t细胞的tcr进行测序(国际专利公布号:wo2014/083173;所述专利的内容以引用的方式整体并入本文)。在一些实施方案中,本发明的有效载荷可为特异性识别与mhc分子复合的tsa、taa或其表位的tcr。可由tcr识别的示例性肿瘤抗原可包括至少以下肿瘤抗原:5t4、707-ap、a33、afp(α-胎蛋白)、akap-4(a激酶锚定蛋白4)、alk、α5β1整合素、雄激素受体、膜联蛋白ii、α-辅肌动蛋白-4、art-4、b1、b7h3、b7h4、bage(b黑素瘤抗原)、bcma、bcr-abl融合蛋白、β-连环蛋白、bkt抗原、btaa、ca-i(碳酸酐酶i)、ca50(癌症抗原50)、ca125、ca15-3、ca195、ca242、钙网膜蛋白、caix(碳酸酐酶)、camel(细胞毒性t淋巴细胞识别的于黑素瘤上的抗原)、cam43、cap-1、胱天蛋白酶-8/m、cd4、cd5、cd7、cd19、cd20、cd22、cd23、cd25、cd27/m、cd28、cd30、cd33、cd34、cd36、cd38、cd40/cd154、cd41、cd44v6、cd44v7/8、cd45,cd49f、cd56、cd68\kp1、cd74、cd79a/cd79b、cd103、cd123、cd133、cd138、cd171、cdc27/m、cdk4(周期素依赖性激酶4)、cdkn2a、cds、cea(癌胚抗原)、ceacam5、ceacam6、嗜铬粒蛋白、c-met、c-myc、coa-1、csap、ct7、ct10、亲环蛋白b、周期素b1、细胞质酪氨酸激酶、细胞角蛋白、dam-10、dam-6、dek-can融合蛋白、肌间线蛋白、depdc1(含有dep结构域的蛋白1)、e2a-prl、ebna、egf-r(表皮生长因子受体)、egp-1(上皮糖蛋白-1)(trop-2)、egp-2、egp-40、egfr(表皮生长因子受体)、egfrviii、ef-2、elf2m、emmprin、epcam(上皮细胞粘附分子)、epha2、艾伯斯坦巴尔病毒抗原、erb(erbb1;erbb3;erbb4)、eta(上皮肿瘤抗原)、etv6-aml1融合蛋白、fap(纤维母细胞活化蛋白)、fbp(叶酸结合蛋白)、fgf-5、叶酸受体α、fos相关抗原1、海藻糖基gm1、g250、gage(gage-1;gage-2)、催乳激素、gd2(神经节苷脂)、gd3、gfap(神经胶质原纤维酸性蛋白)、gm2(免疫原性癌胚抗原-1;ofa-i-1)、gnt-v、gp100、h4-ret、hage(解旋酶抗原)、her-2/neu、hif(缺氧诱导因子)、hif-1α、hif-2α、hla-a2、hla-a*0201-r170i、hla-all、hmwmaa、hom/mel-40、hsp70-2m(热激蛋白70)、hst-2、htgp-175、htert(或htrt)、人乳头状瘤病毒-e6/人乳头状瘤病毒-e7和e6、ice(免疫捕集eia)、igf-1r、igh-igk、il2r、il5、ilk(整合素连接的激酶)、imp3(胰岛素样生长因子iimrna结合蛋白3)、irf4(干扰素调控因子4)、kdr(激酶插入结构域受体)、kiaa0205、krab锌指蛋白(kid)-3;kid31、ksa(17-1a)、k-ras、lage、lck、ldlr/fut(ldlr-海藻糖基转移酶as融合蛋白)、ley(路易斯y)、mad-ct-1、mage(酪氨酸酶,黑素瘤相关抗原)(mage-1;mage-3)、melan-a肿瘤抗原(mart)、mart-2/ski、mc1r(黑皮质素1受体)、mdm2、间皮素、mphosph1、msa(肌肉特异性肌动蛋白)、mtor(哺乳动物雷帕霉素靶标)、muc-1、muc-2、mum-1(黑素瘤相关抗原(突变型)1)、mum-2、mum-3、肌球蛋白/m、myl-rar、na88-a、n-乙酰氨基葡萄糖转移酶、neo-pap、nf-kb(核因子-κb)、神经丝、nse(神经元特异性烯醇酶)、notch受体、numa、n-ras、ny-br-1、ny-co-1、ny-eso-1、制瘤素m、os-9、oy-tes1、p53突变体、p190次要bcr-abl、pl5(58)、pl85erbb2、pl80erbb-3、page(前列腺相关基因)、pap(前列腺酸性磷酸酶)、pax3、pax5、pdgfr(血小板源性生长因子受体)、哌啶和吡咯烷利用中涉及的细胞色素p450(pipa)、pml-rarα融合蛋白、pr-3(蛋白酶3)、psa(前列腺特异性抗原)、psm、psma(前列腺干细胞抗原)、prame(黑素瘤的优先表达抗原)、ptprk、rage(肾肿瘤抗原)、raf(a-raf、b-raf和c-raf)、ras、受体酪氨酸激酶、rcas1、rgss、ror1(受体酪氨酸激酶样孤儿受体1)、ru1、ru2、sage、sart-1、sart-3、scp-1、sdccag16、sp-17(精子蛋白17)、src家族、ssx(滑膜肉瘤x断裂点)-1、ssx-2(hom-mel-40)、ssx-3、ssx-4、ssx-5、stat-3、stat-5、stat-6、stead、stn、存活素、syk-zap70、ta-90(mac-2结合蛋白\亲环蛋白c相关蛋白)、taal6、tacstd1(肿瘤相关钙信号转导物1)、tacstd2、tag-72-4、tage、tarp(t细胞受体γ选择性阅读框蛋白)、tel/aml1融合蛋白、tem1、tem8(内皮唾液酸蛋白或cd248)、tgfβ、tie2、tlp、tmprss2ets融合基因、tnf受体(tnf-α受体、tnf-β受体;或tnf-γ受体)、转铁蛋白受体、tps、trp-1(酪氨酸相关蛋白1)、trp-2、trp-2/int2、tsp-180、vegf受体、wnt、wt-1(韦尔姆斯氏肿瘤抗原)和xage。在一个方面,本发明的有效载荷可为具有美国专利公布号:us20110280894和国际专利公布号wo2016133779a1中公开的α链和β链的核酸序列的特异性识别her2/neu表位的tcr;所述专利各自的内容以引用的方式整体并入本文。在另一方面,本发明的有效载荷可为对tsa酪氨酸酶具有特异性的tcr(参见美国专利号:8,697,854;其内容以引用的方式整体并入本文)。在其他方面,本发明的有效载荷可为具有对滑膜肉瘤x断裂点(ssx)-2抗原(美国专利号:9,345,748);人乳头状瘤病毒(hpv)16e6抗原(国际专利公布号:wo2015/009606);巨细胞病毒(cmv)磷蛋白pp65(美国专利号:8,722,048)具有特异性的多肽序列的tcr;以及如美国专利公布号:us2016/0083449中公开的wt-1特异性tcr,所述wt-1特异性tcr包含具有如以seqidno.:5-8中的任一者阐述的氨基酸序列的tcrα链,并且包含具有如以seqidno.:12或13阐述的氨基酸序列的tcrβ链;所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,对tsa具有特异性的tcr可被修饰来具有编码亲和力减弱基序的序列,所述基序赋予在与tsa的非特异性结合方面的降低。在一些实施方案中,具有对tcrcdr1或cdr2区的修饰的亲和力减弱基序可用于减弱tcr与hla蛋白之间的相互作用(参见国际专利公布号:wo2016/014725;其内容以引用的方式整体并入本文)。在一些实施方案中,对tsa具有特异性的tcr可被修饰来具有亲和力增强基序,所述基序赋予对靶标抗原的结合特异性和亲和力的增强。在一些实施方案中,所述高亲和力tcr可通过以下方式来产生:使用tcrα链来选择重新产生的在t细胞发育期间与抗原特异性tcrα链配对的tcrβ链以形成增强的tcr(参见国际专利公布号:wo2013/166321;其内容以引用的方式整体并入本文)。在其他实施方案中,经修饰tcr也可具有编码对cdr3区进行的亲和力增强修饰的序列,所述修饰使tcr与tsa之间的相互作用加强。在一个实施方案中,对tsa具有特异性的tcr可使用锌指核酸酶(zfn)、talen或crispr/cas系统来修饰。tcrα链和β链可含有核酸酶的靶标位点。核酸酶可裂解tcr序列,从而导致对tcr的某一程度的破坏(参见美国专利公布号:us2014/0301990;其内容以引用的方式整体并入本文)。在一个实施方案中,对tsa具有特异性的tcr可为具有以下结构的可溶性单链tcr:vα2-l-vβ或vβ-l-vα2,其中l是使tcr可变β区(vβ)与2家族的tcr可变α区(vα2)连接的接头肽,如国际专利公布号:wo2011/044186中所讨论;所述专利的内容以引用的方式整体并入本文。在一个实施方案中,可根据美国专利公布号:us2014/0065111中所述的方法来使对tsa具有特异性的tcr成熟以使它对tsa的亲和力增加;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,tcr可对抗体的fc结构域具有特异性(例如fcgrla),并且用于使抗体介导的疗法的功效增强,如国际专利公布号:wo2015/179833中所讨论;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可为充当三功能性t细胞信号传导偶联物(tritac)的重组构建体,所述偶联物模拟通过t细胞受体进行的天然信号传导。tritac使嵌合受体活性增强,同时保留mhc未限定的靶向。在一些方面,重组构建体可包含靶标特异性结合配体诸如对tsa具有特异性的scfv或经设计的锚蛋白重复序列(darpin)、结合与tcr复合物相关的蛋白质的配体和tcr信号传导结构域多肽,例如如国际专利申请号:wo2015/117229中所述;所述专利的内容以引用的方式整体并入本文。tcr相关蛋白质可选自cd3、zap70(ζ链相关蛋白质激酶70)、tyn和cd247。在一些方面,tritac的结合tcr相关蛋白质的配体可为抗体或抗体片段(例如scfv)。在其他方面,tritac的tcr信号传导结构域多肽可包含cd4的跨膜和细胞质结构域。根据本发明,本发明的tcr的α链和β链可被包括在单独构建体中,例如作为两个效应物模块的有效载荷。在其他实施方案中,本发明的tcr的α链和β链可被包括在单一效应物模块中,作为同一效应物模块的两个有效载荷,例如如图3-图6中所说明。5.嵌合抗原受体(car)在一些实施方案中,本发明的有效载荷可为嵌合抗原受体(car),其在转导至免疫细胞(例如t细胞和nk细胞)中时可使免疫细胞重定向来针对表达由car的细胞外靶向部分识别的分子的靶标(例如肿瘤细胞)。如本文所用,术语“嵌合抗原受体(car)”是指模拟t细胞的表面上的tcr的合成受体。一般来说,car由细胞外靶向结构域、跨膜结构域/区域和细胞内信号传导/活化结构域组成。在标准car受体中,组分:细胞外靶向结构域、跨膜结构域和细胞内信号传导/活化结构域被线性构建成单一融合蛋白。细胞外区域包含识别特定肿瘤抗原或其他肿瘤细胞表面分子的靶向结构域/部分(例如scfv)。细胞内区域可含有tcr复合物的信号传导结构域(例如cd3ζ的信号区域),和/或一个或多个共刺激性信号传导结构域,诸如来自cd28、4-1bb(cd137)和ox-40(cd134)的那些。举例来说,“第一代car”仅具有cd3ζ信号传导结构域,而为试图使t细胞持久性和增殖加强,添加了共刺激性细胞内结构域,从而产生具有cd3ζ信号结构域加一个共刺激性信号传导结构域的第二代car,以及具有cd3ζ信号结构域加两个或更多个共刺激性信号传导结构域的第三代car。car在由t细胞表达时会对t细胞赋予由car的细胞外靶向部分决定的抗原特异性。近来,也可合乎需要的是添加一个或多个元件诸如归巢和自杀基因以开发car的更有能力以及更安全的构造,即所谓第四代car。被工程化来表达car的细胞诸如t细胞可被重定向以攻击表达可由car的靶向部分识别的分子的靶标细胞。在一些实施方案中,细胞外靶向结构域通过铰链(也称为间隔结构域或间隔体)和跨膜区域来接合于细胞内信号传导结构域。铰链使细胞外靶向结构域连接于跨膜结构域,所述跨膜结构域横穿过细胞膜,并且连接于细胞内信号传导结构域。归因于靶向部分结合的靶标蛋白质的尺寸以及靶向结构域自身的尺寸和亲和力,所以可能需要使铰链改变以使经car转化细胞对癌细胞的效能最优化。在靶向部分识别和结合靶标细胞后,细胞内信号传导结构域产生cart细胞的活化信号,所述活化信号通过来自一个或多个细胞内共刺激性结构域的“第二信号”而进一步放大。cart细胞一旦活化即可破坏靶标细胞。在一些实施方案中,本发明的car可被分成两个部分,各部分连接有二聚化结构域,以致触发二聚化的输入会促进完整功能性受体的组装。wu和lim近来报道了拆分car,其中细胞外cd19结合结构域和细胞内信号传导元件被分开,并且连接于在雷帕霉素类似物ap21967存在下进行异二聚的fkbp结构域和frb*(fkbp-雷帕霉素结合结构域的t2089l突变体)结构域。拆分受体在ap21967存在下组装,并且连同特异性抗原结合一起使t细胞活化(wu等,science,2015,625(6258):aab4077)。在一些实施方案中,本发明的car可被设计成诱导型car。sakemura等人近来报道了将tet-on诱导型系统并入cd19car构建体中。cd19car仅在多西环素(dox)存在下被活化。sakemura报道相较于常规cd19cart细胞,tet-cd19cart细胞在dox存在下针对cd19+细胞系具有相等细胞毒性,并且在cd19刺激后具有相等的细胞因子产生和增殖(sakemura等,cancerimmuno.res.,2016年6月21日,电子出版先于印刷)。在一个实例中,这个tet-car可为效应物模块的在本发明的sre(例如dd)的控制下的有效载荷。双重系统提供在经转导t细胞中开启和关闭car表达的更大灵活性。根据本发明,本发明的有效载荷可为第一代car、或第二代car、或第三代car、或第四代car。包含car构建体的代表性效应物模块实施方案说明于图13-图18中。在一些实施方案中,本发明的有效载荷可为由细胞外结构域、铰链和跨膜结构域以及细胞内信号传导区域组成的完整car构建体。在其他实施方案中,本发明的有效载荷可为完整car构建体的组分,包括细胞外靶向部分、铰链区、跨膜结构域、细胞内信号传导结构域、一个或多个共刺激性结构域、以及使car构造和功能性改进的其他额外元件,包括但不限于前导序列、归巢元件和安全性开关,或所述组分的组合。由本发明的生物回路和组合物调控的car是可调谐的,并且由此提供若干优势。可逆的开关转换机制允许对由过度car-t细胞扩增引起的急性毒性进行管理。使用本发明的sre进行的脉冲car表达可通过使配体水平循环来实现。配体赋予的对car的调控可有效抵消由抗原丧失所诱导的肿瘤逃逸,避免由归因于长期抗原暴露的滋养信号传导引起的功能性耗竭,并且使car表达性细胞在体内的持久性改进。在一些实施方案中,本发明的生物回路和组合物可用于下调car表达以限制由肿瘤溶解综合征引起的中靶中组织毒性。在抗肿瘤功效之后使本发明的car的表达下调可防止(1)由正常组织中的抗原表达引起的中靶脱肿瘤毒性。(2)在体内的抗原非依赖性活化。细胞外靶向结构域/部分根据本发明,car的细胞外靶向部分可为以高特异性和亲和力识别和结合给定靶标分子例如肿瘤细胞上的新抗原的任何药剂。靶向部分可为特异性结合肿瘤细胞上的靶标分子的抗体及其变体,或基于它结合肿瘤细胞上的靶标分子的能力而选自随机序列汇集物的肽适体或其可结合肿瘤细胞上的靶标分子的变体或片段,或来自天然t细胞受体(tcr)的抗原识别结构域(例如用以识别受hiv感染细胞的cd4细胞外结构域),或外来识别组分诸如导致识别携带细胞因子受体的靶标细胞的所连接细胞因子,或受体的天然配体。在一些实施方案中,car的靶向结构域可为ignar、fab片段、fab'片段、f(ab)'2片段、f(ab)'3片段、fv、单链可变片段(scfv)、双scfv、(scfv)2、微型抗体、微型双功能抗体、微型三功能抗体、微型四功能抗体、二硫键稳定化fv蛋白(dsfv)、单抗体、纳米体、或源于特异性识别靶标分子例如肿瘤特异性抗原(tsa)的抗体的抗原结合区。在一个实施方案中,靶向部分是scfv抗体。当scfv结构域在cart细胞的表面上表达,并且随后结合癌细胞上的靶标蛋白质时,它能够维持所述cart细胞邻近于所述癌细胞,并且触发t细胞的活化。scfv可使用常规重组dna技术工艺来产生,并且在本发明中加以讨论。在一个实施方案中,car构建体的靶向部分可为适体,诸如特异性结合目标靶标分子的肽适体。肽适体可基于它结合目标靶标分子的能力而选自随机序列汇集物。在一些实施方案中,car构建体的靶向部分可为靶标分子的天然配体或其能够结合靶标分子的变体和/或片段。在一些方面,car的靶向部分可为靶标分子的受体,例如作为cd70受体的全长人cd27可与cd3ζ的信号传导结构域同框融合,从而形成cd27嵌合受体作为针对cd70阳性恶性肿瘤的免疫治疗剂(参见例如美国专利公布号:us20130323214;其内容以引用的方式整体并入本文)。在一些实施方案中,car的靶向部分可识别肿瘤特异性抗原(tsa),例如以限定方式在肿瘤细胞上表达的癌症新抗原。作为非限制性实例,本发明的car可包含能够结合选自以下的肿瘤特异性抗原的细胞外靶向结构域:5t4、707-ap、a33、afp(α-胎蛋白)、akap-4(a激酶锚定蛋白4)、alk、α5β1整合素、雄激素受体、膜联蛋白ii、α-辅肌动蛋白-4、art-4、b1、b7h3、b7h4、bage(b黑素瘤抗原)、bcma、bcr-abl融合蛋白、β-连环蛋白、bkt抗原、btaa、ca-i(碳酸酐酶i)、ca50(癌症抗原50)、ca125、ca15-3、ca195、ca242、钙网膜蛋白、caix(碳酸酐酶)、camel(细胞毒性t淋巴细胞识别的于黑素瘤上的抗原)、cam43、cap-1、胱天蛋白酶-8/m、cd4、cd5、cd7、cd19、cd20、cd22、cd23、cd25、cd27/m、cd28、cd30、cd33、cd34、cd36、cd38、cd40/cd154、cd41、cd44v6、cd44v7/8、cd45、cd49f、cd56、cd68\kp1、cd74、cd79a/cd79b、cd103、cd123、cd133、cd138、cd171、cdc27/m、cdk4(周期素依赖性激酶4)、cdkn2a、cds、cea(癌胚抗原)、ceacam5、ceacam6、嗜铬粒蛋白、c-met、c-myc、coa-1、csap、ct7、ct10、亲环蛋白b、周期素b1、细胞质酪氨酸激酶、细胞角蛋白、dam-10、dam-6、dek-can融合蛋白、肌间线蛋白、depdc1(含有dep结构域的蛋白1)、e2a-prl、ebna、egf-r(表皮生长因子受体)、egp-1(上皮糖蛋白-1)(trop-2)、egp-2、egp-40、egfr(表皮生长因子受体)、egfrviii、ef-2、elf2m、emmprin、epcam(上皮细胞粘附分子)、epha2、艾伯斯坦巴尔病毒抗原、erb(erbb1;erbb3;erbb4)、eta(上皮肿瘤抗原)、etv6-aml1融合蛋白、fap(纤维母细胞活化蛋白)、fbp(叶酸结合蛋白)、fgf-5、叶酸受体α、fos相关抗原1、海藻糖基gm1、g250、gage(gage-1;gage-2)、催乳激素、gd2(神经节苷脂)、gd3、gfap(神经胶质原纤维酸性蛋白)、gm2(免疫原性癌胚抗原-1;ofa-i-1)、gnt-v、gp100、h4-ret、hage(解旋酶抗原)、her-2/neu、hif(缺氧诱导因子)、hif-1α、hif-2α、hla-a2、hla-a*0201-r170i、hla-all、hmwmaa、hom/mel-40、hsp70-2m(热激蛋白70)、hst-2、htgp-175、htert(或htrt)、人乳头状瘤病毒-e6/人乳头状瘤病毒-e7和e6、ice(免疫捕集eia)、igf-1r、igh-igk、il2r、il5、ilk(整合素连接的激酶)、imp3(胰岛素样生长因子iimrna结合蛋白3)、irf4(干扰素调控因子4)、kdr(激酶插入结构域受体)、kiaa0205、krab锌指蛋白(kid)-3;kid31、ksa(17-1a)、k-ras、lage、lck、ldlr/fut(ldlr-海藻糖基转移酶as融合蛋白)、ley(路易斯y)、mad-ct-1、mage(酪氨酸酶,黑素瘤相关抗原)(mage-1;mage-3)、melan-a肿瘤抗原(mart)、mart-2/ski、mc1r(黑皮质素1受体)、mdm2、间皮素、mphosph1、msa(肌肉特异性肌动蛋白)、mtor(哺乳动物雷帕霉素靶标)、muc-1、muc-2、mum-1(黑素瘤相关抗原(突变型)1)、mum-2、mum-3、肌球蛋白/m、myl-rar、na88-a、n-乙酰氨基葡萄糖转移酶、neo-pap、nf-kb(核因子-κb)、神经丝、nse(神经元特异性烯醇酶)、notch受体、numa、n-ras、ny-br-1、ny-co-1、ny-eso-1、制瘤素m、os-9、oy-tes1、p53突变体、p190次要bcr-abl、pl5(58)、pl85erbb2、pl80erbb-3、page(前列腺相关基因)、pap(前列腺酸性磷酸酶)、pax3、pax5、pdgfr(血小板源性生长因子受体)、哌啶和吡咯烷利用中涉及的细胞色素p450(pipa)、pml-rarα融合蛋白、pr-3(蛋白酶3)、psa(前列腺特异性抗原)、psm、psma(前列腺干细胞抗原)、prame(黑素瘤的优先表达抗原)、ptprk、rage(肾肿瘤抗原)、raf(a-raf、b-raf和c-raf)、ras、受体酪氨酸激酶、rcas1、rgss、ror1(受体酪氨酸激酶样孤儿受体1)、ru1、ru2、sage、sart-1、sart-3、scp-1、sdccag16、sp-17(精子蛋白17)、src家族、ssx(滑膜肉瘤x断裂点)-1、ssx-2(hom-mel-40)、ssx-3、ssx-4、ssx-5、stat-3、stat-5、stat-6、stead、stn、存活素、syk-zap70、ta-90(mac-2结合蛋白\亲环蛋白c相关蛋白)、taal6、tacstd1(肿瘤相关钙信号转导物1)、tacstd2、tag-72-4、tage、tarp(t细胞受体γ选择性阅读框蛋白)、tel/aml1融合蛋白、tem1、tem8(内皮唾液酸蛋白或cd248)、tgfβ、tie2、tlp、tmprss2ets融合基因、tnf受体(tnf-α受体、tnf-β受体;或tnf-γ受体)、转铁蛋白受体、tps、trp-1(酪氨酸相关蛋白1)、trp-2、trp-2/int2、tsp-180、vegf受体、wnt、wt-1(韦尔姆斯氏肿瘤抗原)和xage。在一些实施方案中,本发明的car可包含具有能够结合经标记抗原的靶向部分的通用免疫受体。产生通用免疫受体car的方法讨论于国际专利公布号:wo2013044225a1中;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的car可包含能够结合病原体抗原的靶向部分。在一些实施方案中,本发明的car可包含能够结合非蛋白质分子诸如肿瘤相关糖脂和碳水化合物的靶向部分。tsa也可为脂质分子、多糖、糖、核酸、半抗原、碳水化合物或其组合。在一些实施方案中,本发明的car可包含能够结合肿瘤微环境内的组分的靶向部分,所述组分包括在各种肿瘤基质细胞中表达的蛋白质,所述肿瘤基质细胞包括肿瘤相关的巨噬细胞(tam)、不成熟单核细胞、不成熟树突细胞、免疫抑制性cd4+cd25+调控性t细胞(treg)和mdsc。一项使用动物模型进行的新近研究证明在全身性移植之后,表达vegfr-2car和il12的t细胞对肿瘤进行浸润,扩增,并且持续存在于肿瘤团块内,从而导致肿瘤消退。抗肿瘤作用取决于通过vegfr-2car-t细胞的活化以及il12的释放来靶向il12应答性宿主细胞(chinnasamy等,clinicalcancerresearch,2012,18:1672-1683)。在一些实施方案中,本发明的car可包含能够结合细胞表面粘附分子、在自体免疫疾病的情况下出现的炎症性细胞的表面分子、或导致自体免疫性的tcr的靶向部分。作为非限制性实例,本发明的靶向部分可为识别肿瘤特异性抗原(tsa)的scfv抗体,例如特异性识别和结合人间皮素的抗体ss、ss1和hn1的scfv(美国专利号:9,359,447)、gd2的抗体的scfv(美国专利号:9,315,585)、cd19抗原结合结构域(美国专利号:9,328,156);nkg2d配体结合结构域(美国专利号:9,273,283;美国专利公布号:us20160311906a1);美国专利9,272,002的包含氨基酸序列seqidno:11和12的人抗间皮素scfv;抗cs1结合剂(美国专利公布号:us20160075784);抗bcma结合结构域(国际专利公布号:wo2016/014565);美国专利号:9,102,761中的具有seqidno.:20的抗cd19scfv抗体;国际专利公布号:2016/025880的具有氨基酸序列seqidno:59和79的gfrα4抗原结合片段;国际专利公布号:wo2016014535的具有氨基酸序列seqidno.:47、44、48、49、50、39、40、41、42、43、45、46、51、73、70、74、75、76、65、66、67、68、69、71、72、77、195、86、83、87、88、89、78、79、80、81、82、84、85、90和196的抗cll-1(c型凝集素样分子1)结合结构域;国际专利公布号:wo2016014576的具有氨基酸序列seqidno:39-46的cd33结合结构域;gpc3(磷脂酰肌醇蛋白聚糖-3)结合结构域(国际专利公布号:wo2016036973的seqidno.:2和seqidno.:4);gfrα4(糖基磷脂酰肌醇(gpi)连接的gdnf家族α受体4细胞表面受体)结合结构域(国际专利公布号:wo2016025880);国际专利公布号:wo20160258896的具有氨基酸序列seqidno:480、483、485、478、158、159、160、157、217、218、219、216、276、277、278和275的cd123结合结构域;抗ror1抗体或其片段(国际专利公布号:wo2016016344);对gpc-3具有特异性的scfv(国际专利公布号:wo2016049459的seqidno:1和24);针对cspg4的scfv(国际专利公布号:wo2015080981的seqidno.:2);针对叶酸受体α的scfv(美国专利公布号:us20170002072a1);所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,天然配体可用作本发明的car的靶向部分。所述天然配体可能够以在scfv的范围内的亲和力结合抗原,并且可使t细胞特异性和效应物功能重定向以靶向表达互补性受体的细胞。在一些实施方案中,car的靶向部分可为神经调节蛋白-1(nrg1),其是her3和her4的天然配体;vegf,其是vegfr的天然配体;结合il13ra2的il13野生型蛋白或il13突变蛋白例如e13y;nkg2d配体,其是nkg2d受体的天然配体;cd70,其是cd27的配体;以及增殖诱导性配体(april),其是bcma8以及跨膜活化子和caml相互作用因子(taci)的天然高亲和力配体。美国专利公布号us20160362467a1中教导的任何基于配体的bcmacar都是适用的,所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的靶向部分可为包含表11中的氨基酸序列的scfv。表11:scfv序列在一个实施方案中,car的靶向部分可识别cd19。cd19是一种熟知的b细胞表面分子,其在b细胞受体活化后使b细胞抗原受体诱导的信号传导以及b细胞群体的扩增增强。cd19在正常b细胞与赘生性b细胞两者中均广泛表达。源于b细胞的恶性肿瘤诸如慢性淋巴细胞性白血病、急性淋巴细胞性白血病和许多非霍奇金淋巴瘤常常保留cd19表达。为单一细胞谱系所具有的这个近乎普遍表达和特异性已使得cd19成为对于免疫疗法来说具有吸引力的靶标。人cd19具有14个外显子,其中外显子1-4编码cd19的细胞外部分,外显子5编码cd19的跨膜部分,并且外显子6-14编码细胞质尾部。在一个实施方案中,靶向部分可包含源于fmc63抗体的可变区的scfv。fmc63是一种对cd19抗原具有特异性的igg2a小鼠单克隆抗体克隆,其与b谱系的细胞上的cd19抗原进行反应。cd19的由fmc63抗体识别的表位在外显子2中(sotillo等(2015)cancerdiscov;5(12):1282-95;其内容以引用的方式整体并入本文)。在一些实施方案中,car的靶向部分可源于包括但不限于4g7、sj25c1、cvid3/429、cvid3/155、hib19和j3-119的其他cd19单克隆抗体克隆的可变区。在一些实施方案中,car的靶向部分可识别肿瘤特异性抗原(tsa),例如由于会改变蛋白质编码序列,因此产生新型外来抗原的遗传突变或转录改变而仅由肿瘤细胞表达的癌症新抗原。遗传变化由遗传取代、插入、缺失或天然同源蛋白质(即在正常细胞中表达的分子)的任何其他遗传变化所致。在cd19的情形下,tsa可包括人cd19的缺乏外显子2或缺乏外显子5-6或缺乏两者的转录物变体(参见国际专利公布号wo2016061368;其内容以引用的方式整体并入本文)。因为fmc63结合表位在外显子2中,所以缺乏外显子2的cd19不由fmc63抗体识别。因此,在一些实施方案中,car的靶向部分可为与fmc63不同的scfv。如本文所用,“与fmc63不同”是指对cd19抗原的表位具有特异性,并且结合所述表位的抗体、scfv或其片段,所述表位不同于或不像cd19抗原的由fmc63结合的表位。在一些情况下,靶向部分可识别缺乏外显子2的cd19抗原。在一个实施方案中,靶向部分识别cd19的由外显子1、3和/或4编码的片段。在一个实例中,靶向部分识别使cd19的由外显子1编码的部分和cd19的由外显子3编码的部分进行桥接的表位。细胞内信号传导结构域在结合它的靶标分子之后,car融合多肽的细胞内结构域将信号传输至免疫效应细胞,从而使免疫效应细胞的至少一种正常效应物功能活化,所述效应物功能包括细胞溶解活性(例如细胞因子分泌)或辅助活性。因此,细胞内结构域包含t细胞受体(tcr)的“细胞内信号传导结构域”。在一些方面,可采用整个细胞内信号传导结构域。在其他方面,可替代完整链来使用细胞内信号传导结构域的截短部分,只要它转导效应物功能信号即可。在一些实施方案中,本发明的细胞内信号传导结构域可含有称为免疫受体酪氨酸基活化基序(itam)的信号传导基序。含有itam的细胞质信号传导序列的实例包括源于tcrcd3ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的那些。在一个实例中,细胞内信号传导结构域是cd3ζ(cd3zeta)信号传导结构域。在一些实施方案中,本发明的细胞内区域进一步包含一个或多个对免疫效应细胞提供额外信号的共刺激性信号传导结构域。这些共刺激性信号传导结构域与信号传导结构域组合可进一步改进经car工程化免疫细胞(例如cart细胞)的扩增、活化、记忆、持久性和肿瘤根除效率。在一些情况下,共刺激性信号传导区域含有一种或多种细胞内信号传导和/或共刺激性分子的1、2、3或4个细胞质结构域。共刺激性信号传导结构域可为包括但不限于以下的共刺激性分子的细胞内/细胞质结构域:cd2、cd7、cd27、cd28、4-1bb(cd137)、ox40(cd134)、cd30、cd40、icos(cd278)、gitr(糖皮质素诱导的肿瘤坏死因子受体)、lfa-1(淋巴细胞功能相关抗原-1)、light、nkg2c、b7-h3。在一个实例中,共刺激性信号传导结构域源于cd28的细胞质结构域。在另一实例中,共刺激性信号传导结构域源于4-1bb(cd137)的细胞质结构域。在另一实例中,共刺激性信号传导结构域可为gitr的细胞内结构域,如美国专利号:9,175,308中所教导;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的细胞内区域可包含来自选自由以下组成的组的蛋白质的功能性信号传导结构域:i类mhc分子、tnf受体蛋白质、免疫球蛋白样蛋白质、细胞因子受体、整合素、信号传导性淋巴细胞性活化蛋白质(slam)诸如cd48、cd229、2b4、cd84、ntb-a、cracc、blame、cd2f-10、slamf6、slamf7、活化性nk细胞受体、btla、toll配体受体、ox40、cd2、cd7、cd27、cd28、cd30、cd40、cds、icam-1、lfa-1(cd11a/cd18)、4-1bb(cd137)、b7-h3、cds、icam-1、icos(cd278)、gitr、baffr、light、hvem(lightr)、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、il15ra、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、nkg2d、nkg2c、nkd2cslp76、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、cd270(hvem)、gads、slp-76、pag/cbp、cd19a、特异性结合cd83的配体、dap10、trim、zap70、杀伤免疫球蛋白受体(kir)诸如kir2dl1、kir2dl2/l3、kir2dl4、kir2dl5a、kir2dl5b、kir2ds1、kir2ds2、kir2ds3、kir2ds4、kir2ds5、kir3dl1/s1、kir3dl2、kir3dl3和kir2dp1;凝集素相关nk细胞受体诸如ly49、ly49a和ly49c。在一些实施方案中,本发明的细胞内信号传导结构域可含有源于jak-stat的信号传导结构域。在其他实施方案中,本发明的细胞内信号传导结构域可含有源于dap-12(死亡相关蛋白12)的信号传导结构域(topfer等,immunol.,2015,194:3201-3212;以及wang等,cancerimmunol.,2015,3:815-826)。dap-12是nk细胞中的一种关键信号转导受体。由dap-12介导的活化性信号在触发nk细胞对某些肿瘤细胞和受病毒感染细胞的细胞毒性应答方面起重要作用。dap12的细胞质结构域含有免疫受体酪氨酸基活化基序(itam)。因此,含有dap12源性信号传导结构域的car可用于nk细胞的过继性转移。在一些实施方案中,用两种或更多种并有独特共刺激性结构域,并且由独特dd调控的car加以工程化的t细胞可用于提供对下游信号传导的动态控制。在一些实施方案中,本发明的有效载荷可为任何本文所述的共刺激性分子和/或细胞内结构域。在一些实施方案中,一种或多种各自在不同sre的控制下的共刺激性分子可用于本发明中。sre调控的共刺激性分子也可与第一代car、第二代car、第三代car、第四代car或本文所述的任何其他car设计联合表达。在一些实施方案中,本发明的细胞内结构域可包含表12的氨基酸序列。表12:细胞内信号传导和共刺激性结构域跨膜结构域在一些实施方案中,本发明的car可包含跨膜结构域。如本文所用,术语“跨膜结构域(tm)”广泛指代长度是约15个残基的跨越质膜的氨基酸序列。更优选地,跨膜结构域包括至少20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44或45个氨基酸残基,并且跨越质膜。在一些实施方案中,本发明的跨膜结构域可源于天然来源或合成来源。car的跨膜结构域可源于任何天然膜结合型或跨膜蛋白质。举例来说,跨膜区域可源于以下各物(即包含以下各物的至少跨膜区域):t细胞受体的α、β或ζ链,cd3ε、cd4、cd5、cd8、cd8α、cd9、cd16、cd22、cd33、cd28、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152或cd154。或者,本发明的跨膜结构域可为合成的。在一些方面,合成序列可主要包含疏水性残基诸如亮氨酸和缬氨酸。在一些实施方案中,本发明的跨膜结构域可选自由以下组成的组的:cd8α跨膜结构域、cd4跨膜结构域、cd28跨膜结构域、ctla-4跨膜结构域、pd-1跨膜结构域和人igg4fc区。作为非限制性实例,跨膜结构域可为国际专利公布号:wo2014/100385的包含氨基酸序列seqidno.:1-5的ctla-4跨膜结构域;和国际专利公布号:wo2014100385的包含氨基酸序列seqidno.:6-8的pd-1跨膜结构域;所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,本发明的car可包含任选铰链区(也称为间隔体)。铰链序列是有助于细胞外靶向结构域的柔性的短氨基酸序列,其使靶标结合结构域远离效应细胞表面进行移动以使得能够达成适当细胞/细胞接触、靶标结合和效应细胞活化(patel等,genetherapy,1999;6:412-419)。铰链序列可位于靶向部分与跨膜结构域之间。铰链序列可为源于任何适合分子或由任何适合分子获得的任何适合序列。铰链序列可源于免疫球蛋白(例如igg1、igg2、igg3、igg4)铰链区的全部或一部分,所述铰链区即落在免疫球蛋白的chi结构域与ch2结构域之间的序列,例如igg4fc铰链;1型膜蛋白诸如cd8α、cd4、cd28和cd7的细胞外区域,所述铰链序列可为野生型序列或衍生物。一些铰链区包括免疫球蛋白ch3结构域或ch3结构域与ch2结构域两者。在某些实施方案中,铰链区可从igg1、igg2、igg3或igg4加以修饰,其包括一个或多个氨基酸残基例如1、2、3、4或5个残基被与存在于未修饰铰链中的氨基酸残基不同的氨基酸残基取代。表13提供可用于本文所述的car中的各种跨膜区域。表13:跨膜结构域适用于本发明中的铰链区序列提供于表14中。表14:铰链区在一些实施方案中,铰链结构域和跨膜结构域可为配对的。铰链结构域可存在于跨膜结构域的n末端、跨膜结构域的c末端或跨膜结构域内。可适用于本发明中的铰链和跨膜区域序列提供于表15中。表15:配对的铰链和跨膜区域在一些实施方案中,本发明的car可包含一个或多个在car的任何结构域之间的接头。接头的长度可在1-30个氨基酸之间。就此而言,接头的长度可为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸。在其他实施方案中,接头可为柔性的。在一些实施方案中,本发明的组分,包括靶向部分、跨膜结构域和细胞内信号传导结构域,可构建在单一融合多肽中。融合多肽可为本发明的效应物模块的有效载荷。在一些实施方案中,超过一个car融合多肽可被包括在效应物模块中,例如两个、三个或更多个car可在单一sre(例如dd)的控制下被包括在效应物模块中。包含car有效载荷的代表性效应物模块说明于图2-图6中。在一些实施方案中,本发明的有效载荷可包括本领域中教导的包括细胞外靶向结构域、跨膜结构域和细胞内信号传导结构域的car构建体,例如靶向间皮素的car(美国专利号:9,272,002和9,359,447);美国专利号:9,266,960中的egfrviii特异性car;美国专利号:9,233,125中的抗tagcar;美国专利公布号:2016014533中的cd19car;美国专利号:9,328,156的具有氨基酸序列seqidno.:24的cd19car;美国专利号:8,911,993;8,975,071;9,101,584;9,102,760;和9,102,761中的cd19car;国际专利公布号:wo2016/014565(seqidno.:109-113以及213至233)和wo2016/014789中公开的bcma(cd269)特异性car;国际专利公布号:wo2016014535中公开的包含氨基酸序列seqidno:99、96、100、101、102、91、92、93、94、95、97、98、103和197的cll-1(c型凝集素样分子1)car;国际专利公布号:wo2016014576中的包含氨基酸序列seqidno:48-56的cd33特异性car;国际专利公布号:wo2015150526中的包含氨基酸序列seqidno:19-22、27-30以及35-38的cd33特异性car;美国专利公布号:us20150329640中的由核酸seqidno:1-5编码的cd37特异性car;gpc3car(国际专利公布号:wo2016036973)、国际专利公布号:wo2016025880中的具有氨基酸序列seqidno:85、86、90、92、94、96、98、100、102和104的gfrα4car;国际专利公布号:wo2016028896中的包含氨基酸序列seqidno:98、99、100和101的cd123car;国际专利公布号:wo2015193406中的cd123特异性多链car;国际专利公布号:wo2016/120220中的包含氨基酸序列seqidno.:160、171、188-197的cd123car;国际专利公布号:wo2016/016344中的包含氨基酸序列seqidno:93、95和117的ror-1特异性car;国际专利公布号:wo2016/016343中的ror-1特异性多链car;国际专利公布号:wo2016034666中的包含氨基酸序列seqidno:21、27、33、39、23、29、34、41、19、25、31、37、20、26、32、38、22、28、34、40、24、30、36和42的滋养层糖蛋白(5t4、tpbg)特异性car;国际专利公布号:wo2016016341中的包含氨基酸序列seqidno:15、17、24、25、26和27的egfrviii特异性car;国际专利公布号:wo2014164544中的包含氨基酸序列seqidno:1的tem8car、国际专利公布号:wo2014164544中的包含氨基酸序列seqidno:2的temlcar;国际专利公布号:wo2016/049459中的具有氨基酸序列seqidno:3和26的gpc-3car;国际专利公布号:wo2015/080981中的硫酸软骨素蛋白聚糖-4(cspg4)car;国际专利公布号:wo2015/164739中的κ/λcar;国际专利公布号:wo2016/134284中的gd2car;国际专利公布号:wo2016120218中的cll1car;国际专利公布号:wo2016120219中的cll1多亚单位car;国际专利公布号:wo2016120217中的hsp70car;国际专利公布号:wo2016120216中的经mab驱动car;所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,本发明的car构建体可包括caix(羧基脱水酶ix(caix))特异性car(lamers等,biochemsoctrans,2016,44(3):951-959)、hiv-1特异性car(ali等,jvirol.,2016年5月25日,pii:jvi.00805-16)、cd20特异性car(rufener等,cancerimmunol.res.,2016,4(6):509-519)、cd20/cd19双特异性car(zah等,cancerimmunolres.,2016,4(6):498-508)、cd22/cd19car(国际公布号:wo2016/149578)、cd138/bcma双特异性car(国际公布号:wo2016/130598)、egfr特异性car和抗egfrviii特异性car;所述文献和专利各自的内容以引用的方式整体并入本文。在一些实施方案中,car序列可选自表16。表16:car序列在本发明的一个实施方案中,本发明的有效载荷是靶向不同b细胞恶性肿瘤的cd19特异性car和靶向肉瘤、胶质母细胞瘤和晚期her2阳性肺恶性肿瘤的her2特异性car。在一些实施方案中,car是cd19car。cd19car组分和cd19car构建体的氨基酸序列呈现于表17a和表17b中。表17b也提供给定构建体标识符的替代性别名。这些别名由前缀ot标识。表17acd19car构建体组分表17b:cd19car构建体串联car(tancar)在一些实施方案中,本发明的car可为能够靶向两个、三个、四个或更多个肿瘤特异性抗原的串联嵌合抗原受体(tancar)。在一些方面,car是包括两个识别肿瘤细胞上的两种不同tsa的靶向结构域的双特异性tancar。双特异性car可进一步定义为包含含有对第一肿瘤抗原具有特异性的靶向结构域(例如抗原识别结构域)和对第二肿瘤抗原具有特异性的靶向结构域(例如抗原识别结构域)的细胞外区域。在其他方面,car是包括三个或更多个以串联排列方式加以构造的靶向结构域的多特异性tancar。tancar中靶向结构域之间的间隔的长度可在约5个氨基酸与约30个氨基酸之间,例如6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29和30个氨基酸。拆分car在一些实施方案中,本发明的组分,包括靶向部分、跨膜结构域和细胞内信号传导结构域,可被分成两个或更多个部分,以使它依赖于促进完整功能性受体的组装的多个输入。在一个实施方案中,可构建拆分合成car系统,其中活化的car受体的组装依赖于配体与sre(例如小分子)的结合以及特定抗原与靶向部分的结合。作为一非限制性实例,拆分car由以小分子依赖性方式组装的两个部分组成;受体的一个部分的特征在于具有细胞外抗原结合结构域(例如scfv),并且另一部分具有细胞内信号传导结构域诸如cd3ζ细胞内结构域。在其他方面,car系统的拆分部分可被进一步修饰来使信号增加。在一个实例中,细胞质片段第二部分可通过将跨膜结构域(例如cd8α跨膜结构域)并入构建体中来锚定于质膜。也可将额外细胞外结构域添加至car系统的第二部分中,例如介导同二聚化的细胞外结构域。这些修饰可使受体输出活性即t细胞活化增加。在一些方面,拆分car系统的两个部分含有在结合致异二聚化小分子后进行条件性相互作用的异二聚化结构域。因此,受体组分在小分子存在下组装,以形成可接着通过抗原啮合来活化的完整系统。任何已知致异二聚化组分都可被并入拆分car系统中。也可使用其他小分子依赖性异二聚化结构域,包括但不限于赤霉素诱导的二聚化系统(gid1-gai)、甲氧苄啶-slf诱导的ecdhfr和fkbp二聚化(czlapinski等,jamchemsoc.,2008,130(40):13186-13187)以及aba(脱落酸)诱导的pp2c和pyl结构域二聚化(cutler等,annurevplantbiol.2010,61:651-679)。拆分car系统的使用诱导型组装(例如配体依赖性二聚化)和降解(例如去稳定结构域诱导的car降解)达成的双重调控可提供用以控制经car修饰t细胞的活性的更大灵活性。可开关car在一些实施方案中,本发明的car可为可开关car。juilerat等人(juilerat等,sci.rep.,2016,6:18950;其内容以引用的方式整体并入本文)近来报道了可响应于刺激物(例如小分子)来短暂开启的可控制car。在这个car设计中,系统被直接整合在car中的使scfv结构域与细胞膜结构域分隔的铰链结构域中。所述系统有可能将car的在受体复合物的不同链内的不同关键功能诸如活化和共刺激进行拆分或组合,从而模拟tcr天然构造的复杂性。这个整合系统可使scfv和抗原相互作用在由不存在/存在刺激物加以控制的开启/关闭状态之间转换。可逆car在其他实施方案中,本发明的car可为可逆car系统。在这个car构造中,lid结构域(配体诱导的降解)被并入car系统中。car可通过添加lid结构域的配体来暂时下调。lid介导的调控和dd介导的调控的组合会提供对持续活化的cart细胞的可调谐控制,由此使car介导的组织毒性降低。抑制性car(icar)在一些实施方案中,本发明的有效载荷可为抑制性car。抑制性car(icar)是指一种双特异性car设计,其中负性信号用于使肿瘤特异性增强,并且限制正常组织毒性。这个设计并有第二car,所述第二car具有表面抗原识别结构域与抑制性信号结构域组合以限制t细胞应答性,即使在并行啮合活化性受体的情况下也如此。这个抗原识别结构域针对正常组织特异性抗原,以使t细胞可在第一靶标蛋白质存在下被活化,但如果存在结合icar的第二蛋白质,那么t细胞活化被抑制。作为一非限制性实例,基于ctla4和pd1抑制性结构域的针对前列腺特异性膜抗原(pmsa)的icar显示能够选择性限制由t细胞活化诱导的细胞因子分泌、细胞毒性和增殖(fedorovv.d等,2013,scitranslmed,11;5(215):215ra172;其内容整体并入本文)。嵌合转换受体在一些实施方案中,本发明的有效载荷可为可将负性信号转换成正性信号的嵌合转换受体。如本文所用,术语“嵌合转换受体”是指一种包含第一细胞外结构域和第二跨膜和细胞内结构域的融合蛋白,其中所述第一结构域包括负性信号区域,并且所述第二结构域包括正性细胞内信号传导区域。在一些方面,融合蛋白是含有t细胞上的抑制性受体的细胞外结构域融合于共刺激性受体的跨膜和细胞质结构域的嵌合转换受体。这个嵌合转换受体可使t细胞抑制性信号转变成t细胞刺激性信号。作为一非限制性实例,嵌合转换受体可包含pd-1的细胞外结构域融合于cd28的跨膜和细胞质结构域,如由liu等人(liu等人,cancerres.,2016,76(6):1578-1590;其内容以引用的方式整体并入本文)所教导。在一些方面,其他抑制性受体诸如ctla-4、lag-3、tim-3、kir和btla的细胞外结构域也可融合于源于共刺激性受体诸如cd28、4-1bb、cd27、ox40、cd40、gtir和icos的跨膜和细胞质结构域。在本发明的情形下,sre结构域(例如dd)可被插入在嵌合转换受体的n末端或c末端。在一些实施方案中,本发明的嵌合转换受体可包括重组受体,其包含抑制性细胞因子受体(例如il13受体α(il13rα1)、il10r和il4rα)的细胞外细胞因子结合结构域融合于刺激性细胞因子受体诸如il2r(il2rα、il2rβ和il2rγ)和il7rα的细胞内信号传导结构域。所述嵌合细胞因子受体的一个实例是含有il4rα的细胞因子结合细胞外结构域连接于il7rα的细胞内信号传导结构域的重组受体(参见美国专利公布号:2014/0050709;其内容以引用的方式整体并入本文)。在一个实施方案中,本发明的嵌合转换受体可为嵌合tgfβ受体。嵌合tgfβ受体可包含源于tgfβ受体诸如tgfβ受体1、tgfβ受体2、tgfβ受体3或任何其他tgfβ受体或其变体的细胞外结构域;以及非tgfβ受体细胞内结构域。非tgfβ受体细胞内结构域可为源于以下的细胞内结构域或其片段:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、cd28、4-1bb(cd137)、ox40(cd134)、cd3ζ、cd40、cd27或其组合。所述嵌合tgfβ受体的一个实例讨论于美国专利公布号:us2016/0075755中;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可为由两部分构成的融合受体。在一个方面,由两部分构成的融合受体可包含结合肿瘤抗原的抗原结合结构域和结合一个或多个细胞表面分子的活化结构域。在一些方面,由两部分构成的受体的抗原结合结构域是scfv抗体。在其他方面,活化结构域结合可选自cd3、cd27、cd28、cd40、ox40(cd134)和4-1bb(cd137)的t细胞表面刺激性分子,或选自cd16、nkg2d和nkp30的nk细胞表面刺激性分子。活化结构域也可为对免疫细胞(例如t细胞和nk细胞)的表面上的刺激性分子具有特异性的scfv。免疫细胞可被遗传修饰来表达包含至少一个抗原结合结构域和活化结构域的由两部分构成的分子。抗原结合结构域结合一个或多个存在于靶标细胞诸如癌细胞上的分子。表达由活化结构域识别的分子的免疫细胞将被活化,并且攻击所识别的癌细胞。作为一非限制性实例,由两部分构成的分子可为如美国专利公布号:us2016/0015749中所述的包含对cd19或epha2具有特异性的抗原识别scfv的衔接物分子;所述专利的内容以引用的方式整体并入本文。活化条件性car在一些实施方案中,本发明的有效载荷可为活化条件性嵌合抗原受体,其仅在活化的免疫细胞中表达。可使car的表达与活化条件性控制区联结,所述活化条件性控制区是指一个或多个诱导在它的控制下的序列例如car的转录和/或表达的核酸序列。所述活化条件性控制区可为在免疫效应细胞的活化期间得以上调的基因的启动子例如il2启动子或nfat结合位点。在一些实施方案中,免疫细胞的活化可通过组成性表达的car来实现(国际公布号:wo2016126608;其内容以引用的方式整体并入本文)。靶向具有特定蛋白聚糖标志物的肿瘤细胞的car在一些实施方案中,本发明的有效载荷可为靶向特定类型的癌细胞的car。人癌细胞和转移瘤可表达独特以及另外异常的蛋白聚糖,诸如多糖链(例如硫酸软骨素(cs)、硫酸皮肤素(ds或csb)、硫酸乙酰肝素(hs)和肝素)。因此,car可与识别癌症相关蛋白聚糖的结合部分融合。在一个实例中,car可与以高亲和力结合与蛋白聚糖相连的特定类型的硫酸软骨素a(csa)的var2csa多肽融合(var2-car)。car的细胞外scfv部分可用包含至少最小csa结合结构域的var2csa变体替换,从而产生对硫酸软骨素a(csa)修饰具有特异性的car。或者,car可与拆分蛋白质结合系统融合以产生谍-car(spy-car),其中car的scfv部分用拆分蛋白质结合系统的一个部分诸如谍标签(spytag)和spy-catcher(谍捕手)替换,并且癌识别分子(例如scfv和/或var2-csa)通过拆分蛋白质结合系统来与car相连(参见例如pct公布号:wo2016/135291;其内容以引用的方式整体并入本文)。supracar在一些实施方案中,本发明的有效载荷可为拆分通用可编程(supra)car。supracar可为两组分受体系统,其包含在t细胞上表达的通用受体(zipcar)和靶向肿瘤的scfv衔接头。zipcar通用受体可通过细胞内信号传导结构域和作为细胞外结构域的亮氨酸拉链的融合来产生。靶向肿瘤的scfv衔接分子或zipfv可通过同源亮氨酸拉链和scfv的融合来产生。zipfv的scfv可结合肿瘤抗原,并且亮氨酸拉链可结合并活化t细胞上的zipcar。不同于常规固定car设计,supracar模块化设计允许在不对免疫细胞进行进一步遗传操作的情况下靶向多个抗原。由cho等,2018,cell173,1–13公开的任何car设计都可适用于本发明中(所述文献的内容以引用的方式整体并入本文)。6.细胞因子、趋化因子和其他可溶性因子根据本发明,本发明的有效载荷可为由免疫细胞、癌细胞和其他细胞类型产生的充当身体内的细胞和组织之间的化学通信物的细胞因子、趋化因子、生长因子和可溶性蛋白质。这些蛋白质介导广泛范围的生理功能,从对细胞生长、分化、迁移和存活的影响直至许多效应物活性。举例来说,活化的t细胞产生多种用于达成细胞毒性功能的细胞因子以消除肿瘤细胞。在一些实施方案中,本发明的有效载荷可为细胞因子及其片段、变体、类似物和衍生物,包括但不限于肿瘤坏死因子(tnf)、干扰素(ifn)、tgfβ和趋化因子。在一些实施方案中,本发明的有效载荷可为刺激免疫应答的细胞因子。在其他实施方案中,本发明的有效载荷可为负性影响抗癌免疫应答的细胞因子的拮抗剂。在一些实施方案中,本发明的有效载荷可为细胞因子受体、重组受体、其变体、类似物和衍生物;或细胞因子的信号组分。在一些实施方案中,本发明的细胞因子可用于使用于免疫疗法的免疫细胞诸如cd8+tem、天然杀伤细胞和肿瘤浸润性淋巴细胞(til)的扩增、存活、持久性和效能改进。在其他实施方案中,用两种或更多种受dd调控的细胞因子加以工程化的t细胞用于提供对t细胞活化和肿瘤微环境重塑的动态控制。在一个方面,本发明提供用以使与细胞因子疗法相关的毒性最小化的生物回路和组合物。尽管全身性细胞因子疗法在使肿瘤负荷缓和方面取得了成功,但它经常导致显现重度剂量限制性副作用。两种因素促成观察到的毒性:(a)基因多效性,其中细胞因子影响不同细胞类型,并且视情形而定有时对相同细胞产生相反作用,(b)细胞因子具有短暂血清半衰期,因此需要在高剂量下加以施用以实现治疗作用,此会加剧基因多效性效应。在一个方面,本发明的细胞因子可用于在不利作用的情况下调节细胞因子表达。在一些实施方案中,本发明的细胞因子可被设计来具有延长的寿命或增强的特异性以使毒性最小化。在一些实施方案中,本发明的有效载荷可为白介素(il)细胞因子。白介素(il)是一类由白细胞产生的用于调控免疫应答的糖蛋白。如本文所用,术语“白介素(il)”是指来自任何物种或来源的白介素多肽,并且包括全长蛋白质以及所述蛋白质的片段或部分。在一些方面,白介素有效载荷选自il1、il1α(也称为促红细胞生成素-1)、il1β(分解代谢产物(catabolin))、il1δ、il1ε、il1η、il1ζ、白介素-1家族成员1至11(il1f1至il1f11)、白介素-1同源物1至4(il1h1至il1h4)、il1相关蛋白1至3(il1rp1至il1rp3)、il2、il3、il4、il5、il6、il7、il8、il9、il10、il10c、il10d、il11、il11a、il11b、il12、il13、il14、il15、il16、il17、il17a、il17b、il17c、il17e、il17f、il18、il19、il20、il20样蛋白(il20l)、il21、il22、il23、il23a、il23-p19、il23-p40、il24、il25、il26、il27、il28a、il28b、il29、il30、il31、il32、il33、il34、il35、il36α、il36β、il36γ、il36rn、il37、il37a、il37b、il37c、il37d、il37e和il38。在其他方面,本发明的有效载荷可为选自以下的白介素受体:cd121a、cdw121b、il2rα/cd25、il2rβ/cd122、il2rγ/cd132、cdw131、cd124、cd131、cdw125、cd126、cd130、cd127、cdw210、il8ra、il11rα、cd212、cd213α1、cd213α2、il14r、il15rα、cdw217、il18rα、il18rβ、il20rα和il20rβ。在某些实施方案中,细胞因子可为i型干扰素(ifn),包括ifnα亚型(ifnα1、ifnα1b、ifnα1c)、ifnβ、ifnδ亚型(ifnδ1、ifnδ2、ifnδ8)、ifnγ、ifnκ以及ifnε、ifnλ、ifnω、ifnτ和ifnζ。在某些实施方案中,细胞因子可为肿瘤坏死因子(tnf)超家族的成员,包括tnf-α、tnf-β(也称为淋巴毒素-α(lt-α))、淋巴毒素-β(lt-β)、cd40l(cd154)、cd27l(cd70)、cd30l(cd153)、fasl(cd178)、4-1bbl(cd137l)、ox40l、trail(tnf相关凋亡诱导性配体)、april(增殖诱导性配体)、tweak、trance、tall-1、gitrl、light以及tnfsf1至tnfsf20(tnf配体超家族成员1至20)。在一个实施方案中,本发明的有效载荷可包括il2(seqidno.8299,由seqidno.8300和8301编码)。在一个方面,本发明的效应物模块可为dd-il2融合多肽。在本发明的一些方面,il2突变蛋白可用作有效载荷。如本文所用,术语“突变蛋白”是具有蛋白质中的突变、变化或改变的构建体、分子或序列,因此也称为突变体,例如蛋白质突变体即突变蛋白。因此,“il2突变蛋白”是il2突变体。在一些实施方案中,il2突变蛋白是野生型il2蛋白的变体,其中所述野生型il2由氨基酸序列seqidno.8299组成。在一些方面,它是指仅结合并活化表达il2rαβγ的细胞,而不显著结合或活化仅表达il2rβγ的细胞的il2变体。在一些实例中,il2突变蛋白可为其中il2的负责结合il2rβ或il2rγ的残基被取代,因此消除它们的相互作用的il2蛋白。在其他实例中,il2突变蛋白可为包含赋予对il2rα的高亲和力的突变的il2蛋白。il2突变蛋白可为il2选择性激动剂(il2sa),其可优先使为相对于nk细胞来选择性活化t细胞所必需的高亲和力il2受体(即il2rαβγ)活化。在一些实施方案中,il2突变蛋白可为优先结合较低亲和力il2rβγ,但对cd25的亲和力降低的il2蛋白。在一些实施方案中,il2突变蛋白可用于优先扩增或刺激treg细胞。如本文所用,“优先扩增或刺激treg细胞”意指il2突变蛋白促进t调控性细胞的增殖、存活、活化和/或功能。示例性il2突变蛋白可包括但不限于n88r取代(shanafelt等,naturebiotech.,2000,18:1197-1202)、具有v91k取代的il2(例如美国专利公布号us20140286898);v91k取代、c125a取代、具有三个突变:v69a、n71r、q74p的il2;对il2rα具有高亲和力的il2突变蛋白(n29s、y31h、k35r、t37a、k48e、v69a、n71r、q74p);具有对il2rα的高亲和力和降低的信号传导活性的il2突变蛋白(n29s、y31h、k35r、t37a、k48e、v69a、n71r、q74p、n88d)、以及如pct申请号1999060128中所述的d20h、d20i、n88g、n88i、n88r和q126l取代;所述文献和专利各自的内容以引用的方式整体并入本文。在其他方面,il2突变蛋白可包括美国专利号:4,518,584;5,116,943;5,206,344;6,955,807;7,105,653;7,371,371;7,803,361;8,124,066;8,349,311;8,759,486;和9,206,243;pct专利公布号:wo2005086751和wo2012088446;欧洲专利号:ep0234599和ep0200280以及sim,g.c.等(2016)cancerimmunolres;4(11):983-994中所述的那些;所述专利和文献各自的内容以引用的方式整体并入本文。在一些方面,il2突变蛋白可融合于使il2突变蛋白的血清半衰期延长的多肽,诸如iggfc片段。优选fc区源于人igg,其包括igg1、igg2、igg3和igg4。在其他方面,本发明的有效载荷可为包含第二功能性多肽的il2融合蛋白。在一非限制性实例中,il2融合蛋白可包含il2或il2突变蛋白多肽与促凋亡bcl-2家族多肽(诸如bad、bik/nbk、bid、bim/bod、hrk、bak或bax)融合;所述融合蛋白可能够抑制表达il2受体的靶标细胞的细胞存活,抑制所述靶标细胞的细胞增殖,或增强所述靶标细胞的细胞死亡或凋亡。或者,il2或il2突变蛋白多肽可与抗凋亡bcl-2家族多肽(诸如bcl-xl、bcl-w或bcl-2)融合。所述融合蛋白可能够增强表达il2受体的靶标细胞的细胞存活,增强所述靶标细胞的细胞增殖,或抑制所述靶标细胞的细胞死亡或凋亡。参见例如美国专利公布号:us2016/0229901。此外,il2融合蛋白可为il2-gmcsf融合蛋白,其可促进细胞-细胞相互作用;因此,使抗癌免疫应答增强(wen等,j.translationalmed.,2016,14:41)。在一个实施方案中,本发明的有效载荷可包括il12。il12是一种具有两个亚单位(p35、p40)的异二聚蛋白质,其由抗原呈递细胞诸如巨噬细胞和树突细胞分泌。il12是通过stat4路径来作用于天然杀伤(nk)细胞、巨噬细胞、cd8+细胞毒性t细胞和cd4+t辅助细胞以诱导在这些效应免疫细胞中产生ifnγ的1型细胞因子(由trinchierig,natrevimmunol.2003;3(2):133–146综述)。il12可促进nk细胞和cd8+t细胞的细胞毒性活性,因此具有抗肿瘤功能。静脉内注射重组il12在患有晚期黑素瘤和肾细胞癌的少数患者中展现适度临床功效(gollob等,clin.cancerres.2000;6(5):1678–1692)。il12已作为佐剂用于增强在使用黑素瘤抗原疫苗或使用经肽脉冲处理的外周血液单核细胞的情况下的细胞毒性免疫性;以及促进在用曲妥珠单抗治疗乳腺癌的情况下的nk细胞活性。在若干肿瘤模型中,向肿瘤微环境中局部递送il12会促进肿瘤消退。这些研究全都指示局部增加的il12水平可促进抗肿瘤免疫性。全身性或局部施用重组il12蛋白或通过溶瘤性病毒载体进行施用的一个主要障碍是当il12在高水平下呈现时的重度副作用。开发严密控制il12水平的系统可提供在癌症治疗中安全使用il12。在一个方面,本发明的效应物模块可为dd-il12融合多肽。这个可调控dd-il12融合多肽可直接用作免疫治疗剂,或转导至免疫效应细胞(t细胞和til细胞)中以产生用于过继性细胞转移的具有较大体内扩增和存活能力的经修饰t细胞。在当前过继性细胞疗法中对苛刻预先调节方案的需要可使用受调控的il12来加以最小化;dd-il12可用于调节肿瘤微环境,并且使在当前为肿瘤抗原靶向疗法所难治的实体肿瘤中的持久性增加。在一些实施方案中,car表达性t细胞可用受dd调控的il12来加置装甲以在无全身性毒性的情况下减轻免疫抑制。在一些实施方案中,il12可为flexiil12,其中p35亚单位与p40亚单位两者由产生单链多肽的单一cdna编码。在一个实施方案中,il12可包含p40亚单位,所述p40亚单位包括野生型il12b的氨基酸23-328,并且包含氨基酸序列seqidno.8302(由seqidno.8303-8312编码),以及p35亚单位,所述p35亚单位包括野生型il12a的氨基酸57-253,并且包含氨基酸序列seqidno.8313(由seqidno.8314-8323编码)。il12的保留全长或成熟il12的一种或多种功能的任何部分都可适用于本发明中。在一些实施方案中,本发明的受dd调控的il12组合物可用于使与全身性il12施用相关的细胞毒性最小化。用il12进行的治疗已与全身性流感样症状(发热、感到寒冷、疲劳、关节肌痛、头痛)、对骨髓和肝的毒性作用相关联。最通常观察到的血液毒性包括嗜中性白细胞减少症和血小板减少症;以短暂(剂量依赖性)转氨酶增加来显现的肝功能异常、高胆红素血症和低白蛋白血症。在一些情况下,毒性也与粘膜的炎症(口腔粘膜炎、口腔炎或结肠炎)相关联。il12的这些毒性作用与继发性产生ifnγ、tnfα和趋化因子诸如ip10和mig相关。在本发明的某些方面,受dd调控的il12可用于预防与升高的第二信使产生相关的毒性作用。在一些实施方案中,受dd调控的flexi-il12构建体可用于通过提供受控制的局部信号以达成肿瘤微环境重塑和表位扩展来改进car的功效,尤其是在实体肿瘤环境下。dd调控也提供flexiil12的快速、剂量依赖性以及局部产生。用作本发明的有效载荷的il12构建体的形式可加以优化。在一个实施方案中,本发明的有效载荷可为含有p40亚单位和p35亚单位的双顺反子il12,所述亚单位由内部核糖体进入位点或裂解位点诸如p2a或弗林蛋白酶裂解位点分隔以允许从单一载体独立表达两个亚单位。这导致相比于flexiil12构建体,所分泌il12的构型更加类似于天然存在的il12,本发明的有效载荷可为il12的p40亚单位。受dd调控的p40可与组成性p35构建体共表达以产生“可调控il12”表达。或者,受dd调控的p40可与内源性p35异二聚。已显示p40会使p35表达稳定,并且刺激p35的输出(jalahr等(2013).journalofbiol.chem.288,6763-6776,其内容以引用的方式整体并入本文)。在一些实施方案中,il12的经修饰形式可用作有效载荷。il12的这些经修饰形式可被工程化来相较于非修饰形式,具有缩短的体内半衰期,尤其是在与本文所述的可调谐系统组合使用时。人flexiil12具有5-19小时的经报道半衰期,当作为治疗性化合物施用时,此可导致全身性细胞毒性(car等(1999)thetoxicologyofinterleukin-12:areview"toxicologicpath.27a,58-63;robertson等(1999)"immunologicaleffectsofinterleukin12administeredbybolusintravenousinjectiontopatientswithcancer"clin.cancerres.5:9-16;atkins等(1997)"phaseievaluationofintravenousrecombinanthumaninterleukin12inpatientswithadvancemalignancies"clin.cancerres.3:409-417)。对il12的配体诱导型控制可以剂量依赖性方式对产生进行调控,从配体给药停止直至蛋白质合成停止以及il12清除的时间可能不足以防止il12在血浆中的毒性积累。在一个实施方案中,用作有效载荷的il12的修饰形式可为topo-scil12,其从n末端至c末端具有如下构型:(i)第一il12p40结构域(p40n),(ii)任选第一肽接头,(iii)il12p35结构域,(iv)任选第二肽接头,和(v)第二il12p40结构域(p40c)。在一个实施方案中,经修饰toposcil12多肽展现对蛋白水解的易感性增加。topo-scil12描述于国际专利公布号wo2016048903中;所述专利的内容以引用的方式整体并入本文。il12多肽也可被修饰(例如被遗传工程化、合成工程化或重组工程化)来使对蛋白酶的易感性增加以相较于缺乏蛋白酶易感性的相应il12来降低il12复合物的生物活性半衰期。il12的蛋白酶易感形式描述于国际专利公布号wo2017062953中;所述专利的内容以引用的方式整体并入本文。il12全身性毒性也可通过涉及使il12栓系于细胞表面来将它的治疗功效限于肿瘤部位的机制加以限制或严密控制。先前已描述使用糖基磷脂酰肌醇(gpi)信号肽或使用cd80跨膜结构域达成的膜栓系il12形式(nagarajans等(2011)jbiomedmaterresa.99(3):410-7;bozemanen等(2013)vaccine.7;31(20):2449-56;wen-yupan等(2012),mol.ther.20:5,927–937;其各自的内容以引用的方式整体并入本文)在一些实施方案中,跨膜结构域可选自表13、表14和表15中所述的那些跨膜结构域中的任一者。在一些实施方案中,当用tlr激动剂活化时,由本发明的免疫细胞分泌的il12水平可大致与由人骨髓性树突细胞(mdc1)分泌的il12水平类似。在一个实施方案中,tlr激动剂可为脂多糖与r848一起施用的组合。在一些实施方案中,相较于在不存在配体下的水平,在配体存在下,由于il12诱导的免疫细胞活化而分泌的ifnγ是至少5倍大。在一些实施方案中,对il12的调控会提供必需的安全性开关。在一些实施方案中,il-12分泌会在肿瘤微环境中募集和/或活化效应细胞。在一些实施方案中,il12调控会对cart功能提供益处而不导致毒性。在一个实施方案中,本发明的有效载荷可包括il15。白介素15是强效免疫刺激性细胞因子和为t细胞和天然杀伤细胞所必需的存活因子。对il2和il15进行比较的临床前研究已显示相比于il2,il15与较小毒性相关联。在一些实施方案中,本发明的效应物模块可为dd-il15融合多肽。il15多肽也可被修饰来使它对il15受体的结合亲和力增加。举例来说,在il15的位置72处,天冬酰胺可用天冬氨酸置换(美国专利公布us20140134128a1的seqidno.2;所述专利的内容以引用的方式整体并入本文)。在一些方面,il15包含氨基酸序列seqidno.8234(由seqidno.8236编码),其包括野生型il15的氨基酸49-162。在一些实施方案中,il15序列可包括终止密码子,并且可由核苷酸序列seqidno.8235以及8237-8238编码。il15介导的活化的一个独特特征是反式呈现机制,其中il15以与il15受体的α亚单位(il15ra)的复合物形式呈现,所述复合物结合并活化同一细胞或不同细胞上的膜结合型il15β/γ受体。相比于单独il15,il15/il15ra复合物更有效使il15信号传导活化。因此,在一些实施方案中,本发明的效应物模块可包括dd-il15/il15ra融合多肽。在一个实施方案中,有效载荷可为美国专利公布号:us20160158285a1中所述的il15/il15ra融合多肽(所述专利的内容以引用的方式整体并入本文)。il15受体α包含称为寿司(sushi)结构域的细胞外结构域,其含有为结合il15所必需的大多数结构元件。因此,在一些实施方案中,有效载荷可为美国专利公布号:us20090238791a1中所述的il15/il15ra寿司结构域融合多肽(所述专利的内容以引用的方式整体并入本文)。受调控的il15/il15ra可用于促进cd8tem细胞群体的扩增、存活和效能而不影响调控性t细胞、nk细胞和til细胞。在一个实施方案中,dd-il15/il15ra可用于增强在b细胞白血病和淋巴瘤的情况下的cd19定向t细胞疗法。在一个方面,il15/il15ra可作为本发明的有效载荷用于降低当前car-t治疗范式中对预先调节方案的需要。含有dd-il15、dd-il15/il15ra和/或dd-il15/il15ra寿司结构域的效应物模块可被设计为分泌型(使用例如il2信号传导)或膜结合型(使用例如ige或cd8a信号序列)。在一些实施方案中,相较于在不存在配体下的水平,在配体存在下,由于il15诱导的免疫细胞活化而分泌的ifnγ是至少10倍大。在一些实施方案中,相较于组成性表达的il15-il15ra,对il15-il15ra融合蛋白的调控会提供安全性开关。在一些实施方案中,il15-il15ra导致cart细胞的更好扩增和/或持久性。在一些方面,dd-il115/il15ra包含表18中提供的氨基酸序列。在一些实施方案中,用于表18中的接头可为sg接头。在表18中,星号指示终止密码子的翻译。在一些实施方案中,表18中所述的dd可含有额外终止密码子。如本文所用,野生型(wt)的il15是指uniprotid:p40933,并且野生型(wt)的il15ra是指uniprotid:q13261。表18也提供给定构建体标识符的替代性别名。这些别名由前缀ot标识。表18:dd-il15-il15ra构建体序列在一些实施方案中,表18中所述的序列可含有额外终止密码子。举例来说,构建体“hpde5(wt的氨基酸535-860,r732l);终止序列”可由核苷酸序列seqidno.8362编码,并且构建体“hpde5(wt的氨基酸535-860,r732l、f736a);终止序列”可由核苷酸序列seqidno.8363编码。在一个实施方案中,本发明的有效载荷可包括il18。il18是一种促进由t细胞和nk细胞达成的ifnγ产生的促炎性和免疫调控性细胞因子。il18属于il1家族。分泌的il18结合由il18rα和β链组成的异二聚体受体复合物,并且引发信号转导。il18与其他细胞因子协力起调节免疫系统功能的作用,包括诱导应答于病原体产物的ifnγ产生、th1应答和nk细胞活化。il18在若干肿瘤的情况下显示抗癌作用。施用重组il18蛋白或il18转基因会通过使cd4+t和/或nk细胞介导的应答活化来诱导黑素瘤或肉瘤消退(由srivastava等,curr.med.chem.,2010,17:3353–3357综述)。il18与其他细胞因子诸如il12或共刺激性分子(例如cd80)的组合使il18抗肿瘤作用增加。举例来说,il18和il12a/b或cd80基因已被成功整合在溶瘤性病毒的基因组中,目的在于协同触发t细胞介导的抗肿瘤免疫应答(choi等,genether.,2011,18:898-909)。il2/il18融合蛋白也在临床前模型中显示相对于任一单独细胞因子得以增强的抗肿瘤性质以及低毒性(acres等,cancerres.,2005,65:9536–9546)。il18在单独或与il12和il15组合的情况下会使nk细胞活化。临床前研究已证明过继性转移的经il12、il15和il18预活化的nk细胞在体内显示针对所建立肿瘤的增强的效应物功能(ni等,jexpmed.2012,209:2351-2365;以及romee等,blood.2012,120:4751-4760)。经il12/il15/il18活化人nk细胞也显示记忆样特征,并且应答于细胞因子(例如低浓度的il2)而分泌更多ifnγ。在一个实施方案中,本发明的效应物模块可为dd-il18融合多肽。在一个实施方案中,本发明的有效载荷可包括il21。il21是另一基因多效性i型细胞因子,主要由t细胞和天然杀伤t(nkt)细胞产生。il21对多种细胞类型具有不同作用,所述细胞类型包括但不限于cd4+和cd8+t细胞、b细胞、巨噬细胞、单核细胞和树突细胞(dc)。il21的功能性受体由il21受体(il21r)和共同细胞因子受体γ链组成,所述γ链也是il2、il4、il7、il9和il15的受体的亚单位。研究提供强效证据表明il21是一种用于癌症免疫疗法的有前景的免疫治疗剂。il21促进成熟,增强细胞毒性,并且诱导由nk细胞对ifnγ和穿孔素(perforin)的产生。这些效应物功能抑制b16黑素瘤的生长(kasaian等,immunity.2002,16(4):559–569;以及brady等,jimmunol.2004,172(4):2048–2058)。il21连同il15一起使抗原特异性cd8+t细胞数目和它们的效应物功能扩增,从而导致肿瘤消退(zeng等,jexpmed.2005,201(1):139–148)。il21也可用于使肿瘤微环境中的多种免疫效应细胞复原。il21也可通过使stat3或stat1信号路径活化来直接诱导某些类型的淋巴瘤诸如弥漫性大b细胞淋巴瘤、套膜细胞淋巴瘤和慢性淋巴细胞性白血病细胞的凋亡。il21在单独或与抗cd20mab(利妥昔单抗)组合的情况下可使nk细胞依赖性细胞毒性作用活化。引起关注的是,对il21的免疫抑制性作用的发现表明这个细胞因子是一把“双刃剑”-il21刺激可导致对免疫应答的诱导或抑制。当使用il21相关免疫治疗剂时,必须考虑il21的刺激作用与抑制作用两者。il21的水平需要由调控元件加以严密控制。在一个方面,本发明的效应物模块可为dd-il21融合多肽。在一些实施方案中,本发明的有效载荷可包括i型干扰素。i型干扰素(ifn-i)是对于对抗人的病毒性感染重要的可溶性蛋白质。ifn-i包括ifnα亚型(ifnα1、ifnα1b、ifnα1c)、ifnβ、ifnδ亚型(ifnδ1、ifnδ2、ifnδ8)、ifnγ、ifnκ以及ifnε、ifnλ、ifnω、ifnτ和ifnζ。ifnα和ifnβ是免疫应答中的主要ifni亚型。ifni的所有亚型都通过独特异二聚受体即干扰素α受体(ifnar)来进行信号传导,所述受体由2个亚单位即ifnar1和ifnar2组成。ifnr活化会调控对病毒性感染以及在适应性免疫性的情况下的宿主应答。若干信号传导级联可由ifnr活化,包括janus活化的激酶–信号转导子和转录活化(jak-stat)路径、有丝分裂原活化的蛋白质激酶(mapk)路径、磷酸肌醇3-激酶(pi3k)路径、v-crk肉瘤病毒ct10致癌基因同源物(鸟)样(crkl)路径和nf-κb级联。长久以来已确定的是i型ifn直接抑制肿瘤细胞和受病毒感染细胞的增殖,并且使i类mhc表达增加,从而使抗原识别增强。ifn-i也已被证明涉及于免疫系统调控中。ifn可通过干扰素受体(ifnr)来直接或通过诱导趋化因子和细胞因子来间接调控免疫系统。i型ifn使nk细胞功能增强,并且促进nk细胞的存活。i型ifn也影响单核细胞,从而支持单核细胞分化成具有高抗原呈递能力的dc;并且刺激巨噬细胞功能和分化。若干研究也证明ifn-i促进cd8+t细胞存活和功能。在一些情况下,可合乎需要的是使用本发明的生物回路来调谐i型ifn的表达以避免由用ifn进行长期治疗所引起的免疫抑制。正在开发使用重组i型ifn蛋白、i型ifn转基因、i型ifn编码载体和i型ifn表达性细胞进行的新型抗癌免疫疗法。举例来说,ifnα已得到核准用于治疗若干赘生性疾病,诸如黑素瘤、rcc和多发性骨髓瘤。尽管i型ifn是用以直接和间接调节免疫系统的功能的强效工具,但全身性长期治疗的副作用以及缺乏足够高的功效已阻抑了对ifnα用于肿瘤学临床使用的关注。据信如果在恶性组织处的ifn水平得以严密调控,那么i型ifn可能更加有效。根据以优化节奏达成的间歇性可有助于避免应答性免疫细胞中由ifn-i诱导(即由于socs1诱导)的信号传导脱敏机制(负反馈机制)的观察结果,提出了用于间歇递送的方法。根据本发明,效应物模块可包括dd-ifn融合多肽。dd和它的配体会控制ifn的表达以诱导抗病毒和抗肿瘤免疫应答,并且同时使由长期暴露于ifn引起的副作用最小化。在一些实施方案中,本发明的有效载荷可包括肿瘤坏死因子(tnf)超家族的成员。如本文所用的术语“tnf超家族”是指可诱导凋亡的一组细胞因子。tnf家族的成员包括tnf-α、tnf-β(也称为淋巴毒素-α(lt-α))、淋巴毒素-β(lt-β)、cd40l(cd154)、cd27l(cd70)、cd30l(cd153)、fasl(cd178)、4-1bbl(cd137l)、ox40l、trail(tnf相关凋亡诱导性配体)、april(增殖诱导性配体)、tweak、trance、tall-1、gitrl、light以及tnfsf1至tnfsf20(tnf配体超家族成员1至20)。在一个实施方案中,本发明的有效载荷可为tnf-α。tnf-α可导致肿瘤细胞的细胞裂解,并且也诱导细胞增殖分化。在一个方面,本发明的效应物模块可包括dd-tnfα融合多肽。在一个实施方案中,本发明的有效载荷可为融合于tnfα外结构域的细胞因子。所述有效载荷以融合于tnf外结构域的膜相关细胞因子形式产生。在一个实施方案中,细胞因子可通过膜相关蛋白酶和/或细胞外间隙中的蛋白酶例如mmp9的作用来从细胞表面脱落。任何本文所述的细胞因子都可适用于本发明中。所述细胞因子-tnf骨架构建体可用于保持经加工细胞因子的天然序列,同时保持调控。在一些实施方案中,本发明的有效载荷可包括阻断抑制性细胞因子的抑制性分子。抑制剂可为对抑制性细胞因子具有特异性的阻断抗体和针对抑制性细胞因子的拮抗剂等。在一些方面,本发明的有效载荷可包括次级细胞因子il35的抑制剂。il35属于白介素-12(il12)细胞因子家族,并且是由il27β链ebi3和il12α链p35组成的异二聚体。已描述生物活性il35仅在叉头框蛋白3(foxp3)+调控性t细胞(treg)(静息和活化的treg)的情况下分泌。不同于家族中的其他成员,il35似乎通过抑制效应t细胞增殖以及也许其他参数来仅仅以消炎方式起作用(collison等,nature,2007,450(7169):566–569)。在一些实施方案中,本发明的有效载荷可包括阻断转化生长因子β(tgf-β)亚型(tgf-β1、tgf-β2和tgf-β3)的抑制剂。tgf-β由包括巨噬细胞的许多细胞类型分泌,并且经常与两种蛋白质ltbp和lap复合。血清蛋白酶诸如纤维蛋白溶酶会催化活性tgf-β从经活化巨噬细胞,从复合物释放。已显示tgf-β表达增加与许多癌症的恶性相关联。tgf-β在肿瘤微环境中的免疫抑制活性会促进肿瘤发生。在一些实施方案中,本发明的有效载荷可包括ido酶的抑制剂。在一些实施方案中,融合于本发明的dd的有效载荷可为免疫抑制性分子诸如tgf-β和ido的抑制剂。在一些实施方案中,本发明的有效载荷可包括趋化因子和趋化因子受体。趋化因子是一个家族的可诱导邻近应答性细胞的定向趋化性的分泌型小细胞因子或信号传导蛋白质。趋化因子可为选自由以下组成的组的scy(小细胞因子):scya1-28(ccl1-28)、scyb1-16(cxcl1-16)、scyc1-2(xcl1-2)、scyd-1和scye-1;或选自以下的c趋化因子:xcl1和xcl2;或选自以下的cc趋化因子:ccl1、ccl2、ccl3、ccl4、ccl5、ccl6、ccl7、ccl8、ccl9、ccl10、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27和ccl28;或选自以下的cxc趋化因子:cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16和cxcl17;或cx3c趋化因子cx3cl1。在一些方面,趋化因子受体可为c趋化因子的受体,包括xcr1;或cc趋化因子的受体,包括ccr1、ccr2、ccr3、ccr4、ccr5、ccr6、ccr7、ccr8、ccr9和ccr10;或cxc趋化因子的受体,包括cxcr1、cxcr2、cxcr3、cxcr4和cxcr5;或cx3c趋化因子受体cx3cr1。在一些实施方案中,本发明的有效载荷可包括在免疫疗法中起关键作用的其他免疫调节剂,诸如gm-csf(粒细胞-巨噬细胞集落刺激因子)、红血球生成素(epo)、mip3a、单核细胞趋化蛋白(mcp)-1、细胞内粘附分子(icam)、巨噬细胞集落刺激因子(m-csf)、白介素-1受体活化性激酶(irak-1)、乳转铁蛋白(lactotransferrin)和粒细胞集落刺激因子(g-csf)。在一些实施方案中,本发明的有效载荷可包括双调蛋白。双调蛋白(areg)是一种egf样生长因子,其结合egfr受体,并且使cd4+调控性t细胞(treg)功能增强。areg促进肿瘤环境中的免疫抑制。因此,在某一实施方案中,本发明的有效载荷可包括双调蛋白以阻抑在免疫疗法期间的免疫应答。在一些实施方案中,本发明的有效载荷可包括其中细胞因子、趋化因子和/或其他可溶性因子可融合于其他生物分子诸如抗体和/或受体的配体的融合蛋白。所述融合分子可使细胞因子的半衰期增加,使全身性毒性降低,并且使细胞因子在肿瘤部位处的局部浓度增加。含有两种或更多种细胞因子、趋化因子和/或其他可溶性因子的融合蛋白可用于获得协同治疗益处。在一个实施方案中,有效载荷可为gm-csf/il2融合蛋白。在一些实施方案中,任何本文所述的铰链和跨膜结构域都可作为骨架用于可溶性细胞因子呈现。细胞因子可通过蛋白酶裂解位点来可操作地连接于cd8铰链和跨膜结构域。在裂解位点处进行的裂解会使细胞因子从细胞表面膜释放。在一些方面,细胞因子可呈前体形式。从前体形式产生细胞因子的活性形式通过在裂解位点处进行的裂解来发生。任何本文所述的细胞因子都可使用任何本文所述的铰链和跨膜结构域作为骨架来工程化。7.免疫调控剂在一些实施方案中,本发明的有效载荷可包括共抑制性分子(例如免疫检查点)的抑制剂(拮抗剂),所述共抑制性分子包括不限于pd-1、pd-l1、pd-l2、ctla-4、tim-3、vista、btla、tigit、laira、cd160、2b4和tgfr。在一些方面,抑制剂可为如先前讨论的阻断/拮抗性抗体或其片段、或共抑制性受体的配体。在一些实施方案中,本发明的有效载荷可包括共刺激性分子的激动剂,所述共刺激性分子包括不限于cd27、cd28、cd30、cd40、ox40(cd134)、4-1bb(cd137)、cds、icam-1、lfa-1(cd11a/cd18)、icos(cd278)、gitr、baffr、hvem、cd7、light、nkg2c、slamf7、nkp80、cd160、b7-h3和cd83。作为一非限制性实例,共刺激性分子icos(cd278)的激动剂可为国际专利公布号:wo2016120789中公开的包含氨基酸序列seqidno:1、2、3、4、5和6的icos结合蛋白;所述专利的内容以引用的方式整体并入本文。在一些方面,共刺激性分子的激动剂可为如先前讨论的激动性抗体或其片段;或共刺激性受体的配体;或可使它的靶标的生物活性增强的任何结合分子。举例来说,ox40的激动性配体可为ox40l(cd252)。如本文所用的ox40配体包括完整ox40配体、可溶性ox40配体、包括ox40配体的功能活性部分共价连接于第二部分例如蛋白质结构域的融合蛋白、以及可在氨基酸序列方面从天然存在的ox4l进行变化,但保留特异性结合ox40受体的能力,或甚至使ox40l的生物活性增强的变体。一般来说,共刺激性分子的激动剂使它的靶标分子的生物活性诸如t细胞活化实质上增强。合乎需要的是,生物活性增强10、20、30、50、70、80、90、95或甚至100%。在一些实施方案中,本发明的有效载荷可包括可整合先天性免疫应答与适应性免疫应答两者的免疫调节剂,包括应激蛋白和热激蛋白(hsp)。它们也可为刺激免疫应答的其他伴侣蛋白和衔接头。作为一非限制性实例,本发明的有效载荷可为包含鞭毛蛋白(flagellin)的nf-kb活化性结构域与atp结合结构域被截断的葡萄糖调控蛋白170(grp170)融合的融合蛋白(参见美国专利公布号:us2015/0315255;其内容以引用的方式整体并入本文)。融合构建体形成可用于刺激抗癌免疫应答的可分泌grp170-鞭毛蛋白杂合伴侣蛋白(flagrp170)。在其他实施方案中,本发明的有效载荷可包括作为细胞质中的衔接分子的sting(干扰素基因刺激物)蛋白,其作为宿主胞质监视路径的组分会使tank结合激酶(tbk1)-irf3信号传导轴活化,从而导致对使先天免疫性强烈活化的ifnβ和其他irf-3依赖性基因产物的诱导,因而导致产生由抗原特异性cd4+和cd8+t细胞以及病原体特异性抗体两者组成的适应性免疫应答。demaria等人报道通过肿瘤内注射作为sting的激动剂的环状二核苷酸gmp-amp(cgamp)达成的sting蛋白活化加强可使抗肿瘤cd8+t细胞应答增强,从而导致对小鼠黑素瘤和结肠癌模型中经注射和对侧肿瘤的生长控制。sting依赖性抗肿瘤免疫性取决于由肿瘤微环境中的内皮细胞产生的i型ifn(demaria等,proc.natl.acad.sci.usa,2015,112(5):15408-15413)。这些研究证明sting通过使肿瘤微环境中的i型ifn信号传导增强来促进抗肿瘤免疫应答。包含sting的生物回路、效应物模块可单独或与本发明的其他免疫治疗剂组合来应用于肿瘤微环境以使抗肿瘤应答增强。除sting蛋白之外,本发明的有效载荷也可包括涉及于感测由病毒和微生物对细胞的感染以使先天性免疫炎症性应答活化中的prr(模式识别受体)。所述prr包括toll样受体(tlr)、rig-i样受体(rlr)、nod样受体(nlr)和c型凝集素受体(clr)。rlr家族是一种rna感测系统,其包含视黄酸诱导型基因样-i(rig-1)、黑素瘤分化相关基因5(mda5)以及遗传学和生理学实验室蛋白2(lgp2)。rig-1识别相对较短的dsrna(直至1kb),而mda5检测长的dsrna(超过2kb)以使包括ifnα和ifnβ的i型ifn的合成活化(wilkins等,curropinimmunol.,2010,22:41–47)。rlr使激起i型ifn产生的下游信号传导蛋白质活化。tlr识别微生物中的独特结构;所述结构经常被称为“pamp”(病原体相关分子样式)。配体结合tlr会激发诱导炎症和免疫性中涉及的因子诸如促炎性细胞因子和趋化因子的产生以及cd4+和cd8+t细胞活化的细胞内信号传导路径的级联。在人中鉴定的十个tlr之中,tlr-1、tlr-2、tlr-4、tlr-5和tlr-6在细胞表面中表达,而tlr-3、tlr-7/tlr-8和tlr-9在er区室内表达。在一些实施方案中,本发明的有效载荷可为一种prr或prr的激动剂。8.代谢因子/代谢检查点在一些实施方案中,用于免疫疗法的免疫细胞诸如t细胞可在代谢方面加以重新编程以使抗肿瘤t细胞应答增强。在通过t细胞受体或car和共刺激性信号来活化后,代谢活性为支持免疫细胞(具体来说t细胞)生长、扩增、分化和效应物功能所必需。癌细胞与浸润性免疫效应细胞之间的代谢竞争导致t细胞无反应性和功能异常。在一些实施方案中,本发明的有效载荷可为糖酵解的调节剂。癌细胞中的瓦伯格效应(warburgeffect)导致大量产生可抑制t细胞细胞毒性和效应物功能的乳酸。作为一非限制性实例,用于过继性转移的免疫细胞可被修饰来过度表达使t细胞中的pep产生增加的磷酸烯醇丙酮酸羧激酶1(pck1)。糖酵解代谢物磷酸烯醇丙酮酸(pep)的产生增加可阻遏sarco/erca(2+)-atp酶(serca)活性,因此维持t细胞受体介导的ca(2+)-nfat信号传导和效应物功能(ho等,cell,2015,162(6):1217-1228)。在一些实施方案中,本发明的有效载荷可包括oxphos路径中涉及的蛋白质。举例来说,lem(淋巴细胞扩增分子)是一种可应答于淋巴细胞脉络丛脑膜炎(cmv)感染来促进细胞毒性cd8+t细胞增殖和效应物功能以及记忆t细胞产生的蛋白质。lem是介导oxphos(氧化磷酸化)蛋白的翻译以及向线粒体内膜中的插入,由此调控oxphos活性的crif1(cr6相互作用因子1)的复合物的一部分。因此,lem是t细胞代谢(线粒体呼吸水平)和扩增的正性调节剂(okoye等,science,2015,348(6238):995-1001)。在一些实施方案中,本发明的有效载荷可为氨基酸调控中涉及的代谢酶的抑制剂。免疫细胞与肿瘤细胞之间的代谢竞争可导致建立和维持归因于t细胞无反应性的免疫抑制性肿瘤微环境。非限制性实例包括一氧化氮合成酶和可使细胞外精氨酸降解的精氨酸酶i或使色氨酸降解的吲哚胺2,3-双加氧酶(ido)的抑制剂。消除由肿瘤细胞和免疫抑制性细胞分泌的这些酶可促进抗肿瘤免疫性。在其他实施方案中,本发明的有效载荷可包括对重新脂肪酸和胆固醇生物合成至关重要的蛋白质。这可包括蛋白质诸如srebp1(也称为srebf1)、srebp2(srebf2)、hmgcr、hmgcs、fasn、acaca和sqle,以及运输路径诸如ldlr。调节细胞毒性cd8+t细胞的胆固醇代谢可增强它们的抗肿瘤效应物功能和增殖。胆固醇是膜脂质的关键组分,并且已显示cd8+t细胞的质膜胆固醇水平的增加会增强t细胞受体簇集和信号传导以及免疫突触的更高效形成(molnár等,jbiolchem.2012,287:42664–42674)。用于过继性转移的t细胞(例如抗肿瘤cart细胞)可被进一步工程化来表达使胆固醇生物合成和/或运输增强的蛋白质。9.安全性开关在一些实施方案中,本发明的有效载荷可包括sre调控的安全性开关,其可在重度毒性的情况下消除过继性转移的细胞,由此缓和t细胞疗法的不利作用。免疫疗法中的过继性转移的t细胞可应答于taa的正常组织表达来攻击正常细胞。即使过继性转移的t细胞的中肿瘤靶标活性也可导致毒性,诸如肿瘤溶解综合征、细胞因子释放综合征和相关巨噬细胞活化综合征。在一个实施方案中,本发明的有效载荷可通过诱导凋亡或通过已在本领域中开发的免疫监视来消除不适当活化的细胞。在一些实施方案中,本发明的有效载荷可包括充当安全性开关的诱导型杀伤/自杀基因。杀伤/自杀基因在引入过继性转移的免疫细胞中时可控制它们的同种异体反应性。杀伤/自杀基因可为允许通过施用sre(例如dd)的非治疗性配体来达成经转导细胞的条件性凋亡的凋亡基因(例如胱天蛋白酶)。在一些实施方案中,本发明的有效载荷可包括胱天蛋白酶9。在一些情况下,胱天蛋白酶9可被修饰来具有低基础表达,并且缺乏胱天蛋白酶募集结构域(card)(美国专利号us9434935b2的seqidno.:26和seqidno.:28;所述专利的内容以引用的方式整体并入本文)。在一个实施方案中,本发明的有效载荷是一种自杀基因系统,即icasp9/化学诱导的二聚化(cid)系统,其由源于胱天蛋白酶9基因的多肽融合于源于人fk506蛋白的药物结合结构域组成。施用生物惰性小分子ap1903(利米度得(rimiducid))会诱导药物结合结构域的交联以及融合蛋白的二聚化,并且转而诱导胱天蛋白酶9的二聚化。这导致下游效应物胱天蛋白酶3的活化以及后续对细胞凋亡的诱导(straathof等,blood,2005,105:4247–4254;以引用的方式整体并入本文)。使用包括icasp9基因的cart进行的临床前试验已显示在小鼠模型中在体内有效消除cart细胞,并且证明这个方法的潜在功效。(budde等,plosone,2013,8:e82742.10.1371;hoyos等,leukemia,2010;24(6):1160-1170)。在一个实施方案中,本发明的有效载荷可包括胱天蛋白酶9。在一个方面,本发明的效应物模块可为dd-胱天蛋白酶9融合多肽。在一些实施方案中,本发明的有效载荷可为全长胱天蛋白酶9(seqidno.8364,由seqidno.8365、8366编码)或胱天蛋白酶9δcd(seqidno.8367,由seqidno.8368编码)。本文所述的胱天蛋白酶9序列可任选包括在序列的c末端的终止密码子。在一些情况下,已显示icasp9/cid系统即使在不存在利米度得下也具有基础二聚化率,从而导致非意图的细胞死亡。调控icasp9/cid的表达水平对使icasp9/cid系统的功效最大化至关重要。本发明的生物回路和/或它们的任何组分可用于调控或调谐icasp9/cid系统以使它的效用最优化。用于二聚化诱导的凋亡范式中的蛋白质的其他实例可包括但不限于fas受体、fas相关蛋白的死亡效应结构域、fadd、胱天蛋白酶1、胱天蛋白酶3、胱天蛋白酶7和胱天蛋白酶8。(belshawp.j.等,chembiol.,996,3:731-738;maccorkler.a.等,procnatlacadsci,1998,95:3655-3660;spencer,d.m.等,currbiol.1996;6:839-847;其各自的内容以引用的方式整体并入本文)。在一些实施方案中,本发明的安全性开关可包括代谢酶,诸如单纯疱疹病毒胸苷激酶(hsv-tk)和胞嘧啶脱氨酶(cd)。hsv-tk使包括阿昔洛韦(acyclovir)和更昔洛韦(ganciclovir,gcv)的核苷类似物磷酸化以产生核苷的三磷酸形式。当并入dna中时,它导致链终止和细胞死亡。不同于哺乳动物胸苷激酶,hsv-tk的特征在于对核苷类似物诸如gcv的亲和力是1000倍高,从而使得它适用作哺乳动物细胞中的自杀基因。胞嘧啶脱氨酶(cd)可使5-氟胞嘧啶(5-fc)转化成细胞毒性5-氟尿嘧啶(5-fu)(tiraby等,femslett.,1998,167:41–49)。在一些实施方案中,本发明的安全性开关可包括cyp4b1突变体(作为自杀基因),其可在经car工程化t细胞中共表达(roellecker等,genther.,2016年5月19日,doi:10.1038/gt.2016.38.)。在一些实施方案中,本发明的有效载荷可包括可诱导细胞死亡的融合构建体,例如具有式st-r1-s1-q-s2-r2的多肽,其中st是茎序列,r1/2和q是不同表位;并且s1/2是任选间隔体序列(参见国际专利公布号:wo2013/153391;其内容以引用的方式整体并入本文)。在一些实施方案中,安全性开关可由特异性结合在过继性转移的细胞的质膜中表达的抗原的治疗性抗体介导。在施用针对抗原的特异性单克隆抗体之后,抗原-抗体相互作用允许达成细胞移除。作为非限制性实例,本发明的有效载荷可包括用于介导安全性开关的抗原和抗体对诸如cd20和抗cd20抗体(griffioen等,haematologica,2009,94:1316–1320)、蛋白质标签和抗标签抗体(kieback等,natl.acad.sci.u.s.a.,2008,105:623–628)、将来自cd34的表位(作为标记部分)和来自cd20的表位(作为自杀部分)组合的紧凑自杀基因(rqr8),其使得能够达成cd34选择、细胞追踪以及在施用抗cd20单克隆抗体之后达成细胞删除(philip等,blood,2014,124:1277–1287);截短人egfr多肽和抗egfr单克隆抗体(wang等,blood,2011,118:1255–1263);以及具有如美国专利申请公布号:2015/0093401中讨论的结构式的紧凑多肽安全性开关;所述文献和专利各自的内容以引用的方式整体并入本文。10.调控性开关过继性细胞疗法(act)的效用已受限于高发生率的移植物抗宿主疾病(gvhd)。gvhd在过继性转移的t细胞引发免疫应答时发生,从而导致宿主组织损害。由移植物细胞对宿主抗原的识别会触发意味着急性gvhd的促炎性细胞因子风暴级联。gvhd被表征为免疫系统的效应分支与调控性分支之间的不平衡。在一些实施方案中,本发明的有效载荷可用作调控性开关。如本文所用,“调控性开关”是指当在靶标细胞中表达时通过使免疫系统的调控性分支增强来使对移植物的耐受性增加的蛋白质。在一个实施方案中,调控性开关可包括优先促进调控性t细胞(treg细胞)的扩增的有效载荷。treg是胸腺中关于高亲和力配体加以正性选择的独特细胞群体,并且在对自身抗原的耐受性方面起重要作用。此外,也已显示treg在对外来抗原的外周耐受性方面起作用。因为treg促进免疫耐受性,所以用本发明组合物使treg扩增可合乎限制gvhd的需要。在一些实施方案中,调控性开关可包括但不限于treg活化因子,诸如nfκb、foxo、核受体nr4a、视黄酸受体α、nfat、ap-1和smad。所述因子可导致t细胞中叉头框p3(foxp3)的表达,从而导致调控性t细胞程序的活化以及t细胞的扩增。在一个实施方案中,调控性开关可为t细胞中的转录调控子foxp3。foxp3的功能在于抑制nfat的功能,此导致对包括il2和效应t细胞细胞因子的许多基因的表达的抑制。foxp3也充当诸如cd2s、细胞毒性t淋巴细胞抗原细胞毒性t淋巴细胞抗原4(ctla4)、糖皮质素诱导的tnf受体家族基因(gitr)和叶酸受体4的基因的转录活化子。foxp3也通过拮抗rorc(rar相关孤儿受体c)来抑制il17产生性辅助t细胞(th17)的分化。foxp3的缺乏外显子2的亚型(foxp3δ2)或缺乏外显子7的亚型(foxp3δ7)也可用作调控性开关。在一个方面,本发明的效应物模块可为dd-foxp3融合多肽。foxp3可为全长foxp3(seqidno.8369,由seqidno.8370编码);或foxp3(wt的氨基酸2-431)(seqidno.8371,由seqidno.8372编码)、δ2foxp3(seqidno.8373,由seqidno.8374编码);或foxp3δ(wt的氨基酸2-396)(seqidno.8375,由seqidno.8376编码)。11.归巢受体在一些实施方案中,本发明的有效载荷可包括将免疫治疗细胞引导至不同解剖区室诸如指定肿瘤部位的归巢受体。举例来说,表达嵌合抗原受体的t细胞可被进一步修饰来表达通常不由t细胞表达的归巢受体。如本文所用,术语“归巢受体”是将表达受体的细胞引导至指定器官、特定组织或特定类型的细胞的受体。所述迁移受体有利于t细胞在某些靶标器官中的积累。在一些实施方案中,本发明的归巢受体可为粘附分子。在其他实施方案中,本发明的归巢受体可为介导对趋化因子的趋化性的趋化因子受体。作为非限制性实例,归巢受体可为b细胞区归巢受体诸如cxcr5;t细胞区归巢受体诸如cxcr7;胃肠归巢受体诸如ccr9和整合素α4β7(也称为淋巴细胞派伊尔斑(peyerpatch)粘附分子);皮肤归巢受体诸如cla(皮肤淋巴细胞相关抗原受体)、ccr4、ccr8和ccr10(参见例如国际专利公布号:wo2016025454;其内容以引用的方式整体并入本文)。其他归巢受体包括不限于使经趋化因子受体修饰的肿瘤浸润性淋巴细胞重定向至黑素瘤肿瘤的cxcr2和cxcr1(idorn等,methodsmol.biol.,2016,1428:261-276;以及sapoznik等,cancerimmunolimmunother.,2012,61(10):1833-1847);当由cd8+t细胞表达时可使经修饰cd8+t细胞归巢至ccl2(一种ccr2配体)表达得以增加所处的前列腺癌部位的ccr2(garetto等,oncotarget,2016年5月10日.doi:10.18632/oncotarget.9280);以及作为肠归巢受体的cd103。12.免疫信号传导用免疫治疗剂进行的治疗可诱导免疫细胞信号传导,从而导致细胞类型特异性免疫活性的活化,最终导致免疫应答。在一些实施方案中,本发明的有效载荷可为用于实现对信号传导路径的外源性控制的免疫信号传导生物分子。示例性免疫信号传导生物分子包括转录因子诸如活化的t细胞的核因子(nfat)(例如nfat、nfat2、nfat3和nfat4)、核因子kb(nfκb)、信号转导子和转录活化子(stat)、活化蛋白-1(ap-1)、rel、fos和jun;激酶诸如janus激酶(jak)、细胞外信号调控的激酶(erk)、有丝分裂原活化的蛋白质激酶(mapk)、哺乳动物雷帕霉素靶标(mtor)、磷酸肌醇依赖性激酶(pdk)、蛋白质激酶b(pkb)、ikb激酶(ikk)、钙/钙调蛋白依赖性激酶(camk);以及其他信号传导分子诸如ras、cbl、钙调蛋白(cam)、钙蛋白酶(calpain)和ikkb激酶。在一个实施方案中,本发明的有效载荷可与shp-1和/或shp-2的抑制剂联合施用。酪氨酸蛋白质磷酸酶shp1(也称为ptpn6)和shp2(也称为ptpn11)涉及于程序化细胞死亡(pd1)抑制性信号传导路径中。pd1的细胞内结构域含有免疫受体酪氨酸基抑制性基序(itim)和免疫受体酪氨酸基转换基序(itsm)。已显示itsm会募集shp-1和shp-2。这产生负性共刺激性微簇,所述微簇会诱导近端tcr信号传导分子的脱磷酸化,由此导致对t细胞活化的抑制,此可导致t细胞耗竭。在一个实施方案中,shp-1和shp-2的抑制剂可包括在t细胞、til或其他细胞类型中表达蛋白质的显性负性形式以减轻耗竭。所述突变体可结合内源性催化活性蛋白质,并且抑制它们的功能。在一个实施方案中,shp-1和/或shp-2的显性负性突变体缺乏为催化活性所需的磷酸酶结构域。在一些实施方案中,bergerons等(2011).endocrinology.2011年12月;152(12):4581-8.;dustinjb等(1999)jimmunol.3月1日;162(5):2717-24.;berchtolds(1998)molendocrinol.4月;12(4):556-67以及schram等(2012)amjphysiolheartcircphysiol.1;302(1):h231-43.教导的任何显性负性shp-1突变体都可适用于本发明中(所述文献各自的内容以引用的方式整体并入本文)。13.溶瘤性病毒在一些实施方案中,本发明的有效载荷可包括溶瘤性病毒或溶瘤性病毒的任何组分。在一些实施方案中,有效载荷可为已被遗传修饰来用于溶瘤性病毒疗法中的溶瘤性病毒或溶瘤性病毒的组分。如本文所用,术语“病毒疗法”是指治疗性使用溶瘤性病毒(有复制能力的病毒)来攻击和破坏癌细胞。溶瘤性病毒是指能够通过直接靶向和杀灭肿瘤内的癌细胞而不对正常组织造成伤害来消除恶性肿瘤的那些病毒。具有癌症特异性趋性的示例性溶瘤性病毒和经遗传工程化溶瘤性病毒可包括细小病毒、腺病毒、柯萨奇病毒(coxsackievirus)、单纯疱疹病毒(hsv)、麻疹病毒、腮腺炎病毒、莫洛尼白血病病毒(moloneyleukemiavirus)、粘病毒、新城病病毒(newcastlediseasevirus)、呼肠孤病毒、弹状病毒、水泡性口炎病毒和痘苗病毒(vv)。它也可为具有增加的溶瘤潜力的嵌合病毒,诸如美国专利号:9,441,246中的腺病毒-细小病毒嵌合体。溶瘤性病毒可被修饰来较不易经受免疫抑制,同时更具特异性地靶向特定类别的癌细胞,或被修饰来插入和表达癌症抑制性转基因。也可对溶瘤性病毒进行修饰以使病毒的复制潜力改进,使病毒效价增加,和/或使可由病毒感染的癌细胞范围增大。可用作有效载荷的经修饰溶瘤性病毒的实例包括美国专利号:us8282917b2、国际专利公布号:wo2011070440、wo2004078206a1、wo2016144564、wo2016119052、wo2009111892中的那些;所述专利各自的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可为一种或多种病毒外壳蛋白、插入转基因、可使肿瘤内病毒复制增加的其他因子以及组合。在某一情况下,两种或更多种溶瘤性病毒也可用作同一sre内或两个或更多个sre中的有效载荷以实现对靶标癌细胞的协同杀灭,如国际专利公布号:wo2010020056中所述(所述专利的内容以引用的方式整体并入本文)。14.基因组编辑系统在一些实施方案中,本发明的有效载荷可为基因编辑系统的组分,包括crispr(成簇规律间隔短回文重复序列)、crispr酶(cas9)、crispr-cas9或crispr系统和crispr-cas9复合物。它也可为其他基因组编辑系统,诸如锌指核酸酶、talen(转录活化子样效应物基核酸酶)和兆碱基大范围核酸酶。额外特征本发明的效应物模块可进一步包含调控有效载荷的分布的信号序列、有助于从效应物模块构建体裂解有效载荷的裂解和/或加工特征、可调控效应物模块的细胞定位的靶向和/或穿透信号、和/或一个或多个连接效应物模块的不同组分(例如dd和有效载荷)的接头序列。在一些实施方案中,效应物模块可进一步包含一个或多个额外特征,诸如接头序列(具有特定序列和长度)、裂解位点、调控元件(调控目标蛋白质的表达,诸如微小rna靶向位点)、将效应物模块导向特定细胞或亚细胞位置的信号序列、穿透序列、或用于追踪效应物模块的标签和生物标记。1.信号序列除sre(例如dd)和有效载荷区域之外,本发明的效应物模块也可进一步包含一个或多个信号序列。信号序列(有时被称为信号肽、靶向信号、靶标肽、定位序列、转运肽、前导序列或前导肽)将蛋白质(例如本发明的效应物模块)导向它们的指定细胞和/或细胞外位置。蛋白质信号序列在几乎所有分泌型蛋白质以及许多整合膜蛋白的靶向和易位方面起主要作用。信号序列是存在于被指定朝向特定位置的大多数新合成蛋白质的n末端的短(长度是5-30个氨基酸)肽。信号序列可由信号识别粒子(srp)识别,并且使用i型和ii型信号肽肽酶来裂解。源于人蛋白质的信号序列可作为效应物模块的调控性模块加以并入以将效应物模块导向特定细胞和/或细胞外位置。这些信号序列以实验方式加以验证,并且可被裂解(zhang等,proteinsci.2004,13:2819-2824)。在一些实施方案中,尽管未必,但信号序列可位于效应物模块的n末端或c末端,并且尽管未必,但可从所需效应物模块裂解去除以产生“成熟”有效载荷,即如本文讨论的免疫治疗剂。在一些实例中,信号序列可为源于天然分泌型蛋白质的分泌型信号序列以及它的变体。在一些情况下,分泌型信号序列可为细胞因子信号序列,诸如但不限于包含氨基酸seqidno.261(由核苷酸序列seqidno.262-265编码)的il2信号序列,和/或包含氨基酸序列seqidno.266(由核苷酸序列seqidno.267-275编码)的p40信号序列。在一些情况下,可使用将有效载荷导向靶标细胞的表面膜的信号序列。在靶标细胞的表面上表达有效载荷可适用于限制有效载荷扩散至非靶标体内环境中,由此潜在改进有效载荷的安全性概况。另外,有效载荷的膜呈现可允许达成生理和定性信号传导以及有效载荷的稳定化和再循环以获得较长半衰期。膜序列可为有效载荷的n末端组分的内源性信号序列。任选地,可合乎需要的是将这个序列交换成不同信号序列。信号序列可基于它们与目标细胞类型的分泌路径的相容性来选择,以使有效载荷存在于t细胞的表面上。在一些实施方案中,信号序列可为包含氨基酸seqidno.276(由核苷酸序列seqidno.277编码)的ige信号序列或包含氨基酸seqidno.278(由核苷酸序列seqidno.279-283编码)的cd8a信号序列。信号序列的其他实例包括可为美国专利号8,148,494、8,258,102、9,133,265、9,279,007和美国专利申请公布号2007/0141666;以及国际专利申请公布号wo1993/018181中讨论的经修饰信号序列的变体;所述专利各自的内容以引用的方式整体并入本文。在其他实例中,信号序列可为来自其他生物体诸如病毒、酵母和细菌的可将效应物模块导向特定细胞位置诸如核的异源性信号序列(例如ep1209450)。其他实例可包括来自木霉(trichoderma)的可使所融合蛋白质诸如酶的分泌增加的天冬氨酸蛋白酶(nsp24)信号序列(例如属于cervin和kim的美国专利号8,093,016)、细菌脂蛋白信号序列(例如属于lau和rioux的pct申请公布号1991/09952)、大肠杆菌(e.coli)肠毒素ii信号肽(例如属于kwon等人的美国专利号6,605,697)、大肠杆菌分泌信号序列(例如属于malley等人的美国专利公布号2016/090404)、来自甲基营养型酵母的脂酶信号序列(例如美国专利号8,975,041)以及源于棒状杆菌(coryneformbacteria)的dna酶的信号肽(例如美国专利号4,965,197);所述专利各自的内容以引用的方式整体并入本文。信号序列也可包括核定位信号(nls)、核输出信号(nes)、极化细胞微管泡结构定位信号(参见例如美国专利号:8,993,742;cour等,nucleicacidsres.2003,31(1):393-396;其各自的内容以引用的方式整体并入本文)、细胞外定位信号、用以实现到达亚细胞位置(例如溶酶体、内质网、高尔基体、线粒体、质膜和过氧化物酶体等)的信号(参见例如美国专利号7,396,811;以及negi等,database,2015,1-7;其各自的内容以引用的方式整体并入本文)。2.裂解位点在一些实施方案中,效应物模块包含裂解和/或加工特征。本发明的效应物模块可包括至少一个蛋白质裂解信号/位点。蛋白质裂解信号/位点可位于n末端、c末端、n末端与c末端之间的任何间隙,诸如但不限于n末端与c末端之间的半途,n末端与半途点之间,半途点与c末端之间,及其组合。效应物模块可包括任何蛋白酶的一个或多个裂解信号/位点。蛋白酶可为丝氨酸蛋白酶、半胱氨酸蛋白酶、内肽酶、二肽酶、金属蛋白酶、谷氨酸蛋白酶、苏氨酸蛋白酶和天冬氨酸蛋白酶。在一些方面,裂解位点可为以下各物的信号序列:弗林蛋白酶、奇异果蛋白酶(actinidain)、钙蛋白酶-1、羧基肽酶a、羧基肽酶p、羧基肽酶y、胱天蛋白酶-1、胱天蛋白酶-2、胱天蛋白酶-3、胱天蛋白酶-4、胱天蛋白酶-5、胱天蛋白酶-6、胱天蛋白酶-7、胱天蛋白酶-8、胱天蛋白酶-9、胱天蛋白酶-10、组织蛋白酶b、组织蛋白酶c、组织蛋白酶g、组织蛋白酶h、组织蛋白酶k、组织蛋白酶l、组织蛋白酶s、组织蛋白酶v、梭菌蛋白酶(clostripain)、胃促胰酶、胰凝乳蛋白酶、弹性蛋白酶、胞内蛋白酶、肠激酶、因子xa、甲酸、粒酶b、基质金属肽酶-2、基质金属肽酶-3、胃蛋白酶、蛋白酶k、sumo蛋白酶、枯草杆菌蛋白酶、tev蛋白酶、嗜热菌蛋白酶、凝血酶、胰蛋白酶和标签酶(tagzyme)。在一个实施方案中,裂解位点是包含氨基酸序列sarnrqkrs(seqidno.284,由核苷酸序列seqidno.285编码)的弗林蛋白酶裂解位点,或包含氨基酸序列arnrqkrs(seqidno.286,由核苷酸序列seqidno.287编码)的经修改弗林蛋白酶裂解位点,或包含氨基酸序列esrrvrrnkrsk(seqidno.288,由核苷酸序列seqidno.289-291编码)的经修饰弗林蛋白酶位点。3.蛋白质标签在一些实施方案中,本发明的效应物模块可包含蛋白质标签。蛋白质标签可用于检测和监测效应物模块的过程。效应物模块可包括一个或多个标签诸如表位标签(例如flag或血凝素(ha)标签)。许多蛋白质标签可用于本发明效应物模块。它们包括但不限于自标记多肽标签(例如卤代烷脱卤素酶(halotag2或halotag7)、acp标签、clip标签、mcp标签、snap标签)、表位标签(例如flag、ha、his和myc)、荧光标签(例如绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)、黄色荧光蛋白(yfp)和它的变体)、生物发光标签(例如荧光素酶和它的变体)、亲和标签(例如麦芽糖结合蛋白(mbp)标签、谷胱甘肽-s-转移酶(gst)标签)、免疫原性亲和标签(例如蛋白a/g、irs、au1、au5、glu-glu、kt3、s-tag、hsv、vsv-g、xpress和v5)、以及其他标签(例如生物素(小分子)、streptag(strepii)、sbp、生物素羧基载体蛋白(bccp)、exact、cbp、cyd、hpc、cbd内含肽-几丁质结合结构域、trx、norpa和nusa)。在其他实施方案中,标签也可选自美国专利号:8,999,897;8,357,511;7,094,568;5,011,912;4,851,341;和4,703,004;美国专利申请公布号:2013/115635和2013/012687;以及国际申请公布号:wo2013/091661中公开的那些;所述专利各自的内容以引用的方式整体并入本文。在一些方面,可使用多个作为相同标签或不同标签的蛋白质标签;各标签可位于相同n末端或c末端,而在其他情况下,这些标签可位于各个末端。4.靶向肽在一些实施方案中,本发明的效应物模块可进一步包含靶向肽和/或穿透肽。选择性识别细胞表面标志物(例如受体、跨膜蛋白质和细胞外基质分子)的小型靶向肽和/或穿透肽可用于使效应物模块靶向所需器官、组织或细胞。在体外合成的短肽(5-50个氨基酸残基)和天然存在的肽或其类似物、变体、衍生物可并入效应物模块中以使效应物模块归巢至所需器官、组织和细胞、和/或细胞内部的亚细胞位置。在一些实施方案中,靶向序列和/或穿透肽可被包括在效应物模块中以将效应物模块驱动至靶标器官或组织或细胞(例如癌细胞)。在其他实施方案中,靶向肽和/或穿透肽可将效应物模块导向细胞内部的特定亚细胞位置。靶向肽具有从约6至约30(包括端值)的任何数目的氨基酸。肽可具有6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸。通常,靶向肽可具有25个或更少氨基酸,例如20个或更少,例如15个或更少。示例性靶向肽可包括但不限于本领域中公开的那些,例如美国专利号9,206,231、9,110,059、8,706,219;和8,772,449以及美国申请公布号2016/089447.2016/060296.2016/060314.2016/060312.2016/060311.2016/009772.2016/002613.2015/314011和2015/166621.以及国际申请公布号wo2015/179691和wo2015/183044中公开的那些;所述专利各自的内容以引用的方式整体并入本文。5.接头在一些实施方案中,本发明的效应物模块可进一步包含接头序列。接头区主要充当效应物模块内两个或更多个多肽之间的间隔体。如本文所用的“接头”或“间隔体”是指连接两个分子或一个分子的两个部分诸如重组蛋白的两个结构域的一个分子或一组分子。在一些实施方案中,如本文所用的“接头”(l)或“接头结构域”或“接头区”或“接头模块”或“肽接头”是指长度是约1至100个氨基酸的寡肽或多肽区域,其将效应物模块的任何结构域/区域连接在一起(也称为肽接头)。肽接头的长度可为1-40个氨基酸、或2-30个氨基酸、或20-80个氨基酸、或50-100个氨基酸。接头长度也可视所用有效载荷的类型而定以及基于有效载荷的晶体结构加以最优化。在一些情况下,可优选选择较短接头长度。在一些方面,肽接头由通过肽键来连接在一起的氨基酸,优选是由肽键连接的1至20个氨基酸组成,其中氨基酸选自20种天然存在的氨基酸:甘氨酸(g)、丙氨酸(a)、缬氨酸(v)、亮氨酸(l)、异亮氨酸(i)、丝氨酸(s)、半胱氨酸(c)、苏氨酸(t)、甲硫氨酸(m)、脯氨酸(p)、苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)、组氨酸(h)、赖氨酸(k)、精氨酸(r)、天冬氨酸(d)、谷氨酸(e)、天冬酰胺(n)和谷氨酰胺(q)。这些氨基酸中的一者或多者可为糖基化的,如由本领域中的人士所了解。在一些方面,肽接头的氨基酸可选自丙氨酸(a)、甘氨酸(g)、脯氨酸(p)、天冬酰胺(r)、丝氨酸(s)、谷氨酰胺(q)和赖氨酸(k)。在一个实例中,人工设计的肽接头可优选由柔性残基如甘氨酸(g)和丝氨酸(s)的聚合物组成以使邻近蛋白质结构域相对于彼此自由移动。当可合乎需要的是确保两个邻近结构域不彼此干扰时,可使用较长接头。对特定接头序列的选择可涉及它是否影响融合构建体的生物活性、稳定性、折叠、靶向和/或药物动力学特征。肽接头的实例包括但不限于:sg、mh、ggsg(seqidno.292),由核苷酸序列seqidno.293编码;ggsgg(seqidno.294),由核苷酸序列seqidno.295-299编码;ggsggg(seqidno.78),由核苷酸序列seqidno.93和300编码;sgggs(seqidno.301),由核苷酸序列seqidno.302-303编码;ggsgggsgg(seqidno.77),由核苷酸序列seqidno.92编码;ggggg(seqidno.304)、ggggs(seqidno.305)或(ggggs)n(n=2(seqidno.306)、3(seqidno.307;由seqidno.308-313编码)、4(seqidno.314)、5(seqidno.315)或6(seqidno.316))、ssssg(seqidno.317)或(ssssg)n(n=2(seqidno.318)、3(seqidno.319)、4(seqidno.320)、5(seqidno.321)或6(seqidno.322))、sgggsggggsggggsggggsgggslq(seqidno.323),由核苷酸序列seqidno.324编码;efstef(seqidno.325),由核苷酸序列seqidno.326-327编码;gkssgsgsesks(seqidno.328)、ggstsgsgkssegkg(seqidno.329)、gstsgsgksssegsgstkg(seqidno.330)、gstsgsgkpgsgegstkg(seqidno.331)、vdypydvpdyald(seqidno.332),由核苷酸序列seqidno.333编码;或egkssgsgseskef(seqidno.334);或gsgsgs(seqidno.8330),由核苷酸序列seqidno.8347编码;或gsgsgsgs(seqidno.8331),由核苷酸序列seqidno.8348编码;或gsgsgggsgs(seqidno.8332),由核苷酸序列seqidno.8349编码;sgsgsgs接头(seqidno:8382)、或sg接头,由agtggt编码;或包含赖氨酸天冬氨酸的ld接头,由ctagat编码。接头也可为dna限制酶识别位点或其修饰形式,诸如富含gs或g/s的柔性接头;由ggatcc编码的bamh1位点;富含g/s的柔性接头或bamh1位点;由tctaga编码的sr/xbai位点;或由ggatccgga编码的gsg接头(bamh1-gly)接头。在其他实例中,肽接头可由大多数的在空间上不受阻碍的氨基酸诸如甘氨酸(g)并丙氨酸(a)组成。示例性接头是多甘氨酸(诸如(g)4(seqidno:8378)、(g)5(seqidno:8379)、(g)8(seqidno:8380))、多(ga)和多丙氨酸。本文所述的接头是示例性的,并且本发明涵盖长得多以及包括其他残基的接头。接头序列可为源于多结构域蛋白质的天然接头。天然接头是分隔蛋白质内的两个不同结构域或基序的短肽序列。在一些方面,接头可为柔性的或刚性的。在其他方面,接头可为可裂解的或非可裂解的。如本文所用,术语“可裂解接头结构域或区域”或“可裂解肽接头”可互换使用。在一些实施方案中,接头序列可以酶促方式和/或以化学方式裂解。适用于裂解肽接头的酶(例如蛋白酶/肽酶)的实例包括但不限于arg-c蛋白酶、asp-n内肽酶、胰凝乳蛋白酶、梭菌蛋白酶、肠激酶、因子xa、谷氨酰基内肽酶、粒酶b、无色菌蛋白酶i、胃蛋白酶、脯氨酸内肽酶、蛋白酶k、葡萄球菌肽酶i、嗜热菌蛋白酶、凝血酶、胰蛋白酶以及蛋白水解酶的胱天蛋白酶家族的成员(例如胱天蛋白酶1-10)。化学敏感性裂解位点也可包括在接头序列中。化学裂解试剂的实例包括但不限于溴化氰,其裂解甲硫氨酸残基;n-氯丁二酰亚胺、碘苯甲酸或bnps-粪臭素(bnps-skatole)[2-(2-硝基苯基亚磺酰基)-3-甲基吲哚],其裂解色氨酸残基;稀酸,其在天冬氨酰基-脯氨酰基键处进行裂解;以及天冬氨酸-脯氨酸酸可裂解识别位点(即包含一个或多个d-p二肽部分的可裂解肽接头)。融合模块可包括由一个或多个可裂解肽接头分隔的编码目标肽的多个区域。在其他实施方案中,可裂解接头可为“自裂解”接头肽,诸如2a接头(例如t2a)、2a样接头或其功能性等效物及其组合。在一些实施方案中,接头包括微小核糖核酸病毒2a样接头、猪捷申病毒(teschovirus)的chysel序列(p2a)、明脉扁刺蛾病毒(thoseaasignavirus)的chysel序列(t2a)、或其组合、变体和功能性等效物。在一些实施方案中,本发明的生物回路可包括2a肽。2a肽是来自病毒的具有约20个氨基酸残基的序列,其由细胞内源性蛋白酶(2a肽酶)识别。2a肽在微小核糖核酸病毒之中得以鉴定,所述微小核糖核酸病毒的一典型实例是足口病病毒(robertsonbh等,jvirol1985,54:651-660)。2a样序列也已见于如马鼻炎a病毒的微小核糖核酸病毒以及无关病毒诸如猪捷申病毒-1和昆虫明脉扁刺蛾病毒(tav)中。在所述病毒中,多个蛋白质源于由一个开放阅读框编码的大型多聚蛋白。2a肽介导这个多聚蛋白在形成病毒衣壳与复制多聚蛋白结构域之间的接合部的单一位点处的共翻译裂解。2a序列含有共有基序d-v/i-e-x-n-p-g-p(seqidno:8381)。这些序列被认为以共翻译方式起作用,从而防止在甘氨酸和末个脯氨酸之间形成正常肽键,从而导致核糖体跳跃至下一密码子(donnellyml等(2001).jgenvirol,82:1013-1025)。在裂解之后,短肽仍然融合于在裂解位点上游的蛋白质的的c末端,而脯氨酸被添加至在裂解位点下游的蛋白质的n末端中。在鉴定的2a肽之中,四种2a肽已被广泛使用,即fmdv2a(在本文中缩写为f2a);马鼻炎a病毒(erav)2a(e2a);猪捷申病毒-12a(p2a)和明脉扁刺蛾病毒2a(t2a)。在一些实施方案中,适用于本发明中的2a肽序列选自国际专利公布wo2010042490的seqidno.8-11,所述专利的内容以引用的方式整体并入本文。在一些实施方案中,裂解位点可为p2a可裂解肽(seqidno.8239),由核苷酸序列seqidno.8269编码。其他接头将为本领域技术人员显而易知,并且可与本发明的替代性实施方案关联使用。本发明的接头也可为非肽接头。举例来说,可使用烷基接头,诸如—nh—(ch2)a-c(o)—,其中a=2-20。这些烷基接头可进一步被任何非空间位阻性基团诸如低级烷基(例如c1-c6)低级酰基、卤素(例如cl、br)、cn、nh2、苯基等取代。在一些方面,接头可为来自美国专利号4,946,778、5,525,491、5,856,456以及国际专利公布号wo2012/083424的人工接头;所述专利各自的内容以引用的方式整体并入本文。6.经嵌入刺激物、信号和其他调控性特征微小rna(或mirna)是长度是19-25个核苷酸的非编码rna,其结合核酸分子的3′utr,并且通过使核酸分子稳定性降低或通过抑制翻译来下调基因表达。本发明的多核苷酸可包含一个或多个微小rna靶标序列、微小rna序列或微小rna种子。所述序列可对应于任何已知微小rna,诸如美国公布号us2005/0261218和美国公布号us2005/0059005中教导的那些,所述专利的内容以引用的方式整体并入本文。作为一非限制性实施方案,人基因组中的已知微小rna、它们的序列以及它们的结合位点序列列于共同拥有的美国临时专利申请号62/320,864(2016年4月11日提交)、62/466,596(2017年3月3日提交)和国际公布wo2017/180587的表14中(所述专利各自的内容以引用的方式整体并入本文)。微小rna序列包含“种子”区域,即在成熟微小rna的位置2-8的区域中的序列,所述序列与mirna靶标序列具有完全watson-crick互补性。微小rna种子可包含成熟微小rna的位置2-8或2-7。在一些实施方案中,微小rna种子可包含7个核苷酸(例如成熟微小rna的核苷酸2-8),其中相应mirna靶标中的种子互补性位点由与微小rna位置1相对的腺嘌呤(a)侧接。在一些实施方案中,微小rna种子可包含6个核苷酸(例如成熟微小rna的核苷酸2-7),其中相应mirna靶标中的种子互补性位点由与微小rna位置1相对的腺嘌呤(a)侧接。参见例如grimsona,farhkk,johnstonwk,garrett-engelep,limlp,barteldp;molcell.2007年7月6日;27(1):91-105。微小rna种子的碱基与靶标序列具有完全互补性。通过将微小rna靶标序列工程化至编码本发明的生物回路组分、效应物模块、sre或有效载荷的多核苷酸中,可对分子进行靶向以达成降解或翻译降低,前提是所论述的微小rna是可用的。这个过程将使在核酸分子递送后的脱靶效应的危害降低。已报道对微小rna、微小rna靶标区域以及它们的表达样式和在生物学中的作用的鉴定(bonauer等,currdrugtargets201011:943-949;anand和chereshcurropinhematol201118:171-176;contreras和raoleukemia201226:404-413(2011年12月20日.doi:10.1038/leu.2011.356);bartelcell2009136:215-233;landgraf等,cell,2007129:1401-1414;gentner和naldini,tissueantigens.201280:393-403以及其中所有参考文献;所述文献各自以引用的方式整体并入本文)。举例来说,如果多核苷酸不意图递送至肝中而是在那里结束,那么在肝中丰富的微小rnamir-122可抑制多核苷酸的表达,条件是mir-122的一个或多个靶标位点被工程化至多核苷酸中。可对用不同微小rna的一个或多个结合位点进行的引入进行工程化以进一步降低多核苷酸的长久性、稳定性和蛋白质翻译,因此提供在刺激物选择、sre设计和有效载荷变化之外的一层额外合理性。如本文所用,术语“微小rna位点”是指微小rna靶标位点或微小rna识别位点或微小rna与其结合或缔合的任何核苷酸序列。应了解“结合”可遵循传统watson-crick杂交规则,或可反映微小rna与靶标序列在或邻近于微小rna位点处的任何稳定缔合。相反,出于本发明的多核苷酸的目的,微小rna结合位点可被工程化出它们天然存在于其中的序列(即从所述序列移除),以使特定组织中的蛋白质表达增加。举例来说,可移除mir-122结合位点以使肝中的蛋白质表达改进。对多个组织中的表达的调控可通过引入或移除一个或若干个微rna结合位点来实现。具体来说,已知微小rna在免疫细胞(也称为造血细胞)中差异性表达,所述免疫细胞诸如抗原呈递细胞(apc)(例如树突细胞和巨噬细胞)、巨噬细胞、单核细胞、b淋巴细胞、t淋巴细胞、粒细胞、天然杀伤细胞等。免疫细胞特异性微小rna涉及于免疫原性、自体免疫性、对感染的免疫应答、炎症以及在基因疗法和组织/器官移植之后的非所要免疫应答中。免疫细胞特异性微小rna也调控造血细胞(免疫细胞)的发育、增殖、分化和凋亡的许多方面。举例来说,mir-142和mir-146仅仅在免疫细胞中表达,特别是在骨髓性树突细胞中是丰富的。将mir-142结合位点引入本发明的多肽的3’-utr中可通过mir-142介导的mrna降解来选择性抑制抗原呈递细胞中的基因表达,从而限制专职apc(例如树突细胞)中的抗原呈递,并且由此防止在基因递送之后由抗原介导的免疫应答(参见annonia等,blood,2009,114,5152-5161,其内容以引用的方式整体并入本文)。在一个实施方案中,已知在免疫细胞特别是抗原呈递细胞中表达的微小rna结合位点可被工程化至多核苷酸中以通过微小rna介导的rna降解来抑制多核苷酸在apc中的表达,从而压制抗原介导的免疫应答,同时维持多核苷酸在其中不表达免疫细胞特异性微小rna的非免疫细胞中的表达。已进行并且在本领域中描述许多微小rna表达研究,以剖析微小rna在各种癌细胞/组织和其他疾病中的差异性表达。一些微小rna在某些癌细胞中异常过度表达,而其他微小rna则表达不足。举例来说,微小rna在癌细胞(wo2008/154098、us2013/0059015、us2013/0042333、wo2011/157294);癌干细胞(us2012/0053224);胰腺癌和疾病(us2009/0131348、us2011/0171646、us2010/0286232、us8389210);哮喘和炎症(us8415096);前列腺癌(us2013/0053264);肝细胞癌(wo2012/151212、us2012/0329672、wo2008/054828、us8252538);肺癌细胞(wo2011/076143、wo2013/033640、wo2009/070653、us2010/0323357);皮肤t细胞淋巴瘤(wo2013/011378);结肠直肠癌细胞(wo2011/0281756、wo2011/076142);癌症阳性淋巴结(wo2009/100430、us2009/0263803);鼻咽癌(ep2112235);慢性阻塞性肺病(us2012/0264626、us2013/0053263);甲状腺癌(wo2013/066678);卵巢癌细胞(us2012/0309645、wo2011/095623);乳腺癌细胞(wo2008/154098、wo2007/081740、us2012/0214699)、白血病和淋巴瘤(wo2008/073915、us2009/0092974、us2012/0316081、us2012/0283310、wo2010/018563,所述专利各自的内容以引用的方式整体并入本文)中差异性表达。在一个实施方案中,微小rna可如本文所述加以使用以支持创建可调谐生物回路。在一些实施方案中,效应物模块可被设计来编码(以dna或rna或mrna形式)一个或多个有效载荷、sre和/或调控序列诸如微小rna或微小rna结合位点。在一些实施方案中,任何所编码有效载荷或sre都可通过突变来稳定或去稳定,接着与一个或多个调控序列组合以产生双重或多重调谐效应物模块或生物回路系统。各个方面或受调谐模态可为效应物模块或生物回路带来以差异性方式受调谐的特征。举例来说,sre可代表去稳定结构域,而蛋白质有效载荷中的突变可改变它的裂解位点或二聚化性质或半衰期,并且对一个或多个微小rna或微小rna结合位点的包括可赋予细胞去靶向或迁移特征。因此,本发明包括在它们的合理性方面是多因素性的生物回路。在一些实施方案中,本发明组合物可包括任选蛋白酶体衔接头。如本文所用,术语“蛋白酶体衔接头”是指对所附接有效载荷进行靶向以达成降解的任何核苷酸/氨基酸序列。在一些方面,衔接头直接对有效载荷进行靶向以达成降解,由此规避对泛素化反应的需要。蛋白酶体衔接头可与去稳定结构域联合用于使有效载荷的基础表达降低。示例性蛋白酶体衔接头包括rad23或hhr23b的ubl结构域;以高亲和力结合靶标蛋白rb与蛋白酶体的s4亚单位两者的hpve7,此允许达成直接蛋白酶体靶向,从而绕过泛素化机构;结合rb和蛋白酶体亚单位s6的蛋白质gankyrin。所述生物回路可被工程化来含有一个、两个、三个、四个或更多个受调谐特征。多核苷酸本发明提供编码本发明的新型hpde5dd、包含有效载荷和相关dd的效应物模块、包含dd和效应物模块的生物回路系统以及其他组分的多核苷酸。本发明提供经分离生物回路多肽、效应物模块、刺激物响应元件(sre)和有效载荷以及编码前述各物中的任一者的多核苷酸;包含本发明的多核苷酸的载体;以及表达本发明的多肽、多核苷酸和载体的细胞。多肽、多核苷酸、病毒载体和细胞适用于在受试者中诱导抗肿瘤免疫应答。术语“多核苷酸”或“核酸分子”在它的广义上包括包含核苷酸的聚合物例如连接的核苷的任何化合物和/或物质。这些聚合物经常被称为多核苷酸。本发明的示例性核酸或多核苷酸包括但不限于核糖核酸(rna)、脱氧核糖核酸(dna)、苏糖核酸(tna)、二醇核酸(gna)、肽核酸(pna)、锁定核酸(lna,包括具有β-d-核糖构型的lna、具有α-l-核糖构型的α-lna(lna的非对映异构体)、具有2′-氨基官能化的2′-氨基-lna以及具有2′-氨基官能化的2′-氨基-α-lna)或其杂合物。在一些实施方案中,本发明的多核苷酸可为信使rna(mrna)或任何核酸分子,并且可或可不加以化学修饰。在一个方面,核酸分子是mrna。如本文所用,术语“信使rna(mrna)”是指编码目标多肽,并且能够在体外、在体内、原位或离体被翻译以产生所编码目标多肽的任何多核苷酸。在传统上,mrna分子的基本组分包括至少编码区、5′utr、3′utr、5′帽和多a尾部。建立在这个野生型模块化结构上,本发明通过提供有效载荷构建体来扩展传统mrna分子的功能性范围,所述有效载荷构建体维持模块化组织,但包含一个或多个对多核苷酸赋予适用性质例如功能合理性的结构和/或化学修饰或改变。如本文所用,“结构”特征或修饰是其中在多核苷酸中进行两个或更多个连接的核苷的插入、缺失、重复、反转或随机化,而不对核苷自身进行重大化学修饰的特征或修饰。因为化学键将必定被破坏和重新形成以实现结构修饰,所以结构修饰具有化学性,因此是化学修饰。然而,结构修饰将产生不同核苷酸序列。举例来说,多核苷酸“atcg”可被化学修饰成“at-5mec-g”。上述多核苷酸可从“atcg”加以结构修饰以获得“atcccg”。在此处,二核苷酸“cc”已被插入,从而导致对多核苷酸的结构修饰。在一些实施方案中,本发明的多核苷酸可具有在翻译起始方面起作用的5'utr序列。5'utr序列可包括诸如kozak序列的特征,所述kozak序列通常已知涉及于核糖体使基因的翻译起始所采用的过程中,kozak序列具有共有xccr(a/g)ccaug,其中r是在起始密码子(aug)上游三个碱基处的嘌呤(腺嘌呤或鸟嘌呤),并且x是任何核苷酸。在一个实施方案中,kozak序列是accgcc。通过对通常见于靶标细胞或组织的大量表达基因中的特征进行工程化,本发明的多核苷酸的稳定性和蛋白质产生可得以增强。进一步提供可含有内部核糖体进入位点(ires)的多核苷酸,所述内部核糖体进入位点在多核苷酸中不存在5'帽结构的情况下使蛋白质合成起始方面起重要作用。ires可充当唯一核糖体结合位点,或可充当多个结合位点中的一者。本发明的含有超过一个功能性核糖体结合位点的多核苷酸可编码由核糖体独立翻译,从而产生双顺反子和/或多顺反子核酸分子的若干肽或多肽。在一些实施方案中,编码生物回路、效应物模块、dd和有效载荷的多核苷酸可包括约30至约100,000个核苷酸(例如30至50、30至100、30至250、30至500、30至1,000、30至1,500、30至3,000、30至5,000、30至7,000、30至10,000、30至25,000、30至50,000、30至70,000、100至250、100至500、100至1,000、100至1,500、100至3,000、100至5,000、100至7,000、100至10,000、100至25,000、100至50,000、100至70,000、100至100,000、500至1,000、500至1,500、500至2,000、500至3,000、500至5,000、500至7,000、500至10,000、500至25,000、500至50,000、500至70,000、500至100,000、1,000至1,500、1,000至2,000、1,000至3,000、1,000至5,000、1,000至7,000、1,000至10,000、1,000至25,000、1,000至50,000、1,000至70,000、1,000至100,000、1,500至3,000、1,500至5,000、1,500至7,000、1,500至10,000、1,500至25,000、1,500至50,000、1,500至70,000、1,500至100,000、2,000至3,000、2,000至5,000、2,000至7,000、2,000至10,000、2,000至25,000、2,000至50,000、2,000至70,000、以及2,000至100,000个核苷酸)。在一些方面,本发明的多核苷酸可包括超过10,000个核苷酸。编码某些特征诸如裂解位点、接头、迁移信号、标签或其他特征的多核苷酸的区域的长度可独立地在10-1,000个核苷酸的范围内(例如大于20、30、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800和900个核苷酸,或至少10、15、20、25、30、35、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800、900和1,000个核苷酸)。在一些实施方案中,本发明的多核苷酸可进一步包含经嵌入调控性部分诸如在核酸分子的3′utr内的微小rna结合位点,其在结合微小rna分子时,通过使核酸分子稳定性降低或通过抑制翻译来下调基因表达。相反,出于本发明的多核苷酸的目的,微小rna结合位点可被工程化出它们天然存在于其中的序列(即从所述序列移除),以使特定组织中的蛋白质表达增加。举例来说,可移除mir-142和mir-146结合位点以使免疫细胞中的蛋白质表达改进。在一些实施方案中,任何所编码有效载荷都可通过sre来调控,接着与一个或多个调控序列组合以产生双重或多重调谐效应物模块或生物回路系统。在一些实施方案中,本发明的多核苷酸可编码本发明的多肽的片段、变体、衍生物。在一些方面,变异序列可保持相同或类似活性。或者,相对于起始序列,变体可具有改变的活性(例如增加或降低)。通常,本发明的特定多核苷酸或多肽的变体与那个特定参照多核苷酸或多肽将具有至少约40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%但小于100%序列同一性,如通过本文所述以及为本领域技术人员所知的序列比对程序和参数所确定。所述比对工具包括blast套件的那些(stephen等,gappedblastandpsi-blast:anewgenerationofproteindatabasesearchprograms,nucleicacidsres.,1997,25:3389-3402)。在一些实施方案中,本发明的多核苷酸可加以修饰。如本文所用,术语“经修饰”或在适当时“修饰”是指关于a、g、u(在dna中是t)或c核苷酸的化学修饰。修饰可在构成多核苷酸的核苷的核苷碱基和/或糖部分上。在一些实施方案中,多个修饰被包括在经修饰核酸中或一个或多个个别核苷或核苷酸中。举例来说,对核苷的修饰可包括一个或多个对核苷碱基和糖的修饰。对本发明的多核苷酸的修饰可包括例如国际公布号wo2013/052523中教导的那些修饰中的任一者,所述公布的内容以引用的方式整体并入本文。如本文所述,“核苷”定义为含有糖分子(例如戊糖或核糖)或其衍生物与有机碱基(例如嘌呤或嘧啶)或其衍生物(在本文中也称为“核苷碱基”)组合的化合物。如本文所述,“核苷酸”定义为包括磷酸酯基团的核苷。在一些实施方案中,修饰可在核苷间键联(例如磷酸酯骨架)上。在本文中,在多核苷酸骨架的情形下,短语“磷酸酯”和“磷酸二酯”可互换使用。骨架磷酸酯基团可通过用不同取代基置换一个或多个氧原子来修饰。此外,经修饰核苷和核苷酸可包括用另一核苷间键联全盘置换未修饰磷酸酯部分。经修饰磷酸酯基团的实例包括但不限于硫代磷酸酯、硒代磷酸酯、硼代磷酸酯(boranophosphate)、硼代磷酸酯(boranophosphateester)、膦酸氢酯、氨基磷酸酯、二氨基磷酸酯、烷基或芳基膦酸酯和磷酸三酯。在二硫代磷酸酯的情况下,两个非连接性氧均由硫置换。磷酸酯接头也可通过用氮(桥接氨基磷酸酯)、硫(桥接硫代磷酸酯)和碳(桥接亚甲基-膦酸酯)置换连接性氧来修饰。可使用的其他修饰在例如国际申请号:wo2013/052523中教导,所述申请的内容以引用的方式整体并入本文。本发明的多核苷酸的核苷酸或核苷碱基的适用于本发明中的化学修饰和/或取代包括本领域中已知的任何经修饰取代物,例如(±)1-(2-羟基丙基)假尿苷tp、(2r)-1-(2-羟基丙基)假尿苷tp、1-(4-甲氧基-苯基)假utp、2′-o-二甲基腺苷、1,2′-o-二甲基鸟苷、1,2′-o-二甲基肌苷、1-己基-假utp、1-高烯丙基假尿苷tp、1-羟基甲基假尿苷tp、1-异丙基-假utp、1-me-2-硫代-假utp、1-me-4-硫代-假utp、1-me-α-硫代-假utp、1-me-gtp、2’-氨基-2’-脱氧-atp、2’-氨基-2’-脱氧-ctp、2’-氨基-2’-脱氧-gtp、2’-氨基-2’-脱氧-utp、2’-叠氮基-2’-脱氧-atp、杀结核菌素(tubercidine)、修饰不完全的羟基怀丁苷(hydroxywybutosine)、5-氧基乙酸尿苷、5-氧基乙酸甲酯尿苷、怀丁苷、丫苷(wyosine)、黄嘌呤、黄苷-5’-tp、木糖-腺苷、泽布拉瑞(zebularine)、α-硫代-腺苷、α-硫代-胞苷、α-硫代-鸟苷和/或α-硫代-尿苷。本发明的多核苷酸可包含本文教导的修饰中的一者或多者。不同糖修饰、碱基修饰、核苷酸修饰和/或核苷间键联(例如骨架结构)可存在于本发明的多核苷酸中的各种位置处。本领域普通技术人员将了解核苷酸类似物或其他修饰可位于多核苷酸的任何位置处,以使所述多核苷酸的功能不实质上降低。修饰也可为5′或3′末端修饰。多核苷酸可含有约1%至约100%经修饰核苷酸(相对于总体核苷酸内含物,或相对于一种或多种类型的核苷酸,即a、g、u或c中的任何一者或多者),或任何间插百分比(例如1%至20%、1%至25%、1%至50%、1%至60%、1%至70%、1%至80%、1%至90%、1%至95%、10%至20%、10%至25%、10%至50%、10%至60%、10%至70%、10%至80%、10%至90%、10%至95%、10%至100%、20%至25%、20%至50%、20%至60%、20%至70%、20%至80%、20%至90%、20%至95%、20%至100%、50%至60%、50%至70%、50%至80%、50%至90%、50%至95%、50%至100%、70%至80%、70%至90%、70%至95%、70%至100%、80%至90%、80%至95%、80%至100%、90%至95%、90%至100%、以及95%至100%)。在一些实施方案中,本发明的多核苷酸的一个或多个密码子可用编码天然氨基酸序列的其他密码子置换以通过被称为密码子选择的过程来调谐sre的表达。因为mrna密码子和trna反密码子汇集物倾向于在生物体、细胞类型、亚细胞位置之间以及随时间发生变化,所以本文所述的密码子选择是时空性(st)密码子选择。在本发明的一些实施方案中,某些多核苷酸特征可加以密码子优化。密码子优化是指通过以下方式来修饰核酸序列以达成在宿主细胞中的表达得以增强的过程:用在那个宿主细胞的基因中最常使用的密码子置换天然序列的至少1、2、3、4、5、10、15、20、25、50个或更多个密码子,同时维持天然氨基酸序列。密码子使用可利用密码子适应指数(cai)来权衡,所述密码子适应指数衡量编码多核苷酸序列从参照基因集合的偏离。密码子使用表可在密码子使用数据库(www.kazusa.or.jp/codon/)获得,并且cai可通过embosscai程序(emboss.sourceforge.net/)来计算。密码子优化方法在本领域中是已知的,并且可适用于用以实现若干目标中的一者或多者的尝试中。这些目标包括匹配靶标和宿主生物体中的密码子频率以确保适当折叠,使核苷酸含量偏倚以改变稳定性或降低二级结构,使可损害基因构建或表达的串联重复密码子或碱基延伸最小化,定制转录和翻译控制区域,插入或移除蛋白质信号传导序列,在所编码蛋白质中移除/添加翻译后修饰位点(例如糖基化位点),添加、移除或改组蛋白质结构域,插入或缺失限制位点,修饰核糖体结合位点和降解位点,调整翻译速率以允许蛋白质的各种结构域适当折叠,或降低或消除多核苷酸内的问题二级结构。密码子优化工具、算法和服务在本领域中是已知的,并且非限制性实例包括来自geneart(lifetechnologies)、dna2.0(menloparkca)、optimumgene(genscript,piscataway,nj)的服务,诸如但不限于dnaworksv3.2.3的算法和/或专有方法。在一个实施方案中,多核苷酸序列或其部分使用最优化算法来加以密码子优化。各氨基酸的密码子选项在本领域中是熟知的,用于针对在那个特定物种中的表达加以优化的各种物种表也是熟知的。在本发明的一些实施方案中,某些多核苷酸特征可加以密码子优化。举例来说,用于密码子优化的优选区域可在编码多肽的区域的上游(5’)或下游(3’)。这些区域可在有效载荷编码区或开放阅读框(orf)的密码子优化之前和/或之后并入多核苷酸中。在优化(如果需要)之后,将多核苷酸组分重构并转化至载体诸如但不限于质粒、病毒、粘粒和人工染色体中。时空性密码子选择可影响本发明的多核苷酸的表达,因为密码子组成决定mrna物质的翻译速率以及它的稳定性。举例来说,经优化密码子的trna反密码子是大量的,因此翻译可得以增强。相比之下,较不常见密码子的trna反密码子是较少的,因此翻译可在较慢速率下进行。presnyak等人已显示mrna物质的稳定性取决于密码子含量,并且较高稳定性以及因此较高蛋白质表达可通过利用经优化密码子来实现(presnyak等(2015)cell160,1111–1124;其内容以引用的方式整体并入本文)。因此,在一些实施方案中,st密码子选择可包括选择经优化密码子以使本发明的sre、效应物模块和生物回路的表达增强。在其他实施方案中,时空性密码子选择可涉及选择在宿主细胞的基因中较不通常使用的密码子以使本发明组合物的表达降低。也可改变经优化密码子与在宿主细胞的基因中较不通常使用的密码子的比率以调谐表达。在一些实施方案中,多核苷酸的某些区域可使用密码子选择方法来修饰。举例来说,用于密码子选择的优选区域可在编码多肽的区域的上游(5’)或下游(3’)。这些区域可在有效载荷编码区或开放阅读框(orf)的密码子选择之前和/或之后并入多核苷酸中。本发明的多核苷酸的终止密码子可被修饰来包括用以改变本发明的sre、有效载荷和效应物模块的表达水平的序列和基序。所述序列可被并入以诱导终止密码子通读,其中终止密码子可指定例如硒代半胱氨酸或吡咯赖氨酸的氨基酸。在其他情况下,终止密码子可被完全跳过以继续通过替代性开放阅读框来进行翻译。终止密码子通读可用于在特定比率(例如如由终止密码子情形所决定)下调谐效应物模块的组分的表达。优选终止密码子基序的实例包括ugan、uaan和uagn,其中n是c或u。多核苷酸修饰和操作可通过本领域中已知的方法诸如但不限于定点诱变和重组技术来实现。所得经修饰分子可接着使用体外或体内测定来测试活性,所述测定诸如本文所述的那些或本领域中已知的任何其他适合筛选测定。在一些实施方案中,本发明的多核苷酸可包含两个或更多个效应物模块序列或两个或更多个有效载荷序列,其呈诸如ababab或aabbaabbaabb或abcabcabc或其变化形式的样式,重复一次、两次或超过三次。在这些样式中,各字母a、b或c代表不同效应物模块组分。在另一实施方案中,本发明的多核苷酸可包含两个或更多个效应物模块组分序列,其中各组分具有一个或多个sre序列(dd序列),或两个或更多个有效载荷序列。作为一非限制性实例,序列可呈诸如ababab或aabbaabbaabb或abcabcabc或其变化形式的样式,在各区域中重复一次、两次或超过三次。作为另一非限制性实例,序列可呈诸如ababab或aabbaabbaabb或abcabcabc或其变化形式的样式,跨越整个多核苷酸重复一次、两次或超过三次。在这些样式中,各字母a、b或c代表不同序列或组分。根据本发明,编码独特生物回路、效应物模块、sre和有效载荷构建体的多核苷酸可使用在3′末端的经修饰核苷酸,通过3′末端来连接在一起。化学缀合可用于控制向细胞中递送的化学计量。多核苷酸可被设计来缀合于其他多核苷酸、染料、插入剂(例如吖啶)、交联剂(例如补骨脂素(psoralene)、丝裂霉素c(mitomycinc))、卟啉(tppc4、得克萨卟啉(texaphyrin)、sapphyrin)、多环芳烃(例如吩嗪、二氢吩嗪)、人工核酸内切酶(例如edta)、烷基化剂、磷酸酯、氨基、巯基、peg(例如peg-40k)、mpeg、[mpeg]2、多氨基、烷基、经取代烷基、经放射性标记的标记、酶、半抗原(例如生物素)、运输/吸收促进剂(例如阿司匹林(aspirin)、维生素e、叶酸)、合成核糖核酸酶、蛋白质例如糖蛋白、或肽例如对共配体具有特定亲和力的分子、或结合指定细胞类型诸如癌细胞、内皮细胞或骨细胞的抗体、激素和激素受体、非肽物质诸如脂质、凝集素、碳水化合物、维生素、辅因子或药物。作为非限制性实例,它们可为具有其他免疫缀合物的缀合物。在一些实施方案中,本发明的多核苷酸的组合物可通过使用gibson组装方法使效应物模块的各种组分组合来产生。gibson组装反应由三个等温反应组成,各自依赖于不同酶活性,包括产生长突出部分的5'核酸外切酶、填充经退火单链区域的间隙的聚合酶、以及将经退火和经填充间隙的切口密封的dna连接酶。在gibson组装之前进行可用于产生具有重叠序列的pcr产物的聚合酶链式反应。这些方法可依序重复以组装越来越大的分子。举例来说,方法可包括重复如上方法以将第二组两个或更多个目标dna分子彼此接合,接着再次重复所述方法以将第一组目标dna分子和第二组目标dna分子接合,等等。在这些多轮组装期间的任何阶段,经组装dna都可通过将它转化至适合微生物中来扩增,或它可在体外加以扩增(例如用pcr)。在一些实施方案中,本发明的多核苷酸可编码本文教导的包含去稳定结构域(dd)和至少一个有效载荷的效应物模块。dd结构域可为包含一个、两个、三个、四个、五个或更多个突变的hpde5突变体。在一些实施方案中,效应物模块可为由seqidno.95-106;205-222;234-236;256-260;378-379;469-503;以及526-533编码的pde5-gfp融合物。在一些实施方案中,效应物模块可为由seqidno.8285-8298编码的hpde5-car构建体或由seqidno.8352-8361编码的hpde5-il15-il15ra构建体。细胞根据本发明,提供被遗传修饰来表达至少一种本发明的生物回路、sre(例如dd)、效应物模块和免疫治疗剂的细胞。本发明的细胞可包括不限于免疫细胞、干细胞和肿瘤细胞。在一些实施方案中,免疫细胞是免疫效应细胞,包括但不限于t细胞诸如cd8+t细胞和cd4+t细胞(例如th1、th2、th17、foxp3+细胞),记忆t细胞诸如t记忆干细胞、中枢性t记忆细胞和效应记忆t细胞,终末分化的效应t细胞、天然杀伤(nk)细胞、nkt细胞、肿瘤浸润性淋巴细胞(til)、细胞毒性t淋巴细胞(ctl)、调控性t细胞(treg)和树突细胞(dc)、可引发效应物功能的其他免疫细胞、或其混合物。t细胞可为tαβ细胞和tγδ细胞。在一些实施方案中,干细胞可来自人胚胎干细胞、间质干细胞和神经干细胞。在一些实施方案中,t细胞可被消减了内源性t细胞受体(参见美国专利号:9,273,283;9,181,527;和9,028,812;其各自的内容以引用的方式整体并入本文)。在一些实施方案中,相对于特定个别受试者,本发明的细胞可为自体的、同种异体的、同种同基因的或异种异体的。在一些实施方案中,本发明的细胞可为哺乳动物细胞,特别是人细胞。本发明的细胞可为原代细胞或永生化细胞系。在一些实施方案中,本发明的细胞可包括作为有效载荷的扩增因子以触发细胞的增殖和扩增。示例性有效载荷包括ras诸如kras、nras、rras、rras2、mras、eras和hras,diras诸如diras1、diras2和diras3,nkiras诸如nkiras1和nkiras2,ral诸如rala和ralb,rap诸如rap1a、rap1b、rap2a、rap2b和rap2c,rasd诸如rasd1和rasd2,rasl诸如rasl10a、rasl10b、rasl11a、rasl11b和rasl12,rem诸如rem1和rem2,gem、rerg、rergl和rrad。经工程化的免疫细胞可通过以下方式来实现:用生物回路、效应物模块、sre和/或目标有效载荷(即免疫治疗剂)的多肽或编码所述多肽的多核苷酸或包含所述多核苷酸的载体转导细胞组合物。载体可为病毒载体诸如慢病毒载体、γ逆转录病毒载体、重组aav、腺病毒载体和溶瘤性病毒载体。在其他方面,也可使用非病毒载体,例如纳米粒子和脂质体。在一些实施方案中,本发明的免疫细胞被遗传修饰来表达至少一种可使用刺激物来调谐的本发明的免疫治疗剂。在一些实例中,将两种、三种或更多种构建在同一生物回路和效应物模块中的免疫治疗剂引入细胞中。在其他实例中,可将两种、三种或更多种其各自包含免疫治疗剂的生物回路、效应物模块引入细胞中。在一些实施方案中,本发明的免疫细胞可为被修饰来表达抗原特异性t细胞受体(tcr)的t细胞或被修饰来表达本文教导的抗原特异性嵌合抗原受体(car)的t细胞(称为cart细胞)。因此,将至少一种编码本文所述的car系统(或tcr)的多核苷酸、或包含所述多核苷酸的载体引入t细胞中。表达car或tcr的t细胞通过car或tcr的细胞外靶向部分来结合特定抗原,由此信号通过细胞内信号传导结构域来传输至t细胞中,因此,t细胞被活化。经活化cart细胞变化它的行为,包括释放细胞毒性细胞因子(例如肿瘤坏死因子和淋巴毒素等),改进细胞增殖速率,变化细胞表面分子等。所述变化导致对表达由car或tcr识别的抗原的靶标细胞的破坏。此外,细胞因子的释放或细胞表面分子的变化会刺激其他免疫细胞,例如b细胞、树突细胞、nk细胞和巨噬细胞。引入t细胞中的car可为仅包括来自tcrcd3ζ的细胞内信号传导结构域的第一代car,或包括来自tcrcd3ζ的细胞内信号传导结构域和共刺激性信号传导结构域的第二代car,或包括来自tcrcd3ζ的细胞内信号传导结构域和两个或更多个共刺激性信号传导结构域的第三代car,或拆分car系统,或开启/关闭开关car系统。在一个实例中,car或tcr的表达由本发明的效应物模块中的去稳定结构域(dd)诸如hdhfr突变体控制。存在或不存在hdhfr结合配体诸如tmp用于调谐经转导t细胞或nk细胞中的car或tcr表达。在一些实施方案中,本发明的cart细胞可被进一步修饰来表达另外一种、两种、三种或更多种免疫治疗剂。免疫治疗剂可为对不同靶标分子具有特异性的另外car或tcr;细胞因子诸如il2、il12、il15和il18,或细胞因子受体诸如il15ra;使抑制性信号转换成刺激性信号的嵌合转换受体;将过继性转移的细胞导向靶标部位诸如肿瘤组织的归巢受体;使免疫细胞的代谢最优化的药剂;或当在过继性细胞转移之后观察到重度事件时或当不再需要转移的免疫细胞时杀灭活化的t细胞的安全性开关基因(例如自杀基因)。这些分子可被包括在同一效应物模块中或单独效应物模块中。在一个实施方案中,本发明的cart细胞(包括tcrt细胞)可为“经武装”cart细胞,其用包含car的效应物模块和包含细胞因子的效应物模块转化。诱导性或组成性分泌活性细胞因子会进一步为cart细胞加置装甲以改进功效和持久性。在这个情形下,所述cart细胞也被称为“装甲化cart细胞”。“装甲”分子可基于肿瘤微环境以及先天性和适应性免疫系统的其他要素来选择。在一些实施方案中,分子可为已显示会通过不同机制来进一步增强cart细胞面对敌对性肿瘤微环境的功效和持久性的刺激性因子,诸如il2、il12、il15、il18、i型ifn、cd40l和4-1bbl(yeku等,biochemsoctrans.,2016,44(2):412-418)。在一些方面,本发明的经武装cart细胞被修饰来表达cd19car和il12。在car于肿瘤中介导的活化之后,所述t细胞释放诱导型il12,其加强t细胞活化,并且吸引和活化先天性免疫细胞以消除cd19阴性癌细胞。在一个实施方案中,本发明的t细胞可被修饰来表达包含car的效应物模块和包含自杀基因的效应物模块。在一个实施方案中,本发明的cart细胞(包括tcrt细胞)可用包含细胞因子和安全性开关基因(例如自杀基因)的效应物模块转化。自杀基因可为诸如胱天蛋白酶9的诱导型胱天蛋白酶,其在由生物回路系统的细胞外刺激物活化时诱导凋亡。所述经诱导凋亡使经转移细胞消除,如为降低直接毒性和不受控制的细胞增殖的风险所需。在一些实施方案中,本发明的免疫细胞可为被修饰来表达本文教导的抗原特异性t细胞受体(tcr)或抗原特异性嵌合抗原受体(car)的nk细胞。天然杀伤(nk)细胞是先天性淋巴样细胞家族的成员,并且在人中的特征在于在不存在cd3(t细胞共受体)下表达表型标志物cd56(神经细胞粘附分子)。nk细胞是先天性免疫系统的强效效应细胞,其介导细胞毒性攻击而不需要先前抗原初免,从而形成针对包括癌症恶性肿瘤和病毒性感染的疾病的第一防线。若干临床前和临床试验已证明过继性转移nk细胞是一种针对癌症诸如急性骨髓性白血病的有前景的治疗方法(ruggeri等,science;2002,295:2097–2100;以及geller等,immunotherapy,2011,3:1445-1459)。过继性转移表达car诸如基于dap12的活化性car的nk细胞揭示对肿瘤细胞的根除得以改进(topfer等,jimmunol.2015;194:3201–3212)。被工程化来表达cs-1特异性car的nk细胞也在多发性骨髓瘤的情况下显示增强的细胞裂解和干扰素-γ(ifnγ)产生(chu等,leukemia,2014,28(4):917-927)。nk细胞活化以一系列具有活化性和抑制性功能的受体为特征。nk细胞上的重要活化受体包括cd94/nkg2c和nkg2d(c型凝集素样受体)以及天然细胞毒性受体(ncr)nkp30、nkp44和nkp46,其识别肿瘤细胞或受病毒感染细胞上的配体。nk细胞抑制基本上由多态性抑制性杀伤细胞免疫球蛋白样受体(kir)与它们的同源人白细胞抗原(hla)配体通过hla分子的α-1螺旋来进行的相互作用介导。由活化性受体产生的信号与由抑制性受体产生的信号之间的平衡主要决定立刻细胞毒性活化。nk细胞可从外周血液单核细胞(pbmc)分离,或源于人胚胎干(es)细胞和诱导多能干细胞(ipsc)。从pbmc分离的原代nk细胞可被进一步扩增以用于过继性免疫疗法。适用于使nk细胞扩增的策略和方案可包括白介素2(il2)刺激以及使用自体饲养细胞或使用经遗传修饰的同种异体饲养细胞。在一些方面,nk细胞可用刺激性配体的组合加以选择性扩增,所述刺激性配体包括il15、il21、il2、41bbl、il12、il18、mica、2b4、lfa-1和bcm1/slamf2(例如美国专利公布号:us20150190471)。表达包含car和/或其他免疫治疗剂的效应物模块的免疫细胞可用作癌症免疫疗法。免疫疗法包含表达car和/或其他免疫治疗剂作为活性成分的细胞,并且可进一步包含适合赋形剂。赋形剂的实例可包括药学上可接受的赋形剂,包括各种细胞培养基和等张氯化钠。在一些实施方案中,本发明的细胞可为被遗传修饰来表达本发明组合物的树突细胞。所述细胞可用作癌症疫苗。iii.药物组合物和制剂本发明进一步提供包含一种或多种本发明的生物回路、效应物模块、sre(例如dd)、刺激物和目标有效载荷(即免疫治疗剂)、载体、细胞和其他组分,以及任选至少一种药学上可接受的赋形剂或惰性成分的药物组合物。如本文所用,术语“药物组合物”是指本文所述的生物回路、sre、刺激物和目标有效载荷(即免疫治疗剂)、其他组分、载体、细胞或其药学上可接受的盐,任选连同其他化学组分诸如生理上适合的载体和赋形剂一起的制剂。本发明的药物组合物包含有效量的一种或多种本发明的活性组合物。含有至少一种本发明组合物和/或额外活性成分的药物组合物的制备将为本领域技术人员在考虑本公开的情况下所知,如由以引用的方式并入本文的remington'spharmaceuticalsciences,第18版mackprintingcompany,1990所例示。术语“赋形剂”或“惰性成分”是指添加至药物组合物和制剂中以进一步有助于活性成分的施用的非活性物质。出于本公开的目的,短语“活性成分”通常是指任何一种或多种如本文所述的待递送的生物回路、效应物模块、sre、刺激物和目标有效载荷(即免疫治疗剂)、其他组分、载体和细胞。短语“药学上可接受”是指分子实体和组合物在向动物,诸如像在适当时向人施用时不产生不利、过敏性或其他不适当反应。在一些实施方案中,向人、人患者或受试者施用药物组合物和制剂。尽管对本文提供的药物组合物的描述主要涉及适于向人施用的药物组合物,但熟练技术人员将了解所述组合物通常适于向任何其他动物,例如向非人动物例如非人哺乳动物施用。预期向其施用药物组合物的受试者包括但不限于非人哺乳动物,包括农业动物诸如牛、马、鸡和猪,家养动物诸如猫、狗,或研究动物诸如小鼠、大鼠、兔、狗和非人灵长类动物。应了解,对于人施用,制剂应满足如由fda生物标准办公室(fdaofficeofbiologicalstandards)所要求的无菌性、致热原性、总体安全性和纯度标准。本发明的药物组合物和制剂可以单一单位剂量形式和/或以多个单一单位剂量形式制备、包装和/或整批销售。如本文所用,“单位剂量”是包含预定量的活性成分的药物组合物的个别量。活性成分的量通常等于活性成分的将向受试者施用的剂量,和/或这种剂量的适宜分数,诸如像这种剂量的一半或三分之一。本发明组合物可以适于递送的任何方式配制。制剂可为但不限于纳米粒子、聚(乳酸共乙醇酸)(plga)、微球体、类脂质、脂质复合物、脂质体、聚合物、碳水化合物(包括简单糖)、阳离子脂质及其组合。在一个实施方案中,制剂是可包含至少一种脂质的纳米粒子。脂质可选自但不限于dlin-dma、dlin-k-dma、98n12-5、c12-200、dlin-mc3-dma、dlin-kc2-dma、dodma、plga、peg、peg-dmg和peg化脂质。在另一方面,脂质可为阳离子脂质,诸如但不限于dlin-dma、dlin-d-dma、dlin-mc3-dma、dlin-kc2-dma和dodma。对于本发明的多核苷酸,制剂可选自例如于国际申请pct/us2012/069610中教导的那些中的任一者,所述申请的内容以引用的方式整体并入本文。本发明的药物组合物中的活性成分、药学上可接受的赋形剂或惰性成分、和/或任何额外成分的相对量将视所治疗受试者的身份、尺寸和/或状况,以及进一步视组合物将被施用所采用的途径而变化。举例来说,组合物可包含在0.1%与100%之间,例如在0.5%与50%之间,在1%-30%之间,在5%-80%之间,至少80%(w/w)的活性成分。治疗或改善疾病的功效可例如通过以下方式来评估:测量疾病进展、疾病缓解、症状严重性、疼痛减轻、生活质量、药物的为维持治疗作用所需的剂量、疾病标志物的水平或适合于所治疗或被靶向以达成预防的给定疾病的任何其他可测量参数。完全属于本领域技术人员的能力的是通过测量所述参数中的任一者或参数的任何组合来监测治疗或预防的功效。关于施用本发明组合物,“有效针对”例如癌症指示以临床适当方式进行的施用会产生对于至少统计显著分数的患者来说有益的作用,诸如症状改进、治愈、疾病负荷降低、肿瘤团块或细胞数目减小、生命延长、生活质量改进、或通常由熟悉治疗特定类型的癌症的医师认定为正性的其他作用。当在疾病状况的一个或多个参数方面存在统计显著改进时,或根据未恶化或未显现症状(其中它们将否则被预期),治疗或预防作用是明显的。作为一实例,在疾病的可测量参数方面具有至少10%,并且优选至少20%、30%、40%、50%或更大的有利变化可指示有效治疗。本发明的给定组合物或制剂的功效也可使用如本领域中已知的关于给定疾病的实验动物模型来评判。当使用实验动物模型时,在观察到统计显著变化时,治疗功效得以证实。iv.递送模态和/或载体载体本发明也提供包装本发明的编码生物回路、效应物模块、sre(dd)和有效载荷构建体及其组合的多核苷酸的载体。在一些实施方案中,提供编码去稳定结构域、效应物模块和生物回路系统的多核苷酸。提供包含本发明的多核苷酸的载体。在一些方面,载体可为非病毒载体或病毒载体。在一些实施方案中,本发明的载体是病毒载体。病毒载体可包括但不限于逆转录病毒载体、腺病毒载体、腺相关病毒载体或慢病毒载体。在一些实施方案中,本发明的载体可为非病毒载体诸如纳米粒子和脂质体。本发明的载体也可用于将经包装多核苷酸递送至细胞、局部组织部位或受试者中。这些载体可具有任何种类,包括dna载体、rna载体、质粒、病毒载体和粒子。病毒载体技术是熟知的,并且描述于sambrook等(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)中。适用作载体的病毒包括但不限于慢病毒载体、腺病毒载体、腺相关病毒(aav)载体、单纯性疱疹病毒载体、逆转录病毒载体、溶瘤性病毒等。一般来说,载体含有在至少一种生物体中具有功能性的复制起点、启动子序列和适宜限限制核酸内切酶以及一种或多种可选择标记例如药物抗性基因。如本文所用,启动子定义为由细胞的转录机构识别的为使本发明的多核苷酸序列的特异性转录起始所需的dna序列。载体可包含天然或非天然启动子可操作地连接于本发明的多核苷酸。所选启动子可为强效的,微弱的,组成型的,诱导型的,组织特异性的,发育阶段特异性的,和/或生物体特异性的。适合启动子的一个实例是立即早期巨细胞病毒(cmv)启动子序列。这个启动子序列是能够驱动操作性地连接于它的多核苷酸序列的高水平表达的强效组成型启动子序列。优选启动子的另一实例是延伸生长因子-1.α(ef-1.α)。也可使用其他组成型启动子,包括但不限于猿猴病毒40(sv40)、小鼠乳腺肿瘤病毒(mmtv)、人免疫缺陷病毒(hiv)长末端重复序列(ltr)启动子、禽白血病病毒启动子、艾伯斯坦-巴尔病毒立即早期启动子、劳斯肉瘤病毒启动子以及人基因启动子,包括但不限于磷酸甘油酸激酶(pgk)启动子、肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子、泛素c(ubc)启动子、人u6小核蛋白启动子和肌酸激酶启动子。在一些情况下,可使用诱导型启动子,诸如但不限于金属硫蛋白启动子、糖皮质素启动子、孕酮启动子和四环素启动子。在一些实施方案中,启动子可选自以下:包含核苷酸序列seqidno.335的cmv启动子、包含核苷酸序列seqidno.336-337的ef1a启动子、以及包含核苷酸序列seqidno.338的pgk启动子。在一些实施方案中,最优启动子可基于它在不存在配体下实现本发明的sre和有效载荷的最小表达,并且在存在配体下实现可检测表达的能力来选择。额外启动子元件例如增强子可用于调控转录起始的频率。所述区域可位于起始位点的上游或下游10-100个碱基对处。在一些情况下,两个或更多个启动子元件可用于以合作方式或以独立方式使转录活化。在一些实施方案中,重组表达载体可包含对于向其中引入载体的宿主细胞类型是特异性的调控序列,诸如转录和翻译起始和终止密码子。1.慢病毒载体在一些实施方案中,慢病毒载体/粒子可用作运载体和递送模态。慢病毒是逆转录病毒科病毒的子组,所述逆转录病毒科病毒因为在整合至宿主基因组中之前需要病毒rna基因组逆转录成dna而得名。因此,慢病毒运载体/粒子的最重要特征是它们的遗传物质整合至靶标/宿主细胞的基因组中。慢病毒的一些实例包括人免疫缺陷病毒:hiv-1和hiv-2、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)、詹布拉纳病病毒(jembranadiseasevirus,jdv)、马传染性贫血病毒(eiav)、马传染性贫血病毒、威司奈-梅迪病毒(visna-maedi)和山羊关节炎脑炎病毒(caev)。通常,组成基因递送运载体的慢病毒粒子独自是复制缺陷性的(也被称为“自失活性的”)。慢病毒可借助于通过完整宿主核包膜来达成的进入机制来感染分裂细胞与非分裂细胞两者(naldinil等,curr.opin.biotechnol,1998,9:457-463)。重组慢病毒运载体/粒子已通过以多重方式使hiv毒力基因减弱来产生,例如使基因env、vif、vpr、vpu、nef和tat缺失,从而使得载体在生物学上是安全的。相应地,例如源于hiv-1/hiv-2的慢病毒运载体可介导转基因向非分裂细胞中的高效递送、整合和长期表达。如本文所用,术语“重组”是指载体或其他核酸含有慢病毒序列与非慢病毒逆转录病毒序列两者。慢病毒粒子可通过在生产细胞诸如人hek293t细胞中共同表达病毒包装元件和载体基因组自身来产生。这些元件通常提供在三个(在第二代慢病毒系统的情况下)或四个单独质粒(在第三代慢病毒系统的情况下)中。生产细胞用编码慢病毒组分(包括病毒的核心(即结构蛋白)和酶组分以及包膜蛋白)的质粒(被称为包装系统)和编码包括待转移至靶标细胞中的外来转基因的基因组即运载体自身的质粒(也被称为转移载体)共转染。一般来说,质粒或载体被包括在生产细胞系中。质粒/载体通过转染、转导或感染来引入生产细胞系中。用于转染、转导或感染的方法为本领域技术人员所熟知。作为非限制性实例,包装构建体和转移构建体可通过以下方式来引入生产细胞系中:磷酸钙转染、脂质体转染或电穿孔,通常连同显性可选择标记诸如neo、dhfr、gln合成酶或ada一起,继之以在适当药物存在下进行选择以及分离克隆。生产细胞产生含有外来基因例如本发明的效应物模块的重组病毒粒子。从培养基回收重组病毒粒子,并且通过由本领域技术人员使用的标准方法来滴定。重组慢病毒运载体可用于感染靶标细胞。可用于产生高效价慢病毒粒子的细胞可包括但不限于hek293t细胞、293g细胞、star细胞(relander等,mol.ther.,2005,11:452-459)、freestyletm293表达系统(thermofisher,waltham,ma)以及其他基于hek293t的生产细胞系(例如stewart等,humgenether.2011,22(3):357-369;lee等,biotechnolbioeng,2012,10996):1551-1560;throm等,blood.2009,113(21):5104-5110;其各自的内容以引用的方式整体并入本文)。在一些方面,包膜蛋白可为来自其他病毒的异源性包膜蛋白,诸如水泡性口炎病毒的g蛋白(vsvg)或杆状病毒gp64包膜蛋白。vsv-g糖蛋白可尤其在分类在水疱病毒属(vesiculovirus)中的物种之中选择:卡拉加斯病毒(carajasvirus,cjsv)、金迪普拉病毒(chandipuravirus,chpv)、科卡尔病毒(cocalvirus,cocv)、伊斯法罕病毒(isfahanvirus,isfv)、马拉巴病毒(marabavirus,marav)、皮理病毒(piryvirus,piryv)、阿拉戈斯水泡性口炎病毒(vesicularstomatitisalagoasvirus,vsav)、印第安纳水泡性口炎病毒(vesicularstomatitisindianavirus,vsiv)和新泽西水泡性口炎病毒(vesicularstomatitisnewjerseyvirus,vsnjv)和/或暂时分类在水疱病毒属中的病毒株如草鱼弹状病毒(grasscarprhabdovirus)、bean157575病毒(bean157575)、博特克病毒(botekevirus,btkv)、卡尔查基病毒(calchaquivirus,cqiv)、美洲鳗病毒(eelvirusamerican,eva)、戈雷洛奇病毒(graylodgevirus,glov)、朱罗纳病毒(juronavirus,jury)、克拉马斯病毒(klamathvirus,klav)、克瓦塔病毒(kwattavirus,kwav)、拉霍亚病毒(lajoyavirus,ljv)、马尔佩斯泉病毒(malpaisspringvirus,mspv)、埃尔贡山蝙蝠病毒(mountelgonbatvirus,mebv)、佩里内特病毒(perinetvirus,perv)、梭子鱼鱼苗弹状病毒(pikefryrhabdovirus,pfrv)、波登病毒(portonvirus,porv)、拉迪病毒(radivirus,radiv)、鲤春病毒血症病毒(springviremiaofcarpvirus,svcv)、树鼩病毒(tupaiavirus,tupv)、溃疡病弹状病毒(ulcerativediseaserhabdovirus,udrv)和尤格波格丹诺夫奇病毒(yugbogdanovacvirus,ybv)。gp64或其他杆状病毒包膜蛋白可源于苜蓿银纹夜蛾核型多角体病毒(autographacalifornicanucleopolyhedrovirus,acmnpv)、芹菜夜蛾核多角体病病毒(anagraphafalciferanuclearpolyhedrosisvirus)、家蚕(bombyxmori)核多角体病病毒、云杉卷叶蛾(choristoneurafumiferana)核型多角体病毒、黄杉毒蛾(orgyiapseudotsugata)单衣壳核多角体病病毒、苹淡褐卷蛾(epiphyaspostvittana)核型多角体病毒、美国白蛾(hyphantriacunea)核型多角体病毒、蜡螟(galleriamellonella)核多角体病病毒、多理病毒(dhorivirus)、索哥托病毒(thogotovirus)、柞蚕(antheraeapemyi)核型多角体病毒或贝特肯病毒(batkenvirus)。提供在慢病毒粒子中的额外元件可包括在5’末端或3’末端的逆转录病毒ltr(长末端重复序列);逆转录病毒输出元件,任选包括慢病毒逆响应元件(rre);启动子或其活性部分以及基因座控制区(lcr)或其活性部分。其他元件包括用以使在非分裂细胞中的转导效率改进的中央多聚嘌呤区(cppt)序列、使转基因的表达增强,并且使效价增加的土拔鼠肝炎病毒(whp)转录后调控元件(wpre)。效应物模块连接于载体。用于产生重组慢病毒粒子的方法在本领域中加以讨论,例如在美国专利号:8,846,385;7,745,179;7,629,153;7,575,924;7,179,903;和6,808,905中加以讨论;所述专利各自的内容以引用的方式整体并入本文。所用慢病毒载体可选自但不限于plvx、plenti、plenti6、pljm1、fugw、pwpxl、pwpi、plenticmvpurodest、pljm1-egfp、pultra、pinducer20、phiv-egfp、pcw57.1、ptrpe、pelps、prrl和plionii。也可使用本领域中已知的慢病毒运载体(参见美国专利号9,260,725;9,068,199;9,023,646;8,900,858;8,748,169;8,709,799;8,420,104;8,329,462;8,076,106;6,013,516;和5,994,136;国际专利公布号:wo2012079000;其各自的内容以引用的方式整体并入本文)。2.逆转录病毒载体(γ-逆转录病毒载体)在一些实施方案中,逆转录病毒载体可用于包装和递送本发明的生物回路、生物回路组分、效应物模块、sre或有效载荷构建体。逆转录病毒载体(rv)允许转基因永久整合在靶标细胞中。除基于复杂hiv-1/2的慢病毒载体之外,基于简单γ-逆转录病毒的逆转录病毒载体也已广泛用于递送治疗性基因,并且在临床上被证明为是一种能够转导广泛范围的细胞类型的最高效和强效的基因递送系统。γ逆转录病毒的实例物种包括鼠白血病病毒(mlv)和猫白血病病毒(felv)。在一些实施方案中,源于哺乳动物γ逆转录病毒诸如鼠白血病病毒(mlv)的γ逆转录病毒载体是重组的。γ逆转录病毒的mlv家族包括亲嗜性、双嗜性、异嗜性和多嗜性亚家族。亲嗜性病毒能够使用mcat-1受体来仅感染鼠细胞。亲嗜性病毒的实例是莫洛尼mlv和akv。双嗜性病毒通过pit-2受体来感染鼠、人和其他物种。双嗜性病毒的一个实例是4070a病毒。异嗜性和多嗜性病毒利用相同(xpr1)受体,但在它们的物种趋性方面不同。异嗜性病毒诸如nzb-9-1感染人和其他物种而非鼠物种,而多嗜性病毒诸如灶形成性病毒(mcf)感染鼠、人和其他物种。γ逆转录病毒载体可通过用若干质粒共转染细胞来在包装细胞中产生,所述质粒包括编码逆转录病毒结构和酶(gag-pol)多聚蛋白的质粒、编码包膜(env)蛋白的质粒、和编码载体mrna的质粒,所述载体mrna包含待包装在新形成的病毒粒子中的编码本发明组合物的多核苷酸。在一些方面,重组γ逆转录病毒载体用来自其他病毒的包膜蛋白加以假型化。将包膜糖蛋白并入病毒粒子的外脂质层中,此可增加/改变细胞趋性。示例性包膜蛋白包括长臂猿白血病病毒包膜蛋白(galv)或水泡性口膜炎病毒水泡性口炎病毒g蛋白(vsv-g)、或猿猴内源性逆转录病毒包膜蛋白、或麻疹病毒h和f蛋白、或人免疫缺陷病毒gp120包膜蛋白、或科卡尔水疱病毒包膜蛋白(参见例如美国申请公布号:2012/164118;其内容以引用的方式整体并入本文)。在其他方面,包膜糖蛋白可被遗传修饰来将靶向/结合配体并入γ逆转录病毒载体中,结合配体包括但不限于肽配体、单链抗体和生长因子(waehler等,nat.rev.genet.2007,8(8):573–587;其内容以引用的方式整体并入本文)。这些经工程化的糖蛋白可使载体重靶向(retarget)表达它们的相应靶标部分的细胞。在其他方面,可引入“分子桥”以将载体导向特定细胞。分子桥具有双重特异性:一端可识别病毒糖蛋白,并且另一端可结合靶标细胞上的分子决定簇。所述分子桥例如配体-受体、亲和素-生物素、以及化学缀合、单克隆抗体和经工程化的致融合蛋白可引导病毒载体附着于靶标细胞以达成转导(yang等,biotechnol.bioeng.,2008,101(2):357-368;以及maetzig等,viruses,2011,3,677-713;其各自的内容以引用的方式整体并入本文)。在一些实施方案中,重组γ逆转录病毒载体是自失活性(sin)γ逆转录病毒载体。载体不具有复制能力。sin载体可具有3’u3区域内的初始包含增强子/启动子活性的缺失。此外,5’u3区域可用源于巨细胞病毒或rsv的强效启动子(在包装细胞系中是需要的)、或所选内部启动子、和/或增强子元件置换。可根据为达成本发明的特定目的所需的特定基因表达要求来进行对内部启动子的选择。在一些实施方案中,将编码生物回路、生物回路组分、效应物模块、sre的多核苷酸插入在重组病毒基因组内。重组γ逆转录病毒载体的病毒mrna的其他组分可通过插入或移除天然存在的序列(例如插入ires,插入编码目标多肽或抑制性核酸的异源性多核苷酸,替代野生型启动子来用来自不同逆转录病毒或病毒的更有效启动子进行改组,等)来修饰。在一些实例中,重组γ逆转录病毒载体可包含经修饰包装信号、和/或引物结合位点(pbs)、和/或在5'长末端重复序列(ltr)的u3区域中的5'增强子/启动子元件、和/或在3'-ltr的u3区域中的经修饰3'-sin元件。这些修饰可使感染的效价和能力增加。适于递送本发明的生物回路组分、效应物模块、sre或有效载荷构建体的γ逆转录病毒载体可选自美国专利号:8,828,718;7,585,676;7,351,585;美国申请公布号:2007/048285;pct申请公布号:wo2010/113037;wo2014/121005;wo2015/056014;以及欧洲专利号:ep1757702;ep1757703中公开的那些(所述专利各自的内容以引用的方式整体并入本文)。3.腺相关病毒载体(aav)在一些实施方案中,本发明的多核苷酸可被包装至重组腺相关病毒(raav)载体中。所述载体或病毒粒子可被设计来利用任何已知血清型衣壳或血清型衣壳的组合。血清型衣壳可包括来自任何经鉴定aav血清型的衣壳及其变体,例如aav1、aav2、aav2g9、aav3、aav4、aav4-4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12和aavrh10。在一个实施方案中,aav血清型可为或具有如以引用的方式整体并入本文的美国公布号us20030138772中所述的序列,诸如但不限于aav1(us20030138772的seqidno:6和64)、aav2(us20030138772的seqidno:7和70)、aav3(us20030138772的seqidno:8和71)、aav4(us20030138772的seqidno:63)、aav5(us20030138772的seqidno:114)、aav6(us20030138772的seqidno:65)、aav7(us20030138772的seqidno:1-3)、aav8(us20030138772的seqidno:4和95)、aav9(us20030138772的seqidno:5和100)、aav10(us20030138772的seqidno:117)、aav11(us20030138772的seqidno:118)、aav12(us20030138772的seqidno:119)、aavrh10(us20030138772的seqidno:81的氨基酸1至738)或其变体。变体的非限制性实例包括us20030138772的seqidno:9、27-45、47-62、66-69、73-81、84-94、96、97、99、101-113,所述专利的内容以引用的方式整体并入本文。在一个实施方案中,aav血清型可具有如pulicherla等(moleculartherapy,2011,19(6):1070-1078),美国专利号:6,156,303;7,198,951;美国专利公布号:us2015/0159173和us2014/0359799;以及国际专利公布号:wo1998/011244、wo2005/033321和wo2014/14422中所述的序列;所述文献和专利各自的内容以引用的方式整体并入本文。aav载体不仅包括单链载体,而且包括自身互补性aav载体(scaav)。scaav载体含有一起退火以形成双链载体基因组的dna。通过跳过第二链合成,scaav允许在细胞中快速表达。raav载体可通过本领域中的标准方法来制造,诸如通过在sf9昆虫细胞中或在人细胞诸如hek293细胞的悬浮细胞培养物中进行三重转染。生物回路、生物回路组分、效应物模块、sre或有效载荷构建体可在一个或多个病毒基因组中被编码以包装在本文教导的aav衣壳中。除至少一个或两个itr(反向末端重复序列)之外,所述载体或病毒基因组也可包括某些为从载体或病毒基因组进行表达所必需的调控元件。所述调控元件在本领域中是熟知的,并且包括例如启动子、内含子、间隔体、填充序列等。在一些实施方案中,超过一个效应物模块或sre(例如dd)可在病毒基因组中被编码。4.溶瘤性病毒载体在一些实施方案中,本发明的多核苷酸可被包装至溶瘤性病毒诸如疫苗病毒中。溶瘤性疫苗病毒可包括足以诱导对肿瘤中的细胞的溶瘤作用的胸苷激酶(tk)缺陷性、粒细胞巨噬细胞(gm)集落刺激因子(csf)表达性、有复制能力的痘苗病毒载体的病毒粒子(例如美国专利号:9,226,977)。在一些实施方案中,本发明的病毒载体可包含两种或更多种本文教导的免疫治疗剂,其中所述两种或更多种免疫治疗剂可被包括在一个效应物模块中,受同一dd调控。在这个情况下,两种或更多种免疫治疗剂由同一刺激物同时调谐。在其他实施方案中,本发明的病毒载体可包含两个或更多个效应物模块,其中各效应物模块包含不同免疫治疗剂。在这个情况下,两个或更多个效应物模块和免疫治疗剂由不同刺激物调谐,从而单独提供对两个或更多个组分的独立调控。5.信使rna(mrna)在一些实施方案中,本发明的效应物模块可被设计成信使rna(mrna)。如本文所用,术语“信使rna”(mrna)是指编码目标多肽,并且能够在体外、在体内、原位或离体被翻译以产生所编码目标多肽的任何多核苷酸。所述mrna分子可具有国际申请号pct/us2013/030062中教导的那些mrna分子中的任一者的结构组分或特征,所述申请的内容以引用的方式整体并入本文。本发明的多核苷酸也可如例如以下中所教导来设计:ribostem有限公司于2003年7月9日提交的英国专利申请序列号0316089.2(现已放弃)、2004年7月9日提交的以wo2005005622公布的pct申请号pct/gb2004/002981、2006年6月8日提交的以us20060247195公布的美国专利申请国家阶段进入序列号10/563,897(现已放弃)和2004年7月9日提交的以ep1646714公布的欧洲专利申请国家阶段进入序列号ep2004743322(现已撤回)中;novozymes股份有限公司于2007年12月19日提交的以wo2008140615公布的pct申请号pct/us2007/88060、2009年7月2日提交的以us20100028943公布的美国专利申请国家阶段进入序列号12/520,072和2009年7月7日提交的以ep2104739公布的欧洲专利申请国家阶段进入序列号ep2007874376中;罗切斯特大学(universityofrochester)于2006年12月4日提交的以wo2007064952公布的pct申请号pct/us2006/46120和2006年12月1日提交的以us20070141030公布的美国专利申请序列号11/606,995中;biontech股份有限公司于2007年12月14日提交的欧洲专利申请序列号ep2007024312(现已放弃)、2008年12月12日提交的以wo2009077134公布的pct申请号pct/ep2008/01059、2010年6月2日提交的以ep2240572公布的欧洲专利申请国家阶段进入序列号ep2008861423、2010年11月24日提交的以us20110065103公布的美国专利申请国家阶段进入序列号12/,735,060、2005年9月28日提交的德国专利申请序列号de102005046490、2006年9月28日提交的以wo2007036366公布的pct申请pct/ep2006/0448、2012年3月21日公布的国家阶段欧洲专利ep1934345和2009年8月14日提交的以20100129877公布的国家阶段美国专利申请序列号11/992,638中;immunediseaseinstitute股份有限公司于2011年4月15日提交的以us20120046346公布的美国专利申请序列号13/088,009和2011年4月15日提交的以wo20110130624公布的pct申请pct/us2011/32679中;shirehumangenetictherapeutics于2010年11月20日提交的以us20110244026公布的美国专利申请序列号12/957,340中;sequitur股份有限公司于1998年9月18日提交的以wo1999014346公布的pct申请pct/us1998/019492中;scrippsresearchinstitute于2010年2月24日提交的以wo2010098861公布的pct申请号pct/us2010/00567和2011年11月3日提交的以us20120053333公布的美国专利申请国家阶段进入序列号13/203,229中;路德维希-马克西米利安大学(ludwig-maximilliansuniversity)于2010年7月30日提交的以wo2011012316公布的pct申请号pct/ep2010/004681中;cellscript股份有限公司于2008年6月30日提交,并且2011年10月18日授予的美国专利号8,039,214、美国专利申请序列号12/962,498(2010年12月7日提交,以us20110143436公布)、12/962,468(2010年12月7日提交,以us20110143397公布)、13/237,451(2011年9月20日提交,以us20120009649公布)以及pct申请pct/us2010/59305(2010年12月7日提交,以wo2011071931公布)和pct/us2010/59317(2010年12月7日提交,以wo2011071936公布)中;宾夕法尼亚大学校董会(thetrusteesoftheuniversityofpennsylvania)于2006年8月21日提交的以wo2007024708公布的pct申请号pct/us2006/32372和2009年3月27日提交的以us20090286852公布的美国专利申请国家阶段进入序列号11/990,646中;curevac有限责任公司于德国专利申请序列号de102001027283.9(2001年6月5日提交)、de102001062480.8(2001年12月19日提交)和de202006051516(2006年10月31日提交)(全都已放弃)、欧洲专利号ep1392341(2005年3月30日授予)和ep1458410(2008年1月2日授予)、pct申请号pct/ep2002/06180(2002年6月5日提交,以wo2002098443公布)、pct/ep2002/14577(2002年12月19日提交,以wo2003051401公布)、pct/ep2007/09469(2007年12月31日提交,以wo2008052770公布)、pct/ep2008/03033(2008年4月16日提交,以wo2009127230公布)、pct/ep2006/004784(2005年5月19日提交,以wo2006122828公布)、pct/ep2008/00081(2007年1月9日提交,以wo2008083949公布)以及美国专利申请序列号10/729,830(2003年12月5日提交,以us20050032730公布)、10/870,110(2004年6月18日提交,以us20050059624公布)、11/914,945(2008年7月7日提交,以us20080267873公布)、12/446,912(2009年10月27日提交,以us2010047261公布)(现已放弃)、12/522,214(2010年1月4日提交,以us20100189729公布)、12/787,566(2010年5月26日提交,以us20110077287公布)、12/787,755(2010年5月26日提交,以us20100239608公布)、13/185,119(2011年7月18日提交,以us20110269950公布)和13/106,548(2011年5月12日提交,以us20110311472公布)中,所述专利全都以引用的方式整体并入本文。在一些实施方案中,效应物模块可被设计成自扩增rna。如本文所用的“自扩增rna”是指可在宿主中复制,从而导致rna和由rna编码的蛋白质的量增加的rna分子。所述自扩增rna可具有国际专利申请公布号wo2011005799中教导的那些自扩增rna中的任一者的结构特征或组分(所述专利的内容以引用的方式整体并入本文)。v.给药、递送和施用本发明组合物可通过一种或多种途径和模态来递送至细胞或受试者中。含有一种或多种本文所述的效应物模块、sre、免疫治疗剂和其他组分的病毒载体可用于将它们递送至细胞和/或受试者中。也可使用其他模态,诸如mrna、质粒,以及以重组蛋白形式使用。1.向细胞中递送在本发明的另一方面,可将编码本发明的生物回路、效应物模块、sre(例如dd)、目标有效载荷(免疫治疗剂)和组合物的多核苷酸和包含所述多核苷酸的载体引入细胞诸如免疫效应细胞中。在本发明的一个方面,编码本发明的生物回路、效应物模块、sre(例如dd)、目标有效载荷(免疫治疗剂)和组合物的多核苷酸可被包装至病毒载体中或整合至病毒基因组中,从而允许短暂或稳定表达多核苷酸。优选病毒载体是逆转录病毒载体,包括慢病毒载体。为构建逆转录病毒载体,将编码生物回路、效应物模块、dd或目标有效载荷(即免疫治疗剂)的多核苷酸分子代替某些病毒序列来插入病毒基因组中以产生复制缺陷性病毒。接着将重组病毒载体引入含有gag、pol和env基因,但不具有ltr和包装组分的包装细胞系中。使重组逆转录病毒粒子分泌至培养基中,接着收集,任选加以浓缩,并且用于基因转移。慢病毒载体是尤其优选的,因为它们能够感染分裂细胞与非分裂细胞两者。载体也可通过非病毒方法,用物理方法诸如针、电穿孔、声致穿孔、流体动力穿孔;化学载体诸如无机粒子(例如磷酸钙、二氧化硅、金)和/或化学方法来转移至细胞中。在一些实施方案中,合成或天然生物可降解剂可用于递送,所述生物可降解剂诸如阳离子脂质、脂质纳米乳液、纳米粒子、基于肽的载体、或基于聚合物的载体。在一些实施方案中,本发明的多肽可被直接递送至细胞中。在一个实施方案中,本发明的多肽可使用包含内体渗漏结构域(eld)融合于细胞穿透结构域(cld)的合成肽来递送。将本发明的多肽与eld-cld合成肽一起共引入细胞中。eld有助于圈闭在内体中的蛋白质逃逸至胞质液中。所述结构域源于微生物和病毒来源的蛋白质,并且已在本领域中加以描述。cpd允许蛋白质跨越质膜进行运输,并且也已在本领域中加以描述。当相较于与任一单独结构域一起共转导时,eld-cld融合蛋白以协同方式使转导效率增加。在一些实施方案中,作为允许运载物从内体逃逸至胞质液中的另一方法,可任选将富含组氨酸的结构域添加至穿梭构建体中。穿梭体也可在n末端或c末端包括半胱氨酸残基以产生融合肽的多聚体。当相较于单融合肽构建体时,通过将半胱氨酸残基添加至肽的末端中来产生的eld-cld融合肽多聚体显示甚至更大的转导效率。本发明的多肽也可附接于适当定位信号以将运载物导向适当亚细胞位置例如核。在一些实施方案中,国际专利公布wo2016161516和wo2017175072中教导的任何eld、cld或融合eld-cld合成肽都可适用于本发明中(所述专利各自的内容以引用的方式整体并入本文)。2.给药本发明提供包括向有需要的受试者施用任何一种或多种用于免疫疗法的组合物的方法。这些组合物可使用有效预防或治疗临床疾患诸如癌症、感染疾病和其他免疫缺陷疾病的任何量和任何施用途径来向受试者施用。本发明的组合物通常以剂量单位形式配制以易于达成剂量的施用和均一性。然而,应了解本发明组合物的总每日用量将由主治医师在合理医学判断的范围内决定。用于任何特定患者的特定治疗有效或防治有效剂量水平都将取决于多种因素,包括所治疗的病症和病症的严重性;所用特定化合物的活性;所用特定组合物;患者的年龄、体重、总体健康状况、性别和膳食;所用特定化合物的施用时间、施用途径、先前或并行治疗干预以及排泄速率;治疗的持续时间;与所用特定化合物组合或同时使用的药物;以及医学领域中熟知的类似因素。本发明组合物可以不同剂量用于避免t细胞无反应性,预防细胞因子释放综合征,以及使与免疫疗法相关的毒性最小化。举例来说,低剂量的本发明组合物可用于初始治疗具有高肿瘤负荷的患者,而具有低肿瘤负荷的患者可用较高和重复剂量的本发明组合物治疗以确保识别最小肿瘤抗原负荷。在另一情况下,本发明组合物可以脉冲方式递送以使滋养t细胞信号传导降低,并且使体内持久性增强。在一些方面,可通过以下方式来使毒性最小化:初始使用低剂量的本发明组合物,随后施用高剂量。如果血清标志物诸如铁蛋白(ferritin)、血清c反应蛋白、il6、ifnγ和tnf-α升高,那么可修改给药。在一个实施方案中,向有需要的受试者施用表达本文所述的组合物例如效应物模块的多肽和/或多核苷酸以治疗癌症。在一个实施方案中,向有需要的受试者施用包含本文所述的生物回路、效应物模块和/或sre的细胞群体以治疗癌症。在一个实施方案中,在本文所述的剂量和/或给药时程下施用表达本文所述的组合物的细胞。在一个实施方案中,将组合物引入免疫细胞(例如t细胞、nk细胞)中。组合物可通过包括但不限于病毒转导、转染和/或体外转录的方法来引入免疫细胞中。在一些实施方案中,用逆转录病毒对免疫细胞进行转导。在一个方面,逆转录病毒可为慢病毒。在一些方面,慢病毒的效价可用于调谐有效载荷的表达。在一些实施方案中,慢病毒的效价可具有在0.001-0.01、0.01-0.1、0.1-1、或1-10的范围内的感染复数(moi)。在一些实施方案中,moi可为1、2、3、4、5、6、7、8、9或10。在一些实施方案中,受试者(例如人)接受用包含本文所述的组合物例如sre的免疫细胞进行的初始施用,以及一次或多次后续细胞施用。在一些实施方案中,可向受试者施用治疗有效量的本文所述的组合物和/或细胞。在一些实施方案中,治疗有效量可指示为抑制肿瘤,降低肿瘤流行和/或肿瘤负荷所需的精确量。治疗有效量可在考虑受试者的年龄、重量、肿瘤尺寸、性别、感染或转移程度的情况下确定。在一些实施方案中,表达本文所述的组合物的细胞可在每kg受试者体重104至109个细胞的剂量下施用。细胞可通过使用免疫疗法中通常已知的输注技术来施用(参见例如rosenberg等,neweng.j.ofmed.319:1676,1988;其内容以引用的方式整体并入本文)。在一些方面,受试者可经受白细胞单采术,其中离体收集、富集或消减白细胞以选择和/或分离目标细胞例如t细胞。这些t细胞分离物可通过本领域中已知的方法来扩增并处理以使本发明组合物可被引入细胞中。有需要的受试者可随后经受用高剂量化学疗法继之以外周血液干细胞移植进行的标准治疗。在某些方面,在移植之后或与移植并行,受试者接受本发明的免疫细胞的输注。在另一方面,在手术之前或之后施用经扩增细胞。以上治疗的待向患者施用的剂量将随所治疗的疾患的确切性质和治疗的接受者而变化。可根据本领域接受的规范对用于向人施用的剂量进行缩放。在一个实施方案中,例如使用体外转录来将组合物引入免疫细胞(例如t细胞、nk细胞)中,并且受试者(例如人)接受用本发明的免疫细胞(例如t细胞、nk细胞)进行的初始施用,以及用本发明的免疫细胞(例如t细胞、nk细胞)进行的一次或多次后续施用,其中所述一次或多次后续施用在前次施用之后小于15天,例如14、13、12、11、10、9、8、7、6、5、4、3或2天施用。在一个实施方案中,每周向受试者(例如人)施用超过一次用本发明的免疫细胞(例如t细胞、nk细胞)进行的施用,例如每周施用2、3或4次用本发明的免疫细胞(例如t细胞、nk细胞)进行的施用。在一个实施方案中,受试者(例如人受试者)每周接受超过一次用免疫细胞(例如t细胞、nk细胞)进行的施用(例如每周2、3或4次施用)(在本文中也称为循环),继之以一周不施用免疫细胞(例如t细胞、nk细胞),接着向受试者施用一次或多次用免疫细胞(例如t细胞、nk细胞)进行的额外施用(例如每周超过一次用免疫细胞(例如t细胞、nk细胞)进行的施用)。在另一实施方案中,受试者(例如人受试者)接受超过一个循环的免疫细胞(例如t细胞、nk细胞),并且各循环之间的时间小于10、9、8、7、6、5、4或3天。在一个实施方案中,每隔一天施用免疫细胞(例如t细胞、nk细胞)以达成每周3次施用。在一个实施方案中,持续至少两周、三周、四周、五周、六周、七周、八周或更多周施用本发明的免疫细胞(例如t细胞、nk细胞)。在一些实施方案中,表达本文所述的本发明组合物的免疫细胞的剂量包括约1x106、1.1x106、2x106、3.6x106、5x106、1x107、1.8x107、2x107、5x107、1x108、2x108、3x108、或5x108个细胞/kg。在一些实施方案中,免疫细胞的剂量包括至少约1x106、1.1x106、2x106、3.6x106、5x106、1x107、1.8x107、2x107、5x107、1x108、2x108、3x108、或5x108个细胞/kg。在一些实施方案中,免疫细胞的剂量包括多达约1x106、1.1x106、2x106、3.6x106、5x106、1x107、1.8x107、2x107、5x107、1x108、2x108、3x108、或5x108个细胞/kg。在一些实施方案中,免疫细胞的剂量包括约1.1x106-1.8x107个细胞/kg。在一些实施方案中,免疫细胞的剂量包括约1x107、2x107、5x107、1x108、2x108、3x108、5x108、1x109、2x109、或5x109个细胞。在一些实施方案中,免疫细胞的剂量包括至少约1x107、2x107、5x107、1x108、2x108、3x108、5x108、1x109、2x109、或5x109个细胞。在一些实施方案中,免疫细胞的剂量包括多达约1x107、2x107、5x107、1x108、2x108、3x108、5x108、1x109、2x109、或5x109个细胞。在一些实施方案中,免疫细胞的剂量包括多达约1x107、1.5x107、2x107、2.5x107、3x107、3.5x107、4x107、5x107、1x108、1.5x108、2x108、2.5x108、3x108、3.5x108、4x108、5x108、1x109、2x109、或5x109个细胞。在一些实施方案中,免疫细胞的剂量包括多达约1-3x107至1-3x108个细胞。在一个实施方案中,表达本文所述的组合物的细胞作为针对疾病例如癌症例如本文所述的癌症的第一线治疗加以施用。在另一实施方案中,表达本文所述的组合物的细胞作为针对疾病例如癌症例如本文所述的癌症的第二线、第三线、第四线治疗加以施用。在一些实施方案中,受试者可在细胞施用之前经受预先调节。本文也提供向有需要的受试者施用本发明的配体的方法。配体可使用有效调谐本发明的生物回路的任何量和任何施用途径来向受试者或向细胞施用。视受试者的物种、年龄和总体状况、疾病的严重性、特定组合物、它的施用模式、它的活性模式等而定,所需精确量将在受试者与受试者之间不同。受试者可为人、哺乳动物或动物。本发明的组合物通常以单位剂型配制以易于达成剂量的施用和均一性。然而,应了解本发明组合物的总每日用量将由主治医师在合理医学判断的范围内决定。在某些实施方案中,本发明的配体可在以下剂量水平下施用,所述剂量水平足以在一天一次或多次的情况下每天递送每kg受试者体重约0.0001mg至约100mg、约0.001mg至约0.05mg、约0.005mg至约0.05mg、约0.001mg至约0.005mg、约0.05mg至约0.5mg、约0.01mg至约50mg、约0.1mg至约40mg、约0.5mg至约30mg、约0.01mg至约10mg、约0.1mg/至约10mg、或约1mg至约25mg、约10mg至约100mg、约50mg至约500mg、约100mg至约1000mg,以获得所需作用。在一些实施方案中,剂量水平可为分成一天一次或多次的每天每kg受试者体重1mg、5mg、10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg、100mg、100mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg或mg,以获得所需作用。本公开提供用于向细胞或组织递送任何本文所述的配体的方法,所述方法包括使所述细胞或组织与所述配体接触,并且可在体外、离体或在体内实现。在某些实施方案中,本发明的配体可在足以递送约1nm至约10nm、约5nm至约50nm、约10nm至约100nm、约50nm至约500nm、约100nm至约1000nm、约1μm至约10μm、约5μm至约50μm、约10μm至约100μm、约25μm至约250μm、约50μm至约500μm的剂量水平下向细胞施用。在一些实施方案中,配体可在选自但不限于0.0064μm、0.0032μm、0.016μm、0.08μm、0.4μm、1μm、2μm、5μm、10μm、25μm、50μm、75μm、100μm、150μm、200μm、250μm的剂量下向细胞施用。本发明的配体的所需剂量可仅一次、一天三次、一天两次、一天一次、每隔一天、每三天、每周、每两周、每三周、或每四周加以递送。在某些实施方案中,可使用多次施用(例如两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次、十二次、十三次、十四次或更多次施用)来递送所需剂量。当采用多次施用时,可使用分次给药方案,诸如本文所述的那些。如本文所用,“分次剂量”是将“单一单位剂量”或总每日剂量分成两次或更多次剂量,例如分两次或更多次施用“单一单位剂量”。如本文所用,“单一单位剂量”是任何治疗剂的以一次剂量/一次/单一途径/单一接触点,即以单一施用事件施用的剂量。本发明的配体的所需剂量可以“脉冲剂量”形式或以“连续流”形式施用。如本文所用,“脉冲剂量”是任何治疗剂的以固定频率历经一段时期加以施用的一系列单一单位剂量。如本文所用,“连续流”是治疗剂的以单一途径/单一接触点持续一段时期,即以连续施用事件加以连续施用的剂量。总每日剂量,即在24小时时期中给与或指定的量,可通过这些方法中的任一者,或以这些方法的组合,或通过适于药物施用的任何其他方法来施用。3.施用在一些实施方案中,用于免疫疗法的组合物可离体向细胞施用,并且随后向受试者施用。免疫细胞可使用本领域中已知的多种方法来分离和离体扩增。举例来说,分离细胞毒性t细胞的方法描述于美国专利号6,805,861和6,531,451中;所述专利各自的内容以引用的方式整体并入本文。对nk细胞的分离描述于美国专利号:7,435,596中;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,视细胞的性质而定,细胞可以广泛多种方式引入宿主生物体例如哺乳动物中,所述方式包括通过注射、输液、输注、局部滴注或植入。在一些方面,本发明的细胞可被引入在肿瘤部位处。采用的细胞的数目将取决于许多事项,即引入目的、细胞的寿命、待使用的方案例如施用次数、细胞繁殖的能力等。细胞可处于生理上可接受的培养基中。在一些实施方案中,本发明的细胞可以多次剂量向患有疾病或疾患的受试者施用。施用通常实现癌症或临床疾患的一种或多种症状的改进,和/或治疗或预防癌症或临床疾患或其症状。在一些实施方案中,用于免疫疗法的组合物可在体内施用。在一些实施方案中,包含本发明的生物回路、效应物分子、sre、目标有效载荷(免疫治疗剂)和组合物的本发明的多肽可在体内向受试者递送。免疫治疗剂的体内递送在本领域中得以充分描述。举例来说,细胞因子的递送方法描述于欧洲专利号:ep0930892a1中,所述专利的内容以引用的方式并入本文。递送途径本发明的药物组合物、生物回路、生物回路组分、包括它们的sre(例如dd)的效应物模块、有效载荷(即免疫治疗剂)、载体和细胞可通过用以实现治疗有效结果的任何途径来施用。这些途径包括但不限于经肠(向肠中)、胃肠、硬膜外(向硬脑膜中)、口服(经口)、经皮、硬膜外、脑内(向脑中)、脑室内(向脑室中)、上皮(施加于皮肤上)、真皮内(向皮肤自身中)、皮下(皮肤下)、经鼻施用(经由鼻)、静脉内(向静脉中)、静脉内团注、静脉内滴注、动脉内(向动脉中)、肌肉内(向肌肉中)、颅内(向心脏中)、骨内输注(向骨髓中)、鞘内(向脊髓管中)、腹膜内(向腹膜中输注或注射)、脊柱内输注、玻璃体内(经由眼)、静脉内注射(向病理性空腔中)、腔内(向阴茎的基底中)、阴道内施用、子宫内、羊膜外施用、经皮(穿过完整皮肤进行扩散以达成全身性分布)、经粘膜(穿过粘膜进行扩散)、经阴道、吹入(鼻吸)、舌下、唇下、灌肠剂、滴眼剂(于结膜上)、以滴耳剂、经耳(在耳中或经由耳)、经颊(向着面颊)、经结膜、经皮肤、经牙(向一颗或多颗牙齿)、电渗、子宫颈内、窦内、气管内、体外、血液透析、浸润、经间质、腹内、羊膜内、关节内、胆囊内、支气管内、囊内、软骨内(在软骨内)、尾部内(在马尾内)、脑池内(在小脑延髓大池内)、角膜内(在角膜内)、牙冠内、冠脉内(在冠状动脉内)、海绵体内(在阴茎的海绵体的可膨胀间隙内)、椎间盘内(在椎间盘内)、导管内(在腺体的导管内)、十二指肠内(在十二指肠内)、硬膜内(在硬膜内或下方)、表皮内(向表皮)、食道内(向食道)、胃内(在胃内)、齿龈内(在齿龈内)、回肠内(在小肠的远侧部分内)、病变内(在局部化病变内或直接引入局部化病变中)、管腔内(在管腔内)、淋巴内(在淋巴内)、髓内(在骨的髓腔内)、脑膜内(在脑脊髓膜内)、心肌内(在心肌内)、眼内(在眼内)、卵巢内(在卵巢内)、心包内(在心包内)、胸膜内(在胸膜内)、前列腺内(在前列腺内)、肺内(在肺或它的支气管内)、脊柱内(在鼻或眶周窦内)、脊柱内(在脊柱内)、滑膜内(在关节的滑膜腔内)、腱内(在肌腱内)、睾丸内(在睾丸内)、鞘内(在脑脊髓轴的任何层面的脑脊髓液内)、胸内(在胸内)、小管内(在器官的小管内)、肿瘤内(在肿瘤内)、鼓室内(在中耳内)、血管内(在一个或多个血管内)、室内(在室内)、离子电渗(借助于电流,其中可溶性盐的离子迀移至身体的组织中)、冲洗(浸泡或冲洗开放性伤口或体腔)、经喉(直接在喉上)、鼻饲(穿过鼻并进入胃)、封闭敷裹技术(表面途径施用,接着用对区域进行封闭的敷料覆盖)、经眼(向外眼)、口咽(直接向口和咽)、胃肠外、经皮、关节周、硬膜外、神经周、牙周、经直肠、经呼吸道(在呼吸道内,通过经口或经鼻吸入以达成局部或全身作用)、眼球后(在脑桥后或在眼球后)、心肌内(进入心肌)、软组织、蛛网膜下、结膜下、粘膜下、经表面、经胎盘(穿过或跨越胎盘)、经气管(穿过气管壁)、经鼓室(跨越或穿过鼓室)、经输尿管(向输尿管)、经尿道(向尿道)、经阴道、骶管阻滞、诊断、神经阻滞、胆灌注、心脏灌注、光分离置换法或经脊柱。药盒也提供一种包括任何本文所述的多核苷酸或表达载体的药盒。本发明包括用于适宜地和/或有效地执行本发明方法的多种药盒。通常,药盒将包括足够数量和/或数目的组分以允许使用者对受试者进行一次或多次治疗和/或进行一个或多个实验。在一个实施方案中,本发明提供用于在体外或在体内抑制基因的药盒,所述药盒包括本发明的生物回路或本发明的生物回路的组合,任选与任何其他适合活性剂组合。药盒可进一步包括包装和说明书和/或递送剂以形成配制组合物。递送剂可包括例如盐水、缓冲溶液。在额外实施方案中,提供测定筛选药盒。药盒包括用于筛选测定的容器。关于测定的使用的说明书和关于筛选方法的信息将被包括在药盒中。在一些实施方案中,本发明的dd、效应物模块和生物回路系统以及组合物可作为研究工具用于探究生物系统诸如细胞和受试者中的蛋白质活性。在其他实施方案中,本发明的dd、效应物模块和生物回路系统以及组合物可用于治疗疾病诸如癌症和遗传病症。vi.应用在本发明的一个方面,提供用于使肿瘤体积或负荷降低的方法。方法包括向患有肿瘤的受试者施用药学上有效量的包含至少一种生物回路系统、效应物模块、dd和/或目标有效载荷(即免疫治疗剂)、至少一种载体、或细胞的药物组合物。具有如本文所述的任何免疫治疗剂的生物回路系统和效应物模块可呈多肽、或多核苷酸诸如mrna、或包含所述多核苷酸的病毒载体、或被修饰来表达生物回路、效应物模块、dd和目标有效载荷(即免疫治疗剂)的细胞的形式。在本发明的另一方面,提供用于在受试者中诱导抗肿瘤免疫应答的方法。方法包括向患有肿瘤的受试者施用药学上有效量的包含至少一种生物回路系统、效应物模块、dd和/或目标有效载荷(即免疫治疗剂)、至少一种载体、或细胞的药物组合物。具有如本文所述的任何免疫治疗剂的生物回路和效应物模块可呈多肽、或多核苷酸诸如mrna、或包含所述多核苷酸的病毒载体、或被修饰来表达生物回路、效应物模块、dd和目标有效载荷(即免疫治疗剂)的细胞的形式。本发明的方法可为使用经遗传工程化细胞诸如本发明的免疫效应细胞进行的过继性细胞转移(act),包含本发明的生物回路系统、效应物模块、dd、目标有效载荷(即免疫治疗剂)的癌症疫苗,或对肿瘤免疫抑制性微环境进行操作的组合物,或其组合。这些治疗可进一步与其他癌症治疗诸如化学疗法和放射疗法一起采用。1.过继性细胞转移(过继性免疫疗法)在癌症免疫学领域的新近进展已允许开发若干方法来帮助免疫系统保持癌症陷入绝境。所述免疫治疗方法包括通过单克隆抗体或通过过继性转移经离体工程化t细胞(例如其含有嵌合抗原受体或经工程化的t细胞受体)来靶向癌症抗原。本发明也提供用于使用本发明组合物来在受试者中诱导免疫应答的方法。也提供用于使用本发明组合物来使受试者中的肿瘤负荷降低的方法。本发明也提供被工程化来包括一种或多种本发明的多肽、多核苷酸或载体的免疫细胞。细胞可为免疫效应细胞,包括t细胞诸如细胞毒性t细胞、辅助t细胞、记忆t细胞、调控性t细胞,天然杀伤(nk)细胞、nkt细胞、细胞因子诱导的杀伤(cik)细胞、细胞毒性t淋巴细胞(ctl)和肿瘤浸润性淋巴细胞(til)。经工程化的细胞可用于过继性细胞转移以治疗疾病(例如癌症)。在一些实施方案中,本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷可用于调节或改变或利用免疫系统以靶向一种或多种癌症。这个方法也可与其他所述生物方法一起考虑,例如免疫应答调节疗法诸如施用干扰素、白介素、集落刺激因子、其他单克隆抗体、疫苗、基因疗法和非特异性免疫调节剂也被设想为待与本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷组合的抗癌疗法。癌症免疫疗法是指被设计来诱导患者的自身免疫系统对抗癌症的一组不同治疗策略。在一些实施方案中,本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷被设计成免疫肿瘤学治疗剂。在一些实施方案中,被遗传修饰来表达至少一种生物回路系统、效应物模块、dd和/或目标有效载荷(免疫治疗剂)的细胞可用于过继性细胞疗法(act)。如本文所用,过继性细胞转移是指施用具有定向抗癌活性的免疫细胞(来自自体、同种异体或经遗传修饰宿主)。act已在针对恶性和感染性疾病的临床应用中显示前景。举例来说,被遗传工程化来识别cd19的t细胞已用于治疗滤泡性b细胞淋巴瘤(kochenderfer等,blood,2010,116:4099-4102;以及kochenderfer和rosenberg,natrevclinoncol.,2013,10(5):267-276),并且使用被遗传修饰来表达抗肿瘤t细胞受体的自体淋巴细胞的act已用于治疗转移性黑素瘤(rosenberg和dudley,curr.opin.immunol.2009,21:233-240)。用于过继性细胞疗法的免疫细胞可选自但不限于cd8+t细胞、cd4+t细胞、辅助t细胞、天然杀伤(nk)细胞、nkt细胞、细胞毒性t淋巴细胞(ctl)、肿瘤浸润性淋巴细胞(til)、记忆t细胞、调控性t(treg)细胞、细胞因子诱导的杀伤(cik)细胞、树突细胞、人胚胎干细胞、间质干细胞、造血干细胞或其混合物。存在若干类型的细胞免疫疗法,包括肿瘤浸润性淋巴细胞(til)疗法、携带嵌合抗原受体(car)的经遗传工程化t细胞、以及重组tcr技术。在一些实施方案中,本发明组合物可用于改变受试者中的til(肿瘤浸润性淋巴细胞)群体。在一个实施方案中,本文所述的任何有效载荷都可用于改变cd4阳性细胞与cd8阳性群体的比率。在一些实施方案中,til可加以离体分选并被工程化来表达任何本文所述的细胞因子。本发明的有效载荷可用于使til的cd4和/或cd8群体扩增以使til介导的免疫应答增强。在一个实施方案中,本发明的嵌合抗原受体(car)可为条件性活性car。野生型蛋白质或其结构域诸如本文所述的那些可用于产生在野生型正常生理条件下被可逆地或不可逆地失活的条件性活性生物蛋白质,以及提供了所述条件性活性生物蛋白质和结构域以及所述条件性活性生物蛋白质和结构域的用途。所述方法和条件性活性蛋白质在例如国际公布号wo2016033331中教导,所述公布的内容以引用的方式整体并入本文。作为一非限制性实例,car包含至少一个从野生型蛋白质或其结构域进化的抗原特异性靶向区域,并且包含以下中的一者或多者:相较于野生型蛋白质或其结构域的抗原特异性靶向区域,在正常生理条件下在测定中的活性降低;以及相较于野生型蛋白质或其结构域的抗原特异性靶向区域,在异常条件下在测定中的活性增加。根据本发明,生物回路和系统可用于开发和实施细胞疗法诸如过继性细胞疗法。适用于细胞疗法中的某些效应物模块在图7-图12中给出。生物回路、它们的组分、效应物模块以及它们的sre和有效载荷可在细胞疗法中用于实现tcr移除-tcr基因破坏、tcr工程化,用于调控表位标签化受体,在用于刺激t细胞的apc平台中使用,用作用以使离体apc刺激增强的工具,用于使t细胞扩增的方法改进,用于以抗原进行的离体刺激中,用于tcr/car组合中,用于对til的操作或调控中,用于同种异体细胞疗法中,用于与其他治疗方式(例如放射、细胞因子)的组合t细胞疗法中,用于编码经工程化的tcr或经修饰tcr,或用于使t细胞在除tcr以外的方面增强(例如通过引入细胞因子基因;pd1、ctla4检查点抑制剂的基因)。在一些实施方案中,获得改进的响应率,以支持细胞疗法。细胞群体的扩增和持久性可通过调控或精细调谐有效载荷来实现,所述有效载荷例如是t细胞、nk细胞或其他免疫相关细胞中的受体或路径组分。在一些实施方案中,生物回路、它们的组分、sre或效应物模块被设计来在空间上和/或在时间上控制使t细胞或nk细胞应答增强的蛋白质的表达。在一些实施方案中,生物回路、它们的组分、sre或效应物模块被设计来在空间上和/或在时间上控制抑制t细胞或nk细胞应答的蛋白质的表达。本文提供用于过继性细胞疗法中的方法。方法涉及预先调节有需要的受试者,用本发明的sre、生物回路和组合物调节免疫细胞,向受试者施用表达本发明组合物的经工程化的免疫细胞以及在受试者内成功移入经工程化的细胞。在一些实施方案中,本发明的sre、生物回路和组合物可用于使与过继性细胞疗法相关的预先调节方案缩减至最低程度。如本文所用,“预先调节”是指向受试者施用以使过继性细胞疗法的结果改进的任何治疗方案。预先调节策略包括但不限于全身照射和/或淋巴细胞消减性化学疗法。不进行预先调节的过继性疗法临床试验已未能显示任何临床益处,从而指示它在act中的重要性。然而,预先调节与重大毒性相关联,并且使适于act的受试者群组受限。在一些情况下,用于act的免疫细胞可被工程化来表达细胞因子诸如il12和il15作为在使用本发明的sre的情况下的有效载荷,以使对预先调节的需要降低(pengram等(2012)blood119(18):4133-41;其内容以引用的方式整体并入本文)。在一些实施方案中,神经毒性可与car或til疗法相关联。所述神经毒性可与cd19-car相关联。毒性可归因于t细胞向脑中的过度浸润。在一些实施方案中,神经毒性可通过预防t细胞迁移穿过血脑屏障来缓和。这可通过对内源性α-4整合素进行靶向基因缺失来实现,诸如泰萨布里(tysabri)/那他珠单抗(natalizumab)的抑制剂也可适用于本发明中。在一些实施方案中,效应物模块可编码一种或多种细胞因子。在一些实施方案中,细胞因子是il15。编码il15的效应物模块可被设计来诱导细胞毒性群体的增殖,并且避免对treg的刺激。在其他情况下,诱导细胞毒性群体的增殖的效应物模块也可刺激nk和nkt细胞。在一些实施方案中,效应物模块可编码或被调谐或诱导来产生一种或多种用于在本发明的生物回路的情况下达成细胞扩增的细胞因子。在所述情况下,可测试细胞的实际扩增。扩增可为至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或更大。在一些实施方案中,肿瘤微环境可使用含有编码il17的效应物模块的生物回路来重塑。在一些实施方案中,生物回路、它们的组分、sre或效应物模块被设计来调节treg以减弱自体免疫病症。在这种情况下,il2可使用如本文所述的受单一调谐的模块或具有受多重调谐的特征的模块来调控。在一些实施方案中,用于act的免疫细胞可为树突细胞、t细胞诸如cd8+t细胞和cd4+t细胞、天然杀伤(nk)细胞、nkt细胞、细胞毒性t淋巴细胞(ctl)、肿瘤浸润性淋巴细胞(til)、淋巴因子活化的杀伤(lak)细胞、记忆t细胞、调控性t细胞(treg)、辅助t细胞、细胞因子诱导的杀伤(cik)细胞及其任何组合。在其他实施方案中,用于act的免疫刺激性细胞可从胚胎干细胞(esc)和诱导多能干细胞(ipsc)产生。在一些实施方案中,自体或同种异体免疫细胞用于act。在一些实施方案中,用于act的细胞可为被工程化来表达具有新型特异性的t细胞受体(tcr)或包含对目标肿瘤细胞上的抗原具有特异性的抗原结合结构域的car的t细胞。在其他实施方案中,用于act的细胞可为被工程化来表达包含对目标肿瘤细胞上的抗原具有特异性的抗原结合结构域的car的nk细胞。除过继性转移用于免疫疗法的经遗传修饰t细胞(例如cart细胞)之外,单独或与cart细胞组合的替代类型的car表达性白细胞也可用于过继性免疫疗法。在一个实例中,t细胞和nk细胞的混合物可用于act。根据本发明,t细胞和nk细胞中的car的表达水平由结合在效应物模块中可操作地连接于car的dd的小分子调谐和控制。在一些实施方案中,被工程化来表达本发明组合物的nk细胞可用于act。nk细胞活化会诱导靶标细胞的穿孔素/粒酶依赖性凋亡。nk细胞活化也会诱导细胞因子分泌,诸如ifnγ、tnf-α和gm-csf。这些细胞因子使巨噬细胞的吞噬功能以及它们的抗微生物活性增强,并且通过上调由抗原呈递细胞诸如树突细胞(dc)达成的抗原呈递来加强适应性免疫应答(由vivier等,nat.immunol.,2008,9(5):503-510综述)。遗传修饰的其他实例可包括引入嵌合抗原受体(car)以及使抑制性nk细胞受体诸如nkg2a下调。car的实例包括但不限于针对b细胞恶性肿瘤的cd19和cd20特异性car、靶向白血病细胞上的cd33的car、关于骨髓瘤细胞的cs1car和cd138car、关于神经母细胞瘤细胞的gd2car、关于乳腺癌细胞的her2/neu和erbb2car、关于结肠癌的癌胚抗原(cea)car、关于上皮肿瘤的epcamcar、关于黑素瘤的gpa7car、关于白血病和实体肿瘤的nkg2d配体car、以及关于各种肿瘤靶标的trailr1car。car可为效应物模块的poi,并且通过dd与它的相应配体的结合来调控。在另一实例中,用于act的nk细胞可被修饰来表达包含高亲和力cd16-158v多态性(ha-cd16)的效应物模块,所述多态性使nk细胞介导的针对肿瘤的抗体依赖性细胞细胞毒性(adcc)加强。输注被遗传修饰来表达ha-cd16的nk细胞可用作用以使基于抗体的疗法用于癌症患者的功效改进的策略。nk细胞也可被遗传重新编程来规避在与肿瘤细胞相互作用后的nk细胞抑制性信号。举例来说,使用crispr、zfn或talen来遗传修饰nk细胞以使它们的抑制性受体沉默可使nk细胞的抗肿瘤能力增强。免疫细胞可使用本领域中已知的多种方法来分离和离体扩增。举例来说,分离和扩增细胞毒性t细胞的方法描述于美国专利号6,805,861和6,531,451;美国专利公布号:us20160348072a1和国际专利公布号:wo2016168595a1中;所述专利各自的内容以引用的方式整体并入本文。nk细胞的分离和扩增描述于美国专利公布号:us20150152387a1、美国专利号:7,435,596;以及oyer,j.l.(2016).cytotherapy.18(5):653-63中;所述专利和文献各自的内容以引用的方式整体并入本文。具体来说,可使人原代nk细胞在饲养细胞例如已被遗传修饰来表达膜结合型il15、il21、il12和4-1bbl的骨髓细胞系存在下扩增。在一些情况下,可使免疫细胞的子群体富集以用于act。用于免疫细胞富集的方法在国际专利公布号:wo2015039100a1中教导。在另一实例中,b和t淋巴细胞弱化子标志物btla阳性t细胞可用于富集抗癌反应性t细胞,如美国专利号:9,512,401中所述(所述专利各自的内容以引用的方式整体并入本文)。在一些实施方案中,可使用于act的免疫细胞中的所选子群体消减以使t细胞扩增增强。举例来说,可使用美国专利公布号:us20160298081a1中教导的方法来使免疫细胞中的使抗肿瘤免疫应答最小化的foxp3+t淋巴细胞消减;所述专利的内容以引用的方式整体并入本文。在一些实施方案中,用于act的t细胞的活化和扩增通过对细胞表面上短暂表达的嵌合抗原受体(car)进行抗原刺激来实现。所述活化方法在国际专利号:wo2017015427中教导,所述专利的内容以引用的方式整体并入本文。在一些实施方案中,免疫细胞可通过与抗原呈递细胞(apc)缔合的抗原来活化。在一些实施方案中,apc可为抗原特异性或非特异性的树突细胞、巨噬细胞或b细胞。apc在它们的来源方面可为自体的或同源的。在一些实施方案中,apc可为人工抗原呈递细胞(aapc)诸如基于细胞的aapc或无细胞aapc。基于细胞的aapc可选自经遗传修饰同种异体细胞诸如人红白血病细胞或异种异体细胞诸如鼠纤维母细胞和果蝇(drosophila)细胞。或者,apc可为无细胞apc,其中抗原或共刺激性结构域在合成表面诸如乳胶珠粒、聚苯乙烯珠粒、脂质囊泡或外体上呈递。在一些实施方案中,过继性细胞疗法通过自体转移来进行,其中细胞源于需要治疗的受试者,并且在分离和加工之后向同一受试者施用细胞。在其他情况下,act可涉及同种异体转移,其中从除最终接受细胞疗法的接受受试者以外的供给受试者分离和/或制备细胞。供给受试者和接受受试者可在遗传上是相同的或类似的,或可表达相同hla类别或亚型。在一些实施方案中,引入用于act的免疫细胞(例如t细胞和nk细胞)中的多种免疫治疗剂可由同一生物回路系统控制。在一个实例中,细胞因子诸如il12和car构建体诸如cd19car连接于同一hdhfr去稳定结构域。il12和cd19car的表达使用tmp来同时调谐。在其他实施方案中,引入用于act的免疫细胞(例如t细胞和nk细胞)中的多种免疫治疗剂可由不同生物回路系统控制。在一个实例中,细胞因子诸如il12和car构建体诸如cd19car在两个单独效应物模块中连接于不同dd,由此可使用不同刺激物来单独调谐。在另一实例中,自杀基因和car构建体可连接于两个单独效应物模块。在使用本发明的sre、生物回路和组合物进行遗传调节之后,向有需要的受试者施用细胞。用于施用用于过继性细胞疗法的细胞的方法是已知的,并且可与提供的方法和组合物关联使用。举例来说,过继性t细胞治疗方法例如描述于属于gruenberg等人的美国专利申请公布号2003/0170238;属于rosenberg的美国专利号4,690,915;rosenberg(2011)natrevclinoncol.8(10):577-85中。参见例如themeli等(2013)natbiotechnol.31(10):928-933;tsukahara等(2013)biochembiophysrescommun438(1):84-9;davila等(2013)plosone8(4):e61338;其各自的内容以引用的方式整体并入本文。在一些实施方案中,用于act的免疫细胞可被修饰来表达一种或多种有助于免疫细胞活化、浸润、扩增、存活和抗肿瘤功能的免疫治疗剂。免疫治疗剂可为对不同靶标分子具有特异性的第二car或tcr;细胞因子或细胞因子受体;使抑制性信号转换成刺激性信号的嵌合转换受体;将过继性转移的细胞导向靶标部位诸如肿瘤组织的归巢受体;使免疫细胞的代谢最优化的药剂;或当在过继性细胞转移之后观察到重度事件时或当不再需要转移的免疫细胞时杀灭活化的t细胞的安全性开关基因(例如自杀基因)。在一些实施方案中,用于过继性细胞转移的免疫细胞可被遗传操作来使它们在体内的持久性、细胞毒性、肿瘤靶向能力以及归巢至疾病部位的能力改进,其中总体目标是进一步改进它们杀灭癌症患者的肿瘤的能力。一个实例是将本发明的包含细胞因子诸如γ-细胞因子(il2和il15)的效应物模块引入免疫细胞中以促进免疫细胞增殖和存活。将细胞因子基因(例如γ-细胞因子il2和il15)转导至细胞中将能够在不添加外源性细胞因子下使免疫细胞繁殖,并且细胞因子表达性nk细胞具有增强的肿瘤细胞毒性。另一实例包括使用遗传修饰来将所输注nk细胞导向适当肿瘤组织。nk细胞可用编码ccr7受体的效应物模块加以遗传工程化以使它们朝向它的一种配体ccl19的迁移改进。其他策略可涉及利用趋化因子受体诸如cxcr3来使nk细胞向发炎组织诸如受转移性肿瘤浸润的那些组织的迁移改进。nk细胞可被修饰来变得对抑制性细胞因子诸如tgf-β不敏感,由此保持它们的细胞毒性。举例来说,nk细胞可被遗传修饰来在它们的表面上表达tgf-βii型受体的显性负性突变形式(dntβrii),所述显性负性突变形式致使nk细胞对tgf-β的抑制作用具有抗性。在一些实施方案中,相比于本领域中的其他生物回路或开关,生物回路、它们的组分、sre或效应物模块被设计来具有显著更小免疫原性。如本文所用,“显著更小免疫原性”是指免疫原性的可检测降低。在另一实施方案中,所述术语是指免疫原性的倍数降低。在另一实施方案中,所述术语是指使得有效量的生物回路、它们的组分、sre或效应物模块可被施用而不触发可检测免疫应答的降低。在另一实施方案中,所述术语是指使得生物回路、它们的组分、sre或效应物模块可被重复施用而不引发免疫应答的降低。在另一实施方案中,降低是如此以致生物回路、它们的组分、sre或效应物模块可被重复施用而不引发免疫应答。在另一实施方案中,相比于它的未修饰对应物或参照化合物,生物回路、它们的组分、sre或效应物模块的免疫原性减小至1/2。在另一实施方案中,免疫原性降低至1/3。在另一实施方案中,免疫原性降低至1/5。在另一实施方案中,免疫原性降低至1/7。在另一实施方案中,免疫原性降低至1/10。在另一实施方案中,免疫原性降低至1/15。在另一实施方案中,免疫原性降低至1/。在另一实施方案中,免疫原性降低至1/50。在另一实施方案中,免疫原性降低至1/100。在另一实施方案中,免疫原性降低至1/200。在另一实施方案中,免疫原性降低至1/500。在另一实施方案中,免疫原性降低至1/1000。在另一实施方案中,免疫原性降低至1/2000。在另一实施方案中,免疫原性以另一倍数差异降低。测定免疫原性的方法在本领域中是熟知的,并且包括例如测量细胞因子(例如il12、ifnα、tnf-α、rantes、mip-1α或mip-1β、il6、ifnβ、或il8)的分泌,测量dc活化标志物(例如cd83、hla-dr、cd80和cd86)的表达,或测量充当适应性免疫应答的佐剂的能力。本发明提供在细胞中诱导免疫应答的方法。如本文所用,术语“免疫应答”是指免疫系统的细胞应答于刺激物或抗原的活性。在一些实施方案中,抗原可为癌症抗原。在一些方面,诱导免疫应答的方法可涉及向细胞施用治疗有效量的任何本文所述的组合物。在一个方面,方法可涉及施用本文所述的药物组合物。在一个方面,方法可涉及施用多核苷酸、载体。在一些实施方案中,对免疫应答的诱导由于本文所述的免疫治疗剂的表达和/或功能而发生。诱导免疫应答的方法可进一步涉及向细胞施用有效量的刺激物以调谐免疫治疗剂的表达。在一些实施方案中,免疫治疗剂能够响应于刺激物而诱导免疫应答。对免疫应答的诱导可在受试者内的细胞中即在体内、离体或在体外发生。对免疫应答的诱导可通过测量细胞因子诸如il2和ifnγ从细胞的释放来评估。在一些实施方案中,对免疫应答的诱导可通过评估细胞表面标志物诸如但不限于cd3、cd4、cd8、cd14、cd20、cd11b、cd16、cd45和hla-dr、cd69、cd28、cd44、ifnγ来测量。抗原呈递细胞的细胞表面标志物的实例包括但不限于i类mhc、ii类mhc、cd40、cd45、b7-1、b7-2、ifnγ受体和il2受体、icam-1和/或fcγ受体。树突细胞的细胞表面标志物的实例包括但不限于i类mhc、ii类mhc、b7-2、cd18、cd29、cd31、cd43、cd44、cd45、cd54、cd58、cd83、cd86、cmrf-44、cmrf-56、dcir和/或树凝素-1(dectin-1)等;而在一些情况下,也具有cd2、cd3、cd4、cd8、cd14、cd15、cd16、cd19、cd20、cd56和/或cd57的不存在性。nk细胞的细胞表面标志物的实例包括但不限于ccl3、ccl4、ccl5、粒溶素(granulysin)、粒酶b、粒酶k、il10、il22、ifng、lap、穿孔素和tnfa。2.癌症疫苗在一些实施方案中,本发明的生物回路、效应物模块、目标有效载荷(免疫治疗剂)、载体、细胞和组合物可用于癌症疫苗。在一个方面,树突细胞被修饰来表达本发明组合物,并且用作癌症疫苗。在一些实施方案中,癌症疫苗可包含源于肿瘤相关抗原(taa)的肽和/或蛋白质。所述策略可用于在受试者中激起免疫应答,所述免疫应答在一些情况下可为细胞毒性t淋巴细胞(ctl)应答。用于癌症疫苗的肽也可被修饰来匹配受试者的突变概况。举例来说,具有与见于需要疗法的受试者中的突变匹配的突变的egfr源性肽已成功用于患有肺癌的患者中(lif等(2016)oncoimmunology.10月7日;5(12):e1238539;其内容以引用的方式整体并入本文)。在一个实施方案中,本发明的癌症疫苗可为源于taa的超级激动剂经改变肽配体(apl)。这些是与天然肽序列有一个或多个氨基酸的偏差的突变肽配体,相比于天然表位,此更有效使特异性ctl克隆活化。这些改变可允许肽更好结合限定性i类mhc分子,或更有利地与给定肿瘤特异性ctl子组的tcr相互作用。apl可使用美国专利公布号:us20160317633a1中教导的方法来选择,所述专利的内容以引用的方式整体并入本文。3.肿瘤微环境(tme)在一些实施方案中,生物回路、它们的组分、sre或效应物模块被设计来重新塑造肿瘤微环境以使生物回路或药物组合物的效用超出定向细胞杀灭而得以扩展。在一些实施方案中,生物回路、它们的组分、sre或效应物模块被设计来使car细胞因子风暴降低、缓和或消除。在一些实施方案中,所述降低、缓解和/或消除发生在实体肿瘤或肿瘤微环境中。在一些实施方案中,本发明的生物回路、效应物模块、目标有效载荷(免疫治疗剂)、载体、细胞和药物组合物可用于转换免疫抑制性微环境以使免疫应答增加。在一些实施方案中,本发明提供用于使用本发明组合物来使来自由癌细胞或周围肿瘤基质分泌的免疫抑制性细胞因子的抑制性免疫调控性信号转换成刺激性信号的方法。免疫抑制性细胞因子包括不限于il13、il4、tgf-β、il6、il8和il10。在一个方面,经遗传修饰肿瘤特异性t细胞(例如cart细胞)或具有天然肿瘤特异性的t细胞可被进一步工程化来表达包含嵌合转换受体的效应物模块,所述嵌合转换受体结合抑制性/遏制性细胞因子,并且使它们的细胞内结果转换成免疫刺激性/活化性信号,由此使肿瘤特异性t细胞的功效改进。嵌合转换受体由抑制性细胞因子受体(例如il13r、il4r、il10r、tgfβr1/alk5、tgfβr2和tgfβr3/β-聚糖)的细胞外结构域与源于刺激性细胞因子受体诸如il2r(即il2rα/cd25、il2rβ/cd122和由各种细胞因子受体共有的共同γ链受体/cd132)和/或il7r(il7rα/cd127、共同γ链受体/cd132)的细胞内信号转导结构域融合所组成。这些操作致使肿瘤特异性t细胞或cart细胞对抑制性肿瘤微环境具有抗性。在一些实施方案中,本发明提供用以消除由骨髓源性抑制细胞(mdsc)产生的免疫抑制性作用的方法。肿瘤细胞分泌吲哚胺2,3-双加氧酶(ido),其通过募集mdsc来促进免疫抑制。免疫抑制性环境由mdsc通过一氧化氮合成酶(nos)和可使细胞外精氨酸降解的精氨酸酶1(arg1)来进一步促进。肿瘤微环境内的氨基酸剥夺会抑制t细胞抗肿瘤活性。在一些实施方案中,本发明的有效载荷可包括nos、arg1和色氨酸代谢路径诸如ido的抑制剂。在一个实施方案中,有效载荷可包括为mdsc的增殖和功能所需的集落刺激因子受体1(csfr1)的抑制剂。在一些实施方案中,抑制性共受体诸如pd-1、ctla-4、lag-3、tim-3、kir或btla的显性负性突变体可作为本发明的有效载荷用于克服肿瘤微环境中的抑制性信号。4.组合治疗在一些实施方案中,可合乎需要的是使本发明的组合物、载体和细胞组合以向受试者施用。包含不同免疫治疗剂的本发明组合物可组合用于使免疫疗法增强。免疫治疗剂在一些实施方案中,可合乎需要的是使本发明组合物与可使抗原特异性免疫应答的效能和长久性增强的佐剂组合。在组合疗法中用作免疫刺激剂的佐剂包括生物分子或递送抗原的递送载体。作为非限制性实例,本发明组合物可与生物佐剂诸如细胞因子、toll样受体、细菌毒素和/或皂素(saponin)组合。在其他实施方案中,本发明组合物可与递送载体组合。示例性递送载体包括聚合物微球体、免疫刺激性复合物、乳液(水包油型或油包水型)、铝盐、脂质体或病毒体。在一些实施方案中,被修饰来表达本发明的生物回路、效应物模块、dd和有效载荷的免疫效应细胞可与本文所述的生物佐剂组合。对car以及细胞因子和配体进行双重调控以使对靶标介导的活化的动态控制与内在细胞t细胞扩增分开。所述双重调控也使对在患者中采用预先调节方案的需要最小化。作为一非限制性实例,受dd调控的car例如cd19car可与细胞因子例如il12组合以使car的抗肿瘤功效增强(pegramh.j.等tumor-targetedtcellsmodifiedtosecreteil12eradicatesystemictumorswithoutneedforpriorconditioning.blood.2012;119:4133–41;其各自的内容以引用的方式整体并入本文)。作为另一非限制性实例,merchant等人使基于树突细胞的疫苗接种与重组人il7组合以使在高风险儿科肉瘤患者中的结果改进(merchant,m.s.等adjuvantimmunotherapytoimproveoutcomeinhigh-riskpediatricsarcomas.clincancerres.2016.22(13):3182-91;其各自的内容以引用的方式整体并入本文)。在一些实施方案中,被修饰来表达一种或多种抗原特异性tcr或car的免疫效应细胞可与包含使免疫抑制性肿瘤微环境转换的免疫治疗剂的本发明组合物组合。在一个方面,可使被修饰来表达对同一细胞上的不同靶标分子具有特异性的car的效应免疫细胞组合。在另一方面,被修饰来表达同一car构建体的不同免疫细胞诸如nk细胞和t细胞可组合用于肿瘤治疗,例如被修饰来表达cd19car的t细胞可与被修饰来表达同一cd19car的nk细胞组合以治疗b细胞恶性肿瘤。在其他实施方案中,被修饰来表达car的免疫细胞可与检查点阻断剂组合。在一些实施方案中,被修饰来表达本发明的生物回路、效应物模块、dd和有效载荷的免疫效应细胞可与本发明的癌症疫苗组合。在一些实施方案中,包含car的效应物模块可与包含细胞因子的效应物模块、或包含安全性开关的效应物模块、或包含代谢因子的效应物模块、或包含归巢受体的效应物模块组合使用。在一个实施方案中,包含cd19car的效应物模块可使用国际专利申请号:wo2016164580中教导的方法来与氨基嘧啶衍生物诸如伯基特氏酪氨酸受体激酶(burkit'styrosinereceptorkinase,btk)抑制剂组合使用,所述专利的内容以引用的方式整体并入本文。癌症在一些实施方案中,本发明方法可包括本发明组合物与有效治疗癌症、感染疾病和其他免疫缺陷病症的其他药剂诸如抗癌剂的组合。如本文所用,术语“抗癌剂”是指能够负性影响受试者的癌症的任何药剂,例如通过杀灭癌细胞,诱导癌细胞的凋亡,降低癌细胞的生长速率,降低转移的发生或数目,降低肿瘤尺寸,抑制肿瘤生长,降低向肿瘤或癌细胞的血液供给,促进针对癌细胞或肿瘤的免疫应答,预防或抑制癌症的进展,或增加患有癌症的受试者的寿命。在一些实施方案中,抗癌剂或抗癌疗法可为化学治疗剂、或放射疗法、免疫治疗剂、手术、或在与本发明组合时会使治疗的治疗功效改进的任何其他治疗剂。在一些实施方案中,本发明组合物可与除本文所述的本发明疗法以外的免疫治疗剂诸如对肿瘤细胞的表面上的一些靶标分子具有特异性的抗体组合使用。示例性化学疗法包括不限于阿西维辛(acivicin);阿柔比星(aclarubicin);盐酸阿考达唑(acodazolehydrochloride);阿克罗宁(acronine);阿多来新(adozelesin);阿地白介素(aldesleukin);六甲蜜胺(altretamine);安波霉素(ambomycin);乙酸阿美蒽醌(ametantroneacetate);安吖啶(amsacrine);阿那曲唑(anastrozole);安曲霉素(anthramycin);天冬酰胺酶(asparaginase);阿斯佩林(asperrin)、舒林酸(sulindac)、姜黄素(curcumin)、烷基化剂,包括:氮芥(nitrogenmustard)诸如二氯甲基二乙胺(mechlorethamine)、环磷酰胺(cyclophosphamide)、异环磷酰胺(ifosfamide)、美法仑(melphalan)和苯丁酸氮芥(chlorambucil);亚硝基脲诸如卡莫司汀(carmustine,bcu)、洛莫司汀(ccnu)和司莫司汀(semustine,甲基-ccu);亚乙基亚胺/甲基蜜胺诸如三亚乙基蜜胺(tem)、三亚乙基硫代磷酰胺(噻替派(thiotepa))、六甲基蜜胺(hmm、六甲蜜胺);烷基磺酸酯诸如白消安(busulfan);三嗪诸如达卡巴嗪(dacarbazine,dtic);抗代谢剂,包括叶酸类似物诸如甲氨蝶呤(methotrexate)和三甲曲沙(trimetrexate)、吡咯烷类似物诸如5-氟尿嘧啶(5-fluorouracil)、氟脱氧尿苷(fluorodeoxyuridine)、吉西他滨(gemcitabine)、胞嘧啶阿拉伯糖苷(arac、阿糖胞苷(cytarabine))、5-氮杂胞苷(5-azacytidine)、2,2'-二氟脱氧胞苷、嘌呤类似物诸如6-巯基嘌呤(6-mercaptopurine)、6-硫鸟嘌呤(6-thioguanine)、咪唑硫嘌呤(azathioprine)、2'-脱氧柯福霉素(2'-deoxycoformycin)(喷司他汀(pentostatin))、赤式羟基壬基腺嘌呤(ehna)、磷酸氟达拉滨(fludarabinephosphate)和2-氯脱氧腺苷(克拉屈滨(cladribine)、2-cda);天然产物,包括抗有丝分裂药物诸如太平洋紫杉醇(paclitaxel)、长春花生物碱,包括长春花碱(vinblastine,vlb)、长春新碱(vincristine)和长春瑞滨(vinorelbine),泰索帝(taxotere)、雌氮芥(estramustine)和磷酸雌氮芥(estramustinephosphate);表鬼臼毒素(epipodophylotoxin)诸如依托泊苷(etoposide)和替尼泊苷(teniposide);抗生素,诸如放线菌素d(actimomycind)、道诺霉素(daunomycin)(红比霉素(rubidomycin))、多柔比星(doxorubicin)、米托蒽醌(mitoxantrone)、伊达比星(idarubicin)、博莱霉素(bleomycins)、光神霉素(plicamycin)(米拉霉素(mithramycin))、丝裂霉素c(mitomycinc)和放线菌素(actinomycin);酶诸如l-天冬酰胺酶、细胞因子诸如干扰素(ifn)-γ、肿瘤坏死因子(tnf)-α、tnf-β和gm-csf,抗血管生成因子诸如血管抑素和内皮抑素、fgf或vegf的抑制剂诸如血管生成因子的受体的可溶性形式,包括可溶性vgf/vegf受体,铂配位络合物诸如顺铂(cisplatin)和卡铂(carboplatin)、蒽二酮诸如米托蒽醌(mitoxantrone)、经取代脲诸如羟基脲、甲基肼衍生物,包括n-甲基肼(miff)和丙卡巴肼(procarbazine),肾上腺皮质抑制剂诸如米托坦(mitotane,ο,ρ'-ddd)和胺鲁米特(aminoglutethimide);激素和拮抗剂,包括肾上腺类固醇拮抗剂诸如泼尼松(prednisone)和等效物、地塞米松(dexamethasone)和胺鲁米特;孕激素(progestin)诸如己酸羟孕酮(hydroxyprogesteronecaproate)、乙酸甲羟孕酮(medroxyprogesteroneacetate)和乙酸甲地孕酮(megestrolacetate);雌激素诸如己烯雌酚(diethylstilbestrol)和乙炔雌二醇等效物;抗雌激素剂诸如他莫昔芬(tamoxifen);雄激素,包括丙酸睾酮(testosteronepropionate)和氟羟甲睾酮(fluoxymesterone)/等效物;抗雄激素剂诸如氟他胺(flutamide)、促性腺激素释放激素(gonadotropin-releasinghormone)类似物和亮脯利特(leuprolide);非类固醇抗雄激素剂诸如氟他胺(flutamide);激酶抑制剂、组蛋白脱乙酰基酶抑制剂、甲基化抑制剂、蛋白酶体抑制剂、单克隆抗体、氧化剂、抗氧化剂、端粒酶抑制剂、bh3模拟物、泛素连接酶抑制剂、stat抑制剂和受体酪氨酸激酶抑制剂诸如甲磺酸伊马替尼(imatinibmesylate)(以格列卫(gleevac/glivac)销售)和现时以特罗凯(tarveca)销售的埃罗替尼(erlotinib)(一种egf受体抑制剂);抗病毒剂诸如磷酸奥司他韦(oseltamivirphosphate)、两性霉素b(amphotericinb)和帕利珠单抗(palivizumab);sdi1模拟物;司莫司汀;衰老源性抑制剂1;膦门冬酸(sparfosicacid);斯卡霉素d(spicamycind);螺莫司汀(spiromustine);脾脏五肽(splenopentin);海绵抑制素1(spongistatin1);角鲨胺(squalamine);斯提酰胺(stipiamide);基质裂解素(stromelysin)抑制剂;萨菲诺辛(sulfinosine);强效血管活性肠肽拮抗剂(superactivevasoactiveintestinalpeptideantagonist);维拉雷琐(velaresol);藜芦明(veramine);瓦尔丁(verdin);维替泊芬(verteporfin);长春瑞滨(vinorelbine);威科萨汀(vinxaltine);维塔辛(vitaxin);伏氯唑(vorozole);扎诺特隆(zanoterone);折尼铂(zeniplatin);亚苄维c(zilascorb);以及净司他汀斯酯(zinostatinstimalamer);pi3kβ小分子抑制剂、gsk2636771;全pi3k抑制剂(bkm120);braf抑制剂。威罗菲尼(vemurafenib)(泽波拉夫(zelboraf))和达拉菲尼(dabrafenib)(塔菲拉(tafinlar));或前述各物的任何类似物或衍生物和变体。在一个实施方案中,本发明进一步涉及本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷用于与其他药物和/或其他治疗方法组合,例如与已知药物和/或已知治疗方法诸如像当前用于治疗这些病症的那些药物和/或治疗方法组合来治疗一种或多种形式的癌症的用途。举例来说,本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷也可与一种或多种额外抗癌治疗诸如生物制剂、化学疗法和放射疗法联合施用。因此,治疗可包括例如伊马替尼(格列卫)、全反式视黄酸、单克隆抗体治疗剂(奥佐米星吉妥单抗(gemtuzumab,ozogamicin))、化学疗法(例如苯丁酸氮芥、泼尼松、泼尼松龙、长春新碱、阿糖胞苷、氯法拉滨、法尼基(farnesyl)转移酶抑制剂、地西他滨、mdr1的抑制剂、利妥昔单抗、干扰素-α、蒽环霉素药物(诸如柔红霉素或伊达比星)、l-天冬酰胺酶、多柔比星、环磷酰胺、多柔比星、博莱霉素、氟达拉滨、依托泊苷、喷司他汀或克拉屈滨)、骨髓移植、干细胞移植、放射疗法、抗代谢物药物(甲氨蝶呤和6-巯基嘌呤)、或任何本文教导的抗体诸如共同拥有的美国临时专利申请号62/320,864(2016年4月11日提交)、62/466,596(2017年3月3日提交)和国际公布wo2017/180587的表6中的那些(所述专利各自的内容以引用的方式整体并入本文)、或其组合。放射冶疗剂和放射冶疗因素包括诱导dna损害的辐射和波,例如γ照射、x射线、uv照射、微波、电子发射、放射性同位素等。疗法可通过用上述形式的辐射对局部化肿瘤部位进行照射来实现。最可能的是所有这些因素都实现对dna、dna的前体、dna的复制和修复、以及染色体的组装和维持的广泛范围的损害。x射线的剂量范围在每日剂量50至200伦琴持续延长时期(3至4周)直至单次剂量2000至6000伦琴的范围内。放射性同位素的剂量范围广泛变化,并且取决于同位素的半衰期、发射的辐射的强度和类型、以及由赘生性细胞达成的摄取。放射疗法(也称为放射治疗、x射线疗法、或照射)是使用电离辐射来杀灭癌细胞以及使肿瘤收缩。放射疗法可通过外部射束放射疗法(ebrt)来在外部施用,或通过近距疗法来在内部施用。放射疗法的作用是局部化的,并且限于所治疗区域。放射疗法可用于治疗几乎每个类型的实体肿瘤,包括脑癌、乳腺癌、子宫颈癌、喉癌、肺癌、胰腺癌、前列腺癌、皮肤癌、胃癌、子宫癌或软组织肉瘤。放射也用于治疗白血病和淋巴瘤。在一些实施方案中,化学治疗剂可为免疫调节剂诸如来那度胺(lenalidomide,len)。新近研究已证明来那度胺可使经car修饰t细胞的抗肿瘤功能增强(otahal等,oncoimmunology,2015,5(4):e1115940)。抗肿瘤抗体的一些实例包括托珠单抗、司妥昔单抗。化学疗法是用可破坏癌细胞的药物治疗癌症。在当前使用中,术语“化学疗法”通常是指一般性地影响快速分裂细胞的细胞毒性药物,这与靶向疗法不同。化学疗法药物以各种可能方式干扰细胞分裂,例如干扰dna的复制或新形成的染色体的分离。大多数形式的化学疗法靶向所有快速分裂细胞,并且不对癌细胞具有特异性,但某一程度的特异性可来自许多癌细胞不能修复dna损害,而正常细胞通常可修复dna损害。大多数化学疗法方案以组合形式给与。示例性化学治疗剂包括但不限于5-fu增强剂、9-ac、ag2037、ag3340、蛋白聚糖酶抑制剂、胺鲁米特、安吖啶(m-amsa)、天冬酰胺酶、阿扎胞苷、巴马司他(batimastat,bb94)、bay12-9566、bch-4556、双萘二甲酰亚胺、白消安、卡培他滨、卡铂、卡莫司汀+聚苯丙生(polifeprosan)、cdk4/cdk2抑制剂、苯丁酸氮芥、ci-994、顺铂、克拉屈滨、cs-682、盐酸阿糖胞苷(cytarabinehcl)、d2163、更生霉素、盐酸柔红霉素、地泊赛特(depocyt)、德西氟萨米得(dexifosamide)、多西他赛、多拉司他丁(dolastain)、脱氧氟尿苷、多柔比星、dx8951f、e7070、egfr、表柔比星、红血球生成素、雌氮芥磷酸钠、依托泊苷(vp16-213)、法尼基转移酶抑制剂、fk317、黄酮吡醇(flavopiridol)、氟尿苷、氟达拉滨、氟尿嘧啶(5-fu)、氟他胺、福吉林(fragyline)、吉西他滨、六甲基蜜胺(hmm)、羟基脲(羟基尿素)、异环磷酰胺、干扰素α-2a、干扰素α-2b、白介素-2、伊立替康、isi641、云芝多糖(krestin)、勒莫纳尔dp2202(lemonaldp2202)、乙酸亮丙瑞林(lhrh释放因子类似物)、左旋咪唑(levamisole)、ligla(γ亚麻酸锂)、罗丁粒子(lodineseed)、洛美曲索(lometexol)、洛莫司汀(ccnu)、马立马司他(marimistat)、盐酸二氯甲基二乙胺(氮芥)、乙酸甲地孕酮、γ-亚麻酸甲葡胺(meglaminegla)、巯基嘌呤、美斯纳(mesna)、米托胍腙(mitoguazone,甲基-gag;丙酮醛双脒基腙;mgbg)、米托坦(o.p'-ddd)、米托蒽醌、盐酸米托蒽醌、mmi270、mmp、mta/ly231514、奥曲肽(octreotide)、odn698、ok-432、口服铂、口服类紫杉烷、太平洋紫杉醇(taxol.rtm.)、parp抑制剂、pd183805、喷司他汀(2'脱氧柯福霉素)、pkc412、光神霉素、盐酸丙卡巴肼、psc833、雷替曲塞(ralitrexed)、法尼基转移酶抑制剂、ras致癌基因抑制剂、司莫司汀(甲基-ccnu)、链脲霉素(streptozocin)、苏拉明(suramin)、柠檬酸他莫昔芬(tamoxifencitrate)、紫杉烷类似物、替莫唑胺(temozolomide)、替尼泊苷(vm-26)、硫鸟嘌呤、噻替派、拓扑替康、酪氨酸激酶、uft(替加氟(tegafur)/尿嘧啶)、戊柔比星(valrubicin)、硫酸长春花碱、硫酸长春地辛(vindesinesulfate)、vx-710、vx-853、ym116、zd0101、zd0473/阿诺美德(anormed)、zd1839、zd9331。可与本发明组合物组合使用的其他药剂也可包括但不限于影响细胞表面受体和它们的配体诸如fas/fas配体、dr4或dr5/trail的上调以及间隙连接的药剂、细胞抑制剂和分化剂、细胞粘附的抑制剂诸如粘着斑激酶(fak)抑制剂和洛伐他汀(lovastatin)、或使高增殖细胞对凋亡诱导剂诸如抗体c225的敏感性增加的药剂。组合可包括同时或分开施用本发明组合物和其他药剂。或者,本发明免疫疗法可在其他药剂/疗法之前或之后,间隔在数分钟、数天、数周至数月的范围内。5.治疗用途本发明中提供一种使有需要的受试者中的肿瘤体积或负荷降低的方法,所述方法包括向所述受试者中引入本发明组合物。本发明也提供用于治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的被遗传修饰来表达至少一种本发明的效应物模块的免疫效应细胞。癌症各种癌症可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。如本文所用,术语“癌症”是指特征在于伴有倾向于侵袭周围组织并向新的身体部位转移的间变性细胞的增殖的各种恶性赘瘤中的任一者,并且是指特征在于所述恶性赘生性生长的病理性疾患。癌症可为肿瘤或血液恶性肿瘤,并且包括但不限于所有类型的淋巴瘤/白血病、癌瘤和肉瘤,诸如见于以下中的那些癌症或肿瘤:肛门、膀胱、胆管、骨、脑、乳腺、子宫颈、结肠/直肠、子宫内膜、食道、眼、胆囊、头颈部、肝、肾、喉、肺、纵隔(胸部)、口、卵巢、胰腺、阴茎、前列腺、皮肤、小肠、胃、脊髓、尾骨、睾丸、甲状腺和子宫。可用本发明组合物治疗的癌瘤的类型包括但不限于乳头状瘤/癌瘤、绒毛膜癌、内胚窦肿瘤、畸胎瘤、腺瘤/腺癌、黑素瘤、纤维瘤、脂肪瘤、平滑肌瘤、横纹肌瘤、间皮瘤、血管瘤、骨瘤、软骨瘤、神经胶质瘤、淋巴瘤/白血病、鳞状细胞癌、小细胞癌、大细胞未分化癌、基底细胞癌和鼻窦未分化癌。可用本发明组合物治疗的癌瘤的类型包括但不限于软组织肉瘤诸如腺泡状软组织肉瘤、血管肉瘤、皮肤纤维肉瘤、硬纤维肿瘤、促结缔组织增生性小圆细胞肿瘤、骨骼外软骨肉瘤、骨骼外骨肉瘤、纤维肉瘤、血管外皮细胞瘤、血管肉瘤、卡波西氏肉瘤(kaposi'ssarcoma)、平滑肌肉瘤、脂肉瘤、淋巴管肉瘤、淋巴肉瘤、恶性纤维组织细胞瘤、神经纤维肉瘤、横纹肌肉瘤、滑膜肉瘤、以及阿斯金氏肿瘤(askin'stumor)、尤因氏肉瘤(ewing'ssarcoma)(原始神经外胚层肿瘤)、恶性血管内皮细胞瘤、恶性神经鞘瘤、骨肉瘤和软骨肉瘤。作为一非限制性实例,可治疗的癌瘤可为急性粒细胞性白血病、急性淋巴细胞性白血病、急性骨髓源性白血病、腺癌、腺肉瘤、肾上腺癌、肾上腺皮质癌、肛门癌、间变性星形细胞瘤、血管肉瘤、阑尾癌、星形细胞瘤、基底细胞癌、b细胞淋巴瘤、胆管癌、膀胱癌、骨癌、肠癌、脑癌、脑干神经胶质瘤、脑肿瘤、乳腺癌、类癌肿瘤、子宫颈癌、胆管癌、软骨肉瘤、慢性淋巴细胞性白血病、慢性骨髓源性白血病、结肠癌、结肠直肠癌、颅咽管瘤、皮肤淋巴瘤、皮肤黑素瘤、弥漫性星形细胞瘤、导管原位癌、子宫内膜癌、室管膜瘤、上皮样肉瘤、食道癌、尤文肉瘤(ewingsarcoma)、肝外胆管癌、眼癌、输卵管癌、纤维肉瘤、胆囊癌、胃癌、胃肠癌、胃肠类癌、胃肠基质肿瘤、一般性癌症、生殖细胞肿瘤、多形性胶质母细胞瘤、神经胶质瘤、毛细胞白血病、头颈部癌、血管内皮瘤、霍奇金淋巴瘤、霍奇金氏病、霍奇金氏淋巴瘤、下咽癌、浸润性导管癌、浸润性小叶癌、炎症性乳腺癌、肠癌、肝内胆管癌、侵袭性/浸润性乳腺癌、胰岛细胞癌、颚癌、卡波西肉瘤、肾癌、喉癌、平滑肌肉瘤、柔脑膜转移瘤、白血病、唇癌、脂肉瘤、肝癌、小叶原位癌、低级星形细胞瘤、肺癌、淋巴结癌、淋巴瘤、男性乳腺癌、髓样癌、神经管母细胞瘤、黑素瘤、脑脊髓膜瘤、梅克尔(merkel)细胞癌、间胚叶性软骨肉瘤、间质癌、间皮瘤、转移性乳腺癌、转移性黑素瘤、转移性鳞状颈癌、混合性胶质细胞瘤、口癌、粘液癌、粘膜黑素瘤、多发性骨髓瘤、鼻腔癌、鼻咽癌、颈癌、神经母细胞瘤、神经内分泌肿瘤、非霍奇金淋巴瘤、非霍奇金氏淋巴瘤、非小细胞肺癌、燕麦细胞癌、眼癌、眼黑素瘤、寡树突神经胶质细胞瘤、口癌、口腔癌、口咽癌、骨源性肉瘤、骨肉瘤、卵巢癌、卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢原发性腹膜癌、卵巢性索基质肿瘤、佩吉特氏病(paget'sdisease)、胰腺癌、乳头状癌、鼻窦癌、甲状旁腺癌、骨盆癌、阴茎癌、外周神经癌、腹膜癌、咽癌、嗜铬细胞瘤、毛细胞性星形细胞瘤(pilocyticastrocytoma)、松果体区域肿瘤、松果体母细胞瘤、垂体腺癌、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞癌、肾盂癌、横纹肌肉瘤、唾液腺癌、肉瘤、肉瘤、骨肉瘤、软组织肉瘤、子宫癌、窦癌、皮肤癌、小细胞肺癌、小肠癌、软组织肉瘤、脊癌、脊柱癌、脊髓癌、脊肿瘤、鳞状细胞癌、胃癌、滑膜肉瘤、t细胞淋巴瘤、睾丸癌、喉癌、胸腺瘤/胸腺癌、甲状腺癌、舌癌、扁桃体癌、移行细胞癌、移行细胞癌、移行细胞癌、三重阴性乳腺癌、输卵管癌、管状癌、输尿管癌、输尿管癌、尿道癌、子宫腺癌、子宫癌、子宫肉瘤、阴道癌和外阴癌。在一些实施方案中,本发明的car可为适用于治疗多发性骨髓瘤的car,诸如cs1car、cd38car、cd138car和bcmacar。在一些实施方案中,本发明的car可为适用于治疗急性骨髓性白血病的car,诸如cd33car、cd123car和cll1car。在一些实施方案中,本发明的car可为适用于治疗t细胞白血病的car,诸如cd5car和cd7car。在一些实施方案中,本发明的car可为适用于治疗实体肿瘤的car,诸如间皮素car、gd2car、gpc3car、her2car、egfrcar、muc1car、epcamcar、pd-l1car、ceacar、muc16car、cd133car、cd171car、cd70car、cld18car、cmetcar、epha2car、fapcar、叶酸受体car、il13ra2car、mg7car、psmacar、ror1car和vegfr2car。本发明也提供使受试者中的肿瘤负荷降低的方法。在一些实施方案中,如本文所用,“肿瘤负荷”是指受试者中癌细胞的数目或癌的数量。在一些方面,肿瘤负荷也是指肿瘤负担。在一些实施方案中,肿瘤可遍及受试者的身体加以散播。在一个方面,肿瘤可为液体肿瘤诸如白血病或淋巴瘤。使肿瘤负荷降低的方法可涉及向受试者施用治疗有效量的免疫细胞。免疫细胞可被工程化来表达本文所述的组合物。在一些实施方案中,表达本发明组合物的免疫细胞可通过任何本文所述的递送途径来向受试者施用。本文也提供关于施用免疫细胞的给药方案。在一些实施方案中,也可向受试者施用治疗有效量的刺激物以调谐免疫治疗剂的表达。在一些方面,免疫治疗剂可能够使肿瘤负荷降低。也提供关于配体/刺激物给药的方案。肿瘤负荷降低可通过任何本领域中已知的方法来测量,所述方法包括肿瘤成像和测量标志物蛋白质。在一些方面,生物发光成像可用于测量肿瘤负荷。生物发光成像利用来自生物发光蛋白质诸如荧光素酶的天然光发射。通过添加适合底物,所述生物发光蛋白质可参与使光子释放的化学反应。光子的释放可通过灵敏检测方法来捕集并定量。肿瘤细胞可被工程化来表达荧光素酶,并且本文所述的组合物使肿瘤负荷降低的功效可通过成像来定量。在一些方面,肿瘤负荷可通过光子通量(每秒光子数)来度量。在一些实施方案中,光子通量与肿瘤负荷正性相关。疾病和毒素各种感染性疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。如本文所用,术语“感染性疾病”是指由生物体诸如细菌、病毒、真菌或寄生物引起的任何病症。作为一非限制性实例,感染性疾病可为急性细菌性鼻窦炎、14天麻疹、痤疮、慢性萎缩性肢皮炎(aca)-(潜伏性莱姆病(lymedisease)的晚期皮肤表现形式)、急性出血性结膜炎、急性出血性膀胱炎、急性鼻窦炎、成人t细胞白血病-淋巴瘤(atll)、非洲昏睡病(africansleepingsickness)、aids(获得性免疫缺陷综合征)、肝泡状棘球蚴病(alveolarhydatid)、阿米巴病(amebiasis)、阿米巴脑膜脑炎、边虫病、炭疽、虫媒病毒病或类感染病、蛔虫病-(蛔虫感染)、无菌性脑膜炎、足癣(脚癣)、澳大利亚蜱媒斑疹伤寒(australianticktyphus)、禽流感、巴贝虫病、杆菌性血管瘤病、细菌性脑膜炎、细菌性阴道病、龟头炎、小袋虫病、布氏病(bang'sdisease)、巴马森林病毒感染(barmahforestvirusinfection)、巴尔通氏体病(bartonellosis)(秘鲁疣(verrugaperuana);卡里翁氏病(carrion'sdisease);奥罗亚热(oroyafever))、蝙蝠丽沙病毒感染(batlyssavirusinfection)、湾疮(baysore)(胶工溃疡(chiclero'sulcer))、贝利蛔线虫感染(baylisascarisinfection)(浣熊蛔虫感染)、河狸热(beaverfever)、牛肉绦虫、非性病性梅毒(地方性梅毒)、双相脑膜脑炎、黑祸病、黑死病、黑色发结节病、黑尿热、芽生菌病、新生儿脓溢、睑炎、疖、流行性胸痛病(胸膜痛)、宫本疏螺旋体病(borreliamiyamotoidisease)、肉毒杆菌中毒、南欧斑疹热、巴西紫癜热、断骨热、布里尔病(brill)、细支气管炎、支气管炎、布鲁氏杆菌病(布氏病)、腺鼠疫、大疱性脓疱病、鼻疽伯克霍尔德氏菌病(burkholderiamallei)(鼻疽病(glanders))、类鼻疽伯克霍尔德氏菌病(burkholderiapseudomallei)(类鼻疽病(melioidosis))、布路里溃疡(buruliulcers)(也是分枝杆菌布路里溃疡(mycoburuliulcers))、布斯病(busse)、布斯-布施克病(busse-buschkedisease)(隐球菌病)、加利福尼亚组脑炎(californiagroupencephalitis)、弯曲菌病(campylobacteriosis)、假丝酵母病(candidiasis)、蔗田热(犬钩端螺旋体热;7天热;韦尔氏病(weil'sdisease);钩端螺旋体病;蔗田热)、犬钩端螺旋体热、毛细线虫病、品他病(carate)、碳青霉烯抗性肠杆菌科(carbapenem-resistantenterobacteriaceae,cre)病、痈、卡里翁氏病、猫抓热、洞穴病、中亚出血热、中欧蜱虫病、子宫颈癌、查加斯病(chagasdisease)、软下疳(软性下疳)、芝加哥病(chicagodisease)、禽痘(水痘)、胶工溃疡、切昆贡亚热(chikungunyafever)、衣原体感染、霍乱、着色芽生菌病(chromoblastomycosis)、鱼肉毒(ciguatera)、淋病、华支睾吸虫病(肝片形吸虫感染)、艰难梭菌(clostridiumdifficile)感染、产气荚膜梭菌病(clostridiumperfringens)(ε毒素)、球孢子菌病真菌性感染(溪谷热(valleyfever);球孢子菌病(desertrheumatism))、多头蚴病、科罗拉多蜱传热、尖锐湿疣、尖锐湿疣(疣)、扁平湿疣、刚果热、刚果出血热病毒病、结膜炎、牛痘、阴虱寄生病(crabs)、克里米亚病(crimean)、喉头炎、隐球菌病、隐孢子虫病(crypto)、皮肤幼虫移行症、环孢子虫病(cyclosporiasis)、囊型包虫病(cystichydatid)、囊尾蚴病、膀胱炎、捷克斯洛伐克蜱虫病(czechoslovaktick)、d68(ev-d68)、泪囊炎、登革热、达林氏病(darling'sdisease)、中室斑虻热、登革热(1、2、3和4)、球孢子菌病、胸壁痛(devil'sgrip)、二相产乳热、白喉、散播性血管内凝血、狗绦虫病、杜诺凡病(donovanosis)、杜诺凡病(腹股沟肉芽肿)、麦地那龙线虫病(dracontiasis)、成线虫病、杜克氏病(duke'sdisease)、登登病(dumdumdisease)、迪朗-尼古拉斯-法夫尔病(durand-nicholas-favredisease)、短小绦虫病(dwarftapeworm)、大肠杆菌感染(大肠杆菌)、东部马脑炎、埃博拉出血热(埃博拉病毒病evd)、毛外癣菌病、埃里希体病(ehrlichiosis)(森里特苏热(sennetsufever))、脑炎、地方性回归热、地方性梅毒、眼内炎、毛内癣菌病、蛲虫病(蛲虫感染)、肠毒素-b中毒(葡萄球菌食物中毒)、肠病毒感染、流行性角膜结膜炎、流行性回归热、流行性斑疹伤寒、会厌炎、丹毒、类丹毒(丹毒丝菌病)、慢性游走性红斑、传染性红斑、边缘性红斑、多形性红斑、结节性红斑、麻风结节性红斑、红癣、鼻咽粘膜利什曼病(espundia)、真菌性足分枝菌病、欧洲芽生菌病、幼儿急疹(第六病)、眼丝虫病、远东蜱虫病、片形吸虫病、南欧斑疹热(fievreboutonneuse)(蜱媒斑疹伤寒)、第五病(传染性红斑)、菲拉托夫-杜克斯病(filatow-dukes'disease)(烫伤样皮肤综合征;里特氏病(ritter'sdisease))、鱼绦虫病、菲茨-休-柯蒂斯综合征-肝周炎、弗林德斯岛斑疹热(flindersislandspottedfever)、流行性感冒(流感)、毛囊炎、四角病(fourcornersdisease)、四角病(人肺综合征(hps))、雅司病(frambesia)、弗朗西斯病(francisdisease)、疖病、气性坏疽、胃肠炎、生殖器疱疹、生殖器疣、德国麻疹、格斯特曼-斯脱司勒-史茵克(gerstmann-straussler-scheinker,gss)病、贾第鞭毛虫病、吉尔克里斯特氏病(gilchrist’sdisease)、齿龈炎、龈口炎、鼻疽病、腺热(感染性单核细胞增多症)、颚口线虫病、淋球菌感染(淋病)、淋病、腹股沟肉芽肿(杜诺凡病)、丝虫病、流感嗜血杆菌病、汉堡病(hamburgerdisease)、汉森氏病(hansen'sdisease)-麻风病、汉坦病(hantaandisease)、汉坦-韩国出血热、汉坦病毒肺综合征、汉坦病毒肺综合征(hps)、硬质下疳、硬质麻疹、哈弗希尔热(haverhillfever)-鼠咬热、头和身体虱病、腹地热、螺杆菌病、溶血性尿毒综合征(hus)、甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、疱疹性咽峡炎、生殖器疱疹、唇疱疹、新生儿疱疹、汗腺炎、组织胞浆菌病、组织胞浆菌病感染(组织胞浆菌病)、希斯-沃纳病(his-wernerdisease)、hiv感染、钩虫传染、睑腺炎、睑腺炎(麦粒肿)、htlv病、htlv相关骨髓病(ham)、人粒细胞性埃里希体病、人单核细胞埃里希体病、人乳头状瘤病毒(hpv)病、人肺综合征、包虫囊肿、狂犬病、脓疱病,包括先天性(德国麻疹),包涵体结膜炎、包涵体结膜炎-游泳池性结膜炎-血管翳、婴儿腹泻、感染性单核细胞增多症、感染性心肌炎、感染性心包炎、流感、等孢球虫病、以色列斑疹热(israelispottedfever)、日本脑炎、股癣、乔治拉宝病(jorgelobodisease)-洛博芽生菌病、丛林黄热病、呼宁阿根廷出血热(juninargentinianhemorrhagicfever)、黑热病(kalaazar)、卡波西氏肉瘤、瘢痕瘤性芽生菌病、角膜结膜炎、库鲁病(kuru)、卡萨努森林病(kyasanurforestdisease)、拉克罗斯脑炎(lacrosseencephalitis)、拉沙出血热(lassahemorrhagicfever)、军团杆菌病(军团病)、军团菌肺炎、勒米雷氏综合征(lemierre'ssyndrome)(咽峡炎后败血症)、旅鼠热、麻风病、钩端螺旋体病(七日热;韦尔氏病)、李氏杆菌病(李斯特菌(listeria))、肝片形吸虫感染、拉宝氏霉菌病、破伤风、罗阿丝虫病、羊跳跃病(loupingill)、路德维希氏咽峡炎(ludwig'sangina)、肺吸虫感染、肺吸虫感染(并殖吸虫病)、莱姆病(lymedisease)、性病淋巴肉芽肿感染(lgv)、马丘坡波利维亚出血热(machupobolivianhemorrhagicfever)、足分枝菌病、品他病(maldelpinto)、疟疾、恶性脓泡、马尔他热、马尔堡出血热、马斯特斯病(mastersdisease)、母性败血症(产褥热)、麻疹、地中海斑疹热、类鼻疽(惠特莫尔氏病(whitmore'sdisease))、脑膜炎、脑膜炎球菌病、mers、挤奶员结节(milker'snodule)、触染性软疣、念珠菌病、猴痘、单核细胞增多症、单核细胞增多症样综合征、旅行者腹泻(montezuma'srevenge)、麻疹、mrsa(甲氧西林抗性金黄色葡萄球菌(staphylococcusaureus))感染、毛霉菌病-接合菌病、多器官功能异常综合征或mods、多系统萎缩(msa)、腮腺炎、鼠型斑疹伤寒、墨累河谷脑炎(murrayvalleyencephalitis,mve)、分枝杆菌布路里溃疡、分枝杆菌布路里溃疡-布路里溃疡、霉菌性外阴阴道炎、肌炎、七日热、坏死性筋膜炎、1型坏死性筋膜炎、2型坏死性筋膜炎、根岸病(negishi)、新世界斑疹热(newworldspottedfever)、诺卡氏菌病、非淋菌性尿道炎、非脊髓灰质炎(非脊髓灰质炎肠病毒)、诺如病毒(norovirus)感染、北美芽生菌病、北亚蜱媒斑疹伤寒、诺瓦克病毒(norwalkvirus)感染、挪威痒病(norwegianitch)、奥哈拉病(o'haradisease)、鄂木斯克出血热(omskhemorrhagicfever)、科罗病(onchoceriasis)、甲霉菌病、后睾吸虫病、新生儿眼炎(opthalmianeonatorium)、口腔绒毛状粘膜白斑病、orf、东方疖、东方斑疹热、鸟疫(鹦鹉热;鹦鹉病)、奥罗亚热(oroyafever)、外耳炎、中耳炎、血管翳、副球孢子菌病、并殖吸虫病、麻痹性贝毒(麻痹性贝毒)、甲沟炎(蹄冠炎)、腮腺炎、pcp肺炎、虱病、肝紫癜症、骨盆炎症性疾病、百日咳(也称为喘息咳)、暗色丝孢霉病(phaeohyphomycosis)、咽结膜热、毛孢子菌病(白色毛孢子菌病)、毛孢子菌病(黑色毛孢子菌病)、坏死性肠炎(pigbel)、红眼结膜炎、品他病(pinta)、蛲虫感染、窝状角质层分离、变色性皮癣(花斑癣)、鼠疫;腹股沟腺炎、胸膜痛、肺炎球菌病、肺囊虫病、肺炎、肺炎性(鼠疫)、脊髓灰质炎或小儿麻痹症、多囊性包虫病、庞蒂亚克热(pontiacfever)、猪肉绦虫病、波萨达-韦尼克病(posada-wernickedisease)、咽峡炎后败血症、波瓦桑病(powassan)、进行性多灶性脑白质病、进行性风疹全脑炎、前列腺炎、假膜性结肠炎、鹦鹉病、产褥热、脓疱皮疹病(天花)、肾盂肾炎、门静脉炎、q热、扁桃体周脓肿、五日热(5天热)、兔热、狂犬病、浣熊蛔虫感染、鼠咬热、大鼠绦虫病、莱特尔综合征(reitersyndrome)、回归热、呼吸道融合性病毒(rsv)感染、风湿热、红酵母菌病、篦麻毒素中毒、立克次氏体痘、立克次氏体病、里夫特山谷热(riftvalleyfever)、环癣、里特氏病(ritter'sdisease)、河盲症、洛基山斑疹热(rockymountainspottedfever)、罗斯汉德勒氏病(rosehandler'sdisease)(孢子丝菌病)、婴儿蔷薇疹、蔷薇疹、罗斯河热(rossriverfever)、轮状病毒感染、蛔虫感染、风疹、麻疹、俄罗斯春型病(russianspring)、沙门氏菌病胃肠炎、圣华金溪谷热(sanjoaquinvalleyfever)、圣保罗脑炎(saopauloencephalitis)、圣保罗热、sars、疥疮侵扰(疥疮)(挪威痒病)、烫伤样皮肤综合征、猩红热(scarletfever/scarlatina)、血吸虫病、鲭鱼病(scombroid)、丛林斑疹伤寒、森里特苏热、败血症(败血性休克)、重度急性呼吸综合征、重度急性呼吸综合征(sars)、志贺产毒大肠杆菌(stec/vtec)病、志贺氏菌病胃肠炎(志贺氏菌(shigella))、胫骨热、带状疱疹、航运热、西伯利亚蜱媒斑疹伤寒、窦炎、第六病、掴颊病(slappedcheekdisease)、昏睡病、天花(痘疮)、血吸虫病(snailfever)、软性下疳、南方蜱虫相关皮疹病(southerntickassociatedrashillness)、裂头蚴病(sparganosis)、洞穴探索者病(spelunker’sdisease)、散发性斑疹伤寒、孢子丝菌病、斑疹热、春季病、圣路易斯脑炎(st.louisencephalitis)、葡萄球菌性食物中毒、葡萄球菌感染、链球菌咽炎、链球菌病、链球菌中毒性休克综合征、类圆线虫病、麦粒肿、亚急性硬化性全脑炎、亚急性硬化性全脑炎(sspe)、突发性急性呼吸综合征、突发性皮疹、游泳者耳病、游泳者痒病、游泳池性结膜炎、森林黄热病、梅毒、全身性炎症性应答综合征(sirs)、脊髓痨(三期梅毒)、绦虫病、泰加脑炎(taigaencephalitis)、制革工人病(tanner'sdisease)、绦虫感染、颞叶脑炎、颞叶脑炎、破伤风(牙关紧闭症)、破伤风感染、蛲虫感染、鹅口疮、蜱虫病、蜱媒斑疹伤寒、须癣、发癣、体癣、股癣、手癣、黑癣、脚癣、甲癣、花斑癣、球拟酵母病、隐球菌病、中毒性休克综合征、弓浆虫病、可传播性海绵状病(cjd)、旅行者腹泻(traveler'sdiarrhea)、战壕热5、旋毛虫病、滴虫病、腋毛菌病、鞭虫病、热带痉挛性下肢轻瘫(tsp)、锥虫病、结核病(tb)、结核病、野免热、伤寒、斑疹伤寒、软下疳(ulcusmolle)、波状热(undulantfever)、城市型黄热病(urbanyellowfever)、尿道炎、阴道炎、阴道病、万古霉素中度抗性金黄色葡萄球菌病(visa)、万古霉素抗性金黄色葡萄球菌病(vrsa)、水痘、委内瑞拉马脑炎、秘鲁疣、霍乱弧菌病(霍乱)、弧菌病(弧菌)、文森特氏病(vincent'sdisease)或战壕口炎、病毒性结膜炎、病毒性脑膜炎、病毒性脑膜脑炎、病毒性皮疹、内脏幼虫移行症、黄热病、外阴阴道炎、疣、沃特豪斯病(waterhouse)、韦尔氏病、西尼罗河热、西部马脑炎、惠普尔氏病、鞭虫感染、白色毛孢子菌病、蹄冠炎、惠特莫尔氏病、冬季腹泻、战壕热(wolhyniafever)、拣毛工病(woolsorters'disease)、雅司病(yaws)、黄热病、耶尔森菌病(yersinosis)、耶尔森菌病(耶尔森氏菌(yersinia))、扎霍斯基氏病(zahorsky'sdisease)、寨卡病毒病、带状疱疹、接合菌病、约翰坎宁安病毒(johncunninghamvirus,jcv)病、人免疫缺陷病毒(人免疫缺陷病毒)病、流感病毒病、乙型肝炎、丙型肝炎、丁型肝炎、呼吸道融合性病毒(rsv)、单纯疱疹病毒1和2、人巨细胞病毒病、艾伯斯坦-巴尔病毒病、水痘带状疱疹病毒病、冠状病毒病、痘病毒病、肠病毒71病、风疹病毒病、人乳头状瘤病毒病、肺炎链球菌(streptococcuspneumoniae)病、草绿色链球菌(streptococcusviridans)病、金黄色葡萄球菌(staphylococcusaureus/s.aureus)病、甲氧西林抗性金黄色葡萄球菌(mrsa)病、万古霉素中度抗性金黄色葡萄球菌(visa)病、万古霉素抗性金黄色葡萄球菌病(vrsa)病、表皮葡萄球菌(staphylococcusepidermidis/s.epidermidis)病、破伤风梭菌(clostridiumtetani)病、百日咳博德特氏菌(bordetellapertussis)病、副百日咳博德特氏菌(bordetellaparatussis)病、分支杆菌(mycobacterium)病、野兔热弗朗西斯氏菌(francisellatularensis)病、刚地弓形虫(toxoplasmagondii)病、念珠菌(candida)(白色念珠菌(c.albicans)、光滑念珠菌(c.glabrata)、近平滑念珠菌(c.parapsilosis)、热带念珠菌(c.tropicalis)、克鲁斯念珠菌(c.krusei)和葡萄牙念珠菌(c.lusitaniae))病和/或任何其他感染性疾病、病症或综合征。各种毒素可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷处理。毒素的非限制性实例包括篦麻毒素、炭疽芽孢杆菌毒素、志贺毒素和志贺样毒素、肉毒杆菌毒素。各种热带疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。热带疾病的非限制性实例包括切昆贡亚热、登革热、查加斯病、狂犬病、疟疾、埃博拉病毒病、马伯格病毒病、西尼罗病毒病、黄热病、日本脑炎病毒病、圣路易斯脑炎病毒病。各种食源性病和胃肠炎可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。食源性病和胃肠炎的非限制性实例包括轮状病毒病、诺瓦克病毒(诺如病毒)病、空肠弯曲杆菌(campylobacterjejuni)病、艰难梭菌病、溶组织内阿米巴病、幽门螺杆菌(helicobacterpylori)病、金黄色葡萄球菌的肠毒素b病、甲型肝炎病毒(hav)病、戊型肝炎、单核细胞增多性李斯特菌病、沙门氏菌病、产气荚膜梭菌病和沙门氏菌病。各种感染物可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷处理。感染物的非限制性实例包括腺病毒、嗜吞噬细胞无形体(anaplasmaphagocytophilium)、人蛔虫(ascarislumbricoides)、炭疽芽孢杆菌(bacillusanthracis)、蜡样芽孢杆菌(bacilluscereus)、拟杆菌属某种(bacteriodessp.)、巴马森林病毒、杆菌状巴尔通氏体(bartonellabacilliformis)、汉赛巴尔通氏体(bartonellahenselae)、五日热巴尔通氏体(bartonellaquintana)、产气荚膜梭菌的β毒素、百日咳博德特氏菌、副百日咳博德特氏菌(bordetellaparapertussis)、伯氏疏螺旋体(borreliaburgdorferi)、宫本疏螺旋体(borreliamiyamotoi)、回归热疏螺旋体(borreliarecurrentis)、疏螺旋体属某种(borreliasp.)、肉毒杆菌毒素、布鲁氏菌属某种(brucellasp.)、类鼻疽伯克霍尔德氏菌(burkholderiapseudomallei)、加利福尼亚脑炎病毒、弯曲杆菌(campylobacter)、白色念珠菌(candidaalbicans)、切昆贡亚病毒(chikungunyavirus)、鹦鹉热衣原体(chlamydiapsittaci)、沙眼衣原体(chlamydiatrachomatis)、中华枝睾吸虫(clonorchissinensis)、艰难梭菌细菌、破伤风梭菌、科罗拉多蜱传热病毒、白喉棒杆菌、微小棒杆菌(corynebacteriumminutissimum)、贝纳特氏立克次体(coxiellaburnetii)、柯萨奇a、柯萨奇b、克里米亚-刚果出血热病毒、巨细胞病毒、登革病毒、东方马脑炎病毒、埃博拉病毒、埃可病毒、查菲埃里希氏体(ehrlichiachaffeensis)、马埃里希氏体(ehrlichiaequi)、埃里希氏体属某种、溶组织内阿米巴、肠杆菌属某种、粪肠球菌(enterococcusfaecalis)、肠病毒71(enterovirus71)、艾伯斯坦-巴尔病毒(ebv)、红斑丹毒丝菌(erysipelothrixrhusiopathiae)、大肠杆菌(escherichiacoli)、黄病毒(flavivirus)、坏死梭杆菌(fusobacteriumnecrophorum)、阴道加德纳菌(gardnerellavaginalis)、b组链球菌、埃及嗜血杆菌(haemophilusaegyptius)、杜克雷嗜血杆菌(haemophilusducreyi)、流感嗜血杆菌、汉坦病毒、幽门螺杆菌、甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、单纯疱疹病毒1和2、人疱疹病毒6、人疱疹病毒8、人免疫缺陷病毒1和2、人t细胞白血病病毒i和ii、流感病毒(a、b、c)、詹姆士城峡谷病毒(jamestowncanyonvirus)、日本脑炎抗原、日本脑炎病毒、约翰坎宁安病毒、呼宁病毒(juninvirus)、卡波西氏肉瘤相关疱疹病毒(kshv)、肉芽肿克雷伯氏菌(klebsiellagranulomatis)、克雷伯氏菌属某种、卡萨努森林病病毒(kyasanurforestdiseasevirus)、拉克罗斯病毒、拉沙病毒(lassavirus)、嗜肺军团菌、问号钩端螺旋体、单核细胞增多性李斯特菌、淋巴细胞性脉络丛脑膜炎病毒、丽沙病毒(lyssavirus)、马丘坡病毒(machupovirus)、马伯格病毒、麻疹病毒、mers冠状病毒(mers-cov)、栖息小球菌(micrococcussedentarius)、动弯杆菌属某种(mobiluncussp.)、软疣痘病毒、卡它莫拉氏菌(moraxellacatarrhalis)、麻疹-麻疹病毒(morbilli-rubeolavirus)、腮腺炎病毒、麻风分枝杆菌(mycobacteriumleprae)、结核分枝杆菌、溃疡分枝杆菌(mycobacteriumulcerans)、生殖器支原体(mycoplasmagenitalium)、支原体属某种、内罗毕病毒(nairovirus)、淋病奈瑟氏菌(neisseriagonorrhoeae)、脑膜炎奈瑟氏菌(neisseriameningitidis)、诺卡菌、诺瓦克病毒、诺如病毒、鄂木斯克出血热病毒、乳头状瘤病毒、副流感病毒1-3、副痘病毒、细小病毒b19、消化链球菌属某种(peptostreptococccussp.)、疟原虫属某种(plasmodiumsp.)、i、ii和iii型脊髓灰质炎病毒型、变形杆菌属某种(proteussp.)、绿脓假单胞菌、惠特莫尔氏杆菌、假单胞菌属某种、狂犬病病毒、呼吸道融合性病毒、篦麻毒素毒素、澳洲立克次氏体(rickettsiaaustralis)、康诺尔立克次氏体(rickettsiaconori)、霍氏立克次氏体(rickettsiahonei)、普氏立克次氏体(rickettsiaprowazekii)、罗斯河病毒、轮状病毒、风疹病毒、圣路易型脑炎、伤寒沙门氏菌、疥螨、sars相关冠状病毒(sars-cov)、沙雷氏菌属某种、志贺毒素和志贺样毒素、志贺氏菌属某种、辛诺柏病毒、雪鞋野兔病毒、金黄色葡萄球菌、表皮葡萄球菌、念珠状链杆菌、肺炎链球菌、无乳链球菌、无乳链球菌、a-h组链球菌、肺炎链球菌、化脓性链球菌、梅毒密螺旋体苍白亚种(treponemapallidumsubsp.pallidum)、梅毒密螺旋体斑点病变种(treponemapallidumvar.carateum)、梅毒密螺旋体流行性变种(treponemapallidumvar.endemicum)、惠普尔吸收不良菌(tropherymawhippelii)、解脲脲原体(ureaplasmaurealyticum)、水痘-带状疱疹病毒、天花病毒、霍乱弧菌、西尼罗病毒、黄热病毒、小肠结肠炎耶尔森氏菌、鼠疫耶尔森氏菌和寨卡病毒。各种罕见疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。如本文所用,术语“罕见疾病”是指影响群体中的小百分比成员的任何疾病。作为一非限制性实例,罕见疾病可为阿佩尔氏综合征(acrocephalosyndactylia)、肢皮炎、阿狄森病(addisondisease)、艾迪综合征(adiesyndrome)、阿拉吉欧综合征(alagillesyndrome)、淀粉样变性、肌萎缩性侧索硬化、安吉尔曼综合征(angelmansyndrome)、血管淋巴样增生伴嗜酸粒细胞增多(angiolymphoidhyperplasiawitheosinophilia)、阿诺德-吉亚利畸形(arnold-chiarimalformation)、关节炎、青少年类风湿病、亚斯伯格综合征(aspergersyndrome)、巴得-毕德综合征(bardet-biedlsyndrome)、巴雷特食道症(barrettesophagus)、贝克威思-威德曼综合征(beckwith-wiedemannsyndrome)、贝塞特综合征(behcetsyndrome)、布卢姆综合征(bloomsyndrome)、博文氏病(bowen'sdisease)、臂丛神经病变(brachialplexusneuropathies)、布朗-斯夸综合征(brown-sequardsyndrome)、巴德-吉亚利综合征(budd-chiarisyndrome)、伯基特淋巴瘤、癌瘤256、沃克病(walker)、卡罗利病(carolidisease)、恰克-马利-杜斯病(charcot-marie-toothdisease)、切迪阿克-东综合征(chediak-higashisyndrome)、基亚里-弗罗梅尔综合征(chiari-frommelsyndrome)、点状软骨发育不良(chondrodysplasiapunctata)、结肠假性梗阻、结肠直肠赘瘤、遗传性非息肉病(hereditarynonpolyposis)、颅骨面骨发育不全(craniofacialdysostosis)、克罗伊茨费尔特-雅各布综合征(creutzfeldt-jakobsyndrome)、克罗恩病(crohndisease)、柯兴综合征(cushingsyndrome)、囊性纤维化、丹迪-沃克综合征(dandy-walkersyndrome)、狄兰格综合征(delangesyndrome)、血管性痴呆、疱疹样皮炎、迪乔治综合征(digeorgesyndrome)、希尔德弥漫性脑硬化(diffusecerebralsclerosisofschilder)、杜安眼球退缩综合征(duaneretractionsyndrome)、迪皮特朗挛缩(dupuytrencontracture)、埃布斯坦畸形(ebsteinanomaly)、艾森门格复征(eisenmengercomplex)、埃利斯-范克里威德综合征(ellis-vancreveldsyndrome)、脑炎、软骨发育不良、表皮坏死溶解、中毒、单侧面萎缩、因子xii缺乏、范可尼贫血(fanconianemia)、费尔提氏综合征(felty'ssyndrome)、多骨性纤维性发育不良、福克斯-福代斯病(fox-fordycedisease)、弗里德希共济失调(friedreichataxia)、梭杆菌病、加德纳综合征(gardnersyndrome)、戈谢病(gaucherdisease)、格斯特曼综合征(gerstmannsyndrome)、巨大淋巴结增生、i型糖原贮积病、ii型糖原贮积病、iv型糖原贮积病、v型糖原贮积病、vii型糖原贮积病、戈尔登哈综合征(goldenharsyndrome)、格林-巴利综合征(guillain-barresyndrome)、哈勒曼氏综合征(hallermann'ssyndrome)、多发性错构瘤综合征、哈勒普病(hartnupdisease)、肝豆状核变性(hepatolenticulardegeneration)、肝豆状核变性、遗传性感觉和运动神经病变、赫什朋病(hirschsprungdisease)、组织细胞坏死性淋巴腺炎、组织细胞增多症、朗格汉斯细胞(langerhans-cell)病、霍奇金病、霍纳尔综合征(hornersyndrome)、亨廷顿病(huntingtondisease)、高醛固酮症、多汗、弥漫性特发性骨骼性骨肥厚、垂体机能减退、不当adh综合征、肠息肉、艾萨克综合征(isaacssyndrome)、卡塔格内综合征(kartagenersyndrome)、卡恩斯-塞尔综合征(kearns-sayresyndrome)、克利佩尔-费尔综合征(klippel-feilsyndrome)、克利佩尔-崔罗雷-韦伯综合征(klippel-trenaunay-webersyndrome)、克鲁尔-布西综合征(kluver-bucysyndrome)、科尔萨科夫综合征(korsakoffsyndrome)、拉福拉病(laforadisease)、兰伯特-伊顿肌无力综合征(lambert-eatonmyasthenicsyndrome)、兰达-克莱夫纳综合征(landau-kleffnersyndrome)、兰格-吉迪翁综合征(langer-giedionsyndrome)、利病(leighdisease)、莱希-尼亨综合征(lesch-nyhansyndrome)、脑白质营养不良、球样细胞(globoidcell)病、李-弗劳明综合征(li-fraumenisyndrome)、长qt综合征、马查多-约瑟夫病(machado-josephdisease)、马洛莱-韦斯综合征(mallory-weisssyndrome)、马雷克病(marekdisease)、马凡综合征(marfansyndrome)、梅克尔憩室(meckeldiverticulum)、梅杰综合征(meigesyndrome)、梅尔克松-罗森塔尔综合征(melkersson-rosenthalsyndrome)、梅尼埃尔病(menieredisease)、米库利奇氏病(mikulicz'sdisease)、米勒费雪综合征(millerfishersyndrome)、默比厄斯综合征(mobiussyndrome)、烟雾病(moyamoyadisease)、皮肤粘膜淋巴结综合征、粘多糖贮积症i、粘多糖贮积症ii、粘多糖贮积症iii、粘多糖贮积症iv、粘多糖贮积症vi、1型多发性内分泌赘瘤形成、代理孟乔森综合征(munchausensyndromebyproxy)、脊柱肌肉萎缩、猝睡症、神经轴突营养不良(neuroaxonaldystrophies)、视神经脊髓炎、神经元蜡样质脂褐质沉积症(neuronalceroid-lipofuscinoses)、尼曼-皮克病(niemann-pickdisease)、努南综合征(noonansyndrome)、遗传性视神经萎缩(opticatrophy,hereditary)、畸形性骨炎(osteitisdeformans)、骨软骨炎、骨软骨发育不良、原发性骨质溶解(osteolysis,essential)、乳腺外佩吉特病(pagetdiseaseextramammary)、乳腺佩吉特氏病(paget'sdisease,mammary)、结节性非化脓性脂膜炎(panniculitis,nodularnonsuppurative)、帕皮永-勒菲弗病(papillon-lefevredisease)、麻痹、佩利措伊斯-梅茨巴赫病(pelizaeus-merzbacherdisease)、良性家族性天疱疮、纤维性海绵体炎、缩窄性心包炎、过氧化物酶体病症、珀茨-杰格斯综合征(peutz-jegherssyndrome)、脑皮克病(pickdiseaseofthebrain)、比埃洛宾综合征(pierrerobinsyndrome)、色素沉着病症、苔癣样糠疹、多囊性卵巢综合征、自体免疫多内分泌病变、普拉德-威利综合征(prader-willisyndrome)、瞳孔病症(pupildisorder)、雷特综合征(rettsyndrome)、雷意综合征(reyesyndrome)、鲁宾斯坦-泰必综合征(rubinstein-taybisyndrome)、山多夫病(sandhoffdisease)、尤因氏肉瘤、史尼兹勒综合征(schnitzlersyndrome)、舍格伦氏综合征(sjogren'ssyndrome)、舍格伦-拉森综合征(sjogren-larssonsyndrome)、史密斯-莱米莉-奥皮茨综合征(smith-lemli-opitzsyndrome)、儿童期脊柱肌肉萎缩、斯特奇-韦伯综合征(sturge-webersyndrome)、味觉性出汗、高安动脉炎(takayasuarteritis)、丹吉尔病(tangierdisease)、泰-萨斯病(tay-sachsdisease)、血栓闭塞性脉管炎、自体免疫甲状腺炎、泰齐氏综合征(tietze'ssyndrome)、披膜病毒感染(togaviridaeinfection)、托洛萨-亨特综合征(tolosa-huntsyndrome)、妥瑞综合征(tourettesyndrome)、葡萄膜脑膜脑炎综合征、瓦尔登布尔氏综合征(waardenburg'ssyndrome)、韦格纳肉芽肿病(wegenergranulomatosis)、韦尔病(weildisease)、沃纳综合征(wernersyndrome)、威廉姆斯综合征(williamssyndrome)、威尔姆斯肿瘤(wilmstumor)、沃夫-帕金森-怀特综合征(wolff-parkinson-whitesyndrome)、沃尔弗拉姆综合征(wolframsyndrome)、沃尔曼病(wolmandisease)、齐薇格综合征(zellwegersyndrome)、佐林格-埃利森综合征(zollinger-ellisonsyndrome)和冯威尔邦德病(vonwillebranddisease)。各种自体免疫疾病和自体免疫相关疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。如本文所用,术语“自体免疫疾病”是指其中身体产生攻击它的自身组织的抗体的疾病。作为一非限制性实例,自体免疫疾病可为急性播散性脑脊髓炎(adem)、急性坏死性出血性脑白质炎、阿狄森氏病、无γ球蛋白血症、斑形脱发、淀粉样变性、僵直性脊椎炎、抗gbm/抗tbm肾炎、抗磷脂综合征(aps)、自体免疫血管性水肿、自体免疫再生障碍性贫血、自体免疫自主神经异常、自体免疫肝炎、自体免疫高脂质血症、自体免疫免疫缺陷、自体免疫内耳病(aied)、自体免疫心肌炎、自体免疫卵巢炎、自体免疫胰腺炎、自体免疫视网膜病变、自体免疫血小板减少性紫癜(atp)、自体免疫甲状腺疾病、自体免疫荨麻疹、轴突和神经元神经病变、巴洛病(balodisease)、贝塞特氏病、大疱性类天疱疮、心肌病变、卡斯尔曼病(castlemandisease)、乳糜泻、查加斯病、慢性疲劳综合征、慢性炎症性脱髓鞘性多发性神经病变(cidp)、慢性复发性多灶性骨髓炎(crmo)、许尔-施特劳斯综合征(churg-strausssyndrome)、瘢痕性类天疱疮/良性粘膜类天疱疮、克罗恩氏病、柯根综合征(coganssyndrome)、冷凝集素病、先天性心脏阻滞、柯萨奇心肌炎、crest病、原发性混合冷球蛋白血症、脱髓鞘性神经病变、疱疹样皮炎、皮肤肌炎、德维克氏病(devic’sdisease)(视神经脊髓炎)、盘状狼疮、德雷斯勒氏综合征(dressler’ssyndrome)、子宫内膜异位症、嗜酸性粒细胞性食管炎、嗜酸性粒细胞性筋膜炎、结节性红斑、实验性过敏性脑脊髓炎、埃文斯综合征(evanssyndrome)、纤维肌痛**、纤维性肺泡炎、巨细胞动脉炎(颞动脉炎)、巨细胞心肌炎、肾小球性肾炎、古德帕斯彻氏综合征(goodpasture’ssyndrome)、肉芽肿病伴多血管炎(gpa)(先前称为韦格纳氏肉芽肿病)、格雷夫斯病、格林-巴利综合征、桥本氏脑炎、桥本氏甲状腺炎、溶血性贫血、亨诺克-舍恩来因紫癜(henoch-schonleinpurpura)、妊娠疱疹、低γ球蛋白血症、特发性血小板减少性紫癜(itp)、iga肾病变、igg4相关硬化病、免疫调控性脂蛋白病、包涵体肌炎、间质性膀胱炎、青少年关节炎、青少年糖尿病(1型糖尿病)、青少年肌炎、川崎综合征、兰伯特-伊顿综合征、白细胞破裂性血管炎、扁平苔癣、硬化性苔藓(lichensclerosis)、木质性结膜炎、线性iga疾病(lad)、狼疮(sle)、慢性莱姆病、美尼尔氏病、显微性多血管炎、混合结缔组织疾病(mctd)、莫伦氏溃疡(mooren’sulcer)、慕夏-哈伯曼病(mucha-habermanndisease)、多发性硬化症、重症肌无力、肌炎、猝睡症、视神经脊髓炎(德维克氏)、嗜中性白细胞减少症、眼瘢痕性类天疱疮、视神经炎、复发性风湿病、pandas(与链球菌相关的儿科自体免疫神经精神病症)、副赘生性小脑变性、阵发性夜间血红蛋白尿(pnh)、帕里龙伯格综合征(parryrombergsyndrome)、帕森尼奇-特纳综合征(parsonnage-turnersyndrome)、扁平部睫状体炎(周边葡萄膜炎)、天疱疮、外周神经病变、静脉周脑脊髓炎、恶性贫血、poems综合征、多发性结节性动脉炎、i、ii和iii型自体免疫多腺性综合征、风湿性多肌痛、多发性肌炎、心肌梗塞后综合征、心包切开术后综合征、孕酮皮炎、原发性胆汁性硬化、原发性硬化性胆管炎、牛皮癣、牛皮癣性关节炎、特发性肺纤维化、坏疽性脓皮病、纯红细胞再生障碍、雷诺现象(raynaudsphenomenon)、反应性关节炎、反射交感神经性营养不良、莱特尔氏综合征、复发性多软骨炎、多动腿综合征、腹膜后纤维化、风湿热、类风湿性关节炎、类肉瘤病、施密特综合征(schmidtsyndrome)、巩膜炎、硬皮病、舍格伦氏综合征、精子和睾丸自体免疫性、僵人综合征、亚急性细菌性心内膜炎(sbe)、苏萨克氏综合征(susac’ssyndrome)、交感性眼炎、高安氏动脉炎、颞动脉炎/巨细胞动脉炎、血小板减少性紫癜(ttp)、托洛萨-亨特综合征、横贯性脊髓炎、溃疡性结肠炎、未分化结缔组织疾病(uctd)、葡萄膜炎、血管炎、水疱大疱性皮肤病、白癜风和韦格纳氏肉芽肿病(现时被称为肉芽肿病伴多血管炎(gpa))。各种肾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,肾病可为阿博赫登-考夫曼-利尼亚克综合征(abderhalden-kaufmann-lignacsyndrome)(肾病变性胱氨酸贮积症)、腹部区室综合征、急性肾衰竭/急性肾损伤、急性叶性肾病、急性磷酸盐肾病变、急性肾小管坏死、腺嘌呤磷酸核糖基转移酶缺乏、腺病毒肾炎、奥尔波特综合征(alportsyndrome)、淀粉样变性、与心内膜炎和其他感染相关的anca血管炎、血管肌脂瘤、止痛药肾病变、神经性厌食症和肾病、血管紧张素抗体和局灶节段性肾小球硬化症、抗磷脂综合征、抗tnf-α疗法-相关肾小球性肾炎、apol1突变、表观盐皮质激素过多综合征(apparentmineralocorticoidexcesssyndrome)、马兜铃酸肾病变、中国草本肾病变、巴尔干地方性肾病变、巴特尔综合征(barttersyndrome)、甜菜尿、β-地中海贫血肾病、胆道铸型肾病变(bilecastnephropathy)、天然肾中的bk多瘤病毒肾病变、膀胱破裂、膀胱括约肌协同困难、膀胱填塞、博德-克洛斯尔肾病变(border-crossers'nephropathy)、波旁病毒和急性肾损伤、灼烧甘蔗收集和急性肾功能异常、百泌达(byetta)和肾衰竭、c1q肾病变、大麻素剧吐急性肾衰竭、心肾综合征、卡非佐米(carfilzomib)诱发的肾损伤、cfhr5肾病变、恰克–马利–杜斯病伴肾小球病变、樱桃浓缩物和急性肾损伤、胆固醇血栓、许尔–施特劳斯综合征、乳糜尿、粘菌素肾毒性、胶原纤维性肾小球病变、塌陷性肾小球病变、与cmv相关的塌陷性肾小球病变、先天性肾病综合征、锥形骨骺肾性综合征(美因兹-萨尔迪诺综合征(mainzer-saldinosyndrome)或萨尔迪诺-美因兹病(saldino-mainzerdisease))、造影剂肾病变、硫酸铜中毒、皮质坏死、克唑替尼(crizotinib)相关急性肾损伤、冷球蛋白血症、晶体球蛋白诱发的肾病变、晶体诱发的急性肾损伤、获得性囊肾病、胱氨酸尿、达沙替尼诱发的肾病范围蛋白尿、致密沉积物病(2型mpgn)、登特病(dentdisease)(x染色体连锁的隐性肾石病)、透析平衡失调综合征、糖尿病和糖尿病性肾病、尿崩症、膳食补充剂和肾衰竭、滥用药物和肾病、输尿管重复、east综合征、埃博拉和肾病、肾异位、输尿管异位、水肿、肿胀、埃德海姆-切斯特病(erdheim-chesterdisease)、法布里氏病(fabry’sdisease)、家族性低尿钙高钙血症、范可尼综合征、弗雷泽综合征(frasersyndrome)、纤维连接蛋白肾小球病变、原纤维肾小球性肾炎和免疫触发性肾小球病变、弗雷利综合征(fraleysyndrome)、局灶节段性肾小球硬化症、局灶性硬化、间灶性肾小球硬化症、盖洛威莫沃特综合征(gallowaymowatsyndrome)、巨细胞(颞叶)动脉炎伴肾受累、妊娠性高血压、吉特尔曼综合征(gitelmansyndrome)、肾小球病、肾小球管回流、糖尿、古德帕斯彻综合征(goodpasturesyndrome)、染发剂摄取和急性肾损伤、汉坦病毒感染足细胞病变、血尿症(尿中有血)、溶血性尿毒综合征(hus)、非典型溶血性尿毒综合征(ahus)、噬血细胞性综合征、出血性膀胱炎、出血热伴肾综合征(hfrs、汉坦病毒肾病、韩国出血热、流行性出血热、流行性肾病)、与阵发性夜间血红蛋白尿和溶血性贫血相关的含铁血黄素沉积、肝肾小球病变、肝静脉闭塞病、窦状隙阻塞综合征、丙型肝炎相关肾病、肝肾综合征、草本补充剂和肾病、高血压和肾病、hiv相关肾病变(hivan)、马蹄肾(肾融合)、洪纳氏溃疡(hunner'sulcer)、高醛固酮症、高钙血症、高钾血症、高镁血症、高钠血症、高草酸尿症、高磷酸盐血症、血钙过少、低钾血症、低钾血症诱发的肾功能异常、低钾性周期性瘫痪、低镁血症、低钠血症、低磷酸盐血症、iga肾病变、igg4肾病变、间质性膀胱炎、疼痛膀胱综合征(问卷)、间质性肾炎、伊韦马克氏综合征(ivemark'ssyndrome)、氯胺酮相关膀胱功能异常、肾结石、肾石病、红茶菌毒性(kombuchateatoxicity)、铅肾病变和铅相关肾毒性、钩端螺旋体病肾病、轻链沉积病、单克隆免疫球蛋白沉积病、利德尔综合征(liddlesyndrome)、莱特伍德-欧博莱特综合征(lightwood-albrightsyndrome)、脂蛋白肾小球病变、锂肾毒性、lmx1b突变导致的遗传性fsgs、腰部疼痛血尿症、狼疮、全身性红斑狼疮、狼疮肾病、狼疮肾炎、狼疮肾炎伴抗中性粒细胞细胞质抗体血清阳性、莱姆病病相关肾小球性肾炎、疟疾肾病变、恶性肿瘤相关肾病、恶性高血压、软化斑、尿道口狭窄、髓质囊肾病、髓质海绵肾、巨输尿管、蜜胺毒性和肾病、膜增生性肾小球性肾炎、膜性肾病变、中美洲肾病变、代谢性酸中毒、代谢性碱中毒、甲氨蝶呤相关肾衰竭、显微性多血管炎、乳碱综合征(milk-alkalaisyndrome)、微小变化疾病、mdma(莫利(molly);狂喜迷幻药(ecstacy);3,4-亚甲基二氧基甲基苯丙胺)和肾衰竭、多囊性发育不良肾、多发性骨髓瘤、骨髓增生性赘瘤和肾小球病变、指甲-髌骨综合征(nail-patellasyndrome)、肾钙质沉着、肾性全身性纤维化、肾下垂(活动肾、肾下垂症)、肾病综合征(nephroticsyndrome)、神经源性膀胱(neurogenicbladder)、结节性肾小球硬化、非淋菌性尿道炎、胡桃夹综合征(nutcrackersyndrome)、口面指综合征、乳清酸尿、立位性低血压、立位性蛋白尿、渗压性利尿(osmoticdiuresis)、卵巢过度刺激综合征、佩吉肾(pagekidney)、乳头状坏死、乳头状肾综合征(肾缺损综合征、孤立肾发育不全)、细小病毒b19和肾病、腹膜-肾综合征、后尿道瓣膜(posteriorurethralvalve)病、感染后肾小球性肾炎、链球菌感染后肾小球性肾炎、多发性结节性动脉炎、多囊性肾病、后尿道瓣膜病、子痫前期、丙泊酚(propofol)输注综合征、增生性肾小球性肾炎伴单克隆igg沉积(纳斯尔病(nasrdisease))、蜂胶(蜜蜂树脂)相关肾衰竭、蛋白尿(尿中有蛋白)、假性醛固酮增多症、假性低碳酸氢盐血症、假性甲状旁腺功能减退、肺-肾综合征、肾盂肾炎(肾感染)、脓性肾病、放射性肾病、雷诺嗪(ranolazine)和肾病、再喂食综合征(refeedingsyndrome)、回流肾病变、快速进行性肾小球性肾炎、肾脓肿、肾周脓肿、肾发育不全、肾弓脉微血栓相关急性肾损伤、肾动脉动脉瘤、肾动脉狭窄、肾细胞癌、肾囊肿、肾低尿酸血症伴运动诱发的急性肾衰竭、肾梗塞、肾性骨营养不良、肾小管性酸中毒、肾素分泌性肿瘤(近血管球细胞肿瘤)、渗透调定点重设(resetosmostat)、下腔静脉后榆尿管、腹膜后纤维化、横纹肌瘤、与减肥手术相关的横纹肌瘤、类风湿性关节炎相关肾病、类肉瘤病肾病、肾和脑盐损耗(saltwasting)、血吸虫病和肾小球病、席姆克(schimke)免疫骨性发育不良、硬皮病肾危象、蛇形腓骨-多囊肾综合征(serpentinefibula-polycystickidneysyndrome)、埃克斯纳综合征(exnersyndrome)、镰状细胞肾病变、二氧化硅暴露和慢性肾病、斯里兰卡农民肾病、舍格伦氏综合征和肾病、合成大麻素使用和急性肾损伤、造血细胞移植后肾病、与干细胞移植相关的肾病、薄基底膜病、良性家族性血尿、膀胱三角炎、泌尿道结核病、结节性硬化、小管发育不全(tubulardysgenesis)、归因于针对近端小管刷状缘的自体抗体的免疫复合物小管间质性肾炎、肿瘤溶解综合征、尿毒症、尿毒性视神经病变、囊性输尿管炎、输尿管疝、尿道肉阜(urethralcaruncle)、尿道狭窄、尿失禁、泌尿道感染、泌尿道梗阻、膀胱肠瘘、膀胱输尿管回流、挥发性麻醉剂和急性肾损伤、冯希佩尔-林道病(vonhippel-lindaudisease)、瓦尔登斯特伦氏巨球蛋白血症肾小球性肾炎、华法林(warfarin)相关肾病变、黄蜂螫伤和急性肾损伤、韦格纳氏肉芽肿病、肉芽肿病伴多血管炎、西尼罗病毒和慢性肾病以及文德利希综合征(wunderlichsyndrome)。各种心血管疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,心血管疾病可为缺血性心脏病,也称为冠状动脉疾病,脑血管疾病(中风)、外周血管疾病、心脏衰竭、风湿性心脏病和先天性心脏病。各种抗体缺乏可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,抗体缺乏可为x染色体连锁的无γ球蛋白血症(xla)、常染色体隐性无γ球蛋白血症(ara)、常见变异型免疫缺陷(cvid)、igg(igg1、igg2、igg3和igg4)子类缺乏、选择性iga缺乏、特异性抗体缺乏(sad)、婴儿期短暂低γ球蛋白血症、抗体缺乏伴免疫球蛋白正常或升高、选择性igm缺乏、免疫缺陷伴胸腺瘤(古德氏综合征(good’ssyndrome))、运钴胺素蛋白ii缺乏,疣、低γ球蛋白血症、感染、先天性骨髓粒细胞缺乏症(whim)综合征、药物诱发的抗体缺乏、k链缺乏、重链缺乏、减数分裂后分离(pms2)病症和未指定的低γ球蛋白血症。各种眼病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,眼病可为甲状腺眼病(ted)、格雷夫斯病(graves'disease,gd)和眼眶病、视网膜变性、白内障、视神经萎缩、黄斑变性、利伯先天性黑朦(lebercongenitalamaurosis)、视网膜变性、视锥-视杆营养不良、厄舍综合征(ushersyndrome)、豹斑综合征(leopardsyndrome)、畏光和厌光。各种神经疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,神经疾病可为不存在透明隔、酸性脂酶病、酸性麦芽糖酶缺乏、获得性癫痫样失语、急性播散性脑脊髓炎、注意力缺陷-活动过度障碍(adhd)、艾迪氏瞳孔(adie'spupil)、艾迪综合征(adie'ssyndrome)、肾上腺脑白质营养不良、胼胝体发育不全、认识不能(agnosia)、艾卡尔迪综合征(aicardisyndrome)、艾卡尔迪-葛替尔斯综合征病症、aids-神经并发症、亚历山大病(alexanderdisease)、阿尔珀斯病(alpers'disease)、交替性半身不遂、阿尔茨海默氏病(alzheimer'sdisease)、肌萎缩性侧索硬化(als)、无脑、动脉瘤、安吉尔曼综合征、血管瘤病、缺氧症、抗磷脂综合征、失语、精神性运动不能、蛛网膜囊肿、蛛网膜炎、阿诺德-吉亚利畸形(arnold-chiarimalformation)、动静脉畸形、亚斯伯格综合征、共济失调、共济失调性毛细血管扩张症、共济失调和小脑或脊髓小脑变性、心房纤维性颤动和中风、注意力缺陷-活动过度障碍、自闭症谱系障碍、自主功能异常、背痛、巴斯综合征(barthsyndrome)、巴登病(battendisease)、贝克尔氏肌强直(becker'smyotonia)、贝塞特氏病、贝尔氏麻痹(bell'spalsy)、良性原发性眼睑痉布拉德伯里-埃格尔斯顿综合征(bradbury-egglestonsyndrome)、脑和脊柱肿瘤、脑动脉瘤、脑损伤、布朗-斯夸综合征、延髓脊髓性肌肉萎缩、脑常染色体显性动脉病伴皮质下梗塞和脑白质病(cadasil)、卡纳万病(canavandisease)、腕管综合征、灼痛、海绵状瘤、海绵形痣、海绵状畸形、中心颈脊髓综合征(centralcervicalcordsyndrome)、中心脊髓综合征、中枢性疼痛综合征、脑桥中部髓鞘溶解、头部病症、神经酰胺酶缺乏、小脑变性、小脑发育不全、脑动脉瘤、脑动脉硬化、脑萎缩、脑型脚气病(cerebralberiberi)、脑海绵状畸形、大脑性巨人症、脑缺氧、脑性麻痹、脑-眼-面-骨骼综合征(cofs)、恰克-马利-杜斯病、吉亚利畸形、胆固醇酯贮积病、舞蹈病(chorea)、舞蹈病棘红细胞增多症(choreoacanthocytosis)、慢性炎症性脱髓鞘性多发性神经病变(cidp)、慢性直立不耐受性、慢性疼痛、ii型科凯恩综合征(cockaynesyndrometypeii)、柯芬洛利综合征(coffinlowrysyndrome)、空洞脑(colpocephaly)、昏迷、复杂性区域性疼痛综合征、先天性两侧面瘫、先天性肌无力、先天性肌病变、先天性血管海绵状畸形、皮质基底变性、颅动脉炎、颅缝早闭、克里脑炎(creeencephalitis)、克罗伊茨费尔特-雅各布病(creutzfeldt-jakobdisease)、累积创伤病症、库欣氏综合征(cushing'ssyndrome)、巨细胞包涵体病、巨细胞病毒感染、舞蹈眼-舞蹈足综合征(dancingeyes-dancingfeetsyndrome)、丹迪-沃克综合征、道森病(dawsondisease)、狄摩西尔氏综合征(demorsier'ssyndrome)、德热里纳-克隆普克麻痹(dejerine-klumpkepalsy)、痴呆、多发性梗塞痴呆、词义性痴呆、皮质下痴呆、路易体痴呆(dementiawithlewybodies)、齿状核小脑共济失调(dentatecerebellarataxia)、齿状核红核萎缩、皮肤肌炎、发育性运动困难、德维克氏综合征、糖尿病性神经病变、弥漫性硬化症、德拉韦综合征(dravetsyndrome)、自主神经异常、书写困难、阅读困难、吞咽困难、运动困难、肌阵挛性小脑协同失调、进行性小脑协同失调、肌张力障碍、早期婴儿癫痫性脑病变、空蝶鞍综合征(emptysellasyndrome)、脑炎、昏睡性脑炎(encephalitislethargica)、脑膨出、脑病变、脑病变(家族性婴儿性)、脑三叉神经性血管瘤病、癫痫、癫痫性半身不遂、厄尔布氏麻痹(erb'spalsy)、厄尔布-杜兴和德热里纳-克隆普克麻痹(erb-duchenneanddejerine-klumpkepalsy)、原发性震颤、脑桥外髓鞘溶解症、法布里病(fabrydisease)、法尔氏综合征(fahr'ssyndrome)、昏厥、家族性自主神经异常、家族性血管瘤、家族性特发性基底神经节钙化、家族周期性麻痹、家族性痉挛性麻痹、法伯氏病(farber'sdisease)、发热性癫痫发作、纤维肌性发育不良、费雪综合征(fishersyndrome)、婴儿松弛综合征、足下垂、弗里德希氏共济失调(friedreich'sataxia)、额颞叶性痴呆、戈谢病、全身性神经节苷脂沉积症(generalizedgangliosidoses)、格斯特曼氏综合征(gerstmann'ssyndrome)、格斯特曼-斯脱司勒-史茵克病(gerstmann-straussler-scheinkerdisease)、巨轴突神经病变、巨细胞动脉炎、巨细胞包涵体病、球样细胞性脑白质营养不良、舌咽神经痛、糖原贮积病、格林-巴利综合征、哈勒沃登-施帕茨病(hallervorden-spatzdisease)、头部损伤、头痛、持续性偏头痛、半面痉挛、交叉性半身不遂、遗传性神经病变、遗传性痉孪性截瘫、多神经炎型遗传性运动失调、带状疱疹、耳部带状疱疹、平山综合征(hirayamasyndrome)、霍姆斯-艾迪综合征(holmes-adiesyndrome)、前脑无裂畸形、htlv-1相关骨髓病、休斯综合征(hughessyndrome)、亨廷顿氏病(huntington'sdisease)、积水性无脑畸形、脑积水、常压性脑积水(hydrocephalus-normalpressure)、脊髓积水、皮质醇过多症、睡眠过度、张力亢进、张力减退、缺氧、免疫介导的脑脊髓炎、包涵体肌炎、色素失调症、婴儿张力减退、婴儿神经轴突营养不良、婴儿植烷酸贮积病、婴儿雷夫叙姆病(infantilerefsumdisease)、婴儿痉挛、炎症性肌病变、枕骨裂脑露畸形、肠原性脂肪代谢障碍、颅内囊肿、颅内高压、艾萨克综合征、朱伯特综合征(joubertsyndrome)、卡恩斯-塞尔综合征(kearns-sayresyndrome)、肯尼迪氏病(kennedy'sdisease)、金斯伯恩综合征(kinsbournesyndrome)、克莱恩-莱文综合征(kleine-levinsyndrome)、克利佩尔-费尔综合征、克利佩尔-崔罗雷综合征(kts)、克鲁尔-布西综合征(klüver-bucysyndrome)、科尔萨科夫氏遗忘综合征(korsakoff'samnesicsyndrome)、克拉伯病(krabbedisease)、库格伯格-维兰德病(kugelberg-welanderdisease)、库鲁病(kuru)、兰伯特-伊顿肌无力综合征、兰达-克莱夫纳综合征(landau-kleffnersyndrome)、股外侧皮神经卡压、侧髓综合征、学习失能、利氏病(leigh'sdisease)、伦诺克斯-加斯托综合征(lennox-gastautsyndrome)、莱希-尼亨综合征、脑白质营养不良、莱文-克里奇利综合征(levine-critchleysyndrome)、路易体痴呆、脂质贮积病、类脂蛋白沉积症、无脑回症、闭锁综合征、路格里克氏病(lougehrig'sdisease)、狼疮-神经后遗症、莱姆病病-神经并发症、马查多-约瑟夫病(machado-josephdisease)、大头畸形、巨头、梅尔克松-罗森塔尔综合征、脑膜炎、脑膜炎和脑炎、蒙克斯病(menkesdisease)、感觉异常性股痛、异染性脑白质营养不良、小头畸形、偏头痛、米勒费雪综合征(millerfishersyndrome)、小中风、线粒体肌病变、莫必斯综合征(moebiussyndrome)、单肢肌萎缩、运动神经元病、烟雾病、粘脂贮积症、粘多糖贮积症、多梗塞性痴呆、多灶性运动神经病变、多发性硬化症、多系统萎缩、多系统萎缩伴立位性低血压、肌营养不良、先天性肌无力、重症肌无力、脱髓鞘弥漫性硬化症、婴儿肌阵挛性脑病、肌阵挛、肌病变、先天性肌病变、甲状腺毒性肌病变、肌强直、先天性肌强直、猝睡症、神经棘红细胞增多症、神经变性伴脑铁积累、神经纤维瘤病、神经阻滞剂恶性综合征、aids的神经并发症、莱姆病的神经并发症、巨细胞病毒感染的神经后果、蓬佩病(pompedisease)的神经表现形式、狼疮的神经后遗症、视神经脊髓炎、神经性肌强直、神经元蜡样质脂褐质沉积症、神经元迁移病症、遗传性神经病变、神经类肉瘤病、神经梅毒、神经毒性、海绵形痣、尼曼-皮克病(niemann-pickdisease)、奥沙利文-麦克劳德综合征(o'sullivan-mcleodsyndrome)、枕神经痛、大田原综合征(ohtaharasyndrome)、橄榄体脑桥小脑萎缩、斜视眼阵挛肌阵挛、立位性低血压、过度使用综合征(overusesyndrome)、慢性疼痛、泛酸激酶相关神经变性、副赘生性综合征(paraneoplasticsyndrome)、感觉异常、帕金森氏病、发作性舞蹈手足徐动症(paroxysmalchoreoathetosis)、发作性偏头痛、帕里-龙伯格(parry-romberg)病、佩利措伊斯-梅茨巴赫病(pelizaeus-merzbacherdisease)、佩娜舒凯尔ii综合征(penashokeiriisyndrome)、神经周囊肿、周期性麻痹、外周神经病变、脑室周围白质软化、持续性植物状态、广泛性发育障碍(pervasivedevelopmentaldisorder)、植烷酸贮积病、皮克氏病、神经挟捏、梨状肌综合征(piriformissyndrome)、垂体肿瘤、多发性肌炎、蓬佩病、孔洞脑、脊髓灰质炎后综合征、带状疱疹后神经痛、感染后脑脊髓炎、体位性低血压、体位性直立心动过速综合征、体位性心动过速综合征、原发性齿状核萎缩、原发性侧索硬化、原发性进行性失语、朊病毒疾病、进行性面部单侧萎缩、进行性运动性共济失调、进行性多灶性脑白质病、进行性硬化性灰质萎缩、进行性核上麻痹、脸盲症、假性torch综合征(pseudo-torchsyndrome)、假弓形体病综合征、假脑瘤、心因性运动障碍、拉姆齐亨特综合征i(ramsayhuntsyndromei)、拉姆齐亨特综合征ii、拉斯穆森氏脑炎(rasmussen'sencephalitis)、反射性交感神经营养不良综合征、雷夫叙姆病、婴儿雷夫叙姆病、重复性动作障碍、反复性应激损伤、多动腿综合征、逆转录病毒相关骨髓病、雷特综合征、雷意氏综合征、风湿性脑炎、赖利-戴综合征(riley-daysyndrome)、骶神经根囊肿、圣维特斯舞蹈病(saintvitusdance)、涎腺病、山多夫病(sandhoffdisease)、谢尔德氏病(schilder'sdisease)、脑裂、赛特贝格病(seitelbergerdisease)、癫痫发作病症、词义性痴呆、中隔-眼发育不良、婴儿期重度肌阵挛性癫痫(smei)、摇晃婴儿综合征(shakenbabysyndrome)、带状疱疹、香-德尔格综合征(shy-dragersyndrome)、舍格伦氏综合征、睡眠呼吸暂停、昏睡病、索托斯综合征(sotossyndrome)、僵直、脊柱裂、脊髓梗塞、脊髓损伤、脊髓肿瘤、脊髓性肌肉萎缩、脊髓小脑萎缩、脊髓小脑变性、史提尔-理查德森-奥尔谢夫斯基综合征(steele-richardson-olszewskisyndrome)、僵人综合征、纹状体黑质变性、中风、斯特奇-韦伯综合征(sturge-webersyndrome)、亚急性硬化性全脑炎、皮质下动脉硬化性脑病变、短暂持续性单侧神经痛样(sunct)头痛、吞咽障碍、辛登南舞蹈病(sydenhamchorea)、昏厥、梅毒性脊柱硬化、脊髓积水空洞症、脊髓空洞症、全身性红斑狼疮、脊髓痨、迟发性运动障碍、塔勒夫囊肿(tarlovcysts)、泰-萨斯病(tay-sachsdisease)、颞动脉炎、脊髓栓系综合征(tetheredspinalcordsyndrome)、汤姆森氏肌强直(thomsen'smyotonia)、胸部出口综合征、甲状腺毒性肌病变、三叉神经痛、托德氏麻痹(todd'sparalysis)、妥瑞综合征(tourettesyndrome)、短暂性缺血性发作、传染性海绵状脑病变、横贯性脊髓炎、创伤性脑损伤、震颤、三叉神经痛、热带痉挛性下肢轻瘫、特洛伊综合征(troyersyndrome)、结节性硬化、血管勃起肿瘤(vascularerectiletumor)、中枢和外周神经系统血管炎综合征、冯艾克诺默氏病(voneconomo’sdisease)、冯希佩尔-林道病(vonhippel-lindaudisease,vhl)、冯雷克林豪森氏病(vonrecklinghausen'sdisease)、瓦伦伯格氏综合征(wallenberg'ssyndrome)、韦德尼希-霍夫曼病(werdnig-hoffmandisease)、韦尼克-科尔萨科夫综合征(wernicke-korsakoffsyndrome)、韦斯特综合征(westsyndrome)、挥鞭伤(whiplash)、惠普尔氏病(whipple'sdisease)、威廉姆斯综合征(williamssyndrome)、威尔逊病(wilsondisease)、沃尔曼氏病(wolman’sdisease)、x染色体连锁的脊柱和延髓肌肉萎缩。各种心理障碍可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,心理障碍可为意志力丧失、失神性癫痫、急性应激障碍、适应障碍、药物不利作用(nos)、年龄相关的认知衰退、广场恐怖症、酒精成瘾、阿尔茨海默氏病(alzheimer’sdisease)、遗忘(也称为遗忘障碍)、安非他明成瘾(amphetamineaddiction)、神经性厌食症、顺行性遗忘、反社会人格障碍(也称为社会性病态)、焦虑障碍(也称为广泛性焦虑障碍)、抗焦虑剂相关障碍、亚斯伯格氏综合征(现时是自闭症谱系障碍的一部分)、注意力缺陷障碍(也称为add)、注意力缺陷活动过度障碍(也称为adhd)、自闭症谱系障碍(也称为自闭症)、自体消瘦、回避性人格障碍、巴比妥相关障碍、苯并二氮呯相关障碍、丧亡、藏书狂、暴食障碍、双相障碍(也称为躁狂抑郁,包括双相i和双相ii)、身体畸形障碍、边界智力功能、边缘人格障碍、呼吸相关睡眠障碍、短暂精神病性障碍、夜间磨牙、神经性贪食症、咖啡因成瘾、大麻成瘾、紧张型障碍、紧张型精神分裂症、儿童期遗忘、儿童期崩解障碍(现时是自闭症谱系障碍的一部分)、儿童期发作性流畅障碍(先前称为口吃)、昼夜节律障碍、幽闭恐怖症、可卡因相关障碍、沟通障碍、品行障碍、转换障碍、科塔尔妄想(cotarddelusion)、循环性精神病(也称为循环性精神病障碍)、谵妄、妄想性障碍、痴呆、依赖型人格障碍(也称为无力性人格障碍)、人格解体障碍(现时称为人格解体/现实解体障碍)、抑郁(也称为重度抑郁障碍)、抑郁型人格障碍、现实解体障碍(现时称为人格解体/现实解体障碍)、强迫性皮肤搔抓症(dermotillomania)、同步失调、发育性协调障碍、戴奥真尼斯综合征(diogenessyndrome)、书写表达障碍、情感不快、反社会人格障碍、分离性遗忘、分离性神游症、分离性身份障碍(先前称为多重人格障碍)、唐综合征(downsyndrome)、阅读困难、性交疼痛、心境恶劣(现时称为持续性抑郁障碍)、进食障碍(nos)、埃克波姆氏综合征(ekbom’ssyndrome)(妄想性寄生虫病)、情绪不稳定人格障碍、大便失禁、遗尿(尿床)、色情狂、露阴障碍、表达性语言障碍、做作性障碍、女性性功能障碍、恋物障碍、二联性精神病(folieàdeux)、佛列哥利妄想(fregolidelusion)、摩擦障碍、神游状态、甘瑟综合征(gansersyndrome)、赌博成瘾、性别烦躁不安(先前称为性别认同障碍)、广泛性焦虑障碍、全身性适应综合征、自大型妄想、迷幻剂成瘾、不稳定型人格障碍(haltlosepersonalitydisorder)、戏剧化人格障碍、原发性睡眠过度、亨廷顿氏病、机能减退性性欲障碍、臆想症、轻度躁狂、运动过度综合征、睡眠过度、癔病、冲动控制障碍、冲动控制障碍(nos)、吸入剂成瘾、失眠、智力发展障碍、间歇性爆发性障碍、朱伯特综合征(joubertsyndrome)、盗窃癖、科尔萨科夫氏综合征(korsakoff’ssyndrome)、空隙性遣忘、语言障碍、学习障碍、重度抑郁(也称为重度抑郁障碍)、重度抑郁障碍、男性性功能障碍、装病、数学障碍、药物相关障碍、忧郁症、智力迟钝(现时称为智力发展障碍)、恐音症、病态嫉妒、多重人格障碍(现时称为分离性身份障碍)、孟乔森综合征(munchausensyndrome)、代理孟乔森病(munchausenbyproxy)、自恋人格障碍、猝睡症、忽视儿童、神经认知障碍(先前称为痴呆)、神经阻滞剂相关障碍、恶梦障碍、非快速眼动障碍、强迫症、强迫性人格障碍(也称为强迫型人格障碍)、梦呓性精神病、咬甲癖、类鸦片成瘾、对立反抗障碍、健康食品痴迷症(on)、疼痛障碍、惊恐发作、惊恐障碍、妄想狂样人格障碍、帕金森氏病、伴侣关系问题、被动攻击型人格障碍、病态赌博、恋童障碍、完美主义、迫害性妄想、持续性抑郁障碍(也称为心境恶劣)、归因于一般性医学状况的人格改变、人格障碍、广泛性发育障碍(pdd)、苯环己哌啶相关障碍、病态性恐惧障碍、音韵学障碍、身体虐待、异食癖、多物质相关障碍、产后抑郁、创伤后愤懑障碍(pted)、创伤后应激障碍、早泄、经前烦躁不安障碍、心因性遗忘、影响医学状况的心理因素、精神神经病性人格障碍、未另外指定的精神病障碍、放火狂、反应性依恋障碍、阅读障碍、复发性短期抑郁、关系障碍、rem睡眠行为障碍、不宁腿综合征、逆行遗忘、雷特障碍(rettsdisorder)(现时是自闭症谱系障碍的一部分)、反刍综合征、虐待狂人格障碍、分裂情感性障碍、精神分裂样人格障碍、精神分裂症、精神分裂症样障碍、分裂型人格障碍、季节性情感障碍、镇静剂成瘾、安眠药成瘾或抗焦虑剂成瘾、选择性缄默症、自我挫败型人格障碍、分离焦虑障碍、女性性功能障碍、男性性功能障碍、性成瘾、性受虐狂障碍、性虐待症障碍、共有型精神病障碍、睡眠觉醒障碍、睡眠麻痹、睡眠恐怖障碍(现时是恶梦障碍的一部分)、社交焦虑障碍、躯体症状障碍、特定恐惧症、司汤达综合征(stendhalsyndrome)、刻板型运动障碍(stereotypicmovementdisorder)、刺激物成瘾、口吃(现时称为儿童期发作流畅障碍)、物质相关障碍、迟发性运动障碍、烟草成瘾、妥瑞综合征、短暂痉挛障碍、暂时性完全遗忘、异装障碍、拔毛狂、未分化型躯体形式障碍、阴道痉挛和偷窥障碍。各种肺病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,肺病可为石棉沉着病、哮喘、支气管扩张、支气管炎、慢性咳嗽、慢性阻塞性肺病(copd)、喉头炎、囊性纤维化、汉坦病毒病、特发性肺纤维化、百日咳、胸膜炎、肺炎、肺栓塞、肺高血压、类肉瘤病、睡眠呼吸暂停、肺活量测定、婴儿猝死综合征(sids)、结核病、阿拉吉欧综合征、自体免疫肝炎、胆道闭锁、肝硬化、ercp(内窥镜逆行性胆胰管造影)和血色素沉着病。非酒精性脂肪性肝炎、紫质症、原发性胆汁性硬化、原发性硬化性胆管炎。各种骨病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,骨病可为骨质疏松、神经纤维瘤病、成骨不全(oi)、佝偻病、骨肉瘤、软骨发育不全、骨折、骨髓炎、骨尤因肿瘤、骨软化、髋关节发育不良、骨佩吉特病、大理石状骨病、骨软骨瘤、骨癌、骨病、骨软骨病、骨瘤、纤维性发育不良、锁骨颅骨发育不全、破骨细胞瘤、骨囊肿、代谢骨病、肢骨纹状肥大、愈伤组织、卡菲综合征(caffeysyndrome)和下颌面骨发育不全。各种血液疾病可用本发明的药物组合物、生物回路、生物回路组分、包括它们的sre的效应物模块或有效载荷治疗。作为一非限制性实例,血液疾病可为贫血和ckd(对于健康护理专业人员来说)、再生障碍性贫血和骨髓发育不良综合征、深静脉血栓形成、血色素沉着病、血友病、亨诺克-许兰紫癜(purpura)、特发性血小板减少性紫癜、缺铁性贫血、恶性贫血、肺栓塞、镰状细胞贫血、镰状细胞性状和其他血红蛋白病、地中海贫血、血栓性血小板减少性紫癜和冯威尔邦德病(vonwillebranddisease)。在某一实施方案中,本发明的生物回路可用于治疗感染性疾病。可将本发明的生物回路引入适于进行过继性细胞转移的细胞诸如巨噬细胞、树突细胞、天然杀伤细胞和/或t细胞中。通过本发明的生物回路来治疗的感染性疾病可为由病毒、细菌、真菌和/或寄生物引起的疾病。本发明的il15-il15ra有效载荷可用于使适用于治疗感染性疾病的免疫细胞的免疫细胞增殖和/或持久性增加。6.微生物群系微生物群系的组成的改变可影响抗癌疗法的作用。互利共生、偏利共生和病原性微生物的多样性群落存在于身体中的所有环境暴露部位中,并且在本文中被称为“微生物群系”。身体的可由微生物群系栖息的环境暴露部位包括皮肤、鼻咽、口腔、呼吸道、胃肠道和生殖道。在一些实施方案中,用本发明的生物回路工程化的微生物群系可用于使抗癌免疫疗法的功效改进。sivan等人发现在皮下黑素瘤肿瘤模型中,在它们的消化道微生物群系中具有双歧杆菌(bifidobacterium)的小鼠对免疫检查点阻断例如抗pd-l1免疫疗法更具响应性(sivana.等commensalbifidobacteriumpromotesantitumorimmunityandfacilitatesanti-pd-l1efficacy.science2015;350:1084–9;其内容以引用的方式整体并入本文)。在一个实施方案中,源于微生物群系的蛋白质、rna和/或其他生物分子可作为有效载荷用于影响抗癌免疫疗法的功效。在其他实施方案中,微生物可连同本发明的免疫治疗组合物一起递送以使免疫疗法的功效改进。7.用于制备治疗剂的工具和试剂本发明中提供可用于产生用以使有需要的受试者中的肿瘤体积或负荷降低的免疫治疗剂的工具和试剂。大量变量涉及于产生治疗剂中,诸如有效载荷的结构、细胞的类型、基因转移的方法、离体扩增的方法和时间、预先调节以及受试者中肿瘤负荷的数量和类型。所述参数可使用本文所述的工具和试剂来优化。细胞系本公开提供一种已用本发明组合物遗传修饰的哺乳动物细胞。适合哺乳动物细胞包括原代细胞和永生化细胞系。适合哺乳动物细胞系包括但不限于人胚肾细胞系293、纤维母细胞系nih3t3、人结肠直肠癌细胞系hct116、卵巢癌细胞系skov-3、永生化t细胞系jurkat细胞、淋巴瘤细胞系raji细胞、nalm-6细胞、k562细胞、hela细胞、pc12细胞、hl-60细胞、nk细胞系(例如nkl、nk962和yts)等。在一些情况下,细胞不是永生化细胞系,而是从个体获得的细胞,并且在本文中被称为原代细胞。举例来说,细胞是从个体获得的t淋巴细胞。其他实例包括但不限于从个体获得的细胞毒性细胞、干细胞、外周血液单核细胞或祖细胞。追踪sre、生物回路和细胞系在一些实施方案中,可合乎需要的是追踪本发明组合物或通过本发明组合物来修饰的细胞。追踪可通过使用有效载荷诸如报告子部分来实现,如本文所用,所述报告子部分是指能够响应于输入而产生可检测信号的任何蛋白质。实例包括碱性磷酸酶、β-半乳糖苷酶、氯霉素乙酰转移酶、β-葡萄糖醛酸苷酶、过氧化物酶、β-内酰胺酶、催化性抗体、生物发光蛋白质例如荧光素酶和荧光蛋白诸如绿色荧光蛋白(gfp)。报告子部分可用于监测在添加对应于dd的配体后,dd的响应。在其他情况下,报告子部分可用于在体外、在体内或离体追踪细胞存活、持久性、细胞生长和/或定位。在一些实施方案中,优选报告子部分可为荧光素酶蛋白质。在一个实施方案中,报告子部分是海肾荧光素酶或萤火虫荧光素酶。动物模型本发明组合物的效用和功效可在动物模型优选是小鼠模型中加以体内测试。所用小鼠模型可为同种同基因小鼠模型,其中小鼠细胞用本发明组合物修饰,并且在具有相同遗传背景的小鼠中加以测试。实例包括pmel-1和4t1小鼠模型。或者,在所述研究中也可利用异种移植物模型,其中将人细胞诸如肿瘤细胞和免疫细胞引入免疫缺陷小鼠中。所用免疫缺陷小鼠可为cbyj.cg-foxn1nu/j、b6;129s7-rag1tm1mom/j、b6.129s7-rag1tm1mom/j、b6.cb17-prkdcscid/szj、nod.129s7(b6)-rag1tm1mom/j、nod.cg-rag1tm1momprf1tm1sdz/sz、nod.cb17-prkdcscid/szj、nod.cg-prkdcscidb2mtm1unc/j、nod-scidil2rgnull、裸(nu)小鼠、scid小鼠、nod小鼠、rag1/rag2小鼠、nod-scid小鼠、il2rgnull小鼠、b2mnull小鼠、nod-scidil2rγnull小鼠、nod-scid-b2mnull小鼠和hla转基因小鼠。细胞测定在一些实施方案中,本发明组合物作为免疫治疗剂的有效性可使用细胞测定来评估。本发明组合物的表达水平和/或身份可根据本领域中已知的用于鉴定蛋白质和/或定量蛋白质水平的任何方法来测定。在一些实施方案中,所述方法可包括蛋白质印迹、流式细胞术和免疫沉淀。本文提供用于在功能上表征表达本发明的sre、生物回路和组合物的细胞的方法。在一些实施方案中,功能性表征在原代免疫细胞或永生化免疫细胞系的情况下进行,并且可通过细胞表面标志物的表达来确定。t细胞的细胞表面标志物的实例包括但不限于cd3、cd4、cd8、cd14、cd20、cd11b、cd16、cd45和hla-dr、cd69、cd28、cd44、ifnγ。抗原呈递细胞的细胞表面标志物的实例包括但不限于i类mhc、ii类mhc、cd40、cd45、b7-1、b7-2、ifnγ受体和il2受体、icam-1和/或fcγ受体。树突细胞的细胞表面标志物的实例包括但不限于i类mhc、ii类mhc、b7-2、cd18、cd29、cd31、cd43、cd44、cd45、cd54、cd58、cd83、cd86、cmrf-44、cmrf-56、dcir和/或树凝素-1等;而在一些情况下,也具有cd2、cd3、cd4、cd8、cd14、cd15、cd16、cd19、cd20、cd56和/或cd57的不存在性。nk细胞的细胞表面标志物的实例包括但不限于ccl3、ccl4、ccl5、粒溶素、粒酶b、粒酶k、il10、il22、ifng、lap、穿孔素和tnfa。8.基因编辑crispr-cas9系统是一种新型基因组编辑系统,其已被快速开发以及在众多模型生物体和细胞类型中加以实施,并且取代其他基因组编辑技术诸如talen和zfn。crispr是存在于细菌和古细菌基因组中的序列基序,并且由以类似大小的独特间隔体分隔的短(约24-48个核苷酸)同向重复序列组成(grissa等bmcbioinformatics8,172(2007))。它们通常由为达成crispr维持和功能所需的一组crispr相关(cas)蛋白质编码基因侧接(barrangou等,science315,1709(2007),brouns等,science321,960(2008),haft等ploscomputbiol1,e60(2005))。crispr-cas系统提供针对侵袭性遗传元件(例如病毒、噬菌体和质粒)的适应性免疫性(horvath和barrangou,science,2010,327:167-170;bhaya等,annu.rev.genet.,2011,45:273-297;以及brrangour,rna,2013,4:267-278)。已对细菌中的三种不同类型的crispr-cas系统进行分类,并且对ii型crispr-cas系统的研究最多。在细菌性ii型crispr-cas系统中,从前重复序列-间隔体转录物(前crrna)加工的小型crisprrna(crrna)在反式活化性rna(tracrrna)/cas9存在下可与tracrrna/cas9复合物形成双链体。成熟复合物被募集至互补于tracrrna:crrna双链体中的间隔体序列的靶标双链dna序列以由cas9核酸内切酶对靶标dna进行裂解(garneau等,nature,2010,468:67-71;jinek等,science,2012,337:816-821;gasiunas等,proc.natlacad.sci.usa.,109:e2579-2586;以及haurwitz等,science,2010,329:1355-1358)。在ii型crispr-cas系统的情况下,由crrna:tracrrna/cas9复合物达成的靶标识别和裂解不仅需要tracrrna:crrna双链体中的互补于靶标序列(也称为“原间隔体”序列)的序列,而且也需要位于靶标多核苷酸的原间隔体序列的3'末端的原间隔体邻近基序(pam)序列。在不同crispr-cas系统之间,pam基序可变化。crispr-cas9系统已被开发和改进来用于遗传编辑中,并且被证明是一种用于编辑即使真核细胞中的核酸序列的高度有效和特异性技术。许多研究者公开了对细菌性crispr-cas系统的各种改进,并且证明crispr-cas系统可用于操作细胞中诸如哺乳动物细胞中以及植物细胞中的核酸。代表性参考专利包括美国专利号:8,993,233;8,999,641;8,945,839;8,932,814;8,906,616;8,895,308;8,889,418;8,889,356;8,871,445;8,865,406;8,771,945;和8,697,359;美国专利公布号:20150031134;20150203872;20150218253;20150176013;20150191744;20150071889;20150067922;和20150167000;所述专利各自以引用的方式整体并入本文。然而,对crispr-cas系统(例如引导rna和核酸酶)的作用和活性进行控制已正具有挑战性,并且经常可成问题。本发明的生物回路和/或它们的任何组分可用于调控或调谐crispr/cas9系统以使它的效用最优化。在一些实施方案中,本发明的效应物模块的有效载荷可包括cas9酶的替代性亚型或直系同源物。最通常使用的cas9源于化脓性链球菌(streptococcuspyogenes),并且ruvc结构域可通过d10a突变来失活,并且hnh结构域可通过h840a突变来失活。除源于化脓性链球菌的cas9之外,其他rna引导的核酸内切酶(rgen)也可用于可编程基因组编辑。cas9序列已在超过600个细菌菌株中被鉴定。尽管cas9家族显示氨基酸序列和蛋白质大小的高度多样性,但所有cas9蛋白都共有具有中心hnh核酸酶结构域和拆分ruvc/rna酶h结构域的共同构造。来自其他细菌菌株的cas9直系同源物的实例包括但不限于在以下中鉴定的cas蛋白:acaryochlorismarinambic11017;阿拉伯糖醋盐杆菌(acetohalobiumarabaticum)dsm5501;喜温嗜酸硫杆菌(acidithiobacilluscaldus);氧化亚铁嗜酸硫杆菌(acidithiobacillusferrooxidans)atcc23270;酸热脂环酸芽孢杆菌(alicyclobacillusacidocaldarius)laa1;酸热脂环酸芽孢杆菌酸热亚种dsm446(alicyclobacillusacidocaldariussubsp.acidocaldariusdsm446);酒色别样着色菌(allochromatiumvinosum)dsm180;丹氏制氨菌(ammonifexdegensii)kc4;多变鱼腥藻(anabaenavariabilis)atcc29413;极大节旋藻(arthrospiramaxima)cs-328;钝顶节旋藻(arthrospiraplatensis)paraca菌株;节旋藻属某种(arthrospirasp.)pcc8005;假蕈状芽孢杆菌(bacilluspseudomycoides)dsm12442;还原硒酸盐芽孢杆菌(bacillusselenitireducens)mls10;伯克氏菌目细菌(burkholderialesbacterium)1_1_47;毕氏热解纤维素菌(caldicelulosiruptorbecscii)dsm6725;candidatusdesulforudisaudaxviatormp104c;热液口热解纤维素菌_108(caldicellulosiruptorhydrothermalis_108);棱状芽胞杆菌噬菌体(clostridiumphage)c-st;肉毒梭菌a3马里湖菌株(clostridiumbotulinuma3str.lochmaree);肉毒梭菌ba4657菌株;艰难梭菌(clostridiumdifficile)qcd-63q42;瓦氏鳄球藻(crocosphaerawatsonii)wh8501;蓝丝菌属某种(cyanothecesp.)atcc51142;蓝丝菌属某种ccy0110;蓝丝菌属某种pcc7424;蓝丝菌属某种pcc7822;西伯利亚微小杆菌(exiguobacteriumsibiricum)255-15;大芬戈尔德菌(finegoldiamagna)atcc29328;成簇细枝菌(ktedonobacterracemifer)dsm44963;戴耳布吕克氏乳杆菌保加利亚亚种(lactobacillusdelbrueckiisubsp.bulgaricus)pb2003/044-t3-4;唾液乳酸杆菌(lactobacillussalivarius)atcc11741;无害李斯特菌(listeriainnocua);鞘丝藻属某种(lyngbyasp.)pcc8106;海杆菌属某种(marinobactersp.)elb17;调查甲烷盐菌(methanohalobiumevestigatum)z-7303;微囊藻噬菌体(microcystisphage)ma-lmm01;铜绿微囊藻(microcystisaeruginosa)nies-843;海洋微颤菌(microscillamarina)atcc23134;喜泥微鞘藻(microcoleuschthonoplastes)pcc7420;脑膜炎奈瑟氏菌(neisseriameningitidis);嗜盐亚硝化球菌(nitrosococcushalophilus)nc4;达松维尔拟诺卡氏菌达松维尔亚种(nocardiopsisdassonvilleisubsp.dassonvillei)dsm43111;泡沫节球藻(nodulariaspumigena)ccy9414;念珠藻属某种(nostocsp.)pcc7120;颤藻属某种(oscillatoriasp.)pcc6506;热丙酸盐暗色厌氧香肠状菌(pelotomaculumthermopropionicum)si;运动石袍菌(petrotogamobilis)sj95;萘降解极地单胞菌(polaromonasnaphthalenivorans)cj2;极地单胞菌属某种(polaromonassp.)js666;游海假交替单胞菌(pseudoalteromonashaloplanktis)tac125;始旋链霉菌(streptomycespristinaespiralis)atcc25486;始旋链霉菌atcc25486;嗜热链球菌(streptococcusthermophilus);绿色产色链霉菌(streptomycesviridochromogenes)dsm40736;玫瑰链孢囊菌(streptosporangiumroseum)dsm43021;聚球藻属某种(synechococcussp.)pcc7335;和非洲栖热腔菌(thermosiphoafricanus)tcf52b(chylinski等,rnabiol.,2013;10(5):726-737)。除cas9直系同源物之外,其他cas9变体诸如非活性dcas9和具有不同功能的效应结构域的融合蛋白可充当用于遗传调节的平台。任何前述酶都可适用于本发明中。9.干细胞应用本发明的生物回路和/或它们的任何组分可用于受调控的细胞重新编程、干细胞移入或其中所述重新编程因子的受控制或可调谐表达是适用的其他应用中。本发明的生物回路可用于对包括干细胞或诱导干细胞的细胞重新编程。对诱导多能干细胞(ipsc)的诱导最初由takahashi和yamanaka(cell,2006.126(4):663-76;以引用的方式整体并入本文)使用用以表达另外总称为kmos的klf4、c-myc、oct4和sox2的病毒载体来实现。可切除慢病毒和转座子载体;重复应用短暂质粒载体、游离型载体和腺病毒载体也已用于试图获得ipsc(chang,c.-w.等,stemcells,2009.27(5):1042-1049;kaji,k.等,nature,2009.458(7239):771-5;okita,k.等,science,2008.322(5903):949-53;stadtfeld,m.等,science,2008.322(5903):945-9;woltjen,k.等,nature,2009;yu,j.等,science,2009:1172482;fusaki,n.等,procjpnacadserbphysbiolsci,2009.85(8):348-62;其各自以引用的方式整体并入本文)。用以产生人ipsc的无dna方法也已使用以下方式来获得:用并有细胞穿透肽部分的重组蛋白进行连续蛋白质转导(kim,d.等,cellstemcell,2009.4(6):472-476;zhou,h.等,cellstemcell,2009.4(5):381-4;其各自以引用的方式整体并入本文)以及使用仙台病毒(sendaivirus)进行感染性转基因递送(fusaki,n.等,procjpnacadserbphysbiolsci,2009.85(8):第348-62页;以引用的方式整体并入本文)。本发明的效应物模块可包括包含支持对细胞重新编程的任何基因的有效载荷,所述基因包括但不限于oct诸如oct4,sox诸如sox1、sox2、sox3、sox15和sox18,nanog、klf诸如klf1、klf2、klf4和klf5,myc诸如c-myc和n-myc,rem2、tert和lin28及其变体。所述重新编程因子的序列在例如国际申请pct/us2013/074560中教导,所述申请的内容以引用的方式整体并入本文。在一些实施方案中,本发明的有效载荷可为心脏谱系特化因子诸如脱中胚蛋白(eomes),即一种t框转录因子;wnt信号传导路径组分诸如wnt3和wnt3a。eomes极其为心脏的发育所需。通过eomes达成的心肌细胞编程涉及典型wnt信号传导路径的自分泌活化,并且反之亦然。在有益于促进心脏谱系的条件下,wnt信号传导使eomes活化,并且eomes转而促进wnt信号传导,从而创建促进心脏谱系的自维持环路。太弱或太强的活化环路会促进非心脏命运,诸如分别促进内胚层命运和其他中胚层命运。本发明的dd可用于调谐eomes和wnt有效载荷水平以产生在原肠胚形成期间启动和/或维持心脏特化的活化环路。vii.定义在本说明书中的各处,以群组或范围形式公开本公开的组合物的特征或功能。明确意图本公开包括所述群组和范围的成员的各个和每个个别子组合。以下是术语定义的非限制性清单。活性:如本文所用,术语“活性”是指事情在发生或在进行所处的状况。本发明组合物可具有活性,并且这个活性可涉及一个或多个生物事件。在一些实施方案中,生物事件可包括细胞信号传导事件。在一些实施方案中,生物事件可包括细胞信号传导事件相关蛋白质与一种或多种相应蛋白质、受体、小分子或任何本文所述的生物回路组分的相互作用。过继性细胞疗法(act):如本文所用的术语“过继性细胞疗法”或“过继性细胞转移”是指涉及将细胞转移至患者中的细胞疗法,其中细胞可已来源于所述患者或另一个体,并且被工程化(改变),随后转移回所述患者中。治疗性细胞可源于免疫系统,诸如免疫效应细胞:cd4+t细胞;cd8+t细胞、天然杀伤细胞(nk细胞);以及b细胞和源于所切除肿瘤的肿瘤浸润性淋巴细胞(til)。最通常转移的细胞是在离体扩增或操作之后的自体抗肿瘤t细胞。举例来说,自体外周血液淋巴细胞可被遗传工程化来通过表达t细胞受体(tcr)或嵌合抗原受体(car)以识别特定肿瘤抗原。药剂:如本文所用,术语“药剂”是指生物化合物、药物化合物或化学化合物。非限制性实例包括简单或复杂有机或无机分子、肽、蛋白质、寡核苷酸、抗体、抗体衍生物、抗体片段、受体和可溶性因子。激动剂:如本文所用的术语“激动剂”是指与受体组合可产生细胞应答的化合物。激动剂可为直接结合受体的配体。或者,激动剂可通过例如以下方式来与受体间接组合:(a)与直接结合受体的另一分子形成复合物,或(b)另外导致对另一化合物的修饰以使另一化合物直接结合受体。激动剂可被称为特定受体或受体家族的激动剂,例如共刺激性受体的激动剂。拮抗剂:如本文所用的术语“拮抗剂”是指抑制或降低它所结合的靶标的生物活性的任何药剂。抗原:如本文所用的术语“抗原”定义为当它被引入受试者中或由受试者产生时激起免疫应答的分子,诸如由于癌症自身发展而出现的肿瘤抗原。免疫应答可涉及抗体产生,或特异性免疫感受态细胞诸如细胞毒性t淋巴细胞和t辅助细胞的活化,或两者。抗原可源于生物体、蛋白质/抗原的亚单位、经杀灭或失活的全细胞或裂解物。在本发明的情形下,术语“目标抗原”或“所需抗原”是指与本发明的抗体和/或本文所述的其片段、突变体、变体和/或改变形式进行免疫特异性结合或相互作用的那些蛋白质和/或本文提供的其他生物分子。在一些实施方案中,目标抗原可包括任何本文所述的多肽或有效载荷或蛋白质或其片段或部分。近似:如本文所用,如应用于一个或多个目标值的术语“近似”或“约”是指数值类似于所述参照值。在某些实施方案中,除非另外陈述或另外根据上下文显而易知,否则术语“近似”或“约”是指一定范围的数值落在所述参照值在任一方向(大于或小于)上的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小内(例外之处是当所述数值将超过可能值的100%时)。烷基:如本文所用的术语“烷基”、“烷氧基”、“羟基烷基”、“烷氧基烷基”和“烷氧基羰基”包括含有1至12个碳原子,和/或可经取代或可未经取代的直链与支链两者。烯基:如本文所用的单独或作为较大部分的一部分的术语“烯基”和“炔基”将包括含有2至12个碳原子的直链与支链两者。芳基:如本文所用的单独或如在“芳烷基”、“芳烷氧基”或“芳基氧基烷基”中作为较大部分的一部分的术语“芳基”是指具有总计5至14个环成员的单环、双环和三环碳环系统,其中至少一个环是芳族,并且其中系统中的各环含有3至8个环成员。术语“芳基”可与术语“芳基环”互换使用。芳族:如本文所用的术语“芳族”是指具有离域π电子的不饱和烃环结构。如本文所用,“芳族”可指单环、双环或多环芳族化合物。脂族:如本文所用的术语“脂族”或“脂族基团”是指直链或支链c1-c8烃链或单环c3-c8烃或双环c8-c12烃,其是完全饱和的或含有一个或多个不饱和单元,是完全饱和的或含有一个或多个不饱和单元,但不是芳族(在本文中也称为“碳环”或“环烷基”),并且与分子的其余部分具有单一连接点,其中所述双环系统中的任何个别环都具有3-7个成员。与……缔合:如本文所用,术语“与……缔合”、“缀合”、“连接”、“相连”和“栓系”在关于两个或更多个部分使用时意指所述部分直接地或通过一个或多个充当连接剂的额外部分来彼此以实体方式缔合或连接,以形成以下结构:所述结构足够稳定以使所述部分在使用所述结构所处的条件例如生理条件下保持以实体方式缔合。“缔合”无需严格通过直接共价化学键合来达成。它也可暗示足够稳定以使“所缔合”实体保持以实体方式缔合的离子性键合或氢键合或基于杂交的连接性。自体:如本文所用的术语“自体”意指任何物质源于它稍后将被再引入其中的同一个体。条形码:如本文所用的术语“条形码”是指将一个多核苷酸或氨基酸与另一多核苷酸或氨基酸进行区分的多核苷酸或氨基酸序列。生物回路系统:如本文所用,“生物回路”或“生物回路系统”定义为生物系统内或适用于生物系统中的包含刺激物和至少一个对刺激物起响应的效应物模块的回路,其中对所述刺激物的响应产生在生物系统内,在生物系统之间,作为对生物系统的指示,或在生物系统上的至少一个信号或结果。生物系统通常应理解为任何细胞、组织、器官、器官系统或生物体,无论是动物性的、植物性的、真菌性的、细菌性的还是病毒性的。也应了解生物回路可为采用由本发明教导的刺激物或效应物模块,并且在诸如采用诊断性报告子系统、装置、测定或试剂盒的无细胞环境中实现信号或结果的人工回路。人工回路可与一个或多个电子、磁性或放射性部件或零件相关联。在本发明的情形下,生物回路包括去稳定结构域(dd)生物回路系统。检查点因子:如本文所用,检查点因子是其功能在某一过程的交界处进行发挥的任何部分或分子。举例来说,检查点蛋白质、配体或受体可起使细胞周期停滞或加速的作用。共刺激性分子:如本文所用,根据它在免疫t细胞活化中的含义,是指一组免疫细胞表面受体/配体,其在t细胞与apc之间进行啮合,并且产生t细胞中的刺激性信号,所述刺激性信号与t细胞中的由t细胞受体(tcr)识别apc上的抗原/mhc复合物(pmhc)所产生的刺激性信号组合。细胞因子:如本文所用的术语“细胞因子”是指一个家族的具有基因多效性功能的小型可溶性因子,其由可影响和调控免疫系统的功能的许多细胞类型产生。递送:如本文所用的术语“递送”是指递送化合物、物质、实体、部分、运载物或有效载荷的行为或方式。“递送剂”是指至少部分地有助于将一种或多种物质(包括但不限于本发明的化合物和/或组合物)在体内递送至细胞、受试者或其他生物系统细胞中的任何试剂。去稳定:如本文所用,术语“失稳定”、“去稳定”、“去稳定区域”或“去稳定结构域”意指区域或分子相比于同一区域或分子的起始、参照、野生型或天然形式是较不稳定的。工程化:如本文所用,当本发明的实施方案被设计来具有从起始点、野生型或天然分子变化的结构特征或性质或化学特征或性质时,它们被“工程化”。表达:如本文所用,核酸序列的“表达”是指一个或多个以下事件:(1)从dna序列产生rna模板(例如通过转录);(2)加工rna转录物(例如通过剪接、编辑、5′帽形成和/或3′末端加工);(3)rna翻译成多肽或蛋白质;(4)多肽或蛋白质的折叠;和(5)对多肽或蛋白质的翻译后修饰。特征:如本文所用,“特征”是指特性、性质或独特要素。制剂:如本文所用,“制剂”包括至少本发明的化合物和/或组合物以及递送剂。片段:如本文所用的“片段”是指部分。举例来说,蛋白质的片段可包括通过消化全长蛋白质来获得的多肽。在一些实施方案中,蛋白质的片段包括至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250个或更多个氨基酸。在一些实施方案中,抗体的片段包括抗体的部分。功能性:如本文所用,“功能性”生物分子是具有某一结构以及呈某一形式的生物实体,在所述结构和所述形式的情况下,它展现它的特征所在于的性质和/或活性。杂环:如本文所用的术语“杂环”、“杂环基”或“杂环”是指具有3至14个环成员的单环、双环或三环系统,其中一个或多个环成员是杂原子,其中系统中的各环含有3至7个环成员,并且是非芳族。热点:如本文所用,“热点”或“突变热点”是指蛋白质编码基因中相对于同一基因内的其他地方更加频繁突变(通过取代)的氨基酸位置。亲水性:如本文所用,“亲水性”是指分子与水相互作用或对水具有亲和力。疏水性:如本文所用,“疏水性”是指分子不与水相互作用或不对水具有亲和力。免疫细胞:如本文所用的术语“免疫细胞”是指免疫系统的来源于骨髓中的造血干细胞的任何细胞,所述造血干细胞产生两个主要谱系,即骨髓性祖细胞(其产生骨髓细胞诸如单核细胞、巨噬细胞、树突细胞、巨核细胞和粒细胞)和淋巴样祖细胞(其产生淋巴样细胞诸如t细胞、b细胞和天然杀伤(nk)细胞)。示例性免疫系统细胞包括cd4+t细胞、cd8+t细胞、cd4-cd8-双重阴性t细胞、tγδ细胞、tαβ细胞、调控性t细胞、天然杀伤细胞和树突细胞。巨噬细胞和树突细胞可被称为“抗原呈递细胞”或“apc”,其是当apc的表面上的与肽复合的主要组织相容性复合物(mhc)受体与t细胞的表面上的tcr相互作用时,可使t细胞活化的特化细胞。免疫疗法:如本文所用的术语“免疫疗法”是指一种类型的疾病治疗法,其使用免疫工具诸如单克隆抗体、受体-免疫球蛋白融合蛋白、疫苗和/或免疫细胞。体外:如本文所用,术语“体外”是指事件发生在人工环境中,例如在试管或反应容器中,在细胞培养中,在皮氏培养皿(petridish)中等,而非在生物体(例如动物、植物或微生物)内。体内:如本文所用,术语“体内”是指事件发生在生物体(例如动物、植物或微生物或其细胞或组织)内。接头:如本文所用,接头是指连接两个或更多个结构域、部分或实体的部分。在一个实施方案中,接头可包括10个或更多个原子。在另一实施方案中,接头可包括一组原子,例如10-1,000个原子,并且可包含原子或基团诸如但不限于碳、氨基、烷基氨基、氧、硫、亚砜、磺酰基、羰基和亚胺。在一些实施方案中,接头可包括一个或多个包含一个或多个核苷酸的核酸。在一些实施方案中,接头可包括氨基酸、肽、多肽或蛋白质。在一些实施方案中,由接头结合的部分可包括但不限于原子、化学基团、核苷、核苷酸、核苷碱基、糖、核酸、氨基酸、肽、多肽、蛋白质、蛋白质复合物、有效载荷(例如治疗剂)、或标记(包括但不限于化学标记、荧光标记、放射性标记或生物发光标记)。接头可用于达成任何适用目的,诸如用于形成多聚体或缀合物,以及用于施用有效载荷,如本文所述。可并入接头中的化学基团的实例包括但不限于烷基、烯基、炔基、酰胺基、氨基、醚、硫醚、酯、亚烷基、亚杂烷基、芳基或杂环基,其各自可任选被取代,如本文所述。接头的实例包括但不限于不饱和烷烃、聚乙二醇(例如多个乙二醇或丙二醇单体单元,例如二乙二醇、二丙二醇、三乙二醇、三丙二醇、四乙二醇或四乙二醇)和右旋糖酐聚合物。其他实例包括但不限于接头内的可使用还原剂或光解来裂解的可裂解部分,诸如像二硫键(-s-s-)或偶氮键(-n=n-)。可选择性裂解键的非限制性实例包括酰胺键,其可例如通过使用三(2-羧乙基)膦(tcep)或其他还原剂和/或光解来裂解,以及酯键,其可例如通过酸性或碱性水解来裂解。亲脂性:如本文所用,术语“亲脂性”是指对脂质或脂肪具有亲和力。代谢物:代谢物是由天然存在于细胞内的酶催化的代谢反应的中间产物。这个术语通常用于描述小分子、较大生物分子的片段或经加工产物。修饰:如本文所用,术语“修饰”是指相较于母体或参照分子或实体,分子或实体的状态或结构得以变化。分子可以许多方式加以修饰,包括以化学方式、在结构上以及在功能上加以修饰。在一些实施方案中,本发明的化合物和/或组合物通过引入非天然氨基酸来修饰。突变:如本文所用,术语“突变”是指变化和/或改变。在一些实施方案中,突变可为对蛋白质(包括肽和多肽)和/或核酸(包括多核酸)的变化和/或改变。在一些实施方案中,突变包括对蛋白质和/或核酸序列的变化和/或改变。所述变化和/或改变可包括一个或多个氨基酸(在蛋白质和/或肽的情况下)和/或核苷酸(在核酸和/或多核酸的情况下)的添加、取代和/或缺失。在其中突变包括氨基酸和/或核苷酸的添加和/或取代的一些实施方案中,所述添加和/或取代可包括1个或更多个氨基酸和/或核苷酸残基,并且可包括经修饰氨基酸和/或核苷酸。具有突变、变化或改变的所得构建体、分子或序列可在本文中称为突变体。新抗原:如本文所用的术语“新抗原”是指存在于肿瘤细胞而非正常细胞中,并且不诱导对胸腺中它们的同源抗原特异性t细胞的删除(即中枢耐受性)的肿瘤抗原。类似于病原体,这些肿瘤新抗原可提供“外来”信号,以诱导为癌症免疫疗法所需的有效免疫应答。新抗原可局限于特定肿瘤。新抗原是具有错义突变的肽/蛋白质(错义新抗原),或具有由新型开放阅读框(neoorf)获得的长型完全新型氨基酸链段的新肽。neoorf可由于框外插入或缺失(归因于导致微卫星不稳定性的dna错配修复缺陷)、基因融合、终止密码子通读突变、或对不恰当剪接rna的翻译而在一些肿瘤中产生(例如saeterdal等,procnatlacadsciusa,2001,98:13255-13260)。脱靶:如本文所用,“脱靶”是指对任何一个或多个靶标、基因、细胞转录物、细胞和/或组织的非意图影响。可操作地连接:如本文所用,短语“可操作地连接”是指两个或更多个分子、构建体、转录物、实体、部分等之间的功能性连接。苯基:如本文所用,“苯基”是指具有式c6h5的原子环状基团。有效载荷或目标有效载荷(poi):如本文所用的术语“有效载荷”和“目标有效载荷(poi)”可互换使用。目标有效载荷(poi)是指其功能待改变的任何蛋白质或化合物。在本发明的情形下,poi是包括先天性免疫系统与适应性免疫系统两者的免疫系统中的组分。目标有效载荷可为蛋白质、编码融合蛋白的融合构建体、或非编码基因、或其变体和片段。当基于氨基酸时,目标有效载荷可可被称为目标蛋白质。药学上可接受的赋形剂:如本文所用的术语“药学上可接受的赋形剂”是指存在于药物组合物中的不同于活性剂(例如如本文所述的活性剂),并且具有在受试者中大致上无毒以及不导致炎症的性质的任何成分。在一些实施方案中,药学上可接受的赋形剂是能够使活性剂混悬和/或溶解的媒介物。赋形剂可包括例如:抗粘附剂、抗氧化剂、粘合剂、包覆剂、压制助剂、崩解剂、染料(着色剂)、润肤剂、乳化剂、填充剂(稀释剂)、成膜剂或包覆剂、调味剂、芳香剂、助流剂(流动增强剂)、润滑剂、防腐剂、印刷墨水、吸附剂、混悬剂或分散剂、甜味剂和水化水。示例性赋形剂包括但不限于:丁基化羟基甲苯(bht)、碳酸钙、磷酸钙(二碱式)、硬脂酸钙、交联羧甲基纤维素、交联聚乙烯吡咯烷酮、柠檬酸、交联聚维酮、半胱氨酸、乙基纤维素、明胶、羟基丙基纤维素、羟基丙基甲基纤维素、乳糖、硬脂酸镁、麦芽糖醇、甘露糖醇、甲硫氨酸、甲基纤维素、对羟基苯甲酸甲酯、微晶纤维素、聚乙二醇、聚乙烯吡咯烷酮、聚维酮、预胶凝淀粉、对羟基苯甲酸丙酯、棕榈酸视黄酯、虫胶、二氧化硅、羧甲基纤维素钠、柠檬酸钠、淀粉乙醇酸钠、山梨糖醇、淀粉(玉米)、硬脂酸、蔗糖、滑石、二氧化钛、维生素a、维生素e、维生素c和木糖醇。药学上可接受的盐:本文所述的化合物的药学上可接受的盐是所公开化合物的其中酸或碱部分呈它的盐形式的形式(例如如通过使游离碱基团与适合有机酸反应所产生)。药学上可接受的盐的实例包括但不限于碱性残基诸如胺的无机酸或有机酸盐;酸性残基诸如羧酸的碱盐或有机盐;等。代表性酸加成盐包括乙酸盐、己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙烷磺酸盐、反丁烯二酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚糖酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基-乙烷磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、顺丁烯二酸盐、丙二酸盐、甲烷磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、硬脂酸盐、丁二酸盐、硫酸盐、酒石酸盐、硫代氰酸盐、甲苯磺酸盐、十一酸盐、戊酸盐等。代表性碱金属或碱土金属盐包括钠、锂、钾、钙、镁等,以及无毒铵、季铵和胺阳离子,包括但不限于铵、四甲铵、四乙铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等。药学上可接受的盐包括例如由无毒无机酸或有机酸获得的常规无毒盐。在一些实施方案中,药学上可接受的盐通过常规化学方法来从含有碱性或酸性部分的母体化合物制备。通常,所述盐可通过使这些化合物的游离酸或碱形式与化学计算量的适当碱或酸在水中或在有机溶剂中或在两者的混合物中反应来制备;通常,非水性介质如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈是优选的。适合盐的清单见于remington'spharmaceuticalsciences,第17版,mackpublishingcompany,easton,pa.,1985,第1418页,pharmaceuticalsalts:properties,selection,anduse,p.h.stahl和c.g.wermuth(编),wiley-vch,2008,以及berge等,journalofpharmaceuticalscience,66,1-19(1977)中,所述著作和文献各自以引用的方式整体并入本文。药学上可接受的溶剂合物:如本文所用的术语“药学上可接受的溶剂合物”是指化合物的其中适合溶剂的分子并入晶格中的结晶形式。举例来说,溶剂合物可通过从包括有机溶剂、水或其混合物的溶液进行结晶、重结晶或沉淀来制备。适合溶剂的实例是乙醇、水(例如单水合物、二水合物和三水合物)、n-甲基吡咯烷酮(nmp)、二甲亚砜(dmso)、n,n’-二甲基甲酰胺(dmf)、n,n’-二甲基乙酰胺(dmac)、1,3-二甲基-2-咪唑烷酮(dmeu)、1,3-二甲基-3,4,5,6-四氢-2-(1h)-嘧啶酮(dmpu)、乙腈(acn)、丙二醇、乙酸乙酯、苯甲醇、2-吡咯烷酮、苯甲酸苯甲酯等。当水是溶剂时,溶剂合物被称为“水合物”。在一些实施方案中,并入溶剂合物中的溶剂具有以下类型或处于以下等级,所述类型或等级在生理上可为(例如以药物组合物的单位剂型)向其施用溶剂合物的生物体所耐受。哌嗪:如本文所用,“哌嗪”是指在环中的相对位置处含有两个氮原子的六元环。目标蛋白质:如本文所用,术语“目标蛋白质”或“所需蛋白质”包括本文提供的那些及其片段、突变体、变体和改变形式。嘌呤:如本文所用,“嘌呤”是指芳族杂环结构,其中一个杂环是咪唑环,并且一个杂环是嘧啶环。嘧啶:如本文所用,“嘧啶”是指类似于苯的芳族杂环结构,但其中两个碳原子由氮原子替换。吡啶并嘧啶:如本文所用,“吡啶并嘧啶”是指芳族杂环结构,其中一个杂环是嘌呤环,并且一个杂环是嘧啶环。喹唑啉:如本文所用,术语“喹唑啉”是指芳族杂环结构,其中一个杂环是苯环,并且一个杂环是嘧啶环。稳定:如本文所用,“稳定”是指化合物或实体足够稳健以经受得住从反应混合物进行分离以获得适用纯度,并且优选能够配制成有效治疗剂。稳定化:如本文所用,术语“稳定”、“稳定化”、“稳定化区域”意指使得或变得稳定。在一些实施方案中,相对于绝对值来测量稳定性。在一些实施方案中,相对于次级状况或状态或参照化合物或实体来测量稳定性。标准car:如本文所用,术语“标准car”是指嵌合抗原受体的标准设计。car融合蛋白的包括细胞外scfv片段、跨膜结构域和一个或多个细胞内结构域的组分以线性方式构建成单一融合蛋白。刺激物响应元件(sre):如本文所用的术语“刺激物响应元件(sre)”是效应物模块的组分,其与效应物模块的一个或多个有效载荷接合、相连、连接或缔合,并且在一些情况下,导致效应物模块对一种或多种刺激物的响应性质。如本文所用,sre对刺激物的“响应”性质可通过与刺激物的共价或非共价相互作用、直接或间接缔合、或结构或化学反应来表征。此外,任何sre对刺激物的响应都可为关于程度或种类的问题。响应可为部分响应。响应可为可逆响应。响应可最终导致受调控的信号或输出。所述输出信号可具有与刺激物相关的性质,例如产生在1%与100%之间的调节作用,或倍数化增加或降低,诸如2倍、3倍、4倍、5倍、10倍或更多倍。sre的一个非限制性实例是去稳定结构域(dd)。受试者:如本文所用,术语“受试者”或“患者”是指本发明的组合物可例如出于实验、诊断、防治和/或治疗目的向其施用的任何生物体。典型受试者包括动物(例如哺乳动物诸如小鼠、大鼠、兔、非人灵长类动物和人)和/或植物。t细胞:t细胞是产生t细胞受体(tcr)的免疫细胞。t细胞可为原初的(未暴露于抗原;相较于tcm,cd62l、ccr7、cd28、cd3、cd127和cd45ra的表达增加,并且cd45ro的表达降低)、记忆t细胞(tm)(经受过抗原,并且具有长寿命)和效应细胞(经受过抗原,具有细胞毒性)。tm可被进一步分成中枢性记忆t细胞(tcm,相较于原初t细胞,cd62l、ccr7、cd28、cd127、cd45ro和cd95的表达增加,并且cd54ra的表达降低)和效应记忆t细胞(tem,相较于原初t细胞或tcm,cd62l、ccr7、cd28、cd45ra的表达降低,并且cd127的表达增加)的子组。效应t细胞(te)是指经受过抗原的cd8+细胞毒性t淋巴细胞,相较于tcm,其具有降低的cd62l、ccr7、cd28表达,并且呈粒酶和穿孔素阳性。其他示例性t细胞包括调控性t细胞,诸如cd4+cd25+(foxp3+)调控性t细胞和treg17细胞,以及tr1、th3、cd8+cd28-和qa-1限定的t细胞。t细胞受体:t细胞受体(tcr)是指能够特异性结合与mhc受体结合的抗原肽的免疫球蛋白超家族成员,其具有可变抗原结合结构域、恒定结构域、跨膜区域和短细胞质尾部。tcr可见于细胞的表面上或以可溶性形式得见,并且通常包含具有α链和β链(也分别称为tcrα和tcrβ)、或γ链和δ链(也分别称为tcrγ和tcrδ)的异二聚体。tcr链(例如α链、β链)的细胞外部分含有两个免疫球蛋白结构域,即在n末端的可变结构域(例如α链可变结构域或vα、β链可变结构域或vβ)以及邻近于细胞膜的一个恒定结构域(例如α链恒定结构域或cα以及β链恒定结构域或cβ)。类似于免疫球蛋白,可变结构域含有由框架区(fr)分隔的互补决定区(cdr)。tcr通常与cd3复合物缔合以形成tcr复合物。如本文所用,术语“tcr复合物”是指通过cd3与tcr的缔合所形成的复合物。举例来说,tcr复合物可由cd3γ链、cd3δ链、两个cd3ε链、cd3ζ链的同二聚体、tcrα链和tcrβ链组成。或者,tcr复合物可由cd3γ链、cd3δ链、两个cd3ε链、cd3ζ链的同二聚体、tcrγ链和tcrδ链组成。如本文所用的“tcr复合物的组分”是指tcr链(即tcrα、tcrβ、tcrγ或tcrδ)、cd3链(即cd3γ、cd3δ、cd3ε或cd3ζ)、或由两个或更多个tcr链或cd3链形成的复合物(例如tcrα和tcrβ的复合物、tcrγ和tcrδ的复合物、cd3ε和cd3δ的复合物、cd3γ和cd3ε的复合物、或tcrα、tcrβ、cd3γ、cd3δ和两个cd3ε链的子tcr复合物)。治疗剂:术语“治疗剂”是指在向受试者施用时具有治疗、诊断和/或防治作用和/或引发所需生物和/或药理学作用的任何药剂。本发明的治疗剂包括单独或与其他治疗剂组合的任何本文教导的生物回路组分。治疗有效量:如本文所用,术语“治疗有效量”意指待递送药剂(例如核酸、药物、治疗剂、诊断剂、防治剂等)的在向罹患或易患感染、疾病、病症和/或疾患的受试者施用时足以治疗所述感染、疾病、病症和/或疾患,改善所述感染、疾病、病症和/或疾患的症状,诊断、预防所述感染、疾病、病症和/或疾患,和/或延迟所述感染、疾病、病症和/或疾患的发作的量。在一些实施方案中,治疗有效量以单次剂量提供。在一些实施方案中,治疗有效量以包含多次剂量的剂量方案施用。本领域技术人员将了解,在一些实施方案中,如果单位剂型包含的数量在作为这种剂量方案的一部分加以施用时是有效的,那么它可被视为包含治疗有效量的特定药剂或实体。三嗪:如本文所用,“三嗪”是结构类似于苯的一类含氮杂环,但其中三个碳原子由氮原子替换。治疗(treatment/treating):如本文所用,术语“治疗(treatment/treating)”表示用于获得有益或所需结果(包括并且优选是有益或所需临床结果)的方法。所述有益或所需临床结果包括但不限于以下中的一者或多者:使癌性细胞或其他患病细胞的增殖降低(或破坏癌性细胞或其他患病细胞),使见于癌症中的癌性细胞的转移降低,使肿瘤的尺寸收缩,使由疾病所致的症状减轻,使罹患疾病者的生活质量增加,使为治疗疾病所需的其他药物的剂量降低,使疾病的进展延迟,和/或使个体的存活期延长。调谐:如本文所用,术语“调谐”意指响应于刺激物或朝向特定结果来调整、平衡或改适一个事物。在一个非限制性实例中,本发明的sre和/或dd响应于特定刺激物和/或环境来调整、平衡或改适它们所附接、相连或缔合的组合物的功能或结构。变体:如本文所用,术语“变体”是指与第二组合物(例如第二dd或有效载荷,也被称为“母体”分子)相关的第一组合物(例如第一dd或有效载荷)。变异分子可源于母体分子,从母体分子分离,基于母体分子,或与母体分子同源。术语变体可用于描述多核苷酸或多肽。viii.等效物和范围本领域技术人员将仅使用常规实验就会认识到或能够确定本文所述的本发明的特定实施方案的许多等效物。本发明的范围不意图限于以上描述,而是如随附权利要求中所阐述。在权利要求中,除非相反指示或另外由上下文显而易知,否则诸如“一个(种)(a/an)”和“这个(种)(the)”的冠词可意指一个(种)或超过一个(种)。除非相反指示或另外由上下文显而易知,否则如果一个、超过一个或所有群组成员存在于、用于给定产品或过程中或另外与给定产品或过程相关,那么在群组的一个或多个成员之间包括“或”的权利要求或描述被视为是符合的。本发明包括其中群组的恰好一个成员存在于、用于给定产品或过程中或另外与给定产品或过程相关的实施方案。本发明包括其中超过一个或全部群组成员存在于、用于给定产品或过程中或另外与给定产品或过程相关的实施方案。也应注意术语“包含”意图是开放的,并且允许但不要求包括额外要素或步骤。当术语“包含”在本文中使用时,术语“由……组成”因此也被涵盖和公开。当给出范围时,包括端点。此外,应了解除非另外指示或另外由上下文和本领域普通技术人员的理解显而易知,否则表示为范围的值可在本发明的不同实施方案中表现为所陈述范围内的任何特定值或子范围,达到范围的下限单位的十分之一,除非上下文另外明确规定。此外,应了解本发明的属于先前技术的任何特定实施方案都可从任何一个或多个权利要求明确排除。因为所述实施方案被视为本领域普通技术人员已知,所以它们可被排除,即使在本文中未明确阐述所述排除。本发明组合物的任何特定实施方案(例如任何抗生、治疗或活性成分;任何产生方法;任何使用方法;等)都可由于无论是否与先前技术的存在性相关的任何原因而从任何一个或多个权利要求排除。应了解已使用的措辞是描述措辞而非限制措辞,并且可在不脱离本发明在它的较广泛方面的真实范围和精神下在随附权利要求的界限内进行变化。尽管本发明已关于若干所描述的实施方案相当详细地以及以一定特定性加以描述,但不意图它将限于任何所述特定事项或实施方案或任何特定实施方案,而是它应参照随附权利要求加以解释以便鉴于先前技术来提供对所述权利要求的最广泛可能阐释,因此以便有效涵盖本发明的预定范围。本发明由以下非限制性实施例进一步说明。实施例实施例1.通过诱变筛选来产生新型配体响应性dd研究设计为工程化显示配体依赖性稳定性的构建体,选择候选配体结合结构域(lbd),并且使用黄色荧光蛋白(yfp)作为蛋白质稳定性报告子的基于细胞的筛选被设计来鉴定所述候选lbd的具有去稳定结构域的以下所需特征的突变体:在不存在lbd的配体下蛋白质水平较低(即低基础稳定性),大动态范围,稳健和可预测的剂量-响应行为,以及快速降解动力学(banaszynski等,(2006)cell;126(5):995–1004)。候选lbd结合至所需配体而非内源性信号传导分子。首先使用核苷酸类似物诱变和易出错pcr的组合来使候选lbd序列(作为模板)突变,以产生基于模板候选结构域序列的突变体的文库。将产生的文库同框克隆在yfp基因的5′末端或3′末端,并且逆转录病毒表达系统用于将yfp融合物的文库稳定转导至nih3t3纤维母细胞中。使经转导nih3t3细胞经受三轮至四轮使用荧光激活的细胞分选(facs)进行的分选以筛选候选dd的文库。在不存在配体结合结构域(lbd)的高亲和力配体下培养经转导的nih3t3细胞,并且通过facs来选择展现低水平的yfp表达的细胞。筛选策略i在配体结合结构域的高亲和力配体存在下培养所选细胞群体一段时期(例如24小时),此时,通过facs来再次对细胞进行分选。通过facs来选择展现高水平的yfp表达的细胞,并且将所选细胞群体分成两组,并且用配体结合结构域的高亲和力配体在不同浓度下再次处理;一个组用较低浓度的配体处理,并且另一组用高浓度的配体处理,持续一段时期(例如24小时),此时,通过facs来再次对细胞进行分选。将表达对较低浓度的配体起响应的突变体的细胞进行分离。对较低浓度的配体起响应的经分离细胞用配体再次处理,并且在从培养基移除配体之后4小时收集展现低荧光水平的细胞。这个第四次分选被设计来使展现快速降解动力学的细胞富集(iwamoto等,chembiol.2010年9月24日;17(9):981–988)。筛选策略ii在不存在lbd的高亲和力配体下,使所选细胞群体经受额外一次或多次通过facs进行的分选,并且展现低水平的yfp表达的细胞被选择用于进一步分析。将细胞用配体结合结构域的高亲和力配体处理一段时期(例如24小时),并且通过facs来再次分选。通过facs来选择表达高水平的yfp的细胞。用配体再次处理具有高yfp表达的细胞,并且在从培养基移除配体之后4小时收集展现低荧光水平的细胞以使展现快速降解动力学的细胞富集。可重复任何分选步骤以鉴定具有配体依赖性稳定性的dd。在分选之后回收细胞。收集所鉴定的候选细胞,并且提取基因组dna。候选dd通过pcr来扩增,并且分离。对候选dd测序,并且与lbd模板进行比较以鉴定候选dd中的突变。实施例2.通过定点诱变来由人pde5获得的新型dd为鉴定新型去稳定结构域突变,使用非天然核苷酸来对人pde5催化结构域(seqidno.3)的开放阅读框进行诱变pcr。将突变体文库在c末端与acgfp报告子同框连接,并且克隆至plvx-ires-puro载体中。慢病毒文库接着用于感染hek293t细胞。用嘌呤霉素选择细胞,并且使用实施例1中所述的筛选策略来筛选文库。将dna从细胞汇集物提取,克隆至载体中,并且转化至大肠杆菌中。对各个克隆测序,并且在c末端与接头ggsgggsgg(seqidno.77)和acgfp同框克隆至plvx.irespuro中。也将野生型hpde5的催化结构域克隆至plvx.ires.puro中,并且用作对照。将hek293细胞用各个克隆转导,并且用嘌呤霉素加以选择。使表达ot-hpde5n构建体的hek293细胞与10μm西地那非或媒介物对照dmso一起孵育48小时,并且在蛋白质水平下评价hpde5突变体的稳定性。使用acgfp抗体(clonetech,mountainview,ca)对从hpde5n构建体表达性细胞获得的细胞裂解物进行免疫印迹。样品也用gapdh抗体进行免疫印迹以确保均一蛋白质上样。免疫印迹显示当相较于dmso处理时,在西地那非处理的情况下,ot-hpde5n-002、ot-hpde5n-003、ot-hpde5n-006、ot-hpde5n-008、ot-hpde5n-009、ot-hpde5n-010显示pde5-gfp蛋白质水平增加,从而表明构建体的西地那非依赖性稳定化。此外,相比于在野生型hpde5构建体ot-hpde5n-001中,在ot-hpde5n-002、ot-hpde5n-003和ot-hpde5n-006中,在dmso处理的情况下的hpde5-gfp水平是较低的,从而指示这些构建体在不存在配体下去稳定。表达hpde5构建体的细胞中的gfp表达通过facs来测量。使表达ot-hpde5n-001至ot-hpde5n-010的hek293细胞与10μm西地那非或媒介物对照dmso一起孵育48小时,并且计算平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经西地那非处理样品中的gfp强度的变化倍数。将去稳定突变系数计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-001),hpde5突变构建体(ot-hpde5n-002至ot-hpde5n-010)中的gfp强度的变化倍数。去稳定突变系数小于1以及稳定化比率大于1在dd中是所需的。结果和比率呈现于表19中。表19:在hpde5源性dd中的gfp表达如表19中所示,所有构建体都显示稳定化比率大于1,从而指示所有构建体都显示配体(西地那非)依赖性稳定化。ot-hpde5n-006、ot-hpde5n-008和ot-hpde5n-009的稳定化比率大于10,从而指示强烈配体依赖性稳定化。构建体ot-hpde5n-002、ot-hpde5n-003、ot-hpde5n-005和ot-hpde5n-010显示稳定化比率在2至10的范围内,从而指示适度配体依赖性稳定化。以所有构建体观察到的去稳定突变系数都小于1,从而指示相较于野生型hpde5,所有hpde5突变体都去稳定。值得注意的是,构建体ot-hpde5n-002、ot-hpde5n-003、ot-hpde5n-004、0t-hpde5n-006、ot-hpde5n-008和ot-hpde5n-009显示去稳定突变系数小于0.2,从而指示在不存在配体下的强烈去稳定。将ot-hpde5n-006、ot-hpde5n-008和ot-hpde5n-009鉴定为具有dd的合乎需要特征的突变体,即在不存在配体下的低基础表达,并且在配体存在下的高表达。实施例3.hpde5突变体的西地那非依赖性稳定化使表达ot-hpde5n-006、ot-hpde5n-008或ot-hpde5n-009构建体的hek293细胞与在0.005μm至10μm的范围内的不同浓度的西地那非、或媒介物对照(dmso)一起孵育48小时。使用facs来测量hpde5突变体的稳定性,并且计算gfp的平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即不存在配体),经西地那非处理样品中的gfp强度的变化倍数。稳定化比率大于1在dd中是所需的。mfi和稳定化比率呈现于表20中。表20:西地那非剂量滴定如表20中所示,所有三个构建体都显示稳定化比率随西地那非的剂量增加而增加,从而指示hpde5突变体的配体剂量依赖性稳定化。半数最大有效浓度或ec50是约1μm。也历经一段时期测量hpde5突变体的西地那非依赖性稳定化。用10μm西地那非处理表达ot-hpde5n-006、ot-hpde5n-008和ot-hpde5n-009的hek293细胞2、4、6、16、24和48小时。使用facs来测量hpde5突变体的稳定性,并且计算gfp的平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即不存在配体),经西地那非处理样品中的gfp强度的变化倍数。稳定化比率大于1在dd中是所需的。mfi和稳定化比率呈现于表21中。表21:西地那非处理的时程如表21中所示,所有三个构建体都显示稳定化比率随用西地那非进行处理的持续时间增加而增加,从而指示hpde5突变体的稳定化的时间依赖性增加。实施例4.hpde5dd的伐地那非依赖性稳定化伐地那非具有0.7nm的ic50,并且相比于具有3.9nm的ic50的西地那非是hpde5的更强效抑制剂(doggrells等(2007)intjimpot.res19(3):281-95)。为测试伐地那非是否能够使hpde5dd稳定,用伐地那非在0.0005μm至10μm的范围内的浓度下处理表达ot-hpde5-006、ot-hpde5-008和ot-hpde5-009的hek293细胞48小时。使用facs来测量hpde5突变体的稳定性,并且计算gfp的平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即不存在配体),经伐地那非处理样品中的gfp强度的变化倍数。稳定化比率大于1在dd中是所需的。mfi和稳定化比率呈现于表22中。表22:伐地那非剂量滴定如表22中所示,所有三个构建体都显示稳定化比率随伐地那非的剂量增加而增加,从而指示hpde5dd的伐地那非剂量依赖性稳定化。半数最大有效浓度或ec50是约0.1-0.3μm,其小于以西地那非观察到的ec50(约1μm),从而指示伐地那非相比于西地那非可更强效地使hpde5dd稳定。在用hpde5dd稳定转导的细胞系例如hek293细胞、hct-116细胞和skov-3细胞中测量伐地那非稳定hpde5源性dd的能力。将细胞用ot-hpde5n-006、008和009构建体转导,并且与1μm或10μm伐地那非或与dmso一起孵育48小时。使用facs来测量hpde5突变体的稳定性,并且计算gfp的平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即不存在配体),经伐地那非处理样品中的gfp强度的变化倍数。稳定化比率大于1在dd中是所需的。mfi和稳定化比率呈现于表23中。表23:伐地那非剂量滴定如表23中所示,所有三个构建体都显示在伐地那非的两个剂量的情况下稳定化比率均增加,从而指示hpde5dd的配体剂量依赖性稳定化。这些数据与表22中所观察的以伐地那非的剂量响应所观察到的结果一致。实施例5.hpde5c末端融合蛋白dd在sre内可位于有效载荷的上游或下游。使通过如实施例2中讨论的位点诱变来产生的hpde5突变体融合在gfp的c末端以测试hpde5突变体在融合于目标蛋白质的c末端时是否可使目标蛋白质去稳定。将接头放置在gfp与hpde5之间,并且克隆至plvx.ires.puro中。使稳定表达gfp-hpde5(野生型和突变)构建体的hek293t细胞与10μm西地那非或10μm伐地那非或dmso(对照)一起孵育48小时。在孵育之后,使用facs来测量平均荧光强度(mfi)。当融合于c末端时,所有hpde5(突变)-gfp构建体都被预期会在配体存在下使gfp稳定,同时它们被预期会在不存在配体下使gfp去稳定。实施例6.通过定点诱变来由人hpde获得的新型dd鉴定了磷酸二酯酶中影响蛋白质稳定性的已知突变,并且将其用于鉴定新型hpde源性dd。先前鉴定的突变包括但不限于hpde5(i778t)、或hpde6c(h602l)、hpde6c(e790k)、hpde6c(r104w)、hpde6c(y323n)和hpde6c(p391l)、或hpde4d(s752a)、hpde4d(s754a)、hpde4d(s752a、s754a)和hpde4d(e757a、e758a、d759a)(zhu等(2010)molcellbiol.4379-4390;alexandre等(2015).endocr.relat.cancer22(4):519-30;chegurup.等(2015)molcellneurosci;64:1–8.;其各自的内容以引用的方式整体并入本文)。使人pde突变体融合于接头和报告基因例如gfp。将报告子构建体转染至细胞诸如nih3t3细胞和293t细胞中。使经转染细胞与适当配体例如hpde5的配体西地那非和伐地那非或hpde4的配体阿普司特和罗氟司特一起孵育。通过facs来测量荧光信号,并且计算平均荧光信号强度。实施例7.使用热迁移测定来表征hpde5突变体热迁移测定可用于测量蛋白质的热变性温度作为它响应于不同条件诸如ph、离子、盐、添加剂、药物和/或突变的稳定性的指标。另外,热迁移测定可用于了解配体结合、酶促活性和稳定化效能之间的关联。使人pde5突变体与热测定染料、热测定缓冲液和配体(或dmso对照)混合。也用不同浓度的因子诸如药物、盐、离子或其他参数处理样品。将样品上样至仪器诸如实时pcr仪器中,并且在每分钟约0.1-10摄氏度的范围内设置温度斜坡速率。历经跨越典型蛋白质展开温度25-95摄氏度的温度范围,在固定间隔下测量各条件下的荧光。实施例8.表征hpde5截短突变体先前实施例中显示的数据显示hpde5的催化结构域是适于鉴定去稳定结构域的模板。产生了全长hpde5的若干截短突变体以鉴定催化结构域内除催化区域以外的可充当用于鉴定dd的模板的区域。测试的截短突变体包含hpde5wt的氨基酸535-860(e535-q860)、hpde5wt的氨基酸535至836(e535-s836)、hpde5wt的氨基酸590至860(m590-q860)、hpde5wt的氨基酸590至836(m590-s836),其中氨基酸位置是就seqidno.1来说的。将dd突变r732l掺入所有截短突变体中,并且通过使突变体融合于sg接头和报告子acgfp来将它的去稳定潜力与e535-q860野生型进行比较。将hct-116细胞用上述构建体稳定转导,并且用10μm致稳定配体西地那非或伐地那非或dmso处理48小时。作为对照,亲本未转导细胞和表达ot-hpde5n-001或ot-hpde5n-028的细胞也被包括在分析中。通过facs来分析gfp的平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经西地那非处理样品中的gfp强度的变化倍数。将去稳定突变系数计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-019),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数小于1是合乎需要的。稳定化比率大于1在dd中是所需的。结果和比率呈现于表24中。表24:hpde5截短突变体的表达如表24中所示,在两种配体的情况下,由hpde5的e535-q860氨基酸组成的具有r732l突变的ot-hpde5n-020构建体均在最高稳定化比率的情况下显示最强烈配体依赖性稳定化。也对构建体020-024计算去稳定突变系数,并且这个分析显示所述构建体全都有效使有效载荷去稳定。这表明从催化结构域移除残基似乎不使hpde5的配体依赖性稳定化潜力增强。通过蛋白质印迹来并行进行截短突变体的蛋白质表达分析。将表达ot-hpde5n-019至ot-hpde5n-024的hct116细胞用10μm伐地那非处理24小时,并且使用抗acgfp抗体(目录号63277,clonetech,mountainview,california)来针对acgfp进行免疫印迹。也分析gapdh水平以确保均匀蛋白质上样。由e535-q860即hpde5wt(seqidno.1)的氨基酸535至860组成的具有r732l突变的ot-hpde5n-020构建体显示伐地那非依赖性稳定化。这个结果与facs分析一致。未以ot-hpde5n-021观察到稳定化,而构建体ot-hpde5n-022、ot-hpde5n-023和ot-hpde5n-024在存在以及不存在伐地那非下均不显示acgfp表达,从而指示在这些突变体中,构建体的表达低于蛋白质印迹方法的检测水平。实施例9.表征hpde5组合突变体使鉴定的单一去稳定突变体组合以测试使两个或更多个突变组合是否会以累加方式或以协同方式产生具有更大去稳定潜力的结构域。dd的合乎需要品质包括在不存在配体下sre的表达较低以及sre的配体依赖性稳定化。使用利用sg接头来连接于gfp的dd产生构建体。将hct-116细胞用上述构建体稳定转导,并且用10μm致稳定配体西地那非或伐地那非或dmso处理48小时。作为对照,亲本未转导细胞和表达ot-hpde5n-001或ot-hpde5n-028的细胞也被包括在分析中。通过facs来分析gfp的平均荧光强度(mfi)。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经西地那非处理样品中的gfp强度的变化倍数。将去稳定突变系数计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-019),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数小于1是合乎需要的。稳定化比率大于1在dd中是所需的。结果和比率呈现于表25中。表25:hpde5组合突变体的表达如表25中所示,仅有具有r732l和d764n突变的ot-hpde5n-026构建体以5.63的比率显示西地那非依赖性稳定化。类似结果以ot-hpde5n-026在用伐地那非处理后获得。然而,ot-hpde5n-025仅以4.26的比率显示伐地那非依赖性稳定化。两个构建体均在不存在配体下去稳定。如所预期,hpde5野生型构建体不显示任何显著配体依赖性稳定化。这些数据表明使突变组合的策略可用于鉴定改进的dd以及由特定配体加以稳定的dd。通过蛋白质印迹来并行进行组合突变体的蛋白质表达分析。将表达ot-hpde5n-025和26的hct116细胞用10μm伐地那非处理24小时,并且使用抗acgfp抗体(目录号63277,clonetech,mountainview,california)来针对acgfp进行免疫印迹。也分析gapdh水平以确保均匀蛋白质上样。具有hpde5(f736a、d764n)的ot-hpde5n-025构建体和具有hpde5(r732l、d764n)的ot-hpde5n-026构建体显示如通过蛋白质印迹测量的acgfp蛋白质水平的伐地那非依赖性稳定化。这个结果与facs分析一致。测试hpde5组合突变体对递增剂量的西地那非的响应。用西地那非在0.04μm至30μm的范围内的剂量下处理用hpde5构建体转导的hct116细胞24小时。通过facs来测量平均荧光强度(mfi)。也包括亲本hct116和表达ot-hpde5n-019野生型构建体的细胞作为对照。将组合突变体对西地那非的响应与单突变构建体ot-hpde5n-020的响应进行比较。将在表26中指示为sr的稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经西地那非处理样品中的gfp强度的变化倍数。将去稳定突变系数比率计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-019),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数比率小于1是合乎需要的。稳定化比率大于1在dd中是所需的。结果和稳定化比率呈现于表26中。表26:组合突变体的西地那非剂量响应如表26中所示,ot-hpde5n-026构建体的跨越西地那非的多个剂量获得的稳定化比率高于单突变ot-hpde5n-020构建体。对于任何给定配体剂量,相比于026构建体,组合突变体025实现的稳定化比率都低得多。对ot-hpde5n-020(比率=0.1)、ot-hpde5n-025(比率=0.17)和ot-hpde5n-026(比率=0.1)获得的去稳定突变系数比率指示所有构建体都在不存在配体下去稳定。这些数据指示当致稳定配体是西地那非时,组合突变体ot-hpde5n-026是强力dd候选物。测试hpde5组合突变体对递增剂量的伐地那非的响应。用伐地那非在0.04μm至30μm的范围内的剂量下处理用hpde5构建体转导的hct116细胞24小时。通过facs来测量平均荧光强度(mfi)。也包括亲本hct116和表达包含hpde5野生型构建体的ot-hpde5n-019的细胞作为对照。将组合突变体对伐地那非的响应与单突变构建体ot-hpde5n-020的响应进行比较。将稳定化比率(sr)计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经伐地那非处理样品中的gfp强度的变化倍数。将去稳定突变系数比率计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-019),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数比率小于1是合乎需要的。稳定化比率大于1在dd中是所需的。结果和稳定化比率呈现于表27中。表27:组合突变体的伐地那非剂量响应如表27中所示,ot-hpde5n-026构建体的跨越伐地那非的多个剂量获得的稳定化比率高于单突变ot-hpde5n-020构建体。对于任何给定配体剂量,相比于026构建体,组合突变体025实现的稳定化比率都低得多。对ot-hpde5n-020(比率=0.13)、ot-hpde5n-025(比率=0.12)和ot-hpde5n-026(比率=0.08)获得的去稳定突变系数指示所有构建体都在不存在配体下去稳定。这些数据指示当致稳定配体是伐地那非时,组合突变体ot-hpde5n-026是强力dd候选物。测试hpde5组合突变体对递增剂量的他达那非的响应。用他达那非在0.14至100μm的范围内的剂量下处理用hpde5构建体转导的hct116细胞24小时。通过facs来测量平均荧光强度(mfi)。也包括亲本hct116和表达包含hpde5野生型构建体的ot-hpde5n-019的细胞作为对照。将组合突变体对他达那非的响应与单突变构建体ot-hpde5n-020的响应进行比较。将稳定化比率(sr)计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经他达那非处理样品中的gfp强度的变化倍数。将去稳定突变系数计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-0019),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数小于1是合乎需要的。稳定化比率大于1在dd中是所需的。结果和稳定化比率呈现于表28中。表28:组合突变体的他达那非剂量响应如表28中所示,ot-hpde5n-026构建体的跨越他达那非的多个剂量获得的稳定化比率高于单突变ot-hpde5n-020构建体,例外之处是在100μm浓度的药物下。对于任何给定配体剂量,相比于ot-hpde5-026构建体,组合突变体ot-hpde5-025实现的稳定化比率都低得多。对ot-hpde5n-020(比率=0.1)、ot-hpde5n-025(比率=0.17)和ot-hpde5n-026(比率=0.1)获得的去稳定突变系数指示所有构建体都在不存在配体下去稳定。这些数据指示当致稳定配体是他达那非时,组合突变体ot-hpde5n-026是强力dd候选物。将在所有三种配体西地那非、伐地那非和他达那非的最高浓度下对每个构建体获得的稳定化比率进行比较,并且显示于表29中。表29:hpde5配体的比较分析如表29中所示,基于稳定化比率,明显的是相较于单突变构建体以及另一组合突变构建体(ot-hpde5n-025),ot-hpde5n-026由所有三种配体加以有效稳定。两个组合突变体均由作为hpde5的最强效抑制剂的伐地那非加以最有效稳定。他达那非比西地那非更有效使构建体ot-hpde5n-025稳定,尽管这仅以小差数达成-这个观察结果是值得注意的,因为相比于他达那非,西地那非是hpde5的强力得多的抑制剂。测试hpde5组合突变体对递增的西地那非处理持续时间的响应。用西地那非在0.5或5μm下处理用hpde5构建体转导的hct116细胞0-72小时。通过facs来测量平均荧光强度(mfi)。将组合突变体对西地那非的响应与单突变构建体ot-hpde5-020的响应进行比较。将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经西地那非处理样品中的gfp强度的变化倍数。将去稳定突变系数计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5n-019),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数小于1是合乎需要的。稳定化比率大于1在dd中是所需的。用5或0.5μm进行的时程实验的结果和稳定化比率分别呈现于表30和表31中。表30:随时间对西地那非(5μm)的响应表31:随时间对西地那非(0.5μm)的响应如表30和表31中所示,在5μm剂量的西地那非下,ot-hpde5n-026构建体的随时间获得的稳定化比率高于单突变ot-hpde5n-020构建体。然而,在0.5μm的较低剂量下,这个样式被逆转,其中单突变构建体显示更大稳定化。对于两个配体剂量,在任何给定时间下,相比于ot-hpde5-026构建体,组合突变体ot-hpde5-025实现的稳定化比率都低得多。这些数据指示对适合dd的选择有时可取决于所需配体处理持续时间以及可供在系统中使用的配体浓度。实施例10.dd热点的诱变对通过定点诱变鉴定的突变体的分析鉴定了其突变会对hpde5赋予去稳定化和配体依赖性稳定化性质的氨基酸热点。为使这些构建体的dd特征改进,使在热点位置处的氨基酸突变成任何已知氨基酸,包括但不限于赖氨酸、天冬氨酸、谷氨酸、谷氨酰胺、天冬酰胺、组氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、甲硫氨酸、色氨酸、丙氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸、脯氨酸和甘氨酸。热点突变的文库通过定点诱变来产生,并且文库中的各突变体都通过接头来融合于报告蛋白例如acgfp。如先前所述通过蛋白质印迹和facs来分析dd在存在以及不存在配体下的性质。评价的配体包括但不限于西地那非、伐地那非和他达那非。实施例11.使生物回路行为最优化本发明的生物回路包含可被优化的多个模块。产生各组分的文库以允许快速产生具有所需行为的新型构建体。配体药物动力学是用于达成体内有效载荷特异性调谐的强力工具,视调节因子而定,其可用于使效应物模块的配体响应曲线向左侧或右侧移动。测试若干调节因子,包括但不限于配体剂量、浓度、量级、持续时间和施用途径。去稳定结构域也可被修饰来使生物回路行为改进。去稳定结构域是生物回路的动态范围的核心决定因素。视所选dd而定,可使效应物模块的配体响应曲线向上或向下移动。对效应物模块内dd的性质、位置以及效应物模块内dd的数目进行修改。视它的所需降解动力学而定,也改变dd选择。使以转录方式控制sre的表达的启动子最优化。对启动子的选择会影响基础关闭状态,并且影响稳定化的动态范围。此外,启动子选择会促进产生的经稳定有效载荷的程度。生物回路的其他可优化要素包括载体、翻译元件、前导序列、组分在sre内的放置、密码子选择、蛋白酶位点、接头和mrna稳定性。实施例12.在hpde5突变体中的伐地那非剂量响应曲线如实施例9中所述来产生组合突变体。在用hpde5构建体转导的hct116细胞中测试hpde5组合突变体对递增剂量的伐地那非的响应,所述hct116细胞用伐地那非在0.1至10μm的范围内的剂量下处理48小时,或用媒介物对照(dmso)处理。通过facs来测量gfp的平均荧光强度(mfi)。将组合突变体对伐地那非的响应与单突变构建体ot-hpde5n-020的响应进行比较。超过dmso的mfi变化倍数呈现于表32中。表32:伐地那非剂量响应西地那非(μm)ot-hpde5-020ot-hpde5-025ot-hpde5-0260.014026444438150.046970493438390.1214832513348700.3726429500781071.11349325751218573.3349739105164910510.00513062492764734如表32中所示,相较于其他两种构建体,在较低剂量即0.1和0.3微摩尔浓度的伐地那非下观察到对ot-hpde5n-020构建体获得的配体依赖性稳定化,从而指示极低剂量的配体足以使这个hpde5突变体稳定。在类似剂量下,ot-hpde5n-026构建体不显示配体依赖性稳定化。然而,相比于ot-hpde5n-020,在最高剂量的伐地那非下,获得的gfp表达高得多。相比之下,在较低剂量下,ot-hpde5n-025显示极其少许gfp表达,并且在较高剂量下,相较于其他两个构建体,仅显示适度gfp表达。这些实验指示单一hpde5dd突变的组合会产生不由单一突变体的性质所预测的协同作用。因此,基于目标有效载荷的性质和所需表达水平,可选择适合的hpde5dd。实施例13.受dd调控的免疫治疗剂在体外表达使本发明的免疫治疗性有效载荷诸如细胞因子(例如il2、il12、il15、il15-il15ra)、嵌合抗原受体(cd19car)、调控蛋白(例如foxp3)、安全性开关(例如胱天蛋白酶9)融合于本文所述的任何dd,并且克隆至表达载体中。添加任选接头和裂解位点以使效应物模块的构象最优化。为测试配体依赖性免疫治疗性有效载荷产生,将细胞涂铺在生长培养基例如具有10%fbs的dmem中,并且在37℃、5%co2下孵育过夜。使用lipofectamine2000来用构建体短暂转染或转导细胞,并且孵育48小时。在孵育之后,将生长培养基换成含有配体(例如西地那非、伐地那非和他达那非)的培养基。在与配体一起孵育24小时之后,使细胞裂解,并且使用对有效载荷具有特异性的抗体来进行免疫印迹。对于分泌型有效载荷诸如细胞因子,从表达本发明的效应物模块的培养物收集生长培养基。类似于免疫印迹,使用本领域中已知的方法诸如elisa和msd测定来测定培养基中的有效载荷表达。对于细胞表面表达型有效载荷,也使用本领域中已知的细胞表面表达分析方法诸如流式细胞术来测定有效载荷的表达。将在配体存在下获得的有效载荷表达与在不存在配体下的表达进行比较。有效载荷的水平随配体浓度和/或处理持续时间增加而增加指示dd介导的对有效载荷的调控。也将表达与亲本未转导细胞以及表达未附接于dd的免疫治疗性有效载荷(即组成性表达的)的细胞进行比较。实施例14.受dd调控的免疫治疗剂在体外的功能为测试受dd调控的il12表达是否能够使il12信号传导活化,从pbmc分离人t细胞,并且用植物血球凝集素(pha,2μg/ml)活化3天,随后用50iu/ml的白介素-2(il2)处理24小时。将细胞洗涤,再混悬于新鲜培养基中,并且静息4小时。将t细胞用受dd调控的il12构建体转导,并且基于所用dd来用配体(例如西地那非、伐地那非和他达那非)处理或用媒介物对照处理。通过il12达成的活化会导致stat4磷酸化。另外,il12促进原初t细胞分化成th1细胞,这导致从t细胞分泌ifnγ。收集细胞,并且使用stat4抗体(cellsignalingtechnology,danvers,ma)来测量stat4磷酸化。分析细胞上清液和细胞裂解物中的ifnγ。在配体存在下,预期表达受dd调控的il12的细胞会具有增加的stat4磷酸化以及增加的ifnγ表达。il15和il15/il15ra融合分子可赋予t细胞上的记忆表型,并且使nk细胞的增殖增加(hurtonl等(2016),pnas,113:e7788-7797)。nk细胞增殖对细胞因子的这种依赖性可用于测试受dd调控或组成性表达的细胞因子和细胞因子融合蛋白的功能性。使用一组其表达增加与nk活化相关联的标志物,通过facs来评价nk-92细胞响应于配体处理的活化。这些包括nkg2d、cd71、cd69;趋化因子受体诸如ccr5、cxcr4和cxcr3,穿孔素、粒酶b和干扰素γ(ifng)。预期受dd调控的il15或il15-il15ra融合分子的表达会使nk细胞活化增加。为评价il15和il15-il15ra的配体依赖性稳定化对原代t细胞的影响,用dd-il15ra构建体转导t细胞。通过使用流式细胞术来测量在存在或不存在配体下的t细胞增殖和记忆表型标志物(例如cd62l)。为测试受dd调控的cd19car细胞在体外杀灭靶标细胞的能力,将原代t细胞群体用受dd调控的cd19car构建体转导,在存在或不存在对dd具有特异性的配体下与表达cd19的k562细胞(靶标细胞)一起共培养。建立t细胞和靶标细胞的多个组合。这些组合包括与k562细胞一起(在存在或不存在配体下)共培养的受dd调控的car表达性t细胞,与表达cd19的k562细胞一起共培养的t细胞,以及不进行t细胞共培养的表达cd19的k562细胞。额外对照包括仅靶标细胞;未转导的t细胞;用空载体转导的t细胞。用丝裂霉素c处理靶标细胞以阻止它们的增殖。将k562细胞用nuclightred加以荧光标记,并且与t细胞一起共培养300小时。通过用膜联蛋白v(annexinv)标记细胞来监测细胞死亡,并且靶标k562细胞中的细胞死亡通过使用活细胞分析系统(essenbiosciences,annarbor,mi)评价关于膜联蛋白v与nuclightred两者均呈阳性的细胞来监测。预期仅在配体存在下以及当利用异位表达cd19的k562靶标细胞时,以受dd调控的car构建体达成靶标细胞杀灭。预期在具有相同共培养设置的未处理对照的情况下以及当t细胞与不表达cd19的亲本k562细胞一起在存在或不存在配体下共培养时,无细胞杀灭。预测组成型构建体会在存在以及不存在配体下均显示细胞杀灭。实施例15.受dd调控的免疫治疗剂在体内的功能受dd调控的免疫治疗性有效载荷的配体依赖性体内功能通过以下方式来表征:评价在用本发明的配体处理后,表达受dd调控的构建体的t细胞抑制所建立肿瘤的生长的能力。将肿瘤细胞诸如hct116细胞在皮下异种移植至小鼠中。将用本文所述的受dd调控的构建体稳定转导的t细胞在静脉内注射至小鼠中。大约在注射之后两周当肿瘤达到约300立方毫米的尺寸时,在不同浓度下每两天用配体(例如西地那非、伐地那非和他达那非)或媒介物对照对小鼠给药。一周两次监测肿瘤体积和体重。在末次配体给药之后也收集血浆和肿瘤样品,并且测量有效载荷水平以及配体水平。预期相较于经媒介物治疗动物,在用配体治疗的小鼠中,肿瘤体积显著更小。预期肿瘤有效载荷水平与肿瘤体积正相关。为测量本发明组合物是否促进免疫细胞持久性,将用dd-il15/il15ra构建体转导的t细胞注射至小鼠中。用配体(例如西地那非、伐地那非和他达那非)处理小鼠,并且历经40-50天的时期加以监测。将用组成型ot-il15-008构建体转导的t细胞和未转导亲本t细胞注射至单独小鼠中作为对照。以常规方式从小鼠抽取血液,并且测试t细胞的存在性。预期用配体处理的小鼠会保留表达hpde5dd-il15-il15ra的t细胞,而不预期经媒介物处理小鼠中的t细胞会持续存在。实施例16.受dd调控的有效载荷的共同表达与全身性施用白介素相关的毒性可通过使用car-t细胞来将白介素递送至靶标组织中加以规避。相比于单独白介素和car疗法,这个组合方法也具有更大抗肿瘤活性。用cd19car(组成型或受dd调控)和dd-白介素例如dd-il2、dd-il12、dd-il15和dd-il15/il15ra构建体共转染细胞。视所用dd而定,用致稳定配体处理经转染的细胞。cd19car表达通过对cd3ζ进行免疫印迹来评价。培养基中的dd-il2、dd-il12、dd-il15和dd-il15/il15ra表达通过elisa来测量。受dd调控的胱天蛋白酶9有可能使安全性改进,并且使与cd19car疗法相关的毒性最小化。用cd19car(组成型或受dd调控)和dd-胱天蛋白酶9构建体共转染细胞。视所用dd而定,用致稳定配体处理经转染的细胞。cd19car和胱天蛋白酶9表达通过分别对cd3ζ和胱天蛋白酶9进行免疫印迹来评价。实施例17.在hpde5突变体中的西地那非和他达那非剂量响应曲线如先前在实施例9中所述来产生组合突变。测试表达hpde5组合突变体的hct116细胞对在0.1μm至100μm的范围内的递增剂量的他达那非和西地那非(持续48小时)或媒介物对照(dmso)的响应。通过facs来测量平均荧光强度(mfi)。将组合突变体对配体处理的响应与单突变构建体ot-hpde5n-020进行比较。在配体处理的情况下的mfi显示于表33和表34中。表33:他达那非剂量响应他达那非(μm)ot-hpde5-020ot-hpde5-025ot-hpde5-0260.143616432837200.415811500238041.2311694550348103.70241855744789311.114038082992461733.33572331583152927100.00725873102084334表34:西地那非剂量响应西地那非(μm)ot-hpde5-020ot-hpde5-025ot-hpde5-0260.143771439834010.415463483236811.2310479503144773.70224414974762511.113556156752410433.3352029967751416100.0010122637494136010如表33和表34中所示,在所有三种构建体的情况下都获得了配体剂量依赖性稳定化。相较于其他两种构建体,在单突变构建体ot-hpde5-020中,在较低剂量下(例如直至11μm的西地那非和他达那非)的剂量依赖性稳定化是更明显的。在较高浓度的配体下,ot-hpde5-025与ot-hpde5-026两者均显示配体依赖性稳定化。实际上,相较于ot-hpde5-020与ot-hpde5-025两者,在33和100μm下,ot-hpde5-026构建体显示高得多的mfi值。这些实验指示单一hpde5dd突变的组合会产生不由单一突变体的性质所预测的协同作用。因此,适合的hpde5dd可基于目标有效载荷的性质和所需表达水平来选择。实施例18.hpde5突变体的动力学hpde5突变体ot-hpde5-020和ot-hpde5-026的关闭动力学通过处理表达这些构建体或野生型对照构建体ot-hpde5-019的hct116细胞来测试。用配体处理细胞48小时。移除含有配体的培养基,并且添加不具有配体的新鲜培养基。在0小时(即在开始实验之前)、配体处理之后48小时,以及在配体洗脱之后若干时间点直至96小时,通过facs来分析mfi。将稳定化比率计算为在同一构建体的情况下,相较于在不存在配体下的gfp强度,经配体处理样品中的gfp强度的变化倍数。结果显示于表35中。表35:关闭动力学如表35中所示,在移除配体之后,hpde5突变体的稳定化比率降低。相较于ot-hpde5-020构建体,在组合突变体ot-hpde5-026的情况下,稳定化比率值更快速降低,从而表明在ot-hpde5-026构建体中,更快速实现dd的去稳定化。相比于ot-hpde5-020构建体,以ot-hpde5-026构建体实现的如由稳定化比率指示的配体依赖性稳定化是较低的,这也可促进以ot-hpde5-026构建体所观察到的优越关闭动力学。实施例19.hpde5c末端突变体的行为测试当附接于有效载荷的c末端时,hpde5突变体调谐有效载荷的表达的能力。将ot-hpde5c-030与ot-hpde5c-036进行比较。使nih3t3细胞与不同剂量的西地那非或伐地那非一起孵育48小时,并且通过facs来分析mfi。将稳定化比率(sr)计算为在同一构建体的情况下,相较于在不存在配体下的gfp强度,经配体处理样品中的gfp强度的变化倍数。结果显示于表36中。表36:hpde5c末端突变体对西地那非和伐地那非的响应如表36中所示,ot-hpde5c-030构建体显示稳定化比率大于1,从而指示伐地那非配体与他达那非配体两者均可使gfp表达稳定。如所预期,野生型构建体ot-hpde5c-036不稳定化远大于1,从而指示以野生型构建体实际上未实现稳定化。也测量在24和48小时时的gfp表达以监测hpde5-ddgfp构建体对配体暴露持续时间的依赖性。结果显示于表37和表38a中,其中sr指示稳定化比率。表37:hpde5c末端突变体在西地那非处理的情况下的剂量响应表38a:hpde5c末端突变体在伐地那非处理的情况下的剂量响应与在48小时时测量的响应一致,在24小时时测量的响应显示hpde5突变构建体使gfp表达稳定,如由稳定化比率大于1所证实,而野生型构建体ot-hpde5c-036显示稳定化比率约1,从而指示无配体依赖性稳定化。在西地那非处理与伐地那非处理之间,结果是一致的。注意到在48小时时获得的稳定化比率远大于在24小时时获得的值,从而表明gfp表达的时间依赖性稳定化。类似结果通过使用gfp抗体进行蛋白质印迹分析来获得。在0.1μm西地那非下,通过蛋白质印迹观察到gfp蛋白质水平的适度稳定化。当用1μm西地那非处理细胞时,gfp的稳定化增加。0.1μm与1μm剂量的伐地那非两者均显示gfp水平的稳定化。在24小时和48小时,均观察到这些趋势。所有比较都相对于未用任一配体处理的细胞来进行。也测试hpde5c末端突变体对较低剂量的伐地那非的响应,并且显示于表38b中。表38b:hpde5c末端突变体在伐地那非处理的情况下的剂量响应伐地那非(nm)mfi稳定化比率0137-11631.1932301.68104773.48309096.64100141710.341000178913.06如表38b中所示,hpde5c末端突变体即使在较低剂量的伐地那非下也显示剂量依赖性稳定化,如由稳定化比率增加所指示。因此,即使低纳摩尔浓度剂量的伐地那非也足以诱导hpde5dd的配体依赖性稳定化。实施例20.hpde5荧光素酶构建体的行为使pde5源性dd附接于报告子有效载荷诸如荧光素酶以产生构建体ot-hpde5-031、ot-hpde5-032、ot-hpde5-033和ot-hpde5-035构建体。所述构建体可适用于在体内研究dd的去稳定化和稳定化的动态。将这些构建体转导至hct116细胞中。将细胞在每孔2000个细胞下接种至96孔板中,并且与1μm或dmso伐地那非一起孵育48小时。接着使用读板仪测定来测量荧光素酶活性。亲本未转导细胞作为对照用于测量本底荧光水平。结果显示于表39中。在表39中,将稳定化比率计算为在同一构建体的情况下,相较于用dmso进行的处理(即在不存在配体下),经伐地那非处理样品中的荧光素酶信号的变化倍数。将去稳定突变系数计算为在不存在配体下,相较于hpde5野生型构建体(ot-hpde5-031),hpde5突变构建体中的gfp强度的变化倍数。去稳定突变系数小于1是合乎需要的。稳定化比率大于1在dd中是所需的。表39:荧光素酶构建体的稳定性在不表达构建体的亲本细胞中观察到的荧光素酶信号强度指示一些信号可能是本底噪声。构建体ot-hpde5-033显示最低去稳定突变系数,从而指示所述构建体去稳定。以包括野生型hpde5构建体ot-hpde5-031的所有构建体观察到稳定化比率增加。构建体ot-hpde5-035显示最高稳定化比率,从而指示最强烈配体依赖性稳定化。在测试的构建体之中,ot-hpde5-033显示在不存在配体下的去稳定化以及在存在配体下的稳定化。实施例21.对hpde5的氨基酸732的诱变对通过定点诱变鉴定的突变体的分析鉴定了其突变会对hpde5赋予去稳定化和配体依赖性稳定化性质的氨基酸热点。选择在位置735处的氨基酸用于进一步分析,因为hpde5(r732l)突变具有上述性质。为使这个dd的dd特征改进,使在位置732处的氨基酸突变成任何已知氨基酸,包括但不限于天冬氨酸、谷氨酸、谷氨酰胺、天冬酰胺、组氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、甲硫氨酸、色氨酸、丙氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸、脯氨酸和甘氨酸。突变的文库通过定点诱变来产生,并且文库中的各突变体都通过接头来融合于报告蛋白质例如acgfp并转导至hct116细胞中。如先前所述通过facs来分析dd在存在以及不存在配体下的性质。评价的配体包括但不限于西地那非和伐地那非。结果显示于表40a和表40b中。表40a:热点构建体的配体响应性行为表40b:热点构建体的稳定化比率和去稳定突变系数分析用所指示配体对各构建体获得的去稳定突变系数和稳定化比率以鉴定具有最低去稳定突变系数比率的构建体,并且接着对数据进行第二分选以鉴定具有最高稳定化比率的构建体。这个分析允许鉴定具有最低去稳定突变系数、也具有最高稳定化比率的构建体。基于这个分析,认明了实际上所有测试突变体都显示在西地那非处理的dmso对照的情况下,去稳定突变系数小于1,从而指示所有构建体都在不存在西地那非下去稳定。在西地那非存在下,具有精氨酸至赖氨酸取代的ot-hpde5-081构建体显示高度西地那非依赖性稳定化比率。在伐地那非的情况下对构建体的类似分析将ot-hpde5-081、ot-hpde5-066、ot-hpde5-067和ot-hpde5-065鉴定为具有低去稳定突变系数和高配体依赖性稳定化比率。具有低去稳定突变系数和高稳定化比率的其他构建体包括ot-hpde5-067、ot-hpde5-065、ot-hpde5-069、ot-hpde5-074和ot-hpde5-075。也在用配体处理48小时的hct116细胞中测试所选突变体对增加剂量的西地那非、伐地那非和他达那非的响应。以各配体处理获得的mfi值显示于表41a、表41b和表41c中。表41a:伐地那非剂量响应表41b:西地那非剂量响应表41c:他达那非剂量响应在所有三种测试配体的情况下,在最高剂量下,具有精氨酸至苏氨酸取代的ot-hpde5-074都显示gfp表达最强烈增加。在低于1μm的剂量的伐地那非下,所有构建体都显示配体依赖性稳定化。在低于1μm的剂量的西地那非下,ot-hpde5-069、ot-hpde5-074和ot-hpde5-075显示配体依赖性稳定化。在他达那非的剂量低于1μm的情况下,ot-hpde5-065、ot-hpde5-069和ot-hpde5-074显示配体依赖性稳定化。通过对r732基因座的诱变,获得了具有多种性质的dd。对特定dd的选择可基于所用有效载荷和关于有效载荷的所需表达程度来进行。在各配体的情况下针对各构建体的ec50值显示于表41d中。表41d:针对热点突变体的ec50这些结果与对用这些突变体稳定转导的hct116细胞中的gfp蛋白质水平的蛋白质印迹分析一致。以下构建体显示在伐地那非存在下以及当相较于dmso对照时,gfp水平的强烈稳定化:ot-hpde5-009、ot-hpde5-064、ot-hpde5-065、ot-hpde5-068、ot-hpde5-070、ot-hpde5-071、ot-hpde5-072、ot-hpde5-073、ot-hpde5-074、ot-hpde5-075、ot-hpde5-076、ot-hpde5-077、ot-hpde5-078、ot-hpde5-079和ot-hpde5-080。以ot-hpde5-066、ot-hpde5-067、ot-hpde5-069和ot-hpde5-081观察到gfp水平的适度配体依赖性稳定化。所有样品都显示相等蛋白质上样,如由gapdh蛋白质水平所测量。实施例22:hpde5调控的动态范围将hct116细胞用hpde5-gfp构建体ot-hpde5-083、ot-hpde5-084、ot-hpde5-085和ot-hpde5-094转导,并且与所指示浓度的配体一起孵育48小时。通过facs来测量gfp荧光。在伐地那非、西地那非和他达那非的情况下,超过未处理dmso对照的gfp表达变化倍数分别显示于表42a、表42b和表42c中。表42a:伐地那非剂量响应表42b:西地那非剂量响应表42c:他达那非剂量响应如表42a、表42b和表42c中所示,以ot-hpde5-083、ot-hpde5-084和ot-hpde5-085观察到对hpde5dd的动态调控。在所有三种配体的情况下,hpde5野生型构建体都显示几乎无乃至无配体依赖性稳定化。也计算在每种配体的情况下针对所有四种构建体的稳定化浓度50或(sc50)(其是配体的为实现50%稳定化所需的浓度),和结果显示于表42d中。表42d:hpde5dd的稳定化浓度50(sc50)配体ot-hpde5-83ot-hpde5-84ot-hpde5-85ot-hpde5-94伐地那非0.041.15>300.07西地那非0.386.82>300.67他达那非1.979.54>1000.77总之,这些结果指示结构引导的对pde5中配体结合位点的诱变产生23nm配体-dd相互作用。具有y612f、r732l的ot-hpde5-083能够以23nm的sc50结合至伐地那非,从而表明强效dd-配体相互作用。实施例23.受dd调控的il15-il15-ra在体外的表达使本发明的免疫治疗性有效载荷诸如il15-il15ra融合蛋白融合于本文所述的任何dd,并且克隆至表达载体诸如plvx和pelns载体中。为测试配体依赖性il15-il15ra产生,用构建体短暂转染hek293t细胞。接着将细胞涂铺在具有10%fbs的dmem中,并且在37℃、5%co2下孵育过夜。将生长培养基交换成含有配体例如在10μm下的伐地那非的培养基。在与配体一起孵育48小时之后,使细胞裂解,并且使用对il15ra具有特异性的抗体来进行免疫印迹。在所有三种测试构建体ot-il15-043、ot-il15-044和ot-il15-045的情况下,hpde5-dd都能够在伐地那非存在下调控il15ra水平。相比之下,在组成型构建体ot-il15-008的情况下,在存在以及不存在配体下,il15ra水平均保持不变。注意到配体依赖性稳定化仅在伐地那非存在下伴有il15ra的迁移性的向上偏移,从而指示稳定化可能伴有翻译后蛋白质修饰。样品的均一上样使用肌动蛋白作为上样对照来证明。载体骨架对有效载荷的表达的影响通过将ot-il15-031构建体克隆至pelps载体骨架中以产生ot-il15-079构建体来考查。将构建体转导至hek293t细胞中,并且如上所述来测定il15ra表达。仅有ot-il15-031显示il15ra蛋白质水平的伐地那非依赖性稳定化。在伐地那非存在下,以ot-il15-079构建体仅观察到适度配体依赖性稳定化。也使用msd测定来考查il15水平。从表达il15-il15ra并且暴露于10μm伐地那非或媒介物对照48小时的细胞收集生长培养基。结果显示于表43中,其中稳定化比率定义为目标蛋白质即il15-il15ra响应于刺激物即伐地那非的表达、功能或水平与il15-il15ra在不存在刺激物下即在dmso对照的情况下的表达的比率。将去稳定化比率计算为il15ra在不存在对效应物模块具有特异性的刺激物即伐地那非下的表达与以组成性方式(ot-il15-008)以及在不存在对sre具有特异性的刺激物下表达的目标蛋白质的表达、功能或水平的比率。稳定化比率大于1,并且去稳定化比率小于1是所需的。表43:il15水平(pg/ml)构建体对照伐地那非去稳定化比率稳定化比率ot-il15-008710.73799.39-1.12ot-il15-04363.3793.630.091.48ot-il15-044193.09203.210.271.05ot-il15-045255.05320.390.361.26如表43中所示,所有三个受hpde5调控的构建体都显示去稳定化比率小于1,从而指示在不存在配体下的去稳定化。ot-il15-043似乎是去稳定化程度最大的构建体。它也是配体稳定化程度最大的构建体,具有最高稳定化比率。也通过蛋白质印迹来分析ot-il15-031构建体在hct-116细胞中的表达。使细胞暴露于10μm伐地那非48小时,并且通过蛋白质印迹来分析il15和il15ra水平。类似于hek293t细胞,hct116细胞也显示伐地那非依赖性稳定化,伴有il15ra蛋白的迁移性的相伴向上偏移,从而指示蛋白质修饰。实施例24.接头对dd调控il15-il15ra的影响测试所用接头的类型和接头的长度对有效载荷表达调控的影响。使用gsgsgs(seqidno.8330)作为接头(如在ot-il15-111中),或使用gsgsgsgs(seqidno.8331)作为接头(如在ot-il15-112中),或使用gsgsgggsgs(seqidno.8332)作为接头(如在ot-il15-113中),使il15-il15ra融合构建体连接于hpde5(r732l)dd。构建体的il15部分用flag标签加以标签化,而il15ra部分用ha标签加以标签化。这些标签允许构建体的两个组分在实验中被个别地追踪。将构建体短暂转染至hek293t细胞中,接着与1μm伐地那非一起孵育24小时。如先前所述通过使用ha抗体进行facs来分析在存在以及不存在配体下,受dd调控的il15-il15ra有效载荷的性质。结果显示于表44中,其中稳定化比率定义为目标蛋白质即il15-il15ra响应于刺激物即伐地那非的表达、功能或水平与il15-il15ra在不存在刺激物下即经dmso对照处理样品的表达的比率。表44:在不同接头的情况下的ha阳性细胞%构建体名称对照伐地那非稳定化比率ot-il15-11137.563.21.69ot-il15-11241.674.61.79ot-il15-1134269.11.65如表44中所示,各自具有不同接头的所有三个构建体都产生了有点类似的稳定化比率,从而指示接头长度和身份不影响由dd对有效载荷的调控。所有三个构建体也都具有大于1的稳定化比率,从而表明有效载荷表达在配体存在下得以稳定。在三个测试构建体之中,相比于其他两个构建体,ot-il15-112显示略微更高的稳定化比率,从而指示使用gsgsgsgs接头可导致略微改进的配体依赖性稳定化。实施例25.受dd调控的cd19car表达和功能使本发明的免疫治疗性有效载荷诸如cd19car融合于本文所述的任何dd,并且克隆至表达载体plvx和pelns载体中。以这个方式,ot-cd19-052(hpde5(wt))和ot-cd19-053(hpde5(r732l))。添加ha标签以使得能够易于检测嵌合蛋白。为测试配体依赖性cd19car产生,用构建体短暂转染nih3t3细胞。接着将细胞涂铺在生长培养基例如具有10%fbs的dmem中,并且在37℃、5%co2下孵育过夜。将生长培养基换成含有在30nm至10,000nm的范围内的各种伐地那非浓度下的配体的培养基。在与配体一起孵育48小时之后,通过使用ha抗体进行facs来分析细胞,并且计算平均荧光强度(mfi)。结果显示于表45a中,其中稳定化比率定义为目标蛋白质即cd19car响应于刺激物即伐地那非的表达、功能或水平与cd19car在不存在刺激物下即在dmso对照的情况下的表达的比率。稳定化比率大于1是所需的。表45a:cd19car表达如表45a中所示,以所有剂量的伐地那非,以及甚至以最低浓度的伐地那非(30nm)观察到稳定化比率大于1,从而表明低剂量的配体可足以实现配体依赖性稳定化。也注意到在配体的最高浓度即10,000nm下获得的稳定化比率低于以1000nm配体获得的比率,从而表明稳定化的双峰模式。在用2ugdna转染并且使用2ug/ml嘌呤霉素加以稳定选择的hek293细胞中测量对ot-cd19-052和ot-cd19-053的剂量依赖性调控。在所指示浓度下进行24小时的配体处理之后,使用蛋白l染色来检测car表面表达。中值蛋白l荧光显示于表45b中。表45b:配体剂量依赖性car表达如表45b中所示,仅有ot-cd19-053对递增剂量的配体起响应,伴有表面car表达增加,而wt构建体ot-cd19-052并非如此。这以所有三个配体观察到。然而,最高水平的car表达以递增剂量的伐地那非观察到。伐地那非、他达那非和西地那非的ec50分别被测定为25nm、380nm和1500nm。也用配体持续不同持续时间来处理细胞,其中配体浓度显示于表45c中,并且使用facs来测量蛋白l表达。结果显示于表45c和表45d中。稳定化比率显示于表45e中。表45c:在伐地那非的情况下car表达的时间依赖性增加表45d:在他达那非和西地那非的情况下car表达的时间依赖性增加表45e:car表达的时间依赖性增加对稳定化比率的分析指示随着与配体一起孵育的持续时间的增加,ot-cd19-053由所有三个配体加以稳定。如所预期,相比于1μm剂量,10μm剂量的配体显示大得多的car表达。即使在较低剂量下,调控也是明显的。将构建体ot-cd19-130、ot-cd19-131和ot-cd19-132克隆至pelns载体中,并且转导至t细胞中。对细胞测试慢病毒上清液的三个不同体积,即1μl、10μl和20μl。在转导之后,在第4天开始,将细胞用10μm伐地那非处理或保持不处理24小时。也包括未转导细胞作为阴性对照。在第5天,通过使用1μg/mlcd19fc进行facs来测量car阳性细胞百分比。结果显示于图19a中。如图19a中所示,所有三个构建体都显示在伐地那非存在下,car阳性细胞百分比的病毒剂量依赖性增加。尽管在未处理对照的情况下观察到类似趋势,但以不进行伐地那非处理观察到的car阳性细胞百分比实质上小于经伐地那非处理的对照。在三个构建体之中,ot-cd19-132显示在不存在配体下car的基础表达最低,以及在存在伐地那非下,car阳性细胞的百分比最高。当比较在使用20μl病毒的情况下以不同构建体获得的car阳性细胞百分比时进行类似观察,如图19b中所示,其中观察到相较于未转导细胞以及未处理细胞,经伐地那非处理细胞(标记为处理)中car阳性细胞的数目发生转变。维持培养超过10天的t细胞达到静息,并且因此用ot-cd19-131转导的t细胞在第11天不显示伐地那非依赖性car表达。然而,在第11天用cd3/cd28珠粒再刺激相同t细胞(在3:1珠粒:细胞比率下,与配体处理相伴持续24小时)恢复了用20μl病毒转导的t细胞中的伐地那非依赖性car表达(图19c)。再刺激对car的表达的影响在病毒的所有测试浓度下都是明显的,图19d。总之,这些数据显示可操作地连接于hpde5dd的cd19car显示配体依赖性car表达。此外,配体响应性和后续car表达可通过用cd3/cd28珠粒进行再刺激来在静息t细胞中加以恢复。为测试不同配体对hpde5-car构建体的影响,将构建体包装至质粒中,并且使用10μl病毒来转导至t细胞中。在第9天,用在0.1nm至10μm的范围内的不同剂量的配体处理表达ot-cd19-111、ot-cd19-130、ot-cd19-131或ot-cd19-132的t细胞24小时。包括组成型构建体ot-cd19-063作为阳性对照,并且用空载体(pelns)转导的细胞充当阴性对照。测试hpde5的三种不同配体,包括西地那非、他达那非和伐地那非。将细胞通过facs来分析,并且针对单态/活car阳性细胞加以分选。结果显示于图19e中。在三个测试配体之中,所有构建体都对伐地那非起最大响应,继之以他达那非和西地那非。如先前所见,相比于其他构建体,ot-cd19-131和ot-cd19-132显示较低基础表达,并且具有较高ec50值。通过使用10μl、2μl、0.4μl或0.08μl的病毒,用向t细胞中转导的不同体积的病毒转导t细胞来用ot-cd19-131构建体重复实验,并且通过facs来测量在存在所有三个配体下以及在不存在配体下的car表达。结果显示于表45f中,其中“基础car+%”指示在不存在配体下的car阳性细胞的百分比,并且“最大car+%”指示在配体存在下的最大car表达。ec50定义为药物/配体的产生半数最大响应的浓度。本文的响应是指嵌合抗原受体的表达。表45f.hpde5对cd19-car的调控在三个测试配体之中,较高转导体积使实现的最大car表达水平增加,但不改变配体ec50值。为测试配体可以多快速度使hpde5-car稳定,在t细胞中测试所指示的构建体。使来自供体的t细胞解冻,并且在cd3/cd28dynabeads存在下在3:1珠粒:细胞比率下活化过夜。次日,用10μl从ot-cd19-063、ot-cd19-111、ot-cd19-130、ot-cd19-131和ot-cd19-132构建体制备的慢病毒转导细胞。通过历经10天的过程添加新鲜培养基来使细胞扩增,维持细胞在约0.5x10^6个细胞/ml下,接着冷冻。使经扩增的t细胞解冻,并且用cd3/cd28珠粒再刺激48小时。用10μm他达那非或伐地那非在各种时间下处理细胞,以使所有情况都接受48小时珠粒刺激,伴有0、2、4、6、24或48小时的配体处理。用1μg/mlcd19-fc测量car表面表达。结果显示于图19f中。在活化的t细胞中,截至配体添加之后2小时,car表面表达在近乎最大水平下发生。为测试显示受调控表达的cd19-car是否也显示受调控的细胞毒性,在针对cd19表达性nalm6肿瘤细胞系的细胞毒性测定中测试经转导的t细胞,使来自人供体的t细胞解冻,并且在cd3/cd28dynabeads存在下在3:1珠粒:细胞比率下活化过夜。次日,用10μl来自ot-cd19-063、ot-cd19-111、ot-cd19-130、ot-cd19-131和ot-cd19-132的慢病毒转导细胞。通过历经10天的过程添加新鲜培养基来使细胞扩增,维持细胞在约0.5x10^6个细胞/ml下,接着冷冻。使经扩增t细胞解冻,并且与cd19表达性靶标细胞nalm6-katushka一起在效应细胞:靶标细胞比率10:1下在不存在或存在他达那非下共培养6天。通过随时间测量红色荧光(总nucred面积)来分析在incucytezoom上捕集的图像以获得靶标细胞的增殖。在不存在配体下即在dmso的情况下,ot-cd19-131和ot-cd19-132显示靶标细胞增殖,如由总nucred面积(红色荧光)增加所测量。构建体ot-cd19-130、ot-cd19-111显示极低水平的红色荧光,从而指示与组成性表达的car构建体ot-cd19-063类似的基础活性。当用3μm他达那非或10μm他达那非处理时,所有测试构建体都显示红色荧光降低,此与以组成性表达的car观察到的红色荧光水平类似。如所预期,未转导细胞在存在以及不存在配体下均显示高水平的红色荧光。在t细胞中显示较高基础car表达的构建体ot-cd19-111和ot-cd19-130在不存在他达那非下抑制靶标细胞生长。用就car表达而言具有最高他达那非ec50的ot-cd19-132转导的t细胞需要较高浓度的配体来产生体外功能性响应。为测量t细胞中的细胞因子水平,在48小时时收集来自先前共培养测定的上清液,并且通过msd测定(mesoscalediscovery的elisa)来分析ifnγ和il2水平。结果显示于图19g中。细胞因子水平在以下效应细胞与靶标细胞比率下获得:10:1、3:1、1:1、0.3:1和0.1:1。当与nalm6靶标共培养时,仅在3μm他达那非存在下,由经ot-cd19-131转导t细胞产生高水平的ifnγ与il2两者,这与观察到的细胞毒性相关联。为确认细胞毒性和细胞因子分泌与car表达直接相关,使经ot-cd19-131转导的t细胞与nalm6-katushka靶标细胞在10:1效应细胞:靶标细胞比率下在从10μm至10nm进行剂量滴定的他达那非存在下共培养6天。历经6天的时期测量nalm6细胞响应于以下剂量的他达那非的荧光:0.01μm、0.04μm、0.12μm、0.37μm、1.11μm、3.33μm、10μm。在0.37μm、1.11μm、3.33μm、10μm下的他达那非剂量显示历经6天,nalm6增殖降低。较低浓度(<0.37μm)他达那非不导致nalm6荧光降低,实际上,历经6天的跨度,nalm6细胞继续增殖。在处于或高于300nm的他达那非浓度下,通过使用cd19-fc进行的facs,检测到显著car表达。这个car表达对应于他达那非剂量依赖性细胞毒性(图19h)以及ifnγ和il2的细胞因子分泌(图19i)。也在体外测试经car转导的t细胞的功能性。用ot-cd19-131或组成型构建体ot-cd19-063转导t细胞。接着使细胞冷冻。在实验之前,使t细胞解冻过夜,并且与稳定表达katushkarfp的nalm6靶标细胞共培养。nalm6细胞表达高水平的cd19抗原,并因此是细胞杀灭测定中测试cd19car构建体的理想靶标细胞。使t细胞与nalm6细胞在效应细胞与靶标细胞(e:t)比率5:1下在10μm伐地那非或dmso存在下混合12小时。靶标细胞凋亡通过使用incucyte仪器来随时间测量膜联蛋白v荧光加以测定。将细胞杀灭测量为总体经杀灭靶标面积与nalm6-katushka面积(μm2)的比率。如图19j中所示,当使nalm6细胞与ot-cd19-131表达性t细胞在伐地那非存在下共培养时,总体经杀灭的靶标细胞面积增加。在nalm6细胞的增殖方面观察到类似趋势(图19k)。相同细胞在dmso存在下不导致显著细胞杀灭,从而显示由t细胞达成的靶标细胞杀灭特异性响应于配体的存在。如所预期,组成型构建体ot-cd19-063在存在以及不存在配体下均显示总体经杀灭靶标细胞面积增加,其中在配体存在下具有朝向更大程度杀灭的趋势。与未转导t细胞共培养的nalm6细胞和未与t细胞共培养的nalm6细胞不显示总体经杀灭靶标面积增加。总之,这些数据显示受调控的car构建体ot-cd19-131仅响应于配体来对抗原阳性细胞具有活性。也在66小时时从t细胞/nalm6细胞毒性共培养测定收集细胞上清液,并且通过msd测定来测量干扰素γ水平。结果显示于表45g中。表45g:干扰素γ产生(pg/ml)构建体dmso伐地那非10μmot-cd19-131443.992282.98ot-cd19-0633268.721980.48未转导16.5718.48如表45g中所示,在添加伐地那非下,在经ot-cd19-131转导的t细胞中,干扰素γ水平显示五倍诱导。伐地那非处理不诱导经ot-cd19-063转导的t细胞或未转导的t细胞中的干扰素γ产生,从而指示对干扰素γ的配体特异性诱导与在类似条件下观察到的增加的car表达和细胞杀灭相关联。在经dmso处理的ot-cd19-131的情况下,干扰素γ水平低于以组成型构建体观察到的水平,从而指示ot-cd19-131细胞具有cd19car的低基础表达。实施例26.体内评估受hpde5调控的cd19car为测试受配体调控的car在肿瘤排斥模型中的功效,将500万个car阳性t细胞(总计2500万个t细胞)注射于携带nalm6肿瘤的雌性nsg小鼠中。nalm6-luc是一种用于产生静脉内散播肿瘤模型以研究血液肿瘤的b细胞前体白血病细胞系。用媒介物或他达那非在以下mg/kg体重或mpk下每日治疗小鼠:10mpk、30mpk或100mpk。经组成型ot-cd19-063转导的t细胞充当阳性对照,并且未转导的t细胞充当阴性对照。在植入nalm6细胞之后7天注射t细胞。他达那非组中的动物在注射t细胞之前接受2剂配体。研究的目的在于测试对hpde5ddcd19car-t的配体剂量响应调控以及它对功效的影响。此外,研究也用于阐明抗原的存在性是否为达成car的检测和表达所必需。剂量组包括(a)未转导的t细胞,(b)未转导的经媒介物处理的细胞,(c)用100mg/kg他达那非给药的未转导细胞,(d)500万个cd19+ot-cd19-063cart细胞,(e)500万个cd19阳性nalm6细胞的ot-cd19-063cart细胞(媒介物),(f)500万个cd19阳性nalm6细胞与ot-cd19-063cart细胞(100mg他达那非),(g)500万个cd19阳性nalm6细胞与ot-cd19-131cart细胞(媒介物),(h)500万个cd19阳性nalm6细胞与ot-cd19-131(10mg/kg他达那非),(i)500万个cd19阳性nalm6细胞与ot-cd19-131cart细胞(30mg/kg他达那非),(j)500万个cd19阳性nalm6细胞与ot-cd19-131cart细胞(100mg/kg他达那非)。所有动物都一天一次口服给药,持续25天。使用生物发光成像来每两周进行肿瘤负荷评估,并且随时间观察nalm6luc细胞的荧光强度。进行两端收集以评估骨髓、血液和脾细胞群体。肿瘤负荷/流行的降低通过来自nalm6-荧光素酶细胞的发光的降低来测量,并且在经他达那非治疗的cd19-131动物中被观察到(图20a)。在图20a中,“恒定”是指ot-cd19-063,并且“受调控”是指ot-cd19-131。总之,这些数据显示用他达那非进行每日口服给药导致药量依赖性肿瘤生长抑制和/或肿瘤负荷降低。最大肿瘤抑制与组成型car相当,其中在不存在药物下,活性极低。也对在以所指示剂量水平下单次剂量之后,hpde5抑制剂他达那非和伐地那非在非携带肿瘤的小鼠中的血浆pk进行确定,并且显示于图20b和图20c中。权利要求书(按照条约第19条的修改)1.一种用于在细胞或受试者中诱导免疫应答的包含效应物模块的组合物,所述效应物模块包含:(a)刺激物响应元件(sre);和(b)至少一个与所述sre相连、附接或缔合的有效载荷,其中所述sre包含去稳定结构域(dd),所述dd完全地或部分地包含cgmp特异性3',5'-环状磷酸二酯酶(hpde5;seqidno.1)。2.如权利要求1所述的组合物,其中所述有效载荷附接于所述sre。3.如权利要求1所述的组合物,其中所述dd包含hpde5的催化结构域(seqidno.3),所述催化结构域包含hpde5(seqidno.1)的氨基酸535至860。4.如权利要求3所述的组合物,其中所述dd包含在seqidno.1的位置732处的氨基酸(r732)的突变。5.如权利要求4所述的组合物,其中在位置732处的氨基酸(r732)的所述突变选自由以下组成的组:r732l、r732a、r732g、r732v、r732i、r732p、r732f、r732w、r732y、r732h、r732s、r732t、r732d、r732e、r732q、r732n、r732m、r732c和r732k。6.如权利要求4或权利要求5所述的组合物,其中所述dd选自由以下组成的组:hpde5(wt的氨基酸535-860,r732l)(seqidno.12);hpde5(wt的氨基酸535-860,r732a)(seqidno.384);hpde5(wt的氨基酸535-860,r732g)(seqidno.383);hpde5(wt的氨基酸535-860,r732v)(seqidno.385);hpde5(wt的氨基酸535-860,r732i)(seqidno.386);hpde5(wt的氨基酸535-860,r732p)(seqidno.387);hpde5(wt的氨基酸535-860,r732f)(seqidno.388);hpde5(wt的氨基酸535-860,r732w)(seqidno.389);hpde5(wt的氨基酸535-860,r732y)(seqidno.390);hpde5(wt的氨基酸535-860,r732h)(seqidno.391);hpde5(wt的氨基酸535-860,r732s)(seqidno.392);hpde5(wt的氨基酸535-860,r732t)(seqidno.393);hpde5(wt的氨基酸535-860,r732d)(seqidno.394);hpde5(wt的氨基酸535-860,r732e)(seqidno.395);hpde5(wt的氨基酸535-860,r732q)(seqidno.396);hpde5(wt的氨基酸535-860,r732n)(seqidno.397);hpde5(wt的氨基酸535-860,r732m)(seqidno.398);hpde5(wt的氨基酸535-860,r732c)(seqidno.399);以及hpde5(wt的氨基酸535-860,r732k)(seqidno.400)。7.如权利要求4所述的组合物,其中在位置r732处的氨基酸的所述突变是r732l,并且其中所述dd包含seqidno.12的氨基酸序列。8.如权利要求4所述的组合物,其中在位置r732处的氨基酸的所述突变是r732a,并且其中所述dd包含seqidno.384的氨基酸序列。9.如权利要求4所述的组合物,其中在位置r732处的氨基酸的所述突变是r732g,并且其中所述dd包含seqidno.383。10.如权利要求5所述的组合物,其中所述dd进一步包含一个或多个独立地选自由以下组成的组的突变:h653a、f736a、d764a、d764n、y612f、y612w、y612a、w853f、i821a、y829a、f787a、d656l、y728l、m625i、e535d、e536g、q541r、k555r、f559l、f561l、f564l、f564s、k591e、n587s、k604e、k608e、n609h、k630r、k633e、n636s、n661s、y676d、y676n、c677r、h678r、d687a、t712s、d724n、d724g、l738h、n742s、a762s、d764g、d764v、s766f、k795e、l797f、i799t、t802p、s815c、m816a、i824t、c839s、k852e、s560g、v585a、i599v、i648v、s663p、l675p、t711a、f744l、l746s、f755l、l804p、m816t和f840s。11.如权利要求10所述的组合物,其中所述dd包含突变h653a,并且其中所述dd包含seqidno.509的氨基酸序列。12.如权利要求10所述的组合物,其中所述dd包含突变f736a,并且其中所述dd包含seqidno.227的氨基酸序列。13.如权利要求10所述的组合物,其中所述dd包含突变d764a,并且其中所述dd包含seqidno.510的氨基酸序列。14.如权利要求10所述的组合物,其中所述dd包含突变y612f,并且其中所述dd包含seqidno.506的氨基酸序列。15.如权利要求10所述的组合物,其中所述dd包含突变y612w,并且其中所述dd包含seqidno.507的氨基酸序列。16.如权利要求10所述的组合物,其中所述dd包含突变y612a,并且其中所述dd包含seqidno.508的氨基酸序列。17.如权利要求10所述的组合物,其中所述dd包含突变d764n,并且其中所述dd包含seqidno.505的氨基酸序列。18.如权利要求2所述的组合物,其中所述有效载荷是免疫治疗剂。19.如权利要求18所述的组合物,其中所述免疫治疗剂选自嵌合抗原受体(car)和细胞因子-细胞因子受体融合多肽。20.如权利要求19所述的组合物,其中所述免疫治疗剂是嵌合抗原受体,并且所述嵌合抗原受体包含(a)细胞外靶向部分;(b)铰链和跨膜结构域;(c)细胞内信号传导结构域;和(d)任选地,一个或多个共刺激性结构域。21.如权利要求20所述的组合物,其中所述car是标准car、拆分car、关闭开关car、开启开关car、第一代car、第二代car、第三代car或第四代car。22.如权利要求20所述的组合物,其中所述car部分的所述细胞外靶标对癌细胞的表面上的靶标分子具有亲和力或结合至癌细胞的表面上的靶标分子。23.如权利要求22所述的组合物,其中所述car的所述细胞外靶标部分是scfv。24.如权利要求22所述的组合物,其中所述靶标分子是cd19。25.如权利要求23或权利要求24所述的组合物,其中所述car的所述细胞外靶标部分是cd19scfv(seqidno.8233)。26.如权利要求20所述的组合物,其中所述car的所述铰链和跨膜结构域是配对的,并且其中所述配对的铰链和跨膜结构域源于由以下组成的组的任何成员:(a)选自以下的分子:cd8a、cd5、cd4、cd9、cd16、cd22、cd33、cd28、cd37、cd45、cd64、cd80、cd86、cd148、dap10、epori、gitr、lag3、icos、her2、ox40(cd134)、4-1bb(cd137)、cd152、cd154、pd-1或ctla-4;(b)t细胞受体的cd3ε链;(c)t细胞受体的α、β或ζ链的跨膜区域;和(d)选自igg1、igd、igg4和igg4fc区的免疫球蛋白。27.如权利要求26所述的组合物,其中所述car的所述配对的铰链和跨膜结构域源于cd8a,并且所述配对的铰链和跨膜结构域包含seqidno.8235的氨基酸序列。28.如权利要求20所述的组合物,其中(a)所述car的所述细胞内信号传导结构域是源于cd3ζ或选自由以下组成的组的细胞表面分子的信号传导结构域:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d;并且(b)所述共刺激性结构域是存在的,并且源于由以下组成的组:4-1bb(cd137)2b4、hvem、icos、lag3、dap10、dap12、cd27、cd28、ox40(cd134)、cd30、cd40、icos(cd278)、糖皮质素诱导的肿瘤坏死因子受体(gitr)、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c和b7-h3。29.如权利要求28所述的组合物,其中所述car的所述细胞内信号传导结构域源于cd3ζ,并且所述细胞内信号传导结构域包含seqidno.8236的氨基酸序列。30.如权利要求28所述的组合物,其中所述car的所述共刺激性结构域是存在的,所述共刺激性结构域源于4-1bb,其中所述共刺激性结构域包含seqidno.8237的氨基酸序列。31.如权利要求20所述的组合物,其中所述嵌合抗原受体进一步包含信号序列。32.如权利要求31所述的组合物,其中所述信号序列源于cd8α,并且其中所述信号序列包含seqidno.278的氨基酸序列。33.如权利要求19所述的组合物,其中所述免疫治疗剂是细胞因子-细胞因子受体融合多肽。34.如权利要求33所述的组合物,其中所述细胞因子-细胞因子受体融合多肽包含融合于完整或一部分il15ra以产生il15-il15ra融合多肽的完整或一部分il15。35.如权利要求34所述的组合物,其中所述细胞因子-细胞因子受体融合多肽包含融合于seqidno.8329的氨基酸序列以产生融合多肽的seqidno.8324的氨基酸序列。36.如权利要求1-32中任一项所述的组合物,其中所述效应物模块是选自由以下组成的组的dd-cd19car融合多肽:seqidno.8283;seqidno.8271-8282;以及seqidno.8284。37.如权利要求1-19和权利要求33-35所述的组合物,其中所述效应物模块是选自由以下组成的组的dd-il15-il15ra融合多肽:seqidno.8338;seqidno.8334-8337;以及seqidno.8339-8343。38.如权利要求1-37所述的组合物,其中所述sre对一种或多种刺激物起响应。39.如权利要求38所述的组合物,其中所述刺激物是小分子,并且其中所述小分子选自他达那非、伐地那非、西地那非、阿伐那非、罗地那非、米罗那非、乌地那非、本扎那非、达生他非和贝米那非。40.如权利要求39所述的组合物,其中所述小分子是他达那非。41.一种药物组合物,所述药物组合物包含如权利要求1-40中任一项所述的组合物以及药学上可接受的赋形剂。42.一种多核苷酸,所述多核苷酸编码如权利要求1-40所述的组合物中的任一者或如权利要求41所述的药物组合物。43.一种载体,所述载体包含如权利要求42所述的多核苷酸。44.一种用于过继性细胞转移(act)的免疫细胞,所述免疫细胞表达如权利要求1-40中任一项所述的组合物、如权利要求41所述的药物组合物、如权利要求42所述的多核苷酸,和/或用如权利要求43所述的载体转导或转染。45.一种在细胞中诱导免疫应答的方法,所述方法包括:(a)向所述细胞施用治疗有效量的如权利要求41所述的药物组合物中的任一者;以及(b)向所述细胞施用治疗有效量的刺激物以调节所述免疫治疗剂的表达,其中所述刺激物是配体,并且其中所述免疫治疗剂能够响应于所述刺激物而在所述细胞中诱导免疫应答。46.一种降低受试者中的肿瘤负荷的方法,所述方法包括:(a)向所述受试者施用治疗有效量的如权利要求44所述的免疫细胞;以及(b)向所述受试者施用治疗有效量的刺激物,其中所述刺激物是配体,以调节所述免疫治疗剂的表达,由此降低所述肿瘤负荷。47.如权利要求46所述的方法,其中所述配体是他达那非。48.如权利要求47所述的方法,其中他达那非在处于所述受试者的约0.1mg至约100mg/体重kg的范围内的剂量下向所述受试者施用。49.如权利要求48所述的方法,其中所述他达那非在所述受试者的10mg/体重kg的剂量下向所述受试者施用。50.如权利要求48所述的方法,其中所述他达那非在所述受试者的30mg/体重kg的剂量下向所述受试者施用。51.如权利要求48所述的方法,其中所述他达那非在所述受试者的100mg/体重kg的剂量下向所述受试者施用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1