疫苗制剂及其应用的制作方法
本发明涉及疫苗领域,具体涉及一种疫苗制剂及其应用。
背景技术:
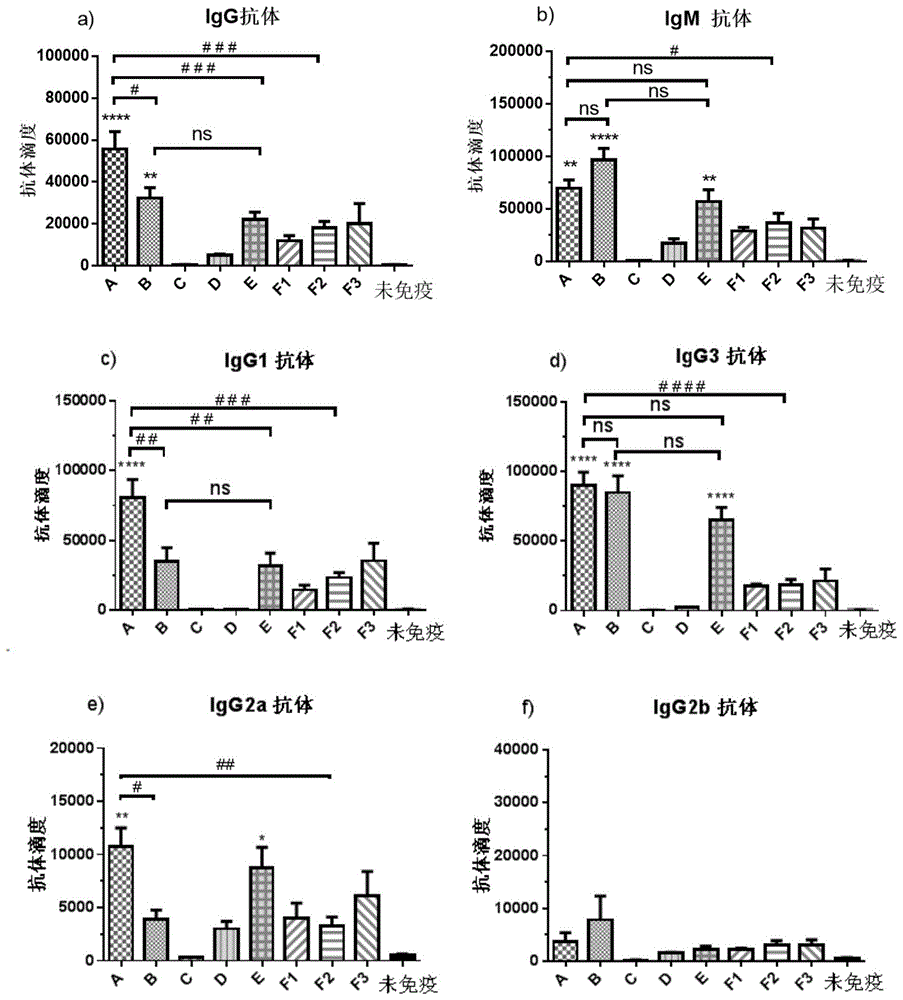
:成瘾药物的滥用严重影响身体健康,同时造成社会财富的巨大损失和浪费。目前,治疗通常采用心理治疗并结合药物的方式,然而这种治疗方法的效果并不令人满意,寻找更有效的方法仍然是现代医学面临的挑战。疫苗可能是一种独特的、具有潜在吸引力的治疗方法,刺激免疫系统并产生相应的特异性抗体。通常由于成瘾物质的分子量太小,不足以刺激免疫系统产生抗体,因此有必要将它们与载体蛋白质连接。半抗原-蛋白复合物(hapten-protein)的半合成疫苗是目前产生igg抗体最常见的方法。将半抗原与含有t细胞表位的蛋白共价连接,可以使半抗原被免疫系统识别,从而产生高亲和力的igg抗体。疫苗产生的抗体可以与抗原结合为抗体-抗原复合物,该复合物分子量大而不能通过血脑屏障,减少大脑对毒品的依赖性从而达到控制毒瘾的目的。其中,蛋白载体包括匙孔血蓝蛋白(klh),牛血清白蛋白(bsa),鸡卵白蛋白(ova),白喉crm197蛋白等。半合成疫苗存在着一些缺点,比如偶联位点不确定、偶联率不稳定以及蛋白本身也会引起一定的免疫反应等。另外,半抗原-蛋白复合物的热稳定性差,带来保存和运输的额外负担。全合成的疫苗分子的研究近年来受到广泛关注。经典的全合成疫苗分子由半抗原,辅助t细胞表位(thepitope)肽和toll样受体(tolllikereceptor,tlr)激动剂等三组分共价偶联组成。据报道,将几种不同th表位构建在同一疫苗分子中,可以提高疫苗分子的免疫性能。另外,主要组织相容性复合体(majorhistocompatibilitycomplex,mhc)具有多形性,不同的个体需要不同的th表位肽和mhc结合,所以普适的疫苗分子需要引入多个th表位肽。随着组分的增加,有机合成的难度也增加,对于工业化生产造成巨大挑战。技术实现要素:本发明的目的是为了克服现有技术存在的成瘾药物疫苗通过半抗原-蛋白复合物的半合成疫苗产生igg抗体,导致偶联位点不确定、偶联率不稳定,且蛋白本身也会引起一定的免疫反应,以及半抗原-蛋白复合物的热稳定性差的问题,提供一种疫苗制剂,其结构简单、免疫性能好(引发高滴度的igg抗体),且热稳定性好,易于保存和运输。为了实现上述目的,本发明一方面提供了一种疫苗制剂,所述制剂包括:组分(a):半抗原,该半抗原为成瘾药物;组分(b):连接单元,该连接单元的一端与所述组分(a)共价连接以形成组分a-b;组分(c):佐剂,该佐剂选自式(1)-式(4)所示的化合物中的至少一种;其中,所述组分(c)与所述组分a-b中的组分(b)的另一端共价连接,以形成a-b-c所示的有效成分;或者所述制剂中还包括组分(d):载体,该载体与所述组分(b)的另一端共价连接以形成组分a-b-d,并且所述组分a-b-d与所述组分(c)混合自组装为a-b-d/c所示的有效成分;在式(1)-(4)中的各个x各自独立地选自-ch3、-nh2、-oh或-sh,各个y各自独立地选自-ch2-、-nh-、-o-或-s-;r选自中的一种;并且,所述连接单元选自式(5)-式(16)所示的结构单元:在式(5)-式(16)中,m1-m5、n1-n7、p1、p2和q1各自独立地为1-60中的任意一个整数,x1-x7、y1-y9各自独立地选自-ch2-、-nh-、-o-或-s-;以及,所述载体选自式(17)-式(20)所示的基团,在式(17)-式(20)中,各个m各自独立地为0-30中的任意一个整数,各个n各自独立地为0-6中的任意一个整数,各个x8各自独立地选自-ch2-、-nh-、-o-或-s-。本发明第二方面提供了一种上述疫苗制剂在制备治疗抗成瘾相关药物中的应用。通过上述技术方案,本发明提供的疫苗制剂能够在简化疫苗分子结构的同时保证产生高滴度、高亲和力的igg抗体;该疫苗分子热稳定性好,更易保存和运输。附图说明图1是疫苗制剂a-e、f1-f3产生的抗尼古丁滴度评价结果,其中a)是igg抗体滴度评价结果,b)是igm抗体滴度评价结果,c)是igg1抗体滴度评价结果,d)是igg3抗体滴度评价结果,e)是igg2a抗体滴度评价结果,f)是igg2b抗体滴度评价结果;图2是实施例7-11中得到的疫苗制剂产生的抗尼古丁滴度评价结果,其中a)是igg抗体滴度评价结果,b)是igm抗体滴度评价结果,c)是疫苗制剂在42d后产生的igg1抗体、igg3抗体、igg2a抗体、igg2b抗体滴度评价结果;图3是疫苗制剂a-e、f1-f3产生的抗体亲和力测定结果;图4是实施例7-11中得到的疫苗制剂产生的抗体亲和力测定结果;图5是疫苗制剂a-e、f1-f3的体内细胞因子测定结果,其中,左图是干扰素-γ(24h)测定结果,右图是白介素-4(2h)测定结果;图6是疫苗制剂a-e、f1-f3的热板测试结果;图7是实施例7-11中得到的疫苗制剂的热板测试结果;图8是注射疫苗制剂a-e、f1-f3后小鼠体温的测试结果;图9是注射实施例7-11中得到的疫苗制剂后小鼠体温的测试结果;图10是注射疫苗制剂a-e、f1-f3后小鼠的体重变化测定结果;图11是注射实施例7-11中得到的疫苗制剂后小鼠的体重变化测定结果。具体实施方式在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。本发明第一方面提供了一种疫苗制剂,所述制剂包括:组分(a):半抗原,该半抗原为成瘾药物;组分(b):连接单元,该连接单元的一端与所述组分(a)共价连接以形成组分a-b;组分(c):佐剂,该佐剂选自式(1)-式(4)所示的化合物中的至少一种;其中,所述组分(c)与所述组分a-b中的组分(b)的另一端共价连接,以形成a-b-c所示的有效成分;或者所述制剂中还包括组分(d):载体,该载体与所述组分(b)的另一端共价连接以形成组分a-b-d,并且所述组分a-b-d与所述组分(c)混合自组装为a-b-d/c所示的有效成分;在式(1)-(4)中的各个x各自独立地选自-ch3、-nh2、-oh或-sh,各个y各自独立地选自-ch2-、-nh-、-o-或-s-;r选自中的一种;并且,所述连接单元选自式(5)-式(16)所示的结构单元:在式(5)-式(16)中,m1-m5、n1-n7、p1、p2和q1各自独立地为1-60中的任意一个整数,x1-x7、y1-y9各自独立地选自-ch2-、-nh-、-o-或-s-;以及,所述载体选自式(17)-式(20)所示的基团,在式(17)-式(20)中,各个m各自独立地为0-30中的任意一个整数,各个各自n独立地为0-6中的任意一个整数,各个x8各自独立地选自-ch2-、-nh-、-o-或-s-。在本发明中,所述有效成分包括两种组成方式:1)所述组分(c)与所述组分a-b中的组分(b)的另一端共价连接,以形成a-b-c所示的有效成分;2)所述组分(d)与所述组分a-b中的组分(b)的另一端共价连接以形成组分a-b-d,并且所述组分a-b-d与所述组分(c)混合自组装为a-b-d/c所示的有效成分。在本发明中,所述混合自组装的方式可以为各种常规方式,例如可以包括:搅拌、涡旋、振荡或反复颠倒等。发明人在研究中发现,通过上述两种组成方式将式(1)-式(4)所示的化合物作为佐剂引入疫苗制剂中,能够在简化疫苗结构的同时保证产生高滴度、高亲和力的igg抗体,并且能够省去半合成疫苗中所用的蛋白复合物,从而增加疫苗的稳定性,易于保存和运输。在本发明中,优选地,所述成瘾药物选自尼古丁、甲基苯丙胺、海洛因、可卡因、芬太尼、鸦片、氯胺酮和咖啡因中的至少一种。进一步优选地,所述尼古丁的结构式选自中的至少一种。优选地,所述甲基苯丙胺的结构式选自中的至少一种。优选地,所述海洛因的结构式选自中的至少一种。优选地,所述可卡因的结构式为优选地,所述芬太尼的结构式为优选地,所述鸦片的结构式选自中的至少一种。优选地,所述氯胺酮的结构式为优选地,所述咖啡因的结构式为根据本发明一种优选的具体实施方式,所述a-b-c所示的有效成分为以下结构:根据本发明另一种优选的具体实施方式,所述a-b-d/c所示的有效成分中,所述组分a-b-d为以下结构:且所述组分(c)选自式(21)-式(25)所示的化合物中的至少一种,根据本发明,在所述a-b-d/c所示的有效成分中,所述组分a-b-d与所述组分(c)的含量摩尔比优选为1:(0.1-10);更优选地,所述组分a-b-d与所述组分(c)的含量摩尔比为1:(0.2-0.8)。在本发明中,优选地,所述疫苗制剂还包括:组分(e):脂质载体,所述脂质载体为胆固醇、1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱和1,2-二油酰基卵磷脂中的一种或多种。优选地,所述脂质载体为摩尔比为(0.1-10):1的胆固醇和1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱的混合物。根据本发明一种优选的具体实施方式,所述制剂含有:所述a-b-c所示的有效成分、胆固醇和1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱,且以摩尔比计,所述a-b-c所示的有效成分:胆固醇:1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱=1:(1-10):(1-10)。根据本发明另一种优选的具体实施方式,所述制剂含有:所述a-b-d/c所示的有效成分、胆固醇和1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱,且以摩尔比计,所述a-b-d/c所示的有效成分:胆固醇:1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱=1:(1-10):(1-10)。本发明提供了一种优选的具体实施方式,所述疫苗制剂包括:a-b-c所示的有效成分、胆固醇和1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱,其中,所述a-b-c所示的有效成分具有以下结构:且以摩尔比计,所述a-b-c所示的有效成分:胆固醇:1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱=1:(1-10):(1-10)。本发明提供了另一种优选的具体实施方式,所述疫苗制剂包括:a-b-d/c所示的有效成分、胆固醇和1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱;其中,所述组分a-b-d为以下结构:所述组分(c)选自式(21)-式(25)所示的化合物中的至少一种,且所述组分a-b-d与所述组分(c)的含量摩尔比为1:(0.2-0.8);以摩尔比计,所述a-b-d/c所示的有效成分:胆固醇:1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱=1:(1-10):(1-10)。本发明提供了一种特别优选的实施方式,所述疫苗制剂包括:a-b-d/c所示的有效成分、胆固醇和1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱;其中,所述组分a-b-d为以下结构:所述组分(c)选自式(21)、式(25)或式(24)所示的化合物,且所述组分a-b-d与所述组分(c)的含量摩尔比为1:(0.2-0.8);以摩尔比计,所述a-b-d/c所示的有效成分:胆固醇:1,2-二硬脂酰基-sn-丙三基-3-磷酸胆碱=1:(1-10):(1-10)。发明人在研究中发现,在该种实施方式下,疫苗制剂具有更好的免疫性能,其igg抗体滴度更高,亲和力更好。本发明第二方面提供了一种本发明所述的疫苗制剂在制备治疗抗成瘾相关药物中的应用。以下将通过实施例对本发明进行详细描述。以下实施例中,所使用的试验方法,如无特殊说明,均为常规方法。下述实例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。疫苗制剂的粒径和zeta电势电位通过malvernzetasizerzen3600analyzer表征(malverninstrumentsltd.,malvern,u.k.)。实施例1用于说明a-b-d/c所示的有效成分中,所述组分a-b-d的制备过程。1)疫苗抗原端的制备化合物7的制备:将化合物6(0.26mmol)溶于干燥的dmf中,并置于冰浴中搅拌10min,氩气保护,向反应液中加入nah(2.6mmol),反应1h后,将干燥dmf溶解的对甲基磺酸叠氮物滴加入反应体系中,室温搅拌过夜,tlc板检测原料6消失,减压除去溶剂,产物通过柱层析提纯,洗脱剂比例ch2cl2/meoh=10:1,旋干溶剂得到淡黄色油状产物7(产率为90%)。核磁数据为:1hnmr(400mhz,cdcl3)δ8.57–8.17(m,2h),7.65(dt,j=7.9,2.0hz,1h),7.17(dd,j=7.9,4.8hz,1h),3.60–3.22(m,10h),3.18–3.08(m,1h),2.81(d,j=8.2hz,1h),2.33–2.20(m,2h),2.05(d,j=5.3hz,4h),1.60(dddd,j=13.1,8.1,5.4,1.9hz,1h);13cnmr(400mhz,cdcl3)δ149.64,148.35,137.67,134.93,123.24,72.90,72.04,70.37,70.26,69.86,55.82,50.50,47.82,40.21,26.82;esi-mscalcd.forc15h23n5o2+[m]+305.19,found305.18.化合物4的制备:将化合物7(0.10mmol)用5mlmeoh溶解,氩气置换完瓶中的空气,加入pd/c(10%,10mg),通入氢气,搅拌反应2-3h,tlc监测原料7反应完通过硅藻土过滤除去pd/c,继续用甲醇冲洗2-3次,合并有机相,真空旋干溶剂得到化合物8,不进行提纯直接进行下一步。将化合物8溶于ch2cl2/meoh(4ml,2:1,v/v),己二酸二硒酯加入反应液中,反应直到tlc监测原料反应完,反应混合液真空中浓缩,通过柱层析提纯,洗脱剂比例为ch2cl2/meoh=10:1,得到化合物4(两步反应产率为70%)。核磁数据为:1hnmr(400mhz,cdcl3)δ8.60(d,j=2.3hz,1h),8.43(dd,j=4.9,1.7hz,1h),7.87(s,1h),7.45(dt,j=7.5,2.3hz,3h),7.33(dd,j=5.3,2.1hz,3h),7.27(dd,j=7.9,4.7hz,1h),3.6-3.35(m,10h),3.33–3.21(m,1h),3.15–3.05(m,1h),2.70(pd,j=6.2,5.6,2.4hz,2h),2.46–2.28(m,2h),2.28–2.10(m,6h),1.78–1.63(m,j=3.6hz,4h),1.56(s,1h);13cnmr(400mhz,cdcl3)δ200.16,172.73,150.72,148.11,137.94,135.75,134.83,129.29,128.84,126.36,123.77,73.76,72.88,70.41,70.25,70.21,55.84,47.37,47.19,40.30,39.36,35.90,26.64,24.89,24.87;esi-mscalcd.forc27h38n3o4se+[m+h]+548.20,found548.16.2)s2β的制备半硒酯化合物2的制备:将n-boc-glycine(2.5mmol)和二苯基二硒醚溶于10mldmf中,在氩气氛围中加入2.5mlpbu3于反应液中,反应通过tlc监测直到原料完全消失停止,水泵旋干溶剂,反应混合物通过柱层析提纯,洗脱剂比例为pe/ch2cl2=1:1,浓缩收集液得到淡黄色固体化合物2(产率为85%)。核磁数据为:1hnmr(400mhz,cdcl3)δ7.49(d,j=6.7hz,2h),7.37(d,j=6.1hz,3h),5.45(s,1h),4.04(d,j=6.0hz,2h),1.53(s,9h);13cnmr(100mhz,cdcl3)δ200.96,155.37,135.77,129.12,128.75,125.16,80.57,53.17,28.43,28.29;esi-mscalcd.forc13h17nnao3se+[m+na]+:338.03,found:337.95.化合物3的制备:将化合物1(0.04mmol)溶于湿润的thf/meoh(10ml,1:9),并在氩气氛围中加入pme3(0.4mmol),室温搅拌直到tlc板监测原料消失。通过水泵旋干溶剂,将残留物在油泵中并将反应瓶置于温度为30℃环境中进一步处理24h除去me3po,化合物s1β不经过提纯直接进行下一步反应。将s1β溶于3mlch2cl2中并加入15μldipea,接着将已溶于ch2cl2的半硒酯2(0.06mmol),室温搅拌2h,减压除去溶剂,混合物通过柱层析提纯,洗脱剂比例为ch2cl2/meoh=20:1,浓缩收集液得到白色固体3(两步产率为96%)。核磁数据为:1hnmr(400mhz,cdcl3)δ7.37–7.23(m,20h),7.04–6.98(m,1h),6.06(d,j=8.7hz,1h),5.59(s,1h),4.78(d,j=11.2hz,1h),4.72–4.64(m,4h),4.60(d,j=11.8hz,1h),4.55(d,j=3.4hz,2h),4.29(d,j=7.7hz,1h),3.88(d,j=3.5hz,1h),3.85–3.74(m,5h),3.70(dd,j=17.0,5.5hz,2h),3.64–3.56(m,2h),3.43(ddd,j=16.0,9.1,3.6hz,2h),3.25(ddd,j=13.1,8.6,3.9hz,1h),2.59(s,1h),1.81(q,j=7.0hz,2h),1.71–1.61(m,2h),1.42(s,9h),1.23(d,j=16.1hz,70h),0.90–0.84(t,6h).13cnmr(100mhz,cdcl3)δ172.90,170.16,155.71,138.22,138.16,137.42,128.33,128.29,128.23,128.18,127.92,127.83,127.70,127.60,127.52,104.36,81.10,80.33,79.61,78.78,75.13,72.90,72.40,72.00,69.03,67.15,50.59,44.12,40.22,36.69,32.04,30.60,29.83,29.49,29.15,28.47,27.78,25.96,25.71,22.84,14.32.esi-mscalcd.forc57h111n3nao11+[m+na]+:1397.00,found:1397.30.化合物s2β的制备:将化合物3(0.039mmol)溶于ch2cl2/meoh(4ml,2:1),并加入pd(oh)2/c(25mg,20%pd负载于碳上),反应液在h2氛围中搅拌直到起始原料消失完。将反应液中的氢气通过氩气置换,然后将反应液通过meoh和ch2cl2预冲洗的硅藻土过滤除去pd(oh)2,收集滤液并浓缩,混合物通过柱层析分离提纯,洗脱剂比例为ch2cl2/meoh=10:1,浓缩收集液得到白色固体s2β(产率为82%)。核磁数据为:1hnmr(400mhz,cdcl3/cd3od1:1)δ4.24(s,1h),4.19(d,j=7.2hz,1h),4.07(d,j=5.6hz,1h),3.77–3.66(m,4h),3.63–3.42(m,7h),2.21(t,j=7.6hz,2h),1.62(m,2h),1.46(s,9h),1.27(s,70h),0.89(t,j=6.6hz,6h).esi-mscalcd.for[m+h]+:1014.82,found:1015.06.3)疫苗抗原端和s2β的共价连接将化合物s2β溶于ch2cl2(4ml)并降温至0℃,加入无水三氟乙酸(0.013mmol),反应液置于0℃中搅拌15min,然后移至室温中搅拌30min。减压除去溶剂得到粗产物s3β。将s3β溶于ch2cl2/meoh(4ml,1:1),然后加入ch2cl2(1ml)溶解的化合物4,并加入50μlet3n,室温搅拌至原料s3β反应完,减压浓缩除去溶剂,混合物通过sephadexlh-20分离,洗脱溶剂为ch2cl2/meoh=1:1,收集纯化部分,冷冻干燥得到白色固体化合物nic-βgalcer(两步产率为53%)。核磁数据为:1hnmr(400mhz,cdcl3/cd3od1:1)δ8.55(dd,j=14.4,3.5hz,1h),7.95(d,j=8.0hz,1h),7.47(dd,j=7.9,4.7hz,1h),4.24(s,1h),4.21(d,j=6.9hz,1h),4.11(dd,j=10.3,4.6hz,1h),3.86(d,j=6.3hz,1h),3.77(d,j=2.9hz,1h),3.64(q,j=7.1hz,4h),3.60–3.45(m,11h),3.38(s,6h),2.44–2.11(m,10h),1.65(s,9h),1.27(s,70h),0.89(t,j=6.7hz,6h).13cnmr(100mhz,cdcl3)δ174.31,174.03,173.95,170.33,148.94,148.35,135.94,123.80,103.29,73.70,72.65,72.41,71.70,71.47,70.63,69.75,69.39,68.97,68.48,56.75,55.16,49.78,48.60,48.38,48.17,47.96,47.74,47.53,47.32,47.11,46.08,42.06,39.23,38.76,38.58,35.75,35.01,34.73,31.39,31.28,29.14,29.05,29.00,28.92,28.81,28.70,28.68,25.48,25.29,24.55,24.38,21.98,16.90,13.07.esi-mscalcd.for[m+h]+:1304.01,found:1304.30.实施例2用于说明a-b-c所示的有效成分的制备过程。化合物s5α的制备:以5为原料制备化合物s5α的过程类似于从1制备3的过程,两步反应得到白色固体s5α(两步产率为82%)。核磁数据为:1hnmr(400mhz,cdcl3)7.42–7.13(m,20h),6.71(d,j=6.0hz,1h),5.76(d,j=8.7hz,1h),5.54(t,j=6.2hz,1h),4.73(d,j=3.8hz,1h),4.67(dt,j=22.3,11.8hz,4h),4.56–4.48(m,2h),4.43(dd,j=28.6,11.5hz,2h),4.21(s,1h),3.87(s,1h),3.79–3.65(m,6h),3.59(q,j=8.7,7.6hz,3h),3.44(s,1h),3.20(dd,j=12.1,6.4hz,1h),2.80(s,1h),1.98–1.78(m,4h),1.65–1.49(m,3h),1.42(t,j=8.8hz,3h),1.36(s,9h),1.18(m,j=7.4hz,64h),0.82(t,j=6.9hz,6h).13cnmr(100mhz,cdcl3)δ173.91,171.15,156.51,138.38,138.30,137.87,137.39,128.38,128.32,128.27,128.13,128.06,127.80,127.76,127.67,127.58,127.52,97.79,79.98,79.67,77.59,75.75,74.24,73.80,71.77,71.25,68.67,66.81,66.55,49.75,43.74,39.77,36.54,31.83,29.65,29.61,29.40,29.28,28.14,25.84,22.60,14.01.esi-mscalcd.forc85h135n3nao11+[m+na]+:1398.00,found:1398.21.化合物s6α的制备:以s5α(0.018mmol)为原料制备s6α的步骤类似于从3制备s2β。混合物通过柱层析分离提纯,洗脱剂为ch2cl2/meoh=10:1,浓缩收集液得到白色固体s6α(产率为82%)。1hnmr(400mhz,cdcl3/cd3od1:1)δ7.51(s,1h),7.43(d,j=8.6hz,1h),6.37(s,1h),4.77(d,j=3.7hz,1h),4.09(s,1h),3.78–3.60(m,7h),3.56–3.42(m,4h),3.27(q,j=1.8hz,1h),2.12(t,j=7.7hz,2h),1.60–1.43(m,4h),1.37(s,9h),1.18(s,68h),0.79(d,j=7.0hz,6h).13cnmr(100mhz,cdcl3/cd3od1:1)δ174.34,171.22,156.48,98.97,79.70,73.78,71.57,69.56,69.19,68.53,68.38,66.46,50.10,48.95,48.74,48.53,48.31,48.10,47.89,47.68,43.29,39.48,36.07,31.81,31.55,29.47,29.36,29.31,29.13,29.04,28.99,27.78,25.57,22.29,13.58.esi-mscalcd.forc57h111n3nao11+[m+na]+:1036.81,found:1037.00.nic-αgalcer的制备:以s6α(0.015mmol)为原料制备nic-αgalcer的步骤类似于从s2β制备nic-βgalcer。混合物通过sephadexlh-20分离,洗脱溶剂为ch2cl2/meoh=1:1,收集纯化部分,冷冻干燥得到白色固体化合物nic-αgalcer(两步产率为61%)。核磁数据为:1hnmr(400mhz,cdcl3/cd3od1:1)δ8.58–8.40(m,2h),7.92(d,j=7.9hz,1h),7.41(dd,j=7.9,4.9hz,1h),4.76(d,j=3.5hz,1h),4.09(d,j=5.2hz,1h),3.77–3.60(m,7h),3.56–3.35(m,13h),3.25(dd,j=12.6,3.8hz,4h),2.39(s,2h),2.21(d,j=6.7hz,3h),2.12(dd,j=9.3,5.8hz,5h),1.55(d,j=7.0hz,9h),1.17(s,70h),0.79(t,j=6.6hz,6h).13cnmr(100mhz,cdcl3/cd3od1:1)δ174.25,174.04,173.90,170.10,149.08,148.88,136.04,123.91,98.95,73.76,71.44,71.25,70.53,69.75,69.41,69.34,69.15,68.91,68.30,68.21,66.21,56.71,55.02,49.91,48.34,48.12,47.91,47.70,47.49,47.27,47.06,41.96,39.33,38.53,38.28,35.72,34.99,34.71,31.63,31.24,29.14,29.05,29.02,28.96,28.79,28.71,28.67,28.64,25.31,25.22,25.06,24.55,24.34,21.95,16.86,13.04.esi-mscalcd.forc73h134n6nao13+[m+na]+:1325.99,found:1326.19.实施例3-6将1,2-二硬酰基-sn-丙三基磷酸胆碱(dspc),胆固醇(cholesterol),疫苗分子和佐剂按照摩尔比5:4:1:0.5溶解于ch2cl2:meoh(v/v,1:1)中,超声20分钟,冻干。按照表1中的组成制备得到疫苗制剂a、f1、f2和f3,其中,αgalcer的结构式为各疫苗制剂的粒径和电势表征结果如表2所示。对比例1-4将1,2-二硬酰基-sn-丙三基磷酸胆碱(dspc),胆固醇(cholesterol),疫苗分子和佐剂按照摩尔比5:4:1:0.5溶解于ch2cl2:meoh(v/v,1:1)中,超声20分钟,冻干。按照表1中的组成制备得到疫苗制剂b、c、d和e,其中c组疫苗第一次免疫采用完全弗氏佐剂,第二次和第三次均采用非完全弗氏佐剂乳化的方式,疫苗制剂的粒径和电势表征结果如表2所示。表1注:摩尔比*为尼古丁抗原、佐剂、dspc和胆固醇的摩尔比。表2实施例7-11将1,2-二硬酰基-sn-丙三基磷酸胆碱(dspc),胆固醇(cholesterol),疫苗分子和佐剂按照摩尔比5:4:1:0.5溶解于ch2cl2:meoh(v/v,1:1)中,超声20分钟,冻干。按照表3中的组成制备得到疫苗制剂。其中,佐剂分别为:表3尼古丁抗原佐剂dspc胆固醇摩尔比*实施例7nic-βgalcer(3.04μg)α-c-galcer(1μg)9.23μg3.61μg10:5:50:40实施例8nic-βgalcer(3.13μg)c34(1μg)9.48μg3.71μg10:5:50:40实施例9nic-βgalcer(3.05μg)α-galcer(1μg)9.23μg3.61μg10:5:50:40实施例10nic-βgalcer(3.38μg)c20:2(1μg)10.27μg4.02μg10:5:50:40实施例11nic-βgalcer(4.17μg)c10:0(1μg)12.63μg4.95μg10:5:50:40注:摩尔比*为尼古丁抗原、佐剂、dspc和胆固醇的摩尔比。测试例1)包被抗原的制备将bsa(10mg)溶于pbs(ph7.5,2ml)缓冲溶液中,化合物4溶于dmf(100l)并缓慢地加入到蛋白溶液中,在摇床中轻微晃动,室温反应24h,加入少量etoac萃取,收集水相并转移至30kda超滤管中分离浓缩,并用去离子水冲洗超滤管然后将浓缩液冻干-20℃保存,将得到的蛋白通过maldi-tof质谱确认,蛋白上连接上的尼古丁抗原分子数为18。2)动物免疫从武汉大学动物实验中心和华中农业大学购买6-8周balb/c雌性小鼠,并在武汉大学人民医院饲养,所有小鼠均按照动物伦理准则操作。每组疫苗分配5只小鼠,小鼠在免疫前取血作为空白对照,在第1天,15天,29天免疫注射实施例和对比例中得到的疫苗制剂,同时在第一天免疫后的2h,24h取血做细胞因子含量检测,14天、28天、42天取血检测抗体滴度。取血的方式通过断尾方式,获得血液静置1h,然后4℃离心获得血清并保存至-80℃。在第56天进行动物行为测试即抗阵痛和体温检测。3)间接法非竞争elisa测定血液中抗体的含量96孔酶标板中包被100μlnic-bsa溶液(1μg/ml,ph=9.0-9.6碳酸盐缓冲液),然后4℃过夜。pbst(pbs含0.05体积%吐温-20)洗板3次,然后用1.5%(w/v)bsa封闭,37℃孵育1h。pbst洗板3次,加入0.1%bsa稀释的血清37℃孵育1h。pbst洗板3次,加入1:5000稀释的辣根过氧化酶标记的羊抗鼠二抗igg、igm、igg1、igg2a、igg2b、igg3,37℃孵育1h。pbst洗板3次,然后加入新配置的tmb显色液,孵育15min,加入2mol/l的h2so4溶液中止,吸光度通过酶标仪在波长450nm测定。疫苗制剂在42d产生的抗尼古丁滴度评价结果如图1所示。其中,测试采用nic-bsa包被板子,血清为第3次免疫后获得。每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复两次,误差棒标识的是平均数标准误差。显著性差异相对于d组:*p<0.05;**p<0.01;***p<0.001;****p<0.0001。疫苗之间相互比较:##p<0.01;#p<0.05;ns,显著性差异不明显。数据分析采用graphpadprism软件(graphpadsoftware,sandiego,ca),并通过单因素方差分析和turkey’sposthoc测试。从图1中可以看出以αgalcer为外加佐剂a组相比于pam3csk4b组和弗氏佐剂c组以及结合αgalcer和pam3csk4e组能引发较高滴度的igg和igm抗体,同时从igg亚型结果可以看出,a组能产生相当比例量的igg1、igg3和igg2a抗体,其中igg1为th2免疫响应,igg3和igg2a为th1免疫响应,表明a组能引发th1/th2混合响应。将抗原与佐剂αgalcer共价连接产生的抗体随着剂量的增加而增加,但是抗体量还是低于外加佐剂的方式。实施例7-11中得到的疫苗制剂产生的抗尼古丁滴度评价结果如图2所示。从图2结果可知,以自组装方式制备的疫苗在14d时可以快速产生igg和igm抗体,并且其抗体滴度可以长期维持在相同的水平,其中a-c-galcer为佐剂的疫苗产生的igg抗体滴度与agalcer为佐剂的疫苗持平。从亚型结果可知,产生的抗体亚型主要为igg1和igg3。以上结果表明,采用本发明提供的疫苗制剂能够产生高滴度抗体。4)间接法竞争elisa测定抗体亲和力抗体亲和力通过竞争elisa测得,步骤基本同非竞争elisa类似。酶标板包被nic-bsa溶液,4℃孵育过夜,然后pbst洗板3次。加入1.5%bsapbs(w/v)溶液封闭,37℃孵育1h。将血清稀释到吸光度为1.0的倍数(步骤参照前面的非竞争elisa),标准品尼古丁酒石酸盐用0.1%bsapbs溶液从100mmol稀释到2nmol,等体积血清稀释液(65l)和尼古丁标准品(65l)加入到非结合的板子37℃孵育1h。封闭好的板子用pbst洗板3次,然后将混合的尼古丁标准品和血清加入到结合板中37℃孵育0.5h。pbst洗板3次,加入羊抗鼠二抗igg,孵育,显色,读数,步骤同非竞争elisa。结合率通过b/b0表示,其中b为含有尼古丁标准品的血清板孔,b0为不含尼古丁标准品的血清板孔。测试结果半抑制浓度如图3和图4所示。其中,抗体亲和力采用竞争性elisa,血清为第3次免疫后获得,每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复两次,误差棒标识的是平均数标准误差。从图3中可以看出外加佐剂αgalcer的a组免疫产生的igg抗体对尼古丁的识别能力高于pam3csk4的b组和结合αgalcer和pam3csk4的e组。虽然共价连接佐剂的f2、f3组产生的抗体滴度不高,但是它们对尼古丁的识别能力与a组相当。从图4结果可知,不同的佐剂以自组装方式产生的igg抗体与尼古丁具有较好的亲和力,其中以c34为佐剂的疫苗产生的igg抗体与尼古丁的ic50最小,表明其产生的抗体亲和力最高。以上结果表明,本发明提供的疫苗制剂亲和力较好。5)体内细胞因子的测定血清中细胞因子的水平通过elisa试剂盒测定(干扰素-γ和白介素-4,biolegend),实验步骤按照试剂盒提供的细胞因子操作流程。96孔酶标板包被上捕捉抗体,并4℃过夜。然后将酶标板用1%bsapbs室温下振荡封闭1h,洗完后稀释好的血清加入板中室温振荡2h,之后加入检测抗体和二抗,tmb显色20-30min,2mol/l硫酸中止显色,在450nm读数。实验结果如图5所示。其中,第一次免疫后2h和24h取的血清分别用于白介素-4和干扰素-γ测定,每个柱状代表5只小鼠的含量平均值,而且每个数值独立重复两次,误差棒标识的是平均数标准误差。显著性差异相对于d组:*p<0.05;**p<0.01;***p<0.001;****p<0.0001。疫苗之间相互比较:##p<0.01;#p<0.05;ns,显著性差异不明显。数据分析采用graphpadprism软件(graphpadsoftware,sandiego,ca),并通过单因素方差分析和turkey’sposthoc测试。从图5中可以看出外加佐剂αgalcer的a组均能分泌th1型的干扰素-γ和th2型的白介素-4,表明th1和th2混合响应,与抗体产生的结果是一致的。虽然结合αgalcer和pam3csk4的e组能分泌干扰素-γ和白介素-4,但是其引发的抗体滴度和半抑制浓度ic50低于a组。共价连接佐剂的疫苗能分泌较高含量的干扰素-γ和白介素-4,其中低剂量的f1组主要分泌干扰素-γ,偏向于τh1响应。以上结果表明本发明提供的疫苗制剂具有较好的免疫活性。6)抗伤害性测定第三次免疫后的2周进行抗伤害测试,具体为先将小鼠置于55℃的热板上记录其爪抬起或者剧烈反应的时间为初始值,然后对小鼠皮下注射0.5mg/kg尼古丁,15min后再置于55℃的热板上记录其反应时间为测试值,其中为了防止小鼠在热板长时间没反应而烫伤设置35s为最大值。抗伤害效应通过%mpe表示,其中%mpe=(测试值-初始值)/(最大值-初始值)。结果如图6和图7所示。其中,每个柱状代表5只小鼠的平均值,误差棒标识的是平均数标准误差。显著性差异相对于未免疫组:*p<0.05;**p<0.01;***p<0.001。数据分析采用graphpadprism软件(graphpadsoftware,sandiego,ca),并通过单因素方差分析和turkey’sposthoc测试。从图6中的热板测试结果可以看出,当给予一定量的尼古丁刺激时,外加佐剂αgalcer的a组抗伤害能力低于其它外加佐剂的疫苗,表明外加佐剂αgalcer的疫苗产生的抗体结合尼古丁的能力要优于其它外加佐剂的疫苗。同时,共价连接αgalcer的疫苗其抗伤害能力随着剂量的增加而降低,这与抗体的亲和力测试结果一致。表明本发明提供的疫苗制剂在行为测试中具有较好的效果。从图7结果可知,以a-c-galcer、c34以及c20:2为佐剂的自组装疫苗在5min、15min抗伤害效果最好,并且在30min时,混合自组装方式的疫苗免疫的小鼠均已恢复到正常状态。7)体温变化测定在接受尼古丁注射后5min,15min,30min测定小鼠体温。结果如图8和图9所示。其中,每个柱状代表5只小鼠的平均值,误差棒标识的是平均数标准误差。显著性差异相对于未免疫组:*p<0.05;**p<0.01;***p<0.001。数据分析采用graphpadprism软件(graphpadsoftware,sandiego,ca),并通过单因素方差分析和turkey’sposthoc测试。从图8中可以看出,外加佐剂αgalcer的a组相对于其它外加佐剂的疫苗在接受尼古丁后体温随时间的变化最小,同时体温恢复的快。共价连接αgalcer的疫苗体温虽然随剂量的增加变化不明显,但其体温的变化与a组相当。表明采用本发明提供的疫苗制剂在行为测试中具有较好的效果。从图9结果可知,混合自组装方式的疫苗产生的抗体可以中和注射小鼠体内的尼古丁,体温相对于未免疫疫苗的恢复快,表明自组装方式的疫苗具有较好的免疫活性。8)体重变化测定观察小鼠在接受疫苗之后体重是否发生变化。如图10和图11所示。从图10中可以看出,采用本发明提供的疫苗制剂随时间在体重上的变化与正常未免疫小鼠的基本相同,表明本发明提供的疫苗制剂相对较安全。从图11结果可知,混合自组装方式的疫苗对小鼠的体重影响小,表明自组装的方式相对安全。以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1