一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法与流程
本发明涉及一种壳聚糖基纳米纤维膜的制备方法。
背景技术:
静电纺丝技术是通过纺丝液与收集板之间电场力的作用制备纳米尺度纤维的一种常用的方法,其主要优势在于操作工艺的简易、成本的低廉和成品纤维应用领域的广泛。利用静电纺丝技术制备的纳米纤维具有极高的比表面积和孔隙率,具有广泛的应用前景和应用价值。而这种高比表面、高孔隙率的特性正是伤口敷料所需要的,满足了其透气以及能够搭载药物的结构。壳聚糖,由甲壳素的部分脱乙酰化得到,具有特殊的理化性质和优异的生物性能,如生物相容性、可生物降解性、无毒性和抑菌活性等。壳聚糖在生物医用领域包括组织工程支架、药物递送以及伤口敷料等方面具有潜在的应用价值。将壳聚糖作为原料制备伤口敷料材料时,除了具有电纺纳米纤维独特的高比表面积、高孔隙率以外,其自身优异的生物性能能够增加伤口敷料对伤口处滋生细菌的抑制,促进伤口的愈合,且对组织细胞没有毒副作用。然而,由于分子链上存在大量的氨基基团,壳聚糖分子本身的可纺性能很差。为了解决这个问题,通常将壳聚糖与其它可纺性能较好的聚合物如聚乙烯醇、聚乳酸等共混,从而提升壳聚糖的可纺性能。聚乙烯醇具有优异的水溶性,并且和壳聚糖分子的相容性很好,所以可以将聚乙烯醇与壳聚糖共混进行纺丝,制备壳聚糖/聚乙烯醇复合电纺纳米纤维。同时,由于聚乙烯醇具有良好的生物相容性和无毒性,以聚乙烯醇为原料制备得到的纳米纤维同样可以广泛应用于医用领域。
常用的应用于医用伤口敷料的壳聚糖基纳米纤维膜通常由壳聚糖和聚乙烯醇两种成分组成。然而壳聚糖基纳米纤维膜的透气性好,成本较低,制备工艺简单,对组织细胞无毒副作用。但由于纳米纤维膜并没有搭载抗菌性药物,其具有的抑制伤口处滋生细菌的活性较弱,且现有医用伤口敷料药物释放持续性差及药物释放率低。
技术实现要素:
本发明要解决现有医用伤口敷料药物释放持续性差及药物释放率低的问题,而提供一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法。
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为2%~5%;所述的冰醋酸的体积与壳聚糖的质量比为(0.5~1)ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h~8h,然后置于水浴锅中,在温度为70℃~90℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%~10%;
③、以速度为0.5g/min~1g/min,将干燥的石墨颗粒及硝酸钠加入到质量百分数为98%的浓硫酸中,然后以速度为0.5g/min~1g/min,加入高锰酸钾,得到混合体系,在温度为12℃~14℃的条件下,搅拌2h~5h,然后升温至30℃~40℃,并在温度为30℃~40℃的条件下,反应25min~35min,得到反应液,以速度为30ml/min~40ml/min,将蒸馏水a加入到反应液中,并保持反应液温度为45℃~55℃,然后将温度升至80℃~90℃,并在温度为80℃~90℃条件下,反应25min~35min,最后加入蒸馏水b和质量百分数为30%的过氧化氢,反应直至颜色由深色变为黄色,得到产物,然后对产物进行洗涤,过滤,直到洗涤液的ph达到6~7,最后将产物进行离心处理,加入蒸馏水c并超声处理,到氧化石墨烯水分散液;
所述的干燥的石墨颗粒与硝酸钠的质量比为1:(0.5~2);所述的干燥的石墨颗粒的质量与质量百分数为98%的浓硫酸的体积比为1g:(10~50)ml;所述的干燥的石墨颗粒与高锰酸钾的质量比为1:(1~5);所述的反应液与蒸馏水a的体积比为1:(1~2);所述的反应液与蒸馏水b的体积比为1:(3~5);所述的反应液与质量百分数为30%的过氧化氢的体积比为1:(3~5);
所述的氧化石墨烯水分散液中氧化石墨烯的质量百分数为1%~2%;
④、将药物加入到蒸馏水中,搅拌均匀,得到药物水分散液;
所述的药物水分散液中药物的质量百分数为1%~10%;
⑤、按重量份数将10份~30份壳聚糖溶液、70份~90份聚乙烯醇溶液、1份~5份氧化石墨烯水分散液及1份~5份药物水分散液混合,搅拌10min~15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv~27kv、针头距收集板的距离为15cm~20cm、针头内径为0.7mm~0.9mm、温度为25℃~35℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h~15h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
本发明的有益效果是:
以具有优异的生物性能的壳聚糖作为原料,利用改性hummers法制备的氧化石墨烯作为高附加值的纳米填料,利用静电纺丝技术制备了搭载抗菌类药物。整个制备工艺流程简易、成本较低、工艺周期短。制备得到的载药纳米纤维膜体外药物释放率高,当负载环丙沙星时,168h药物释放率可达到96.5%,药物的缓释行为得以调节,避免了在缓释开始时的“突然”释放,实现了药物的持续释放。载药纳米纤维膜的抑菌活性强,细胞毒性小,与组织上皮细胞的相容性好。相较于未搭载抗菌类药物的纳米纤维膜,这种载药纳米纤维膜的抑菌活性较强;相较于现在普遍的伤口敷料,这种载药纳米纤维敷料的细胞毒性小,与组织上皮细胞的相容性好。
本发明用于一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法。
附图说明
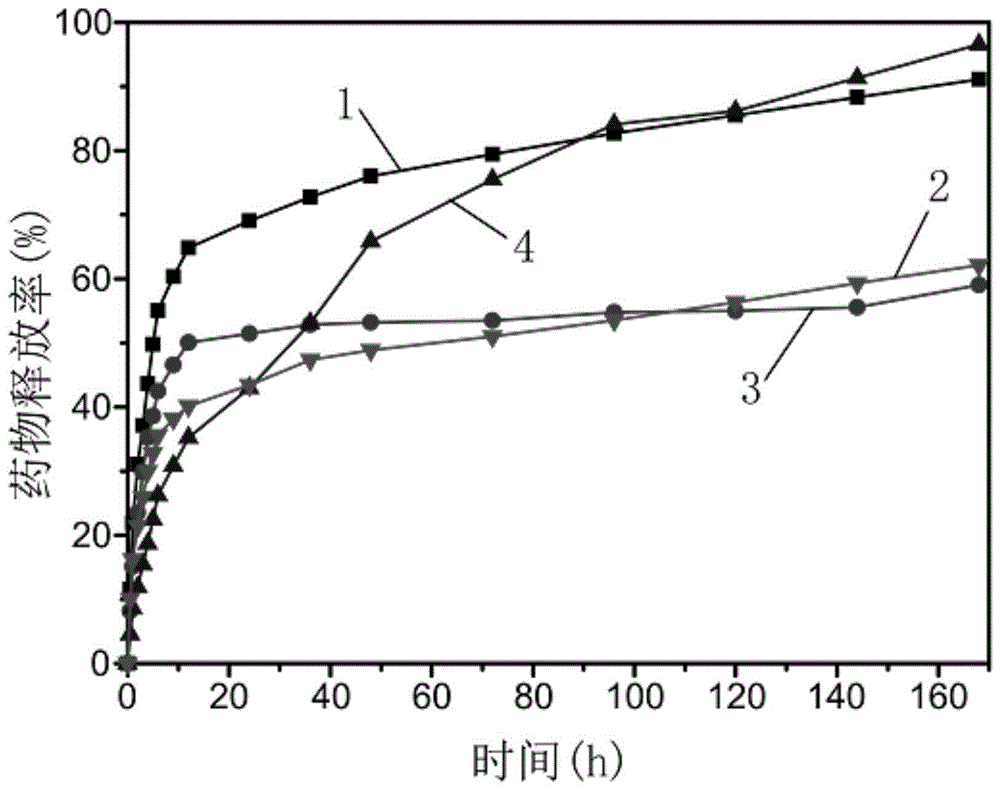
图1为药物缓释曲线,1为对比实验一制备的cs/pva/cip膜,2为实施例二制备的cs/pva/go/ciphcl膜,3为对比实验二制备的cs/pva/ciphcl膜,4为实施例一制备的cs/pva/go/cip膜;
图2为图1的局部放大图,1为对比实验一制备的cs/pva/cip膜,2为实施例二制备的cs/pva/go/ciphcl膜,3为对比实验二制备的cs/pva/ciphcl膜,4为实施例一制备的cs/pva/go/cip膜;
图3为大肠杆菌的抑菌活性测试实物图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜;
图4为金黄色葡萄球菌的抑菌活性测试实物图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜;
图5为枯草芽孢杆菌的抑菌活性测试实物图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜。
图6为抑菌活性测试柱状图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜;
图7为载药纳米纤维的细胞毒性测试图,g为空白对照组,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜,1为培养24h,2为培养48h,3为培养72h。
具体实施方式
具体实施方式一:本实施方式一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为2%~5%;所述的冰醋酸的体积与壳聚糖的质量比为(0.5~1)ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h~8h,然后置于水浴锅中,在温度为70℃~90℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%~10%;
③、以速度为0.5g/min~1g/min,将干燥的石墨颗粒及硝酸钠加入到质量百分数为98%的浓硫酸中,然后以速度为0.5g/min~1g/min,加入高锰酸钾,得到混合体系,在温度为12℃~14℃的条件下,搅拌2h~5h,然后升温至30℃~40℃,并在温度为30℃~40℃的条件下,反应25min~35min,得到反应液,以速度为30ml/min~40ml/min,将蒸馏水a加入到反应液中,并保持反应液温度为45℃~55℃,然后将温度升至80℃~90℃,并在温度为80℃~90℃条件下,反应25min~35min,最后加入蒸馏水b和质量百分数为30%的过氧化氢,反应直至颜色由深色变为黄色,得到产物,然后对产物进行洗涤,过滤,直到洗涤液的ph达到6~7,最后将产物进行离心处理,加入蒸馏水c并超声处理,到氧化石墨烯水分散液;
所述的干燥的石墨颗粒与硝酸钠的质量比为1:(0.5~2);所述的干燥的石墨颗粒的质量与质量百分数为98%的浓硫酸的体积比为1g:(10~50)ml;所述的干燥的石墨颗粒与高锰酸钾的质量比为1:(1~5);所述的反应液与蒸馏水a的体积比为1:(1~2);所述的反应液与蒸馏水b的体积比为1:(3~5);所述的反应液与质量百分数为30%的过氧化氢的体积比为1:(3~5);
所述的氧化石墨烯水分散液中氧化石墨烯的质量百分数为1%~2%;
④、将药物加入到蒸馏水中,搅拌均匀,得到药物水分散液;
所述的药物水分散液中药物的质量百分数为1%~10%;
⑤、按重量份数将10份~30份壳聚糖溶液、70份~90份聚乙烯醇溶液、1份~5份氧化石墨烯水分散液及1份~5份药物水分散液混合,搅拌10min~15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv~27kv、针头距收集板的距离为15cm~20cm、针头内径为0.7mm~0.9mm、温度为25℃~35℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h~15h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
本实施方式的有益效果是:以具有优异的生物性能的壳聚糖作为原料,利用改性hummers法制备的氧化石墨烯作为高附加值的纳米填料,利用静电纺丝技术制备了搭载抗菌类药物。整个制备工艺流程简易、成本较低、工艺周期短。制备得到的载药纳米纤维膜体外药物释放率高,当负载环丙沙星时,168h药物释放率可达到96.5%,药物的缓释行为得以调节,避免了在缓释开始时的“突然”释放,实现了药物的持续释放。载药纳米纤维膜的抑菌活性强,细胞毒性小,与组织上皮细胞的相容性好。相较于未搭载抗菌类药物的纳米纤维膜,这种载药纳米纤维膜的抑菌活性较强;相较于现在普遍的伤口敷料,这种载药纳米纤维敷料的细胞毒性小,与组织上皮细胞的相容性好。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一①中所述的壳聚糖的脱乙酰度为90%~91%。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二不同的是:步骤一④中所述的药物为环丙沙星或环丙沙星盐酸盐。其它与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤一①中所述的壳聚糖溶液中壳聚糖的质量百分数为3%~5%;步骤一①中所述的冰醋酸的体积与壳聚糖的质量比为(0.8~1)ml:1g。其它与具体实施方式一至三相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤一②中将聚乙烯醇加入到蒸馏水中,浸泡4h~6h,然后置于水浴锅中,在温度为80℃~90℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液。其它与具体实施方式一至四相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤一②中所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%~8%。其它与具体实施方式一至五相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤一④中所述的药物水分散液中药物的质量百分数为5%~10%。其它与具体实施方式一至六相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤一⑤中按重量份数将20份~30份壳聚糖溶液、70份~80份聚乙烯醇溶液、3份~5份氧化石墨烯水分散液及2份~5份药物水分散液混合,搅拌12min~15min,得到纺丝前驱液。其它与具体实施方式一至七相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:步骤二中对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv~25kv、针头距收集板的距离为15cm~18cm、针头内径为0.8mm~0.9mm、温度为25℃~30℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h~13h。其它与具体实施方式一至八相同。
具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:步骤二中对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为25kv~27kv、针头距收集板的距离为18cm~20cm、针头内径为0.7mm~0.8mm、温度为30℃~35℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝13h~15h。其它与具体实施方式一至九相同。
采用以下实施例验证本发明的有益效果:
实施例一:
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为5%;所述的冰醋酸的体积与壳聚糖的质量比为1ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h,然后置于水浴锅中,在温度为80℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%;
③、以速度为1g/min,将干燥的石墨颗粒及硝酸钠加入到质量百分数为98%的浓硫酸中,然后以速度为1g/min,加入高锰酸钾,得到混合体系,在温度为13℃的条件下,搅拌4h,然后升温至35℃,并在温度为35℃的条件下,反应30min,得到反应液,以速度为30ml/min,将蒸馏水a加入到反应液中,并保持反应液温度为50℃,然后将温度升至90℃,并在温度为90℃的条件下,反应30min,最后加入蒸馏水b和质量百分数为30%的过氧化氢,反应直至颜色由深色变为黄色,得到产物,然后对产物进行洗涤,过滤,直到洗涤液的ph达到6~7,最后将产物进行离心处理,加入蒸馏水c并超声处理,到氧化石墨烯水分散液;
所述的干燥的石墨颗粒与硝酸钠的质量比为1:1;所述的干燥的石墨颗粒的质量与质量百分数为98%的浓硫酸的体积比为1g:30ml;所述的干燥的石墨颗粒与高锰酸钾的质量比为1:3;所述的反应液与蒸馏水a的体积比为1:1;所述的反应液与蒸馏水b的体积比为1:4;所述的反应液与质量百分数为30%的过氧化氢的体积比为1:4;
所述的氧化石墨烯水分散液中氧化石墨烯的质量百分数为1%;
④、将环丙沙星加入到蒸馏水中,搅拌均匀,得到环丙沙星水分散液;
所述的环丙沙星水分散液中环丙沙星的质量百分数为5%;
⑤、按重量份数将30份壳聚糖溶液、70份聚乙烯醇溶液、3份氧化石墨烯水分散液及5份环丙沙星水分散液混合,搅拌15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv、针头距收集板的距离为15cm、针头内径为0.9mm、温度为25℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
步骤一①中所述的壳聚糖的脱乙酰度为90%~91%;
步骤一②中所述的聚乙烯醇的级别为分析纯,型号为1788;
步骤一③中所用的环丙沙星为原药,纯度为95%。
实施例二:
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为5%;所述的冰醋酸的体积与壳聚糖的质量比为1ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h,然后置于水浴锅中,在温度为80℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%;
③、以速度为1g/min,将干燥的石墨颗粒及硝酸钠加入到质量百分数为98%的浓硫酸中,然后以速度为1g/min,加入高锰酸钾,得到混合体系,在温度为13℃的条件下,搅拌4h,然后升温至35℃,并在温度为35℃的条件下,反应30min,得到反应液,以速度为30ml/min,将蒸馏水a加入到反应液中,并保持反应液温度为50℃,然后将温度升至90℃,并在温度为90℃的条件下,反应30min,最后加入蒸馏水b和质量百分数为30%的过氧化氢,反应直至颜色由深色变为黄色,得到产物,然后对产物进行洗涤,过滤,直到洗涤液的ph达到6~7,最后将产物进行离心处理,加入蒸馏水c并超声处理,到氧化石墨烯水分散液;
所述的干燥的石墨颗粒与硝酸钠的质量比为1:1;所述的干燥的石墨颗粒的质量与质量百分数为98%的浓硫酸的体积比为1g:30ml;所述的干燥的石墨颗粒与高锰酸钾的质量比为1:3;所述的反应液与蒸馏水a的体积比为1:1;所述的反应液与蒸馏水b的体积比为1:4;所述的反应液与质量百分数为30%的过氧化氢的体积比为1:4;
所述的氧化石墨烯水分散液中氧化石墨烯的质量百分数为1%;
④、将环丙沙星盐酸盐加入到蒸馏水中,搅拌均匀,得到环丙沙星盐酸盐水分散液;
所述的环丙沙星盐酸盐水分散液中环丙沙星盐酸盐的质量百分数为5%;
⑤、按重量份数将30份壳聚糖溶液、70份聚乙烯醇溶液、3份氧化石墨烯水分散液及5份环丙沙星盐酸盐水溶液混合,搅拌15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv、针头距收集板的距离为15cm、针头内径为0.9mm、温度为25℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
步骤一①中所述的壳聚糖的脱乙酰度为90%~91%;
步骤一②中所述的聚乙烯醇的级别为分析纯,型号为1788;
步骤一③中所用的环丙沙星盐酸盐为原药,纯度为95%。
对比实验一:
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖粉末加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为5%;所述的冰醋酸与壳聚糖的质量比为1ml:1g;
②、将聚乙烯醇粉末加入到蒸馏水中,浸泡4h,然后置于水浴锅中,在温度为80℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%;
③、将环丙沙星加入到蒸馏水中,搅拌均匀,得到环丙沙星水分散液;
所述的环丙沙星水分散液中环丙沙星的质量百分数为5%;
④、按重量份数将30份壳聚糖溶液、70份聚乙烯醇溶液及5份环丙沙星水分散液混合,搅拌15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv、针头距收集板的距离为15cm、针头内径为0.9mm、温度为25℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
步骤一①中所述的壳聚糖的脱乙酰度为90%~91%;
步骤一②中所述的聚乙烯醇的级别为分析纯,型号为1788;
步骤一③中所用的环丙沙星为原药,纯度为95%。
对比实验二:
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为5%;所述的冰醋酸的体积与壳聚糖的质量比为1ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h,然后置于水浴锅中,在温度为80℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%;
③、将环丙沙星盐酸盐加入到蒸馏水中,搅拌均匀,得到环丙沙星盐酸盐水溶液;
所述的环丙沙星盐酸盐水溶液中环丙沙星盐酸盐的质量百分数为5%;
④、按重量份数将30份壳聚糖溶液、70份聚乙烯醇溶液及5份环丙沙星盐酸盐水溶液混合,搅拌15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv、针头距收集板的距离为15cm、针头内径为0.9mm、温度为25℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
步骤一①中所述的壳聚糖的脱乙酰度为90%~91%;
步骤一②中所述的聚乙烯醇的级别为分析纯,型号为1788;
步骤一③中所用的环丙沙星盐酸盐为原药,纯度为95%。
对比实验三:
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,其特征在于它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为5%;所述的冰醋酸的体积与壳聚糖的质量比为1ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h,然后置于水浴锅中,在温度为80℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%;
③、以速度为1g/min,将干燥的石墨颗粒及硝酸钠加入到质量百分数为98%的浓硫酸中,然后以速度为1g/min,加入高锰酸钾,得到混合体系,在温度为13℃的条件下,搅拌4h,然后升温至35℃,并在温度为35℃的条件下,反应30min,得到反应液,以速度为30ml/min,将蒸馏水a加入到反应液中,并保持反应液温度为50℃,然后将温度升至90℃,并在温度为90℃的条件下,反应30min,最后加入蒸馏水b和质量百分数为30%的过氧化氢,反应直至颜色由深色变为黄色,得到产物,然后对产物进行洗涤,过滤,直到洗涤液的ph达到6~7,最后将产物进行离心处理,加入蒸馏水c并超声处理,到氧化石墨烯水分散液;
所述的干燥的石墨颗粒与硝酸钠的质量比为1:1;所述的干燥的石墨颗粒的质量与质量百分数为98%的浓硫酸的体积比为1g:30ml;所述的干燥的石墨颗粒与高锰酸钾的质量比为1:3;所述的反应液与蒸馏水a的体积比为1:1;所述的反应液与蒸馏水b的体积比为1:4;所述的反应液与质量百分数为30%的过氧化氢的体积比为1:4;
所述的氧化石墨烯水分散液中氧化石墨烯的质量百分数为1%;
④、按重量份数将30份壳聚糖溶液、70份聚乙烯醇溶液及3份氧化石墨烯水分散液混合,搅拌15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv、针头距收集板的距离为15cm、针头内径为0.9mm、温度为25℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
步骤一①中所述的壳聚糖的脱乙酰度为90%~91%;
步骤一②中所述的聚乙烯醇的级别为分析纯,型号为1788。
对比实验四:
一种可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜的制备方法,其特征在于它是按以下步骤进行的:
一、配制纺丝前驱液:
①、将壳聚糖加入到蒸馏水中,然后加入冰醋酸,搅拌均匀,得到壳聚糖溶液;
所述的壳聚糖溶液中壳聚糖的质量百分数为5%;所述的冰醋酸的体积与壳聚糖的质量比为1ml:1g;
②、将聚乙烯醇加入到蒸馏水中,浸泡4h,然后置于水浴锅中,在温度为80℃的条件下,恒温搅拌直至聚乙烯醇完全溶解,静置冷却,得到聚乙烯醇溶液;
所述的聚乙烯醇溶液中聚乙烯醇的质量百分数为5%;
③、按重量份数将30份壳聚糖溶液及70份聚乙烯醇溶液混合,搅拌15min,得到纺丝前驱液;
二、制备载药纳米纤维膜:
对注射器的针头进行磨平处理,然后将纺丝前驱液加入到磨平针头的注射器中,在高压电源电压为23kv、针头距收集板的距离为15cm、针头内径为0.9mm、温度为25℃及相对湿度小于45%的条件下,利用静电纺丝设备进行纺丝,纺丝12h,得到可应用于医用伤口敷料的壳聚糖基载药纳米纤维膜。
步骤一①中所述的壳聚糖的脱乙酰度为90%~91%;
步骤一②中所述的聚乙烯醇的级别为分析纯,型号为1788。
验证实验:
a、将实施例一及二、对比实验一至四制备的8mg载药纳米纤维膜进行剪碎,置于pbs缓冲液中,在温度为37℃的条件下,恒温震荡168h,利用紫外分光光度计衡量载药纳米纤维膜的药物缓释行为。
b、将实施例一及二、对比实验一至四制备的载药纳米纤维膜剪成1cm2×1cm2的矩形,分别置于预先分别培养了大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的lb培养基中,在混合气氛、温度为37℃及湿度为45%的潮湿环境中培养12h,培养之后,利用抑菌圈法对载药纳米纤维膜的抑菌效应进行表征验证;所述的混合气氛为co2与空气的混合气体,且co2与空气的体积比为5:95。
c、将实施例一及二、对比实验一至四制备的8mg载药纳米纤维膜剪碎,置于血清培养基中,然后将培养过的黑色素瘤细胞加入到培养基中,在混合气氛、温度为37℃及湿度为45%的潮湿环境中培养24h、48h和72h,对细胞的存活率进行测定;所述的混合气氛为co2与空气的混合气体,且co2与空气的体积比为5:95;
所述的培养过的黑色素瘤细胞是在混合气氛及温度为37℃的潮湿环境中培养24h;所述的混合气氛为co2与空气的混合气体,且co2与空气的体积比为5:95。
实施例一制备的产物简写为cs/pva/go/cip膜,实施例二制备的产物简写为cs/pva/go/ciphcl膜,对比实验一制备的产物简写为cs/pva/cip膜,对比实验二制备的产物简写为cs/pva/ciphcl膜,对比实验三制备的产物简写为cs/pva/go膜,对比实验四制备的产物简写为cs/pva膜。
图1为药物缓释曲线,1为对比实验一制备的cs/pva/cip膜,2为实施例二制备的cs/pva/go/ciphcl膜,3为对比实验二制备的cs/pva/ciphcl膜,4为实施例一制备的cs/pva/go/cip膜。图2为图1的局部放大图,1为对比实验一制备的cs/pva/cip膜,2为实施例二制备的cs/pva/go/ciphcl膜,3为对比实验二制备的cs/pva/ciphcl膜,4为实施例一制备的cs/pva/go/cip膜。由图可得在168h的药物释放测试以后,实施例一制备得到的载药纳米纤维膜的药物释放率为96.5%,对比试验一制备得到的载药纳米纤维膜的药物释放率为91.1%,实施例二制备得到的载药纳米纤维膜的药物释放率为62.1%,对比实验二制备得到的载药纳米纤维膜的药物释放率为59.0%。另外,加入氧化石墨烯之后,载药纳米纤维膜的缓释曲线发生了改变,起始时的突然释放被延缓,氧化石墨烯的加入对载药纳米纤维的体外药物缓释行为起到了调节作用,实现了药物的可持续释放。相较于搭载环丙沙星盐酸盐的纳米纤维膜,搭载环丙沙星的纳米纤维膜的药物释放率高。
图3为大肠杆菌的抑菌活性测试实物图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜;图4为金黄色葡萄球菌的抑菌活性测试实物图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜;图5为枯草芽孢杆菌的抑菌活性测试实物图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜。
图6为抑菌活性测试柱状图,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜;
由图可得,实施例一和对比实验一制备得到的载药纳米纤维膜对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌活性较强,实施例一和对比实验一大肠杆菌抑菌圈半径分别为19.5cm,19.9cm;实施例一和对比实验一金黄色葡萄球菌抑菌圈半径分别为15.3cm,16.2cm;实施例一和对比实验一枯草芽孢杆菌抑菌圈半径分别为18.7cm,19.2cm;
实施例二及对比实验二制备得到的载药纳米纤维膜的抑菌活性次之,实施例二及对比实验二大肠杆菌抑菌圈半径分别为6.86cm,4.5cm;实施例二及对比实验二金黄色葡萄球菌抑菌圈半径分别为2.56cm,3.2cm;实施例二及对比实验二枯草芽孢杆菌抑菌圈半径分别为11.7cm,6.99cm;
对比实验三及四制备得到的纳米纤维膜由于没有搭载抑菌性药物,抑菌活性较差,对比实验三及四大肠杆菌抑菌圈半径分别为0.42cm,9.77cm;对比实验三及四金黄色葡萄球菌抑菌圈半径分别为0.27cm,2.21cm;对比实验三及四枯草芽孢杆菌抑菌圈半径分别为0.44cm,6.48cm。相较于未搭载抗菌类药物的纳米纤维膜,载药纳米纤维的抑菌活性较强。
图7为载药纳米纤维的细胞毒性测试图,g为空白对照组,a为对比实验四制备的cs/pva膜,b为对比实验三制备的cs/pva/go膜,c为对比实验二制备的cs/pva/ciphcl膜,d为实施例二制备的cs/pva/go/ciphcl膜,e为对比实验一制备的cs/pva/cip膜,f为实施例一制备的cs/pva/go/cip膜,1为培养24h,2为培养48h,3为培养72h。由图可得通过实施例一及二、对比实验一至五制备得到的载药纳米纤维对黑色素瘤细胞基本没有细胞毒性。培养48h,黑色素瘤细胞的细胞存活率都在125%以上,最高达到了132%。培养72h,细胞存活率全部达到120%以上。相较于现在普遍的伤口敷料,这种载药纳米纤维敷料的细胞毒性小,与组织上皮细胞的相容性好。
通过以上研究可以证明这种抑菌性的载药纳米纤维膜可以应用于医用的伤口敷料领域。
- 还没有人留言评论。精彩留言会获得点赞!