副干酪乳杆菌L9用于预防或治疗口腔疾病以及调节口腔菌群的用途的制作方法
本发明属于口腔疾病的预防、治疗领域,特别涉及副干酪乳杆菌l9用于预防或治疗口腔疾病以及调节口腔菌群的用途。
背景技术:
随着我国居民生活质量的提高,口腔健康已经成为一个备受关注的公共健康问题。长期以来,一些口腔常见疾病,如龋病、牙周病及粘膜病等发病率逐年上升。口腔疾病不仅影响着人们的口腔健康,也会引发一些全身性疾病,而口腔致病菌是引起这些疾病的关键性因素,因此,对口腔中致病菌的控制和预防黏附是对预防口腔及其他系统疾病具有至关重要的意义。
已有大量临床研究证明,益生菌在预防或降低口腔疾病方面起着举足轻重的作用。其中,鼠李糖乳杆菌lgg不仅在体外能够抑制口腔致病菌的生长,同时还能够定殖在口腔中,降低变异链球菌的含量从而降低儿童口腔龋病的发病率;有研究表明,通过使用益生菌咀嚼片作为学龄前儿童每日使用含氟牙膏的辅助剂,可以减少幼儿龋齿的发展。本研究所用到的菌株副干酪乳杆菌l9,是一株从长寿老人粪便中分离得到的益生菌株,已有实验证明该菌株具有较高的安全性,目前还未应用于口腔的研究。
技术实现要素:
本发明的目的是研究副干酪乳杆菌l9在口腔致病菌的抑制黏附作用,并监控副干酪乳杆菌l9对口腔菌群的调节作用,从而为预防和控制口腔疾病提供有效措施和理论依据。
本发明的目的是通过以下技术方案实现的:
副干酪乳杆菌l9用于制备预防或治疗口腔疾病制品的用途,其特征在于,所述副干酪乳杆菌l9保藏编号为cgmccno.9800。
进一步的,所述副干酪乳杆菌l9通过抑制变异链球菌和戈式链球菌的黏附以及抑制牙菌斑生物膜的发展过程中的蔗糖依赖性黏附来预防或治疗口腔疾病。
进一步的,所述口腔疾病包括龋齿、口臭和牙周病。
进一步的,所述副干酪乳杆菌l9为具有活性的菌株或去活性的菌株,及菌体培养物或它们的提取物。
进一步的,所述制品包括药物组合物、食品、口腔清洁制品。所述食品包含但不限于乳制饮品、茶、咖啡、口含片、软糖;所述乳制饮品包含发酵乳、酸奶、干酪和乳粉。口腔清洁制品包含但不限于牙膏、漱口水、口气清新喷雾、涂氟剂、洁牙粉。
进一步的,所述药物组合物中副干酪乳杆菌l9的菌体或菌体培养物或它们的提取物的含量为15wt%-20wt%。
进一步的,所述食品和口腔清洁制品中副干酪乳杆菌l9的菌体或菌体培养物或它们的提取物的含量为5wt%-10wt%。
本发明的另一方面:
副干酪乳杆菌l9用于调节口腔菌群的用途,所述副干酪乳杆菌l9保藏编号为cgmccno.9800。
进一步的,副干酪乳杆菌l9通过下调放线菌门、唾液链球菌科、放线菌科、消化链球菌科、纤毛菌科、梭杆菌科及黄杆菌科,调节口腔菌群从而达到预防或治疗口腔疾病的目的。
进一步的,所述放线菌门包含克雷伯菌属、气球菌属、gemella、棒状杆菌和铜绿假单胞菌。
生物保藏:
本发明的副干酪乳杆菌l9(lactobacillusparacasei),于2014年10月22日被保藏在中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101)(保藏单位的缩写为cgmcc),保藏编号为cgmccno.9800。
本发明相比现有技术的有益效果为:
1、本发明首次对所述的副干酪乳杆菌l9进行口腔相关的研究,通过在体外构建口腔模型,建立了基于rt-pcr技术的致病菌的定量检测方法,并且证明副干酪乳杆菌l9显著抑制了戈氏链球菌和变异链球菌在羟磷灰石上的黏附,在培养2、6、18h后,戈氏链球菌和变异链球菌的黏附量均显著降低,同时副干酪乳杆菌l9显著减少了变异链球菌在羟磷灰石上形成的生物膜的厚度和密度;
2、本发明利用变异链球菌诱导小鼠龋齿模型,进一步探究副干酪乳杆菌l9对小鼠口腔龋齿的预防和对口腔菌群的调节作用,研究结果显示:与模型组相比,l9组显著缓解咬合面e级龋齿的发生程度;通过多种致龋因子的rt-pcr的分析,表明l9的预防龋齿功能与其抑制变异链球菌的初始黏附和牙菌斑生物膜的发展过程中的蔗糖依赖性黏附有关;口腔菌群的16srdna高通量测序结果表明,模型组口腔菌群多样性指数无显著差异,但菌群结构变化显著,尤其是放线菌门显著上调,而l9组的放线菌门明显下调,且在属分类水平上的克雷伯菌属、气球菌属、gemella、棒状杆菌和铜绿假单胞菌显著下调,降低了口腔疾病的风险;
3、通过高通量测序的方法检测l9对正常人群唾液和牙菌斑菌群的影响,并同时检测唾液ph和口腔中vsc含量的变化情况。研究结果显示,两周食用l9益生菌含片后,唾液物种丰富度显著下调,唾液链球菌科、放线菌科、消化链球菌科等口腔疾病相关菌的相对丰度显著下调,可能对牙周炎疾病有缓解作用;牙菌斑菌群物种多样性显著下调,纤毛菌科、梭杆菌科及黄杆菌科的相对丰度均显著降低,可能对牙周病、口臭、龋齿等口腔疾病有缓解作用。
附图说明
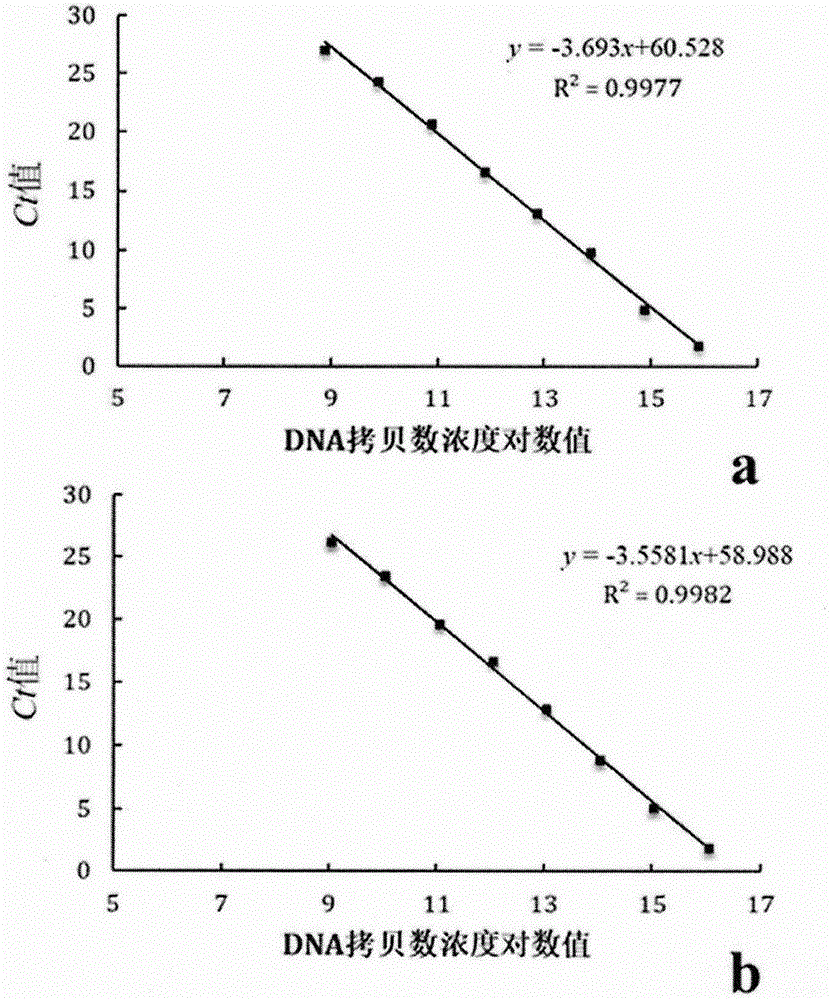
图1为变异链球菌和格式链球菌定量检测的标准曲线;
图2为羟基磷灰石模型粘附实验的流程图;
图3变异链球菌拷贝数随黏附时间的变化结果图;其中,(a)为预防组,(b)为治疗组;
图4为戈氏链球菌拷贝数随黏附时间的变化结果图;其中,(a)为预防组,(b)为治疗组;
图5为羟磷灰石圆盘形成生物膜厚度及其示意图;其中,(a)为羟磷灰石圆盘厚度显著性分析,*表示该组与对照组有显著性差异(p<0.05);(b)、(c)分别为对照组、l9组、生物膜的正面示意图,(d)、(e)分别为对照组、l9组生物膜的侧面示意图;
图6为致龋因子扩增产物电泳图;
图7为spap、luxs及ciah基因相对表达量柱形图;
图8为gtf基因相对表达量柱形图;
图9为小鼠牙菌斑稀释曲线图;
图10为核心物种数与样本量的关系示意图;
图11为门水平小鼠牙菌斑微生物群落组成热图;
图12为out水平小鼠牙菌斑微生物pcoa图;
图13为属水平小鼠牙菌斑物种差异分析示意图;
图14为人体口腔菌群多样性的实验流程图;
图15为总物种数与核心物种数与样本量的关系示意图;其中,a为唾液,b为牙菌斑,test2(4)表示第2(4)周,横坐标表示样本数量,a1、b1纵坐标表示检测到的总out数,a2、b2纵坐标表示核心out数;
图16为人群唾液及牙菌斑稀释曲线图;其中,a为唾液,b为牙菌斑,横坐标表示测序量,纵坐标表示物种多样性;
图17为门水平上唾液与牙菌斑的群落组成柱形图;其中,a为唾液,b为牙菌斑,横坐标表示各门微生物在该组样本中所占比例,纵坐标表示组别;
图18为基于bray_curtis算法的out水平上唾液与牙菌斑的pcoa图;其中,a为唾液,b为牙菌斑,横、纵坐标表示两个选定的主坐标成分,百分比表示主坐标成分对样本组成差异的贡献值。横、纵坐标轴的刻度是相对距离,无实际意义。两样本点越接近,表明两样本物种组成越相似;
图19、图20为科水平上唾液与牙菌斑优势物种组成差异图;其中,*0.01<p≤0.05,**0.001<p≤0.01,***p≤0.001;
在上述附图中,相同字母表示无显著性差异(p>0.05),不同字母表示有显著性差异(p<0.05)。
具体实施方式
以下将详述本发明的各实施例,并配合附图作为示例,除了这些详细说明之外,本发明亦可以广泛的施行于其他的实施例中,任何实施例的轻易替代、修改、等效变化都包含在本发明的范围内,并以申请专利范围为准。
副干酪乳杆菌l9分离自广西巴马长寿老人肠道,使用乳酸细菌mrs肉汤培养基进行培养。以20%脱脂乳形式保存于-20℃,取200μl于相应培养基在37℃恒温培养箱中培养12h,并传代。
实施例1——副干酪乳杆菌l9对口腔致病菌的体外抑制黏附
通过定量pcr筛选出能够特异性扩增变异链球菌和戈氏链球菌,但不能扩增副干酪乳杆菌的特异性引物——正向引物(5′-3′)序列:gcctacagctcagagatgctattct,反向引物(5′-3′)序列:gccatacaccactcatgaattga。引物的反应体系及反应条件为:2.5μldna,10μltaq酶,0.5μl上游引物,0.5μl下游引物,6.5μl超纯水;95℃预变性2min;95℃变性5s,退火温度60℃下退火60s,72℃延伸30s,40个循环;72℃延伸5min。
使用上述特异性引物对致病菌进行定量pcr扩增,将产物进行琼脂糖凝胶电泳,切胶并使用胶回收试剂盒回收dna,测定标准dna浓度并进行10倍梯度稀释8次,以此作为模板进行定量pcr,最后以各梯度稀释液中dna的拷贝数浓度的对数为横坐标,以ct值为纵坐标,制作标准曲线,如图1所示,以dna拷贝数浓度对数值为x轴,循环数ct值作为y轴。(a)变异链球菌扩增标准曲线为y=-3.5581x+58.998,r2=0.9982;(b)戈氏链球菌扩增标准曲线为y=-3.693x+60.528,r2=0.9977。通过r2>0.99判断,可用于变异链球菌和戈氏链球菌的定量检测。
为验证副干酪乳杆菌l9的抑制口腔致病菌黏附性能,进行了以下检测:
羟基磷灰石模型粘附实验:
(1)唾液预处理
唾液收集,选择10名24-40岁的健康志愿者,收集唾液。健康成人在进食2小时后用清水漱口,利用salivette唾液收集管收集无刺激性唾液(口含棉棒10分钟),收集到的唾液立即使用低温高速离心机在4℃以5500r/min的转速离心15min取上清液,以0.22μm的微孔滤膜过滤除菌,收集的唾液部分与0.1mol/l的氯化钾缓冲液1∶1混合,用于构建唾液包被的羟磷灰石模型,部分与pbs1∶1混合用于生物膜形成。均保存于-20℃备用,长期存放于-80℃。志愿者要求如下:
无吸烟历史,在收集前1小时内没有进食、饮水、饮酒等;没有正在生病、没有正在服用药物,尤其一月内未服用抗生素类药物;三天内未食用酸奶、益生菌饮料;无龋病、牙周病等口腔疾患。
(2)操作如图2所示,准确称量10mg羟基磷灰石(ha)珠子于24孔培养板中,每孔加入200μl氯化钾缓冲液中浸泡过夜,次日吸去缓冲液加入100μl已处理好的唾液,室温下6r/min旋转1h后吸去唾液,200μl缓冲液洗涤两次并吸干缓冲液,加入100μl含5mg/ml牛血清蛋白(bsa)的氯化钾缓冲液,室温下6r/min旋转30min后吸干,氯化钾缓冲液洗涤两次,即制成唾液包被的羟磷灰石模型。
传代的第二代菌室温2500r/min离心15min,收集细菌,氯化钾缓冲液洗菌两次,悬浮于含有5mg/ml牛血清蛋白的氯化钾缓冲液中,制成菌浓度为107cfu/ml的菌悬液备用。将实验分为两组预防组和治疗组:预防组为加入l9悬浮液125μl旋转作用1h后加入致病菌悬浮液125μl;治疗组为加入致病菌悬浮液125μl旋转作用1h后加入l9悬浮液125μl;空白对照组则用含5mg/ml牛血清蛋白的氯化钾缓冲液代替l9悬浮液。室温6r/min旋转2、6、18h,氯化钾缓冲液洗涤两次,收集羟磷灰石珠子进行定量pcr,收集缓冲液测定ph,每组三次重复。
副干酪乳杆菌l9对变异链球菌预防黏附的结果如图3所示,与对照组相比,副干酪乳杆菌l9在加入2h和6h后,变异链球菌含量均显著降低(p<0.05),黏附2h时l9组降低了26.88%(0.93×109copies),6h降低了33.26%(1.49×109copies),作用18h后,加入l9的实验组中变异链球菌的含量(2.46×109copies)显著低于对照组(4.26×109copies)(p<0.05);而在治疗组中,l9在作用2h后显著抑制了变异链球菌的含量(p>0.05),降低了51.55%(3.0×109copies)。
副干酪乳杆菌l9对戈氏链球菌抑制结果如图4示,与不加l9的对照组的戈式链球菌含量相比加入l9与戈式链球菌相互作用2、6、18h后,戈氏链球菌黏附量显著降低(p<0.05),分别降低了51.19%(2.15×109copies)、56.09%(3.36×109copies)、58.40%(3.51×109copies),充分证明了l9对戈式链球菌均具有显著预防黏附作用。
加入l9的先后影响了致病菌的黏附,该结果表明l9在口腔中起到的抑制作用并非是简单的非特异性空间位阻,而很可能是l9能够与致病菌竞争性结合唾液获得性膜上的蛋白受体,从而减少致病菌的黏附量。
共聚焦激光显微镜检测生物膜:
基于以上羟磷灰石黏附模型的研究结果,进行l9抑制变异链球菌生物膜形成的实验。细菌在37℃接种两代至生长对数期4500r离心10min弃上清,pbs(4℃,4500g,10min)洗涤2次,悬浮于含有0.2%蔗糖的人造唾液培养基中,制成菌浓度为107cfu/ml的菌悬液备用。高压灭菌的圆盘置于24孔组织培养板的孔中(每孔中一个圆盘,圆盘不可接触孔壁),37℃用上述唾液(1.5ml/孔)包衣4h,之后,1.5mlpbs冲洗2次。加入细菌悬浮液各750μl,在羟磷灰石圆盘表面培养24h形成生物膜。
将圆盘依次用1.5ml无菌pbs(每次漂洗的浸泡时间,10s)冲洗三次,以除去未粘附的细菌;使用安装在无振动平台上的488nmar/ar-kr激光扫描头的tcssp2共聚焦显微镜进行非侵入式共聚焦成像。使用的物镜是20×,图像三倍放大;样本进行live/dead染色使用
成熟的牙菌斑生物膜是导致口腔疾病发生的主要因素,从图5(a)中可以看出,与对照组相比,l9组在羟磷灰石表面形成的生物膜厚度均显著降低(p<0.05),对照组的平均厚度为16.33μm,l9组平均厚度分别为12.63μm。图5(b、c)显示对照组细菌生物膜密度明显高于加入l9的实验组,细菌密集成大片云状,层层叠叠,比较聚集,排布紧密,视野内的空隙范围很小。而加入l9的实验组细菌菌落较分散,暗黑的空隙范围很大,细菌分布零乱,l9组细菌呈现零星点状,细菌密度小。因此,副干酪乳杆菌l9能够通过抑制变异链球菌的黏附,减少牙菌斑生物膜的产生,从而预防口腔疾病的发生。
实施例2——副干酪乳杆菌l9对小鼠口腔菌群多样性的影响
将-20℃保藏的变异链球菌1.2499、副干酪乳杆菌l9分别在10ml的bhi、mrs和m17肉汤培养基中37℃活化培养三代,4500r/min离心10min后去除上清液,变异链球菌用无菌生理盐水复溶菌泥,副干酪乳杆菌l9用蔗糖溶液复溶,均调节菌液浓度至108cfu/ml,4℃保存备用。
小鼠口腔龋齿造模方法:
本实施例的动物模型选择了购买自维通利华的3周龄的雄性spf级balb/c小鼠共28只,每组7只,分为对照组、模型组、副干酪乳杆菌l9组共3个组。购买到的spf级小鼠首先经过一周的适应期后随机分为四组,适应期间小鼠喂食无菌水和普通无菌饲料。之后,对照组小鼠喂食10%的蔗糖溶液和普通无菌饲料;模型组小鼠喂食10%的蔗糖溶液和致龋饲料,同时连续4天接种变异链球菌,每天接种1次,接种量为1ml/次,接种前先用无菌pbs擦拭清洗小鼠口腔;l9组的小鼠喂食含有l9的10%的蔗糖溶液和致龋饲料,接种致病菌1周后接种l94天,每天接种1次,接种量为108cfu/次,喂养4w后处死所有小鼠,处死前2h禁食,处死后以无菌棉签拭子摩擦小鼠的口腔各部位(包括上下牙齿、舌头、牙龈等),采集小鼠牙菌斑样本后,将拭子剪下置于装有1ml核酸保护液的离心管中,-20℃保存。
致龋因子的定量检测
通过查找文献筛选出7种常见的致龋因子及其特异性引物,引物序列如表1所示,以reca基因作为内参基因,利用该内参将目的基因归一化到相同拷贝数的比较,对7种致龋因子进行相对定量检测,扩增体系为20μl包括:2.5μldna模板、0.5μl上、下游引物、10μlsybr酶和6.5μl无菌无酶水,经过95℃预变性3min,95℃10s、53℃30s和72℃20s进行40次循环。
表1引物序列表
将7个目的基因的扩增产物进行琼脂糖凝胶电泳,结果如图6所示,各引物对相应基因均具有良好特异性,可用于各基因的定量检测。
对小鼠牙菌斑中致龋因子的定量结果如图7所示,从图中可以看出,与对照组相比,模型组中的spap、luxs、ciah的相对表达量均显著提高(p<0.05),副干酪乳杆菌l9组中spap和ciah的表达水平已降低到了对照组的表达水平,luxs基因的表达量虽显著低于模型组(p<0.05),但比对照组相比,相对表达量仍有所提高,l9组的luxs相对表达量与对照组还是有显著差异的。
从图8中可以看出,与对照组相比,模型组中的gtfb、gtfd的相对表达量均显著提高(p<0.05),尤其是gtfb,两种基因在副干酪乳杆菌l9组的表达量虽比对照组有所提高,但其相对表达量均显著低于模型组(p<0.05)。此外,四组间的gtfc的相对表达量差异不显著(p>0.05)。gtfd表达量的降低可能使gtf-d合成的可溶性糖减少,从而减少了gtf-b代谢底物的提供。所以,gtfb、d基因相对表达量的降低表明副干酪乳杆菌l9显著抑制了牙菌斑生物膜的形成和发展。
而后进行pcr和高通量测序:
(1)细菌dna抽提
使用qiagen细菌dna提取试剂盒按照制造商的说明提取小鼠牙菌斑的细菌基因组dna。使用qubitr6荧光计定量检测dna浓度,并使用琼脂糖凝胶电泳估计分子大小。
(2)pcr扩增
为保证后续数据分析的准确性及可靠性,需满足两个条件:1)尽可能使用低循环数扩增;2)保证每个样本扩增的循环数一致。随机选取具有代表性的样本进行预实验,确保在最低循环数中使绝大多数样本能够扩增出浓度合适的产物。
16srrna以引物b341f(5′-cctacgggnggcwgcag-3′)和b785r(5′-gactachvgggtatctaatcc-3′)对通用靶v3-v4区域进行pcr扩增,靶片段长度为450bp并进行退火。温度为55℃。在第一轮pcr扩增中,将10ng模板dna加入到最终25μl体积的反应混合物中,其含有0.25μl每种引物(25μm),12.5μl2×kapahifihotstartreadymix和pcr级无菌无酶水。循环条件为:在95℃预孵育3min,25个循环,在95℃下30s进行变性,在55℃下30s进行退火,在72℃下进行30s进行延伸,然后进行最终在72℃下延伸5min并保持在4℃。通过2%琼脂糖凝胶电泳检测2μlpcr产物以检测靶片段,并使用1xampurexpbeads(beckmancoulter,inc.)纯化。在第二次pcr中,将2.5μl上述pcr产物加入到最终25μl体积的反应混合物中,其中含有0.25μl每种引物(25μm),12.5μl2×kapahifihotstartreadymix和9.5μlpcr级无菌无酶水。如下在t100tm热循环仪中对每个样品进行pcr反应:95℃预变性3min,95℃30s,55℃30s和72℃30s进行8个循环,然后在72℃下最终延伸5min并保持在4℃。合并来自相同样品的pcr反应,使用2%琼脂糖凝胶分离和提取进行纯化。
(3)荧光定量pcr扩增
通过使用qiaquick凝胶提取试剂盒再循环靶标片段,并使用kapa文库定量试剂盒定量检测。
(4)miseq文库构建
通过pcr将illumina官方接头序列添加至目标区域外端;使用凝胶回收试剂盒切胶回收pcr产物;tris-hcl缓冲液洗脱,2%琼脂糖电泳检测;氢氧化钠变性,产生单链dna片段。
(5)miseq测序
dna片段的一端与引物碱基互补,固定在芯片上;以dna片段为模板,芯片上固定的碱基序列为引物进行pcr合成,在芯片上合成目标待测dna片段;变性、退火后,芯片上dna片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥”;pcr扩增,产生dna簇;dna扩增子线性化成为单链。加入改造过的dna聚合酶和带有4种荧光标记的dntp,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3′端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板dna片段的序列。
高通量测序结果:
将文库混合、变性后,加入到illuminamiseq测序平台进行高通量并行测序。经16srdna测序,在28个小鼠牙菌斑样本中获得优化序列共1364420条,平均序列长度为449.13;
将获得的上述序列进行out聚类,按最小样本序列数进行抽平,共聚类到1个域1个界32个门70个纲135个目228个科404个属549个种781个out,其中对照组检测到424个out,龋齿模型组检测到346个out,副干酪乳杆菌治疗组检测到327个out。与对照组相比,模型组检测到的总out数降低,副干酪乳杆菌组与模型组似乎检测到的out数较为接近。
从图9中可以看出随着样本测序量的增加香浓指数(shannonindex)无限趋近于平衡,表明本实施例的样本测序量足够,覆盖度均大于0.99,对样本全部序列具有代表性。图10中检测到的核心物种数随样本量的增加逐渐趋于平缓,表明本研究检测的样本量足够。
通过otu聚类小鼠牙菌斑菌群主要分类为5个菌门如图11所示,分别是厚壁菌门(firmicutes)、变形菌门(proteobacteria)、放线菌门(actinobacteria)、无壁菌门(tenericutes)及拟杆菌门(bacteroidetes),其中厚壁菌门和变形菌门为优势菌门;与对照组相比,模型组中放线菌门明显上调,而l9组的物种组成与对照组更接近,与模型组差异较大。
图12是基于bray-curtis算法的pcoa分析,图中显示在otu水平模型组与对照组群落组成有显著差异;l9组与模型组样本群落组成差异显著,尤其在pc1(38.34%)轴上。
如图13所示,与对照组相比;模型组小鼠口腔中葡萄球菌属(staphylococcus)、克雷伯菌属(klebsiella)显著上调;与模型组相比,l9中巴斯德氏菌、gemella、支原体(mycoplasma)、棒状杆菌(corynebacterium_1)显著下调。
综上所述:
(1)与对照组相比,模型组e级龋显著增高;与模型组相比,l9组e级龋齿显著降低;同时三组间ds、dm级龋无显著差异。
(2)与对照组相比,模型组中致龋因子spap、luxs、ciah、gtfb、gtfd表达量均显著上调;副干酪乳杆菌l9加入显著降低了这五种致龋因子的表达。
(3)与对照组相比,模型组口腔菌群多样性指数无显著差异,但菌群结构变化显著,尤其是放线菌门(actinobacteria)显著上调;且l9组的群落组成均发生了显著变化。
实施例3——副干酪乳杆菌l9对人口腔菌群多样性的影响
进行人员招募:
(1)纳入标准
①无活动性龋病的受试者
②无任何全身性疾病
③没有任何预防牙科治疗史的受试者
(2)排除标准
①在研究过程中接受抗生素治疗的人
②在研究过程中,使用任何其他益生菌补充剂(酸奶或其他含益生菌补品)的人
③在实验开始前1周和在研究过程中使用木糖醇产品的受试者
④在实验开始前6个月内具有口腔内手术史的受试者
⑤目前吸烟或实验开始前一年吸烟者
(3)实验期间对受试者的要求
要求受试者分别在早(9:00之前)中(11:00-13:00)晚(17:00之后)饭后服用一粒益生菌片,受试者需含至少2-3min后再咀嚼吞咽,要避免偏侧咀嚼;每天刷两次牙,分别为早晚各一次,服用后至少2h内不可刷牙。
如图14所示的根据上述标准筛选出15名志愿者,经过1周的排空期后(期间不可食用任何木糖醇产品或益生补充剂),收集受试者的唾液、牙菌斑使用细菌dna提取试剂盒提取dna,进行16srdna测序,并测定口气中的vsc(挥发性硫化物)和唾液ph,作为基线指标,之后4周内受试者按要求食用益生菌含片(含副干酪乳杆菌l9109cfu/片),两周后再次收集样本进行测序并测定指标。
取样方法:
(1)唾液(取样时间:早9:00前)
唾液采集要求漱口后咀嚼唾液收集管中的棉棒2min至棉棒完全湿润,要避免偏侧咀嚼,两侧咀嚼时间要平均,置于离心管中,存放于-20℃用于提取dna;
(2)牙菌斑(取样时间:早9:00前)
取样时用口腔拭子在牙冠、牙缝隙、牙龈、龈沟、牙周袋部位以及牙上其他不易清洁的窝沟、裂隙、邻接面、龋洞表面等部位来回摩擦1min后将拭子放4回到拭子管中,并在1h内浸泡在rnalater中并存放于4℃用于提取dna;
(3)口气值测定(取样时间:早10:30前)
受试者检测前24小时内不使用芳香性饮料、明显气味的口红或润唇膏及其他漱口水,不食用大蒜、韭菜、萝卜等含硫较高食物,晨起不刷牙、不漱口、不进食。
使用hialmeter仪检测记录每位患者的口气值,使用前先用空气调零,受试者闭口3min后,将hialmeter的采气管插入口腔内约4cm,放置于舌背中1/3上方0.5cm处,检测过程中口保持微微张开,用鼻呼吸,待数值升至峰值并开始下降时,移去吸管,记录挥发性硫化物浓度峰值。重复检测3次,结果取平均值。
按照实施例2所述相同的方法进行pcr和高通量测序。
高通量测序结果:
将文库混合、变性后,加入到illuminamiseq测序平台进行高通量并行测序。经16s测序,在48个唾液样本中共获得2946563条高质量的序列,平均序列长度为449.12,在48个牙菌斑样本中共获得2088899条高质量的序列,平均序列长度为459.44。
将获得的上述序列进行out聚类,按最小样本序列数抽平,唾液样本中检测到1个域1个界23个门43个纲102个目180个科442个属786个种1125个out,其中0周检测到941个out,第2周检测到766个out,第2周检测到808个out;牙菌斑样本中检测到1个域1个界14个门27个纲45个目77个科166个属334个种643个out,其中0周测到415个out,第2周检测到589个out,第4周检测到549个out,食用益生菌片(含副干酪乳杆菌l9109cfu/片)2周后唾液样本out数降低,而牙菌斑样本out数升高,总体来看,相较于唾液样本,牙菌斑样本的丰富度要低。
在图15显示随着检测样本数量的增加,总out水平和共有out水平都不再增加,说明本实验唾液、牙菌斑样本数量都充足,且食用益生菌片后唾液总out降低,而牙菌斑总out数明显上升。从图16稀释曲线可以看出随着样本测序量的增加唾液与牙菌斑样本out水平的香浓指数(shannon)趋于平衡,不再上升,即物种多样性不再增加,证明本次人群实验样本测序量足够。
从表2可以看出,与对照组相比,第2周唾液样本的群落丰富度指数(sobs、ace、chao)极显著下调,群落丰富度降低,而其他多样性指标无显著变化;表3显示食用益生菌片2、4w后,牙菌斑群落多样性指数(shannon)显著下调,simpson指数显著上调,群落多样性减少;群落丰富度指数(ace、chao)均显著上调,群落丰富度增加;唾液、牙菌斑样本覆盖度(coverage)均大于0.99接近1,证明本次测序结果能够反映样本中微生物的真实情况,具有代表性。
表2唾液样本alpha多样性指数表
注:*0.01<p≤0.05,**0.001<p≤0.01,***p≤0.001
表3牙菌斑样本alpha多样性指数表
注:*0.01<p≤0.05,**0.001<p≤0.01,***p≤0.001
如图17a唾液样本中检测到的微生物主要包括8个门,厚壁菌门(firmicutes)、变形菌门(proteobacteria)、螺旋体菌门(saccharibacteria)、拟杆菌门(bacteroidetes)、放线菌门(actinobacteria)、sr1、蓝藻门(cyanobacteria)、梭杆菌门(fusobacteria),另外还有一个未被注释到的,其中第0和4周厚壁菌门为优势菌门,而第2周变形菌门显著上调成为优势菌,螺旋体菌门显著下降,此外拟杆菌门相对丰度逐渐增加;牙菌斑样本(如图17b)中检测到6个门,厚壁菌门(firmicutes)、变形菌门(proteobacteria)、拟杆菌门(bacteroidetes)、放线菌门(actinobacteria)、梭杆菌门(fusobacteria)、螺旋体菌门(saccharibacteria),其中厚壁菌门为优势菌门,放线菌门占比明显增加,拟杆菌门明显少。
唾液和牙菌斑样本pcoa图18显示,不论是唾液还是牙菌斑,第2、4周样本与0周在图中均明显分离开,表明摄入益生菌片后明显影响了口腔微生物群落的分布。唾液pcoa图中第2周的样本与0周略微接近,第4周则与0周样本相距甚远,其中唾液pc1和pc2解释度分别为40.87%和9.76%,同时图中可以看到第0周唾液样本分布较为松散,而经过副干酪乳杆菌l9菌片调节后,第2、4周样本分布聚集;牙菌斑pcoa图中第2、4周牙菌斑样本几乎无法分开,仅与0周样本显著分离,pc1和pc2解释度分别为18%和14.56%。
唾液样本中检测到的优势菌科共28种如图19,除韦荣菌、奈瑟氏菌、放线菌外的25个科均有显著性差异,尤其是第2周的变化最为显著,瘤胃菌科、盐单胞菌科、叶瘤菌科、拟杆菌科和微细菌科相对丰度极显著上升,链球菌、family_xiii、梭杆菌科、消化链球菌和三种未注释到的科相对丰度显著下降,第4周唾液的变化与第2周并不一致,普雷沃氏菌、紫单胞菌、弯曲杆菌、巴斯德氏菌、梭杆菌显著上调,出现这样的结果可能是由于唾液流动性较大,唾液中的微生物更新较快,l9很难在唾液中长时间停留,仅能在短时间内对唾液起到调节作用,因此维持效果时间较短;牙菌斑样本中检测到的优势菌科共16个如图20,链球菌为最优势菌科,且第2、4周样本微生物组成相近,除放线菌科显著上调外,纤毛菌科、紫单胞菌、毛螺菌科、梭杆菌科、黄杆菌科相对丰度均显著降低。另外,韦荣菌、普雷沃氏菌、二氧化碳噬纤维菌在第2周显著降低,以及奈瑟菌和棒状杆菌在第4周显著降低。
唾液、牙菌斑样本覆盖度高,测序结果能够反映样本中微生物的真实情况,具有代表性。唾液样本群落丰富度和牙菌斑群落多样性的减少,说明食用l9益生菌片对口腔菌群有正向的调整。我们的研究结果表明,链球菌和放线菌的相对丰度似乎在斑块中同步增加并且在唾液中减少。这种变化可能与细菌粘附有关。
综上所述:
(1)短期(2w)食用l9益生菌含片后,唾液物种丰富度显著下调,物种组成发生显著变化,变形菌门显著上调成为优势菌,螺旋体菌门显著下降,但第4周向原始水平回复,此外拟杆菌门相对丰度随时间逐渐增加;
(2)食用l9含片后,牙菌斑菌群物种多样性显著下调,丰富度显著上调,物种组成变化显著,放线菌门占比明显增加,拟杆菌门明显减少,且第2周与第4周物种组成无显著差异。科分类水平上,食用菌片后除放线菌外,纤毛菌、紫单胞菌、毛螺菌、梭杆菌、黄杆菌科、韦荣菌、普雷沃氏菌、二氧化碳噬纤维菌、奈瑟菌和棒状杆菌相对丰度均显著降低;
(3)副干酪乳杆菌l9益生菌含片的使用对人群口腔的vsc含量和唾液ph影响不显著,但短期内(2w)可降低唾液酸度和vsc含量。
实施例4
本实施例提供了一种用于预防或治疗口腔疾病的药物组合物,所述组合物中包含副干酪乳杆菌l9的菌体,副干酪乳杆菌l9保藏编号为cgmccno.9800。所述菌体为具有活性的菌体,组合物中该菌体的含量为16wt%,且副干酪乳杆菌l9的数量为103cfu以上,较佳者,副干酪乳杆菌的数量为106cfu以上。
实施例5
本实施例提供了一种用于预防或治疗口腔疾病的乳制饮品,所述组合物中包含副干酪乳杆菌l9的菌体,副干酪乳杆菌l9保藏编号为cgmccno.9800。所述菌体为灭活的菌体,组合物中该菌体的含量为5wt%,且副干酪乳杆菌l9的数量为103cfu以上,较佳者,副干酪乳杆菌的数量为106cfu以上。
- 还没有人留言评论。精彩留言会获得点赞!