一种抗肿瘤药物组合物及其用途
本发明属于制药领域,具体涉及一种抗肿瘤药物组合物及其用途。
背景技术:
紫杉醇(paclitaxel,ptx)是红豆杉属植物中的一种复杂的次级代谢产物。其分子式为c47h51no14,重均分子量为853.92。ptx是一种临床应用广泛的广谱抗肿瘤药物,其通过抑制微管蛋白解聚,保持解聚态的稳定,从而抑制肿瘤细胞的有丝分裂,最终达到抑制肿瘤细胞增殖的目的。但是ptx的水溶性极差,传统制剂采用聚氧乙烯蓖麻油(cremophorel)与无水乙醇作为增溶溶媒,但cremophorel会带来一系列过敏反应,用药前需进行脱敏处理。此外,由于缺乏靶向特异性,ptx临床使用时存在骨髓抑制、过敏反应、消化道反应、神经毒性等不良反应。因此,ptx在临床上的使用受到严重限制。
5-氟尿嘧啶(5-fluorouracil,5-fu)是尿嘧啶中的氢原子被氟原子取代所得。其分子式为c4h3n2o2f,重均分子量为130.8。5-fu是一种亲水性药物,略溶于水,在水中溶解度为17mg/ml,在稀酸或碱液中溶解。5-fu也是一种临床上广泛使用的抗肿瘤药物,它对多种肿瘤包括乳腺癌、结直肠癌、胃癌、头颈部癌和宫颈癌都具有抗肿瘤活性。其抗肿瘤的主要机制为5-fu的代谢产物一磷酸氟代脱氧尿苷(fdump)抑制胸苷酸合成酶而阻止dna的合成,抑制肿瘤的生长。5-fu口服吸收不完全且难以预测,故临床上多采用注射的方式给药。但5-fu的半衰期较短,在体内很快被代谢掉,需要频繁给药,给药非常不方便。此外,5-fu也具有一系列副作用,主要包括消化道反应及骨髓抑制,同时还会发生脱发、指甲改变、皮炎、皮肤色素增加的现象。因此,5-fu在临床上的使用也受到严重限制。
ptx与5-fu在临床上常常配伍使用于癌症治疗。文献报道ptx与5-fu配伍使用可治疗晚期乳腺癌、转移性乳腺癌和晚期胃癌等癌症,近期疗效肯定,不良反应少,生活质量改善明显,具有很高的临床价值。但是,ptx与5-fu配伍使用的效果并非是确定的,其药效可能会产生相加作用,也可能产生协同作用或拮抗作用。这些作用往往与药物之间的剂量比例、肿瘤细胞类型紧密相关。因此,找到ptx与5-fu配伍使用可以发挥协同作用的剂量比例具有重要意义。
技术实现要素:
本发明的目的是提供一种抗肿瘤药物组合物及其用途。
本发明提供了一种抗肿瘤药物组合物,它由5-氟尿嘧啶和紫杉醇组成;所述5-氟尿嘧啶和紫杉醇的重量配比为2:(2.3~10)。
进一步地,所述5-氟尿嘧啶和紫杉醇的重量配比为(2:5)~(5:6);
优选地,所述5-氟尿嘧啶和紫杉醇的重量配比为(2:5)~(13:20)。
进一步地,所述肿瘤为恶性肿瘤;优选地,所述恶性肿瘤为乳腺癌。
本发明还提供了前述的抗肿瘤药物组合物的制备方法,所述制备方法是按照以下步骤制备:按照重量配比取5-氟尿嘧啶和紫杉醇原料药混合,或制成溶液混合,即可;
优选地,所述制成溶液混合后,混合溶液中5-氟尿嘧啶和紫杉醇总浓度不小于0.0825μg/ml;
更优选地,所述制成溶液混合后,混合溶液中5-氟尿嘧啶和紫杉醇总浓度为0.0825μg/ml~1.32μg/ml;
更优选地,当混合溶液中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,混合溶液中5-氟尿嘧啶和紫杉醇总浓度为0.28μg/ml~1.32μg/ml;
进一步优选地,当混合溶液中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,混合溶液中5-氟尿嘧啶和紫杉醇总浓度为0.33μg/ml~1.32μg/ml。
本发明还提供了一种抗肿瘤药物制剂,它是以前述的抗肿瘤药物组合物为活性成分,加上药学上可接受的辅料或者辅助性成分制备而成的制剂;
优选地,所述制剂中5-氟尿嘧啶和紫杉醇总浓度不小于0.0825μg/ml;
更优选地,所述制剂中5-氟尿嘧啶和紫杉醇总浓度为0.0825μg/ml~1.32μg/ml;
更优选地,当制剂中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,制剂中5-氟尿嘧啶和紫杉醇总浓度为0.28μg/ml~1.32μg/ml;
进一步优选地,当制剂中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,制剂中5-氟尿嘧啶和紫杉醇总浓度为0.33μg/ml~1.32μg/ml。
本发明还提供了一种抗肿瘤的联合用药物,它含有相同或者不同规格的同时或者分别给药的5-氟尿嘧啶和紫杉醇,以及药学上可接受的载体;所述5-氟尿嘧啶和紫杉醇的重量配比为2:(2.3~10);
优选地,所述5-氟尿嘧啶和紫杉醇的重量配比为(2:5)~(5:6);
更优选地,所述5-氟尿嘧啶和紫杉醇的重量配比为(2:5)~(13:20)。
进一步地,所述药物中,5-氟尿嘧啶和紫杉醇总浓度不小于0.0825μg/ml;
优选地,所述药物中5-氟尿嘧啶和紫杉醇总浓度为0.0825μg/ml~1.32μg/ml;
更优选地,当药物中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,药物中5-氟尿嘧啶和紫杉醇总浓度为0.28μg/ml~1.32μg/ml;
进一步优选地,当药物中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,药物中5-氟尿嘧啶和紫杉醇总浓度为0.33μg/ml~1.32μg/ml。
进一步地,所述肿瘤为恶性肿瘤;优选地,所述恶性肿瘤为乳腺癌。
本发明还提供了5-氟尿嘧啶和紫杉醇联用在制备抗肿瘤药物中的用途;所述5-氟尿嘧啶和紫杉醇的重量配比为2:(2.3~10);
优选地,所述5-氟尿嘧啶和紫杉醇的重量配比为(2:5)~(5:6);
更优选地,所述5-氟尿嘧啶和紫杉醇的重量配比为(2:5)~(13:20)。
进一步地,所述药物中,5-氟尿嘧啶和紫杉醇总浓度不小于0.0825μg/ml;
优选地,所述药物中5-氟尿嘧啶和紫杉醇总浓度为0.0825μg/ml~1.32μg/ml;
更优选地,当药物中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,药物中5-氟尿嘧啶和紫杉醇总浓度为0.28μg/ml~1.32μg/ml;
进一步优选地,当药物中5-氟尿嘧啶和紫杉醇的重量配比为13:20时,药物中5-氟尿嘧啶和紫杉醇总浓度为0.33μg/ml~1.32μg/ml。
进一步地,所述肿瘤为恶性肿瘤;优选地,所述恶性肿瘤为乳腺癌。
现有技术中,乳腺癌治疗时可以进行局部给药,如将药物制备成注射制剂进行局部给药,这样的给药方式可以使药物直接作用于肿瘤组织,避免药物经过血液或消化道后浓度被稀释,确保药物作用于肿瘤组织时的浓度,发挥更好的药效。本发明药物组合物、制剂以及联合用药物也可以制成局部给药制剂,直接作用于肿瘤组织,确保作用于肿瘤组织的给药浓度不被稀释。
本发明研究表明特定重量比的5-fu与ptx联合使用,在一定浓度范围内对于抑制乳腺癌细胞的增殖具有协同作用。本发明特定重量比的5-fu与ptx可用于制备治疗乳腺癌的药物,具有良好的应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
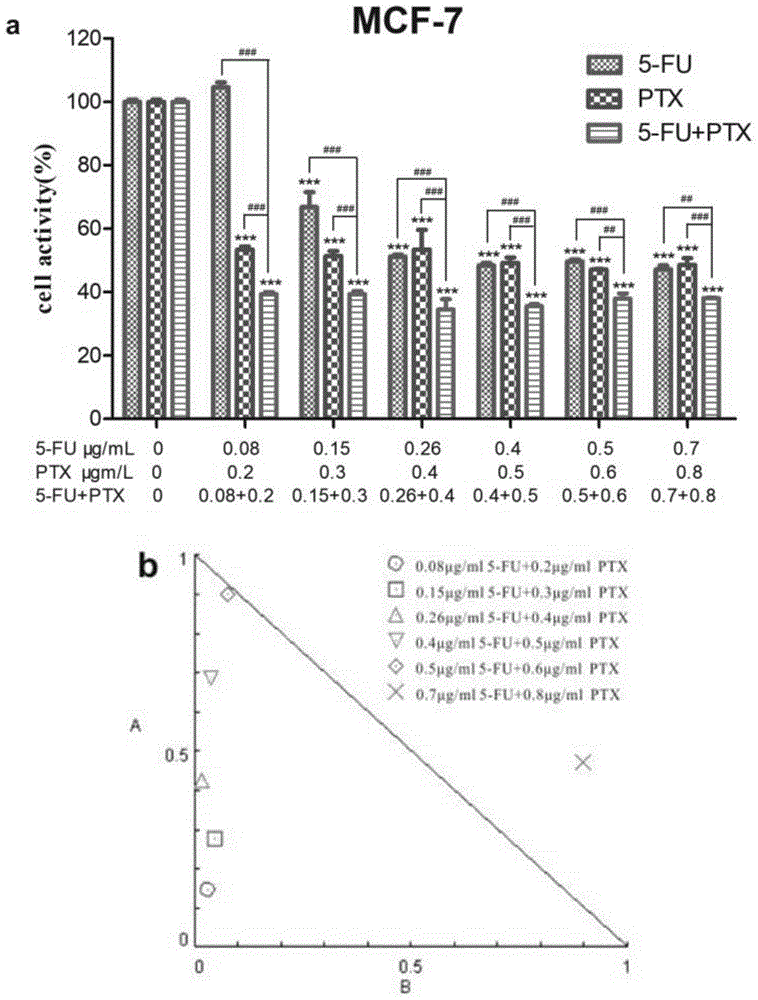
图1为5-fu与ptx以不同浓度比联合用药对mcf-7细胞增殖作用的影响:a为不同浓度比的5-fu和ptx联合用药对mcf-7细胞活性的影响,其中,*p<0.05,**p<0.01,***p<0.001,表示各供试药液组与阴性对照组的统计学比较;#p<0.05,##p<0.01,###p<0.001,表示5-fu药液或ptx药液与相同浓度的5-fu和ptx混合药液的统计学比较;统计学比较采用双因素方差分析;b为不同浓度比5-fu与ptx联合用药后的剂量-等效性曲线。
图2为5-fu与ptx在固定浓度比不同浓度下联合用药对mcf-7细胞增殖作用的影响:a为5-fu与ptx在不同浓度下联合用药用对mcf-7细胞活性的影响,其中,*p<0.05,**p<0.01,***p<0.001,表示各供试药液组与阴性对照组的统计学比较;#p<0.05,##p<0.01,###p<0.001,表示5-fu药液或ptx药液与相同浓度的5-fu和ptx混合药液的统计学比较;统计学比较采用双因素方差分析;b为5-fu与ptx在固定浓度比不同浓度下联合用药后的剂量-等效性曲线。
图3为5-fu、ptx及联合用药对mcf-7细胞凋亡的诱导作用,图中,q1-ul表示坏死细胞,q1-ur表示细胞处于晚期凋亡和继发性坏死,q1-ll表示活细胞,q1-lr表示早期细胞凋亡。
图4为用hoechst33258染色观察细胞凋亡的荧光图片,图片的放大倍数为20×,小箭头表示核皱缩、核分裂和凋亡小体:a为阴性对照组;b为单独使用浓度为0.52μg/ml的5-fu药液;c为单独使用浓度为0.8μg/ml的pxt药液;d为使用等体积的浓度为0.52μg/ml的5-fu药液与浓度为0.8μg/ml的pxt药液混合后的的5-fu和ptx混合药液;e为单独使用浓度为1.04μg/ml的5-fu药液;f为单独使用浓度为1.60μg/ml的pxt药液;g为使用等体积的浓度为1.04μg/ml的5-fu药液与浓度为1.60μg/ml的pxt药液混合后的的5-fu和ptx混合药液。
具体实施方式
1、实验仪器及设备
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。其中,主要仪器与设备如表1所示,使用的主要原料与试剂如表2所示。
表1.仪器与设备
表2原料与试剂
2、实验使用的细胞株
本发明具体实施方式中使用的细胞株为人乳腺癌细胞系(mcf-7)。
3、实验方法
本发明具体实施方式中溶液的配制及细胞实验所涉及的实验方法均采用细胞实验常规方法(除具有特殊说明),部分溶液配制方法和细胞实验所涉及的方法如下。
(1)完全培养基的配制
按照100ml的单位体积配制完全培养基:取10mlfbs溶液置于无菌的具刻度的玻璃瓶中,再加入1ml的双抗溶液(青霉素的浓度为10000u/ml,链霉素的浓度为10mg/ml),最后添加89mldmem培养基,混合均匀,终浓度为含10%fbs,1%双抗(青霉素的浓度为100u/ml,链霉素的浓度为0.1mg/ml)的完全培养基(dmem培养基)。完全培养基放置于4℃,现配现用,存放时间不超过1周。
(2)细胞冻存液的配制
从-20℃的冻库取出胎牛血清(fbs),待血清融化后混匀待用,按胎牛血清与培养基7:3的比例,取700μl的fbs与300μl的培养基混合均匀,即得1ml的冻存液。长期保存应放置于-20℃冻库中。
(3)磷酸盐缓冲液(pbs)的配制
取一袋磷酸盐缓冲液粉末,先用适量的超纯水进行溶解,再调节ph至7.2~7.6,分装于100ml的玻璃瓶中,在121℃条件下进行高压蒸汽灭菌,放置于4℃密封保存。
(4)培养条件
在含有5%co2,37℃的恒温细胞培养箱中培养细胞。
(5)肿瘤细胞的传代
于倒置显微镜下观察细胞生长状态,取一瓶生长状态良好的细胞,贴壁的细胞铺满培养瓶底部面积的85%~95%即可,取0.25%的胰蛋白酶,先于37℃培养箱中预热。将培养瓶中的旧培养基弃掉,用pbs缓冲液清洗2~3次,再用预热好的胰蛋白酶进行细胞消化。待消化完毕立即加入适量培养基,轻轻地吹打贴壁的细胞,将细胞悬液转移至15ml的无菌离心管中,以800rpm离心5min。离心完毕,弃掉上清液,用新的培养基重悬细胞,按1:2或者1:3的比例进行传代培养。
(6)肿瘤细胞的冻存
取一瓶生长状态良好,贴壁的细胞铺满培养瓶底部面积90%以上的细胞,按照上述(5)细胞传代的操作进行pbs清洗、消化、离心,离心获得的细胞用1ml冻存液进行重悬,移至无菌的冻存管,密封,做好标记。按照温度梯度法,先于-20℃、-80℃冰箱中依次预冻12h,再转至液氮罐中长期保存。
(7)肿瘤细胞的复苏
将恒温水浴锅温度设置为37.5℃,待温度恒定后,迅速地取出液氮罐中的细胞,装于pe手套中,于37℃水浴中不停的晃动约1-2min,待刚好融化,立即将细胞悬液置于预热好的培养基中,以800rpm离心5min。离心结束后,弃上清液,用新鲜配制的完全培养基重悬细胞,待混匀后转至培养瓶中进行培养。新复苏的细胞需要在细胞贴壁4h左右,观察细胞的贴壁与生长状态,确定复苏是否顺利进行。
实施例1、不同浓度比5-氟尿嘧啶与紫杉醇协同抗乳腺癌细胞增殖作用
1、实验方法
(1)细胞接种
取处于对数生长期的mcf-7细胞,按照“肿瘤细胞的传代”中所述清洗、消化、离心的方法,对mcf-7细胞进行清洗、消化、离心。离心所得细胞用dmem培养基重悬,取少量的细胞悬液用pbs溶液稀释10倍,使用流式细胞仪计数,再根据计数的结果将细胞悬液稀释到5×104个/ml,按每孔100μl细胞悬液均匀接种于96孔板内,细胞周围加入200μl的pbs溶液,防止培养基的挥发。将接种好细胞的培养板分别做好标记,均置于37℃,5%co2的恒温细胞培养箱中培养过夜。
(2)供试药液的配制
称取适量的5-氟尿嘧啶(5-fu)原料药,用dmem培养基进行溶解,配制成100μg/ml的母液,再利用dmem培养基将母液稀释成不同浓度的5-fu药液,5-fu药液的浓度为0.08μg/ml、0.15μg/ml、0.26μg/ml、0.4μg/ml、0.5μg/ml和0.7μg/ml。
称取适量的紫杉醇(ptx)原料药,先用dmso充分溶解,配制成1×105μg/ml的母液,再利用dmem培养基将母液稀释成不同浓度的ptx药液,ptx药液的浓度为0.2μg/ml、0.3μg/ml、0.4μg/ml、0.5μg/ml、0.6μg/ml和0.8μg/ml。
再分别将不同浓度的5-fu药液与ptx药液混合,得到5-fu和ptx浓度比不同的5-fu和ptx混合药液:
将等体积的浓度为0.08μg/ml的5-fu药液和浓度为0.2μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.04μg/ml,ptx的浓度为0.1μg/ml,5-fu和ptx的浓度比为2:5;
将等体积的浓度为0.15μg/ml的5-fu药液和浓度为0.3μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.075μg/ml,ptx的浓度为0.15μg/ml,5-fu和ptx的浓度比为1:2;
将等体积的浓度为0.26μg/ml的5-fu药液和浓度为0.4μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.13μg/ml,ptx的浓度为0.2μg/ml,5-fu和ptx的浓度比为13:20;
将等体积的浓度为0.4μg/ml的5-fu药液和浓度为0.5μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.2μg/ml,ptx的浓度为0.25μg/ml,5-fu和ptx的浓度比为4:5;
将等体积的浓度为0.5μg/ml的5-fu药液和浓度为0.6μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.25μg/ml,ptx的浓度为0.3μg/ml,5-fu和ptx的浓度比为5:6;
将等体积的浓度为0.7μg/ml的5-fu药液和浓度为0.8μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.35μg/ml,ptx的浓度为0.4μg/ml,5-fu和ptx的浓度比为7:8。
(3)实验组别
阴性对照组:细胞+dmem培养基;
供试药液组:细胞+不同浓度比的5-fu和ptx混合药液,细胞+不同浓度的5-fu药液,细胞+不同浓度的ptx药液;
空白组:不含细胞,只添加dmem培养基。
(4)给药
待细胞完全贴壁后,吸出孔板中原有的培养基,依照实验组别:阴性对照组加入100μl培养基;供试药液组分别加入不同浓度比的5-fu和ptx混合药液100μl,或者分别加入不同浓度的5-fu药液100μl,或者分别加入不同浓度的ptx药液100μl;空白组加入100μl培养基。给药完成后置于37℃,5%co2的恒温细胞培养箱中孵育24h。
(5)od值的测量及细胞存活率的计算
给药24h后,弃去孔板中原有的培养基,加入100μl新的dmem培养基,再每孔加入10μlcck-8试剂,置于37℃,5%co2的细胞培养箱中培养4h后,取出振荡混匀30s,最后将96孔板置于酶标仪上,在25℃,450nm处测定其吸光度值(od值),然后按照下述公式计算细胞存活率:细胞存活率(%)=(od供试药液组-od空白组)/(od阴性对照组-od空白组)×100%。od供试药液组为供试药液组测得的od值,od空白组为空白组测得的od值,od阴性对照组为阴性对照组测得的od值。
(6)协同作用的分析
基于两种药物药理学相互作用模型,使用协同指数-等效线方程评估5-fu和ptx之间的相互作用,参见文献(choutc.drugcombinationstudiesandtheirsynergyquantificationusingthechou-talalaymethod.[j].cancerresearch,2010,70(2):440-446.)。协同指数(combinationindex,ci)为1,表示两种药物具有相加效应;ci<1,表示两种药物具有协同作用;ci>1,表示两种药物具有拮抗作用。使用
2、实验结果
5-fu与ptx以不同浓度比联合用药对乳腺癌mcf-7细胞增殖作用的影响如图1所示。图1a为不同浓度比的5-fu和ptx联合用药对mcf-7细胞活性的影响。由图1a可知:5-fu与ptx以不同浓度比联合作用于乳腺癌mcf-7细胞,抑制肿瘤细胞增殖的效果均优于单独给药5-fu或给药ptx的效果。但随着剂量的增加没有显著的效应增加趋势。
图1b为不同浓度比5-fu与ptx联合用药后的剂量-等效性曲线,表3为不同浓度比的5-fu与ptx联合用药的协同指数(ci)。由图1b可知:5-fu与ptx联合用药时,在剂量-等效性曲线中有5个点位于数值1以下,即ci<1。而ci<1时表明联合使用的两种药物具有协同作用,说明该5个联合用药浓度比例对抑制mcf-7细胞的增殖具有协同作用,这5个联合用药比例为5-fu与ptx的浓度比为2:5、1:2、13:20、4:5和5:6。表3也可得到和图1b相同的结果。其中5-fu与ptx的浓度比为13:20时,协同效果最优。
表3.不同浓度比的5-fu与ptx联合用药的协同指数
实施例2、相同浓度比5-氟尿嘧啶与紫杉醇协同抗乳腺癌细胞增殖作用
1、实验方法
(1)细胞接种
同实施例1中的“(1)细胞接种”。
(2)供试药液的配制
称取适量的5-氟尿嘧啶(5-fu)原料药,用dmem培养基进行溶解,配制成100μg/ml的母液,再利用dmem培养基将母液稀释成不同浓度的5-fu药液,5-fu药液的浓度为0.0325μg/ml、0.065μg/ml、0.13μg/ml、0.26μg/ml、0.52μg/ml和1.04μg/ml。
称取适量的紫杉醇(ptx)原料药,先用dmso充分溶解,配制成1×105μg/ml的母液,再利用dmem培养基将母液稀释成不同浓度的ptx药液,ptx药液的浓度为0.05μg/ml、0.10μg/ml、0.20μg/ml、0.40μg/ml、0.80μg/ml和1.60μg/ml。
固定5-fu和ptx联合用药的浓度比为13:20,分别将5-fu药液与ptx药液混合,得到不同浓度的5-fu和ptx混合药液:
将等体积的浓度为0.0325μg/ml的5-fu药液和浓度为0.05μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.01625μg/ml,ptx的浓度为0.025μg/ml,混合药液中5-fu和ptx的总浓度为0.04125μg/ml;
将等体积的浓度为0.065μg/ml的5-fu药液和浓度为0.10μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.0325μg/ml,ptx的浓度为0.05μg/ml,混合药液中5-fu和ptx的总浓度为0.0825μg/ml;
将等体积的浓度为0.13μg/ml的5-fu药液和浓度为0.20μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.065μg/ml,ptx的浓度为0.10μg/ml,混合药液中5-fu和ptx的总浓度为0.165μg/ml;
将等体积的浓度为0.26μg/ml的5-fu药液和浓度为0.40μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.13μg/ml,ptx的浓度为0.20μg/ml,混合药液中5-fu和ptx的总浓度为0.33μg/ml;
将等体积的浓度为0.52μg/ml的5-fu药液和浓度为0.80μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.26μg/ml,ptx的浓度为0.40μg/ml,混合药液中5-fu和ptx的总浓度为0.66μg/ml;
将等体积的浓度为1.04μg/ml的5-fu药液和浓度为1.60μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.52μg/ml,ptx的浓度为0.80μg/ml,混合药液中5-fu和ptx的总浓度为1.32μg/ml。
(3)实验组别
阴性对照组:细胞+dmem培养基;
供试药液组:细胞+不同浓度的5-fu和ptx混合药液,细胞+不同浓度的5-fu药液,细胞+不同浓度的ptx药液;
空白组:不含细胞,只添加dmem培养基。
(4)给药
待细胞完全贴壁后,吸出孔板中原有的培养基,依照实验组别:阴性对照组加入100μl培养基;供试药液组分别加入不同浓度的5-fu和ptx混合药液100μl,或者分别加入不同浓度的5-fu药液100μl,或者分别加入不同浓度的ptx药液100μl;空白组加入100μl培养基。给药完成后置于37℃,5%co2的恒温细胞培养箱中孵育24h。
(5)od值的测量及细胞存活率的计算
同实施例1中的“(5)od值的测量及细胞存活率的计算”。
(6)协同作用的分析
同实施例1中的“(6)协同作用的分析”。
2、实验结果
固定5-fu和ptx联合用药的浓度比为13:20,5-fu与ptx在不同浓度下联合用药用对乳腺癌mcf-7细胞增殖作用的影响如图2所示。图2a为5-fu与ptx在不同浓度下联合用药用对mcf-7细胞活性的影响。由图2a可知,当5-fu与ptx联合用药的浓度比确定,而5-fu与ptx混合药液总浓度不同时,5-fu与ptx联合用药抑制mcf-7细胞增殖的效果均明显优于单独给药5-fu或给药ptx的效果。且随混合药液中5-fu和ptx总浓度增加,抑制mcf-7细胞增殖效果越好,最后趋于稳定。当混合药液中5-fu和ptx总浓度达到0.33μg/ml、0.66μg/ml和1.32μg/ml时,抑制mcf-7细胞增殖的效果显著增加。
图2b为固定5-fu和ptx联合用药的浓度比,5-fu与ptx在不同浓度下联合用药后的剂量-等效性曲线,表4为5-fu与ptx在不同浓度下联合用药的协同指数(ci)。由图2b可知:5-fu与ptx联合用药时,在剂量-等效性曲线显示6个联合用药浓度中有5个浓度(0.0825μg/ml、0.165μg/ml、0.33μg/ml、0.66μg/ml和1.32μg/ml)联合用药对于抑制mcf-7细胞增殖具有协同作用。如表4所示,总浓度为0.04125μg/ml时没有表现出协同效应。而总浓度为0.33μg/ml时,协同效应最优。
表4.5-fu与ptx在不同浓度下联合用药的协同指数
实施例3、流式细胞仪检测固定比例下5-氟尿嘧啶与紫杉醇协同诱导乳腺癌细胞凋亡
1、实验方法
(1)细胞接种
取处于对数生长期的mcf-7细胞,按照“肿瘤细胞的传代”中所述清洗、消化、离心的方法,对mcf-7细胞进行清洗、消化、离心。离心所得细胞用dmem培养基重悬,取少量的细胞悬液用pbs溶液稀释20倍,使用流式细胞仪计数,再根据计数的结果将细胞悬液稀释到2×105个/ml,按每孔1000μl细胞悬液均匀接种于12孔板上。将接种好细胞的培养板分别做好标记,均置于37℃,5%co2的恒温细胞培养箱中培养过夜。
(2)供试药液的配制
称取适量的5-氟尿嘧啶(5-fu)原料药,用dmem培养基进行溶解,配制成100μg/ml的母液,再利用dmem培养基将母液稀释成不同浓度的5-fu药液,5-fu药液的浓度为0.52μg/ml和1.04μg/ml。
称取适量的紫杉醇(ptx)原料药,先用dmso充分溶解,配制成1×105μg/ml的母液,再利用dmem培养基将母液稀释成不同浓度的ptx药液,ptx药液的浓度为0.80μg/ml和1.60μg/ml。
固定5-fu和ptx联合用药的浓度比为13:20,分别将5-fu药液与ptx药液混合,得到不同浓度的5-fu和ptx混合药液:
将等体积的浓度为0.52μg/ml的5-fu药液和浓度为0.80μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.26μg/ml,ptx的浓度为0.40μg/ml,混合药液中5-fu和ptx的总浓度为0.66μg/ml;
将等体积的浓度为1.04μg/ml的5-fu药液和浓度为1.60μg/ml的ptx药液混合,混合药液中5-fu的浓度为0.52μg/ml,ptx的浓度为0.80μg/ml,混合药液中5-fu和ptx的总浓度为1.32μg/ml。
(3)实验组别
阴性对照组:细胞+dmem培养基;
供试药液组:细胞+不同浓度的5-fu和ptx混合药液,细胞+不同浓度的5-fu药液,细胞+不同浓度的ptx药液。
(4)给药
待细胞完全贴壁后,吸出孔板中原有的培养基,依照实验组别:阴性对照组加入1000μl培养基;供试药液组分别加入不同浓度的5-fu和ptx混合药液1000μl,或者分别加入不同浓度的5-fu药液1000μl,或者分别加入不同浓度的ptx药液1000μl。给药完成后置于37℃,5%co2的恒温细胞培养箱中孵育24h。
(5)细胞染色及检测分析
先将孔板中原有的培养基吸出,每孔加入500μl不含edta的胰蛋白酶进行消化,然后2000rpm离心5min,pbs溶液清洗两次收集细胞,分别加入500μl的bindingbuffer重悬细胞,再加入5μlannexinv-fitc和5μlpropidiuniodide混匀,在室温下避光反应15min。在1h内,用流式细胞仪进行检测,检测通道为fl1和fl2或fl3,激发波长ex=488nm,发射波长em=530nm。
2、实验结果
为了证明5-fu与ptx联合用药对mcf-7细胞的凋亡具有诱导作用,采取了annexin-fitc/pi双染色法对两药单独使用以及联合使用的细胞进行染色与检测,结果如图3所示。图3的结果显示:5-fu与ptx联合用药作用于mcf-7细胞时,细胞凋亡诱导率分别为27.6%(混合药液中5-fu的浓度为0.26μg/ml,ptx的浓度为0.40μg/ml,混合药液中5-fu和ptx的总浓度为0.66μg/ml)和27.1%(混合药液中5-fu的浓度为0.52μg/ml,ptx的浓度为0.80μg/ml,混合药液中5-fu和ptx的总浓度为1.32μg/ml);单独使用5-fu时,细胞凋亡诱导率分别是10.4%(5-fu浓度为0.52μg/ml)和12.5%(5-fu浓度为12.5μg/ml);单独使用ptx时,细胞凋亡诱导率分别是15.8%(ptx浓度为0.8μg/ml)和18.2%(ptx浓度为1.60μg/ml)。实验结果表明:特定用量比的5-fu与ptx联合用药对mcf-7细胞的凋亡诱导率远远高于单药作用于mcf-7细胞的凋亡诱导率,表现出潜在的凋亡诱导和协同作用。
实施例4、固定比例下5-氟尿嘧啶与紫杉醇协同诱导乳腺癌细胞凋亡细胞核形态的影响
1、实验方法
(1)细胞接种
取洁净的盖玻片(75%乙醇中浸泡),先用pbs溶液清洗2遍,再用培养基洗涤2遍,再将其置于六孔板内,备用。
取处于对数生长期的mcf-7细胞,按照“肿瘤细胞的传代”中所述清洗、消化、离心的方法,对mcf-7细胞进行清洗、消化、离心。离心所得细胞用dmem培养基重悬,取少量的细胞悬液用pbs溶液稀释20倍,使用流式细胞仪计数,再根据计数的结果将细胞悬液稀释到5×105个/ml,按每孔2000μl细胞悬液均匀接种于每个6孔板内的盖玻片上。将接种好细胞的培养板分别做好标记,均置于37℃,5%co2的恒温细胞培养箱中培养过夜,使其约60%~80%满。
(2)供试药液的配制
同实施例3中的“(2)供试药液的配制”。
(3)实验组别
同实施例3中的“(3)实验组别”。
(4)给药
待细胞完全贴壁后,吸出孔板中原有的培养基,依照实验组别:阴性对照组加入2000μl培养基;供试药液组分别加入不同浓度的5-fu和ptx混合药液2000μl,或者分别加入不同浓度的5-fu药液2000μl,或者分别加入不同浓度的ptx药液2000μl。给药完成后置于37℃,5%co2的恒温细胞培养箱中孵育24h。
(5)细胞染色及检测分析
先将孔板中原有的培养基吸出,pbs溶液清洗两次;然后加入500μl的固定液,固定细胞约15min后,吸出固定液再用pbs溶液洗涤2遍,每次3min,不停地摇晃使之清洗完全;再加入500μl的hoechst33258染色液,染色15min以上。吸出染色液,用pbs溶液再洗涤2遍,每次3min。取一滴(约10μl)抗荧光淬灭液于载玻片上,再盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡。采用倒置荧光显微镜观察呈蓝色的细胞核,激发波长为345nm,发射波长487nm。
2、实验结果
为了直观地观察肿瘤细胞凋亡的细胞核形态,采取hoechst染色法对5-fu与ptx单独使用以及联合使用的细胞进行核染色,观察凋亡作用,结果如图4所示。由图4可知:阴性对照组(图4a)的细胞核呈现出规则的圆形或近圆形,蓝色分布均匀,细胞核的大小均一;供试药液组(图4b为0.52μg/ml5-fu,图4c为0.8μg/mlpxt,图4d为0.52μg/ml5-fu+0.8μg/mlpxt,图4e为1.04μg/ml5-fu,图4f为1.6μg/mlpxt,图4g为1.04μg/ml5-fu+1.6μg/mlpxt)的细胞核部分呈现出致密的蓝色浓染,有部分细胞核出现皱缩、分裂等现象,表现出明显的凋亡特征。特别是5-fu和ptx联合使用时,表现出凋亡特征的细胞核数量明显多于单独使用5-fu或ptx,且随着5-fu和ptx混合溶液的浓度增加,凋亡细胞数目增加。本试验例直观地表现出5-fu和ptx两药联合作用对于mcf-7细胞具有明显的凋亡诱导作用。
上述实施例1~4表明:
(1)5-fu与ptx经过cck-8试验被证实了两药联合作用于人乳腺癌mcf-7细胞,对于mcf-7细胞具有协同抑制增殖的作用,由compusyn软件分析得出的协同指数进一步被证实5-fu与ptx两药联用的协同作用。协同作用与两药的浓度比与总剂量都有相关的联系。
(2)5-fu与ptx经过annexinv-fitc/pi双染色法试验表明其对人乳腺癌mcf-7细胞均具有凋亡诱导作用,两药联合使用后凋亡诱导率有明显的上升趋势,具有协同诱导mcf-7细胞凋亡的作用。hoechst的试验结果也进一步证实了这一结论。
综上,本发明研究表明特定重量比的5-fu与ptx联合使用,在一定浓度范围内对于抑制乳腺癌细胞的增殖具有协同作用。本发明特定重量比的5-fu与ptx可用于制备治疗乳腺癌的药物,具有良好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!