一种精准靶向中枢神经系统的高分子纳米囊泡及其应用的制作方法
本发明涉及一种精准靶向中枢神经系统的高分子纳米囊泡及其应用,是一种具有免疫逃逸、肾肝摄取量低、高效血脑屏障识别穿透、纳米尺度下的双链高分子自组装的囊泡可载药体系。
背景技术:
血脑屏障是由大脑内皮细胞构成的紧致细胞屏障,在保持脊椎动物的中枢神经系统内环境的稳定,调节营养物质及代谢产物的出入密切相关。目前,绝大多数的药物无法透过血脑屏障作用于大脑病灶,因此,中枢神经系统退行性病变(如:阿兹海默症)、癌细胞的脑转移等脑类疾病成为威胁人类健康并难以克服的社会问题。目前,有少量的小分子脂溶性药物能够实现血脑屏障的穿透,但是在血液内的沉积、对肝脏和肾脏造成的毒副作用、大脑内药物浓度低等仍是无法克服的问题。因此,设计安全高效的能透过血脑屏障的中枢神经系统药物递送系统具有重要的科学意义。
纳米类载药系统近年来受到了广泛的关注,其中,脂质体类纳米载药系统已经广泛的应用于临床。然而,脂质体纳米颗粒对外部刺激的响应不敏感,在生物环境不稳定,组织穿透性低。目前,市场上还没出现能透过血脑屏障并在大脑内释放药物的脂质体类药物。因此,寻找脂质体类载药系统的替代品用于中枢神经系统的靶向和疾病治疗具有巨大的市场价值。
申请人对本申请的主题进行了如下的文献检索:
1、www.google.com网检索结果:(2019/12/05)
2、中国知网检索结果:
检索方式一:
篇名-一种精准靶向中枢神经系统的高分子载药囊泡的制备方法:无相关文献。
检索方式二:
全文-一种精准靶向中枢神经系统的高分子载药囊泡的制备方法:无相关文献。
技术实现要素:
本发明旨在提供一种精准靶向中枢神经系统的高分子纳米囊泡及其应用。动物实验表明,该类纳米囊泡可以高效的穿透血脑屏障,并且可以将药物大量的递送到中枢神经系统。研究发现,该类纳米囊泡在大脑内的富集远大于在其他脏器的富集,包括肝脏,肾脏等,对动物无明显的毒副作用,使之在临床药物递送系统,尤其是治疗脑部疾病领域有具有广阔的应用前景。
本发明精准靶向中枢神经系统的高分子纳米囊泡,是通过两种不同的双链高分子聚合物进行精确掺杂,自组装后获得的高分子纳米囊泡(angio-poegma-pdpapolymersomes)。
所述两种不同的双链高分子聚合物为双链高分子聚合物p(eo10gma)20-pdpa112以及肽链修饰的双链高分子聚合物angiopep-2-p(eo10gma)20-pdpa112。
进一步地,双链高分子聚合物p(eo10gma)20-pdpa112与肽链修饰的双链高分子聚合物angiopep-2-p(eo10gma)20-pdpa112的质量比为97:3。
所述双链高分子聚合物p(eo10gma)20-pdpa112的结构式如下:
肽链修饰的双链高分子聚合物angiopep-2-p(eo10gma)20-pdpa112的结构式如下:
上述结构式中修饰的肽链angiopep-2即r基的结构式如下:
本发明精准靶向中枢神经系统的高分子纳米囊泡的制备方法,包括如下步骤:
步骤1:双链高分子聚合物的制备
双链高分子聚合物p(eo10gma)20-pdpa112与肽链修饰的双链高分子聚合物angiopep-2-p(eo10gma)20-pdpa112根据现有技术制备获得,具体参见文献(scientificreports,5,11990(2015))。
步骤2:两种不同的双链高分子聚合物的掺杂
称取19.4mg的p(eo10gma)20-pdpa112及0.6mg的angiopep-2-p(eo10gma)20-pdpa112加入10ml的平底玻璃瓶中,用2mlph=2的pbs缓冲溶液溶解上述高分子混合物,然后用1mmnaoh溶液缓慢提高溶液的ph至7.2-7.4,不停震荡搅拌;由于pdpa具有ph响应,发生自组装后得到乳白色悬浊液;将上述乳白色悬浊液超声30-45分钟,利用针筒式过滤器(孔径<200nm)过滤,得到较为浑浊的白色悬浊液,即得高分子纳米囊泡。利用动态光散射(dls)和透射电子显微镜(tem)进行颗粒大小及形貌的表征。
本发明高分子纳米囊泡的用途,是将其作为中枢神经系统药物的载体,能够透过血脑屏障并在大脑内释放药物,从而可以用于中枢神经系统的靶向和疾病治疗。
所述中枢神经系统药物包括设计合成的环金属铂配合物pta2作为装载的模式药物,其特点具有分子量小易于装载,发光稳定,斯托克位移大,可以运用各类荧光技术(如活体成像仪、共聚焦等)进行定位表征;另外,铂类化合物的使用可以利用电感耦合等离子体质谱法对各个器官的药物运载进行精确分析。该新型配合物与上述双链高分子聚合物联用的载药系统易于诊疗一体化的评估。
所述中枢神经系统药物还包括经典小分子抗癌药物顺铂、紫杉醇等。
所述环金属铂配合物pta2的结构式如下所示:
所述环金属铂配合物pta2是通过包括如下步骤的方法制备获得:
步骤1:在250ml圆底烧瓶中依次加入主配体fa1(7-(对甲苯基)-5,6,8,9-四氢二苯并[c,h]吖啶)(0.53g,1.3mmol)、氯亚铂酸钾(0.41g,1.0mmol)及90ml冰乙酸,常温下搅拌,待配体全部溶解后升温至130℃,反应72h,反应液由无色缓慢转化为黄绿色固体;待反应结束后冷却至室温,抽滤,残渣依次用30ml乙醇、30ml丙酮及30ml去离子水洗涤2次,旋干溶液,得黄绿色固体即中间体;
步骤2:将所得黄绿色固体加入50ml圆底烧瓶中,用15ml二甲基亚砜溶解,升温至180℃反应30min,得橙黄色溶液;将所得溶液分散在水中得淡黄色固体,离心,收集滤渣,采用柱层析法提纯得铂配合物,层析分离液顺序为石油醚、石油醚:乙酸乙脂(v/v=20:1)、石油醚:乙酸乙脂(v/v=5:1),层析得橙红色粉末状固体pta2(0.32g),产率:53.2%。
环金属铂配合物pta2的分子结构和合成路线如下:
本发明高分子纳米囊泡的应用,是将其作为中枢神经系统药物的载体,能够透过血脑屏障并在大脑内释放药物,从而可以用于中枢神经系统的靶向和疾病治疗。药物的装载过程包括如下步骤:
称取19.4mg的p(eo10gma)20-pdpa112及0.6mg的angiopep-2-p(eo10gma)20-pdpa112加入10ml的平底玻璃瓶中,用2mlph=2的pbs缓冲溶液溶解上述高分子混合物,然后加入待装载药物,随后用1mmnaoh溶液缓慢提高溶液的ph至7.2-7.4,不停震荡搅拌;由于pdpa具有ph响应,发生自组装后得到乳白色悬浊液,将上述乳白色悬浊液超声30-45分钟,利用针筒式过滤器(孔径<200nm)过滤,即得高分子载药纳米囊泡。
所述待装载药物包括环金属铂配合物pta2、经典小分子抗癌药物顺铂、紫杉醇等,添加量为100μg/ml-1mg/ml。
人工合成的高分子聚合材料具有分子量可调控,易于生物受体的化学修饰,自组装大小易调节等特点。本发明通过将发光的金属铂配合物包埋后,制备成了具有诊断治疗一体的多功能纳米颗粒。
本发明高分子纳米囊泡用于活体研究后发现:
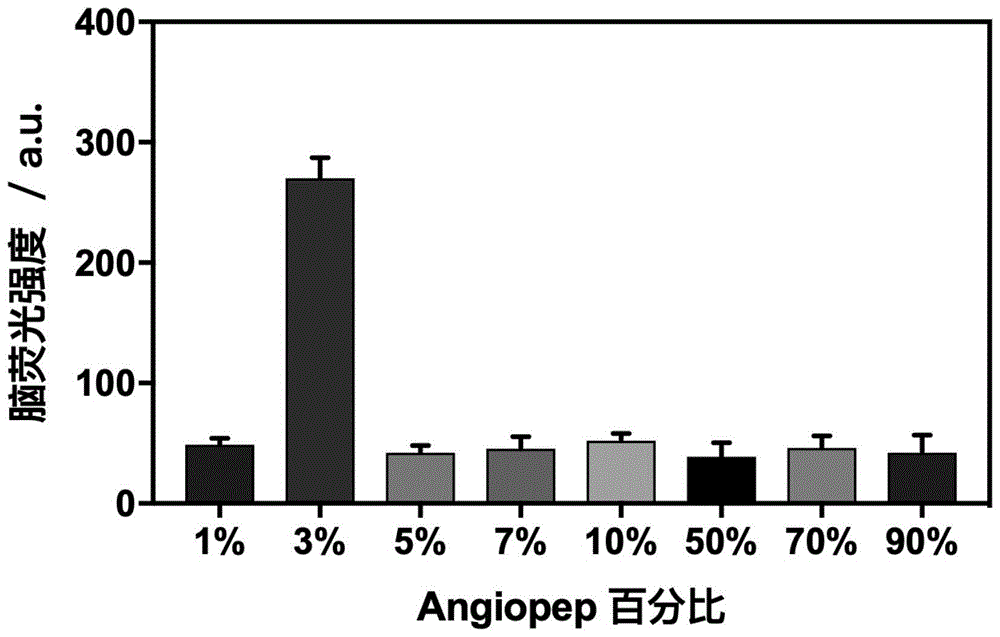
1、通过将双链高分子聚合物p(eo10gma)20-pdpa112和肽链修饰的angiopep-p(eo10gma)20-pdpa112进行不同配比的掺杂,筛选得到了可以高效透过血脑屏障的纳米囊泡(97:3)。动物实验表明在其它的配比下(99:1,5%95:5,93:7,90:10,50:50,30:70,10:90)均不具有脑靶向的功能(图1)。
2、筛选得到的可以高效透过血脑屏障的纳米囊泡(97:3),以及在此配比下得到的环金属铂化合物的载药囊泡,通过尾静脉注射进入小鼠体内,每次注射体积为200μl,高分子浓度约为1mg/ml,最终铂化合物浓度约为100μg/ml。小鼠分别在3小时,6小时,12小时,24小时后麻醉处死,心脏灌注,并取各个脏器进行切片及活体荧光成像观测。小鼠在此期间无明显不良反应。
本发明的有益效果体现在:
(1)本发明采用了肽链修饰后的双链高分子聚合物,通过和非肽链修饰的双链高分子聚合物精确配比(图1),为其进行精准医疗商品化提供了参考,并使之在生命科学研究领域具有广阔的应用前景。
(2)该体系大小均一并可控,具有较长的血液半衰期,定向靶向大脑的同时不在肾脏、肝脏内富集(图2),具有极小的毒副作用,其安全性为推进临床应用并开发相关的载药体系提供了较强的商业前景。
(3)该纳米囊泡成功的递送了发荧光的环金属铂类化合物至中枢神经系统,具备诊断治疗一体化的特点,可方便的通过小动物活体成像仪,观察到大脑的摄入量明显的高于其他器官的摄取量。(图3)大脑切片成像说明了被递送的药物成功的穿透了血脑屏障并富集在大脑的各个区域(图4)。目前市场上还不存在如此高效的大脑药物递送系统,具有很大的商业价值。
(4)该纳米囊泡体系制备步骤简单,原料易得,反应条件温和。为大规模商业生产提供了可能。
附图说明
图1是不同肽链配比的高分子囊泡经尾静脉注射3小时后,大脑在小动物活体成像仪下的荧光强度分析图。说明只有在肽链修饰的双链高分子聚合物添加比例为3%的情况下,该纳米囊泡才能显著触发血脑屏障的穿透。该结果为其进行精准医疗商品化提供了参考,并使之在生命科学研究领域具有广阔的应用前景。
图2是电感耦合等离子体质谱(icp-ms)分析纳米囊泡在不同器官的载药效率图。说明铂类化合物包裹在angiopep功能化3%的纳米囊泡中,通过尾静脉注射到小鼠体内并停留24小时,在此过程中小鼠没有出现明显的不良反应均存活。24小时后取不同器官的组织,干燥后测量等重组织内的铂含量。结果表明该纳米囊泡载药体系在肝脏,肾脏等组织没有富集,而可把大量药物输送至脑内。其安全性为推进临床应用并开发相关的载药体系提供了较强的商业前景。
图3是纳米囊泡系统装载环金属铂发光化合物,被小鼠摄取后各个器官的荧光强度实物图。将发光的铂化合物包裹在angiopep功能化3%的纳米囊泡中,通过尾静脉注射到小鼠体内并停留3和24小时,然后心脏灌注,取不同器官在小动物成像仪下成像。观察到大脑的亮度明显的高于其他器官的亮度。
图4是大脑切片的激光共聚焦照片。将注射过囊泡的小鼠大脑切片,a是标记了细胞核和被递送的铂化合物的切片。b在切片中将构成血脑屏障的毛细血管(绿色)用lectin标记,大脑切片成像说明了被递送的铂化合物(红色)成功的穿透了血脑屏障并富集在大脑的各个区域,使之在开发脑部靶向新药具有巨大的商业应用价值。
具体实施方式
以下通过具体的实施例对本发明技术方案作进一步分析说明。
实施例1:高分子纳米囊泡的制备
1、angiopep-2功能化p(eo10gma)20-pdpa112囊泡的制备
p(eo10gma)20-pdpa112双链高分子及angiopep-2连接的p(eo10gma)20-pdpa112)双链高分子根据文献合成(scientificreports,5,11990(2015))。
2、两种不同的双链高分子聚合物的掺杂
称取19.4mg的p(eo10gma)20-pdpa112及0.6mg的angiopep-2-p(eo10gma)20-pdpa112加入10ml的平底玻璃瓶中,用2mlph=2的pbs缓冲溶液溶解上述高分子混合物,然后用1mmnaoh溶液缓慢提高溶液的ph至7.2-7.4,不停震荡搅拌;由于pdpa具有ph响应,发生自组装后得到乳白色悬浊液;将上述乳白色悬浊液超声30-45分钟,利用针筒式过滤器(孔径<200nm)过滤,得到较为浑浊的白色悬浊液,即得高分子纳米囊泡。利用动态光散射(dls)和透射电子显微镜(tem)进行颗粒大小及形貌的表征。
实施例2:angiopep-2功能化p(eo10gma)20-pdpa112)囊泡在血脑屏障细胞模型的评估
利用人类大脑内皮细胞在transwell内建立三维血脑屏障模型,并利用跨膜电阻仪表征该三维血脑屏障模型的完整性。待该模型的跨膜电阻达到~1000ω/cm2,在该模型的上层加入步骤1得到的悬浊液200μl。3个小时后,通过共聚焦显微镜进行三维成像,观察囊泡在该模型上的穿透性。
实施例3:环金属铂化合物pta2的合成
在250ml圆底烧瓶中依次加入主配体fa1(0.53g,1.3mmol)、氯亚铂酸钾(0.41g,1.0mmol)及90ml冰乙酸,常温搅拌20min,待配体全部溶解后升温至130℃,反应72h,反应液由无色缓慢转化为黄绿色固体;待反应结束后冷却至室温,抽滤,残渣依次用30ml乙醇、30ml丙酮及30ml去离子水洗涤2次,旋干溶液,得黄绿色固体(中间体);将所得黄绿色固体倒入50ml圆底烧瓶中,用15ml二甲基亚砜溶解,升温至180℃反应30min,得橙黄色溶液。将所得溶液分散在水中得淡黄色固体。离心,收集滤渣,采用柱层析法提纯得铂配合物,层析分离液顺序为石油醚、石油醚:乙酸乙脂(v/v=20:1)、石油醚:乙酸乙脂(v/v=5:1),层析得橙红色粉末状固体pta2(0.32g),产率:53.2%。
pt-a2:1hnmr(400mhz,d6-dmso)δppm:7.46(t,j=8.1hz,2h),7.35(d,j=7.8hz,2h),7.23(d,j=8.0hz,2h),7.07(dd,j=15.3,8.0hz,2h),6.83(dd,j=31.1,7.5hz,2h),2.78(t,j=7.6hz,4h),2.53(d,j=5.0hz,10h),2.40(s,3h).13cnmr(100mhz,d6-dmso)δppm:164.50,159.43,146.55,137.52,135.81,134.02,132.01,129.23,128.24,126.03,123.49,27.05,24.42,20.19.ft-ir(kbr,ν,cm-1):3433,3037,2912,1603,1567,1390,1310,1244,1112,1016,765,685,450.hrms(esi-ms)m/z:calcdforc30h27nopts=644.69,found645.15([m+h]+)。
环金属铂配合物pta2的分子结构和合成路线如下:
实施例4:环金属铂配合物pta2(1mg/ml)的装载
称取19.4mg的p(eo10gma)20-pdpa112及0.6mg的angiopep-2-p(eo10gma)20-pdpa112加入10ml的平底玻璃瓶中,用2mlph=2的pbs缓冲溶液溶解上述高分子混合物,然后加入待装载药物,随后用1mmnaoh溶液缓慢提高溶液的ph至7.2-7.4,不停震荡搅拌;由于pdpa具有ph响应,发生自组装后得到乳白色悬浊液,将上述乳白色悬浊液超声30-45分钟,利用针筒式过滤器(孔径<200nm)过滤,即得高分子载药纳米囊泡。
实施例5:高分子纳米囊泡载药后对大脑的靶向
以实施例4制备的装载环金属铂配合物pta2的高分子纳米囊泡(1mg/ml)作为模式药物,构建诊疗一体化模型;利用三维血脑屏障模型,通过共聚焦显微镜观察囊泡在该模型上的递送药物的效率。图4是大脑切片的激光共聚焦照片。将注射过囊泡的小鼠大脑切片,a是标记了细胞核和被递送的铂化合物的切片。b在切片中将构成血脑屏障的毛细血管(绿色)用lectin标记,大脑切片成像说明了被递送的铂化合物(红色)成功的穿透了血脑屏障并富集在大脑的各个区域,使之在开发脑部靶向新药具有巨大的商业应用价值。
- 还没有人留言评论。精彩留言会获得点赞!