人干扰素-ε在肿瘤治疗中的应用的制作方法
本发明涉及肿瘤治疗技术领域,具体而言,涉及干扰素-ε在制备用于治疗肿瘤的药物中的应用。
背景技术:
当前,恶性肿瘤(癌症)已经成为严重威胁全球人群健康的主要公共卫生问题之一,根据最新的世界卫生组织(who)国际癌症研究机构(iarc)的统计数据显示,全世界罹患癌症的人数在“迅速增长”,仅2018年一年就新增1810万病例,死亡人数高达960万。到本世纪末,癌症将可能成为全球头号“杀手”。癌症仍是中国目前致死率最高的疾病之一。根据国家癌症中心发布的最新癌症数据,2015年中国恶性肿瘤发病约392.9万例,发病率为285.8/10万;死亡人数233.8万人,平均每分钟有7.5人被确诊为癌症。在过去的十余年里,我国癌症生存率呈逐渐上升趋势,目前癌症5年相对生存率约为40.5%。但与欧美发达国家相比还有很大差距。
黑色素瘤是世界上最具侵略性的皮肤癌,它是由黑色素基因突变引起的常见皮肤癌之一,可出现在人体的许多部位,如皮肤、眼睛、内耳、头颈。据统计,每2分钟约有一个人被诊断出患有黑色素瘤,每10分钟就有1人死于这种疾病。黑色素瘤在皮肤癌中具有极高的死亡率,是因为它更可能扩散到人体的其他部位,而普通的手术和化学疗法无助于提供帮助。尽管目前已经开发了许多药物和治疗方法,但是它们的功效,高成本和令人不快的副作用仍然是治疗黑素瘤的主要挑战。因此黑色素瘤仍然是人类主要的疾病负担之一。
宫颈癌是占女性中发生率和死亡率第二的癌症,2018年估计有570,000例新病例,占所有女性癌症的6.6%。宫颈癌死亡的大约90%发生在低收入和中等收入国家。尽管当前已经有疫苗可以预防常见的致癌类型的人乳头瘤病毒,并且可以大大降低患子宫颈癌的风险。但是对于已患宫颈癌的患者来说,治疗仍然是宫颈癌患者女性的一重要负担,因此,新的药物和治疗方案仍需不断的开发和完善。
干扰素是最早投放市场的基因药物,自1989年以来已经获得广泛的使用。国际上批准的治疗适应症约有数十种,自投入市场以来已经成为抗癌症和抗病毒最为广泛的药物之一,取得了巨大的社会效益和经济效益。干扰素是一种具有多种生物学活性的低相对分子质量糖蛋白,具有抗病毒、抗肿瘤、调节免疫活动及抑制细胞增殖等多种生物学功能,这些功能构成了动物机体内抵抗病原体的第一道防线。因此,干扰素已被广泛地用于各种疾病的治疗。根据干扰素的结构、理化性质、生物学性质(包括所在基因位置和与之结合的受体信号转导方式等)将干扰素分为两类:i型和ii型干扰素。干扰素-ε(interferonepsilon)是干扰素家族中较晚发现的成员,属于i型干扰素。虽然干扰素-ε与其他成员有一些共有的生物学作用,但又有着自身的特点。目前已经尝试用于病毒感染性疾病如尖锐湿疣、乙型肝炎、丙型肝炎等的治疗,
由于干扰素-ε发现较晚,对它的研究远不如其他同型的干扰素。在α、β等干扰素被广泛应用于临床治疗的情况下,对干扰素-ε的研究还停留在基础研究阶段,关于它的作用与机制目前还尚不完全明确。因此,探索干扰素-ε在抗肿瘤应用领域是具有重要临床意义的,特别是黑色素瘤。
鉴于此,特提出本发明。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供干扰素-ε在制备用于治疗肿瘤的药物中的应用。
作为进一步改进,干扰素-ε用于制备治疗肿瘤的药物的应用,为制备诱导先天免疫应答的激活剂的应用。
作为进一步改进,所述诱导先天免疫应答的激活剂包括用于激活i型和ii型干扰素信号传导途径。
作为进一步改进,用于制备治疗肿瘤的药物的应用,为制备oas2、oas1、oas3、ifi44l、ifi44、ifi3、ifi27、ifi6、ifit1、ifit5、ifih1、ifitm1、dhx58、ddx60、irf9、epsti1、isg15、helz2、herc6、stat1、rp11-572p18.1、rp11-468e2.4、parp9、parp12、parp14、samd9l、xage1e、epsti1、helz2、cmpk2、usp18、rec8、samhd1、plscr1中一种或者多种的基因表达的激活剂的应用;
或/和为制备txndc5、ac016739.2、rpl5p34、ube2q2p6中一种或者多种的基因表达的拮抗剂的应用。
作为进一步改进,作为上皮肿瘤治疗药物中的ifi27、ifi44l、ifi6、oas2、ifi44、isg15、samd9l、oas1、oas3、plscr1、parp9、ddx60、herc6、ifit1中一种或者多种的基因表达的激活剂的应用。
作为本发明的一种应用方式,所述肿瘤包括黑色素瘤。
作为本发明的一种应用方式,干扰素-ε在制备用于抑制黑色素瘤细胞增殖的抑制剂中的应用。
作为本发明的一种应用方式,干扰素-ε在制备用于促进黑色素瘤细胞凋亡的促进剂中的应用。
作为本发明的一种应用方式,干扰素-ε在制备用于促进黑色素瘤细胞核碎裂,形成凋亡小体的促进剂中的应用。
作为本发明的一种应用方式,有效剂量为100-1000ng/ml。
作为本发明的一种应用方式,有效剂量为500-1000ng/ml。
作为本发明的一种应用方式,有效剂量为800ng/ml。
本发明具有如下优点:本发明提供了干扰素-ε新用途,在肿瘤治疗中的应用,由于干扰素-ε在上皮细胞和粘膜组织的表达特性,我们发现干扰素-ε在用于治疗黑色素瘤有显著的效果。另外干扰素-ε虽然属于i型干扰素,但是我们发现了其能够通过调控i型和ii型干扰素信号传导途径,促进肿瘤免疫应答来用于抗肿瘤治疗。并且能够调控干扰素-ε可显著的抑制sk-mel103黑色素瘤细胞的增殖及改变肿瘤细胞的形态。因此,本发明提供了干扰素-ε在肿瘤治疗中的应用,为干扰素-ε在肿瘤尤其是以黑色素瘤为代表的实体瘤治疗的抗癌效应提供了一定的理论基础,同时也为肿瘤治疗尤其是以黑色素瘤为代表的实体瘤治疗提供了一种新的思路和治疗手段。
附图说明
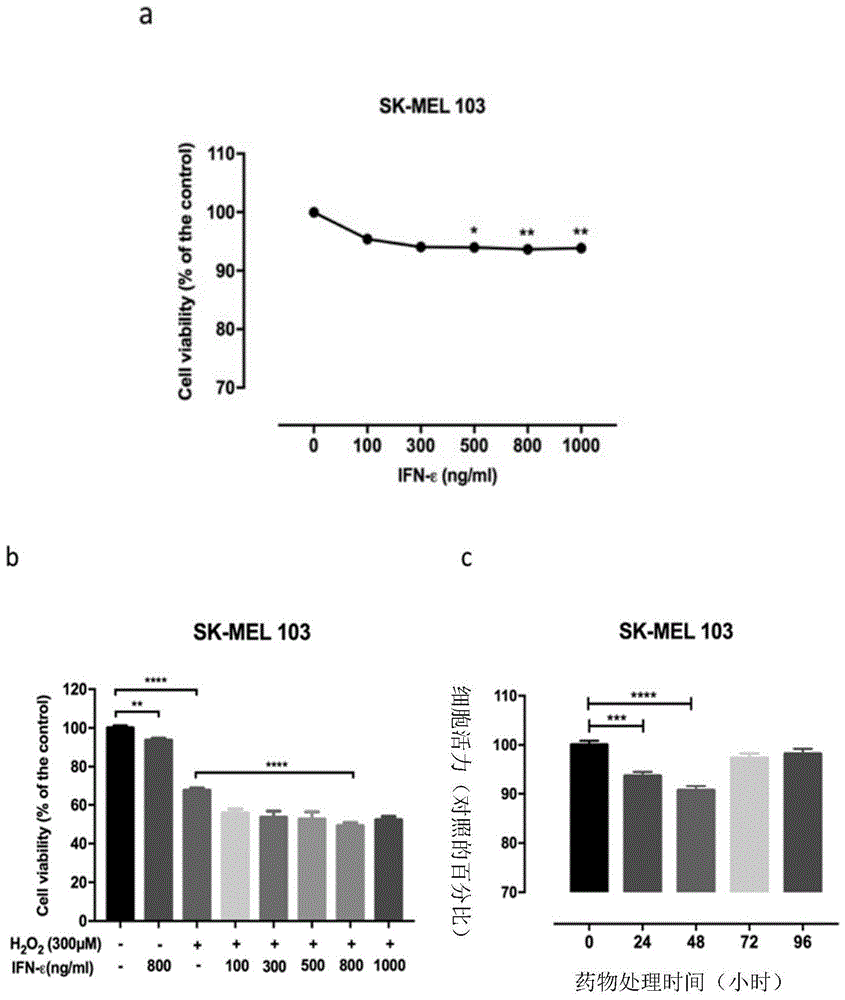
图1为本发明实施例1提供的干扰素-ε对黑色素瘤细胞的增殖影响结果,图1a不同浓度梯度干扰素-ε对黑色素瘤细胞增殖的影响;图1b为干扰素-ε与h2o2分别处理黑色素瘤细胞对其增殖的影响,图1c为干扰素-ε不同处理时间对黑色素瘤细胞增殖的影响;
图2为本发明实施例2提供的干扰素-ε对黑色素瘤细胞的形态变化图,用800ng/ml的干扰素-ε处理48小时后,通过设置200x放大率的倒置显微镜对细胞成像;标记表示(1)正常细胞,(2)核浓缩,(3)细胞收缩,(4)膜起泡,(5)细胞凋亡小体,(6)核碎裂,(7)起泡,(8)类棘突;
图3为归一化的箱形图,rna序列中读取计数的分布,纵坐标表示log2(归一化或非归一化计数),x轴表示各组,对照组(mcl,mc2,mc3)和实验组(mt1,mt2,mt3)。(a)非标准化读取计数的分布。(b)标准化读取计数的分布。
图4为实施例3差异表达基因的火山图,横坐标表示log2(倍数变化)值,纵坐标表示log10(padj)的平均表达值;
图5为实施例3差异表达基因的功能性分析,其中前面7条是富集的分子功能项(p<0.05),而后面17条是富集的生物过程;
图6为实施例3reactome途径的富集分析;
图7为实施例4差异表达基因的火山图,横坐标表示log2(倍数变化)值,纵坐标表示log10(padj)的平均表达值;
图8为实施例4差异表达基因的功能性分析,其中前面2条是富集的分子功能项(p<0.05),而后面6条是富集的生物过程;
图9为实施例4reactome途径的富集分析。
具体实施方式
下面将结合实施例和效果例对本发明做进一步的详述,而非限制本发明的范围,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。下面对本发明实施例的干扰素-ε在肿瘤治疗中的应用进行具体说明。
细胞系和主要试剂:
黑色素瘤细胞系(sk-mel103)使用dmem培养液(含5%胎牛血清)在37℃、5%c02孵箱内培养,重组人干扰素-ε(purity>90%)购于北美的bio-techno公司,并根据制造商的指导用无菌水制成250μg/ml制剂备用。
实施例1干扰素-ε对sk-mel103黑色素瘤细胞增殖的影响
wst法检测细胞增殖
为了优化干扰素-ε最佳剂量,使用wst-1细胞增殖和细胞毒性测定试剂盒(beyotime,上海)来评估细胞活力。将sk-mel103细胞以每孔2×103个细胞的密度接种到96孔细胞板中直至完全附着,然后用0至1000ng/ml浓度梯度的干扰素-ε处理细胞24小时,加入等体积的无菌水作为对照组(既control组)。向每个孔中加入10μlwst-1混合溶液,并在37℃的培养箱中培养4小时,并通过酶标仪(biotek,美国)来检测450nm的吸光度(od)值。绘制曲线图表示细胞活力情况。在细胞活力测试中,每组3孔,重复5次,结果以(平均值±标准误)表示。
图1a结果显示:用干扰素-ε(0-1000ng/ml)梯度处理sk-mel103黑色素瘤细胞24小时,暴露出干扰素-ε对黑素瘤细胞的最佳剂量(800ng/ml),例如,与对照组相比,被800ng/ml的干扰素-ε刺激24小时后导致细胞活力降低了7%(p<0.05)。
为了进一步验证干扰素-ε对细胞的抑制作用,将细胞用(0-1000ng/ml)梯度的干扰素-ε处理24小时后,再用300μm/l的h2o2孵育4小时。通过wst-1分析确定细胞活力。图1b数据表明:与对照组相比,单独使用干扰素-ε(800ng/ml)处理对黑素瘤细胞的活性仍具有明显的抑制作用(p<0.01)。有趣的是,与单独使用h2o2处理相比,用800ng/ml的干扰素-ε预处理后,再用300μm/lh2o2处理将细胞活力水平从67%显着降低到49%(p<0.0001)。与单独使用干扰素-ε处理时的7%相比,细胞活力的损失增加到11%(图1b)。这些结果表明干扰素-ε对黑素瘤细胞的增殖具有明显的抑制作用。
为了进一步研究干扰素-ε在不同处理时间点对黑素瘤细胞的影响,分别用800ng/ml干扰素-ε处理了黑色素瘤细胞24小时,48小时,72小时和96小时。图1c的数据表明:与对照组相比,干扰素-ε在48小时时对黑素瘤细胞的活力表现出最显着的抑制作用,被处理48小时后的细胞活力降低了约10%(p<0.0001)。综上所述,干扰素-ε可以抑制黑素瘤细胞系的增殖,且48小时的处理时间效果较为理想。
实施例2干扰素-ε对sk-mel103黑色素瘤细胞形态的影响
为了调查可能影响细胞增殖的原因,我们对癌细胞进行了形态变化检查。将1×104个细胞接种在35mm细胞培养皿(thermofisher)中,并孵育24小时。丢弃培养基后,将细胞用pbs(hyclonetm)洗涤两次。用1ml新鲜的完全培养基浸润细胞,并用800ng/ml干扰素-ε处理48小时,加入等体积的无菌水作为对照组(既control组)。通过使用200x放大率的倒置显微镜(nikon,japan)检查癌细胞的形态变化。所有实验被重复三次。
图2结果表明:与对照组相比,黑素瘤细胞发生了明显的形态变化。对照组(未处理)细胞的可视化结果表明细胞生长并附着良好。同时,细胞保持原始状态,只有少数细胞显示出核收缩状态。相比之下,用干扰素-ε(800ng/ml)处理的细胞在相同视野中的细胞数量显着减少,并且细胞形态暴露出典型的异常特征,例如核碎裂,凋亡小体,冒泡和类棘突棘突,尤其是凋亡小体的频率很高。这表明,干扰素-ε可以影响黑色素瘤细胞的形态,进而导致黑色素瘤细胞的凋亡。
实施例3干扰素-ε对黑色素瘤细胞基因表达水平的影响
黑色素瘤细胞的转录本丰度评估和差异表达分析在比较两组样品的表达谱之前,我们将所有样品归一化,结果如图3所示。归一化数据表明六个样品的归一化工作良好,并且表明数据适合于比较差异表达分析。比较对照组(mc)和治疗组(mt)的表达谱后,当倍数变化的阀值≥2时,我们成功鉴定了由31个上调基因和3个下调基因组成的34个差异表达基因(p<0.05)(图4a)。如图4b所示,当使用了更宽松的阀值(倍数变化≥1.5),可以鉴定出68个显着差异表达的基因,包括54个上调基因和14个下调基因。我们发现通过设置两个临界阀值所生成的两组基因基本相似。因此,我们决定使用严格阀值(倍数变化≥2)中设置的基因进行下游分析。
差异表达基因的火山图结果如图4所示,横坐标表示log2(倍数变化)值,纵坐标表示log10(padj)的平均表达值。34个差异表达基因具体如表1所示,干扰素-ε处理的黑色素瘤细胞中的31个上调基因中,我们发现了许多干扰素诱导的蛋白家族成员,包括oas2、ifi44l、ifi6、ifit1、ifi27、irf9、ifit3、ifi44和与先天性免疫相关的蛋白成员isg15,parp9和irf7等也被显着诱导。在干扰素诱导的蛋白质中,oas2和ifi44l表现出明显的诱导作用,变化约为16倍。oas2蛋白是dsrna激活的抗病毒酶,可通过激活rnasel介导抗病毒作用,引起细胞病毒rna降解,从而抑制蛋白合成并终止病毒复制。除此之外,据报道它在细胞过程如增殖,分化,凋亡和基因调控中起关键作用。oas2的有效诱导可能揭示干扰素-ε在抑制癌细胞增殖中的潜在功能。另一个基因表达明显上调的是xage1e,倍数变化约为10.24倍。该基因是xage家族的成员,在多种肿瘤例如乳腺癌,前列腺癌和许多类型的肺癌中高表达,包括鳞状细胞癌,小细胞癌,非小细胞癌和腺癌等。其他xage成员(如xage3)可能在抑制癌细胞生长中起作用。因此,用干扰素-ε处理黑色素瘤细胞后,xage1e基因表达明显上调,为癌症治疗提供了可能的候选药物或药物靶点。
表1
功能富集分析是为了更好地了解差异表达基因的功能,我们使用了geneontology(go)网站上的panther分类系统进行功能富集分析。我们的结果表明,与对照样品相比,干扰素-ε处理的黑色素瘤样品中的go分子功能和go生物学进展显著富集,如图5所示。对于生物学过程,最重要的术语是i型干扰素信号传导途径,分配了41%的基因。干扰素-γ介导的信号通路和病毒基因组复制的负调控,也得到了显着富集,分别占24%,21%和17%。此外,有10%的基因分配给先天免疫应答和其他i型或ii型信号通路(图5)。前五个最重要的基因与先天性抗病毒反应以及增殖,分化和基因调控最相关,这证明它们参与了介导肿瘤宿主免疫应答的多种机制。特别是,大多数与i型信号通路相关的基因,例如oas2、isg15、stat1、ifi6、irf9等,都参与介导癌症免疫应答的机制。这些结果表明,干扰素-ε通过诱导先天免疫对黑素瘤细胞产生作用,包括i型和ii型干扰素信号传导途径。对于分子功能,deg主要分配给结合和酶活性(图5)。最上面代表的是碳水化合物衍生物结合,核苷酸结合,嘌呤核糖核苷三磷酸结合和双链rna结合,分别占38%,38%,34%和21%。最上面代表的基因包括rna解旋酶活性,nad+adp-核糖基转移酶活性和2'-5'-寡腺苷酸合成酶活性分别映射为14%,l0%和10%。
为了进一步确定差异表达基因参与的途径,通过panther分类系统(geneontoly)和reactome途径注释对差异表达基因进行了分析。我们的分析表明,差异表达的基因(41%)大部分富含干扰素α/β信号传导,其次是ii型信号传导,ddx85/ifih1介导的干扰素α/β诱导作用以及isg15抗病毒机制(图6)。激活的干扰素信号传导可通过激活免疫反应的jak-stat途径发挥重要的抗癌作用。因此,该途径分析表明,干扰素-ε通过激活i型或/和ii型干扰素信号传导途径来调节免疫反应而杀死癌细胞。
实施例4干扰素-ε对宫颈癌瘤细胞基因表达水平的影响
宫颈癌细胞的转录本丰度评估和差异表达分析在比较两组样品的表达谱之前,我们将所有样品归一化,结果如图3所示。归一化数据表明六个样品的归一化工作良好,并且表明数据适合于比较差异表达分析。比较对照组(hc)和实验组(ht)的表达谱后,当倍数变化的阀值≥2时,我们成功鉴定了由17个上调基因和1个下调基因组成的18个差异表达基因(p<0.05)。
差异表达基因的火山图结果如图7所示,横坐标表示log2(倍数变化)值,纵坐标表示log10(padj)的平均表达值。
18个差异表达基因具体如表2所示,在干扰素-ε处理的宫颈癌细胞中的17个上调基因中,我们发现了许多干扰素诱导的蛋白家族成员,包括oas2,ifi27,ifi44l,ifi44l,ifi6,ifi27,ifit3,ifit5,ifitm1,ifi44和与先天性免疫相关的蛋白成员isg15和parp9等被显着诱导。在干扰素诱导的蛋白质中,ifi27和ifi44l表现出明显的诱导作用,倍数变化约为11.14-18倍。ifi27是i型干扰素的诱导蛋白,能够激活干扰素相关的通路来抑制癌细胞的增殖。此外,还显著诱导了isg15,samd9l,plscr1,parp9,ddx60,herc6等细胞因子和酶。这些细胞因子参与dna损伤修复,先天免疫应答,介导生长因子信号传导的下调以及细胞因子调节的细胞增殖和分化。同时,txndc5基因可以促进癌症的生长和细胞增殖。在干扰素-ε处理的宫颈癌细胞中,txndc5基因表达明显被下调,表明干扰素-ε通过下调txndc5基因表达来抑制癌症细胞的生长和增殖。
表2
功能富集分析为了更好地了解差异表达基因的功能,我们使用了geneontology(go)网站上的panther分类系统进行功能富集分析。我们的结果表明,与对照样品相比,干扰素-ε处理的宫颈癌样品中的go分子功能和go生物学过程显著富集,如图8所示。对于生物学过程,最重要的术语是病毒防御反应,分配了76%的基因。i型干扰素-γ介导的信号通路和病毒基因组复制的负调控,也得到了显着富集,分别占47%和41%。此外,有18%的基因分配给ii型信号通路(图8)。前五个最重要的基因与先天性抗病毒反应以及增殖,分化和基因调控最相关,这证明它们参与了介导肿瘤宿主免疫应答的多种机制。特别是,与i型和ii型干扰素信号通路相关的基因,例如oas2,isg15,ifi6等,都参与介导癌症免疫应答的机制。这些结果表明,干扰素-ε通过诱导先天免疫对宫颈癌细胞产生作用,包括i型和ii型干扰素信号传导途径。
为了进一步确定差异表达基因参与的途径,通过panther分类系统(geneontoly)和reactome途径注释对差异表达基因进行了分析。我们选择富集最多的两个途径来分析,分析表明,差异表达的基因(47%)大部分富含干扰素α/β信号传导,其次是ii型信号传导(18%)(图9)。激活的干扰素信号传导可通过激活免疫反应的jak-stat途径发挥重要的抗癌作用。因此,该途径分析表明,干扰素-ε通过激活i型或/和ii型干扰素信号传导途径来调节免疫反应而杀死癌细胞。
通过实施例3和实施例4,干扰素-ε作用黑色素瘤细胞和宫颈癌瘤细胞的调节基因对比后,两者具有14个相同的调节基因,如表3所示,进一步揭示了14个相同的调节基因通过诱导先天免疫应答作用于上皮肿瘤细胞。
表3
结论
从分子水平上来说干扰素-ε通过激活干扰素-/调控肿瘤信号传导途径来调节免疫反应而杀死癌细胞,特别是上皮肿瘤细胞,其中干扰素-ε调控oas、stat1、irf7和irf9基因的表达,富集干扰素-γ介导的信号传导途径和干扰素γ信号传导。干扰素-γ信号传导可诱导肿瘤缺血和体内稳态程序,从而导致肿瘤清除。
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!