一种经基因工程改造的抗肿瘤微颗粒的制备方法及应用与流程
本发明涉及抗肿瘤技术领域,具体为一种经基因工程改造的抗肿瘤微颗粒的制备方法及应用。
背景技术:
放射治疗是临床常规治疗肿瘤的有效治疗手段,肿瘤放射治疗是利用放射线产生的电离辐射来治疗肿瘤的一种局部治疗方法。大约70%以上的肿瘤患者在治疗的过程中需要用放射治疗,约有40%的癌症可以用放疗根治。放射治疗在肿瘤治疗中的作用和地位日益突出,已成为治疗恶性肿瘤的主要手段之一,尤其在头颈肿瘤、乳腺癌、肺癌和宫颈癌等一些肿瘤治疗中发挥着重要作用。但临床上有些肿瘤并不常规接受放射治疗,如胃癌、结肠癌、膀胱癌、肾癌,以及恶性胸腔积液(malignantpleuraleffusion,mpe)等。虽然采用粒子植入等肿瘤内照射方式可以扩大放疗的适应症,但对外科手术技能要求较高,且存在手术风险。另外,此种方式也无法针对mpe进行治疗。
基因工程(geneticengineering),又称基因拼接技术和dna重组技术,是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因按预先设计的蓝图,在体外构建杂种dna分子,然后导入宿主细胞,以改变生物原有的遗传特性、获得新的表征。本技术的主要工具包括酶(限制性核酸内切酶和dna连接酶)和载体(主要有质粒载体、噬菌体载体、ti质粒和人工染色体等),主要步骤为提取目的基因、目的基因与运载体结合、将目的基因导入受体细胞和目的基因的检测和表达。目前,基因工程技术在各个领域具有广泛的应用,尤其是医药卫生领域。基因工程药品(如基因工程胰岛素、基因工程干扰素等)是指将生物合成相应药物成分的基因导入微生物细胞内,让它们产生相应的药物后提取药物,在解决产量问题的同时可大大降低生产成本。基因治疗是把正常基因导入病人体内,使该基因的表达产物发挥功能,从而达到治疗疾病的目的,这是治疗遗传病的最有效的手段。但基因治疗技术尚未成熟,一些关键问题尚未解决,如如何选择有效的治疗基因等。
技术实现要素:
为解决以上问题,本发明提供了一种经基因工程改造的抗肿瘤微颗粒的制备方法、药剂及应用,该抗肿瘤微颗通过间接放疗并趋化免疫细胞至肿瘤微环境中以实现抗肿瘤,解决常规局部化疗效果差、副作用大、易产生耐药性、对机体免疫产生抑制的技术问题。
本发明是由以下技术手段实现的:
一种经基因工程改造的抗肿瘤微颗粒的制备方法,包括以下步骤:
s1构建过表达gm-csf和跨膜过表达gm-csf的质粒;
s2获得离体肿瘤细胞进行原代肿瘤细胞培养,并获得原代肿瘤细胞;
s3包装过表达gm-csf和跨膜过表达gm-csf的慢病毒颗粒;
s4用慢病毒颗粒对所述步骤s2得到的原代肿瘤细胞进行感染,得到过表达gm-csf和跨膜过表达gm-csf的原代肿瘤细胞;
s5将所述步骤s4得到的原代肿瘤细胞及培养液进行x线照射,收集放疗后的上清液,获得所需微颗粒和凋亡的肿瘤细胞碎片混合物;
s6将所述步骤s5得到的混合物进行离心,即得到所述基因工程改造的抗肿瘤微颗粒。
步骤s6中所述离心包括依次进行第一离心、第二离心、第三次离心所述第一离心的转速为1000g,时间为10分钟,得上清;第二离心的转速为14000g,时间为2分钟,得上清;第三次离心的转速为14000g,时间为60分钟,得沉淀即为微颗粒。
所述步骤s5的x线放射剂量为5-20gy,x线能量为6mv,所述上清液收集时间为放疗后的第2-7天。
所述肿瘤细胞系为小鼠肺癌细胞系lewis细胞,所述离体肿瘤细胞来自于实体瘤。
一种经基因工程改造的抗肿瘤微颗粒的制备方法制得的抗肿瘤微颗粒,所述经基因工程改造的抗肿瘤微颗粒为携载gm-csf的微囊泡结构,所述微囊泡结构的粒径为100-1000nm。
一种经基因工程改造的抗肿瘤微颗粒药剂,由所述的经基因工程改造的抗肿瘤微颗粒通过纯化和浓缩而获得。
一种经基因工程改造的抗肿瘤微颗粒的制备方法制得的经基因工程改造的抗肿瘤微颗粒在制备抗肿瘤药物中的应用。
有益效果
本发明提供了一种经基因工程改造的抗肿瘤微颗粒的制备方法及应用。
具备以下有益效果:
①对不能进行放射治疗的肿瘤,可以采用本技术制得药剂实现间接放疗;
②相较于放疗,本技术可通过静脉注射药剂,反复多次给药,可实现对转移瘤起到抑制作用;
③可有效趋化免疫细胞到肿瘤微环境中,促进抗肿瘤免疫的作用;
④自体来源的微颗粒制得的药剂具有较好的生物安全性和生物相容性;
⑤制备工艺简单,便于规模化生产;
⑥功能可扩展:自组装多肽材料可联合小分子靶向抑制剂,或直接再负载化疗药物直接杀伤肿瘤。
附图说明
图1为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒的电镜图;
图2为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒的粒径图;
图3为本发明所用质粒载体图谱;
图4为本发明所设计的核心质粒1目的基因序列;
图5为本发明所设计的核心质粒2目的基因序列;
图6为稳转肿瘤细胞膜表面gm-csf含量检测;
图7为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒整体gm-csf含量检测;
图8为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒表面gm-csf含量检测;
图9为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒的趋化作用小室图;
图10为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒的趋化作用统计图;
图11为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒治疗实体瘤过程中瘤体的体积统计图;
图12为本发明放疗产生微颗粒、膜gm-csf微颗粒和gm-csf微颗粒治疗实体瘤过程中小鼠的体重统计图;
图13为本发明膜gm-csf微颗粒治疗恶性胸腔积液过程中小鼠的生存统计图。。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
本发明涉及一种基于基因工程改造的可替代放射治疗进行间接放疗的抗肿瘤技术,其主要包括一种自体来源的经基因工程改造的抗肿瘤微颗粒的研制,所述抗肿瘤微颗粒由基因工程改造的肿瘤细胞受放射线处理所产生。所述经基因工程改造的抗肿瘤微颗粒,具有显著的抗肿瘤活性,可趋化免疫细胞达到肿瘤微环境,能提高抗肿瘤免疫,对实体瘤起到控制作用。所述经基因工程改造的抗肿瘤微颗粒完全来自肿瘤细胞自体,生物安全性和生物相容性好。经基因工程改造的抗肿瘤微颗粒也可以负载化疗药物和靶向药物,或者联合小分子靶向药物直接作用于肿瘤。
本发明的具体原理如下:
微颗粒(microparticle)是一种能被多种活细胞分泌,直径为100~1000nm,并广泛分布于多种体液中的微囊泡结构。近10年来研究发现微颗粒因为其富含蛋白质、dna、rna和脂质等生物活性分子而参与细胞之间的信号交流,微颗粒可以直接携带信号分子,也可以将肿瘤细胞的fas配体转移至t细胞从而介导免疫逃逸,甚至介导基因信息的传递。微颗粒适用于局部治疗,有研究将微颗粒包裹化疗药物治疗mpe取得了一定的效果,但是其抗肿瘤效果有限,其部分原因在于该微颗粒载体本身并无抗肿瘤效果。
细胞因子是由多种组织细胞(主要为免疫细胞)所合成和分泌的小分子多肽或糖蛋白,可介导细胞间的相互作用,具有多种生物学功能,如调节细胞生长、分化成熟、功能维持、调节免疫应答、参与炎症反应、创伤愈合和肿瘤消长等。细胞因子可被分为白细胞介素、干扰素、肿瘤坏死因子超家族、集落刺激因子、趋化因子、生长因子等类别。粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophagecolonystimulatingfactor,gm-csf)为集落刺激因子类,对髓系干细胞到成熟粒细胞的增殖与分化过程均有刺激作用。本发明利用基因工程技术,设计一种可使gm-csf表达在宿主细胞膜表面的重组质粒,将其包装成慢病毒颗粒后感染宿主细胞,使gm-csf在宿主细胞膜表面表达。微颗粒是真核细胞在活化或凋亡时从细胞膜表面剥落下来的囊泡状分泌物,其被认为是一种生物信息载体,可介导生物信息物质在不同类型细胞间的传递和交换。放疗能导致肿瘤细胞凋亡,因而也能促使肿瘤细胞分泌微颗粒。经基因工程改造的肿瘤细胞分泌的微颗粒膜上含有gm-csf,可有效地趋化免疫细胞,因此也具备较好的抗肿瘤效应。利用在体外放疗产生的微颗粒技术,可获得膜表面含有gm-csf的微颗粒,将这些微颗粒回输,将会为治疗肿瘤提供更有效和安全的局部治疗手段,进而实现间接放疗的目的。
一种经基因工程改造的抗肿瘤微颗粒的制备方法,包括以下步骤:
s1、构建过表达gm-csf和跨膜过表达gm-csf的重组质粒;
s2、获得离体肿瘤细胞进行原代肿瘤细胞培养,并获得原代肿瘤细胞;
s3、包装过表达gm-csf和跨膜过表达gm-csf的慢病毒颗粒;
s4、用慢病毒颗粒对所述步骤s2得到的原代肿瘤细胞进行感染,得到过表达gm-csf和跨膜过表达gm-csf的原代肿瘤细胞;
s5、将所述步骤s4得到的原代肿瘤细胞及培养液进行x线照射,收集放疗后的上清液,获得所需微颗粒和凋亡的肿瘤细胞碎片混合物;
s6、将所述步骤s5得到的混合物进行离心,即得到所述抗肿瘤微颗粒。
步骤s6中所述离心包括依次进行第一离心、第二离心、第三次离心,所述第一离心的转速为1000g,时间为10分钟,得上清;第二离心的转速为14000g,时间为2分钟,得上清;第三次离心的转速为14000g,时间为60分钟,得沉淀即为微颗粒。
所述步骤s5的x线放射剂量为5-20gy,x线能量为6mv,所述上清液收集时间为放疗后的第2-7天。
所述离体肿瘤细胞为自体来源的肿瘤细胞或肿瘤细胞系产生的肿瘤细胞。
所述离体肿瘤细胞来自于实体瘤。
一种经基因工程改造的抗肿瘤微颗粒的制备方法制得的经基因工程改造的抗肿瘤微颗粒,所述经基因工程改造的抗肿瘤微颗粒为携载gm-csf的微囊泡结构,所述微囊泡结构的粒径为100-1000nm。
一种经基因工程改造的抗肿瘤微颗粒药剂,由所述的经基因工程改造的抗肿瘤微颗粒通过纯化和浓缩而获得。
一种经基因工程改造的抗肿瘤微颗粒的制备方法制得的经基因工程改造的抗肿瘤微颗粒在制备抗肿瘤药物中的应用。
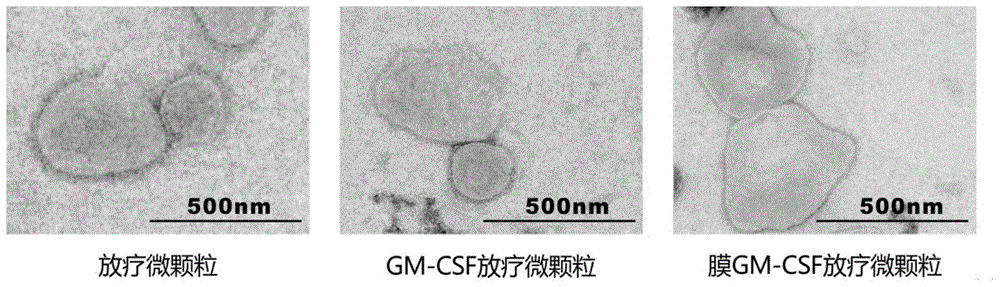
在使用放疗照射基因工程改造的肿瘤细胞后,细胞将分泌表面富含gm-csf的微颗粒。所得到的微颗粒具有抗肿瘤能力和趋化免疫细胞功能。本发明中,所述经基因工程改造的微颗粒保存抗肿瘤活性的储存条件为4℃和7天以内。本发明所述经基因工程改造的微颗粒结构如图1所示,粒径大小如图2所示。
下文结合实施例对本发明的效果作进一步解释和验证。
构建重组质粒并包装成慢病毒颗粒感染肿瘤细胞
在pubmed网站确定gm-csf的蛋白质编码区序列,在该序列前加上出膜信号肽,序列后加上跨膜区及sfb标签序列,插入pcdh-cmv-mcs-ef1-copgfp-t2a-puro质粒载体(如图3所示)的多克隆位点中,以构建可跨膜过表达gm-csf的核心质粒1(如图4所示)。在核心质粒2的基础上去掉跨膜区即构建过表达gm-csf的核心质粒2(如图5所示)。在10mm×10mm的培养皿中用10%fbs(胎牛血清)的培养基293t细胞,待皿中细胞密度约达50%时,更换10毫升新鲜培养基。取2个无菌、无rnase的ep管,其中一个加入opti-mem优化培养基1.5ml,向内加入30μl转染试剂pei,枪头轻轻吹打混匀后,室温静置5min。另一个ep管中同样加入opti-mem优化培养基1.5ml,向内加入核心质粒6μg、pspax2质粒4.5μg和pmd2.g质粒1.5μg,轻轻吹匀。将有转染试剂的ep管中液体加入有质粒的ep管中,轻轻吹匀,室温静置20min。将上述混合静置后的液体加入到293t细胞中,轻轻摇匀,放入培养箱中培养。24h后更换13ml培养基,继续培养48h后,将细胞上清用0.45μm过滤。在10mm×10mm的培养皿中用10%fbs(胎牛血清)的培养基lewis细胞,待皿中细胞密度约50%时,更换过滤所得上清5ml和新鲜培养基5ml,同时加入10μl基因转染增强剂polybrene,连续感染两天。用含有嘌呤霉素的培养基(1:1000)进行筛选,得到过表达gm-csf和膜过表达gm-csf的稳转肿瘤细胞。
过表达gm-csf和跨膜过表达gm-csf的稳转肿瘤细胞验证
将稳转肿瘤细胞消化成单细胞悬液离心并用1mlpbs(现配现用)重悬细胞并计数,调整细胞到合适浓度,转移至流式管中。向管中加入gm-csf荧光抗体,在冰上避光孵育30min(每10min混匀)后,加入3mlpbs,350g离心5min,此步骤重复2次。加入适量4%多聚甲醛,于室温避光固定30min后洗去,pbs重悬细胞等待流式上机检测。如图6所示,膜过表达gm-csf的稳转肿瘤细胞具有更高的gm-csf含量。
构建并bca定量具有趋化作用的放疗微颗粒以及保存方法
在10mm×10mm的培养皿中用10%fbs(胎牛血清)的培养基培养稳转肿瘤细胞,待皿中细胞达到约5×106个时,以20gy的剂量进行放疗,放疗后的第一天换液,加入20ml含10%fbs的培养基,第3天收集培养皿内所有液体采用梯度离心法提取微颗粒。取放疗后的细胞培养基1000g离心10min后取上清,再将上清14000g,离心2min去除碎片后弃沉淀,最后将上清14000g、4℃离心60min,弃上清,沉淀即是微颗粒,将沉淀再用生理盐水洗两遍,1mlpbs(即磷酸缓冲盐)溶液重悬后4℃保存,取100μl液体离心后,加入适量蛋白裂解液,冰上充分裂解30min后,12000g离心30min,取上清加入bca定量液进行蛋白定量。
经基因工程改造的微颗粒整体gm-csf含量检测
将定量的微颗粒裂解液与1/4裂解液体积的5×sdsloadingbuffer混匀,100℃加热10min。按配方制备12%分离胶和5%浓缩胶,在上样孔中加入蛋白样品,边缘孔加等体积的1×sds上样缓冲液。电泳时,浓缩胶80v恒压,待蛋白marker分开时,调电压至120v恒压。当电泳跑至溴酚蓝于分离胶底部时,结束电泳。把转膜液倒入铁盘中,并放入转膜夹。撬开玻璃板,用切胶板将所需目的蛋白根据marker的位置横切下来,置于黑胶面滤纸上,将用甲醇浸泡过的pvdf膜覆盖于胶上,夹紧夹子。将夹子放入转膜槽中,把铁盘中的转膜液倒入转膜槽里,夹子黑面对槽的黑面,把转膜槽放入装冰的泡沫盒中,选择200ma恒流转膜。2h后,将pvdf膜取出,用5%脱脂牛奶封闭液室温摇床上封闭1h。用1×tbst洗涤3遍,每遍10min,按照一定的稀释比用一抗稀释液配置一抗液,膜的蛋白面与抗体接触,放入4℃冰箱过夜。将膜在摇床上用1×tbst洗涤3遍,每遍10min,再与hrp标记的二抗(用5%脱脂牛奶稀释成1:5000)室温摇床孵育1h。将膜在摇床上用1×tbst洗涤3遍,每遍10min,配置ecl显影液(ecla:eclb=1:s1,将ecl显影液滴在膜上,用曝光仪曝光。如图7所示,gm-csf放疗微颗粒和膜gm-csf放疗微颗粒中均含有gm-csf。
经基因工程改造的微颗粒表面gm-csf含量检测
放疗微颗粒、膜gm-csf放疗微颗粒和gm-csf放疗微颗粒各30μg与10μl4μm直径的醛/硫酸乳胶珠在室温结合15min,加入1mlpbs,37℃轻微震荡2h,加入10nmol/l甘氨酸30min阻断反应,pbs洗涤3遍,500μlpbs重悬,加入gm-csf荧光抗体,避光孵育1h,pbs洗涤3次,等待流式上机检测。如图8所示,膜gm-csf放疗微颗粒表面具有更高的gm-csf含量。
经基因工程改造的微颗粒的趋化作用
transwell小室上室加入1×105个巨噬细胞,细胞悬液体积为200μl,下室中加入500μl分别含pbs、放疗微颗粒、膜gm-csf放疗微颗粒和gm-csf放疗微颗粒的培养基。将装有transwell小室的培养板置于37℃5%co2细胞培养箱,24h后取出小室,4%多聚甲醛固定细胞后,用结晶紫进行染色,棉签小心擦拭内层细胞,在显微镜下观察迁移细胞数。如图9和图10所示,膜gm-csf放疗微颗粒组细胞迁移数最多,充分证明了微颗粒表面gm-csf对免疫细胞有较强趋化能力。
经基因工程改造的微颗粒抗实体瘤的动物实验
建立c57小鼠皮下移植瘤模型:以每只鼠5×105个lewis细胞的接种量种植于c57小鼠皮下,待肿瘤体积达到约50mm3(大约8天)时,分别于第1天和第3天瘤内注射50μl的20gy放疗后第3天提取的微颗粒(5mg/kg)和pbs,于药物注射后当天开始每间隔两天测量肿瘤大小。如图11所示,膜gm-csf微颗粒组相较于gm-csf微颗粒组,其肿瘤体积明显缩小,充分证明了微颗粒表面有gm-csf可显著抑制肿瘤生长。如图12所示,各组小鼠体重无明显差别,说明各类型放疗微颗粒无明显的毒副作用。
经基因工程改造的微颗粒治疗恶性胸腔积液的动物实验
建立恶性胸腔积液模型:以每只鼠3×104个lewis-luc小鼠肺癌细胞的接种量接种于c57小鼠胸腔,控制进针深度为3.3mm,注射体积为50μl。于第8天时进行小动物活体成像证明造模成功后,胸腔分别注射50μl的稳转细胞20gy放疗后第3天提取的微颗粒(5mg/kg)和pbs,连续注射7天,观察老鼠的生存时间。如图13所示,膜gm-csf放疗微颗粒可显著延长小鼠的生存时间。
如图1所示,通过5-20gy、6mv的x射线放疗后的肿瘤细胞微颗粒电镜下的代表图,可见其为球形囊泡样结构,粒径约为500nm。
如图2所示,通过马尔文粒径分析仪,分析微颗粒的粒径,得出该微颗粒粒径分布在100-1000nm。
如图3所示,为pcdh-cmv-mcs-ef1-copgfp-t2a-puro载体质粒图谱。
如图4所示,为核心质粒一(膜过表达gm-csf)的目的基因序列。
如图5所示,为核心质粒二(过表达gm-csf)的目的基因序列。
如图6所示,采用流式检测小鼠肺癌细胞lewis稳定系的构建,证明膜过表达gm-csf的稳转肿瘤细胞膜表面具有更高的gm-csf含量。
如图7所示,采用westernblot检测不同微颗粒中sfb标签蛋白的含量,flag条带证明gm-csf放疗微颗粒和膜gm-csf放疗微颗粒中均含有gm-csf。
如图8所示,采用流式检测不同微颗粒表面gm-csf的含量,证明膜gm-csf放疗微颗粒表面具有更高的gm-csf含量。
如图9所示,采用小鼠来源的原代巨噬细胞,检测不同微颗粒对巨噬细胞的趋化作用,证明膜gm-csf放疗微颗粒组细胞迁移数最多。
如图10所示,采用小鼠来源的原代巨噬细胞,检测不同微颗粒对巨噬细胞的趋化作用,证明膜gm-csf放疗微颗粒组细胞迁移数最多。
如图11所示,用小鼠肺癌lewis细胞制作小鼠皮下移植瘤模型,采用普通lewis细胞和稳转lewis细胞释放的放疗微颗粒瘤内注射给药治疗,证明膜gm-csf放疗微颗粒对肿瘤的抑制效果最显著。
如图12所示,用小鼠肺癌lewis细胞制作小鼠皮下移植瘤模型,采用普通lewis细胞和稳转lewis细胞释放的放疗微颗粒瘤内注射给药治疗,证明各类型的放疗微颗粒对小鼠体重无影响。
如图13所示,用小鼠肺癌lewis-luc细胞制作小鼠胸水模型,采用pbs和稳转lewis细胞释放的放疗微颗粒进行胸腔灌注治疗,证明膜gm-csf放疗微颗粒可显著延长小鼠的生存时间。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!