一种修复损伤组织的干细胞因子脂质体及其制备方法与流程
本发明属于干细胞
技术领域:
,具体地说涉及一种修复损伤组织的干细胞因子脂质体及其制备方法。
背景技术:
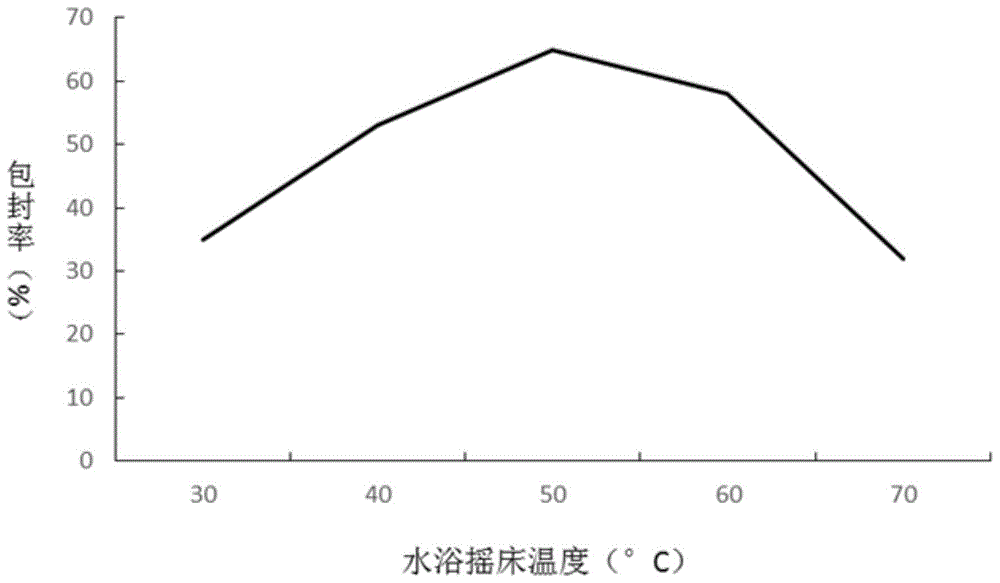
:脂肪间充质干细胞是脂肪组织中具有自我更新和多向分化潜能的细胞群,由于其获取方便,具有多向分化能力且体外增殖能力强,近年来在创伤愈合和组织修复过程中的作用日益受到研究者的重视。脂肪间充质干细胞能够主动迁移到组织损伤的部位,参与免疫调节和组织损伤修复,其中脂肪间充质干细胞旁分泌作用可以产生大量的可溶性干细胞因子促进组织损伤的修复,通常被认为是脂肪间充质干细胞参与组织损伤修复的主要机制。脂肪干细胞因子包括白介素,干细胞生长因子,血管内皮细胞生长因子,成纤维细胞生长因子,基质细胞衍生因子,胎盘生长因子,胰岛素样生长因子,存活素,粒细胞-巨噬细胞集落刺激因子等多种活性物质。其中多种物质是以外泌体等小泡的形式进行运输,但此类膜结构在提取过程中极易破损,导致对吸收效果有一定的不利影响。脂质体是由磷脂等类脂形成的双分子层的完全封闭的多层囊泡,其结构类似于细胞,脂质体膜与细胞膜的构成成分相似,可将它的膜插细胞膜的脂质层中而释放出水相包封物到细胞内,同时其吸附在细胞表面后仅在蛋白溶解酶的作用下才能与细胞脱离,这便使细胞周围的包封物的浓度升高,这样包封物可慢慢渗透到细胞内部。并且脂质体与细胞接触引起脂质体通透性的增加,脂质体包封物“接触释放”。这样释放的包封物在细胞膜附近形成高浓度。一般的干细胞因子制剂多是靠细胞的主动吸收及浓度依赖性的被动吸收,故吸收效率不高,因此制备一种吸收效率高,治疗效果好的干细胞因子制剂是目前急需解决的问题。因此,现有技术还有待于进一步发展和改进。技术实现要素:针对现有技术的种种不足,为了解决上述问题,现提出一种修复损伤组织的干细胞因子脂质体及其制备方法,该方法活性高,临床用量小,见效快,物毒副作用。为实现上述目的,本发明提供如下技术方案:一种修复损伤组织的干细胞因子脂质体的制备方法,包括以下步骤:步骤1、分离并培养犬脂肪源间充质干细胞;步骤2、将培养的犬脂肪源间充质干细胞消化后破碎,并通过离心、过滤和超滤获得干细胞提取液;步骤3、将预先制备的脂质体与干细胞提取液混合,进行超声处理,得到干细胞因子脂质体混悬液,加入丙酸钠混匀后进行过滤,得到干细胞因子脂质体溶液。优选的,所述步骤1中分离犬脂肪源间充质干细胞的具体步骤包括:从青年犬获得新鲜的肠系膜脂肪,加入2%双抗dpbs缓冲液浸泡清洗,剔除脂肪组织中的血管和筋膜并剪成小块,加入胰蛋白酶消化液,震荡消化后3000r/min离心去除上清液及漂浮脂肪,然后用室温dpbs混匀清洗沉淀层细胞,再次3000r/min离心去除上清液,用含10%fbs、100u/ml青霉素和100u/ml链霉素的mem培养液重悬沉淀细胞。优选的,对分离出的犬脂肪源间充质干细胞进行活力检测,其活细胞占比需≥95%。优选的,以10%fbs、100u/ml青霉素、100u/ml链霉素的mem培养液增殖传代,培养足量犬脂肪源间充质干细胞。优选的,所述步骤2具体包括:将犬脂肪源间充质干细胞用胰蛋白酶消化,3000r/min离心收集干细胞,用室温dpbs混匀清洗沉淀层细胞,再次3000r/min离心去除上清液,将分离得到细胞重悬于无菌生理盐水中,冰浴超声破碎细胞后,12000r/min,4℃离心,取上清弃沉淀,然后将上清先以0.22μm滤膜过滤除菌,再以5k超滤膜过滤浓缩,以生理盐水调节蛋白浓度,0.22μm滤膜过滤后4℃保存,所述,冰浴超声破碎细胞的条件为:超声强度40%超声3秒,间隔5秒,共超声8次。优选的,脂质体制备方法具体包括:称取0.4g大豆磷脂,0.05g胆固醇和0.1g吐温80溶于10ml无水乙醇中,超声使其充分溶解,在40-60℃水浴摇床的振荡下,将大豆磷脂,胆固醇和吐温80的混合物导入10ml10%硫酸铵溶液中,进进行60℃减压蒸发有机溶剂后,置于ph7.0的dpbs中透析24h形成脂质体。优选的,所述干细胞因子脂质体制备方法的具体包括:将制得的干细胞提取液缓慢加入预先制备的在40-60℃水浴摇床振荡下,向预先制备的脂质体中缓慢加入20ml步骤(4)中的干细胞提取液,保持40-60℃继续振荡30min;随后置于超声细胞粉碎机进行冰浴低温超声处理,使干细胞因子充分均匀地融合到脂质体中,从而得到干细胞因子脂质体混悬液;,按质量比加入0.5%-1%的丙酸钠充分混匀,再将其分别依次挤压过孔径为0.45μm、0.22μm的微孔滤膜,即得干细胞因子脂质体溶液。一种修复损伤组织的干细胞因子脂质体,所述干细胞因子脂质体由上述制备方法得到,所述干细胞因子脂质体包括脂质体以及包封于脂质体内的干细胞因子,所述干细胞因子为白介素、干细胞生长因子、血管内皮细胞生长因子、成纤维细胞生长因子、基质细胞衍生因子、胎盘生长因子、胰岛素生长因子、存活素或粒细胞-巨噬细胞集落刺激因子中的一种或几种。有益效果:本发明提供一种修复损伤组织的干细胞因子脂质体的制备方法,该方法能提升干细胞因子的吸收率,保护干细胞因子的活性,减少有效成分的损失,有效提高有效成分的利用率。本发明还提供一种修复损伤组织的干细胞因子脂质体,该制备体中干细胞因子为纯天然成分,应用安全,无毒副作用,无药物残留,活性高,临床用量小,见效快。附图说明图1是本发明具体实施例中一种修复损伤组织的干细胞因子脂质体的制备方法中水域摇床温度对脂质体包封率的影响;图2是本发明具体实施例中一种修复损伤组织的干细胞因子脂质体的制备方法中水域摇床温度对脂质体载药量的影响;图3是本发明具体实施例中一种修复损伤组织的干细胞因子脂质体对细胞增殖的影响。具体实施方式为了使本领域的人员更好地理解本发明的技术方案,下面结合本发明的附图,对本发明的技术方案进行清楚、完整的描述,基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的其它类同实施例,都应当属于本申请保护的范围。此外,以下实施例中提到的方向用词,例如“上”“下”“左”“右”等仅是参考附图的方向,因此,使用的方向用词是用来说明而非限制本发明创造。以下为本发明具体实施例:具体实施例1:从健康青年犬获得新鲜的肠系膜脂肪,然后转入到50ml无菌离心管中,用2%双抗dpbs缓冲液浸泡清洗三次;将清洗后的脂肪组织进行提纯,剔除其内部的血管与筋膜,获得高纯度脂肪组织;将高纯度脂肪组织剪成1mm3小块,并转入50ml无菌离心管中,加入10ml0.25%的胰蛋白酶消化液,37℃震荡消化30分钟;将消化后的脂肪组织3000r/min离心10分钟后取出上清液,在所取出的上层清液中加入含有10%fbs、100u/ml青霉素和100u/ml链霉素的5mlmem培养液重悬沉淀细胞,获得重悬细胞液。对分离出来的重悬细胞液中加入等体积的0.4%台盼蓝溶液;将混合后的物质以cellometer·mini全自动细胞计数仪检测活细胞比例;若活细胞比例小于95%则不合格需要重新分离犬脂肪源间充质干细胞,若活细胞比例大于等于95%则合格,将合格的重悬细胞液用含有10%fbs、100u/ml青霉素和100u/ml链霉素的5mlmem培养液将细胞密度调整至1×105个/ml;将5ml细胞密度调整后的细胞培养与接在t25细胞培养瓶内,移入培养箱中,将培养箱设置37℃,5%co2,饱和湿度条件进行培养;培养48小时后换液,取出无法贴壁的其他种类细胞,然后每隔72h更换mem培养液;当细胞生长至80%融合后,用0.25%的胰蛋白酶消化2min,然后用mem培养液终止消化;将终止消化后的物质反复吹匀制成细胞悬液后按1:3传代,重复此操作反复传代扩增并收集,培养出足量的犬脂肪源间充质干细胞。将增殖传代培养后的脂肪源间充质干细胞用0.25%的胰蛋白酶进行消化后,3000r/min离心10min收集干细胞;用10ml室温dpbs缓冲液混匀清洗沉淀层细胞后,3000r/min离心10分钟取出上清液,重复三次;将细胞重悬于无菌生理盐水中,然后对重悬于生理盐水中的细胞进行冰浴超声破碎细胞,具体方法为使用强度40%的超声3s/次,共进行8次,每次间隔5s;将破碎后的细胞12000r/min离心10min,整个离心过程控制在4℃,然后取上层清液;将所得上层清液以0.22微米滤膜过滤除菌,再以5k超滤膜过滤浓缩;浓缩后,用bca试剂盒检测蛋白浓度,用生理盐水调节蛋白浓度至300微克/毫升,然后用0.22微米滤膜过滤后4℃保存该干细胞提取液。称取0.4g大豆磷脂,0.05g胆固醇和0.1g吐温80溶于10ml无水乙醇中,超声使其充分溶解;在40℃水浴摇床的振荡下,将大豆磷脂,胆固醇和吐温80的混合物导入10ml10%硫酸铵溶液中,进而置于圆底烧瓶中;将溶液进行60℃减压蒸发去出有机溶剂后,置于ph7.0的dpbs中透析24h形成脂质体。将透析后的脂质体放入40℃的水浴摇床的振荡,然后缓慢加入制备好的干细胞提取液20ml,加入完成后,继续保持40℃振荡30min;用超声波粉碎机进行冰浴超声处理,超声波条件为,超声强度40%,超声3s,间隔5s,共作用20min,使干细胞因子充分均匀的融合到脂质体中,获得干细胞因子脂质体混悬液;按质量比加入0.5%-1%的丙酸钠充分混匀,再将其依次挤压过孔径为0.45μm、0.22μm的微孔滤膜,各重复三次,即得干细胞因子脂质体溶液,4℃保存。具体实施例2:本实施例与具体实施例1相同部分不再赘述,不同之处在于称取0.4g大豆磷脂,0.05g胆固醇和0.1g吐温80溶于10ml无水乙醇中,超声使其充分溶解;在50℃水浴摇床的振荡下,将大豆磷脂,胆固醇和吐温80的混合物导入10ml10%硫酸铵溶液中,进而置于圆底烧瓶中;将溶液进行50℃减压蒸发去出有机溶剂后,置于ph7.0的dpbs中透析24h形成脂质体。将透析后的脂质体放入50℃的水浴摇床的振荡,然后缓慢加入制备好的干细胞提取液20ml,加入完成后,继续保持50℃振荡30min;用超声波粉碎机进行冰浴超声处理,超声波条件为,超声强度40%,超声3s,间隔5s,共作用20min,使将干细胞因子充分均匀的融合到脂质体中,获得干细胞因子脂质体混悬液;按质量比加入0.5%-1%的丙酸钠充分混匀,再将其依次挤压过孔径为0.45μm、0.22μm的微孔滤膜,各重复三次,即得干细胞因子脂质体溶液,4℃保存。具体实施例3:本实施例与具体实施例1相同部分不再赘述,不同之处在于:称取0.4g大豆磷脂,0.05g胆固醇和0.1g吐温80溶于10ml无水乙醇中,超声使其充分溶解;在60℃水浴摇床的振荡下,将大豆磷脂,胆固醇和吐温80的混合物导入10ml10%硫酸铵溶液中,进而置于圆底烧瓶中;将溶液进行60℃减压蒸发去出有机溶剂后,置于ph7.0的dpbs中透析24h形成脂质体。将透析后的脂质体放入60℃的水浴摇床的振荡,然后缓慢加入制备好的干细胞提取液20ml,加入完成后,继续保持60℃振荡30min;用超声波粉碎机进行冰浴超声处理,超声波条件为,超声强度40%,超声3s,间隔5s,共作用20min,使将干细胞因子充分均匀的融合到脂质体中,获得干细胞因子脂质体混悬液;按质量比加入0.5%-1%的丙酸钠充分混匀,再将其依次挤压过孔径为0.45μm、0.22μm的微孔滤膜,各重复三次,即得干细胞因子脂质体溶液,4℃保存。具体实施例4:本实施例与具体实施例1相同部分不再赘述,不同之处在于:称取0.4g大豆磷脂,0.05g胆固醇和0.1g吐温80溶于10ml无水乙醇中,超声使其充分溶解;在30℃水浴摇床的振荡下,将大豆磷脂,胆固醇和吐温80的混合物导入10ml10%硫酸铵溶液中,进而置于圆底烧瓶中;将溶液进行30℃减压蒸发去出有机溶剂后,置于ph7.0的dpbs中透析24h形成脂质体。将透析后的脂质体放入30℃的水浴摇床的振荡,然后缓慢加入制备好的干细胞提取液20ml,加入完成后,继续保持30℃振荡30min;用超声波粉碎机进行冰浴超声处理,超声波条件为,超声强度40%,超声3s,间隔5s,共作用20min,使将干细胞因子充分均匀的融合到脂质体中,获得干细胞因子脂质体混悬液;按质量比加入0.5%-1%的丙酸钠充分混匀,再将其依次挤压过孔径为0.45μm、0.22μm的微孔滤膜,各重复三次,即得干细胞因子脂质体溶液,4℃保存。具体实施例5:本实施例与具体实施例1相同部分不再赘述,不同之处在于:称取0.4g大豆磷脂,0.05g胆固醇和0.1g吐温80溶于10ml无水乙醇中,超声使其充分溶解;在70℃水浴摇床的振荡下,将大豆磷脂,胆固醇和吐温80的混合物导入10ml10%硫酸铵溶液中,进而置于圆底烧瓶中;将溶液进行70℃减压蒸发去出有机溶剂后,置于ph7.0的dpbs中透析24h形成脂质体。将透析后的脂质体放入70℃的水浴摇床的振荡,然后缓慢加入制备好的干细胞提取液20ml,加入完成后,继续保持70℃振荡30min;用超声波粉碎机进行冰浴超声处理,超声波条件为,超声强度40%,超声3s,间隔5s,共作用20min,使将干细胞因子充分均匀的融合到脂质体中,获得干细胞因子脂质体混悬液;按质量比加入0.5%-1%的丙酸钠充分混匀,再将其依次挤压过孔径为0.45μm、0.22μm的微孔滤膜,各重复三次,即得干细胞因子脂质体溶液,4℃保存。实施例1-实施例5中水域摇床温度对脂质体包封率的影响如图1所示,对比可知水域摇床温度为50℃时,脂质体对干细胞因子包封率最高,温度升高或降低则包封率均有不同程度下降。实施例1-实施例5中水域摇床温度对脂质体载药量的影响如图2所示,对比可知水浴摇床温度为50℃时,脂质体对干细胞因子载药量最大,温度升高或降低则载药量均有不同程度下降。具体实施例6:损伤组织修复效果实验:选取12只3岁比格犬,随机分为三组,第一组为对照组,使用生理盐水治疗;第二组为正常治疗组,用碘酊治疗;第三组为干细胞治疗组,使用本发明的犬脂肪源间充质干细胞因子脂质体。将所有实验犬用3%戊巴比妥钠静脉麻醉,背部剃毛消毒,手术在其背部制作直径为2cm的圆形创面,深度为贯穿皮肤全层,但不触及肌肉,每天早晚两次于创面按照组别涂抹对应治疗剂,并以粘贴型无菌敷料保护伤口,在施用治疗后的4,8,12,20天测量其创面大小并依靠图像分析仪测定其创面面积。按照(原创面面积-剩余创面面积)/原创面面积代表其愈合速度,表一为犬皮肤损伤后愈合面积百分比的治疗结果。表一:犬皮肤损伤后愈合面积百分比组别4天8天12天20天对照组26±1.933±6.031±7.669±4.3正常治疗组29±3.138±1.353±2.077±5.8干细胞治疗组30±1.248±4.768±3.590±0.6实验结果表明,创面在以犬脂肪源间充质干细胞因子脂质体涂抹后,其愈合速度明显增快。第8日即与对照组产生明显差异,在20日时,干细胞治疗组已痊愈,而正常治疗组的创面尚未完全愈合。利用本发明的犬脂肪源间充质干细胞因子脂质体可有效促进犬损伤部位的皮肤修复,具有良好的临床应用前景。具体实施例7:干细胞因子脂质体对细胞增殖的影响:取4-6周龄icr小鼠,常规脱颈处死,无菌取出小鼠脾脏,将脾脏置于盛有hank’s液的平皿中,轻轻洗涤并剥去周围结缔组织;用少量hank’s液润湿200目细胞筛,再将脾脏移入其中;用剪刀对脾脏剪碎处理,再用研磨器轻轻研磨,使脾细胞透过细胞筛进入hank’s液中,再加入少许hank’s液,并用吸管吹打数次,制成单细胞悬液;取适量脾淋巴细胞悬液于离心管内,以1500r/min离心8min,弃去上清,加入等体积红细胞裂解液,以1500r/min离心8min,同样弃去上清,收集沉淀,再经hank’s反复洗涤2次,即得所需的脾淋巴细胞;细胞计数,用rpmi1640完全培养液调节细胞密度至4.0×106个/ml;将细胞悬液加到96孔细胞板中,100μl/孔,每孔中分别加入80μl/孔由50℃水浴摇床制备而成的干细胞因子脂质体,对应浓度的干细胞因子和空白脂质体,每个浓度重复8孔,另设空白对照孔;然后置于37℃,5%co2条件下培养44h,取出每孔加入mtt30μl,继续培养4h后,吸去上清液,每孔再加裂解液dmso100μl,将细胞板置于微量震荡器震荡5min,使沉淀完全溶解,在酶联免疫仪上检测a570值,做为细胞增殖的指标。由图3所示干细胞因子脂质体对细胞增值的影响可得出干细胞因子脂质体对于细胞增殖具有显著效果。以上已将本发明做一详细说明,以上所述,仅为本发明之较佳实施例而已,当不能限定本发明实施范围,即凡依本申请范围所作均等变化与修饰,皆应仍属本发明涵盖范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1