一种含西达本胺的抗肿瘤药物组合物及其应用的制作方法
一种含西达本胺的抗肿瘤药物组合物及其应用
[0001]
本申请要求于2019年08月15日提交中国专利局、申请号为201910754966.7、发明名称为“一种含西达本胺的抗肿瘤药物组合物及其应用”的中国专利申请的优先权,其全部内容通过引用结合在本申请中。
技术领域
[0002]
本发明涉及医药领域,具体涉及一种含西达本胺的抗肿瘤药物组合物及其应用。
背景技术:
[0003]
西达本胺具有下式(1)结构,其化学名称为n-(2-氨基-4-氟苯基)-4-[n-[(e)-3-(3-吡啶)丙烯酰基]氨甲基]苯甲酰胺。
[0004][0005]
西达本胺是深圳微芯生物科技股份有限公司独家发现的新分子实体药物,机制新颖,是全球首个亚型选择性组蛋白去乙酰化酶(hdac)抑制剂和全球首个获批治疗外周t细胞淋巴瘤的口服药物,属于表观遗传调控剂类药物。
[0006]
西达本胺具有对肿瘤发生发展相关的表观遗传异常的重新调控作用,作用于表观遗传相关靶点-组蛋白去乙酰化酶(第i类的1、2、3亚型和第iib类的10亚型)。组蛋白去乙酰化酶(hdac)是一类对染色体的结构修饰和基因表达调控发挥重要作用的蛋白酶,西达本胺作为hdac抑制剂,通过抑制hdac的生物学活性产生作用,并由此产生针对肿瘤发生的多条信号传递通路基因表达的改变(即表观遗传改变)。
[0007]
alk(间变性淋巴瘤激酶,anaplastic lymphoma kinase)基因是一种跨膜受体酪氨酸激酶,可在多种恶性肿瘤中发生变异或与其他癌基因融合,是肿瘤的致癌驱动基因。alk可激活多个细胞内信号通路,包括磷脂酶cγ,jak激酶、信号转导和转录激活因子(signaltransducer and activator of transcription-3,stat3)、磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,pi3k)、哺乳动物雷帕霉素靶蛋白(mammaliantarget of rapamycin,mtor)及丝裂原活化蛋白激酶(mitogen-activated protein kinase,mapk)等,参与调节细胞生长、转化及抗细胞凋亡。在多种肿瘤中均发现了alk基因重组、突变或扩增,包括淋巴瘤、神经母细胞瘤及非小细胞肺癌。近年来靶向alk融合基因已成为nsclc治疗的前沿手段,第一、二、三代alk酪氨酸激酶抑制剂治疗alk阳性的nsclc显示出较好的疗效,但仅在一定时间内对特定人群有效。alk抑制剂包括克唑替尼(crizotinib)、色瑞替尼(ceritinib)及艾乐替尼(alectinib)等。
[0008]
细胞间质上皮转换因子(cellular-mesenchymal epithelial transition factor,c-met),又被称为肝细胞生长因子受体(hepatocyte growth factor receptor,
hgfr),是受体酪氨酸激酶家族中一类独特的亚族。c-met信号通路对胚胎发育和产后器官再生期间的侵袭性生长具有关键作用。通常成人只有在伤口愈合和组织再生的过程中c-met信号通路才被完全激活,但肿瘤c-met信号通路能被癌细胞频繁激活,促使肿瘤形成、侵袭性生长和转移。据报道,c-met信号通路在多种类型的实体瘤(肺癌、胃癌、肝癌、乳腺癌、皮肤癌、大肠癌等)中均存在异常调节的现象,并且在结直肠癌肝转移,口腔鳞癌的形成、生长、转移,乳腺癌、卵巢癌和胃癌的侵袭、转移,以及肝癌、肺癌和胰腺癌等的发生发展中发挥重要的作用。由于异常的c-met信号在人类肿瘤形成、侵袭和转移中的重要作用。因此,抑制c-met信号成为癌症治疗的重要策略。c-met抑制剂包括厄洛替尼、吉非替尼(gefitinib)、卡博替尼、戈伐替尼、福瑞替尼、替伐替尼、克唑替尼和卡扎替尼等。
[0009]
ros1(c-ros原癌基因1,c-ros oncogene 1)融合基因是rikova等于2007年首次在肺腺癌患者组织中分离出的靶基因,发生率约占nsclc的1.0%~3.4%。尽管罕见,ros1作为新的肺癌驱动基因,被证实为有潜力的nsclc治疗新靶点。ros1酪氨酸激酶作为一个关键的跨膜受体蛋白酪氨酸激酶,控制细胞凋亡、生存、分化及增殖等多个细胞进程,对多种恶性肿瘤的治疗有重要作用。近年来,一些靶向ros1小分子抑制剂被相继报道,ros1抑制剂包括克唑替尼、色瑞替尼、brigatinib、azd-3463、nvp-tae684、foretinib和cabozantinib等,2-氨基嘧啶类、4-芳氨基喹啉类等化合物相继被报道具有较强的ros1激酶抑制活性,此外,一些选择性ros1抑制剂也被开发出来。
[0010]
克唑替尼(crizotinib)具有下式(2)结构,其化学名称是:3-[(r)-1-(2,6-二氯-3-氟苯基)乙氧基]-5-[1-(吡啶-4-基)-1h-吡唑-4-基]吡啶-2-胺。
[0011][0012]
克唑替尼是由辉瑞公司研制的抑制met/alk/ros的atp竞争性的多靶点蛋白激酶抑制剂。分别在alk、ros和met激酶活性异常的肿瘤患者中证实克唑替尼对人体有显著临床疗效。克唑替尼2011年被美国fda批准用于治疗间变性淋巴瘤激酶(alk)阳性的nsclc晚期患者的小分子靶向药物,已在临床应用于alk阳性非小细胞肺癌的治疗。克唑替尼靶向作用于alk蛋白,抑制其酪氨酸激酶域的磷酸化,使其不能活化,从而调控下游信号蛋白pi3k、akt和mtor的活化形式p-pi3k、p-akt和p-mtor的表达。
[0013]
目前,未见有将西达本胺与c-met抑制剂、间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)抑制剂或repressor of silencing 1(ros1)抑制剂联合应用已用于肿瘤治疗的研究。
技术实现要素:
[0014]
本发明人在研究中意外发现:将西达本胺与c-met/alk/ros1抑制剂联用,可实现协同抗肿瘤作用。
[0015]
因此,本发明提供了一种含西达本胺的抗肿瘤药物组合物,它含有西达本胺和c-met抑制剂,或者含有西达本胺和间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)抑制剂,或者含有西达本胺和repressor of silencing 1(ros1)抑制剂。
[0016]
所述c-met抑制剂包括而不限于crizotinib、cabozantinib、tivantinib、glumetinib等具有c-met抑制活性的药物。
[0017]
所述alk抑制剂包括而不限于ceritinib、alectinib、crizotinib、brigatinib、repotrectinib、entrectinib、lorlatinib等具有alk抑制活性的药物。
[0018]
所述ros1抑制剂包括而不限于crizotinib、brigatinib、repotrectinib、entrectinib、lorlatinib等具有ros1抑制活性的药物。
[0019]
所述西达本胺和c-met抑制剂的重量比为1:1~1:5。
[0020]
所述西达本胺和alk抑制剂的重量比为1:1~1:5。
[0021]
所述西达本胺和ros1抑制剂的重量比为1:1~1:5。
[0022]
本发明的上述药物组合物还可包含药学上可接受的载体。
[0023]
同时,本发明还提供了上述药物组合物在制备治疗c-met或alk或ros1发生基因扩增、重排、过表达或其他形式突变等的恶性肿瘤的药物中的用途。
[0024]
所述恶性肿瘤包括而不限于肺癌、胃癌、肝癌、乳腺癌、皮肤癌、肠癌、卵巢癌、胰腺癌、淋巴瘤、神经母细胞瘤。
[0025]
进一步的,本发明提供了一种药盒,它含有上述药物组合物。
[0026]
本发明的药盒中,所述西达本胺与c-met抑制剂、alk抑制剂或ros1抑制剂分别是具有相同或不同规格的单位制剂。所述西达本胺与c-met抑制剂、alk抑制剂或ros1抑制剂分别置于单独容器中提供。所述西达本胺分别与c-met抑制剂、alk抑制剂或ros1抑制剂的重量比为1:1~1:5。
[0027]
最后,本发明提供了一种治疗恶性肿瘤的方法,其包括向有需要的患者施用治疗有效量的上述药物组合物或药盒的步骤。其中,所述西达本胺与c-met抑制剂、alk抑制剂或ros1抑制剂同时、分别或依次给药。
[0028]
本发明经mts实验发现,组蛋白去乙酰化酶抑制剂西达本胺和c-met/alk/ros1抑制剂克唑替尼的联合给药能够在肺癌细胞系calu-3、hcc827、nci-h460,胃癌细胞系ags和淋巴瘤细胞系karpas-299中产生协同抑制效果,即两药联合时对肿瘤细胞的抑制作用强于两药单独应用所产生抑制作用之和。同时在hcc827和karpas-299裸鼠移植瘤模型上验证了西达本胺和克唑替尼联用的协同抗肿瘤药效。
附图说明
[0029]
图1:在肺癌细胞系中西达本胺协同增敏c-met/alk/ros1抑制剂(克唑替尼);
[0030]
图2:在胃癌、淋巴瘤细胞系中西达本胺协同增敏c-met/alk/ros1抑制剂(克唑替尼);
[0031]
图3:在裸鼠动物试验中西达本胺与c-met/alk/ros1抑制剂(克唑替尼)联合给药
的协同抗肿瘤药效。
具体实施方式
[0032]
本发明公开了西达本胺和c-met/alk/ros1抑制剂的组合及其在治疗癌症中的用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述应用和药用组合物已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述应用和药用组合物进行改动或适当变更与组合,来实现和应用本发明技术。
[0033]
实验部分
[0034]
实验材料:
[0035]
人肺癌细胞系calu-3、hcc827、nci-h460,人胃癌细胞系ags和人淋巴瘤细胞系karpas-299均购自美国典型培养物保藏中心(american type culture collection,atcc),于37℃,5%co2条件下常规培养,其中,hcc827、nci-h460和karpas-299的培养液为含10%胎牛血清(fetal bovine serum,fbs;gibco)和1%penicillin-streptomycin(hyclone)的rpmi-1640(gibco),calu-3的培养液为含10%fbs和1%penicillin-streptomycin的minimum eagle’s medium(mem,gibco),ags的培养液为含10%fbs和1%penicillin-streptomycin的f12(gibco)。胰蛋白酶(trypsin)购自于gibco;mts细胞活性检测试剂盒购自于promega。裸鼠购自于广东省医学实验动物中心。
[0036]
实施例1.mts实验
[0037]
实验方法:
[0038]
将贴壁培养细胞系calu-3、hcc827、nci-h460、ags通过trypsin消化收集并计数,悬浮培养细胞系karpas-299吸打混匀并计数后,按每孔3000个/180μl接种于96孔细胞培养板中,5%co2、37℃培养。细胞接种过夜后按图1及图2所示的分组和终浓度剂量给药(给药后每孔最终体积均为200μl),每个分组剂量设置3个复孔。药物处理144小时后,每孔加入20μl mts细胞活性检测试剂,其中mts和pms体积比为20:1,在未种细胞的孔中加入同样体积的培养液和mts细胞活性检测试剂作为检测背景(od490-blk)。37℃孵育约1小时后,通过酶标仪读取每孔490nm波长处的吸光度值。各孔读数减去od490-blk后获得扣除检测背景的各给药孔od490-t及阴性对照孔od490-t0。
[0039]
各给药孔细胞的相对存活率按以下公式计算:
[0040]
细胞相对生长率=od490-t/od490-t0
×
100%
[0041]
实验结果:
[0042]
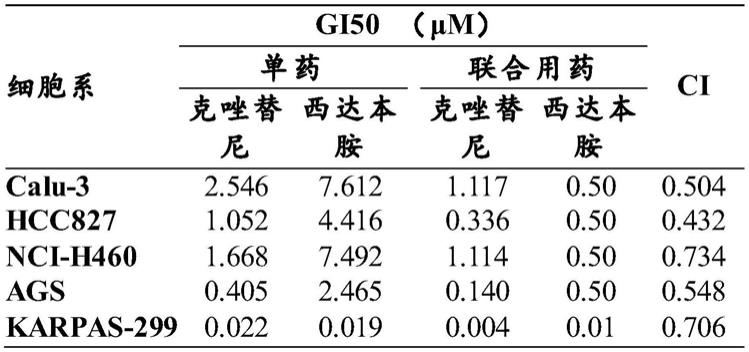
如图1a所示,人肺癌细胞系calu-3、hcc827和nci-h460中,西达本胺单药均显现出一定的抑制肿瘤细胞增殖作用,且呈剂量依赖性,通过graphpad软件测算,西达本胺单药对上述三株细胞系的50%抑制剂量gi50
(西达本胺单药)
分别为7.612μm、4.416μm和7.492μm。图1b中显示了克唑替尼单药及0.5μm西达本胺联合梯度剂量克唑替尼对上述三株细胞系产生的剂量依赖性增殖抑制作用,克唑替尼单药对三株肺癌细胞系的gi50
(克唑替尼单药)
分别为2.546μm、1.052μm和1.668μm,而克唑替尼与0.5μm西达本胺联合使用时对三株细胞系的gi50
(克唑替尼联合)
分别为1.117μm、0.336μm和1.114μm,此时视gi50
(西达本胺联合)
为0.5μm。
[0043]
如图2所示,人胃癌细胞系ags中,gi50
(西达本胺单药)
为2.465μm、gi50
(克唑替尼单药)
为0.405μm、gi50
(克唑替尼联合)
分别为0.140μm、视gi50
(西达本胺联合)
为0.5μm。而人淋巴瘤细胞系karpas-299中,gi50
(西达本胺单药)
为0.019μm、gi50
(克唑替尼单药)
为0.022μm、gi50
(克唑替尼联合)
分别为0.004μm、视gi50
(西达本胺联合)
为0.01μm。
[0044]
根据如下公式计算两种药物在各细胞系中联合使用时的协同指数(combined index,ci):
[0045]
ci=gi50
(西达本胺联合)
/gi50
(西达本胺单药)
+gi50
(克唑替尼联合)
/gi50
(克唑替尼单药)
[0046]
一般认为,ci=1时,两药联用为叠加效应;ci>1时为拮抗效应;ci<1为协同效应,ci值越小表明协同效应越强。
[0047]
如表1所示,在calu-3、hcc827、nci-h460、ags和karpas-299中,西达本胺与克唑替尼联合用药时的协同度ci分别为0.504、0.432、0.734、0.548和0.706,表明两药在5株细胞系中均表现出较强的协同效应。
[0048]
表1 50%抑制剂量(gi50)及协同指数(ci)
[0049][0050]
实施例2.裸鼠移植瘤模型实验
[0051]
实验方法:
[0052]
大量扩增培养hcc827细胞并使细胞保持在对数生长状态。待细胞数量达到所需后,胰酶消化收集,大量pbs充分清洗2次以去除胰酶和血清成分,室温、800rpm离心10min,弃上清。用不含fbs的rpim-1640培养液重悬细胞,调整细胞浓度至107/300μl。
[0053]
对悬浮培养的karpas-299细胞,同样大量扩增培养并使细胞保持在对数生长状态。待细胞数量达到所需后,离心收集细胞沉淀,大量pbs充分清洗2次以去除血清成分,室温、800rpm离心10min,弃上清。用不含fbs的rpim-1640培养液重悬细胞,调整细胞浓度至107/300μl。
[0054]
在无菌条件下,按300μl/针将细胞悬液注射至裸鼠背部皮下,每只裸鼠注射一针。注射时使用1ml一次性医用注射器,保证每只裸鼠进针部位和方向基本一致。
[0055]
接种细胞后,每2天观察和测量接种部位是否成瘤,用游标卡尺测量接种部位可能出现肿块的最长径(length)及与之垂直的最宽径(width),通过公式ts=length
×
(width)2/2计算肿瘤体积并记录,以ts达到100立方毫米作为判断成瘤的标准。
[0056]
观察到成瘤后,将成瘤裸鼠随机分成四组(即溶剂对照组、西达本胺组、克唑替尼组和联合用药组),标记并分笼饲养,每天按分组给药并观察肿瘤生长情况。每只裸鼠给药
前测量体重,按每千克体重计算给药剂量,hcc827裸鼠中,溶剂对照组按每克体重10μl的cmc-na溶液、西达本胺10毫克/公斤体重组按每克体重10μl的1mg/ml西达本胺-cmc-na悬浊液、克唑替尼25毫克/公斤体重组按每克体重10μl的2.5mg/ml克唑替尼-cmc-na悬浊液、联合用药组按每克体重10μl的每毫升含2.5mg克唑替尼和1mg西达本胺的cmc-na悬浊液进行灌胃给药;karpas-299裸鼠中,溶剂对照组按每克体重10μl的cmc-na溶液、西达本胺2毫克/公斤体重组按每克体重10μl的0.2mg/ml西达本胺-cmc-na悬浊液、克唑替尼2.5毫克/公斤体重组按每克体重10μl的0.25mg/ml克唑替尼-cmc-na悬浊液、联合用药组按每克体重10μl的每毫升含0.25mg克唑替尼和0.2mg西达本胺的cmc-na悬浊液进行灌胃给药。每3~4天用游标卡尺测量、计算肿瘤体积并记录。每只裸鼠每天定时灌胃给药1次,当测量到有实验个体的肿瘤体积达到或超过2000立方毫米时,结束实验。
[0057]
实验结果:
[0058]
如图3a所示,在裸鼠hcc827移植瘤模型中,与溶剂对照组相比,西达本胺10毫克/公斤体重和克唑替尼25毫克/公斤体重两单独给药组在最终对裸鼠荷瘤体积均有一定抑制,而联合用药组的最终抑瘤率高于两单药组抑瘤率之和,表明两药在hcc827荷瘤裸鼠体内具有协同增敏抗肿瘤的活性。
[0059]
如图3b所示,在裸鼠karpas-299移植瘤模型中,与溶剂对照组相比,西达本胺2毫克/公斤体重和克唑替尼2.5毫克/公斤体重两单独给药组在最终对裸鼠荷瘤体积均有明显的抑制,而联合用药组的最终抑瘤率则更为显著,高于两单药组抑瘤率之和,表明两药在karpas-299荷瘤裸鼠体内具有协同增敏抗肿瘤的活性。
[0060]
以上对本发明提供的包含西达本胺和c-met/alk/ros1抑制剂克唑替尼的组合及其应用进行了详细的介绍,本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想,包括最佳方式,并且也使得本领域的任何技术人员都能够实践本发明,包括制造和使用任何装置或系统,和实施任何结合的方法。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。本发明专利保护的范围通过权利要求来限定,并可包括本领域技术人员能够想到的其他实施例。如果这些其他实施例具有不是不同于权利要求文字表述的结构要素,或者如果它们包括与权利要求的文字表述无实质差异的等同结构要素,那么这些其他实施例也应包含在权利要求的范围内。
[0061]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1