适用于骨缺损及脊柱融合移植的植入材料、植入物及其制备方法与流程
本发明涉及骨缺损移植及脊柱融合手术所采用的移植物技术领域。
背景技术:
目前用于骨缺损移植和脊柱融合手术的外科移植材料通常采用中空金属结构外框(钛金属笼体支架)填充自体碎骨组织或其他异体成骨材料,或直接采用自体或异体骨块辅以成骨材料移植填充缺损中间部分填充手术中分散的自体碎骨组织或其他异体成骨材料。近年来由于组织工程技术的进步,多种材料被用于骨缺损和脊柱融合手术的移植,包括羟基磷灰石、活性骨水泥等其他成分。
由于骨缺损和脊柱融合修复的过程需要针对复杂的损伤微环境进行精细调节,不同的材料应答损伤微环境的程度不同,对骨组织新生的效率也有很大的不同。现有的移植材料采用的多为整体结构,无区域化特征,难以适应损伤部位不同区域的微环境和有序调节修复过程,因此在促成骨效果上仍存在局限性。尤其是移植材料的中心区域,由于远离骨组织,缺少相应的成骨微环境,材料形成的低氧环境不利于成骨细胞迁移到中心区域定植并分化形成新生骨组织和相应的骨小梁结构,对于损伤部位微环境应答和成骨修复过程缺乏智能化的精细调节过程。
有鉴于此,有必要研发新的外科移植材料,能解决以上问题。
技术实现要素:
本发明的目的在于提供一种能适应损伤部位不同区域的微环境和有序调节修复过程的适用于骨缺损及脊柱融合移植的植入物。
为了实现上述目的,本发明采用了以下技术方案:
一种适用于骨缺损及脊柱融合移植的植入材料,其特征在于所述植入材料用于填充在钛金属笼体支架内腔或骨缺损部位,其由上层、下层及位于上层与下层之间的中间层构成,中间层由位于外围的环形包裹区及位于环形包裹区内部的中心区构成,中心区由第一填充材料填充而成,第一填充材料为含有促成骨作用的凝胶材料;环形包裹区由第二填充材料填充而成,第二填充材料为具有调节表观遗传作用的凝胶材料;上层及下层由第三填充材料填充而成,第三填充材料为具有调节免疫炎症和应激反应作用的凝胶材料。
进一步地,第一填充材料由自修复水凝胶包裹负载有趋化作用和促成骨mrna和mirna的生物玻璃构成。
优选地,有趋化作用和促成骨mrna和mirna的为mcp1或il8,或两者的混合。
进一步地,第二填充材料由自修复水凝胶包裹负载有炎症调节相关mrna/蛋白以及成骨成血管相关的mrna和负载蛋白活性玻璃和负载有与成骨信号相关的表观遗传调节的核酸和蛋白分子的纳米类脂体构成。
优选地,负载有炎症调节相关mrna/蛋白以及成骨成血管相关的mrna和蛋白分子选自runx2、osx、bmp2/7、tgfb1、fgf2、vegf之中的一种或多种的混合;与成骨信号相关的表观遗传调节的核酸和蛋白分子选自mir424、mir146、mir200a之中的一种或多种的rna-类脂体复合体。
进一步地,第三填充材料由自修复水凝胶包裹负载有与低氧应激以及炎症调节相关的mrna/蛋白分子的生物玻璃构成。
优选地,有与低氧应激以及炎症调节相关的mrna/蛋白分子选自hif-1或timp1之中的一种或它们的混合。
优选地,自修复水凝胶含量有质量份为10%-15%的甲基丙烯酸明胶、质量份为2%-8%的氧化葡聚糖、质量份为2.5%-10%的明胶、质量份为0.1-0.5%的光引发剂irgacure2959。
本发明的第二目的在于提供一种适用于骨缺损及脊柱融合移植的植入物,其包括钛金属笼体支架及填充于钛金属笼体内腔的如上任一所述的植入材料。
本发明的第三目的在于提供上述适用于骨缺损及脊柱融合移植的植入材料的制备方法。
为了实现这一目的,本发明采用了以下技术方案:一种如上任一所述的适用于骨缺损及脊柱融合移植的植入材料的制备方法,其括以下步骤:
(1)制备生物玻璃;
(2)制备纳米类脂体;
(3)制备自修复水凝胶;
(4)将自修复水凝胶与生物玻璃或将自修复水凝胶与生物玻璃及纳米类脂体颗粒混合,从而分别制得第一填充材料、第二填充材料和第三填充材料。
本发明根据骨缺损部位的机构特征设计能够响应损伤微环境和骨修复过程的多层区结构,按照损伤修复的区域特征分为三个不同的区域,每个区域中的凝胶材料、功能不同。利用不同区域材料的不同成分差异,使骨缺损和脊柱融合移植物能根据损伤微环境的不同区域特征分别产生响应,并通过空间结构来应对骨组织中细胞迁移和新生骨组织的形成过程,实现了生物材料对骨组织的智能化和精准化的调节。
附图说明
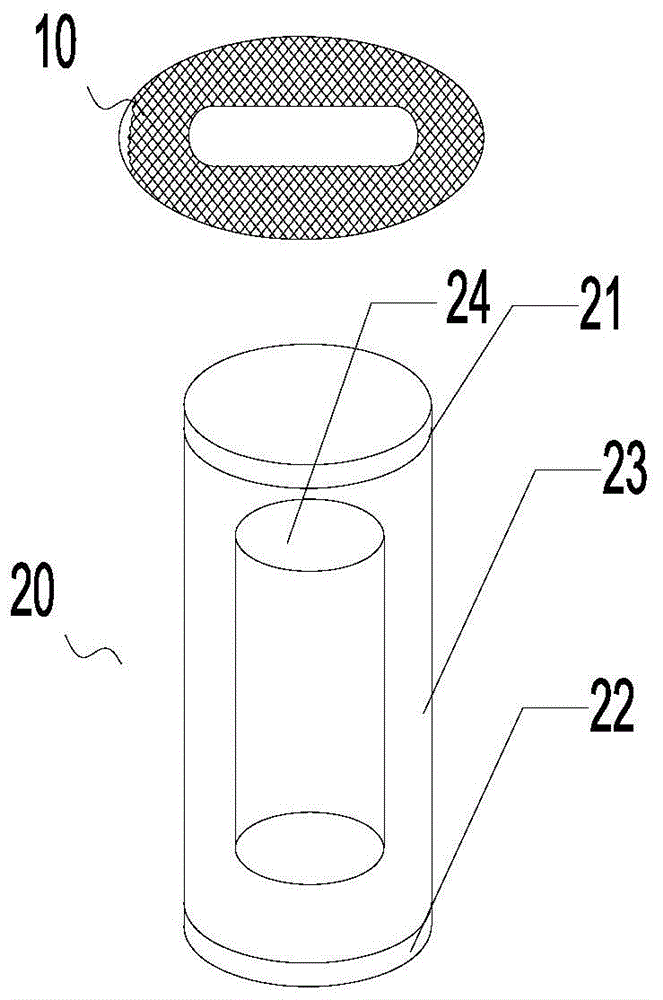
图1是本发明的移植物结构示意图。
图2是适用于脊柱融合的植入物中填充物的结构示意图。
钛金属笼体支架10,填充物20,上层21,下层22,环形包裹区23,中心区24
具体实施方式
本发明根据骨缺损部位的机构特征设计能够响应损伤微环境和骨修复过程的多层区结构的植入材料。所述植入材料用于填充在钛金属笼体支架内腔或骨缺损部位,作为最基本的结构,其由上层、下层及位于上层与下层之间的中间层构成,中间层由位于外围的环形包裹区及位于环形包裹区内部的中心区构成,中心区由第一填充材料填充而成,第一填充材料为含有促成骨作用的凝胶材料;环形包裹区由第二填充材料填充而成,第二填充材料为具有调节表观遗传作用的凝胶材料;上层及下层由第三填充材料填充而成,第三填充材料为具有调节免疫炎症和应激反应作用的凝胶材料。
考虑到实际应用的方便,第一填充材料、第二填充材料及第三填充材料均包裹于封装袋内或封闭瓶内。第一填充材料、第二填充材料及第三填充材料的体积大小根据不同型号的钛金属笼来设置。
考虑到使用的便捷性,本发明还可以制作成一种包含了钛金属笼与植入材料的整体性植入物。如图1所示的适用于骨缺损及脊柱融合移植的植入物,其包括钛金属笼体支架10及填充于钛金属笼体支架内腔的填充物20,所述填充物20由上层21、下层22及位于上层与下层之间的中间层构成,中间层由位于外围的环形包裹区23及位于环形包裹区内部的中心区24构成,中心区由第一填充材料填充而成,环形包裹区由第二填充材料填充而成,上层及下层由第三填充材料填充而成。
除了促成骨的基本功能外,上/下层、环形包裹区及中心区还存在其他功能上的差别,主要差别为:上/下层区与骨组织接触,主要应答炎症反应和应激调节,中间环形包裹区23通过表观遗传调节成骨,中心区24增加趋化信号。在不同的区域通过不同的凝胶成份及所包裹的内容物的差异,可以分别实现以上功能调节。
生物玻璃负载促成骨作用因子以及低氧应激和炎症反应调节作用的核酸或蛋白分子;纳米类脂体负载与成骨信号相关的表观遗传调节的核酸和蛋白分子,自修复水凝胶与结合有负载的生物玻璃和纳米类脂体按照比例混合形成不同层区的凝胶填充材料。具体如下表1。
表1
本发明的制作步骤如下:
1、制备生物玻璃,负载有促成骨作用的核酸或蛋白颗粒结构(如bmp-2等促成骨蛋白以及调节骨形成作用的microrna或mrna)。
2、制备纳米类脂体,负载有应激调节的核酸和蛋白颗粒结构(如il-10、hif-1α等免疫抑制因子和低氧应激调节因子以及具有免疫调节作用的microrna或mrna)。
3、制备自修复水凝胶,按表1中的比例准备好各配料,其中明胶和氧化葡聚糖先通过可逆的席夫碱反应形成可自动修复所受损伤的水凝胶,然后甲基丙烯酸明胶通过紫外光固化形成提升水凝胶机械强度的第二网络结构,最终制备形成具有较高机械强度的双网络自修复水凝胶。
4、按照表1中的比例将自修复水凝胶与负载有核酸和蛋白颗粒的生物玻璃及纳米类脂体颗粒混合,从而分别制得第一填充材料、第二填充材料和第三填充材料。
5、通过注射方式将第一填充材料、第二填充材料及第三填充材料分别填充到对应的骨缺损区域;或待第一填充材料、第二填充材料和第三填充材料的自修复水凝胶冷冻干燥后将干燥后的填充体整体填充至脊柱融合的金属钛笼内或骨缺损部位,接触组织后吸水膨胀,紫外照射成型。
依据具体情况,对于某些情况下的骨缺损区域的修复,可以选择只注射第一填充材料和第三填充材料。
根据骨修复区域的微环境差异,可将修复区分为双侧的骨组织近端区域和中央的骨组织远端区域,近端区域由于直接与骨组织接触,植入材料第一时间参与损伤环境的低氧应激反应以及迁移细胞首先响应骨修复早期事件,而植入物的中央为骨组织远端区域,迁移细胞经受更为强烈应激,使成骨过程相对滞后。根据不同的成骨修复微环境的不同时间和空间特征,可以选择不同的注射顺序。例如,首先将调节免疫炎症和应激反应的第三填充材料注射至骨组织近端区域,即上层和下层,再将混合负载趋化作用和促成骨mrna/蛋白的生物玻璃的第一填充材料注射到钛金属笼体内腔的中心区,最后调节表观遗传作用的第二填充材料注射在第一填充材料外形成环形包裹区。针对钛金属笼体,可以先将第二填充材料注射进入钛金属笼体形成外层包裹区,再将第一填充材料注射进入钛金属笼体形成中心区成骨材料核心,最后将第三填充材料注射至上层和下层与骨组织接触区域。在适用的情况下也可以是按照第一填充材料、第二填充材料和第三填充材料的顺序来进行注射填充。
利用双网络水凝胶支架的自修复性能设计,实现填充区域微环境可控调节以达到支撑与骨修复的目的。
实施例一
制备如图2所示的适用于脊柱融合植入的植入物中的填充物。
一、制备第一填充材料。
1.1通过核酸分子磷酸基团化学反应方法构建促成骨的生物玻璃负载蛋白分子。
配料为:成骨成血管相关调控蛋白vegf(10ng/ml)以及细胞趋化调节相关蛋白如mcp1(2ng/ml)等装载的生物玻璃。
1.2制备gelma的双网络自修复水凝胶体系。
配料为:甲基丙烯酸明胶、氧化葡聚糖、明胶、光引发剂irgacure2959,分别溶于pbs后混合搅拌均匀,是最终浓度配比(w/v)为甲基丙烯酸明胶12%、氧化葡聚糖4%、明胶5%、光引发剂0.3%。
1.3将步骤1.1制得的生物玻璃以10%浓度与步骤1.2制得的自修复水凝胶混合交联从而制得第一填充材料。
二、制备第二填充材料。
2.1通过核酸分子磷酸基团化学反应等方法构建促成骨的生物玻璃负载mrna/蛋白分子。
配料为:炎症调节相关因子il10(2ng/ml)mrna装载的微纳米生物活性玻璃,并负载与成骨成血管相关的mrna负载的微纳米生物活性玻璃runx2(200μg/ml)、bmp2(500μg/ml),tgfb1(10μg/ml),vegf(100μg/ml)。
2.2制备负载mirna分子的基本结构单元的纳米类脂体,其外层包裹具有缓释效果的海藻酸盐水凝胶。
配料为:激活成骨信号通路的mir146(200μg/ml)与纳米类脂体形成mirna-类脂体复合体,外层包裹2%海藻酸盐凝胶。
2.3制备gelma的双网络自修复水凝胶体系。
配料为:甲基丙烯酸明胶、氧化葡聚糖、明胶、光引发剂irgacure2959,分别溶于pbs后混合搅拌均匀,是最终浓度配比(w/v)为甲基丙烯酸明胶15%、氧化葡聚糖2%、明胶2.5%、光引发剂0.5%。
2.4将步骤2.1制得的生物玻璃与步骤2.2制得的负载mirna分子的基本结构单元的纳米类脂体及步骤2.3制得的自修复水凝胶按照生物玻璃10%,纳米类脂体颗粒1%的比例与自修复水凝胶混合,从而制得第二填充材料。
三、制备第三填充材料
3.1通过核酸分子磷酸基团化学反应方法构建促成骨的生物玻璃负载蛋白分子。
配料为:与低氧应激以及炎症调节因子hif-1(10ng/ml)装载的微纳米生物活性玻璃。
3.2制备gelma的双网络自修复水凝胶体系。
配料为:甲基丙烯酸明胶、氧化葡聚糖、明胶、光引发剂irgacure2959,分别溶于pbs后混合搅拌均匀,是最终浓度配比(w/v)为甲基丙烯酸明胶14%、氧化葡聚糖3%、明胶3.75%、光引发剂0.4%。
3.3将步骤3.1制得的生物玻璃按照5%比例与步骤3.2制得的自修复水凝胶均匀混合从而制得第三填充材料。
四、将第三填充材料,即5%浓度生物玻璃负载炎症免疫调节因子的水凝胶注射进入钛金属笼体上、下层与骨组织接触区域,形成完整的移植材料构建。
五、将第一填充材料,即生物玻璃负载促成骨mrna混合趋化因子经双网络自修复水凝胶包裹形成的凝胶混合物注射进入钛金属笼体形成中心区成骨材料核心。
六、将第二填充材料,即生物玻璃负载促成骨mrna结合表观遗传调控因子通过双网络自修复水凝胶形成的凝胶混合物注射进入钛金属笼体形成外层包裹区。
实施例二
制备适用于腰椎融合植入的填充物,其形状可采用图1所示的填充物形状。
本例与实施例一分区形式相同,外部形状不同,部分区域材料负载的成分比例不同,按照图1所示制备。
一、制备第一填充材料。
1.1通过核酸分子磷酸基团化学反应方法构建促成骨的生物玻璃负载蛋白分子。
配料为:成骨成血管相关调控蛋白vegf(10ng/ml)以及细胞趋化调节相关蛋白如timp1(2ng/ml)等装载的生物玻璃。
1.2制备gelma的双网络自修复水凝胶体系。
配料为:甲基丙烯酸明胶、氧化葡聚糖、明胶、光引发剂irgacure2959,分别溶于pbs后混合搅拌均匀,是最终浓度配比(w/v)为甲基丙烯酸明胶12%、氧化葡聚糖4%、明胶5%、光引发剂0.3%。
1.3将步骤1.1制得的生物玻璃以15%浓度与步骤1.2制得的自修复水凝胶混合交联从而制得第一填充材料。
二、制备第二填充材料。
2.1通过核酸分子磷酸基团化学反应等方法构建促成骨的生物玻璃负载mrna/蛋白分子。
配料为:炎症调节相关因子il10(2ng/ml)mrna装载的微纳米生物活性玻璃,并负载与成骨成血管相关的mrna负载的微纳米生物活性玻璃osx(200μg/ml)、bmp2(500μg/ml),vegf(200μg/ml)。
2.2制备负载mirna分子的基本结构单元的纳米类脂体,其外层包裹具有缓释效果的海藻酸盐水凝胶。
配料为:激活成骨信号通路的mir424(100μg/ml)、mir200a(200μg/ml)与纳米类脂体形成mirna-类脂体复合体,外层包裹2%海藻酸盐凝胶。
2.3制备gelma的双网络自修复水凝胶体系。
配料为:甲基丙烯酸明胶、氧化葡聚糖、明胶、光引发剂irgacure2959,分别溶于pbs后混合搅拌均匀,是最终浓度配比(w/v)为甲基丙烯酸明胶15%、氧化葡聚糖2%、明胶2.5%、光引发剂0.5%。
2.4将步骤2.1制得的生物玻璃与步骤2.2制得的负载mirna分子的基本结构单元的纳米类脂体及步骤2.3制得的自修复水凝胶按照生物玻璃15%,纳米类脂体颗粒0.1%的比例与自修复水凝胶混合,从而制得第二填充材料。
三、制备第三填充材料
3.1通过核酸分子磷酸基团化学反应方法构建促成骨的生物玻璃负载蛋白分子。
配料为:与低氧应激以及炎症调节因子hif-1(10ng/ml)装载的微纳米生物活性玻璃。
3.2制备gelma的双网络自修复水凝胶体系。
配料为:甲基丙烯酸明胶、氧化葡聚糖、明胶、光引发剂irgacure2959,分别溶于pbs后混合搅拌均匀,是最终浓度配比(w/v)为甲基丙烯酸明胶14%、氧化葡聚糖3%、明胶3.75%、光引发剂0.4%。
3.3将步骤3.1制得的生物玻璃按照10%比例与步骤3.2制得的自修复水凝胶均匀混合从而制得第三填充材料。
四、将第三填充材料,即10%浓度生物玻璃负载炎症免疫调节因子的水凝胶注射进入上、下层与骨组织接触区域,形成完整的移植材料构建。
五、将第一填充材料,即生物玻璃负载促成骨mrna混合趋化因子经双网络自修复水凝胶包裹形成的凝胶混合物注射进入钛金属笼体形成中心区成骨材料核心。
六、将第二填充材料,即生物玻璃负载促成骨mrna结合表观遗传调控因子通过双网络自修复水凝胶形成的凝胶混合物注射进入钛金属笼体形成外层包裹区。
以上实施方式仅用于说明本发明,而并非对本发明的限制,有关技术领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型,因此所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。
- 还没有人留言评论。精彩留言会获得点赞!