一种取代吲哚类化合物在制备抗冠状病毒制剂中的应用
本发明涉及医药技术领域,具体地说,涉及一种取代吲哚类化合物在制备抗冠状病毒制剂中的应用。
背景技术:
新型冠状病毒肺炎(coronavirusdisease2019,covid-19)严重威胁人类健康,是由新型冠状病毒(severeacuterespiratorysyndromecoronavirus2,sars-cov-2)引起的。抗新型冠状病毒病的新药发现,是防控措施的重要组成部分,新药发现将为临床防治新型冠状病毒病提供重要的治疗方案。
基因测序结果表明,sars-cov-2与sars-cov和mers-cov一样,同属于冠状病毒β属,与sars-cov的基因序列同源性为75%~80%,与蝙蝠sars样冠状病毒(bat-sl-covzc45)的同源性超过85%。与sars-cov病毒相比,sars-cov-2病毒具有更强的感染性,其感染系数(r0)可达5.7(sars-cov为2.0左右),同时潜伏期为7-14天,大大超过了sars-cov(2-7天),并有大量具有传染能力的无症状感染者,病毒的防控面临巨大挑战。
疫苗和抗病毒药物是防治新冠病毒的最有效手段。老药新用是寻找抗sars-cov-2病毒药物的重要思路,who推出4种最有希望的新冠肺炎治疗方案:瑞德西韦、氯喹和羟氯喹、洛匹那韦/利托那韦以及洛匹那韦/利托那韦/阿比多尔。多数核苷类似物整合到病毒rna时,会被冠状病毒表达的非结构性蛋白nsp14外切酶(nonstructuralproteinnsp14exoribonuclease,nsp14-exon)切除,不过瑞德西韦对于nsp14-exon具有抗性,这使其优于其他核苷类似物。但是随后的临床试验研究表明这些药物副作用大及疗效不显著,不适用于广泛的抗sars-cov-2治疗。因此,仍有必要研发新型抗新冠感染有效治疗药物。
sars-cov-2病毒是正股单链rna病毒,sars-cov-2基因组长度为29.8kb~29.9kb。目前认为其生活周期包括病毒吸附进入,脱衣壳,基因组转录和复制,病毒蛋白合成,组装和释放等过程。病毒编码16个非结构蛋白(nsp1~nsp16)。这16种nsps中的一些是sars-cov-2复制所必需的酶。其中包括木瓜样蛋白酶(nsp3)、胰凝乳蛋白酶样蛋白酶(3cl蛋白酶,nsp5)、引物酶复合物(nsp7-nsp8)、rna依赖的rna聚合酶rdrp(nsp12)、解旋酶(nsp13)和外切酶(nsp14),这些都是抗sars-cov-2药物开发的潜在靶点。
新冠病毒rna依赖的rna聚合酶(rnadependentpolymerase,rdrp)主要负责病毒rna的复制,是研究广谱抗病毒药物靶点。一方面,新冠病毒的rna聚合酶是由病毒自身编码的rna依赖的rna聚合酶与哺乳动物细胞内的dna依赖的rna聚合酶完全不同;另外,新冠病毒编码聚合酶各亚基的基因序列在不同新冠病毒毒株间高度保守,使得新冠病毒rna聚合酶是极赋潜力的抗新冠病毒药物靶标。研究表明rdrp的形成需要病毒的辅助因子nsp7和nsp8的参与。核苷类似物作为rdrp的广谱抑制剂,通过病毒的rdrp结合,占据核苷结合空间使rna的合成受阻,从而发挥抗病毒作用。由美国吉利德(gilead)公司研发的一种新型核苷类似物前药瑞德西韦(remdesivir,gs-5734),静脉注射给药后在体内代谢为gs-441542,而gs-441542进一步被三磷酸化为具有药理学活性的三磷酸核苷(ntp)。病毒在进入细胞后,rdrp和细胞竞争性结合核苷。由于细胞的rna聚合酶不能识别瑞德西韦这类核苷类似物,因此不会受到影响。同样,其他的核苷类似物只有在体内被代谢为三磷酸化才能具有抗病毒的效果。这种复杂的作用机制严重制约了酶活分析方法的发展,直接影响了以新冠rdrp为靶点的药物筛选和研发。虽然在基础研究中,可以从纯化的病毒颗粒中分离到具有活性的rdrp,但这种高成本低收率的实验方法难以应用于大规模的药物筛选和药效评价。
吲哚(idole)是一种具有一系列生物活性的天然物质,其分子式为c8h7n。吲哚可被看作苯和吡咯相互共用一个环的化合物,整个环具有芳香族性,能在3-位上发生亲核取代反应。它是自然界中许多天然产物的基本结构骨架或重要组成部分。吲哚类化合物具有抗菌、抗病毒、抗肿瘤等多种生物学活性。silvestrir等以有效的抗hiv-1活性的化合物结构为依据合成了1-和3-取代苯磺酰基吲哚。发现3-取代苯磺酰基吲哚抗hiv活性的ec50值为0.001μm,选择性指数si>200000;而1-取代苯磺酰基吲哚活性较差。而且在苯环上引入甲基或氯后其抗hiv-1活性有一定的提高。柴慧芳等设计合成了11种5-羟基-6-溴-1h-吲哚-3-羧酸乙酯类化合物,研究发现化合物1和2对流感病毒a3和呼吸道合胞病毒株rsvlong的ic50值都为1.46μg/ml,优于金刚烷胺2.90μg/ml,而化合物3对流感病毒a3的治疗指数ti与金刚烷胺相当,抗呼吸道合胞病毒株rsvlong的治疗指数ti稍弱于金刚烷胺。这表明不同的吲哚化合物具有不同的生物学活性,针对冠状病毒有效的化合物仍有待开发研究。
技术实现要素:
针对上述技术问题,本发明的目的是提供一种可有效抗冠状病毒的化合物。
为了实现本发明的发明目的,本发明的技术方案如下:
一种取代吲哚类化合物在制备冠状病毒依赖的rna聚合酶拮抗剂中的应用,所述取代吲哚类化合物如式i所示:
其中,r1=4-br,
本发明中,所述冠状病毒为sars-cov-2。
本发明发现了一种有效抑制sars-cov-2rdrp的化合物,并利用gaussialuciferase(gluc)报告基因,成功建立了细胞水平cov-rdrp-gluc报告系统,通过建立的该细胞水平sars-cov-2rdrp高通量报告系统,借由检测荧光强度对新冠病毒rdrp活性进行了定量分析验证。并通过qrt-pcr实验,检测了本发明cov-rdrp-gluc系统中gluc正链和负链rna水平的变化,发现该化合物能够显著降低gluc正链和负链rna的水平。在之后,本发明又利用sars-cov-2rdrp外切酶模型进一步验证,发现该化合物依旧能够表现出对sars-cov-2外切酶nsp14具有很好的抗性。从而最终说明了式i化合物对冠状病毒抑制的有效性。
本发明还提供一种取代吲哚类化合物在制备抗冠状病毒药物中的应用,所述取代吲哚类化合物如式i所示。
本发明中,所述冠状病毒为hcov-oc43。
本发明发现如式i所示的化合物能够抑制新冠病毒sars-cov-2rna依赖的rna聚合酶活性进而抑制新冠病毒的复制,并可有效抑制冠状病毒hcov-oc43的复制,为研发新型抗新冠病毒先导化合物提供关键数据,同时为研发covid-19有效治疗药物提供理论依据。也可用于制备抗多种类型的冠状病毒的药物中。
本发明另提供一种冠状病毒依赖的rna聚合酶拮抗剂,其包括取代吲哚类化合物,所述取代吲哚类化合物如式i所示。
本发明中,所述冠状病毒为sars-cov-2。
本发明再提供一种抗冠状病毒药物,其包括取代吲哚类化合物,所述取代吲哚类化合物如式i所示。
本发明中,所述冠状病毒为hcov-oc43。
本发明中抗冠状病毒药物进一步包含药学上可接受的助剂。
优选,所述助剂包括载体、赋形剂或稀释剂中的一种或多种。
本发明的有益效果至少在于:
本发明发现式i化合物在低细胞毒性的条件下,能够表现出很好的抑制新冠病毒sars-cov-2rdrp的活性,且这种抑制效果在cov-rdrp-glucrna水平上也得到了验证。因此,式i化合物有待发展成为临床上sars-cov-2rdrp的小分子抑制剂。此外,本发明还发现该化合物能够有效抑制hcov-oc43病毒的复制。
附图说明
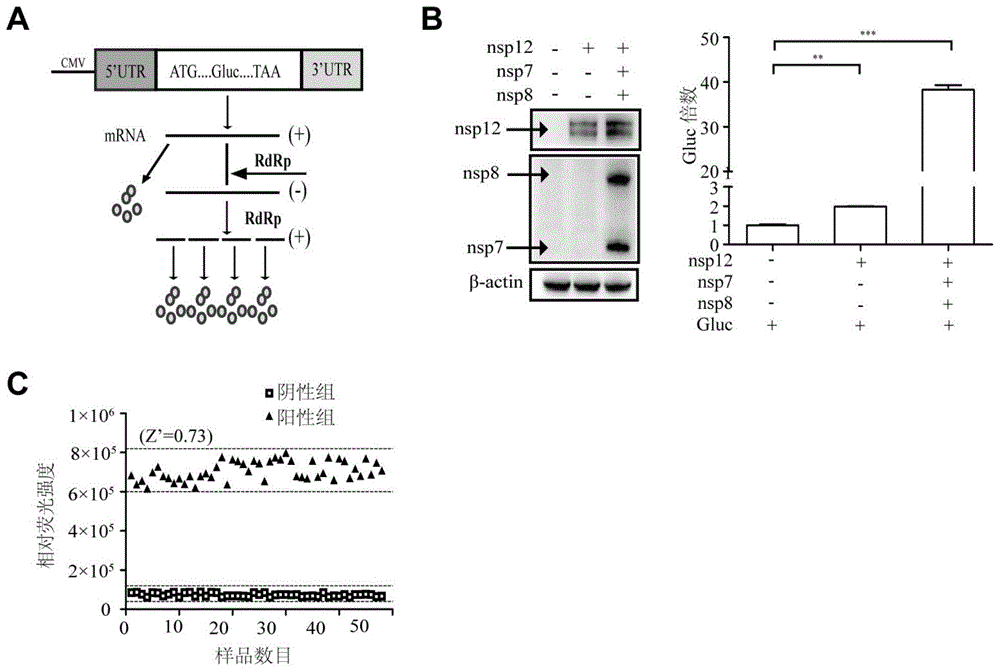
图1为本发明实施例1的报告系统构建原理示意图及验证结果图;其中,a为本发明实施例1中利用cov-rdrp-gluc报告系统构建原理示意图;b中的左图为本发明实施例1中利用westernblot检测cov-rdrp-gluc报告系统中nsp12,nsp7,nsp8蛋白的表达结果;b中的右图为本发明实施例1中利用酶标仪centroxs3lb960检测cov-rdrp-gluc报告系统中各组gluc的表达结果;c为本发明实施例1中cov-rdrp-gluc报告系统用于高通量检测的z’因子检测结果。
图2为本发明实施例2中sars-cov-2rna依赖的rna聚合酶的抑制效果图;其中,a为本发明实施例2中化合物imb-7-71(式i所示化合物)、瑞德西韦对sars-cov-2rna依赖的rna聚合酶的抑制率结果图;b为本发明实施例2中化合物imb-7-71(式i所示化合物)对sars-cov-2rna依赖的rna聚合酶的ec50结果图;c为本发明实施例2中阳性化合物瑞德西韦对sars-cov-2rna依赖的rna聚合酶的ec50结果图。
图3为本发明实施例3中sars-cov-2rna依赖的rna聚合酶转录活性的影响结果图;其中,a为本发明实施例3中化合物imb-7-71(式i所示化合物)在mrna水平对sars-cov-2rna依赖的rna聚合酶转录活性的影响结果图;b为本发明实施例3中阳性化合物瑞德西韦在mrna水平对sars-cov-2rna依赖的rna聚合酶转录活性的影响结果图。
图4为本发明实施例4的实验结果图;其中,a为本发明实施例4中利用westernblot检测sars-cov-2外切酶nsp14报告系统中nsp12、nsp7、nsp8、nsp14、nsp10蛋白的表达结果;b为本发明实施例4中利用酶标仪centroxs3lb960检测sars-cov-2外切酶nsp14报告系统中gluc的表达结果;c为本发明实施例4中化合物imb-7-71(式i所示化合物)对sars-cov-2外切酶nsp14的抗性结果图;d为本发明实施例4中阳性化合物瑞德西韦对sars-cov-2外切酶nsp14的抗性结果图;
图5为本发明实施例5中化合物imb-7-71(式i所示化合物)和瑞德西韦(remdesivir)对冠状病毒hcov-oc43毒株的抑制效果。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明具体实施方式部分所记载的真核密码子优化的质粒pcovid19-nsp7、真核密码子优化的质粒pcovid19-nsp8、真核密码子优化的质粒pcovid19-nsp10、真核密码子优化的质粒pcovid19-nsp12、真核密码子优化的质粒pcovid19-nsp14为将nsp7、nsp8、nsp10、nsp12、nsp14基因分别通过xhoi无缝克隆到pcmv6-entry(购自origen)载体所获得的质粒。
nsp7、nsp8、nsp10、nsp12、nsp14基因参见renll,wangym,wuzq,xiangzc,guol,xut,jiangyz,xiongy,liyj,lixw,lih,fangh,guxy,xiaoy,gaoh,xujy,yangf,wangxm,wuc,chenl,liuyw,liub,yangj,wangxr,dongj,lil,huangcl,zhaojp,huy,chengzs,liull,qianzh,qinc,jinq,caob,wangjw.identificationofanovelcoronaviruscausingseverepneumoniainhuman:adescriptivestudy.chinmedj2020;00:00–00.doi:10.1097/cm9.0000000000000722。
实施例1细胞水平cov-rdrp-gluc报告系统的建立
本实施例建立了新冠病毒sars-cov-2rdrp特异启动的荧光素酶报告系统,简称cov-rdrp-gluc。在新冠病毒5′utr和3′utr之间插入gaussialuciferase(gluc)编码序列(如seqidno.1所示),然后将其插入pretrox-tight-pur(clontech)载体bamhi-hf(#r3136l,neb)和notl(noti-hf,neb)位点之间,引物为正向(5′-ggcggatccattaaaggtttatac-3′,如seqidno.2所示)和反向(5′-ttagcggccgcgtcattctcctaagaa-3′,如seqidno.3所示),构建了pcov-gluc质粒。在cmv启动子的作用下,正链的gluc(mrna)发生转录,经翻译产生gluc蛋白。当在系统中同时表达新冠病毒rna依赖的rna聚合酶(nsp12)时,rdrp首先以正链的gluc为模板合成负链的vrna,随后vrna被转录为正链gluc(mrna),最终翻译成gluc蛋白。因此,加入rdrp后增加的gluc反映了sars-cov-2rdrp的活性。构建原理示意图见图1中的a。
另外,nsp12发挥功能时需要nsp7和nsp8的参与。因此本实施例分别设置了三组试验进行比较:单独表达cov-gluc(上述构建的pcov-gluc质粒)(10ng),共表达cov-gluc(10ng)和真核密码子优化的质粒pcovid19-nsp12(nsp12)(200ng)以及共表达cov-gluc(10ng)、nsp12(200ng)、真核密码子优化的质粒pcovid19-nsp7(nsp7)(600ng)和真核密码子优化的质粒pcovid19-nsp8(nsp8)(600ng),实验中为了保证质粒总的转染量相同,各组中添加空载体质粒pcmv6-entry补齐。具体结果参见图1中的b。b中的左图为本发明实施例1中利用westernblot检测cov-rdrp-gluc报告系统中nsp12,nsp7,nsp8蛋白的表达结果;b中的右图为本发明实施例1中利用酶标仪centroxs3lb960检测cov-rdrp-gluc报告系统中各组gluc的表达结果。
具体westernblot、centroxs3lb960检测实验过程如下:
(1)westernblot实验
将2.5×105个/ml的hek293t细胞悬液,按照每孔2ml接种于6孔板中。hek293t细胞所用培养基分别为含10%胎牛血清(fbs)的dmem培养基;将细胞在37℃含5%二氧化碳恒温培养箱培养。待细胞长至80%时,hek293t细胞组每孔按上述实验组设计进行质粒转染。转染后4小时将培养基换成含10%胎牛血清(fbs)的dmem培养基;继续培养24小时。弃培养基,每孔加入80μl的ripa裂解液,将裂解液转移至1.5mlep管中冰上裂解20分钟,每管加入20μl的5x蛋白上样缓冲液(loadingbuffer),100摄氏度金属浴煮30分钟。sds-page凝胶电泳分离,westernblot检测nsp12,nsp7和nsp8表达量。检测结果见图1中b的左图。
(2)gasussia荧光素酶活性检测
将250μg的底物coelenterazine-h冻干粉末溶解于600μl的无水乙醇中,制成浓度为1.022mm的底物母液,保存在-20℃;测量前,将母液以1:60的比例稀释于pbs中,制成底物工作液。在室温静置30min以稳定工作液,由于底物见光不稳定,全程需要避光处理;取10μl细胞培养上清(上述westernblot实验中转染后培养24小时后的细胞上清)到白色不透明96孔板中,利用酶标仪centroxs3lb960自动进样器将避光孵育的底物工作液按每孔60μl的进样量逐孔加入,持续收集信号0.5秒,测量结果以相对光单位relativelightunits(rlu)表示。实验设置了三组平行,并进行了统计学分析,其中,**p<0.01,***p<0.001是以单独表达cov-gluc组为参照。实验数据以
实验结果显示,共表达cov-gluc和nsp12组以及cov-gluc、nsp12、nsp7和nsp8组分别是单独表达cov-gluc组gluc的2倍和38倍。上述结果说明本发明所构建的cov-rdrp-gluc系统中gluc蛋白的表达特异性地依赖于新冠病毒rdrp。
本实施例还对上述cov-rdrp-gluc报告系统进行了z’因子检测,检测方法如下:
将2.5×105个/ml的hek293t细胞悬液,按照每孔2ml接种于6孔板中,培养24h后转染。分两组进行:表达质粒cov-gluc(10ng)的细胞为阴性对照(补加1.4μg质粒pcmv6-entry,购自origen),共表达质粒cov-gluc(10ng)、nsp12(200ng)、nsp7(600ng)和nsp8(600ng)的细胞为阳性对照组。转染12h后,分别将两组细胞用胰酶消化,加入dmem培养基制成细胞悬液,接种于96孔板(1×105个/ml),每孔100μl。培养24h后检测荧光素酶活性。计算公式为:z′因子=1-(3×阳性对照组相对荧光值sd+3×阴性对照组相对荧光值sd)/(阳性对照组相对荧光值平均值-阴性对照组相对荧光值平均值)。
检测结果见图1中的c,其为本发明实施例1中cov-rdrp-gluc报告系统用于高通量筛选的z’因子检测结果,从中可知z’因子为0.73,符合高通量筛选的要求。
实施例2利用cov-rdrp-gluc报告系统对本发明的取代吲哚类化合物(如式i所示)进行测试实验
将2.5×105个/ml的hek293t细胞悬液,按照每孔2ml接种于6孔板中。待细胞长至80%时,hek293t细胞组每孔共转染10ng实施例1构建的pcov-gluc,200ng真核密码子优化的质粒pcovid19-nsp12,600ng真核密码子优化的质粒pcovid19-nsp7和600ng真核密码子优化的质粒pcovid19-nsp8质粒。转染后4小时将培养基换成含10%胎牛血清(fbs)的dmem培养基,继续培养12小时。将六孔板中的细胞消化后制成细胞悬液,按1.0×104个/ml的hek293t细胞接种于96孔板,每孔100μl。每孔分别加入1μl浓度为10μm的化合物imb-7-71(式i的化合物)和瑞德西韦,接着培养24小时进行处理。其中阴性对照组每孔加入1μldmso(二甲基亚砜)。最后按照实施例1的方法检测荧光值。实验设置了三组平行,并进行了统计学分析,数据以dmso组的值为参比进行了百分化处理。实验数据以
本实施例继续对化合物imb-7-71进行sars-cov-2rdrp活性实验的验证,以检测其抑制的ec50。实验步骤如上所述,化合物imb-7-71和瑞德西韦的终浓度分别为0.39,0.78,1.56,3.125,6.25,12.5,25,50μm。实验组进行了三次,每次实验以每组的dmso组为参照。实验数据以
实施例3imb-7-71在mrna水平抑制sars-cov-2rdrp的转录活性实验
在mrna水平检测imb-7-71对sars-cov-gluc的影响可以进一步证实imb-7-71对sars-cov-2rdrp转录活性的影响。本发明采用qrt-pcr方法检测了imb-7-71在mrna水平对sars-cov-2rdrp的抑制情况。
将2.5×105个/ml的hek293t细胞悬液,按照每孔2ml接种于6孔板中。待细胞长至80%时,hek293t细胞组每孔共转染10ngpcov-gluc,200ng真核密码子优化的质粒pcovid19-nsp12,600ng真核密码子优化的质粒pcovid19-nsp7和600ng真核密码子优化的质粒pcovid19-nsp8质粒。转染后4小时将培养基换成含10%胎牛血清(fbs)的dmem培养基,其中一组按照每孔5.00mm或10.00mm的imb-7-71各加入2μl,另一组以dmso(二甲基亚砜)作为阴性对照,同时选用广谱抗病毒核苷类抑制剂瑞德西韦作为阳性对照,每孔5.00mm或10.00mm的瑞德西韦各加入2μl,继续培养24小时。最后将培养基吸掉,每孔加入1ml的trizol试剂,从trizol中提取出mrna之后,利用反转录法获得全基因组cdna,随后进行qrt-pcr检测glucmrna的表达量。本实验利用gapdh作为内参基因。实验设置了三组平行,并进行了统计学分析,其中,**p<0.01,***p<0.001是以dmso组为参照。实验数据以
试验结果显示,imb-7-71在5.00μm与10.00μm的浓度下可以显著抑制sars-cov-gluc中glucmrna表达量,结合实施例2的试验结果,本发明分别从不同的方面说明了imb-7-71是一类新型sars-cov-2rdrp小分子抑制剂。
实施例4imb-7-71对新冠病毒外切酶nsp14的抗性实验
核苷类似物抑制新冠病毒rdrp时,由于新冠病毒外切酶nsp14的校准功能,导致多数核苷类似物对nsp14的抗性较差。这也导致核苷类似物作为rdrp抑制剂在治疗新冠病毒的疗效较差。因此,本发明在sars-cov-gluc系统的基础上,共表达nsp14和nsp10,检测了化合物对新冠病毒外切酶的抗性。
具体实验步骤参照实施例1,不同之处在于:在hek293t细胞中,每孔单独表达cov-gluc(10ng),共表达cov-gluc(10ng)、nsp12(200ng)、nsp7(600ng)和nsp8(600ng),共表达cov-gluc(10ng)、nsp12(200ng)、nsp7(600ng)、nsp8(600ng)、真核密码子优化的质粒pcovid19-nsp14(nsp14)(500ng)和真核密码子优化的质粒pcovid19-nsp10(nsp10)(500ng),其它操作相同。为了更清楚地展示nsp10和nsp14蛋白的位置和表达情况,在图4的a的westernblot中还单独对两个蛋白分别进行了检测。实验设置了三组平行,并进行了统计学分析,其中***p<0.001,以单独表达cov-gluc组为参照。实验数据以
本实施例进一步检测了imb-7-71和瑞德西韦对sars-cov-2外切酶nsp14的抗性。
具体方法如下:
具体实验步骤参照实施例2,不同之处在于:在hek293t细胞中,共表达cov-gluc(10ng)、nsp12(200ng)、nsp7(600ng)、nsp8(600ng)、nsp14(500ng)和nsp10(500ng),其它操作相同。
检测结果如图4中的c、d所示,c为本发明实施例4中imb-7-71对sars-cov-2外切酶nsp14的抗性结果图;d为本发明实施例4中阳性化合物瑞德西韦对sars-cov-2外切酶nsp14的抗性结果图;
试验结果显示,imb-7-71对sars-cov-2外切酶的ec50为1.89μm,阳性化合物瑞德西韦对sars-cov-2外切酶的ec50值为3.11μm,两者ec50(imb-7-71/瑞德西韦)的比值为0.61。实验结果表明,imb-7-71对sars-cov-2外切酶nsp14不敏感,且略优于瑞德西韦。
实施例5imb-7-71抑制冠状病毒hcov-oc43的复制的实验
hct-8细胞按1.0×104个/ml接种于96孔板,每孔100μl,细胞培养基为含10%fbs的dmem培养基,培养48小时。弃上清,更换为含2%fbs的新鲜dmem培养基,以moi=0.1感染hcov-oc43(atcc:vr-1558)病毒。每孔加入梯度稀释的化合物imb-7-71(终浓度从50μm按2倍稀释,稀释9个梯度)1μl,阴性对照组每孔加入1μldmso(二甲基亚砜),采用广谱抗病毒核苷类抑制剂瑞德西韦作为阳性对照(终浓度从50μm按2倍稀释,稀释9个梯度)每孔加入1μl,接着在33℃下继续培养60小时。每孔加入20μlcellproliferationcolorimetricassay(mts)试剂37℃作用3小时。最后检测490nm波长下产生的吸收峰。抑制率的计算公式:抑制率=(病毒组–样品组)/(病毒组–空白组)×100%。
图5为本发明实施例5中化合物imb-7-71和瑞德西韦对冠状病毒hcov-oc43毒株的抑制效果。试验结果显示,imb-7-71对冠状病毒hcov-oc43的ec50约为0.56μm。进一步说明,imb-7-71有希望发展成新型抗新冠病毒先导化合物,为研发covid-19有效治疗药物提供理论依据。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国医学科学院医药生物技术研究所
<120>一种取代吲哚类化合物在制备抗冠状病毒制剂中的应用
<130>khp201118606.5
<160>3
<170>siposequencelisting1.0
<210>1
<211>1160
<212>dna
<213>人工序列(artificialsequence)
<400>1
attaaaggtttataccttcccaggtaacaaaccaaccaactttcgatctcttgtagatct60
gttctctaaacgaactttaaaatctgtgtggctgtcactcggctgcatgcttagtgcact120
cacgcagtataattaataactaattactgtcgttgacaggacacgagtaactcgtctatc180
ttctgcaggctgcttacggtttcgtccgtgttgcagccgatcatcagcacatctaggttt240
cgtccgggtgtgaccgaaaggtaagatgggcgtgaaggtcctcttcgctctgatctgtat300
cgccgtggccgaggccaaacccaccgagaacaacgaggacttcaacatcgtggccgtggc360
cagcaatttcgccacaaccgatctggacgccgacagaggcaagctgcccggcaagaagct420
gcctctggaggtgctgaaggagatggaggccaacgctagaaaggctggctgcaccagagg480
atgtctgatctgtctgagccacatcaagtgcacccccaagatgaagaagttcatccccgg540
cagatgccacacctacgagggcgacaaggagagcgctcaaggcggcatcggcgaagccat600
cgtggacattcccgagatccccggctttaaggatctggagcccatggagcagttcatcgc660
tcaagtggatctgtgcgtggactgtaccaccggctgcctcaagggcctcgccaacgtgca720
gtgcagcgatctgctgaagaagtggctgccccagagatgcgccacattcgccagcaagat780
ccaaggccaagtggataagatcaagggcgccggaggcgattgaactcatgcagaccacac840
aaggcagatgggctatataaacgttttcgcttttccgtttacgatatatagtctactctt900
gtgcagaatgaattctcgtaactacatagcacaagtagatgtagttaactttaatctcac960
atagcaatctttaatcagtgtgtaacattagggaggacttgaaagagccaccacattttc1020
accgaggccacgcggagtacgatcgagtgtacagtgaacaatgctagggagagctgccta1080
tatggaagagccctaatgtgtaaaattaattttagtagtgctatccccatgtgattttaa1140
tagcttcttaggagaatgac1160
<210>2
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggcggatccattaaaggtttatac24
<210>3
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttagcggccgcgtcattctcctaagaa27
- 还没有人留言评论。精彩留言会获得点赞!