用于递送多核糖核苷酸的组合物、方法和试剂盒与流程
用于递送多核糖核苷酸的组合物、方法和试剂盒
相关申请的交叉引用
1.本技术要求于2019年3月1日提交的美国临时申请号62/812,763的优先权和权益,该临时申请的全部内容通过援引并入本文。背景
2.多核糖核苷酸是用于生物活性诸如基因表达、基因调控和细胞信号转导的关键生物分子。概述
3.本文所述的发明包括用于递送多核糖核苷酸的组合物、药物组合物和方法。在某些实施例中,这些组合物和药物组合物包含乙醇和多核糖核苷酸。在其他实施例中,这些组合物和药物组合物包含醇和多核糖核苷酸。在另一个实施例中,这些组合物和药物组合物包含细胞渗透剂和多核糖核苷酸。这些方法包括将这些组合物和药物组合物施加至受试者的表面区域。
4.本文所述的发明包括不含任何载体而包含多核糖核苷酸和稀释剂的组合物。可以将这些组合物施加至上皮细胞以递送多核糖核苷酸。这些组合物可以在将消毒剂施加至表面区域之后施加至该区域。
5.在一些方面,药物组合物包含多核糖核苷酸和乙醇的混合物,其中乙醇占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,乙醇占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。在一些实施例中,乙醇占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。
6.在一些方面,药物组合物包含多核糖核苷酸和醇的混合物,其中醇占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,醇占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。在一些实施例中,醇占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇
(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。
7.在一些方面,药物组合物包含多核糖核苷酸和细胞渗透剂的混合物,其中细胞渗透剂占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,细胞渗透剂占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。在一些实施例中,细胞渗透剂占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。在一些实施例中,细胞渗透剂是醇。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。
8.在一些实施例中,多核糖核苷酸编码蛋白。在一些实施例中,蛋白是治疗性蛋白。在一些实施例中,蛋白是伤口愈合蛋白。在一些实施例中,伤口愈合蛋白是生长因子。在一些实施例中,生长因子是egf、pdgf、tgfβ或vegf。在一些实施例中,药物组合物是液体、凝胶、润肤露、糊剂、乳膏、泡沫或棒。在一些实施例中,多核糖核苷酸是线性多核糖核苷酸。在一些实施例中,多核糖核苷酸是mrna。在一些实施例中,多核糖核苷酸缺少帽或聚a尾。在一些实施例中,多核糖核苷酸是免疫原性的。在一些实施例中,多核糖核苷酸是非免疫原性的。在一些实施例中,多核糖核苷酸是环状多核糖核苷酸。在一些实施例中,多核糖核苷酸包含经修饰的核糖核苷酸。在一些实施例中,药物组合物具有约7的ph。在一些实施例中,药物组合物具有与水大致相同的粘度。在一些实施例中,药物组合物基本上不含疏水性或亲脂性基团。在一些实施例中,药物组合物基本上不含烃。在一些实施例中,药物组合物基本上不含阳离子脂质体。在一些实施例中,药物组合物基本上不含脂肪酸、脂质、脂质体、胆固醇或其任何组合。在一些实施例中,细胞渗透剂可溶于极性溶剂。在一些实施例中,细胞渗透剂不溶于极性溶剂。
9.在一些方面,治疗组合物包含多核糖核苷酸和细胞渗透剂,其中细胞渗透剂被配置用于局部施用。在一些方面,治疗组合物包含多核糖核苷酸和醇,其中醇被配置用于局部施用。
10.在一些方面,治疗组合物包含多核糖核苷酸和醇,其中多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中有效负载对细胞具有生物效应。在一些方面,治疗组合物包含多核糖核苷酸和细胞渗透剂,其中多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中有效负载对细胞具有生物效应。
11.在一些方面,治疗组合物包含多核糖核苷酸和醇,其中多核糖核苷酸的量有效产生对细胞或组织的生物效应,并且其中醇的量有效产生对细胞或组织的生物效应。在一些方面,治疗组合物包含多核糖核苷酸和细胞渗透剂,其中多核糖核苷酸的量有效产生对细胞或组织的生物效应,并且其中细胞渗透剂的量有效产生对细胞或组织的生物效应。
12.在一些方面,治疗伤口的方法包括使伤口或伤口周围的组织与包含多核糖核苷酸
和乙醇的混合物的组合物接触,其中乙醇占混合物的至少约0.3%v/v至约75%v/v。在一些方面,治疗伤口的方法包括使伤口或伤口周围的组织与包含多核糖核苷酸和醇的混合物的组合物接触,其中醇占混合物的至少约0.3%v/v至约75%v/v。在一些方面,治疗伤口的方法包括使伤口或伤口周围的组织与包含多核糖核苷酸和细胞渗透剂的混合物的组合物接触,其中细胞渗透剂占混合物的至少约0.3%v/v至约75%v/v。
13.在一些方面,治疗组合物包含多核糖核苷酸、醇和局部递送赋形剂,其中局部递送赋形剂包含稳定剂。在一些方面,治疗组合物包含多核糖核苷酸、细胞渗透剂和局部递送赋形剂,其中局部递送赋形剂包含稳定剂。在一些实施例中,稳定剂包含葡萄糖(4.5g/l)。
14.在一些方面,栓剂或其他基于脂质的配制品包含多核糖核苷酸和醇。在一些方面,栓剂或其他基于脂质的配制品包含多核糖核苷酸和细胞渗透剂。
15.在一些方面,可吸入组合物包含多核糖核苷酸、醇和推进剂的混合物。在一些方面,可吸入组合物包含多核糖核苷酸、细胞渗透剂和推进剂的混合物。
16.在一些方面,治疗组合物包含负载有多核糖核苷酸和醇的生物可降解支架。在一些方面,治疗组合物包含负载有多核糖核苷酸和细胞渗透剂的生物可降解支架。
17.在一些实施例中,细胞渗透剂包含醇。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。在一些实施例中,醇是乙醇。
18.在一些方面,将多核糖核苷酸递送至受试者的方法包括:a)将消毒剂施加至受试者的表面区域;b)将包含多核糖核苷酸和稀释剂而不含任何载体的组合物施加至该表面区域。在一些实施例中,消毒剂是醇、紫外光、激光或热。
19.在一些方面,将多核糖核苷酸递送至受试者的方法包括:a)将醇施加至受试者的表面区域;b)将包含多核糖核苷酸和稀释剂而不含任何载体的组合物施加至该表面。
20.在一些方面,将多核糖核苷酸递送至上皮细胞的方法包括将包含稀释剂和未修饰的多核糖核苷酸而不含任何载体的组合物施加至该上皮细胞。
21.在一些方面,将多核糖核苷酸递送至受试者的方法包括将包含多核糖核苷酸和乙醇的混合物的组合物局部施加至受试者的表面区域,其中乙醇占混合物的至少约0.3%v/v至约75%v/v。在一些方面,将多核糖核苷酸递送至受试者的方法包括将包含多核糖核苷酸和醇的混合物的组合物局部施加至受试者的表面区域,其中醇占混合物的至少约0.3%v/v至约75%v/v。在一些方面,将多核糖核苷酸递送至受试者的方法包括将包含多核糖核苷酸和细胞渗透剂的混合物的组合物局部施加至受试者的表面区域,其中细胞渗透剂占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,组合物将多核糖核苷酸递送至受试者的真皮或表皮组织。在一些实施例中,组合物在不使用离子导入法的情况下将多核糖核苷酸递送至受试者的真皮或表皮组织。
22.在一些方面,将多核糖核苷酸递送至细胞或组织的方法包括使细胞或组织与包含多核糖核苷酸和醇的混合物接触,其中醇占混合物的至少约0.3%v/v至约75%v/v。在一些方面,将多核糖核苷酸递送至细胞或组织的方法包括使细胞或组织与包含多核糖核苷酸和细胞渗透剂的混合物接触,其中细胞渗透剂占混合物的至少约0.3%v/v至约75%v/v。
23.在一些方面,将治疗组合物递送至细胞或组织的方法包括使该细胞或组织与包含
多核糖核苷酸和醇的治疗组合物接触,其中醇被配置用于局部施用。在一些方面,将治疗组合物递送至细胞或组织的方法包括使细胞或组织与包含多核糖核苷酸和细胞渗透剂的治疗组合物接触,其中细胞渗透剂被配置用于局部施用。
24.在一些方面,体内递送多核糖核苷酸的方法包括将包含多核糖核苷酸和醇的混合物施加在受试者的表面区域上。在一些方面,体内递送多核糖核苷酸的方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加在受试者的表面区域上。
25.在一些方面,局部递送多核糖核苷酸的方法包括将包含多核糖核苷酸和醇的混合物施加在受试者的表面区域上。在一些方面,局部递送多核糖核苷酸的方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加在受试者的表面区域上。
26.在一些方面,将治疗性多核糖核苷酸递送至受试者的方法包括将包含治疗性多核糖核苷酸和醇的混合物局部接触上皮表面、内皮表面、暴露的组织或开放性伤口。在一些方面,将治疗性多核糖核苷酸递送至受试者的方法包括将包含治疗性多核糖核苷酸和细胞渗透剂的混合物局部接触上皮表面、内皮表面、暴露的组织或开放性伤口。
27.在一些方面,治疗方法包括将包含多核糖核苷酸和醇的混合物施加至患有病状或疾病的受试者的表面区域。在一些方面,治疗方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加至患有病状或疾病的受试者的表面区域。在一些实施例中,细胞渗透剂包含醇。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。在一些实施例中,醇包括乙醇。在一些实施例中,乙醇、醇或细胞渗透剂占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。在一些实施例中,乙醇、醇或细胞渗透剂占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。在一些实施例中,该方法进一步包括将多核糖核苷酸与细胞渗透剂或醇混合。在一些实施例中,多核糖核苷酸在混合之前呈固体形式。在一些实施例中,多核糖核苷酸在混合之前被冻干。在一些实施例中,多核糖核苷酸在混合之前呈液体形式。在一些实施例中,多核糖核苷酸在混合之前溶解在溶剂中。在一些实施例中,多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中有效负载对细胞或组织具有生物效应。在一些实施例中,多核糖核苷酸的量有效产生对细胞的生物效应,并且细胞渗透剂的量有效产生对细胞或组织的生物效应。在一些实施例中,多核糖核苷酸编码蛋白。在一些实施例中,蛋白是治疗性蛋白。在一些实施例中,蛋白是伤口愈合蛋白。在一些实施例中,伤口愈合蛋白是生长因子。在一些实施例中,生长因子是egf、pdgf、tgfβ或vegf。在一些实施例中,组合物是液体、凝胶、润肤露、糊剂、乳膏、泡沫或棒。在一些实施例中,多核糖核苷酸是线性多核糖核苷酸。在一些实施例中,多核糖核苷酸是mrna。在一些实施例中,多核糖核苷酸缺少帽或聚a尾。在一些实施例中,多核糖核苷酸是免疫原性的。在一些实施例中,多核糖核苷酸是非免疫原性的。
在一些实施例中,多核糖核苷酸是环状多核糖核苷酸。在一些实施例中,多核糖核苷酸包含经修饰的核糖核苷酸。在一些实施例中,组合物具有约7的ph。在一些实施例中,组合物具有与水大致相同的粘度。在一些实施例中,组合物基本上不含疏水性或亲脂性基团。在一些实施例中,组合物基本上不含烃。在一些实施例中,组合物基本上不含阳离子脂质体。在一些实施例中,组合物基本上不含脂肪酸、脂质、脂质体、胆固醇或其任何组合。在一些实施例中,细胞渗透剂可溶于极性溶剂。在一些实施例中,细胞渗透剂不溶于极性溶剂。在一些实施例中,组合物进一步包含药学上可接受的赋形剂。在一些实施例中,递送是全身性的。在一些实施例中,递送是局部的。在一些实施例中,表面区域选自由以下组成的组:皮肤,口腔、鼻腔、耳腔、胃肠道、呼吸道、阴道、子宫颈、宫内、泌尿道和眼睛的表面区域。当表面区域是口腔、鼻腔、胃肠道、呼吸道、阴道、子宫颈、宫内、泌尿道和眼睛的表面区域时,通过非侵入性方式递送至此类表面区域的上皮层。在一些实施例中,施加包括将混合物液滴直接沉积到表面区域上。在一些实施例中,施加包括用嵌入有混合物的贴片、凝胶或膜擦拭表面区域。在一些实施例中,施加包括将混合物喷雾到表面区域上。在一些实施例中,施加包括经由气雾化将混合物施用给受试者。在一些实施例中,施加包括经由栓剂将混合物施用给受试者。在一些实施例中,施加包括经由口服摄取含有混合物的胶囊而将混合物施用给受试者,并且其中胶囊被配置成在受试者的胃肠道内释放混合物。在一些实施例中,细胞包括上皮细胞。在一些实施例中,环状多核糖核苷酸具有的翻译效率高于线性对应物至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少150%、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍或至少100倍。在一些实施例中,环状多核糖核苷酸具有的翻译效率高于线性对应物至少5倍。在一些实施例中,多核糖核苷酸具有短期生物效应。
28.在一些实施例中,多核糖核苷酸具有长期生物效应。在一些实施例中,混合物中多核糖核苷酸的浓度为至少约50ng/ml、至少约100ng/ml、至少约500ng/ml、至少约1μg/ml、至少约2μg/ml、至少约3μg/ml、至少约4μg/ml、至少约5μg/ml、至少约10μg/ml、至少约20μg/ml、至少约50μg/ml、至少约100μg/ml、至少约200μg/ml、至少约500μg/ml、至少约1mg/ml、至少约2mg/ml、至少约5mg/ml、至少约10mg/ml、至少约20mg/ml、至少约50mg/ml、或至少约100mg/ml。
29.本发明还提供了包含本文所述的药物组合物的试剂盒。在一些方面,试剂盒包括施加工具和如任一前述实施例所述的药物组合物,其中施加工具被配置成将药物组合物施加至受试者的表面区域。
30.在一些方面,试剂盒包括第一施加工具、第二施加工具、消毒剂以及包含多核糖核苷酸和稀释剂而不含任何载体的组合物,其中第一施加工具被配置成将消毒剂施加至受试者的表面区域,并且第二施加工具被配置成将组合物施加至受试者的表面区域。在一些实施例中,消毒剂是醇、紫外光、激光或热。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。在一些实施例中,第一施加工具是擦拭物。在一些实施例中,擦拭物包含消毒剂。在一些实施例中,第一施加工具是施加紫外光或激光的装置。在一些实施例中,第一施加工具是施加热量的装
置。
31.在一些方面,试剂盒包括施加工具和包含多核糖核苷酸和细胞渗透剂的混合物,其中施加工具被配置成将混合物施加至受试者的表面区域。在一些实施例中,施加工具或第二施加工具包括移液管。在一些实施例中,施加工具或第二施加工具包括基材,并且其中基材嵌入有混合物。在一些实施例中,基材由天然或人造纤维制成。
32.在某些实施例中,试剂盒包括栓剂。在一些实施例中,施加工具或第二施加工具包括贴片。在一些实施例中,施加工具或第二施加工具包括喷雾器。在一些实施例中,施加工具或第二施加工具包括雾化器。在一些实施例中,施加工具或第二施加工具包括胶囊,该胶囊被配置成在受试者的胃肠道内释放混合物。在一些实施例中,施加工具或第二施加工具被配置成以受控方式释放混合物。在一些实施例中,表面区域选自由以下组成的组:皮肤,口腔、鼻腔、胃肠道和呼吸道的表面区域,及其任何组合。
33.在另一方面,试剂盒包括本文所述的组合物和醇擦拭物。在另一方面,试剂盒包括本文所述的组合物和含有用于施加至受试者的表面区域的醇的小瓶。定义
34.本发明将针对特定实施例并参考某些附图进行描述,但是本发明不限于此,而是仅由权利要求书来限定。除非另有说明,否则下文陈述的术语通常应以其共识来理解。
35.如本文所用的术语“多核苷酸”意指包含一个或多个核酸亚基、或核苷酸的分子,并且可与“核酸”或“寡核苷酸”互换使用。多核苷酸可以包含选自腺苷(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t)和尿嘧啶(u)或其变体的一个或多个核苷酸。核苷酸可以包含核苷和至少1、2、3、4、5、6、7、8、9、10个或更多个磷酸(po3)基团。核苷酸可以包含核碱基、五碳糖(核糖或脱氧核糖)和一个或多个磷酸基团。核糖核苷酸是其中糖为核糖的核苷酸。多核糖核苷酸或核糖核酸或rna可以指包含经由磷酸二酯键聚合的多个核糖核苷酸的大分子。脱氧核糖核苷酸是其中糖是脱氧核糖的核苷酸。
36.多脱氧核糖核苷酸或脱氧核糖核酸或dna意指包含经由磷酸二酯键聚合的多个脱氧核糖核苷酸的大分子。核苷酸可以是核苷一磷酸或核苷多磷酸。核苷酸意指脱氧核糖核苷多磷酸,例如脱氧核糖核苷三磷酸(dntp),其可选自脱氧腺苷三磷酸(datp)、脱氧胞苷三磷酸(dctp)、脱氧鸟苷三磷酸(dgtp)、尿苷三磷酸(dutp)和脱氧胸苷三磷酸(dttp)dntp,其包括可检测标签,诸如发光标签或标记(例如荧光团)。核苷酸可以包含可掺入到正生长的核酸链中的任何亚基。此类亚基可以是a、c、g、t或u,或对一个或多个互补的a、c、g、t或u具有特异性的、或与嘌呤(即,a或g,或其变体)或嘧啶(即,c、t或u,或其变体)互补的任何其他亚基。在一些实例中,多核苷酸是脱氧核糖核酸(dna)、核糖核酸(rna)或其衍生物或变体。在一些情况下,仅举数例,多核苷酸是短干扰rna(sirna)、微rna(mirna)、质粒dna(pdna)、短发夹rna(shrna)、小核rna(snrna)、信使rna(mrna)、前体mrna(pre
‑
mrna)、反义rna(asrna),并且涵盖核苷酸序列及其任何结构实施例,诸如单链、双链、三链、螺旋、发夹等。在一些情况下,多核苷酸分子是环状的。多核苷酸可以具有各种长度。核酸分子可以具有至少约10个碱基、20个碱基、30个碱基、40个碱基、50个碱基、100个碱基、200个碱基、300个碱基、400个碱基、500个碱基、1千个碱基(kb)、2kb、3kb、4kb、5kb、10kb、50kb或更大的长度。多核苷酸可以从细胞或组织中分离。如本文所述,多核苷酸序列可以包括分离和纯化的dna/rna分子、合成的dna/rna分子和合成的dna/rna类似物。
37.多核苷酸,例如多核糖核苷酸或多脱氧核糖核苷酸,可以包含一种或多种核苷酸变体,包括非标准核苷酸、非天然核苷酸、核苷酸类似物和/或经修饰的核苷酸。经修饰的核苷酸的实例包括但不限于二氨基嘌呤、5
‑
氟尿嘧啶、5
‑
溴尿嘧啶、5
‑
氯尿嘧啶、5
‑
碘尿嘧啶、次黄嘌呤、黄嘌呤、4
‑
乙酰胞嘧啶、5
‑
(羧基羟基甲基)尿嘧啶、5
‑
羧基甲基氨基甲基
‑2‑
硫代尿苷、5
‑
羧基甲基氨基甲基尿嘧啶、二氢尿嘧啶、β
‑
d
‑
半乳糖基q核苷、肌苷、n6
‑
异戊烯基腺嘌呤、1
‑
甲基鸟嘌呤、1
‑
甲基肌苷、2,2
‑
二甲基鸟嘌呤、2
‑
甲基腺嘌呤、2
‑
甲基鸟嘌呤、3
‑
甲基胞嘧啶、5
‑
甲基胞嘧啶、n6
‑
腺嘌呤、7
‑
甲基鸟嘌呤、5
‑
甲基氨基甲基尿嘧啶、5
‑
甲氧基氨基甲基
‑2‑
硫尿嘧啶、β
‑
d
‑
甘露糖基q核苷、5'
‑
甲氧基羧甲基尿嘧啶、5
‑
甲氧基尿嘧啶、2
‑
甲硫基
‑
d46
‑
异戊烯基腺嘌呤、尿嘧啶
‑5‑
羟基乙酸(v)、怀丁氧苷(wybutoxosine)、假尿嘧啶、q核苷(queosine)、2
‑
硫代胞嘧啶、5
‑
甲基
‑2‑
硫尿嘧啶、2
‑
硫尿嘧啶、4
‑
硫尿嘧啶、5
‑
甲基尿嘧啶、尿嘧啶
‑5‑
羟基乙酸甲酯、尿嘧啶
‑5‑
羟基乙酸(v)、5
‑
甲基
‑2‑
硫尿嘧啶、3
‑
(3
‑
氨基
‑3‑
n
‑2‑
羧基丙基)尿嘧啶、(acp3)w、2,6
‑
二氨基嘌呤等。在一些情况下,核苷酸可以包括其磷酸部分中的修饰,包括对三磷酸部分的修饰。此类修饰的非限制性实例包括较大长度的磷酸链(例如,具有4、5、6、7、8、9、10个或更多个磷酸部分的磷酸链)和具有硫醇部分的修饰(例如,α
‑
硫代三磷酸和β
‑
硫代三磷酸)。核酸分子还可以在碱基部分(例如,在通常可用于与互补核苷酸形成氢键的一个或多个原子处和/或在通常不能与互补核苷酸形成氢键的一个或多个原子处)、糖部分或磷酸骨架处被修饰。核酸分子还可以包含胺修饰的基团,诸如氨基烯丙基1
‑
dutp(aa
‑
dutp)和氨基己基丙烯酰胺
‑
dctp(aha
‑
dctp),以允许共价附接胺反应性部分,诸如n
‑
羟基琥珀酰亚胺酯(nhs)。本披露的寡核苷酸中的标准dna碱基对或rna碱基对的替代物可以提供更高的位/立方毫米密度,更高的安全性(抵抗天然毒素的意外或有目的的合成),光编程聚合酶的更容易区分,或更低的二级结构。在betz k,malyshev da,lavergne t,welte w,diederichs k,dwyer tj,ordoukhanian p,romesberg fe,marx a.nat.chem.biol.[自然
‑
化学生物学]2012年7月;8(7):612
‑
4中描述了与用于从头和/或扩增合成的天然和突变体聚合酶相容的此类替代性碱基对,该文献出于所有目的通过援引并入本文中。
[0038]
多核糖核苷酸可以以线性或环状形式存在。如本文所用,术语“线性rna”或“线性多核糖核苷酸”可互换使用,并且意指具有自由5'和3'末端的多核糖核苷酸。在一些实施例中,线性rna具有自由5'末端或3'末端。在一些实施例中,线性rna具有非共价连接的5'或3'末端。如本文所用,术语“circrna”或“环状多核糖核苷酸”或“环状rna”可互换使用,并且意指通过共价或非共价键形成环状结构的多核糖核苷酸。在一些情况下,环状多核糖核苷酸具有连续环,其中相应线性多核糖核苷酸的典型自由5'和3’末端经由共价或非共价键或经由非核酸接头(例如,非核酸聚合物或蛋白)连接在一起。在一些情况下,本文提供的环状多核糖核苷酸可由两个或更多个线性多核糖核苷酸形成,这些线性多核糖核苷酸经由共价键或非共价键连接在一起以形成连续环结构。不受理论的束缚,可能的是,rna的多个区段可以由dna产生并且其5’自由端和3’自由端退火以产生一“串”rna,当只留有一个5’自由端和一个3’自由端时,该“串”rna最终可能会被环化。
[0039]
如本文所用,“多肽”意指最常通过肽键连接在一起的氨基酸残基(天然或非天然)的聚合物。如本文所用的该术语是指任何大小、结构或功能的蛋白、多肽和肽。多肽可以包括基因产物、天然存在的多肽、合成的多肽、同源物、直系同源物、旁系同源物、片段和前述
物质的其他等同物、变体和类似物。多肽可以是单分子或可以是多分子复合物,诸如二聚体、三聚体或四聚体。它们还可以包括单链或多链多肽,诸如抗体或胰岛素,并且可以是缔合的或连接的。最常见的二硫键存在于多链多肽中。术语多肽也可以应用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学类似物的氨基酸聚合物。
[0040]
如本文所用,术语“混合物”意指由混合的两种或更多种不同物质制成的材料。在一些情况下,本文所述的混合物可以是两种或更多种不同物质的均质混合物,例如,该混合物可以在混合物的任何给定样品中具有相同比例的其组分(例如,两种或更多种物质)。在一些情况下,如本文所提供的混合物可以是两种或更多种不同物质的异质混合物,例如混合物的组分(例如两种或更多种物质)的比例可在整个混合物中变化。在一些情况下,混合物是液体溶液,例如混合物以液相存在。在一些情况下,液体溶液可被视为包含液体溶剂和溶质。在液体溶剂中混合溶质可称为“溶解”过程。在一些情况下,液体溶液是液体在液体中的溶液(例如,液体溶质溶解在液体溶剂中)、固体在液体中的溶液(例如,固体溶质溶解在液体溶剂中)、或气体在液体中的溶液(例如,固体溶质溶解在液体溶剂中)。在一些情况下,存在多于一种溶剂和/或多于一种溶质。在一些情况下,混合物是胶体、液体悬浮液或乳液。在一些情况下,混合物是固体混合物,例如混合物以固相存在。
[0041]
如本文所用,术语“细胞渗透剂”意指当与细胞接触时促进进入细胞的试剂。在一些情况下,细胞渗透剂促进细胞膜的直接渗透,例如,经由与细胞膜的带负电荷的磷脂的直接静电相互作用,或通过诱导膜蛋白或磷脂双层的构型变化的瞬时孔形成。在一些情况下,细胞渗透剂促进胞吞作用介导的易位至细胞中。例如,在某些情况下,细胞渗透剂可以刺激细胞经历胞吞过程,由此细胞膜可以向内折叠到细胞中。在某些实施例中,细胞渗透剂有助于形成跨细胞膜转运的暂时性结构。不希望受特定理论的束缚,如本文所提供的细胞渗透剂可以增加细胞膜的渗透性或增加分子内化到细胞中,其结果是,当细胞与细胞渗透剂同时接触时,与不含细胞渗透剂的其他方面相同的递送相比,递送至细胞中可以更有效。
[0042]
如本文所用,术语“有效负载”意指由如本文所披露的多核糖核苷酸递送的任何分子。在一些情况下,有效负载是核酸、蛋白、化学品、核糖核蛋白或其任何组合。在一些情况下,有效负载是直接包含在如本文所披露的多核糖核苷酸内的核酸序列。在一些情况下,有效负载例如经由互补杂交或经由蛋白
‑
核酸相互作用与如本文所披露的多核糖核苷酸附接或缔合。在某些情况下,有效负载是由包含在多核糖核苷酸内、附接于多核糖核苷酸或与多核糖核苷酸缔合的核酸序列编码的蛋白。在一些情况下,“附接”意指两个分子之间的共价键或非共价相互作用。在一些情况下,当在有效负载与多核糖核苷酸之间的相互作用的背景下使用时,“缔合”意指有效负载与多核糖核苷酸经由其间的一个或多个其他分子间接连接。在一些情况下,附接或缔合可以是瞬时的。在一些情况下,有效负载在一种条件下与多核糖核苷酸附接或缔合,但在另一种条件下不与多核糖核苷酸附接或缔合,例如,取决于环境ph条件或者存在或不存在刺激或结合伴侣。
[0043]
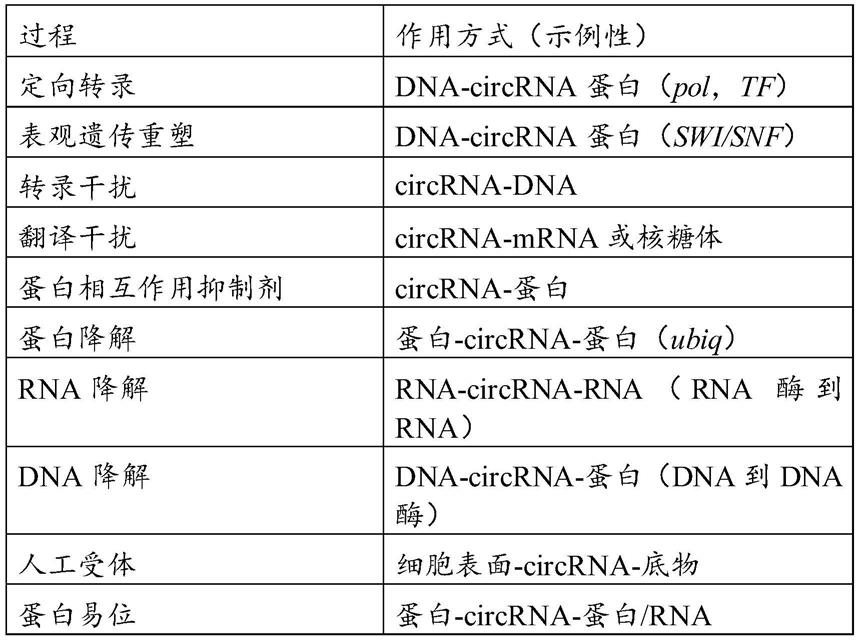
术语“对细胞的生物效应”意指对细胞的可导致细胞上或细胞中的变化(例如形态或功能变化)的任何效应。例如,对细胞的生物效应可以包括但不限于影响细胞功能的细胞内信号转导的变化,诸如但不限于细胞增殖的加速或减速、存活、细胞凋亡或细胞坏死、基因转录和mrna翻译以及某些分化的细胞功能(例如,免疫细胞的激活、神经元的激发或抑制、激素分泌细胞的激素分泌或巨噬细胞的吞噬活性)、或外源分子进入细胞的效率的改
变,例如相对于外源分子增加或降低细胞渗透性。对细胞的生物效应可以导致受试者所患疾病的一种或多种症状的改善,或治疗或根除受试者的疾病。
[0044]
术语“对组织的生物效应”意指对组织的可导致组织上或组织中的变化(例如形态或功能变化)的任何效应。例如,对组织的生物效应可以包括但不限于影响细胞功能或影响组织功能的组织内信号转导的变化,诸如但不限于组织中细胞增殖的加速或减速、组织存活、组织中细胞的凋亡、或组织坏死、组织中细胞的基因转录和mrna翻译,以及某些分化的组织功能或进入组织的外源分子的效率的变化,例如,相对于外源性分子增加或降低组织渗透性。对组织的生物效应可以导致受试者所患疾病的一种或多种症状的改善,或治疗或根除受试者的疾病。
[0045]
术语“醇”意指其中羟基官能团(
‑
oh)与碳结合的任何有机化合物。如本文所述的醇可以包括但不限于一元醇、多元醇、不饱和脂族醇和脂环族醇。在一些情况下,醇可以指乙醇。在一些情况下,醇可以包括但不限于甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。
[0046]
如本文所用,术语受试者身体的“表面区域”是指受试者的暴露于外部环境受试者身体的或具有暴露于外部环境受试者身体的可能性的任何区域。受试者身体(例如哺乳动物身体,例如人体)的表面区域可以包括皮肤,口腔、鼻腔、耳腔、胃肠道、呼吸道、阴道、子宫颈、宫内、泌尿道和眼睛的表面区域。在一些情况下,受试者身体的表面区域通常可以指上皮细胞排列在其下方的外部区域。例如,皮肤可以是如本文所讨论的一种类型的表面区域,并且可以由表皮和真皮组成,表皮形成皮肤的最外层并且可以包括上皮细胞在许多其他类型的细胞中的有组织的组装。
[0047]
如本文所用,术语“局部递送”意指将物质递送至皮肤或可通过非侵入性方式接近的上皮层,例如肠和其他胃肠(gi)上皮或阴道上皮。药物组合物的局部递送可以对受试者具有局部药效学作用,例如,局部递送的药物组合物在递送药物组合物的身体特定部位(例如皮肤)处或其附近具有药效学作用。在一些其他实施例中,如本文所讨论的药物组合物的局部递送仅用于指递送模式(局部递送至例如特定表面区域),而药物组合物可以具有局部或全身药效学作用。例如,药物组合物可以停留在施用部位的局部或附近,或者可以进入受试者身体的循环系统(例如,血液或淋巴系统),通过该循环系统,药物组合物可以被运输至身体的远端部分,这些远端部分通常是药物组合物经由循环系统以外的途径不能到达的。
[0048]
如本文所用,术语“全身递送”或“全身施用”意指将药物组合物或其他物质施用至循环系统(例如血液或淋巴系统)中的途径。全身施用可以包括口服施用、肠胃外施用、鼻内施用、舌下施用、直肠施用、透皮施用或其任何组合。如本文所用,术语“非全身递送”或“非全身施用”可以指除了药物组合物或其他物质的全身递送之外的任何其他施用途径,例如,所递送的物质不进入受试者身体的循环系统(例如血液和淋巴系统)。
[0049]
如本文所用,术语“表达序列”意指编码产物,例如肽或多肽或调控核酸的核酸序列。编码肽或多肽的示例性表达序列可以包含多个核苷酸三联体,其中每一个都可以编码氨基酸,并被称为“密码子”。
[0050]
如本文所用,术语“经修饰的核糖核苷酸”意指具有至少一个针对糖、核碱基或核苷间键的修饰的核苷酸。
[0051]
如本文所用,术语“实质性抗性”意指相较于参考物具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%抗性的物质。
[0052]
如本文所用,术语“免疫原性”意指诱导对物质的免疫反应的潜力。在一些情况下,当生物体或某种类型的免疫细胞的免疫系统暴露于免疫原性物质时,可以诱导免疫反应。术语“非免疫原性”可以指在物质的可检测阈值之上缺少或不存在免疫反应。在一些情况下,当生物体或某种类型的免疫细胞的免疫系统暴露于非免疫原性物质时,未检测到免疫反应。在一些情况下,当通过免疫原性测定法测量时,本文提供的非免疫原性多核糖核苷酸不会诱导超过预定阈值的免疫反应。例如,当使用免疫原性测定法来测量针对环状多核糖核苷酸产生的抗体时,如本文所提供的非免疫原性多核糖核苷酸可以导致抗体的产生低于预定阈值的水平。预定阈值可以是例如对照参考物产生的抗体水平的至多1.5倍、2倍、3倍、4倍或5倍。
[0053]
如本文所用,术语“复合物”意指至少两个彼此具有亲和力的部分(例如,化学部分或生物化学部分)之间的缔合。
[0054]“多肽”和“蛋白”可互换使用并且意指通过共价键(例如酰胺键)连接的两个或更多个氨基酸的聚合物。如本文所述的多肽可以包括全长蛋白(例如,完全加工的蛋白)以及较短的氨基酸序列(例如,天然存在的蛋白的片段或合成的多肽片段)。多肽可以包括天然存在的氨基酸(例如,天然合成的肽中常见并且已知以一个字母缩写(a、r、n、c、d、q、e、g、h、i、l、k、m、f、p、s、t、w、y和v)的二十种氨基酸之一)和非天然存在的氨基酸(例如,不是天然合成的肽中常见的二十种氨基酸之一的氨基酸),包括合成的氨基酸、氨基酸类似物、经修饰的氨基酸和氨基酸模拟物)。
[0055]
如本文所用,术语“载体”意指通过环状多核糖核苷酸的共价修饰、经由部分或完全包封剂或其组合促进组合物(例如环状多核糖核苷酸)转运或递送至细胞中的化合物、组合物、试剂或分子。载体的非限制性实例包括碳水化合物载体(例如,酸酐修饰的植物糖原或糖原型材料)、纳米颗粒(例如,包封或共价连接结合至环状多核糖核苷酸的纳米颗粒)、脂质体、融合体、离体分化的网织红细胞、外来体、蛋白载体(例如,共价连接至环状多核糖核苷酸的蛋白)或阳离子载体(例如,阳离子脂聚合物或转染试剂)。
[0056]
如本文所用,术语“药学上可接受的”和“治疗上可接受的”可互换使用。“治疗上可接受的”组分意指不是生物学上或其他方面不合需要的组分,例如,该组分可以掺入本发明的药物配制品中并如本文所述施加给患者,而不引起任何显著的不合需要的生物效应或以有害方式与包含该组分的配制品的任何其他组分相互作用。当术语“治疗上可接受的”用于指赋形剂时,它意味着该组分已经满足毒理学和制造测试的所需标准或它包括在由美国食品药品监督管理局(u.s.food and drug administration)编制的inactive ingredient guide[无活性成分指南]上。
[0057]
如本文所用,术语“裸递送”或“裸rna”意指用于递送至细胞的rna配制品,其不借助于载体并且不对有助于递送至细胞的部分进行共价修饰。裸递送配制品不含任何转染试剂、阳离子载体、碳水化合物载体、纳米颗粒载体或蛋白载体。例如,环状多核糖核苷酸的裸递送配制品是包含未经共价修饰的环状多核糖核苷酸且不含载体的配制品。
[0058]
如本文所用,术语“稀释剂”意指包含无活性溶剂的媒介物,本文所述的组合物(例如,包含环状多核糖核苷酸的组合物)可以稀释或溶解在其中。稀释剂可以是rna增溶剂、缓
冲剂、等渗剂或其混合物。稀释剂可以是液体稀释剂或固体稀释剂。液体稀释剂的非限制性实例包括水或其他溶剂、增溶剂和乳化剂,诸如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3
‑
丁二醇(1,3
‑
butylene glycol)、二甲基甲酰胺、油(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、丙三醇、四氢糠醇、聚乙二醇、和脱水山梨糖醇的脂肪酸酯,以及1,3
‑
丁二醇(1,3
‑
butanediol)。固体稀释剂的非限制性实例包括碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、磷酸钠、乳糖、蔗糖、纤维素、微晶纤维素、高岭土、甘露醇、山梨醇、肌醇、氯化钠、干淀粉、玉米淀粉或糖粉。
[0059]
如本文所用,术语“消毒剂”意指抑菌、杀菌和/或主动杀灭微生物、灭活微生物或防止微生物生长的任何试剂。杀灭微生物的消毒剂可以是抗微生物剂和/或防腐剂。在一些实施例中,消毒剂是液体,诸如醇、碘或过氧化氢。在一些实施例中,消毒剂是紫外光或激光。在一些实施例中,消毒剂是通过电或通过其他方式(例如,蒸气、接触)传递的热。通过引用并入
[0060]
本说明书中提到的所有出版物、专利和专利申请均通过援引并入本文,其程度如同明确地和单独地指明将各个出版物、专利或者专利申请通过援引并入本文一样。
附图说明
[0061]
当结合附图阅读时,将更好地理解以下详细描述的本发明的实施例。出于说明本发明的目的,在附图中示出了本发明示例的实施例。然而,应当理解,本发明不限于附图中所示实施例的精确安排和手段。
[0062]
图1说明了一个实例,其中将示例性的线性和环状rna局部递送至小鼠的耳朵皮肤,并在递送后6小时至3天检查它们在耳朵组织中的rna水平。
[0063]
图2a和图2b是总结了在增进剂(boost)(乙醇)的帮助下局部递送线性或环状rna后6小时、1天、3天或12天得自小鼠耳朵打孔样品的qpcr结果的图。图2a显示了使用用于检测线性和环状rna的引物进行的qpcr测定的结果。图2b显示了使用用于检测环状rna而不是线性rna的引物进行的qpcr测定的结果。
[0064]
图3a和图3b是总结了在增进剂(乙醇)和transit mrna剂(米卢斯生物有限责任公司(mirus bio,llc),一种阳离子、非脂质体聚合物脂质转运剂)两者的帮助下局部递送线性或环状rna后6小时、1天、3天或12天得自小鼠耳朵打孔样品的qpcr结果的图。图3a显示了使用用于检测线性和环状rna的引物进行的qpcr测定的结果。图3b显示了使用用于检测环状rna而不是线性rna的引物进行的qpcr测定的结果。
[0065]
图4说明了使用dmso凝胶(rna)或单独的dmso凝胶(媒介物)局部施用的rna的蛋白表达。
[0066]
图5说明了用强生(johnson&johnson)婴儿润肤露(rna)或单独的强生婴儿润肤露(媒介物)配制的局部施用的rna的蛋白表达。
[0067]
图6说明了使用乙醇(rna)或单独的乙醇(媒介物)的情况下局部施用的rna的蛋白表达。
[0068]
图7显示了局部施用circrna
‑
cy5导致将rna递送至组织的荧光图像(b/w)。
[0069]
图8显示了局部施用circrna
‑
cy5导致将rna递送至组织的荧光图像的定量。
[0070]
图9显示了局部施用mrna
‑
cy5导致将rna递送至组织的荧光图像(b/w)。
[0071]
图10显示了局部施用mrna
‑
cy5导致将rna递送至组织的荧光图像的定量。
[0072]
图11显示了当在施加前用乙醇擦拭物擦拭组织时,局部施用mrna导致在施用后第1天和第4天将rna递送至组织。
[0073]
图12显示了当在施加前用异丙醇擦拭物擦拭组织时,局部施用mrna导致在施用后第1天和第4天将rna递送至组织。
[0074]
图13显示了当在施加前用乙醇擦拭物擦拭组织时,局部施用环状rna导致在施用后第1天和第4天将rna递送至组织。
[0075]
图14显示了局部施用与10%乙醇混合的环状rna导致在施用后第1天和第4天将rna递送至组织。
[0076]
图15显示了局部施用与10%异丙醇混合的环状rna导致在施用后第1天和第4天将rna递送至组织。
[0077]
图16显示了当在施加前用异丙醇擦拭物擦拭组织时,局部施用环状rna导致在施用后第1天和第4天将rna递送至组织。
[0078]
图17显示了局部施用与pbs、pbs和10%乙醇、或pbs和10%异丙醇混合的线性mrna导致在施用后第1天将rna递送至组织,而局部施用与pbs和10%乙醇、或pbs和10%异丙醇混合的线性mrna导致在施用后第4天将rna递送至组织。
[0079]
图18显示了当在施加前用乙醇擦拭物擦拭组织时,局部施用circrna导致组织中功能性蛋白的表达。
[0080]
图19显示了当circrna与10%乙醇一起施用时,局部施用circrna导致将rna递送至组织。
[0081]
图20显示了当circrna与10%异丙醇一起施用时,局部施用circrna导致将rna递送至组织。
[0082]
图21显示了当在施加前用乙醇擦拭物擦拭皮肤时,局部施用mrna导致将rna递送至组织。
[0083]
图22显示了当mrna仅与pbs一起施用时,局部施用mrna导致将rna递送至组织。
[0084]
图23显示了当mrna与10%异丙醇一起施用时,局部施用mrna导致将rna递送至组织。
具体实施方式
[0085]
本披露整体涉及多核糖核苷酸的药物组合物、制剂和递送及其应用。多核糖核苷酸可以是线性多核糖核苷酸、环状多核糖核苷酸(circrna)或其组合。
[0086]
在一些方面,本披露提供了用于将多核糖核苷酸递送至细胞的组合物和方法。在一些情况下,本文提供的组合物和方法将多核糖核苷酸离体或体内递送至细胞中。在某些实施例中,本文提供的组合物和方法特别可用于将多核糖核苷酸局部递送至受试者的细胞中。在一些情况下,本文提供的组合物和方法递送多核糖核苷酸用于治疗性应用,诸如预防或治疗受试者的疾病。
[0087]
本文披露的组合物可以包含多核糖核苷酸和醇诸如乙醇的混合物。本文披露的方法可以包括在包含多核糖核苷酸和醇诸如乙醇的混合物的组合物中递送多核糖核苷酸。在一些方面,本披露提供了包含多核糖核苷酸和用于将多核糖核苷酸递送至细胞中的醇(例
如,乙醇)的试剂盒。在一些实施例中,试剂盒包括消毒剂。在特定实施例中,试剂盒包括多核糖核苷酸和醇擦拭物(例如,乙醇擦拭物、异丙基擦拭物)。
[0088]
本文披露的组合物可以包含多核糖核苷酸和细胞渗透剂的混合物。本文披露的方法可以包括在包含多核糖核苷酸和细胞渗透剂的混合物的组合物中递送多核糖核苷酸。在一些方面,本披露提供了包含多核糖核苷酸和用于将多核糖核苷酸递送至细胞中的细胞渗透剂的试剂盒。在一些实施例中,试剂盒包括消毒剂。
[0089]
本文披露的组合物可以是包含多核糖核苷酸和稀释剂而不含任何载体的组合物。该组合物可用于递送至上皮细胞的方法中。
[0090]
在一些实施例中,本文所述的组合物、治疗组合物或药物组合物直接施用至表面区域(例如,局部表面区域)。在一些实施例中,在施加消毒剂后,将本文所述的组合物、治疗组合物或药物组合物施加至受试者的表面区域。
[0091]
本文提供的组合物、方法和试剂盒可以提供简单有效的将多核糖核苷酸递送至细胞中的解决方案。与不存在细胞渗透剂相比,在存在细胞渗透剂的情况下,多核糖核苷酸可以更有效地递送至细胞中。在一些情况下,与不存在细胞渗透剂的情况下的多核苷酸递送效率相比,本文所述的细胞渗透剂可使多核苷酸递送效率增加至少约10%、15%、20%、30%、40%、50%、60%、70%、80%、90%、100%、120%、150%、200%、250%、300%、400%、500%、600%、700%、800%、900%、1000%、2000%、5000%、8000%、10,000%、20,000%或50,000%。用于多核糖核苷酸递送的组合物
[0092]
在一些方面,本披露提供了用于递送多核糖核苷酸的组合物或药物组合物。这些组合物或药物组合物可以包含用于将多核糖核苷酸递送至细胞的醇(例如乙醇)。这些组合物或药物组合物可以包含细胞渗透剂。细胞渗透剂被配置成增强多核糖核苷酸向细胞中的递送。多核糖核苷酸可以以线性或环状形式存在。
[0093]
在一些情况下,本文提供的组合物或药物组合物适用于治疗性应用,例如,多核糖核苷酸是当将组合物施用给受试者时具有治疗效果的治疗性多核糖核苷酸。在一些方面,多核糖核苷酸编码促进伤口愈合的蛋白。
[0094]
在某些方面,本披露提供治疗组合物和施用本文所述的组合物、治疗组合物或药物组合物的方法。在一些实施例中,将本文所述的组合物、治疗组合物或药物组合物直接施用至表面区域(例如,局部表面区域)。在一些实施例中,在施加消毒剂后,将本文所述的组合物、治疗组合物或药物组合物施加至受试者的表面区域。
[0095]
细胞渗透剂被配置成增强多核糖核苷酸向细胞中的递送。在一些情况下,本文提供的组合物适用于治疗性应用,例如,多核糖核苷酸是当将组合物施用给受试者时具有治疗效果的治疗性多核糖核苷酸。在一些方面,本披露提供治疗组合物和施用本文所述的治疗组合物的方法。多核糖核苷酸可以以线性或环状形式存在。
[0096]
如本文所述的组合物或药物组合物可用于伤口治疗。例如,治疗伤口的方法可以包括使伤口或伤口周围的组织与如本文所述的组合物或药物组合物接触。在一些实施例中,组合物或药物组合物的多核糖核苷酸包含编码生长因子诸如egf、pdgf、tgfβ或vegf的序列。醇
[0097]
如本文所述的醇可用于将多核糖核苷酸递送至细胞中。醇可以与如本文所述的多核糖核苷酸混合,用于将多核糖核苷酸递送至细胞中。该混合物可以包含至少约0.3%v/v至约75%v/v的醇。该醇可以是乙醇。在一些实施例中,将混合物施加至受试者的表面区域。在一些实施例中,该混合物是药物组合物。
[0098]
醇可以是包含一个或多个羟基官能团的任何醇。在一些情况下,醇是但不限于一元醇、多元醇、不饱和脂族醇或脂环族醇。醇可以包括甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素中的一种或多种。在某些实施例中,醇是乙醇。
[0099]
在其他情况下,本文提供的组合物、药物组合物和方法仅包括醇而不具有或不使用任何其他试剂来增强多核糖核苷酸向细胞中的递送。在一些情况下,醇是乙醇,并且组合物、药物组合物和方法不具有或不使用任何其他试剂来增强多核糖核苷酸向细胞中的递送。在一些情况下,醇是细胞渗透剂。在一些情况下,醇不是细胞渗透剂。
[0100]
本文披露的组合物可以包括醇和多核糖核苷酸的混合物。在一些情况下,多核糖核苷酸存在于与醇的预混合混合物中。在一些情况下,多核糖核苷酸在与细胞接触之前与醇分开提供。在这些情况下,多核糖核苷酸在施加至细胞时与醇接触,并混合在一起以将多核糖核苷酸递送至细胞中。不受特定理论的束缚,混合物中醇的浓度可以有助于递送效率。因此,在一些情况下,在混合物中以预定的浓度提供醇。在一些其他情况下,当醇和多核糖核苷酸最初是分开的,但当施加以用于递送时混合在一起时,醇以相对于多核糖核苷酸足够的量提供,该量将确保其在混合物中达到最小预定浓度。
[0101]
在一些情况下,醇占混合物的至少约0.01%、至少约0.02%、至少约0.03%、至少约0.04%、至少约0.05%、至少约0.06%、至少约0.07%、至少约0.08%、至少约0.09%、至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约0.6%、至少约0.7%、至少约0.9%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、或至少约98%体积比(v/v)。在一些情况下,醇占混合物的至多约0.01%、至多约0.02%、至多约0.03%、至多约0.04%、至多约0.05%、至多约0.06%、至多约0.07%、至多约0.08%、至多约0.09%、至多约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%或90%v/v。在一些情况下,醇占混合物的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约98%或约100%v/v。
[0102]
在一些情况下,醇占混合物的至少约0.01%、至少约0.02%、至少约0.03%、至少约0.04%、至少约0.05%、至少约0.06%、至少约0.07%、至少约0.08%、至少约0.09%、至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约0.6%、至少约0.7%、至少约0.9%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、或至少约98%重量比(w/w)。在一些情况下,醇占混合物的至多约0.01%、至多约0.02%、至多约
0.03%、至多约0.04%、至多约0.05%、至多约0.06%、至多约0.07%、至多约0.08%、至多约0.09%、至多约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%或90%w/w。在一些情况下,细胞渗透剂占混合物的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%或约98%w/w。在一些情况下,醇占混合物的约10%v/v。
[0103]
在一些实施例中,醇占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v,或其间的任何百分比v/v。在一些实施例中,醇占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v,或其间的任何百分比v/v。
[0104]
在一些情况下,本文所述的混合物是液体溶液。例如,醇本身是液体物质。在这些情况下,多核糖核苷酸也可以溶解在液体溶液中。
[0105]
在一些情况下,乙醇占混合物的至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约0.6%、至少约0.7%、至少约0.9%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、或至少约98%体积比(v/v)。在一些情况下,乙醇占混合物的至多约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%或90%v/v。在一些情况下,乙醇占混合物的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约98%或约100%v/v。在一些情况下,乙醇占混合物的约10%v/v。
[0106]
在一些实施例中,乙醇占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v,或其间的任何百分比v/v。在一些实施例中,乙醇占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v,或其间的任何百分比v/v。细胞渗透剂
[0107]
本文所述的细胞渗透剂可以包括增强多核糖核苷酸递送至细胞中的任何物质。细胞渗透剂可以包括有机化合物或无机分子。在一些情况下,细胞渗透剂是具有一个或多个官能团的有机化合物,诸如但不限于烷烃、烯烃和芳烃;卤素取代的烷烃、烯烃和芳烃;醇、酚(苯的衍生物)、醚、醛、酮和羧酸;胺和腈。在一些实施例中,细胞渗透剂可溶于极性溶剂。
在一些实施例中,细胞渗透剂不溶于极性溶剂。多核糖核苷酸可以以线性或环状形式存在。
[0108]
细胞渗透剂可以包括有机化合物,诸如具有一个或多个羟基官能团的醇。在一些情况下,细胞渗透剂包括醇,诸如但不限于一元醇、多元醇、不饱和脂族醇和脂环族醇。细胞渗透剂可以包括甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素中的一种或多种。在某些实施例中,细胞渗透剂包括乙醇。
[0109]
在其他情况下,本文提供的组合物和方法仅包括醇作为细胞渗透剂,而不具有或不使用任何其他试剂来增强多核糖核苷酸向细胞中的递送。在一些情况下,细胞渗透剂包括乙醇和可增强多核糖核苷酸递送至细胞中的任何其他醇。在一些情况下,细胞渗透剂包括乙醇和可增强多核糖核苷酸递送至细胞中的任何其他有机或无机分子。在一些情况下,细胞渗透剂包括乙醇和脂质体或纳米颗粒,诸如在国际公开号wo 2013006825、wo 2016036735、wo 2018112282a1和wo 2012031043a1中描述的那些,其各自通过援引以其全文并入本文。在一些情况下,细胞渗透剂包括乙醇和细胞渗透肽或蛋白,诸如以下文献中描述的那些:bechara等人,cell
‑
penetrating peptides:20 years later,where do we stand?[细胞渗透肽:20年后,我们在哪里?]febs letters[欧洲生化学会联合会快报]587(12):1693
‑
1702(2013);langel,cell
‑
penetrating peptides:processes and applications[细胞渗透肽:过程和应用](佛罗里达州波卡拉顿crc出版社(crc press,boca raton fl,2002));el
‑
andaloussi等人,curr.pharm.des.[当今药物设计]11(28):3597
‑
611(2003);deshayes等人,cell.mol.life sci.[细胞和分子生命科学]62(16):1839
‑
49(2005);美国专利公开号us 20130129726、us 20130137644和us 20130164219,其各自通过援引以其全文并入本文)。在一些情况下,乙醇与其他细胞渗透剂的比率为约1:0.001、1:0.002、1:005、1:008、1:0.01、1:0.02、1:0.05、1:0.08、1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1、1:1.2、1:1.5、1:1.8、1:2、1:2.5、1:3、1:3.5、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:15、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:120、1:150、1:200、1:250、1:500或1:1000。在一些情况下,乙醇与其他细胞渗透剂的比率为至少约1:0.001、1:0.002、1:005、1:008、1:0.01、1:0.02、1:0.05、1:0.08、1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1、1:1.2、1:1.5、1:1.8、1:2、1:2.5、1:3、1:3.5、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:15、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:120、1:150、1:200、1:250或1:500。
[0110]
本文披露的组合物可以包含细胞渗透剂和多核糖核苷酸的混合物。在一些情况下,多核糖核苷酸存在于与细胞渗透剂预混合的混合物中。在一些情况下,多核糖核苷酸在与细胞接触之前与细胞渗透剂分开提供。在这些情况下,多核糖核苷酸与细胞渗透剂在施加至细胞时接触,并混合在一起以将多核糖核苷酸递送至细胞中。不受特定理论的束缚,混合物中细胞渗透剂的浓度可有助于递送效率。因此,在一些情况下,在混合物中以预定浓度提供细胞渗透剂。在一些其他情况下,当细胞渗透剂和多核糖核苷酸最初是分开的,但当施加以用于递送时混合在一起时,细胞渗透剂以相对于多核糖核苷酸足够的量提供,该量将确保其在混合物中达到最小预定浓度。
[0111]
在一些情况下,细胞渗透剂占混合物的至少约0.01%、至少约0.02%、至少约0.03%、至少约0.04%、至少约0.05%、至少约0.06%、至少约0.07%、至少约0.08%、至少
约0.09%、至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约0.6%、至少约0.7%、至少约0.9%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、或至少约98%体积比(v/v)。在一些情况下,细胞渗透剂占混合物的至多约0.01%、至多约0.02%、至多约0.03%、至多约0.04%、至多约0.05%、至多约0.06%、至多约0.07%、至多约0.08%、至多约0.09%、至多约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%或90%v/v。在一些情况下,细胞渗透剂占混合物的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约98%或约100%v/v。
[0112]
在一些情况下,细胞渗透剂占混合物的至少约0.01%、至少约0.02%、至少约0.03%、至少约0.04%、至少约0.05%、至少约0.06%、至少约0.07%、至少约0.08%、至少约0.09%、至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约0.6%、至少约0.7%、至少约0.9%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、或至少约98%重量比(w/w)。在一些情况下,细胞渗透剂占混合物的至多约0.01%、至多约0.02%、至多约0.03%、至多约0.04%、至多约0.05%、至多约0.06%、至多约0.07%、至多约0.08%、至多约0.09%、至多约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%或90%w/w。在一些情况下,细胞渗透剂占混合物的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%或约98%w/w。在一些情况下,细胞渗透剂占混合物的约10%v/v。
[0113]
在一些情况下,本文所述的混合物是液体溶液。例如,细胞渗透剂本身是液体物质。替代性地,细胞渗透剂是固体、液体或气体物质并溶解在液体载体例如水中。在这些情况下,多核糖核苷酸也可以溶解在液体溶液中。
[0114]
在一些情况下,乙醇占混合物的至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约0.6%、至少约0.7%、至少约0.9%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、或至少约98%体积比(v/v)。在一些情况下,乙醇占混合物的至多约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、20%、30%、40%、50%、60%、70%、80%或90%v/v。在一些情况下,乙醇占混合物的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约98%或约100%v/v。在一些情况下,乙醇占混合物的约10%v/v。多核糖核苷酸
[0115]
本披露的方面涉及用于将多核糖核苷酸离体或体内递送至细胞中的组合物和方法。多核糖核苷酸可以是线性多核糖核苷酸或环状多核糖核苷酸。在一些情况下,多核糖核苷酸对施用这些多核糖核苷酸的细胞或受试者具有生物效应。本披露的方面提供了包含多
核糖核苷酸的药物组合物,当将该组合物递送至受试者的细胞中(例如直接施用)或递送至待施用给受试者的细胞中(细胞移植或细胞输注)时,这些多核糖核苷酸对受试者具有治疗作用。如本文所述的多核糖核苷酸可以与醇(例如乙醇)在药物组合物中混合。如本文所述的多核糖核苷酸可以与稀释剂在不含任何载体的组合物中混合。
[0116]
多核糖核苷酸可以包括表达产物的序列。替代性地或另外,多核糖核苷酸包括与其他实体(例如,靶标)结合的序列,这些实体诸如为核酸(例如,rna、dna、rna
‑
dna杂合体)、小分子(例如,药物)、适体、多肽、蛋白、脂质、磷脂(例如,pi(4,5)p2)、碳水化合物、抗体、病毒、病毒颗粒、膜、多组分复合物、细胞、其他细胞部分、其任何片段及其任何组合。来自多核糖核苷酸的序列的表达和/或多核糖核苷酸与靶标的结合可以具有多种生物效应。在一些情况下,多核糖核苷酸调节细胞功能,例如瞬时或长期调节。在某些实施例中,细胞功能发生稳定地改变,例如调节持续存在至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或更长时间或其间的任何时间。在某些实施例中,细胞功能发生瞬时地改变,例如调节持续存在不超过约30分钟至约7天、或不超过约1小时、2小时,3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。
[0117]
多核糖核苷酸可以是至少约20个核苷酸、至少约30个核苷酸、至少约40个核苷酸、至少约50个核苷酸、至少约75个核苷酸、至少约100个核苷酸、至少约200个核苷酸、至少约300个核苷酸、至少约400个核苷酸、至少约500个核苷酸或至少约1,000个核苷酸。在一些情况下,多核糖核苷酸具有足够的大小以容纳核糖体的结合位点,用于从多核糖核苷酸表达序列。在一些情况下,多核糖核苷酸具有足够的大小以容纳靶标的结合位点,从而表现出多核糖核苷酸的调控功能,诸如抑制靶标mrna的翻译、降解靶标mrna、调节靶标rna的剪接,以及促进靶标受体与其配体之间的结合。本领域技术人员可以理解,线性或环状多核糖核苷酸的最大大小可以与产生线性或环状多核糖核苷酸和/或使用环状多核糖核苷酸的技术限制内的一样大。在一些情况下,本文提供的线性或环状多核糖核苷酸的最大大小可受包装和递送rna至靶标的能力的限制。在一些情况下,多核糖核苷酸的大小是足以编码有用多肽的长度,并且因此小于约20,000个核苷酸、小于约15,000个核苷酸、小于约10,000个核苷酸、小于约7,500个核苷酸、或小于约5,000个核苷酸、小于约4,000个核苷酸、小于约3,000个核苷酸、小于约2,000个核苷酸、小于约1,000个核苷酸、小于约500个核苷酸、小于约400个核苷酸、小于约300个核苷酸、小于约200个核苷酸、小于约100个核苷酸的长度可能是有用的。
[0118]
本文提供的多核糖核苷酸可以相对于参考序列,特别是亲本多核糖核苷酸具有一个或多个修饰,诸如取代、插入和/或添加、缺失和共价修饰。例如,多核糖核苷酸包括一个或多个转录后修饰(例如,加帽、切割、聚腺苷酸化、剪接、聚a序列、甲基化、酰化、磷酸化、赖氨酸和精氨酸残基的甲基化、乙酰化、以及硫醇基团和酪氨酸残基的亚硝基化等)。多核糖核苷酸可以包含选自由以下组成的组的至少一种核苷:吡啶
‑4‑
酮核糖核苷、5
‑
氮杂
‑
尿苷、2
‑
硫代
‑5‑
氮杂
‑
尿苷、2
‑
硫尿苷、4
‑
硫代
‑
假尿苷、2
‑
硫代
‑
假尿苷、5
‑
羟基尿苷、3
‑
甲基尿
苷、5
‑
羧基甲基尿苷、1
‑
羧基甲基
‑
假尿苷、5
‑
丙炔基尿苷、1
‑
丙炔基
‑
假尿苷、5
‑
牛磺酸基甲基尿苷、1
‑
牛磺酸基甲基假尿苷、5
‑
牛磺酸基甲基
‑2‑
硫代
‑
尿苷、1
‑
牛磺酸基甲基
‑4‑
硫代
‑
尿苷、5
‑
甲基
‑
尿苷、1
‑
甲基
‑
假尿苷、4
‑
硫代
‑1‑
甲基
‑
假尿苷、2
‑
硫代
‑1‑
甲基
‑
假尿苷、1
‑
甲基_1_去氮_假尿苷、2
‑
硫代
‑1‑
甲基
‑1‑
去氮
‑
假尿苷、二氢尿苷、二氢假尿苷、2
‑
硫代
‑
二氢尿苷、2
‑
硫代
‑
二氢假尿苷、2
‑
甲氧基尿苷、2
‑
甲氧基
‑4‑
硫代
‑
尿苷、4
‑
甲氧基
‑
假尿苷和4
‑
甲氧基
‑2‑
硫代
‑
假尿苷。在一些情况下,mrna包含选自由以下组成的组的至少一种核苷:5
‑
氮杂
‑
胞苷、假异胞苷、3
‑
甲基
‑
胞苷、n4
‑
乙酰基胞苷、5
‑
甲酰基胞苷、n4
‑
甲基胞苷、5
‑
羟基甲基胞苷、1
‑
甲基
‑
假异胞苷、吡咯并
‑
胞苷、吡咯并
‑
假异胞苷、2
‑
硫代
‑
胞苷、2
‑
硫代
‑5‑
甲基
‑
胞苷、4
‑
硫代
‑
假异胞苷、4
‑
硫代
‑1‑
甲基
‑
假异胞苷、4
‑
硫代
‑1‑
甲基
‑1‑
去氮
‑
假异胞苷、1
‑
甲基
‑1‑
去氮
‑
假异胞苷、折布拉林(zebularine)、5
‑
氮杂
‑
折布拉林、5
‑
甲基
‑
折布拉林、5
‑
氮杂
‑2‑
硫代
‑
折布拉林、2
‑
硫代
‑
折布拉林、2
‑
甲氧基
‑
胞苷、2
‑
甲氧基
‑5‑
甲基
‑
胞苷、4
‑
甲氧基
‑
假异胞苷和4
‑
甲氧基
‑1‑
甲基
‑
假异胞苷。在一些情况下,mrna包含选自由以下组成的组的至少一种核苷:2
‑
氨基嘌呤、2,6
‑
二氨基嘌呤、7
‑
去氮
‑
腺嘌呤、7
‑
去氮
‑8‑
氮杂
‑
腺嘌呤、7
‑
去氮
‑2‑
氨基嘌呤、7
‑
去氮
‑8‑
氮杂
‑2‑
氨基嘌呤、7
‑
去氮
‑
2,6
‑
二氨基嘌呤、7
‑
去氮
‑8‑
氮杂
‑
2,6
‑
二氨基嘌呤、1
‑
甲基腺苷、n6
‑
甲基腺苷、n6
‑
异戊烯基腺苷、n6
‑
(顺式
‑
羟基异戊烯基)腺苷、2
‑
甲基硫代
‑
n6
‑
(顺式
‑
羟基异戊烯基)腺苷、n6
‑
甘氨酰氨甲酰基腺苷、n6
‑
苏氨酰氨甲酰基腺苷、2
‑
甲基硫代
‑
n6
‑
苏氨酰氨甲酰基腺苷、n6,n6
‑
二甲基腺苷、7
‑
甲基腺嘌呤、2
‑
甲基硫代
‑
腺嘌呤和2
‑
甲氧基
‑
腺嘌呤。在一些情况下,mrna包含选自由以下组成的组的至少一种核苷:1
‑
甲基
‑
肌苷、怀俄苷、怀丁苷、7
‑
去氮
‑
鸟苷、7
‑
去氮
‑8‑
氮杂
‑
鸟苷、6
‑
硫代
‑
鸟苷、6
‑
硫代
‑7‑
去氮
‑
鸟苷、6
‑
硫代
‑7‑
去氮
‑8‑
氮杂
‑
鸟苷、7
‑
甲基
‑
鸟苷、6
‑
硫代
‑7‑
甲基
‑
鸟苷、7
‑
甲基肌苷、6
‑
甲氧基
‑
鸟苷、1
‑
甲基鸟苷、n2
‑
甲基鸟苷、n2,n2
‑
二甲基鸟苷、8
‑
氧代
‑
鸟苷、7
‑
甲基
‑8‑
氧代
‑
鸟苷、1
‑
甲基
‑6‑
硫代
‑
鸟苷、n2
‑
甲基
‑6‑
硫代
‑
鸟苷和n2,n2
‑
二甲基
‑6‑
硫代
‑
鸟苷。在一些实施例中,多核糖核苷酸缺少帽。在一些实施例中,多核糖核苷酸缺少聚a尾。在一些实施例中,多核糖核苷酸是非免疫原性的。在一些实施例中,多核糖核苷酸是免疫原性的。
[0119]
多核糖核苷酸可以包括任何有用的修饰,诸如针对糖、核碱基或核苷间键(例如针对连接的磷酸/针对磷酸二酯键/针对磷酸二酯骨架)。嘧啶核碱基的一个或多个原子可以被任选取代的氨基、任选取代的硫醇、任选取代的烷基(例如甲基或乙基)或卤代(例如氯代或氟代)替代或取代。在某些实施例中,在每个糖和核苷间键中存在修饰(例如,一个或多个修饰)。修饰可以是对脱氧核糖核酸(dna)、苏糖核酸(tna)、乙二醇核酸(gna)、肽核酸(pna)、锁核酸(lna)或其杂交体的核糖核酸(rna)修饰。本文描述了其他修饰。
[0120]
不同的糖修饰、核苷酸修饰和/或核苷间键合(例如骨架结构)可以存在于本文提供的多核糖核苷酸中的不同位置。本领域普通技术人员将理解,核苷酸类似物或其他一个或多个修饰可以位于多核糖核苷酸的任何一个或多个位置,使得多核糖核苷酸的功能基本上不降低。多核糖核苷酸可以包含约1%至约100%的经修饰核苷酸(相对于总核苷酸含量,或相对于一种或多种类型的核苷酸,例如a、g、u或c中的任何一种或多种)或任何中间百分比(例如,1%至20%、1%至25%、1%至50%、1%至60%、1%至70%、1%至80%、1%至90%、1%至95%、10%至20%、10%至25%、10%至50%、10%至60%、10%至70%、10%到80%、10%至90%、10%至95%、10%至100%、20%至25%、20%至50%、20%至60%、20%
至70%、20%至80%、20%至90%、20%至95%、20%至100%、50%至60%、50%至70%、50%至80%、50%至90%、50%至95%、50%至100%、70%至80%、70%至90%、70%至95%、70%至100%、80%至90%、80%至95%、80%至100%、90%至95%、90%至100%和95%至100%)。
[0121]
在一些情况下,混合物中多核糖核苷酸的浓度为至少约0.1ng/ml、至少约0.2ng/ml、至少约0.5ng/ml、至少约1ng/ml、至少约5ng/ml、至少约10ng/ml、至少约20ng/ml、至少约50ng/ml、至少约100ng/ml、至少约200ng/ml、至少约500ng/ml、至少约1μg/ml、至少约2μg/ml、至少约3μg/ml、至少约4μg/ml、至少约5μg/ml、至少约10μg/ml、至少约20μg/ml、至少约30μg/ml、至少约40μg/ml、至少约50μg/ml、至少约100μg/ml、至少约200μg/ml、至少约300μg/ml、至少约400μg/ml、至少约500μg/ml、至少约1mg/ml、至少约2mg/ml、至少约5mg/ml、至少约10mg/ml、至少约20mg/ml、至少约50mg/ml、或至少约100mg/ml。在一些情况下,混合物中多核糖核苷酸的浓度为至多约0.1ng/ml、至多约0.2ng/ml、至多约0.5ng/ml、至多约1ng/ml、至多约5ng/ml、至多约10ng/ml、至多约20ng/ml、至多约50ng/ml、至多约100ng/ml、至多约200ng/ml、至多约500ng/ml、至多约1μg/ml、至多约2μg/ml、至多约3μg/ml、至多约4μg/ml、至多约5μg/ml、至多约10μg/ml、至多约20μg/ml、至多约30μg/ml、至多约40μg/ml、至多约50μg/ml、至多约100μg/ml、至多约200μg/ml、至多约300μg/ml、至多约400μg/ml、至多约500μg/ml、至多约1mg/ml、至多约2mg/ml、至多约5mg/ml、至多约10mg/ml、至多约20mg/ml、至多约50mg/ml、或至多约100mg/ml。
[0122]
在一些情况下,混合物中多核糖核苷酸的浓度为约0.1ng/ml、约0.2ng/ml、约0.5ng/ml、约1ng/ml、约5ng/ml、约10ng/ml、约20ng/ml、约50ng/ml、约100ng/ml、约200ng/ml、约500ng/ml、约1μg/ml、约2μg/ml、约3μg/ml、约4μg/ml、约5μg/ml、约10μg/ml、约20μg/ml、约30μg/ml、约40μg/ml、约50μg/ml、约100μg/ml、约200μg/ml、约300μg/ml、约400μg/ml、约500μg/ml、约1mg/ml、约2mg/ml、约5mg/ml、约10mg/ml、约20mg/ml、约50mg/ml、或约100mg/ml。
[0123]
组合物可以包含多核糖核苷酸和醇(例如乙醇)。在某些特定的实施例中,组合物包含线性多核糖核苷酸和醇。在某些特定的实施例中,组合物包含环状多核糖核苷酸(circrna)和醇。由于环状结构,与相应的线性rna相比,circrna具有改善的稳定性、延长的半衰期、降低的免疫原性和/或改善的功能性(例如,本文所述的功能)。
[0124]
组合物可以包含多核糖核苷酸和细胞渗透剂。在某些特定的实施例中,组合物包含线性多核糖核苷酸和细胞渗透剂。在某些特定的实施例中,组合物包含环状多核糖核苷酸(circrna)和细胞渗透剂。由于环状结构,与相应的线性rna相比,circrna具有改善的稳定性、延长的半衰期、降低的免疫原性和/或改善的功能性(例如,本文所述的功能)。
[0125]
在一些情况下,本文提供的环状多核糖核苷酸具有的半衰期至少是线性对应物(例如,线性表达序列或线性环状多核糖核苷酸)的半衰期。在一些情况下,环状多核糖核苷酸具有的半衰期相对于线性对应物的半衰期延长。在一些情况下,半衰期延长约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更长。在一些情况下,环状多核糖核苷酸在细胞中的半衰期或持续性为至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或
更长时间或其间的任何时间。在某些实施例中,环状多核糖核苷酸在细胞中的半衰期或持续性为不超过约10分钟至约7天、或不超过约1小时、2小时,3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。有效负载和生物效应
[0126]
在一些情况下,多核糖核苷酸包含至少一个有效负载,在递送至细胞或受试者时或之后该有效负载对细胞或受试者具有生物效应。有效负载可以是在多核糖核苷酸中编码的一个或多个序列,这些序列被表达,结合至靶标实体,诸如靶标分子(例如蛋白、核酸、小分子或核酶)或靶标细胞。多核糖核苷酸可以以线性或环状形式存在。对细胞的生物效应可以包括对细胞的导致细胞上或细胞中的变化(例如形态或功能变化)的多种分子和细胞变化。例如,对细胞的生物效应可以包括但不限于影响细胞功能的细胞内信号转导的变化,诸如但不限于细胞增殖的加速或减速、存活、细胞凋亡或细胞坏死、基因转录和mrna翻译以及某些分化的细胞功能(例如,免疫细胞的激活、神经元的激发或抑制、激素分泌细胞的激素分泌或巨噬细胞的吞噬活性)、或外源分子进入细胞的效率的改变,例如相对于外源分子增加或降低细胞渗透性。对受试者的生物效应还可以包括受试者生理学的多种变化,例如任何一种或多种组织或器官的结构或功能变化。对受试者的生物效应可以导致可从受试者测量的一个或多个生理参数的变化,诸如ecg、血糖、血压、体温、血细胞计数、hbco和methb。生物效应还可以包括改善受试者所患疾病的一种或多种症状,或治疗或根除受试者的疾病。生物效应还可以包括伤口愈合。表达序列
[0127]
在一些情况下,如本文所述的多核糖核苷酸包含至少一个编码肽或多肽的表达序列。肽可以包括但不限于蛋白、小肽、模拟肽(例如类肽)、氨基酸和氨基酸类似物。肽可以是直链或支链的。肽可以具有小于约500,000克/摩尔的分子量、小于约200,000克/摩尔的分子量、小于约100,000克/摩尔的分子量、小于约50,000克/摩尔的分子量、小于约20,000克/摩尔的分子量、小于约10,000克/摩尔的分子量、小于约5,000克/摩尔的分子量、小于约2,000克/摩尔的分子量、小于约1,000克/摩尔的分子量、小于约500克/摩尔的分子量,以及此类化合物的盐、酯和其他药学上可接受的形式。肽可以包括例如神经递质、激素、药物、毒素、病毒或微生物颗粒、合成分子及其激动剂或拮抗剂。多核糖核苷酸可以以线性或环状形式存在。
[0128]
由本文提供的多核糖核苷酸表达的肽或多肽的一些实例包括荧光标签或标记物、抗原、治疗性肽、天然生物活性肽的合成或类似物肽、激动剂或拮抗剂肽、抗微生物肽、成孔肽、双环肽、靶向或细胞毒性肽、降解或自毁肽、以及多种降解或自毁肽。本文所述的肽还可以包括抗原结合肽,例如,抗原结合抗体或抗体样片段,诸如单链抗体、纳米抗体(参见例如,steeland等人2016.nanobodies as therapeutics:big opportunities for small antibodies.[纳米抗体作为治疗剂:小抗体的巨大机会]drug discov today[今日药物发现]:21(7):1076
‑
113)。此类抗原结合肽可以结合细胞质抗原、核抗原、细胞内抗原。
[0129]
在一些情况下,多核糖核苷酸包含编码蛋白(例如治疗性蛋白)的表达序列。治疗性蛋白的一些实例包括但不限于蛋白替代品、蛋白补充品、疫苗、抗原(例如肿瘤抗原、病
毒、细菌)、激素、细胞因子、抗体、免疫疗法(例如癌症)、细胞重编程/转分化因子、转录因子、嵌合抗原受体、转座酶或核酸酶、免疫效应子(例如,影响对免疫反应/信号的易感性)、经调控的死亡效应蛋白(例如,细胞凋亡或坏死的诱导物)、肿瘤的非溶解性抑制剂(例如癌蛋白抑制剂)、表观遗传修饰剂、表观遗传酶、转录因子、dna或蛋白修饰酶、dna嵌入剂、外排泵抑制剂、核受体激活剂或抑制剂、蛋白酶体抑制剂、酶竞争性抑制剂、蛋白合成效应物或抑制剂、核酸酶、蛋白片段或结构域、配体或受体、以及crispr系统或其组分。在一些实施例中,蛋白或治疗性蛋白是伤口愈合蛋白,诸如生长因子。例如,生长因子是egf、pdgf、tgfβ或vegf。
[0130]
在一些实施例中,蛋白或治疗性蛋白用于伤口愈合的方法中。例如,治疗伤口的方法可以包括使伤口或伤口周围的组织与如本文所述的组合物或药物组合物接触,其中组合物或药物组合物的多核糖核苷酸包含编码生长因子诸如egf、pdgf、tgfβ或vegf的序列。
[0131]
在一些情况下,多核糖核苷酸包含调控元件,例如修饰环状多核糖核苷酸或线性多核糖核苷酸内表达序列的表达的序列。调控元件可以编码位置与编码表达产物的表达序列相邻的序列。调控元件可以可操作地连接至相邻序列。与不存在调控元件时表达产物的量相比,调控元件可以增加表达产物的量。另外,一个调控元件可以增加串联连接的多个表达序列表达的产物的量。因此,一种调控元件可以增强一个或多个表达序列的表达。多个调控元件是本领域普通技术人员众所周知的。
[0132]
在一些情况下,多核糖核苷酸包含翻译起始序列,例如起始密码子。在一些情况下,翻译起始序列是科扎克或夏因
‑
达尔加诺(shine
‑
dalgarno)序列。
[0133]
在一些情况下,多核糖核苷酸起始于不是第一起始密码子的密码子,例如aug。多核糖核苷酸的翻译可以起始于替代的翻译起始序列,例如但不限于acg、agg、aag、ctg/cug、gtg/gug、ata/aua、att/auu、ttg/uug。在一些情况下,翻译由真核起始因子4a(eif4a)起始。在其他实施例中,翻译从多核糖核苷酸的内部核糖体进入位点(ires)元件起始。ires元件可以包含能够接合真核核糖体的rna序列。在一些情况下,ires元件为至少约5nt、至少约8nt、至少约9nt、至少约10nt、至少约15nt、至少约20nt、至少约25nt、至少约30nt、至少约40nt、至少约50nt、至少约100nt、至少约200nt、至少约250nt、至少约350nt或至少约500nt。在一个实施例中,ires元件衍生自生物体的dna,该生物体包括但不限于病毒、哺乳动物和果蝇。此类病毒dna可以衍生自但不限于小核糖核酸病毒互补dna(cdna)、脑心肌炎病毒(emcv)cdna和脊髓灰质炎病毒cdna。在一个实施例中,衍生ires元件的果蝇dna包括但不限于来自黑腹果蝇(drosophila melanogaster)的触角足基因。
[0134]
在一些情况下,多核糖核苷酸包含一个或多个表达序列并且每个表达序列可以或可以不具有终止元件。在一些情况下,多核糖核苷酸包含一个或多个表达序列并且表达序列缺少终止元件。在一些实施例中,多核糖核苷酸是缺少终止元件的环状多核糖核苷酸,使得环状多核糖核苷酸被连续翻译。在一些情况下,多核糖核苷酸在一个或多个表达序列的端部包括终止元件。在一些情况下,一个或多个表达序列缺少终止元件。通常,终止元件包括发出翻译终止信号的框内核苷酸三联体,例如uaa、uga、uag。
[0135]
多核糖核苷酸可以包含例如修饰内源基因和/或外源基因的表达的调控核酸。在一些情况下,多核糖核苷酸包含一个或多个编码(例如,互补于)调控核酸的表达序列。调控核酸可以包括但不限于非编码rna,诸如但不限于trna、lncrna、mirna、rrna、snrna、微rna、
sirna、pirna、snorna、snrna、exrna、scarna、y rna和hnrna。
[0136]
在一个实例中,调控核酸靶向宿主基因。调控核酸可以包括但不限于与内源基因杂交的核酸(例如,如本文其他地方所述的mirna、sirna、mrna、lncrna、rna、dna、反义rna、grna)、与外源核酸(例如病毒dna或rna)杂交的核酸、与rna杂交的核酸、干扰基因转录的核酸、干扰rna翻译的核酸、稳定rna或去稳定rna的核酸(例如通过靶向降解),以及调节dna或rna结合因子的核酸。在一个实施例中,序列是mirna。
[0137]
在一些情况下,多核糖核苷酸包含调控核酸,如指导rna(grna)。在一些情况下,多核糖核苷酸包含指导rna或编码指导rna。grna可以是由“支架”序列组成的短合成rna,该“支架”序列对于结合基因组靶标的用户定义的约20个核苷酸的靶向序列是必需的。grna可以识别特定的dna序列(例如,与基因的启动子、增强子、沉默子或阻遏子相邻或在其内的序列)。grna可以是用于基因编辑的crispr系统的一部分。出于基因编辑的目的,可将多核糖核苷酸设计为包括一个或多个与所需的靶标dna序列相对应的指导rna序列;参见例如,cong等人(2013)science[科学],339:819
‑
823;ran等人(2013)nature protocols[自然实验手册],8:2281
‑
2308,其各自通过援引以其全文并入本文。
[0138]
多核糖核苷酸可以编码与内源基因或基因产物(例如,mrna)的全部或片段基本上互补或完全互补的调控核酸。调控核酸可以与内含子和外显子之间的边界处的、外显子之间的、或邻近外显子的序列互补,从而防止特定基因的新生成的核rna转录物成熟为用于转录的mrna。与特定基因互补的调控核酸可与该基因的mrna杂交并阻止其翻译。反义调控核酸可以是dna、rna或其衍生物或杂交体。在一些情况下,调控核酸包含与参与内源基因或外源基因表达调控的蛋白结合的蛋白结合位点。
[0139]
在一些情况下,如本文所提供的环状多核糖核苷酸的翻译效率大于参考物,例如线性对应物、线性表达序列或线性环状多核糖核苷酸。在一些情况下,如本文所提供的环状多核糖核苷酸具有的翻译效率高于参考物的翻译效率至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%、500%、600%、70%、800%、900%、1000%、2000%、5000%、10000%、100000%或更高。在一些情况下,环状多核糖核苷酸的翻译效率高于线性对应物的翻译效率10%。在一些情况下,环状多核糖核苷酸的翻译效率高于线性对应物的翻译效率300%。
[0140]
在一些情况下,环状多核糖核苷酸产生化学计量比的表达产物。滚环翻译连续地以基本上相等的比率产生表达产物。在一些情况下,环状多核糖核苷酸具有化学计量的翻译效率,使得表达产物以基本上相等的比率产生。在一些情况下,环状多核糖核苷酸具有多种表达产物(例如来自2、3、4、5、6、7、8、9、10、11、12或更多个表达序列的产物)的化学计量翻译效率。
[0141]
在一些情况下,一旦起始环状多核糖核苷酸的翻译,在完成环状多核糖核苷酸的至少一轮翻译之前,结合至环状多核糖核苷酸的核糖体不会与环状多核糖核苷酸脱离。在一些情况下,如本文所述的环状多核糖核苷酸能够滚环翻译。在一些情况下,在滚环翻译期间,一旦起始环状多核糖核苷酸的翻译,在完成环状多核糖核苷酸的至少2轮、至少3轮、至少4轮、至少5轮、至少6轮、至少7轮、至少8轮、至少9轮、至少10轮、至少11轮、至少12轮、至少13轮、至少14轮、至少15轮、至少20轮、至少30轮、至少40轮、至少50轮、至少60轮、至少70轮、
至少80轮、至少90轮、至少100轮、至少150轮、至少200轮、至少250轮、至少500轮、至少1000轮、至少1500轮、至少2000轮、至少5000轮、至少10000轮、至少105轮或至少106轮翻译之前,结合至环状多核糖核苷酸的核糖体不会与环状多核糖核苷酸脱离。
[0142]
在一些情况下,环状多核糖核苷酸的滚环翻译导致生成多肽产物,该多肽产物由环状多核糖核苷酸的多于一轮翻译得出(“连续”表达产物)。在一些情况下,环状多核糖核苷酸包含交错元件(stagger element)(例如,在翻译期间引起核糖体停顿的元件),并且环状多核糖核苷酸的滚环翻译导致产生由环状多核糖核苷酸的单轮翻译或少于单轮翻译产生的多肽产物(允许产生“离散”表达产物)。在一些情况下,环状多核糖核苷酸被配置成使得环状多核糖核苷酸的滚环翻译期间生成的总多肽(摩尔/摩尔)中的至少10%、20%、30%、40%、50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%是离散多肽。在一些情况下,在体外翻译系统中测试离散产物相对于总多肽的量比。在一些情况下,用于测试量比的体外翻译系统包含兔网织红细胞裂解物。在一些情况下,在体内翻译系统如真核细胞或原核细胞、培养细胞或生物体中的细胞中测试量比。
[0143]
在一些情况下,多核糖核苷酸包含非翻译区(utr)。包含基因的基因组区域的utr可以转录但不翻译。在一些情况下,utr可以在本文所述的表达序列的翻译起始序列的上游。在一些情况下,utr可以被包括在本文所述的表达序列的下游。在一些情况下,第一表达序列的一个utr与第二表达序列的另一个utr相同、连续或重叠。在一些情况下,内含子是人内含子。在一些情况下,内含子是全长人内含子,例如zkscan1。
[0144]
在一些情况下,多核糖核苷酸包含内嵌有一段或多段腺苷和尿苷的utr。这些au富集签名可能会增加表达产物的转化率。
[0145]
utr au富集元件(are)的引入、去除或修饰可用于调节多核糖核苷酸的稳定性或免疫原性。工程化特定的多核糖核苷酸时,可以将are的一个或多个拷贝引入多核糖核苷酸中,并且are的这些拷贝可以调节表达产物的翻译和/或产生。同样,可以对are进行识别和去除或工程化至多核糖核苷酸以调节细胞内稳定性,从而影响所得蛋白的翻译和产生。
[0146]
应当理解,可以将来自任何基因的任何utr掺入多核糖核苷酸的相应侧翼区中。作为一个非限制性实例,可以掺入的utr或其片段是在美国临时申请号us 61/775,509和us 61/829,372或国际专利申请号pct/us2014/021522中列出的utr;其各自的内容通过援引以其全文并入本文。此外,可以使用任何已知基因的多个野生型utr。提供不是野生型基因的变体的人工utr也在本发明的范围内。这些utr或其部分可以放置在与选择它们的转录物中相同的方向,或者可以改变方向或位置。因此,可以将5'或3'utr反向、缩短、加长、与一个或多个其他5'utr或3'utr制成嵌合体。如本文所用,与utr序列有关时,术语“改变的”是指utr已经相对于参考序列以某种方式改变。例如,3'或5'utr可以通过如上所传授的方向或位置的更改相对于野生型或天然utr改变,或者可以通过额外核苷酸的纳入、核苷酸的缺失、核苷酸的交换或转座来改变。这些产生“改变的”utr的任何更改(无论是3'还是5')都包含变体utr。
[0147]
在一个实施例中,可以使用双、三或四utr,如5'或3'utr。如本文所用,“双”utr是其中相同utr的两个拷贝被串联或基本上串联地编码的一种情况。例如,可以如美国专利公开号20100129877中所述使用双β球蛋白3'utr,该专利的内容通过援引以其全文并入本文。
[0148]
在一些情况下,多核糖核苷酸可以包括聚a序列。在一些情况下,聚a序列的长度大于10个核苷酸。在一个实施例中,聚a序列的长度大于15个核苷酸(例如,至少或大于约10、15、20、25、30、35、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800、900、1,000、1,100、1,200、1,300、1,400、1,500、1,600、1,700、1,800、1,900、2,000、2,500和3,000个核苷酸)。在一些情况下,聚a序列是约10个至约3,000个核苷酸(例如,30至50、30至100、30至250、30至500、30至750、30至1,000、30至1,500、30至2,000、30至2,500、50至100、50至250、50至500、50至750、50至1,000、50至1,500、50至2,000、50至2,500、50至3,000、100至500、100至750、100至1,000、100至1,500、100至2,000、100至2,500、100至3,000、500至750、500至1,000、500至1,500、500至2,000、500至2,500、500至3,000、1,000至1,500、1,000至2,000、1,000至2,500、1,000至3,000、1,500至2,000、1,500至2,500、1,500至3,000、2,000至3,000、2,000至2,500和2,500至3,000)。
[0149]
在一个实施例中,相对于整个多核糖核苷酸的长度设计聚a序列。该设计可以基于编码区的长度、特定特征或区域(如第一或侧翼区)的长度,或者基于多核糖核苷酸表达的最终产物的长度。在本文中,聚a序列的长度可以比环状多核糖核苷酸或其特征长10、20、30、40、50、60、70、80、90或100%。聚a序列也可以设计为其所属的多核糖核苷酸的一部分。在本文中,聚a序列可以是构建体的总长度的或构建体总长度减去聚a序列后的10%、20%、30%、40%、50%、60%、70%、80%或90%或更多。进一步,工程化的结合位点和环状多核糖核苷酸与聚a结合蛋白的缀合可以增强表达。
[0150]
在一个实施例中,将多核糖核苷酸设计为包括聚a
‑
g四分体(quartet)。g
‑
四分体可以是四个鸟嘌呤核苷酸的环状氢键阵列,可以由dna和rna中的富含g的序列形成。在一个实施例中,g
‑
四分体被掺入聚a序列的端部。在一些情况下,聚a
‑
g四分体产生的蛋白产量等于单独使用120个核苷酸的聚a序列所得的蛋白产量的至少75%。
[0151]
在一些情况下,多核糖核苷酸包含聚a、缺少聚a或具有经修饰的聚a以调节多核糖核苷酸的一种或多种特征。在一些情况下,缺少聚a或具有经修饰的聚a的多核糖核苷酸改善了一种或多种功能特征,例如免疫原性、半衰期、表达效率等。支架
[0152]
在一些情况下,本文提供的多核糖核苷酸结合一个或多个靶标。在一个实施例中,多核糖核苷酸既结合dna靶标又结合蛋白靶标,并且例如介导转录。在另一个实施例中,多核糖核苷酸将蛋白复合物聚集在一起,并例如介导信号转导。在另一个实施例中,多核糖核苷酸结合两个或更多个不同的靶标,诸如蛋白,并且例如将这些蛋白穿梭至细胞质。多核糖核苷酸可以以线性或环状形式存在。
[0153]
在一些实施例中,多核糖核苷酸结合dna、rna和蛋白中的至少一种,从而调控细胞过程(例如改变蛋白表达)。在一些实施例中,合成的多核糖核苷酸包括用于与选择的dna、rna或蛋白的至少一个部分(例如结合部分)相互作用的结合位点,从而与内源性对应物竞争结合。
[0154]
在一个实施例中,合成的多核糖核苷酸结合和/或螯合mirna。在另一个实施例中,合成的多核糖核苷酸结合和/或螯合蛋白。在另一个实施例中,合成的多核糖核苷酸结合和/或螯合mrna。在另一个实施例中,合成的多核糖核苷酸结合和/或螯合核糖体。在另一个实施例中,合成的多核糖核苷酸结合和/或螯合多核糖核苷酸。在另一个实施例中,合成的
多核糖核苷酸结合和/或螯合长非编码rna(lncrna)或任何其他非编码rna,例如mirna、trna、rrna、snorna、ncrna、sirna、长非编码rna、shrna。除了结合和/或螯合位点,多核糖核苷酸还可以包括降解元件,其导致所结合和/或螯合的rna和/或蛋白的降解。
[0155]
在一个实施例中,多核糖核苷酸包含lncrna或lncrna的序列,例如,多核糖核苷酸包含天然存在的非环状lncrna的序列或其片段。在一个实施例中,将lncrna或lncrna的序列环化,具有或不具有间隔子序列,以形成合成的环状多核糖核苷酸。
[0156]
在一个实施例中,多核糖核苷酸具有核酶活性。在一个实施例中,多核糖核苷酸充当核酶并切割致病性或内源性rna、dna、小分子或蛋白。在一个实施例中,多核糖核苷酸具有酶活性。在一个实施例中,合成的多核糖核苷酸特异性识别和切割rna(例如病毒rna)。在另一个实施例中,多核糖核苷酸特异性识别和切割蛋白。在另一个实施例中,多核糖核苷酸特异性识别和降解小分子。
[0157]
在一个实施例中,多核糖核苷酸是牺牲型、自切割或可切割的多核糖核苷酸。在一个实施例中,多核糖核苷酸可以用于递送rna,例如mirna、trna、rrna、snorna、ncrna、sirna、长非编码rna、shrna。在一个实施例中,合成的多核糖核苷酸由被(1)可自切割的元件(例如锤头结构、剪接元件)、(2)切割募集位点(例如adar)、(3)可降解接头(丙三醇)、(4)化学接头和/或(5)间隔子序列隔开的微rna构成。在另一个实施例中,合成的多核糖核苷酸由被(1)可自切割的元件(例如锤头结构、剪接元件)、(2)切割募集位点(例如adar)、(3)可降解接头(丙三醇)、(4)化学接头和/或(5)间隔子序列隔开的sirna构成。
[0158]
在一个实施例中,多核糖核苷酸是具有转录/复制能力的多核糖核苷酸。这种多核糖核苷酸可以编码任何类型的rna。在一个实施例中,合成的多核糖核苷酸包含反义mirna和转录元件。在一个实施例中,在转录后,从环状多核糖核苷酸产生线性功能性mirna。
[0159]
在一个实施例中,多核糖核苷酸包含与翻译元件组合的一个或多个上述属性。
[0160]
多核糖核苷酸可以包含针对靶标的结合部分的至少一个结合位点。靶标包括但不限于核酸(例如rna、dna、rna
‑
dna杂交体)、小分子(例如药物)、适体、多肽、蛋白、脂质、碳水化合物、抗体、病毒、病毒颗粒、膜、多组分复合物、细胞、其他细胞部分,其任何片段及其任何组合。(参见例如,fredriksson等人,(2002)nat biotech[自然生物技术]20:473
‑
77;gullberg等人,(2004)pnas[美国国家科学院院刊],101:8420
‑
24)。例如,靶标是单链rna、双链rna、单链dna、双链dna、包含一个或多个双链区域和一个或多个单链区域的dna或rna、rna
‑
dna杂交体、小分子、适体、多肽、蛋白、脂质、碳水化合物、抗体、抗体片段、抗体混合物、病毒颗粒、膜、多组分复合物、细胞、细胞部分、其任何片段或其任何组合。
[0161]
在一些实施例中,靶标是多肽、蛋白或其任何片段。例如,靶标是纯化的多肽、分离的多肽、融合标记的多肽、附着于或跨越细胞或病毒或病毒体的膜的多肽、细胞质蛋白、细胞内蛋白、细胞外蛋白、激酶、磷酸酶、芳香酶、解旋酶、蛋白酶、氧化还原酶、还原酶、转移酶、水解酶、裂解酶、异构酶、糖基化酶、细胞外基质蛋白、连接酶、离子转运蛋白、通道、孔、凋亡蛋白、细胞粘附蛋白、致病蛋白、异常表达的蛋白、转录因子、转录调节物、翻译蛋白、伴侣蛋白、分泌蛋白、配体、激素、细胞因子、趋化因子、核蛋白、受体、跨膜受体、信号转导子、抗体、膜蛋白、整合膜蛋白、外周膜蛋白、细胞壁蛋白、球状蛋白、纤维状蛋白、糖蛋白、脂蛋白、染色体蛋白、其任何片段或其任何组合。在一些实施例中,靶标是异源多肽。在一些实施例中,靶标是使用分子技术(诸如转染)在细胞中过表达的蛋白。在一些实施例中,靶标是重
组多肽。例如,靶标在由细菌(例如,大肠杆菌)、酵母、哺乳动物或昆虫细胞产生的样品中(例如,由生物过表达的蛋白)。在一些实施例中,靶标是具有突变、插入、缺失或多态性的多肽。在一些实施例中,靶标是抗原,诸如用于免疫生物体或在生物体中产生免疫反应,诸如用于抗体产生的多肽。
[0162]
在一些实施例中,靶标是抗体。抗体可以特异性结合另一个分子的特定空间和极性组织。抗体可以是单克隆抗体、多克隆抗体或重组抗体,并且可以通过本领域熟知的技术制备,诸如免疫宿主并收集血清(多克隆),或通过制备连续的杂交细胞系并收集分泌的蛋白(单克隆),或通过克隆和表达核苷酸序列或其诱变形式,这些核苷酸序列或其诱变形式至少编码天然抗体的特异性结合所需的氨基酸序列。天然存在的抗体可以是包含通过二硫键相互连接的至少两条重(h)链和两条轻(l)链的蛋白。每条重链可以包含重链可变区(v
h
)和重链恒定区。重链恒定区可以包含三个结构域:c
h1
、c
h2
和c
h3
。每条轻链可以包含轻链可变区(v
l
)和轻链恒定区。轻链恒定区可以包含一个结构域c
l
。v
h
和v
l
区可以进一步再分为高变区,称为互补决定区(cdr),其间插着更为保守的区,称为框架区(fr)。每个v
h
和v
l
可以包含从氨基末端至羧基末端按以下顺序排列的三个cdr和四个fr:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)以及经典补体系统的第一组分(c1q))的结合。抗体可以是任何同种型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)、亚类或其经修饰的版本。抗体可以包括完整的免疫球蛋白或其片段。抗体片段可以指抗体的保留特异性结合至结合部分(例如抗原)的能力的一个或多个片段。另外,还包括免疫球蛋白或其片段的聚集体、聚合物和缀合物,只要维持对特定分子的结合亲和力即可。抗体片段的实例包括fab片段,由v
l
、v
h
、c
l
和c
h1
结构域组成的单价片段;f(ab)2片段,其是包含由二硫桥在铰链区连接的两个fab片段的双价片段;由v
h
和c
h1
结构域组成的fd片段;由抗体的单一臂的v
l
和v
h
结构域组成的fv片段;由v
h
结构域组成的单结构域抗体(dab)片段(ward等人,(1989)nature[自然]341:544
‑
46);以及分离的cdr和单链片段(scfv),其中v
l
和v
h
区配对以形成单价分子(称为单链fv(scfv);参见例如bird等人,(1988)science[科学]242:423
‑
26;和huston等人,(1988)pnas[美国国家科学院院刊]85:5879
‑
83)。因此,抗体片段包括fab、f(ab)2、scfv、fv、dab等。尽管两个结构域v
l
和v
h
可以由不同的基因编码,但是它们可以使用重组方法通过人工肽接头连接,该人工肽接头使它们成为单个蛋白链。这样的单链抗体包括一个或多个抗原结合部分。这些抗体片段可以使用本领域技术人员已知的常规技术获得,并能以与完整抗体相同的方式筛选这些片段的实用性。抗体可以是人的、人源化的、嵌合的、分离的、狗的、猫的、驴的、或绵羊的、或任何植物的、动物的或哺乳动物的。
[0163]
在一些实施例中,靶标是核糖核苷酸和/或脱氧核糖核苷酸(腺嘌呤、鸟嘌呤、胸腺嘧啶或胞嘧啶)的聚合形式,诸如dna或rna(例如mrna)。dna包括在线性dna分子(例如,限制性片段)、病毒、质粒和染色体中发现的双链dna。在一些实施例中,多核苷酸靶标是单链、双链、小干扰rna(sirna)、信使rna(mrna)、转运rna(trna)、染色体、基因、非编码基因组序列、基因组dna(例如,片段化的基因组dna)、纯化的多核苷酸、分离的多核苷酸、杂交的多核苷酸、转录因子结合位点、线粒体dna、核糖体rna、真核多核苷酸、原核多核苷酸、合成的多核苷酸、连接的多核苷酸、重组多核苷酸、含有核酸类似物的多核苷酸、甲基化的多核苷酸、脱甲基化的多核苷酸、其任何片段、或其任何组合。在一些实施例中,靶标是重组多核苷酸。在
一些实施例中,靶标是异源多核苷酸。例如,靶标是由细菌(例如,大肠杆菌)、酵母、哺乳动物或昆虫细胞产生的多核苷酸(例如,与生物体异源的多核苷酸)。在一些实施例中,靶标是具有突变、插入、缺失或多态性的多核苷酸。
[0164]
在一些实施例中,靶标是适体。适体是分离的核酸分子,其以高特异性和亲和力结合至结合部分,诸如蛋白。适体是保持一个或多个特定构型的三维结构,其提供化学接触以特异性结合其给定靶标。尽管适体是基于核酸的分子,但适体与其他核酸分子(诸如基因和mrna)之间存在根本差异。在这些其他核酸分子中,核酸结构通过其线性碱基序列来编码信息,因此该序列对信息存储的功能具有重要意义。完全相反,基于靶标分子的特异性结合的适体功能并不完全依赖于保守的线性碱基序列(非编码序列),而是特定的二级/三级/四级结构。适体可能具有的任何编码潜力是完全偶然的,并且在适体与其同源靶标的结合中无论如何不起作用。适体还必须与结合某些蛋白的天然存在的核酸序列不同。这些后者的序列是嵌入生物体基因组中的天然存在的序列,其与参与天然存在的核酸(例如核酸结合蛋白)的转录、翻译和运输的蛋白的特定亚组结合。另一方面,适体是短的、分离的、非天然存在的核酸分子。尽管可以鉴定出结合核酸结合蛋白的适体,但在大多数情况下,这种适体与自然中由核酸结合蛋白识别的序列具有极少或没有序列同一性。更重要的是,适体可以结合几乎任何蛋白(不仅是结合核酸的蛋白)以及几乎任何目的伴侣,包括小分子、碳水化合物、肽等。对于大多数伴侣,甚至蛋白,与其结合的天然存在的核酸序列不存在。对于确实具有这样的序列的那些伴侣,例如结合核酸的蛋白,由于与紧密结合的适体相比,自然界中使用的结合亲和力相对较低,因此此类序列可以不同于适体。适体能够特异性结合至选择的伴侣并例如通过结合来调节伴侣的活性或结合相互作用,适体可以阻断其伴侣起功能的能力。与伴侣特异性结合的功能特性是适体的固有特性。典型的适体大小为6
‑
35kda(20
‑
100个核苷酸),以微摩尔至亚纳摩尔的亲和力结合其伴侣,并且可以区分紧密相关的靶标(例如,适体可以选择性地结合来自相同基因家族的相关蛋白)。适体能够使用通常见到的分子间相互作用,例如氢键、静电互补性、疏水性接触和空间排阻来与特定伴侣结合。适体具有用作治疗和诊断的许多期望的特征,包括高特异性和亲和力、低免疫原性、生物学功效以及优异的药代动力学特性。适体可以包含由共价连接的互补多核苷酸的杂交形成的分子茎和环结构(例如,发夹环结构)。茎包含杂交的多核苷酸,并且环是共价连接两个互补多核苷酸的区域。
[0165]
在一些实施例中,靶标是小分子。例如,小分子可以是大环分子、抑制剂、药物或化合物。在一些实施例中,小分子包含不超过五个氢键供体。在一些实施例中,小分子包含不超过十个氢键受体。在一些实施例中,小分子的分子量是500道尔顿或更小。在一些实施例中,小分子的分子量是约180至500道尔顿。在一些实施例中,小分子包含不大于五的辛醇
‑
水分配系数lop p。在一些实施例中,小分子具有
‑
0.4至5.6的分配系数log p。在一些实施例中,小分子的摩尔折射率是40至130。在一些实施例中,小分子包含约20至约70个原子。在一些实施例中,小分子的极性表面积是140埃2或更小。
[0166]
在一些实施例中,靶标是细胞。例如,靶标是完整的细胞、用化合物(例如,药物)处理的细胞、固定的细胞、裂解的细胞或其任何组合。在一些实施例中,靶标是单个细胞。在一些实施例中,靶标是多个细胞。
[0167]
在一些实施例中,单个靶标或多个(例如,两个或更多个)靶标具有多个结合部分。
在一个实施例中,单个靶标可以具有2、3、4、5、6、7、8、9、10或更多个结合部分。在一个实施例中,样品中有两个或更多个靶标,例如靶标的混合物或文库,并且样品包含两个或更多个结合部分。在一些实施例中,单个靶标或多个靶标包含多个不同的结合部分。例如,多个可以包括至少约2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1,000、2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000、11,000、12,000、13,000、14,000、15,000、16,000、17,000、18,000、19,000、20,000、25,000或30,000个结合部分。
[0168]
靶标可以包含多个结合部分,这些结合部分包含至少2个不同的结合部分。例如,结合部分可以包含多个结合部分,该多个结合部分包括至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1,000、2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000、11,000、12,000、13,000、14,000、15,000、16,000、17,000、18,000、19,000、20,000、21,000、22,000、23,000、24,000或25,000个不同的结合部分。
[0169]
在一些情况下,多核糖核苷酸包含一个结合位点。在一些情况下,多核苷酸包含至少两个结合位点。例如,多核糖核苷酸可以包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个结合位点。在一些实施例中,本文所述的多核糖核苷酸是结合一个或多个靶标的一个或多个结合部分的分子支架。每个靶标可以是但不限于不同或相同的核酸(例如,rna、dna、rna
‑
dna杂交体)、小分子(例如、药物)、适体、多肽、蛋白、脂质、碳水化合物、抗体、病毒、病毒颗粒、膜、多组分复合物、细胞、细胞部分、其任何片段及其任何组合。在一些实施例中,一个或多个结合位点结合至相同靶标的一个或多个结合部分。在一些实施例中,一个或多个结合位点结合至不同靶标的一个或多个结合部分。在一些实施例中,circrna充当一个或多个靶标的一个或多个结合部分的支架。在一些实施例中,多核糖核苷酸通过与一个或多个靶标的一个或多个结合部分特异性结合来调节细胞过程。在一些实施例中,本文描述的多核糖核苷酸包括针对一个或多个特定目的靶标的结合位点。在一些实施例中,多核糖核苷酸包括针对每个目的结合部分的多个结合位点或结合位点的组合。例如,多核糖核苷酸包含针对多核苷酸靶标诸如dna或rna的结合位点。例如,多核糖核苷酸包含针对mrna靶标的结合位点。例如,多核糖核苷酸包含针对rrna靶标的结合位点。例如,多核糖核苷酸包含针对trna靶标的结合位点。例如,多核糖核苷酸包含针对基因组dna靶标的结合位点。
[0170]
在一些情况下,多核糖核苷酸包含针对单链dna上的结合部分的结合位点。在一些情况下,多核苷酸包含针对双链dna上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对抗体上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对病毒颗粒上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对小分子上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对细胞内或细胞上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对rna
‑
dna杂交体上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对甲基化的多核苷酸上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对未甲基化的多核苷酸上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对适体上的结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对多肽上结合部分的结合位点。在一些情况下,多核糖核苷酸包含针对多肽、蛋白、蛋白片段、经标记的蛋白、抗体、抗体片段、小分子、病毒颗粒(例如,包含跨膜蛋白的病毒颗
粒)或细胞上的结合部分的结合位点。
[0171]
在一些情况下,结合部分包含至少两个酰胺键。在一些情况下,结合部分不包含磷酸二酯键。在一些情况下,结合部分不是dna或rna。
[0172]
本文提供的多核糖核苷酸可以包含针对复合物上的结合部分的一个或多个结合位点。本文提供的多核糖核苷酸可以包含一个或多个靶标结合位点以形成复合物。本文提供的多核糖核苷酸可以在多核糖核苷酸与靶标之间形成复合物。在一些实施例中,多核糖核苷酸与单个靶标形成复合物。在一些实施例中,circrna与两个或更多个靶标的复合物形成复合物。在一些实施例中,多核糖核苷酸与三个或更多个靶标的复合物形成复合物。在一些实施例中,两个或更多个多核糖核苷酸与单个靶标形成复合物。在一些实施例中,两个或更多个多核糖核苷酸与两个或更多个靶标形成复合物。在一些实施例中,第一circrna与第一靶标的第一结合部分和第二靶标的第二不同结合部分形成复合物。在一些实施例中,第一多核糖核苷酸与第一靶标的第一结合部分形成复合物,并且第二多核糖核苷酸与第二靶标的第二结合部分形成复合物。
[0173]
在一些实施例中,多核糖核苷酸可以包括针对以下物质上的一个或多个结合部分的结合位点:一种或多种抗体
‑
多肽复合物、多肽
‑
多肽复合物、多肽
‑
dna复合物、多肽
‑
rna复合物、多肽
‑
适体复合物、病毒颗粒
‑
抗体复合物、病毒颗粒
‑
多肽复合物、病毒颗粒
‑
dna复合物、病毒颗粒
‑
rna复合物、病毒颗粒
‑
适体复合物、细胞
‑
抗体复合物、细胞
‑
多肽复合物、细胞
‑
dna复合物、细胞
‑
rna复合物、细胞
‑
适体复合物、小分子
‑
多肽复合物、小分子
‑
dna复合物、小分子
‑
适体复合物、小分子
‑
细胞复合物、小分子
‑
病毒颗粒复合物及其组合。
[0174]
在一些情况下,结合部分在多肽、蛋白或其片段上。在一些实施例中,结合部分包含多肽、蛋白或其片段的结构域、片段、表位、区域或一部分。例如,结合部分包含分离的多肽、细胞的多肽、纯化的多肽或重组多肽的结构域、片段、表位、区域或一部分。例如,结合部分包含抗体或其片段的结构域、片段、表位、区域或一部分。例如,结合部分包含转录因子的结构域、片段、表位、区域或一部分。例如,结合部分包含受体的结构域、片段、表位、区域或一部分。例如,结合部分包含跨膜受体的结构域、片段、表位、区域或一部分。结合部分可以在分离的、纯化的和/或重组的多肽的结构域、片段、表位、区域或一部分上或包含分离的、纯化的和/或重组的多肽的结构域、片段、表位、区域或一部分。结合部分可以包括在分析物(例如,裂解物)的混合物的结构域、片段、表位、区域或一部分上的结合部分或包含分析物(例如,裂解物)的混合物的结构域、片段、表位、区域或一部分的结合部分。例如,结合部分在来自多个细胞或来自单个细胞的裂解物的结构域、片段、表位、区域或一部分上或包含来自多个细胞或来自单个细胞的裂解物的结构域、片段、表位、区域或一部分。
[0175]
在一些情况下,结合部分在小分子的结构域、片段、表位、区域或一部分上或包含小分子的结构域、片段、表位、区域或一部分。例如,结合部分在药物的结构域、片段、表位、区域或一部分上或包含药物的结构域、片段、表位、区域或一部分。例如,结合部分在化合物的结构域、片段、表位、区域或一部分上或包含化合物的结构域、片段、表位、区域或一部分。例如,结合部分在有机化合物的结构域、片段、表位、区域或一部分上或包含有机化合物的结构域、片段、表位、区域或一部分。在一些情况下,结合部分在分子量为900道尔顿或更小的小分子的结构域、片段、表位、区域或一部分上或包含分子量为900道尔顿或更小的小分子的结构域、片段、表位、区域或一部分。在一些情况下,结合部分在分子量为500道尔顿或
更大的小分子的结构域、片段、表位、区域或一部分上或包含分子量为500道尔顿或更大的小分子的结构域、片段、表位、区域或一部分。结合部分可以例如从天然存在的或合成的分子的文库获得,该文库包括通过组合方式产生的化合物的文库,例如化合物多样性组合文库。组合文库及其产生和筛选方法是本领域已知的,并在以下专利中进行了描述:us 5,741,713、5,734,018、5,731,423、5,721,099、5,708,153、5,698,673、5,688,997、5,688,696、5,684,711、5,641,862、5,639,603、5,593,853、5,574,656、5,571,698、5,565,324、5,549,974、5,545,568、5,541,061、5,525,735、5,463,564、5,440,016、5,438,119、5,223,409,它们的披露内容通过援引并入本文。
[0176]
结合部分可以在特异性结合对的成员(例如配体)的结构域、片段、表位、区域或一部分上或包含特异性结合对的成员(例如配体)的结构域、片段、表位、区域或一部分。结合部分可以在单价(单表位)或多价(多表位)的结构域、片段、表位、区域或一部分上或包含单价(单表位)或多价(多表位)的结构域、片段、表位、区域或一部分。结合部分可以是抗原的或半抗原的。结合部分可以在共享至少一个共同表位或决定簇位点的单个分子或多个分子的结构域、片段、表位、区域或一部分上或包含共享至少一个共同表位或决定簇位点的单个分子或多个分子的结构域、片段、表位、区域或一部分。结合部分可以在细胞(例如细菌细胞、植物细胞或动物细胞)的一部分的结构域、片段、表位、区域或一部分上或包含细胞(例如细菌细胞、植物细胞或动物细胞)的一部分的结构域、片段、表位、区域或一部分。结合部分可以在天然环境(例如组织)、培养的细胞或微生物(例如细菌、真菌、原生动物或病毒)或裂解的细胞中。可以修饰(例如,化学地)结合部分,以提供一个或多个另外的结合位点,例如但不限于染料(例如,荧光染料)、多肽修饰性部分(例如磷酸基团、碳水化合物基团等)、或多核苷酸修饰性部分(例如甲基)。
[0177]
在一些情况下,结合部分在来自宿主的样品中发现的分子的结构域、片段、表位、区域或一部分上或包含来自宿主的样品中发现的分子的结构域、片段、表位、区域或一部分。来自宿主的样品包括体液(例如尿液、血液、血浆、血清、唾液、精液、粪便、痰、脑脊髓液、眼泪、粘液等)。样品可以直接检查,也可以进行预处理以使结合部分更易于检测。样品可以包括一定数量的来自活物或曾经是活物的物质。样品可以是天然的、重组的、合成的或非天然存在的。结合部分可以是上述任何,其从细胞天然或重组表达,在细胞裂解物中或细胞培养基中,是体外翻译的样品,或从样品(例如细胞裂解物)免疫沉淀。
[0178]
在一些情况下,靶标的结合部分在无细胞系统中或在体外表达。例如,靶标的结合部分在细胞提取物中。在一些情况下,靶标的结合部分在细胞提取物中,该细胞提取物具有dna模板以及用于转录和翻译的试剂。可以使用的细胞提取物的示例性来源包括小麦胚芽、大肠杆菌、兔网织红细胞、极端嗜热菌、杂交瘤、爪蟾卵母细胞、昆虫细胞和哺乳动物细胞(例如人细胞)。可用于表达靶标多肽(例如,在阵列上产生靶标多肽)的示例性无细胞方法包括蛋白原位阵列(pisa)、多重斑点技术(mist)、自组装mrna翻译、核酸可编程蛋白阵列(nappa)、纳米孔nappa、dna阵列至蛋白阵列(dapa)、无膜dapa、纳米孔复制和μip
‑
微凹版印刷以及pmac
‑
蛋白微阵列复制(参见kilb等人,eng.life sci.[生命科学工程]2014,14,352
‑
364)。
[0179]
在一些情况下,靶标的结合部分是从dna模板原位(例如,在阵列的固体基底上)合成的。在一些情况下,平行或在单个反应中从多个相应的dna模板原位合成多个结合部分。
用于原位靶标多肽表达的示例性方法包括以下中描述的那些:stevens,structure[结构]8(9):r177
‑
r185(2000);katzen等人,trends biotechnol.[生物技术趋势]23(3):150
‑
6.(2005);he等人,curr.opin.biotechnol.[生物技术当前观点]19(1):4
‑
9.(2008);ramachandran等人,science[科学]305(5680):86
‑
90.(2004);he等人,nucleic acids res.[核酸研究]29(15):e73
‑
3(2001);angenendt等人,mol.cell proteomics[分子与细胞蛋白组学]5(9):1658
‑
66(2006);tao等人,nat biotechnol[自然生物技术]24(10):1253
‑
4(2006);angenendt等人,anal.chem.[分析化学]76(7):1844
‑
9(2004);kinpara等人,j.biochem.[生物化学杂志]136(2):149
‑
54(2004);takulapalli等人,j.proteome res.[蛋白组学研究杂志]11(8):4382
‑
91(2012);he等人,nat.methods[自然方法]5(2):175
‑
7(2008);chatterjee和j.labaer,curr opin biotech[生物技术当前观点]17(4):334
‑
336(2006);he和wang,biomol eng[生物分子工程]24(4):375
‑
80(2007);以及he和taussig,j.immunol.methods[免疫学方法杂志]274(1
‑
2):265
‑
70(2003)。
[0180]
在一些情况下,核酸靶标的结合部分包含至少6个核苷酸的跨度,例如,至少8、9、10、12、15、20、25、30、40、50或100个核苷酸。在一些情况下,蛋白靶标的结合部分包含连续核苷酸段。在一些情况下,蛋白靶标的结合部分包含不连续核苷酸段。在一些情况下,核酸靶标的结合部分包含突变或功能性突变的位点,该突变或功能性突变包括核酸序列中核苷酸的缺失、添加、交换或截短。
[0181]
在一些情况下,蛋白靶标的结合部分包含至少6个氨基酸的跨度,例如至少8、9、10、12、15、20、25、30、40、50或100个氨基酸。在一些情况下,蛋白靶标的结合部分包含连续氨基酸段。在一些情况下,蛋白靶标的结合部分包含不连续氨基酸段。在一些情况下,蛋白靶标的结合部分包含突变或功能性突变的位点,该突变或功能性突变包括多肽序列中氨基酸的缺失、添加、交换或截短。
[0182]
在一些实施例中,结合部分在膜结合蛋白的结构域、片段、表位、区域或一部分上或包含膜结合蛋白的结构域、片段、表位、区域或一部分。示例性的膜结合蛋白包括但不限于gpcr(例如肾上腺素能受体、血管紧张素受体、胆囊收缩素受体、毒蕈碱乙酰胆碱受体、神经降压素受体、甘丙肽受体、多巴胺受体、阿片受体、血清素受体、生长抑素受体等)、离子通道(例如、烟碱乙酰胆碱受体、钠通道、钾通道等)、受体酪氨酸激酶、受体丝氨酸/苏氨酸激酶、受体鸟苷酸环化酶、生长因子和激素受体(例如表皮生长因子(egf)受体),等。结合部分也可以在膜结合蛋白的突变体或修饰变体的结构域、片段、表位、区域或一部分上或包含膜结合蛋白的突变体或修饰变体的结构域、片段、表位、区域或一部分。例如,gpcr的一些单点或多点突变保留功能并在疾病中涉及(参见例如,stadel等人,(1997)trends in pharmacological review[药理学趋势综述]18:430
‑
37)。
[0183]
在一些实施例中,多核糖核苷酸可以包括用于结合其他细胞内分子的其他结合基序。多核糖核苷酸(诸如circrna)应用的非限制性实例列于表1中。表1
[0184]
在一些实施例中,本文所述的多核糖核苷酸螯合靶标,例如dna、rna、蛋白和其他细胞组分,以调控细胞过程。具有针对目的靶标的结合位点的多核糖核苷酸可以与内源性结合伴侣竞争靶标结合。在一些实施例中,本文所述的多核糖核苷酸螯合mirna。在一些实施例中,本文所述的多核糖核苷酸螯合mrna。在一些实施例中,本文所述的多核糖核苷酸螯合蛋白。在一些实施例中,本文所述的多核糖核苷酸螯合核糖体。在一些实施例中,本文所述的多核糖核苷酸螯合其他多核糖核苷酸。在一些实施例中,本文所述的多核糖核苷酸螯合非编码rna、lncrna、mirna、trna、rrna、snorna、ncrna、sirna或shrna。在一些实施例中,本文所述的多核糖核苷酸包含降解与多核糖核苷酸结合的螯合靶标(例如dna、rna、蛋白或其他细胞组分)的降解元件。多核糖核苷酸(诸如circrna)螯合应用的非限制性实例列于表2中。表2过程作用方式(示例性)转录干扰circrna
‑
dna
翻译干扰circrna
‑
mrna或核糖体蛋白相互作用抑制剂circrna
‑
蛋白微rna螯合circrna
‑
rna(反义)circrna螯合(内源性circrna)circrna
‑
circrna(反义)
[0185]
在一些实施例中,使用本文所述的多核糖核苷酸的任何方法都可以与翻译元件组合。本文所述的包含翻译元件的多核糖核苷酸可以将rna翻译成蛋白。例如,通过包含序列特异性rna结合基序、序列特异性dna结合基序、蛋白特异性结合基序和调控性rna基序的多核糖核苷酸促进蛋白表达。调控性rna基序可以启动rna转录和蛋白表达。加密原
[0186]
如本文所述,多核糖核苷酸可以包含加密原以减少、逃避或避免细胞先天免疫反应。多核糖核苷酸可以以线性或环状形式存在。在一些实施例中,与参照化合物触发的免疫反应相比,本文提供的环状多核糖核苷酸导致来自宿主的免疫反应降低,例如,与相应的线性多核苷酸或包含加密原的线性多核苷酸相比,环状多核糖核苷酸产生降低的免疫反应,与缺少加密原的相应线性多核糖核苷酸相比,环状多核糖核苷酸产生降低的免疫反应。在一些实施例中,多核糖核苷酸的免疫原性比缺少加密原的对应物的免疫原性小。
[0187]
在一些实施例中,多核糖核苷酸在哺乳动物例如人中是非免疫原性的。在一些实施例中,多核糖核苷酸能够在哺乳动物细胞例如人细胞中复制。
[0188]
在一些实施例中,多核糖核苷酸包括序列或表达产物。
[0189]
在一些实施例中,包含加密原的多核糖核苷酸具有的半衰期至少是缺乏加密原的对应物的半衰期。在一些实施例中,多核糖核苷酸具有的半衰期相对于对应物的半衰期延长。在一些实施例中,半衰期延长约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更长。在一些实施例中,多核糖核苷酸在细胞中的半衰期或持续性为至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或更长时间或其间的任何时间。在某些实施例中,多核糖核苷酸在细胞中的半衰期或持续性为不超过约10分钟至约7天、或不超过约1小时、2小时,3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。
[0190]
在一些实施例中,包含加密原的多核糖核苷酸调节细胞功能,例如瞬时或长期调节细胞功能。在某些实施例中,细胞功能发生稳定地改变,例如调节持续至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或更长时间或其间的任何时间。在某些实施例中,细胞功能发生瞬时地改变,例如调节持续存在不超过约30分钟至约7天、或不超过约1小时、2小时,3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。
[0191]
在一些实施例中,包含加密原的多核糖核苷酸是至少约20个碱基对、至少约30个
碱基对、至少约40个碱基对、至少约50个碱基对、至少约75个碱基对、至少约100个碱基对、至少约200个碱基对、至少约300个碱基对、至少约400个碱基对、至少约500个碱基对或至少约1,000个碱基对。在一些实施例中,包含加密原的多核糖核苷酸可以具有足够的大小以容纳核糖体的结合位点。本领域技术人员可以理解的是,包含加密原的多核糖核苷酸的最大大小可以与产生多核糖核苷酸和/或使用多核糖核苷酸的技术限制内的一样大。
[0192]
在一些实施例中,包含加密原的环状多核糖核苷酸具有的半衰期至少是线性对应物(例如,线性表达序列或线性环状多核糖核苷酸)的半衰期。在一些实施例中,环状多核糖核苷酸具有的半衰期相对于线性对应物的半衰期延长。在一些实施例中,半衰期延长约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更长。在一些实施例中,环状多核糖核苷酸在细胞中的半衰期或持续性为至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或更长时间或其间的任何时间。在某些实施例中,环状多核糖核苷酸在细胞中的半衰期或持续性为不超过约10分钟至约7天、或不超过约1小时、2小时,3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。
[0193]
在一些实施例中,包含加密原的环状多核糖核苷酸调节细胞功能,例如瞬时或长期调节细胞功能。在某些实施例中,细胞功能发生稳定地改变,例如调节持续至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或更长时间或其间的任何时间。在某些实施例中,细胞功能发生瞬时地改变,例如调节持续存在不超过约30分钟至约7天、或不超过约1小时、2小时,3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。
[0194]
在一些实施例中,包含加密原的环状多核糖核苷酸是至少约20个碱基对、至少约30个碱基对、至少约40个碱基对、至少约50个碱基对、至少约75个碱基对、至少约100个碱基对、至少约200个碱基对、至少约300个碱基对、至少约400个碱基对、至少约500个碱基对或至少约1,000个碱基对。在一些实施例中,环状多核糖核苷酸可以具有足够的大小以容纳核糖体的结合位点。本领域技术人员可以理解,环状多核糖核苷酸的最大大小可以与产生环状多核糖核苷酸和/或使用环状多核糖核苷酸的技术限制内的一样大。不受理论的束缚,可能的是,rna的多个区段可以由dna产生并且其5’自由端和3'自由端退火以产生一“串”rna,当只留有一个5'自由端和一个3'自由端时,该“串”rna最终可能会被环化。在一些实施例中,环状多核糖核苷酸的最大尺寸可能受包装rna并将其递送至靶标的能力所限制。在一些实施例中,环状多核糖核苷酸的大小是足以编码有用多肽的长度,并且因此,小于约20,000个碱基对、小于约15,000个碱基对、小于约10,000个碱基对、小于约7,500个碱基对、或小于约5,000个碱基对、小于约4,000个碱基对、小于约3,000个碱基对、小于约2,000个碱基对、小于约1,000个碱基对、小于约500个碱基对、小于约400个碱基对、小于约300个碱基对、小
于约200个碱基对、小于约100个碱基对的长度可以是有用的。切割序列
[0195]
在一些实施例中,多核糖核苷酸包含至少一个切割序列。多核糖核苷酸可以以线性或环状形式存在。在一些实施例中,切割序列与表达序列相邻。在一些实施例中,多核糖核苷酸包含切割序列,诸如在牺牲型多核糖核苷酸、可切割多核糖核苷酸或自切割多核糖核苷酸中。在一些实施例中,多核糖核苷酸包含两个或更多个切割序列,导致将多核糖核苷酸分离成多个产物,例如mirna、线性rna、较小的环状多核糖核苷酸等。
[0196]
在一些实施例中,切割序列包含核酶rna序列。核酶(来自核糖核酸酶,也称为rna酶或催化性rna)是催化化学反应的rna分子。许多天然核酶催化其自身的磷酸二酯键之一的水解,或催化其他rna中的键的水解,但也发现天然核酶催化核糖体的氨基转移酶活性。催化性rna可以通过体外方法“进化”。类似于上文讨论的核糖开关活性,核酶及其反应产物可以调控基因表达。在一些实施例中,可以将催化性rna或核酶置于较大的非编码rna中,使得核酶以许多拷贝存在于细胞内,用于从大体积中化学转化分子。在一些实施例中,适体和核酶都可以在相同的非编码rna中编码。牺牲型序列
[0197]
在一些实施例中,本文所述的多核糖核苷酸包含牺牲型多核糖核苷酸、可切割多核糖核苷酸或自切割多核糖核苷酸。多核糖核苷酸可以以线性或环状形式存在。多核糖核苷酸可以递送细胞组分,包括,例如,rna、lncrna、lincrna、mirna、trna、rrna、snorna、ncrna、sirna或shrna。在一些实施例中,多核糖核苷酸包含由以下部分隔开的mirna:(i)可自切割的元件;(ii)切割募集位点;(iii)可降解接头;(iv)化学接头;和/或(v)间隔子序列。在一些实施例中,多核糖核苷酸包含由以下部分隔开的sirna:(i)可自切割的元件;(ii)切割募集位点(例如adar);(iii)可降解接头(例如丙三醇);(iv)化学接头;和/或(v)间隔子序列。可自切割的元件的非限制性实例包括锤头结构、剪接元件、发夹、丁型肝炎病毒(hdv)、varkud卫星(vs)和glms核酶。多核糖核苷酸(诸如circrna)牺牲应用的非限制性实例列于表3中。表3核糖开关
[0198]
在一些情况下,多核糖核苷酸包含一个或多个核糖开关。多核糖核苷酸可以以线
性或环状形式存在。
[0199]
核糖开关典型地被认为是多核糖核苷酸的一部分,可以直接结合一个小的靶标分子,并且核糖开关与靶标的结合会影响rna翻译、表达产物的稳定性和活性(tucker b j,breaker r r(2005),curr opin struct biol[结构生物学新见]15(3):342
‑
8)。因此,取决于核糖开关靶标分子的存在或不存在,包含核糖开关的多核糖核苷酸直接参与调控其自身的活性。在一些情况下,核糖开关具有适体样亲和力区域用于单独的分子。因此,在本发明的更广泛的上下文中,包含在非编码核酸中的任何适体都可以用于从大体积中螯合分子。经由“(核糖)开关”活动对事件的下游报告可能是特别有利的。
[0200]
在一些情况下,核糖开关可对基因表达具有影响,包括但不限于转录终止、翻译起始抑制、mrna自切割、以及在真核生物中剪接途径的改变。核糖开关可以通过结合或去除触发分子而起到控制基因表达的作用,诸如通过使包含核糖开关的多核糖核苷酸经受激活、失活或阻断核糖开关以改变表达的条件。表达由于例如转录终止或核糖体与rna结合的阻断而改变。取决于核糖开关的性质,触发分子或其类似物的结合可以减少或阻止rna分子的表达或促进或增加rna分子的表达。本文描述了核糖开关的一些实例。
[0201]
在一些情况下,核糖开关是钴胺素核糖开关(也称b
12
‑
元件),该核糖开关结合腺苷钴胺素(维生素b
12
的辅酶形式)以调控钴胺素和类似代谢物的生物合成和转运。
[0202]
在一些情况下,核糖开关是环状二
‑
gmp核糖开关,这些核糖开关结合环状二
‑
gmp以调控多种基因。分为非结构相关的两类,即环状二
‑
gmp
‑
l和环状二
‑
gmp
‑
ll。
[0203]
在一些情况下,核糖开关是fmn核糖开关(也称rfn元件),该核糖开关结合黄素单核苷酸(fmn)以调控核黄素的生物合成和转运。
[0204]
在一些情况下,核糖开关是glms核糖开关,当存在足够浓度的葡萄糖胺
‑6‑
磷酸时,该核糖开关自切割。
[0205]
在一些情况下,核糖开关是谷氨酰胺核糖开关,该核糖开关结合谷氨酰胺以调控涉及谷氨酰胺和氮代谢的基因。它们还结合未知功能的短肽。这些核糖开关分为结构上相关的两类:glna rna基序和下游肽基序。
[0206]
在一些情况下,核糖开关是甘氨酸核糖开关,该核糖开关结合甘氨酸以调控甘氨酸代谢基因。甘氨酸核糖开关在同一mrna中包含两个相邻的适体结构域,并且是已知唯一显示出协同结合的天然rna。
[0207]
在一些情况下,核糖开关是赖氨酸核糖开关(也称l
‑
box),该核糖开关结合赖氨酸以调控赖氨酸的生物合成、分解代谢和转运。
[0208]
在一些情况下,核糖开关是preq1核糖开关,该核糖开关结合前q核苷以调控参与该前体的合成或转运至q核苷的基因。已知两种完全不同的pregi核糖开关类别:preq1
‑
l核糖开关和preq1
‑
ll核糖开关。在天然存在的核糖开关中,preq1
‑
l核糖开关的结合结构域异常小。仅在链球菌和乳球菌属的某些物种中发现的pregi
‑
ii核糖开关具有完全不同的结构,并且更大。
[0209]
在一些情况下,核糖开关是嘌呤核糖开关,该核糖开关结合嘌呤以调控嘌呤的代谢和转运。嘌呤核糖开关的不同形式结合鸟嘌呤(一种最初称为g
‑
box的形式)或腺嘌呤。鸟嘌呤或腺嘌呤的特异性完全取决于与核糖开关中y74位处单个嘧啶的沃森
‑
克里克相互作用。在鸟嘌呤核糖开关中,该残基是胞嘧啶(即c74),在腺嘌呤中,该残基总是尿嘧啶(即
u74)。嘌呤核糖开关的同源类型结合脱氧鸟苷,但比单核苷酸突变具有更显著的差异。
[0210]
在一些情况下,核糖开关是sah核糖开关,该核糖开关结合s
‑
腺苷高半胱氨酸以调控参与回收该代谢物的基因,该代谢产物是在甲基化反应中使用s
‑
腺苷甲硫氨酸时产生的。
[0211]
在一些情况下,核糖开关是sam核糖开关,该核糖开关结合s
‑
腺苷甲硫氨酸(sam)以调控甲硫氨酸和sam的生物合成和转运。已知三个截然不同的sam核糖开关:sam
‑
i(最初称为s
‑
box)、sam
‑
ii和s
m
k box核糖开关。sam
‑
i广泛存在于细菌中,但是sam
‑
ii仅在α
‑
变形菌门、β
‑
变形菌门和少数γ
‑
变形菌门中发现。仅在乳酸杆菌目中发现s
m
k box核糖开关。这三种核糖开关变体在序列或结构上没有明显的相似性。第四种变体sam
‑
iv似乎具有与sam
‑
i类似的配体结合核心,但是在不同的支架的情况下。
[0212]
在一些情况下,核糖开关是sam
‑
sah核糖开关,该核糖开关以相似的亲和力结合sam和sah。由于总是在调控编码甲硫氨酸腺苷转移酶基因的位置中发现它们,因此提出仅它们与sam的结合在生理学上相关。
[0213]
在一些情况下,核糖开关是四氢叶酸核糖开关,该核糖开关结合四氢叶酸以调控合成并转运基因。
[0214]
在一些情况下,核糖开关是结合茶碱的核糖开关或结合胸腺嘧啶焦磷酸的核糖开关。
[0215]
在一些情况下,核糖开关是腾冲嗜热菌(t.tengcongensis)glms催化性核糖开关,该核糖开关感测葡萄糖胺
‑6‑
磷酸(klein和ferre
‑
d'amare2006)。
[0216]
在一些情况下,核糖开关是tpp核糖开关(也称thi
‑
box),该核糖开关结合硫胺素焦磷酸(tpp)以调控硫胺素的生物合成和转运,以及类似代谢物的转运。这是迄今为止在真核细胞中发现的唯一核糖开关。
[0217]
在一些情况下,核糖开关是moco核糖开关,该核糖开关结合钼辅因子,以调控参与该辅酶的生物合成和转运的基因,以及使用该辅酶或其衍生物作为辅因子的酶。
[0218]
在一些情况下,核糖开关是在创伤弧菌的腺嘌呤脱氨酶编码基因的5'utr中发现的腺嘌呤传感add
‑
a核糖开关。适体酶
[0219]
在一些情况下,多核糖核苷酸包含适体酶。适体酶是用于条件性表达的开关,在该条件性表达中适体区域用作变构控制元件并偶联至催化性rna的区域。在一些情况下,适体酶在细胞类型特异性翻译中具有活性。在一些情况下,适体酶在细胞状态特异性翻译(例如,病毒感染的细胞或存在病毒核酸或病毒蛋白)下具有活性。多核糖核苷酸可以以线性或环状形式存在。
[0220]
核酶(来自核糖核酸酶,也称为rna酶或催化性rna)是催化化学反应的rna分子。许多天然核酶催化其自身的磷酸二酯键之一的水解,或催化其他rna中的键的水解,但也发现天然核酶催化核糖体的氨基转移酶活性。最近显示催化性rna可以通过体外方法“进化”[1.agresti j j,kelly b t,jaschke a,griffiths a d:selection of ribozymes that catalyse multiple
‑
turnover diels
‑
alder cycloadditions by using in vitro compartmentalization[通过体外区室化选择催化多周转环加成的核酶].proc natl acad sci usa[美国国家科学院院刊]2005,102:16170
‑
16175;2.sooter l j,riedel t,
davidson e a,levy m,cox j c,ellington a d:toward automated nucleic acid enzyme selection[自动化核酸酶选择].biological chemistry[生物化学]2001,382(9):1327
‑
1334.].winkler等人,[winkler w c,nahvi a,roth a,collins j a,breaker r r:control of gene expression by a natural metabolite
‑
responsive ribozyme[天然代谢物响应核酶对基因表达的控制].nature[自然]2004,428:281
‑
286],类似于上文讨论的核糖开关活性,核酶及其反应产物可以调控基因表达。在本发明的上下文中,将催化性rna或核酶置于较大的非编码rna中可能特别有利,使得核酶以许多拷贝存在于细胞内,用于从大体积中化学转化分子。此外,在同一非编码rna中同时编码适体和核酶可能是特别有利的。
[0221]
核酶的一些非限制性实例包括锤头状核酶、vl核酶、铅酶、发夹核酶。
[0222]
在一些情况下,适体酶是切割rna序列并且可以由于结合配体/调节子而被调控的核酶。核酶也可以是自切割核酶。这样,适体酶组合了核酶和适体的特性。适体酶由于其在途翻译活性的潜力相较于常规适体提供更多优势,事实上适体酶具有催化作用以使表达失活,并且由于其自身或异源转录物的切割,失活是不可逆的。
[0223]
在一些情况下,适体酶被包括在多核糖核苷酸(例如,线性或环状多核糖核苷酸)的非翻译区中,并且在不存在配体/调节子时是失活的,从而允许转基因的表达。可以通过添加配体来关闭(或下调)表达。应当注意,响应于特定调节子的存在而被下调的适体酶可用于需要响应调节子的基因表达上调的控制系统中。
[0224]
适体酶还可以允许形成用于多核糖核苷酸表达自调控的系统。例如,环状多核糖核苷酸的蛋白产物是特定小分子合成中的速率决定酶,可以对该小分子进行修饰,以包含选择用于在该分子存在下催化活性更强的适体酶,从而为该小分子合成提供自调控反馈回路。替代性地,适体酶活性可以被选择为对环状多核糖核苷酸或任何其他细胞大分子的蛋白产物积累敏感。
[0225]
在一些情况下,多核糖核苷酸可以包括适体序列。一些非限制性实例包括结合溶菌酶的rna适体、toggle
‑
25t(包括2'氟嘧啶核苷酸的rna适体,以高特异性和亲和力结合凝血酶)、结合人免疫缺陷病毒反式作用应答元件(hiv tar)的rnatat、结合血红素的rna适体、结合干扰素γ的rna适体、结合血管内皮生长因子(vegf)的rna适体、结合前列腺特异性抗原(psa)的rna适体、结合多巴胺的rna适体和结合非经典致癌基因
‑
热休克因子1(hsf1)的rna适体。其他试剂
[0226]
在一些情况下,组合物或药物组合物包含除醇或细胞渗透剂和多核糖核苷酸之外的试剂。例如,除了多核糖核苷酸之外,组合物或药物组合物可进一步包含一种或多种活性剂,例如治疗剂,诸如一种或多种肽、核酸(例如dna)、蛋白(例如抗体或其片段)、apc、病毒、小分子化合物、前药或其组合。在一些情况下,包含一种或多种活性剂(例如治疗剂)的组合物或药物组合物可使用一种或多种生理学上可接受的载体配制,这些载体包括赋形剂、稀释剂和/或例如促进将一种或多种活性剂加工成可施用的制剂的助剂。多核糖核苷酸可以以线性或环状形式存在。
[0227]
在一些情况下,本文所述的组合物或药物组合物可进一步包含治疗上可接受的赋形剂、载体、稀释剂、佐剂、其他辅助媒介物、缓冲剂、稳定剂或支架。组合物或药物组合物可
进一步包含其他试剂以维持适当的物理或化学性质,诸如但不限于盐浓度、重量渗透摩尔浓度、ph、疏水性/亲水性和溶解度。例如,组合物可以包含稳定剂,例如适当浓度的葡萄糖,例如约4.5g/l。在一些实施例中,多核糖核苷酸是非免疫原性的。在一些实施例中,多核糖核苷酸是免疫原性的。组合物或药物组合物可进一步包含适当的佐剂或可增强或抑制多核糖核苷酸免疫原性的其他试剂。
[0228]
治疗上可接受的载体的非限制性实例包括淀粉、葡萄糖、乳糖、蔗糖、明胶、盐水、阿拉伯树胶、角蛋白、尿素、麦芽、米粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、丙三醇、丙烯、二醇、湿润剂(例如,尿素)、二醇类(例如,丙二醇)、脂肪酸(例如,油酸)、表面活性剂(例如,肉豆蔻酸异丙酯和月桂基硫酸钠)、吡咯烷酮、单月桂酸甘油酯、亚砜、萜烯(例如,薄荷醇)、胺、酰胺、烷烃、烷醇、水、碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶、聚合物诸如聚乙二醇以及水。如果需要,载体还可以含有少量的润湿剂或乳化剂,或ph缓冲剂。稳定性
[0229]
本文提供的多核糖核苷酸在递送至细胞或组织中后可以是稳定的,从而允许多核糖核苷酸的翻译,导致对递送该多核糖核苷酸的细胞或组织的生物效应。多核糖核苷酸可以以线性或环状形式存在。在一些实施例中,多核糖核苷酸是线性多核糖核苷酸并且用于短期生物效应,诸如用于持续至少1小时、6小时、12小时、24小时、48小时、72小时或其间的任何时间的生物效应。在一些实施例中,多核糖核苷酸是环状多核糖核苷酸并且用于长期生物效应,诸如持续至少3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天或更长时间或其间的任何时间的生物效应。在一些实施例中,多核糖核苷酸对例如核酸外切酶的降解具有实质性抗性。在一些实施例中,多核糖核苷酸抗自降解。在一些实施例中,多核糖核苷酸缺少酶促切割位点,例如dicer切割位点。
[0230]
在一些实施例中,多核糖核苷酸在细胞分裂期间持续存在于细胞中。在一些实施例中,多核糖核苷酸在有丝分裂后持续存在于子细胞中。在一些实施例中,多核糖核苷酸在细胞内复制并传递给子细胞。在一些实施例中,多核糖核苷酸包含介导多核糖核苷酸的自复制的复制元件。在一些实施例中,复制元件介导环状多核糖核苷酸转录成与环状多核糖核苷酸互补的线性多核糖核苷酸(线性互补)。在一些实施例中,线性互补的多核糖核苷酸可以在细胞中体内环化为互补的环形多核糖核苷酸。在一些实施例中,互补的多核糖核苷酸可以进一步自复制成另一个环状多核糖核苷酸,该环状多核糖核苷酸具有与起始环状多核糖核苷酸相同或相似的核苷酸序列。一种示例性自复制元件包括hdv复制结构域(如beeharry等人,virol[病毒学],2014,450
‑
451:165
‑
173所描述)。在一些实施例中,细胞以至少25%、50%、60%、70%、80%、85%、90%、95%或99%的效率将至少一种多核糖核苷酸传递至子细胞。在一些实施例中,正经历减数分裂的细胞以至少25%、50%、60%、70%、80%、85%、90%、95%或99%的效率将多核糖核苷酸传递至子细胞。在一些实施例中,经历有丝分裂的细胞将多核糖核苷酸传递给子代。组合物和递送途径
[0231]
本文提供的组合物或药物组合物可以部分地基于组合物的预期施用途径来配制。在本披露的某些方面,本文提供的组合物或药物组合物可以在受试者的特定部位或附近局部施用。组合物可以如本文所述并且进一步包含药学上可接受的赋形剂。直接局部施加例
如粘性液体、溶液、悬浮液、凝胶、胶冻、乳膏、润肤露、软膏、栓剂、泡沫或气溶胶喷雾可用于局部施用。在一些实施例中,组合物被配制用于全身施用。用于此类配制品的药学上合适的媒介物包括例如低级脂肪醇、聚二醇(例如丙三醇或聚乙二醇)、脂肪酸酯、油、脂肪、硅酮等。如果需要,此类制剂还可以包含防腐剂(例如对羟基苯甲酸酯)和/或抗氧化剂(例如抗坏血酸和生育酚)。多核糖核苷酸可以以线性或环状形式存在。
[0232]
组合物或药物组合物可以包含醇(例如乙醇)和多核糖核苷酸。组合物或药物组合物可以包含细胞渗透剂和多核糖核苷酸。组合物或药物组合物可以包含稀释剂和多核糖核苷酸,其中组合物或药物组合物不含任何载体。
[0233]
本文提供的组合物或药物组合物可以配制用于直接施用在受试者的表面区域上,诸如皮肤、指甲,口腔、鼻腔、耳腔、阴道、子宫颈、宫内、泌尿道和眼睛的表面区域。
[0234]
本文所述的组合物或药物组合物可以是液体制剂,诸如悬浮液、糖浆或酏剂。在一些情况下,将水溶液包装以按原样使用,或冻干,并在施用之前将冻干制剂与无菌溶液组合。组合物可以以溶液或悬浮液的形式递送。通常,诸如凝胶(例如,dmso凝胶)、胶冻、乳膏、润肤露(例如,强生润肤露)、栓剂和软膏等配制品可以使区域更长时间暴露于一种或多种活性剂,而溶液中的配制品(例如,喷雾)可以提供更立即的短期暴露。
[0235]
如本文所述的组合物或药物组合物可以具有约7的ph。在一些实施例中,组合物或药物组合物具有与水大致相同的粘度。组合物或药物组合物可以基本上不含疏水性或亲脂性基团。在一些实施例中,组合物或药物组合物基本上不含烃。组合物或药物组合物可以基本上不含脂肪酸、脂质、脂质体、胆固醇或其任何组合。
[0236]
在一些实施例中,递送如本文所述的多核糖核苷酸的方法包括将包含多核糖核苷酸和乙醇的混合物的组合物局部施加至受试者的表面区域,其中乙醇占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,递送如本文所述的多核糖核苷酸的方法包括将包含多核糖核苷酸和醇的混合物的组合物局部施加至受试者的表面区域,其中醇占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,递送如本文所述的多核糖核苷酸的方法包括将包含多核糖核苷酸和细胞渗透剂的混合物的组合物局部施加至受试者的表面区域,其中细胞渗透剂占混合物的至少约0.3%v/v至约75%v/v。在一些实施例中,乙醇、醇或细胞渗透剂占混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v,或其间的任何百分比v/v。在一些实施例中,乙醇、醇或细胞渗透剂占混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v,或其间的任何百分比v/v。
[0237]
通常,如本文所述的组合物或药物组合物将多核糖核苷酸递送至受试者的真皮或表皮组织。在一些实施例中,多核糖核苷酸在不使用离子导入法的情况下递送。经皮施用
[0238]
用于局部施用的配制品可以呈液体、半固体剂型(例如,糊剂、乳膏、润肤露、粉末、
软膏或凝胶)、贴片、膜或喷雾的形式。在一些情况下,局部组合物可以为可施加至有需要的受试者的皮肤的受影响区域(例如经皮或皮肤施用)的乳膏或凝胶。不同的释放曲线可以通过不同的形式实现,诸如但不限于控制释放、延迟释放、延长释放或持续释放。局部药物组合物可以每天多次、每天一次或根据需要经常施加。多核糖核苷酸可以以线性或环状形式存在。
[0239]
在一些情况下,组合物或药物组合物被配制用于直接施加在皮肤区域上(例如,经皮或皮肤施用)。本文提供的组合物或药物组合物可以包含皮肤病学可接受的稀释剂。此类稀释剂与皮肤、指甲、粘膜、组织和/或毛发相容,并且可以包括满足这些要求的任何皮肤病学稀释剂。此类稀释剂可由本领域的普通技术人员容易地选择。在配制皮肤软膏时,一种或多种试剂可以配制在油质烃基质、无水吸收基质、油包水吸收基质、水包油水可洗去型基质和/或水溶性基质中。
[0240]
软膏和乳膏例如用水性或油性基质并添加合适的增稠剂和/或胶凝剂来配制。润肤露可以用水性或油性基质配制,并且通常还包含一种或多种乳化剂、稳定剂、分散剂、助悬剂、增稠剂或着色剂。用于递送药剂的透皮贴片的构造和使用是本领域已知的。此类贴片可被构造用于连续、脉冲或按需递送药剂。
[0241]
可用于形成组合物和剂型的润滑剂可以包括硬脂酸钙、硬脂酸镁、矿物油、轻质矿物油、甘油、山梨醇、甘露醇、聚乙二醇、其他二醇类、硬脂酸、月桂基硫酸钠、滑石、氢化植物油(例如花生油、棉籽油、葵花油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂或其混合物。另外的润滑剂包括例如syloid硅胶、合成二氧化硅的凝聚型气溶胶或其混合物。润滑剂可以任选地以小于组合物的约1重量%的量加入。
[0242]
本文提供的组合物或药物组合物可以呈适于局部施用的任何形式,包括水性、水醇性或油性溶液,润肤露或精华液分散体,水性、无水或油性凝胶,通过将脂肪相分散于水相中(o/w或水包油)或相反地(w/o或油包水)获得的乳液,微乳液或替代性地离子型和/或非离子型微囊、微粒或脂质囊泡分散体。除了多核糖核苷酸和其他活性成分之外,本文提供的组合物的各种成分的量可以是本领域中使用的那些。这些组合物可以构成用于面部、手、身体和/或粘膜或用于清洁皮肤的保护、治疗或护理乳膏、乳、润肤露、凝胶或泡沫。组合物还可以由构成皂或清洁条的固体制剂组成。
[0243]
本文提供的用于局部(local/topical)施用的组合物或药物组合物可以包含一种或多种抗微生物防腐剂,诸如季铵化合物、有机汞制剂、对羟基苯甲酸酯、芳族醇、氯丁醇等。吸入(例如经鼻施用或经口吸入)
[0244]
本文所述的组合物或药物组合物可以被配制用于经由受试者的鼻腔通道施用。适于经鼻施用的配制品(其中载体为固体)可以包括具有例如在约10至约500微米范围内的粒度的粗粉,其可以采取鼻吸的方式施用,例如通过从靠近鼻子的粉末容器中经鼻腔通道快速吸入。该配制品可以是鼻喷雾剂、滴鼻剂或通过雾化器进行的气溶胶施用。配制品可以包含多核糖核苷酸的水溶液或油溶液。多核糖核苷酸可以以线性或环状形式存在。
[0245]
本文提供的组合物或药物组合物可以配制成气溶胶配制品。气溶胶配制品可以是例如气溶胶溶液、悬浮液或干粉。气溶胶可以通过呼吸系统或鼻腔通道施用。例如,可以将组合物悬浮或溶解在合适的载体例如药学上可接受的推进剂中,并使用鼻喷雾剂或吸入剂
直接施用至肺中。例如,将包含一种或多种活性剂的气溶胶配制品溶解、悬浮或乳化在推进剂或溶剂和推进剂的混合物中,例如作为鼻喷雾剂或吸入剂施用。气溶胶配制品可以包含任何可接受的加压推进剂,诸如药学上可接受的推进剂。
[0246]
用于经鼻施用的气溶胶配制品可以是被设计成以滴剂或喷雾剂形式施用至鼻腔通道的水溶液。鼻用溶液可以类似于鼻分泌物,因为它们可以是等渗的且轻微缓冲的以保持约5.5至约6.5的ph。在一些情况下,可以使用该范围之外的ph值。
[0247]
用于吸入的气溶胶配制品可以被设计成使得当通过鼻或口呼吸途径施用时,一种或多种活性剂被携带到受试者的呼吸系统中,例如沿着呼吸道,例如鼻腔、口、咽、喉、气管、主支气管和肺。吸入溶液例如通过雾化器施用。包含细粉状或液体组合物的吸入剂或吹入剂可以作为药剂或药剂组合在例如帮助分配的推进剂中的溶液或悬浮液的药物气溶胶递送至呼吸系统。推进剂可以是液化气体,包括卤代碳,例如碳氟化合物诸如氟化氯化烃、氢氯氟烃和氢氯烃,以及烃和烃醚。
[0248]
气溶胶配制品还可以包含其他组分,例如表面活性剂或其他组分,诸如油和洗涤剂。这些组分可用于稳定配制品和/或润滑阀部件。
[0249]
气溶胶配制品可以在压力下包装,并且可以使用溶液、悬浮液、乳液、粉末和半固体制剂配制成气溶胶。例如,溶液气溶胶配制品可以包括活性剂诸如在(基本上)纯的推进剂或推进剂和溶剂的混合物中的溶液。溶剂可以用于溶解一种或多种活性剂和/或延缓推进剂的蒸发。溶剂可以包括例如水和二醇类。可使用合适溶剂的任何组合,任选地与防腐剂、抗氧化剂和/或其他气溶胶组分组合。
[0250]
气溶胶配制品可以是分散体或悬浮液。悬浮气溶胶配制品可以包含一种或多种活性剂(例如多核糖核苷酸)和分散剂的悬浮液。分散剂可以包括例如脱水山梨糖醇三油酸酯、油醇、油酸、卵磷脂和玉米油。悬浮气溶胶配制品还可以包含润滑剂、防腐剂、抗氧化剂和/或其他气溶胶组分。
[0251]
气溶胶配制品也可配制成乳液。乳液气溶胶配制品可以包含例如表面活性剂、水和推进剂,以及活性剂或活性剂的组合,例如一种或多种肽。所使用的表面活性剂可以是非离子的、阴离子的或阳离子的。乳液气溶胶配制品的一个实例包含例如表面活性剂、水和推进剂。乳液气溶胶配制品的另一个实例包含例如植物油、单硬脂酸甘油酯和丙烷。口服施用
[0252]
在一些情况下,本文提供的组合物或药物组合物可以配制用于口服施用。有时,组合物或药物组合物可以包括支架(例如丸剂、糖衣丸、胶囊、锭剂、硬糖、液体、凝胶、糖浆、浆液、粉末、悬浮液、酏剂、糯米纸囊剂(wafer)),其包含细胞渗透剂和多核糖核苷酸的混合物。在一些情况下,支架被配置成沿胃肠道的任何地方释放混合物。在其他情况下,支架被配置成在胃肠道的特定位置释放混合物,例如咽、食道、胃、肠或结肠的一个或多个位置。使用用于口服施用的不同支架可以实现不同的释放曲线,诸如但不限于控制释放、延迟释放、延长释放或持续释放。多核糖核苷酸可以以线性或环状形式存在。
[0253]
对于口服施用,本文提供的组合物或药物组合物可以通过将混合物与本领域已知的药学上可接受的稀释剂组合来容易地配制。此类稀释剂使得活性剂能够被配制成片剂,包括咀嚼片、丸剂、糖衣丸、胶囊、锭剂、硬糖、液体、凝胶、糖浆、浆液、粉末、悬浮液、酏剂、糯米纸囊剂等,用于待治疗患者的口服摄取。此类配制品可以包含药学上可接受的稀释剂,包
括固体稀释剂或填充剂、无菌水性介质和各种无毒有机溶剂。固体稀释剂可以是一种或多种也可用作稀释剂、调味剂、增溶剂、润滑剂、助悬剂、粘合剂、防腐剂、片剂崩解剂或包封材料的物质。
[0254]
用于口服使用的液体混合物可以配制成胶囊,这些胶囊可以包含具有药学上可接受的赋形剂的混合物,这些赋形剂诸如为助悬剂(例如甲基纤维素)、润湿剂(例如卵磷脂、溶血卵磷脂和/或长链脂肪醇)以及着色剂、防腐剂、调味剂等。由于例如存在大的亲脂性部分,可能需要油或非水性溶剂将一种或多种活性剂带入溶液中。替代性地,可使用乳液、悬浮液或其他制剂。
[0255]
可以口服使用的药物制剂包括由明胶制成的推入配合(push
‑
fit)胶囊,以及由明胶和增塑剂诸如丙三醇或山梨醇制成的密封软胶囊。推入配合胶囊可以包含细胞渗透剂和多核糖核苷酸与填充剂诸如乳糖、粘合剂诸如淀粉和/或润滑剂诸如滑石或硬脂酸镁以及任选的稳定剂配混而成的混合物。软胶囊可以包含赋形剂诸如脂肪油、液体石蜡或液体聚乙二醇。此外,可以添加稳定剂。用于口服施用的所有配制品可以处于适于施用的剂量。
[0256]
当配制用于口服施用的化合物时,可能需要利用胃滞留配制品来增强从胃肠道的吸收。在胃中保留数小时的配制品可以缓慢释放细胞渗透剂和多核糖核苷酸的混合物,并提供可用于本文的持续释放。在胃中保留数小时的配制品可以缓慢释放醇和多核糖核苷酸的混合物,并提供可用于本文的持续释放。可以使用可扩展的、浮动的生物粘附技术以使混合物在胃肠道表面区域的施加最大化。眼部施用
[0257]
本文提供的组合物或药物组合物可以通过眼睛施用,例如以滴眼剂或软膏递送。将组合物局部施加至眼睛可以使眼睛中的细胞(例如视网膜)与细胞渗透剂和多核糖核苷酸的混合物接触。将组合物局部施加至眼睛可以使眼睛中的细胞(例如视网膜)与醇(例如乙醇)和多核糖核苷酸的混合物接触。多核糖核苷酸可以以线性或环状形式存在。
[0258]
如果单独的细胞渗透剂和多核糖核苷酸的混合物本身处于液相中,则可以通该混合物来制备滴眼剂。如果单独的醇(例如乙醇)和多核糖核苷酸的混合物本身处于液相中,则可以通该混合物来制备滴眼剂。替代性地,可以通过将细胞渗透剂和多核糖核苷酸的固体混合物溶解在无菌水溶液诸如生理盐水、缓冲溶液等中,或通过使将在使用前溶解的粉末组合物合并来制备滴眼剂。替代性地,可以通过将醇(例如乙醇)和多核糖核苷酸的固体混合物溶解在无菌水溶液诸如生理盐水、缓冲溶液等中,或通过使将在使用前溶解的粉末组合物合并来制备滴眼剂。如本领域已知的,可以选择其他媒介物,它们包括但不限于:平衡盐溶液、盐水溶液、水溶性聚醚诸如聚乙二醇、聚乙烯基类化合物诸如聚乙烯醇和聚维酮、纤维素衍生物诸如甲基纤维素和羟丙基甲基纤维素、石油衍生物诸如矿物油和白凡士林、动物脂肪诸如羊毛脂、丙烯酸聚合物诸如羧基聚亚甲基凝胶、植物脂肪诸如花生油和多糖诸如葡聚糖,以及糖胺聚糖诸如透明质酸钠。如果需要,可以添加通常用于滴眼剂的添加剂。此类添加剂包括等渗剂(例如,氯化钠等)、缓冲剂(例如,硼酸、磷酸氢二钠、磷酸二氢钠等)、防腐剂(例如,苯扎氯铵、苄索氯铵、氯丁醇等)、增稠剂(例如,糖诸如乳糖、甘露醇、麦芽糖等;例如,透明质酸或其盐诸如透明质酸钠、透明质酸钾等;例如,粘多糖诸如硫酸软骨素等;例如,聚丙烯酸钠、羧乙烯基聚合物、交联聚丙烯酸酯、聚乙烯醇、聚乙烯吡咯烷酮、甲基纤维素、羟丙基甲基纤维素、羟乙基纤维素、羧甲基纤维素、羟丙基纤维素或本领域技术
人员已知的其他试剂)。其他施用
[0259]
在一些情况下,本文所述的组合物或药物组合物被配制用于作为栓剂施用。对于直肠施加,组合物的合适剂型包括栓剂(乳液或悬浮液型)和直肠明胶胶囊(溶液或悬浮液)。在示例性栓剂配制品中,本文提供的组合物与合适的药学上可接受的栓剂基质诸如可可脂、酯化脂肪酸、甘油化明胶和各种水溶性或水分散性基质如聚乙二醇组合。可以将各种添加剂、增强剂或表面活性剂掺入。例如,可以首先熔化低熔点蜡,诸如甘油三酯、脂肪酸甘油酯、witepsol s55(德国诺贝尔炸药化学公司(dynamite nobel chemical)的商标)或可可脂的混合物,并且可以例如通过搅拌均匀地分散该混合物。然后可将熔化的均匀混合物倒入适宜尺寸的模具中,使其冷却并固化。多核糖核苷酸可以以线性或环状形式存在。
[0260]
在一些情况下,本文所述的组合物或药物组合物被配制用于粘膜施用。
[0261]
在一些情况下,本文所述的组合物或药物组合物被配制用于阴道施用。在一些情况下,阴道栓、棉塞、乳膏、凝胶、糊剂、泡沫或喷雾含有本文所述的一种或组合物。
[0262]
在一些情况下,组合物或药物组合物被配制用于施用至上皮细胞。该组合物或药物组合物可以不含任何载体,而包含稀释剂和如本文所述的多核糖核苷酸。在一些实施例中,将该组合物或药物组合物直接施加至上皮细胞以递送多核糖核苷酸。预处理
[0263]
如本文所述的组合物或药物组合物可以在将消毒剂施加至表面后再施加至该表面(例如,用消毒剂预处理该表面以递送多核糖核苷酸)。该表面可以是受试者的表面区域。受试者的表面区域包括细胞,诸如上皮细胞。
[0264]
消毒剂可以是杀菌、抑菌和/或主动杀灭微生物、灭活微生物或防止微生物生长的任何试剂。在一些实施例中,消毒剂是醇、碘或过氧化氢。消毒剂可以是紫外光或激光。在一些实施例中,消毒剂是以电的方式或通过其他方式诸如通过蒸气或接触传递的热。
[0265]
消毒剂可以通过各种非侵入性方法施加至受试者的表面区域。例如,消毒剂可以通过包含消毒剂的擦拭物或拭子施加。在一些实施例中,消毒剂作为喷雾而施加。可以使用各种装置来施加消毒剂。例如,可以使用产生紫外光或激光的装置。在其他实施例中,可以使用产生热量的装置。
[0266]
预处理后施加至表面区域的组合物或药物组合物可以不含任何载体,而包含多核糖核苷酸和稀释剂。多核糖核苷酸可以是线性多核糖核苷酸或环状多核糖核苷酸。防腐剂
[0267]
本文提供的组合物或药物组合物可以包含用于单次施用的材料,或者可以包含用于多次施用的材料(例如,“多剂量”试剂盒)。多核糖核苷酸可以以线性或环状形式存在。组合物或药物组合物可以包含一种或多种防腐剂,诸如硫柳汞或2
‑
苯氧乙醇。防腐剂可以用于防止使用期间的微生物污染。合适的防腐剂包括:苯扎氯铵、硫柳汞、氯丁醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯乙醇、依地酸二钠、山梨酸、onamer m或本领域技术人员已知的其他试剂。在眼科产品中,例如,此类防腐剂可以按0.004%至0.02%的水平使用。在本文所述的组合物中,防腐剂例如苯扎氯铵可以按重量计以0.001%至小于0.01%,例如0.001%至0.008%,优选约0.005%的水平使用。
[0268]
聚核糖核苷酸对周围环境中丰富的rna酶可能敏感。本文提供的组合物可以包括
抑制rna酶活性的试剂,从而防止多核糖核苷酸降解。在一些情况下,组合物或药物组合物包含本领域技术人员已知的任何rna酶抑制剂。替代性地或另外,本文提供的组合物中的多核糖核苷酸和细胞渗透剂和/或药学上可接受的稀释剂或载体、媒介物、赋形剂或其他试剂可以在无rna酶的环境中制备。组合物可以在无rna酶的环境中配制。
[0269]
在一些情况下,本文提供的组合物可以是无菌的。组合物可以在本领域已知的合适媒介物中配制成无菌溶液或悬浮液。组合物可以通过常规的已知灭菌技术灭菌,例如组合物可以无菌过滤。盐
[0270]
在一些情况下,本文提供的组合物或药物组合物包含一种或多种盐。为了控制张力,本发明提供的组合物可以包含生理盐诸如钠盐。其他盐可以包括氯化钾、磷酸二氢钾、磷酸氢二钠和/或氯化镁等。在一些情况下,组合物与一种或多种药学上可接受的盐一起配制。该一种或多种药学上可接受的盐可以包含无机离子例如钠、钾、钙、镁离子等的盐。此类盐可以包括与无机酸或有机酸的盐,该无机酸或有机酸诸如为盐酸、氢溴酸、磷酸、硝酸、硫酸、甲磺酸、对甲苯磺酸、乙酸、富马酸、琥珀酸、乳酸、扁桃酸、苹果酸、柠檬酸、酒石酸或马来酸。多核糖核苷酸可以以线性或环状形式存在。缓冲剂/ph
[0271]
本文提供的组合物或药物组合物可以包含一种或多种缓冲剂,诸如tris缓冲剂;硼酸盐缓冲剂;琥珀酸盐缓冲剂;组氨酸缓冲剂(例如,具有氢氧化铝佐剂);或柠檬酸盐缓冲剂。在一些情况下,缓冲剂以5
‑
20mm的范围包括在内。
[0272]
本文提供的组合物或药物组合物可以具有约5.0至约8.5、约6.0至约8.0、约6.5至约7.5、或约7.0至约7.8的ph。组合物或药物组合物可以具有约7的ph。多核糖核苷酸可以以线性或环状形式存在。洗涤剂/表面活性剂
[0273]
本文提供的组合物或药物组合物可以根据预期的施用途径包含一种或多种洗涤剂和/或表面活性剂,例如聚氧乙烯脱水山梨糖醇酯表面活性剂(通常称为“吐温”),例如聚山梨醇酯20和聚山梨醇酯80;以dowfax
tm
商品名出售的环氧乙烷(eo)、环氧丙烷(po)和/或环氧丁烷(bo)的共聚物,诸如线性eo/po嵌段共聚物;辛苯聚醇,其重复乙氧基(氧基
‑
l,2
‑
乙烷二基)的数目可以变化,例如辛苯聚醇
‑
9(triton x
‑
100或叔辛基苯氧基聚乙氧基乙醇);(辛基苯氧基)聚乙氧基乙醇(igepal ca
‑
630/np
‑
40);磷脂诸如磷脂酰胆碱(卵磷脂);壬基苯酚乙氧基化物,诸如tergitol
tm np系列;衍生自月桂醇、鲸蜡醇、硬脂醇和油醇的聚氧乙烯脂肪醚(称为brij表面活性剂),诸如三乙二醇单月桂基醚(brij 30);以及脱水山梨糖醇酯(通常称为“span”),诸如脱水山梨糖醇三油酸酯(span 85)和脱水山梨糖醇单月桂酸酯、辛苯聚醇(诸如辛苯聚醇
‑
9(triton x
‑
100)或叔辛基苯氧基聚乙氧基乙醇)、十六烷基三甲基溴化铵(“ctab”)或脱氧胆酸钠。该一种或多种洗涤剂和/或表面活性剂可以仅以痕量存在。在一些情况下,组合物可以包含各自少于1mg/ml的辛苯聚醇
‑
10和聚山梨醇酯80。本文可以使用非离子表面活性剂。表面活性剂可按其“hlb”(亲水/亲脂平衡)分类。在一些情况下,表面活性剂具有至少10、至少15和/或至少16的hlb。多核糖核苷酸可以以线性或环状形式存在。有效递送
[0274]
本文提供的组合物、药物组合物、方法和试剂盒可以提供用于将多核糖核苷酸递送至细胞中的容易操作且有效的解决方案。在一些情况下,将多核糖核苷酸递送至细胞中是治疗性的。在一些情况下,与没有醇的递送相比,在本文所述的醇的存在下的递送效率可以相对较高。在一些情况下,与没有细胞渗透剂的递送相比,在本文所述的细胞渗透剂的存在下的递送效率可以相对较高。在一些情况下,与没有预处理的递送相比,在使用本文所述的消毒剂(例如,醇)预处理后,递送效率可以相对较高。多核糖核苷酸可以以线性或环状形式存在。
[0275]
在一些情况下,递送效率表示为递送至细胞中的多核糖核苷酸的量与接触细胞的总多核糖核苷酸的量的比率。在一些情况下,递送效率表示为递送至细胞中的多核糖核苷酸的量与施用在细胞附近的总多核糖核苷酸的量的比率(例如,当多核糖核苷酸直接施加在皮肤区域上时递送至皮肤细胞中的量)。本文提供的方法的递送效率可以为至少约0.5%、1%、1.5%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%。在一些情况下,本文提供的方法的递送效率可以为约0.5%、1%、1.5%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
[0276]
在一些情况下,本文提供的组合物和方法的药物作用根据施用后从受试者观察到的生物效应来测量。例如,可以测量受试者或受试者的一个或多个细胞(例如,血液样品或组织活检物)中多核糖核苷酸的丰度。在其他情况下,如果组合物包含编码待在受试者中表达的蛋白的表达序列,则表达产物可以视作本文提供的组合物和方法的递送效率的指标。
[0277]
与线性多核糖核苷酸相比,本文提供的组合物和方法可以特别更有效地递送环状多核糖核苷酸。递送至细胞的环状多核糖核苷酸的量是包含线性多核糖核苷酸和细胞渗透剂的混合物接触细胞时递送的线性多核糖核苷酸的量的至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.2、2.4、2.5、2.6、2.8、3.0、3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0或10.0倍。在一些情况下,递送至细胞的环状多核糖核苷酸的量是包含线性多核糖核苷酸和细胞渗透剂的混合物接触细胞时递送的线性多核糖核苷酸的量的至少1.1倍。
[0278]
当体内施用时,取决于施用途径,多核糖核苷酸可以根据本文提供的方法递送至接近受试者表面区域的任何类型的细胞中。例如,可以通过本文提供的方法将多核糖核苷酸递送至位于皮肤下、位于腔或通道(例如口、鼻腔、咽喉、胃肠道、呼吸道或阴道)表面上的上皮细胞。上皮细胞的非限制性类型包括单层鳞状上皮、单层立方上皮、单层柱状上皮、假复层柱状上皮、复层鳞状上皮、复层立方上皮、复层柱状上皮和移行上皮。通过本文提供的方法,可以将多核糖核苷酸递送至表面区域例如皮肤下的任何类型的细胞,包括但不限于角化细胞、梅克尔细胞、黑素细胞、朗格汉斯细胞、成纤维细胞、巨噬细胞和脂肪细胞。可以通过本文提供的方法将多核糖核苷酸递送至皮肤下面的组织的任何部分,诸如表皮、基材膜、真皮和皮下组织。
[0279]
例如,多核糖核苷酸可以进入施用位置附近的血管和/或血液。例如,可以将多核糖核苷酸递送至皮肤下毛细血管壁中的上皮细胞中。在一些情况下,递送是全身性的,例如,多核糖核苷酸在血管内递送并转染进血细胞,诸如红细胞、白细胞和血小板。在这些情况下,可以将多核糖核苷酸递送至循环细胞中,这些循环细胞可以扩散到身体的任何部分中,这可以被认为是多核糖核苷酸的全身递送。
[0280]
本文提供的组合物、药物组合物、方法和试剂盒可适于多核糖核苷酸的延长递送。例如,可以将多核糖核苷酸和醇(例如乙醇)配制用于延长释放、控制释放、延迟释放或持续释放,使得可以实现特定的治疗效果或者可以将多核糖核苷酸递送至受试者的期望位置。例如,可以将多核糖核苷酸和醇配制成贴片的形式,该贴片将粘附于受试者的皮肤区域持续延长的时间段,例如至少约2小时、4小时、6小时、8小时、10小时、15小时、20小时、24小时、36小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、2周、3周、4周、5周、2个月、3个月、4个月或甚至更长。在一些情况下,贴片中的多核糖核苷酸和醇在延长的时间段内递送,例如只要贴片粘附在皮肤区域上。在其他实施例中,可以将多核糖核苷酸和细胞渗透剂配制用于延长释放、控制释放、延迟释放或持续释放,使得可以实现特定的治疗效果或可以将多核糖核苷酸递送至受试者的期望位置。例如,可以将多核糖核苷酸和细胞渗透剂配制成贴片的形式,该贴片将粘附于受试者的皮肤区域持续延长的时间段,例如至少约2小时、4小时、6小时、8小时、10小时、15小时、20小时、24小时、36小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、2周、3周、4周、5周、2个月、3个月、4个月或甚至更长。在一些情况下,贴片中的多核糖核苷酸和细胞渗透剂在延长的时间段内递送,例如只要贴片粘附在皮肤区域上。
[0281]
在一些情况下,组合物、药物组合物、方法和试剂盒提供被递送至细胞中并在延长的时间段内具有生物效应的多核糖核苷酸。例如,一些多核糖核苷酸对rna酶的敏感性很小或不敏感,或者它们在细胞内的半衰期可以非常长。因此,多核糖核苷酸可以在长时间段内存在并且可能具有活性,例如至少约24小时、36小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、2周、3周、4周、5周、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、1年、2年、3年或甚至更长。在一些情况下,多核糖核苷酸可以具有约24小时、36小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、2周、3周、4周、5周、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、1年、2年或3年的半衰期。在某些情况下,多核糖核苷酸的生物效应在细胞或受试者的生命期内延续,例如,当出于基因编辑目的在具有生命期或能够产生子代细胞(例如,干细胞或其他祖细胞)的细胞中施用多核糖核苷酸时。试剂盒和施加工具
[0282]
取决于不同的预期施用途径,本文提供的组合物可以按不同的方式包装,和/或在一些情况下,包装在不同的试剂盒中,这些试剂盒包括组合物和被配置成经由预期途径将组合物施用给受试者的一种或多种施加工具。如上所讨论,本文提供的组合物可以被配制用于通过不同的途径施用,这些途径包括直接局部施用(例如,经皮、栓剂、粘膜和阴道内)、吸入和口服摄取。在一些方面,本披露提供了用于施用包含多核糖核苷酸和细胞渗透剂的组合物的试剂盒。在一些方面,本披露提供了用于施用包含多核糖核苷酸和醇的组合物的试剂盒。在一些方面,本披露提供了用于施用包含多核糖核苷酸和乙醇的组合物的试剂盒。在一些方面,本披露提供了用于在如本文所述的预处理之后施用包含多核糖核苷酸和稀释剂而不含任何载体的组合物的试剂盒。多核糖核苷酸可以以线性或环状形式存在。
[0283]
试剂盒可被配置用于直接局部施用,例如直接施加在皮肤上。在一些情况下,试剂盒包括含有如本文所提供的组合物的基材或支架。基材或支架可以呈贴片、擦拭物、棉签(q
‑
tip)的形式,或允许将组合物直接施加至受试者的皮肤表面上的任何其他形式。基材或
支架可以由一次性材料或生物可降解材料制成。在一些情况下,基材可以是纤维层,例如使用非弹性体原材料构成的并且至少在一个方向上具有可伸长性的纤维层,例如棉花、桉树或生物纤维素。作为纤维层,可以使用纸、非织造织物、织造织物等。纤维层可以是亲水性的并具有液体保留性能。纤维层可以由使用亲水性原料获得的亲水性纤维制成,也可以由非弹性体原料或由其形成的纤维制成。在一些情况下,试剂盒包括本文提供的液体组合物和被配置成转移或分配液体组合物的转移工具。转移工具可以简单地为吸管、洗耳器或移液吸管。转移工具也可以被设计成具有附加特征,诸如刻度、致动、报警系统或自动分配系统。
[0284]
试剂盒可以被配置用于本文提供的组合物的吸入施用。在一些情况下,试剂盒包括吸入器和组合物。在一些情况下,吸入器是被配置成将液体组合物转化成气溶胶的雾化器。组合物可以以液体形式包装,或以固体形式包装,准备溶解在溶剂中用于雾化和吸入。雾化器的非限制性实例包括呼吸激活的或呼吸致动的雾化器、手持式吸入器装置、喷射雾化器、振动网式喷雾器、如国际专利申请号wo 2004/071368、美国已公开的申请号2004/0011358和2004/0035413中所述的雾化器,这些专利各自通过援引以其全文并入本文。雾化器可以具有压缩空气源。在一些情况下,雾化器通过穿过微米或亚微米尺寸的孔挤出药物制剂或通过施加超声波将液体药物转化成气溶胶。在一些情况下,吸入器是干粉雾化装置,其将固体组合物转化成气溶胶。干粉雾化装置可以是干粉吸入器,诸如主动或被动干粉吸入器。示例性干粉吸入器包括美国专利号4,069,819和4,995,385、美国专利号3,991,761、美国专利号3,991,761中所述的那些,这些专利中的每一个都通过援引以其全文并入本文。
[0285]
试剂盒可以被配置用于口服施用本文提供的组合物。用于口服施用(例如口服摄取)的组合物可以被配制成各种形式,诸如片剂(包括咀嚼片)、丸剂、糖衣丸、胶囊、锭剂、硬糖、液体、凝胶、糖浆、浆液、粉末、悬浮液、酏剂、糯米纸囊剂等。
[0286]
本文提供的试剂盒可以进一步包括含有所配制的组合物的容器,诸如瓶子、盒子、胶囊或分配器。所披露的容器也可以是施加工具。在一些情况下,提供用于分配本文所述的组合物的液体或固体配制品的分配器。例如,可以使用移液吸管将液体滴到皮肤表面或眼睛上用于眼内递送。在其他情况下,分配器可用于分配在施加前需要无菌保存的胶囊。如果需要,可以在如本文所述的容器中保持无菌性、湿度和/或温度。在一些情况下,如果需要,如上所讨论的吸入器可以是用于储存液体、固体或气溶胶形式的组合物的容器。在某些实施例中,容器和施加工具可以分开提供。
[0287]
本文提供的试剂盒可以包括第一施加工具、第二施加工具、消毒剂以及包含多核糖核苷酸和稀释剂而不含任何载体的组合物,其中该第一施加工具被配置成将消毒剂施加至受试者的表面区域,并且该第二施加工具被配置成将该组合物施加至该受试者的该表面区域。消毒剂可以是醇、碘、过氧化氢、紫外光、激光或热。在一些实施例中,该醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。第一施加工具可以是擦拭物或拭子,其中擦拭物或拭子包含消毒剂。替代性地,第一施加工具可以是施加紫外光或激光的装置,或施加热量的装置。第二施加工具可以包括移液管。在一些实施例中,第二施加工具包括基材,并且其中基材嵌入有混合物。通常,基材由天然或人造纤维制成。在一些实施例中,第二施加工具包括贴片、喷雾器或雾化器。在一些情况下,第二施加工具被配置成以受控方式释放混合物。用于施加的表面区域可以选自
由以下组成的组:皮肤,口腔、鼻腔、胃肠道和呼吸道的表面区域,及其任何组合。产生方法
[0288]
在一些情况下,本文提供的组合物或药物组合物中的多核糖核苷酸包含非天然存在的且可使用重组dna技术(下文详细描述了方法;例如,使用dna质粒体外衍生)或化学合成而产生的脱氧核糖核酸序列。多核糖核苷酸可以以线性或环状形式存在。
[0289]
在本发明的范围内,用于产生rna环的dna分子可以包括天然存在的原始核酸序列的dna序列、其修饰形式或编码通常未在自然中发现的合成多肽的dna序列(例如,嵌合分子或融合蛋白)。dna分子可以使用多种技术修饰,这些技术包括但不限于经典诱变技术和重组dna技术,诸如定点诱变、化学处理核酸分子以诱导突变、限制性酶切割核酸片段、连接核酸片段、聚合酶链式反应(pcr)扩增和/或诱变核酸序列的选定区域、合成寡核苷酸混合物以及连接混合物基团以“建造”核酸分子混合物、及其组合。
[0290]
多核糖核苷酸可以根据任何可用的技术制备,包括但不限于化学合成和酶促合成。在一些情况下,线性多核糖核苷酸可由核糖核苷酸合成或由dna构建体转录。使用本领域技术人员可获得的技术,从dna构建体的转录可以在细胞内或体外进行。
[0291]
在一些情况下,线性初级构建体或线性mrna可被环化或连环化以产生本文所述的环状多核糖核苷酸。环化或连环化的机制可以通过诸如但不限于化学、酶促、夹板连接或核酶催化的方法来发生。新形成的5'
‑
/3'
‑
键可以是分子内键或分子间键。
[0292]
制备本文所述的环状多核糖核苷酸的方法描述于例如khudyakov&fields,artificial dna:methods and applications[人工dna:方法与应用],crc出版社(2002);zhao,synthetic biology:tools and applications[合成生物学:工具和应用],(第一版),学术出版社(academic press)(2013);和egli&herdewijn,chemistry and biology of artificial nucleic acids[人工核酸的化学与生物学],(第一版),威利
‑
vch出版社(wiley
‑
vch)(2012)。
[0293]
多种合成环状多核糖核苷酸的方法也在本领域中进行了描述(参见例如,美国专利号us6210931、美国专利号us5773244、美国专利号us5766903、美国专利号us5712128、美国专利号us5426180、美国公开号us20100137407、国际公开号wo 1992001813和国际公开号wo 2010084371;其各自的内容通过援引以其全文并入本文)。
[0294]
本文引用的所有参考文献和出版物均通过援引并入本文。实施例
[0295]
在一些方面,本披露的组合物包含多核糖核苷酸和细胞渗透剂的混合物,其中该细胞渗透剂占该混合物的至少约0.3%v/v。
[0296]
在一些方面,本披露的治疗组合物包含多核糖核苷酸和细胞渗透剂,其中该细胞渗透剂被配置用于局部施用。
[0297]
在一些方面,本披露的治疗组合物包含多核糖核苷酸和细胞渗透剂,其中该多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中该有效负载对细胞具有生物效应。
[0298]
在一些方面,本披露的治疗组合物包含多核糖核苷酸和细胞渗透剂,其中该多核糖核苷酸的量有效产生对细胞或组织的生物效应,并且其中该细胞渗透剂的量有效产生对细胞或组织的生物效应。
[0299]
在一些方面,本披露的治疗组合物包含多核糖核苷酸、细胞渗透剂和局部递送赋形剂,其中该局部递送赋形剂包含稳定剂。在一些实施例中,稳定剂包含葡萄糖(4.5g/l)。
[0300]
在一些方面,本披露的栓剂或其他基于脂质的配制品包含多核糖核苷酸和细胞渗透剂。
[0301]
在一些方面,本披露的可吸入组合物包含多核糖核苷酸、细胞渗透剂和推进剂的混合物。
[0302]
在一些方面,本披露的治疗组合物包含负载有多核糖核苷酸和细胞渗透剂的生物可降解支架。
[0303]
在一些方面,将多核糖核苷酸递送至细胞或组织的方法包括使该细胞或组织接触包含该多核糖核苷酸和细胞渗透剂的混合物,其中该细胞渗透剂占该混合物的至少约0.3%v/v。
[0304]
在一些方面,将治疗组合物递送至细胞或组织的方法包括使细胞或组织与包含多核糖核苷酸和细胞渗透剂的治疗组合物接触,其中细胞渗透剂被配置用于局部施用。在一些实施例中,细胞渗透剂包含醇。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。在一些实施例中,醇包括乙醇。在一些实施例中,细胞渗透剂占混合物的至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约98%或约100%v/v。在一些实施例中,细胞渗透剂占混合物的约100%v/v。在一些实施例中,该方法进一步包括将该多核糖核苷酸与该细胞渗透剂混合。在一些实施例中,多核糖核苷酸在混合之前呈固体形式。在一些实施例中,多核糖核苷酸在混合之前被冻干。在一些实施例中,多核糖核苷酸在混合之前呈液体形式。在一些实施例中,多核糖核苷酸在混合之前溶解在溶剂中。在一些实施例中,多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中有效负载对细胞或组织具有生物效应。在一些实施例中,多核糖核苷酸的量有效产生对细胞的生物效应,并且细胞渗透剂的量有效产生对细胞或组织的生物效应。
[0305]
在一些方面,体内递送多核糖核苷酸的方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加在受试者的表面区域上。
[0306]
在一些方面,局部递送多核糖核苷酸的方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加在受试者的表面区域上。
[0307]
在一些方面,将治疗性多核糖核苷酸递送至受试者的方法包括将包含治疗性多核糖核苷酸和细胞渗透剂的混合物局部接触上皮表面、内皮表面、暴露的组织或开放性伤口。
[0308]
在一些方面,治疗方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加至患有病状或疾病的受试者的表面区域。在一些实施例中,细胞渗透剂包含醇。在一些实施例中,醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。在一些实施例中,醇包括乙醇。在一些实施例中,递送是全身性的。在一些实施例中,递送是局部的。在一些实施例中,细胞渗透剂占混合物的至少约1%、至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、
至少约70%、至少约80%、至少约90%、至少约95%、至少约98%或约100%v/v。在一些实施例中,细胞渗透剂占混合物的约10%v/v。在一些实施例中,表面区域选自由以下组成的组:皮肤,口腔、鼻腔、耳腔、胃肠道、呼吸道、阴道、子宫颈、宫内、泌尿道和眼睛的表面区域。在一些实施例中,施加包括将混合物液滴直接沉积到表面区域上。在一些实施例中,施加包括用嵌入有混合物的贴片、凝胶或膜擦拭表面区域。在一些实施例中,施加包括将混合物喷雾到表面区域上。在一些实施例中,施加包括经由气雾化将混合物施用给受试者。在一些实施例中,施加包括经由栓剂将混合物施用给受试者。在一些实施例中,施加包括经由口服摄取含有混合物的胶囊而将混合物施用给受试者,并且其中胶囊被配置成在受试者的胃肠道内释放混合物。在一些实施例中,细胞包括上皮细胞。在一些实施例中,细胞包括血细胞。在一些实施例中,多核糖核苷酸包括线性多核糖核苷酸。在一些实施例中,多核糖核苷酸包括环状多核糖核苷酸。在一些实施例中,环状多核糖核苷酸具有的翻译效率高于线性对应物至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少150%、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍或至少100倍。在一些实施例中,环状多核糖核苷酸具有的翻译效率是线性物的至少5倍。在一些实施例中,多核糖核苷酸具有短期生物效应。在一些实施例中,多核糖核苷酸是线性多核糖核苷酸。在一些实施例中,多核糖核苷酸具有长期生物效应。在一些实施例中,多核糖核苷酸是环状多核糖核苷酸。在一些实施例中,混合物中多核糖核苷酸的浓度为至少约50ng/ml、至少约100ng/ml、至少约500ng/ml、至少约1μg/ml、至少约2μg/ml、至少约3μg/ml、至少约4μg/ml、至少约5μg/ml、至少约10μg/ml、至少约20μg/ml、至少约50μg/ml、至少约100μg/ml、至少约200μg/ml、至少约500μg/ml、至少约1mg/ml、至少约2mg/ml、至少约5mg/ml、至少约10mg/ml、至少约20mg/ml、至少约50mg/ml、或至少约100mg/ml。
[0309]
在一些方面,本披露的试剂盒包括施加工具以及含有多核糖核苷酸和细胞渗透剂的混合物,其中施加工具被配置成将混合物施加至受试者的表面区域。在一些实施例中,施加工具包括移液管。在一些实施例中,施加工具包括基材,并且其中基材嵌入有混合物。在一些实施例中,基材由天然或人造纤维制成。在一些实施例中,试剂盒包括栓剂。在一些实施例中,施加工具包括贴片。在一些实施例中,施加工具包括喷雾器。在一些实施例中,施加工具包括雾化器。在一些实施例中,施加工具包括被配置成在受试者的胃肠道内释放混合物的胶囊。在一些实施例中,施加工具被配置成以受控方式释放混合物。在一些实施例中,表面区域选自由以下组成的组:皮肤,口腔、鼻腔、胃肠道和呼吸道的表面区域,及其任何组合。编号的实施例[1]一种药物组合物,该药物组合物包含多核糖核苷酸和乙醇的混合物,其中该乙醇占该混合物的至少约0.3%v/v至约75%v/v。[2]如段落[1]所述的药物组合物,其中该乙醇占该混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。
[3]如段落[1]所述的药物组合物,其中该乙醇占该混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。[4]一种药物组合物,该药物组合物包含多核糖核苷酸和醇的混合物,其中该醇占该混合物的至少约0.3%v/v至约75%v/v。[5]如段落[4]所述的药物组合物,其中该醇占该混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。[6]如段落[4]所述的药物组合物,其中该醇占该混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。[7]如段落[4]
‑
[6]中任一段所述的药物组合物,其中该醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。[8]一种药物组合物,该药物组合物包含多核糖核苷酸和细胞渗透剂的混合物,其中该细胞渗透剂占该混合物的至少约0.3%v/v至约75%v/v。[9]如段落[8]所述的药物组合物,其中该细胞渗透剂占该混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。[10]如段落[8]所述的药物组合物,其中该细胞渗透剂占该混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。[11]如段落[8]
‑
[10]中任一段所述的药物组合物,其中该细胞渗透剂是醇。[12]如段落[11]所述的药物组合物,其中该醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。[13]如段落[1]
‑
[12]中任一段所述的药物组合物,其中该多核糖核苷酸编码蛋白。[14]如段落[13]所述的药物组合物,其中该蛋白是治疗性蛋白。
[15]如段落[13]或[14]所述的药物组合物,其中该蛋白是伤口愈合蛋白。[16]如段落[15]所述的药物组合物,其中该伤口愈合蛋白是生长因子。[17]如段落[16]所述的药物组合物,其中该生长因子是egf、pdgf、tgfβ或vegf。[18]如段落[1]
‑
[17]中任一段所述的药物组合物,其中该药物组合物是液体、凝胶、润肤露、糊剂、乳膏、泡沫或棒。[19]如段落[1]
‑
[18]中任一段所述的药物组合物,其中该多核糖核苷酸是线性多核糖核苷酸。[20]如段落[1]
‑
[19]中任一段所述的药物组合物,其中该多核糖核苷酸是mrna。[21]如段落[1]
‑
[20]中任一段所述的药物组合物,其中该多核糖核苷酸缺乏帽或聚a尾。[22]如段落[1]
‑
[18]中任一段所述的药物组合物,其中该多核糖核苷酸是环状多核糖核苷酸。[23]如段落[1]
‑
[22]中任一段所述的药物组合物,其中该多核糖核苷酸包含经修饰的核糖核苷酸。[24]如段落[1]
‑
[23]中任一段所述的药物组合物,其中该药物组合物具有约7的ph。[25]如段落[1]
‑
[24]中任一段所述的药物组合物,其中该药物组合物具有与水大致相同的粘度。[26]如段落[1]
‑
[25]中任一段所述的药物组合物,其中该药物组合物基本上不含疏水性或亲脂性基团。[27]如段落[1]
‑
[26]中任一段所述的药物组合物,其中该药物组合物基本上不含烃。[28]如段落[1]
‑
[27]中任一段所述的药物组合物,其中该药物组合物基本上不含阳离子脂质体。[29]如段落[1]
‑
[28]中任一段所述的药物组合物,其中该药物组合物基本上不含脂肪酸、脂质、脂质体、胆固醇或其任何组合。[30]如段落[4]
‑
[29]中任一段所述的药物组合物,其中该细胞渗透剂可溶于极性溶剂。[31]如段落[4]
‑
[30]中任一段所述的药物组合物,其中该细胞渗透剂不溶于极性溶剂。[32]一种治疗组合物,该治疗组合物包含多核糖核苷酸和醇,其中该醇被配置用于局部施用。[33]一种治疗组合物,该治疗组合物包含多核糖核苷酸和醇,其中该多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中该有效负载对细胞具有生物效应。[34]一种治疗组合物,该治疗组合物包含多核糖核苷酸和醇,其中该多核糖核苷酸的量有效产生对细胞或组织的生物效应,并且其中该醇的量有效产生对细胞或组织的生物效应。[35]一种治疗组合物,该治疗组合物包含多核糖核苷酸、醇和局部递送赋形剂,其中该局部递送赋形剂包含稳定剂。
[36]一种栓剂或其他基于脂质的配制品,该配制品包含多核糖核苷酸和醇。[37]一种可吸入组合物,该可吸入组合物包含多核糖核苷酸、醇和推进剂的混合物。[38]一种治疗组合物,该治疗组合物包含负载有多核糖核苷酸和醇的生物可降解支架。[39]一种治疗组合物,该治疗组合物包含多核糖核苷酸和细胞渗透剂,其中该细胞渗透剂被配置用于局部施用。[40]一种治疗组合物,该治疗组合物包含多核糖核苷酸和细胞渗透剂,其中该多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中该有效负载对细胞具有生物效应。[41]一种治疗组合物,该治疗组合物包含多核糖核苷酸和细胞渗透剂,其中该多核糖核苷酸的量有效产生对细胞或组织的生物效应,并且其中该醇的量有效产生对细胞或组织的生物效应。[42]一种治疗组合物,该治疗组合物包含多核糖核苷酸、细胞渗透剂和局部递送赋形剂,其中该局部递送赋形剂包含稳定剂。[43]一种栓剂或其他基于脂质的配制品,该配制品包含多核糖核苷酸和细胞渗透剂。[44]一种可吸入组合物,该可吸入组合物包含多核糖核苷酸、细胞渗透剂和推进剂的混合物。[45]一种治疗组合物,该治疗组合物包含负载有多核糖核苷酸和细胞渗透剂的生物可降解支架。[46]如段落[35]或段落[42]所述的治疗组合物,其中该稳定剂包含葡萄糖(4.5g/l)。[47]如段落[39]
‑
[38]中任一段所述的治疗组合物、栓剂、其他脂质基配制品或可吸入组合物,其中该细胞渗透剂包含醇。[48]如段落[32]
‑
[38]或[47]中任一段所述的治疗组合物、栓剂、其他脂质基配制品或可吸入组合物,其中该醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。[49]如段落[48]所述的治疗组合物、栓剂、其他脂质基配制品或可吸入组合物,其中该醇是乙醇。[50]一种将多核糖核苷酸递送至受试者的方法,该方法包括a)将消毒剂施加至该受试者的表面区域;b)将包含该多核糖核苷酸和稀释剂而不含任何载体的组合物施加至该表面区域。[51]如段落[50]所述的方法,其中该消毒剂是醇、紫外光、激光或热。[52]一种将多核糖核苷酸递送至受试者的方法,该方法包括a)将醇施加至该受试者的表面区域;b)将包含该多核糖核苷酸和稀释剂而不含任何载体的组合物施加至该表面。[53]一种将多核糖核苷酸递送至上皮细胞的方法,该方法包括将包含稀释剂和未
修饰的多核糖核苷酸而不含任何载体的组合物施加至该上皮细胞。[54]一种将多核糖核苷酸递送至受试者的方法,该方法包括将包含多核糖核苷酸和乙醇的混合物的组合物局部施加至该受试者的表面区域,其中该乙醇占该混合物的至少约0.3%v/v至约75%v/v。[55]一种将多核糖核苷酸递送至受试者的方法,该方法包括将包含多核糖核苷酸和醇的混合物的组合物局部施加至该受试者的表面区域,其中该醇占该混合物的至少约0.3%v/v至约75%v/v。[56]一种将多核糖核苷酸递送至受试者的方法,该方法包括将包含多核糖核苷酸和细胞渗透剂的混合物的组合物局部施加至该受试者的表面区域,其中该细胞渗透剂占该混合物的至少约0.3%v/v至约75%v/v。[57]如段落[53]
‑
[56]中任一段所述的方法,其中该组合物将该多核糖核苷酸递送至该受试者的真皮或表皮组织。[58]如段落[58]所述的方法,其中该组合物在不使用离子导入法的情况下将该多核糖核苷酸递送至该受试者的真皮或表皮组织。[59]一种将多核糖核苷酸递送至细胞或组织的方法,该方法包括使该细胞或组织与包含该多核糖核苷酸和醇的混合物接触,其中该细胞渗透剂或醇占该混合物的至少约0.3%v/v至约75%v/v。[60]一种将治疗组合物递送至细胞或组织的方法,该方法包括使该细胞或组织与包含多核糖核苷酸和醇的治疗组合物接触,其中该细胞渗透剂或醇被配置用于局部施用。[61]一种体内递送多核糖核苷酸的方法,该方法包括将包含该多核糖核苷酸和醇的混合物施加在受试者的表面区域上。[62]一种将多核糖核苷酸递送至受试者的方法,该方法包括将包含该多核糖核苷酸和醇的混合物施加在受试者的表面区域上。[63]一种将治疗性多核糖核苷酸递送至受试者的方法,该方法包括将包含该治疗性多核糖核苷酸和醇的混合物局部接触上皮表面、内皮表面、暴露的组织或开放性伤口。[64]一种治疗方法,该方法包括将包含多核糖核苷酸和醇的混合物施加至患有病状或疾病的受试者的表面区域。[65]一种将多核糖核苷酸递送至细胞或组织的方法,该方法包括使该细胞或组织与包含该多核糖核苷酸和细胞渗透剂的混合物接触,其中该细胞渗透剂或醇占该混合物的至少约0.3%v/v至约75%v/v。[66]一种将治疗组合物递送至细胞或组织的方法,该方法包括使该细胞或组织与包含多核糖核苷酸和细胞渗透剂的治疗组合物接触,其中该细胞渗透剂或醇被配置用于局部施用。[67]一种体内递送多核糖核苷酸的方法,该方法包括将包含该多核糖核苷酸和细胞渗透剂的混合物施加在受试者的表面区域上。[68]一种将多核糖核苷酸递送至受试者的方法,该方法包括将包含该多核糖核苷酸和细胞渗透剂的混合物施加在受试者的表面区域上。[69]一种将治疗性多核糖核苷酸递送至受试者的方法,该方法包括将包含该治疗性多核糖核苷酸和细胞渗透剂的混合物局部接触上皮表面、内皮表面、暴露的组织或开放
性伤口。[70]一种治疗方法,该方法包括将包含多核糖核苷酸和细胞渗透剂的混合物施加至患有病状或疾病的受试者的表面区域。[71]一种治疗伤口的方法,该方法包括使该伤口或该伤口周围的组织与包含多核糖核苷酸和乙醇的混合物的组合物接触,其中该乙醇占该混合物的至少约0.3%v/v至约75%v/v。[72]一种治疗伤口的方法,该方法包括使该伤口或该伤口周围的组织与包含多核糖核苷酸和乙醇的混合物的组合物接触,其中该醇占该混合物的至少约0.3%v/v至约75%v/v。[73]一种治疗伤口的方法,该方法包括使该伤口或该伤口周围的组织与包含多核糖核苷酸和乙醇的混合物的组合物接触,其中该细胞渗透剂占该混合物的至少约0.3%v/v至约75%v/v。[74]如段落[65]
‑
[70]或[73]中任一段所述的方法,其中该细胞渗透剂包含醇。[75]如段落[51]
‑
[65]或[74]中任一段所述的方法,其中该醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。[76]如段落[51]
‑
[65]、[74]或[75]所述的方法,其中该醇包括乙醇。[77]如段落[59]
‑
[76]中任一段所述的方法,其中该乙醇、醇或细胞渗透剂占该混合物的至少约0.3%v/v至约70%v/v、至少约0.3%v/v至约60%v/v、至少约0.3%v/v至约50%v/v、至少约0.3%v/v至约40%v/v、至少约30%v/v至约20%v/v、至少约0.3%v/v至约15%v/v、至少约0.3%v/v至约10%v/v、至少约0.3%v/v至约5%v/v、至少约0.3%v/v至约1%v/v、或至少约0.3%v/v至约0.5%v/v。[78]如段落[59]
‑
[76]中任一段所述的方法,其中该乙醇、醇或细胞渗透剂为该混合物的至少约0.5%v/v至约75%v/v、至少约1%v/v至约75%v/v、至少约5%v/v至约75%v/v、至少约10%v/v至约75%v/v、至少约15%v/v至约75%v/v、至少约20%v/v至约75%v/v、至少约30%v/v至约75%v/v、至少约40%v/v至约75%v/v、至少约50%v/v至约75%v/v、至少约60%v/v至约75%v/v、或至少约70%v/v至约75%v/v。[79]如段落[65]
‑
[78]中任一段所述的方法,进一步包括将该多核糖核苷酸与该细胞渗透剂混合。[80]如段落[59]
‑
[64]或[71]
‑
[78]中任一段所述的方法,进一步包括将该多核糖核苷酸与该醇混合。[81]如段落[79]或[80]所述的方法,其中该多核糖核苷酸在混合之前呈固体形式。[82]如段落78所述的方法,其中该多核糖核苷酸在混合之前被冻干。[83]如段落[79]或[80]所述的方法,其中该多核糖核苷酸在混合之前呈液体形式。[84]如段落[79]或[80]所述的方法,其中该多核糖核苷酸在混合之前溶解在溶剂中。
[85]如段落[50]
‑
[84]中任一段所述的方法,其中该多核糖核苷酸包含有效负载或编码有效负载的序列,并且其中该有效负载对细胞或组织具有生物效应。[86]如段落[50]
‑
[85]中任一段所述的方法,其中该多核糖核苷酸的量有效产生对细胞的生物效应,并且该细胞渗透剂的量有效产生对细胞或组织的生物效应。[87]如段落[50]
‑
[86]中任一段所述的方法,其中该多核糖核苷酸编码蛋白。[88]如段落[87]所述的方法,其中该蛋白是治疗性蛋白。[89]如段落[87]或[88]所述的方法,其中该蛋白是伤口愈合蛋白。[90]如段落[89]所述的方法,其中该伤口愈合蛋白是生长因子。[91]如段落[90]所述的方法,其中该生长因子是egf、pdgf、tgfβ或vegf。[92]如段落[50]
‑
[91]中任一段所述的方法,其中该组合物是液体、凝胶、润肤露、糊剂、乳膏、泡沫或棒。[93]如段落[50]
‑
[92]中任一段所述的方法,其中该多核糖核苷酸是线性多核糖核苷酸。[94]如段落[50]
‑
[93]中任一段所述的方法,其中该多核糖核苷酸是mrna。[95]如段落[50]
‑
[94]中任一段所述的方法,其中该多核糖核苷酸缺乏帽或聚a尾。[96]如段落[50]
‑
[92]中任一段所述的方法,其中该多核糖核苷酸是环状多核糖核苷酸。[97]如段落[50]
‑
[96]中任一段所述的方法,其中该多核糖核苷酸包含经修饰的核糖核苷酸。[98]如段落[50]
‑
[97]中任一段所述的方法,其中该组合物具有约7的ph。[99]如段落[50]
‑
[98]中任一段所述的方法,其中该组合物具有与水大致相同的粘度。[100]如段落[50]
‑
[99]中任一段所述的方法,其中该组合物基本上不含疏水性或亲脂性基团。[101]如段落[50]
‑
[100]中任一段所述的方法,其中该组合物基本上不含烃。[102]如段落[50]
‑
[101]中任一段所述的方法,其中该组合物基本上不含阳离子脂质体。[103]如段落[50]
‑
[102]中任一段所述的方法,其中该组合物基本上不含脂肪酸、脂质、脂质体、胆固醇或其任何组合。[104]如段落[59]
‑
[103]中任一段所述的方法,其中该细胞渗透剂可溶于极性溶剂。[105]如段落[59]
‑
87中任一段所述的方法,其中该细胞渗透剂不溶于极性溶剂。[106]如段落[50]
‑
[105]中任一段所述的方法,其中该组合物进一步包含药学上可接受的赋形剂。[107]如段落[50]
‑
[106]中任一段所述的方法,其中该递送是全身性的。[108]如段落[50]
‑
[106]中任一段所述的方法,其中该递送是局部的。[109]如段落[50]
‑
[108]中任一段所述的方法,其中该表面区域选自由以下组成的组:皮肤,口腔、鼻腔、耳腔、胃肠道、呼吸道、阴道、子宫颈、宫内、泌尿道和眼睛的表面区
域。[110]如段落[50]
‑
[58]、[61]、[62]或[71]
‑
[109]中任一段所述的方法,其中施加包括将该混合物的液滴直接沉积到该表面区域上。[111]如段落[50]
‑
[58]、[61]、[62]或[71]
‑
[109]中任一段所述的方法,其中施加包括用嵌入有该混合物的贴片、凝胶或膜擦拭该表面区域。[112]如段落[50]
‑
[58]、[61]、[62]或[71]
‑
[109]中任一段所述的方法,其中施加包括将该混合物喷雾到该表面区域上。[113]如段落[50]
‑
[58]、[61]、[62]或[71]
‑
[109]中任一段所述的方法,其中施加包括经由气雾化将该混合物施用给该受试者。[114]如段落[50]
‑
[58]、[61]、[62]或[71]
‑
[109]中任一段所述的方法,其中施加包括经由栓剂将该混合物施用给该受试者。[115]如段落[50]
‑
[58]、[61]、[62]或[71]
‑
[109]中任一段所述的方法,其中施加包括经由口服摄取含有混合物的胶囊而将该混合物施用给该受试者,并且其中该胶囊被配置成在该受试者的胃肠道内释放该混合物。[116]如段落[59]、[60]、[65]、[66]或[71]
‑
[115]中任一段所述的方法,其中该细胞包括上皮细胞。[117]如段落[96]至[116]中任一段所述的方法,其中该环状多核糖核苷酸具有的翻译效率高于线性对应物至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少150%、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍或至少100倍。[118]如段落[96]至[117]中任一段所述的方法,其中该环状多核糖核苷酸具有的翻译效率是线性对应物的至少5倍。[119]如段落[50]
‑
[118]中任一段所述的方法,其中该多核糖核苷酸具有短期生物效应。[120]如段落[50]
‑
[119]中任一段所述的方法,其中该多核糖核苷酸具有长期生物效应。[121]如段落[50]
‑
[120]中任一段所述的方法,其中该混合物中该多核糖核苷酸的浓度为至少约50ng/ml、至少约100ng/ml、至少约500ng/ml、至少约1μg/ml、至少约2μg/ml、至少约3μg/ml、至少约4μg/ml、至少约5μg/ml、至少约10μg/ml、至少约20μg/ml、至少约50μg/ml、至少约100μg/ml、至少约200μg/ml、至少约500μg/ml、至少约1mg/ml、至少约2mg/ml、至少约5mg/ml、至少约10mg/ml、至少约20mg/ml、至少约50mg/ml、或至少约100mg/ml。[122]一种试剂盒,该试剂盒包括施加工具和如段落[1]
‑
[31]中任一段所述的药物组合物,其中该施加工具被配置成将该药物组合物施加至受试者的表面区域。[123]一种试剂盒,该试剂盒包括第一施加工具、第二施加工具、消毒剂以及包含多核糖核苷酸和稀释剂而不含任何载体的组合物,其中该第一施加工具被配置成将消毒剂施加至受试者的表面区域,并且该第二施加工具被配置成将该组合物施加至该受试者的该表面区域。[124]如段落[123]所述的试剂盒,其中该消毒剂是醇、紫外光、激光或热。
[125]如段落[124]所述的试剂盒,其中该醇选自由以下组成的组:甲醇、乙醇、异丙醇、丁醇、戊醇、鲸蜡醇、乙二醇、丙二醇、变性醇、苯甲醇,特别是变性醇、二醇、硬脂醇、鲸蜡硬脂醇、薄荷醇、聚乙二醇(peg)
‑
400、乙氧基化脂肪酸和羟乙基纤维素。[126]如段落[123]
‑
[125]中任一段所述的试剂盒,其中该第一施加工具是擦拭物。[127]如段落[126]所述的试剂盒,其中该擦拭物包含消毒剂。[128]如段落[123]或[124]所述的试剂盒,其中该第一施加工具是施加紫外光或激光的装置。[129]如段落[123]或[124]所述的试剂盒,其中该第一施加工具是施加热量的装置。[130]一种试剂盒,该试剂盒包括施加工具以及包含多核糖核苷酸和细胞渗透剂的混合物,其中该施加工具被配置成将该混合物施加至受试者的表面区域。[131]如段落[122]
‑
[130]中任一段所述的试剂盒,其中该施加工具或第二施加工具包括移液管。[132]如段落[122]
‑
[130]中任一段所述的试剂盒,其中该施加工具或第二施加工具包括基材,并且其中该基材嵌入有该混合物。[133]如段落[132]所述的试剂盒,其中该基材由天然或人造纤维制成。[134]如段落[132]所述的试剂盒,其中该试剂盒包括栓剂。[135]如段落[122]
‑
[134]中任一段所述的试剂盒,其中该施加工具或第二施加工具包括贴片。[136]如段落[122]
‑
[134]中任一段所述的试剂盒,其中该施加工具或第二施加工具包括喷雾器。[137]如段落[122]
‑
[134]中任一段所述的试剂盒,其中该施加工具或第二施加工具包括雾化器。[138]如段落[122]
‑
[134]中任一段所述的试剂盒,其中该施加工具或第二施加工具包括被配置成在该受试者的胃肠道内释放该混合物的胶囊。[139]如段落[122]
‑
[138]中任一段所述的试剂盒,其中该施加工具或第二施加工具被配置成以受控方式释放该混合物。[140]如段落[122]
‑
[139]中任一段所述的试剂盒,其中该表面区域选自由以下组成的组:皮肤,口腔、鼻腔、胃肠道和呼吸道的表面区域,及其任何组合。[141]一种治疗伤口的方法,该方法包括使该伤口或该伤口周围的组织与如段落[1]
‑
[31]中任一段所述的组合物接触。实例
[0310]
提供以下实例以进一步说明本发明的一些实施例,但无意于限制本发明的范围;通过它们的示例性性质将理解,可以替换地使用本领域技术人员已知的其他程序、方法或技术。实例1:用于局部递送的rna配制品
[0311]
本实例证明用于局部递送的rna配制品。
[0312]
为了确定rna的局部作用,配制rna用于递送至上皮组织。
[0313]
如本文所述,根据以下方案用细胞渗透剂配制rna:10ng包含egf orf的线性或环状rna5μl 80%的乙醇35μl pbs+葡萄糖(4.5g/l)实例2:线性rna的局部递送
[0314]
本实例证明rna的局部递送。
[0315]
为了确定局部递送效果,配制rna并递送至上皮组织。如本文所述,将用细胞渗透剂配制的线性rna局部递送至耳朵组织。
[0316]
如实例1配制线性rna样品(50μl)并施加至小鼠的耳朵。在将样品施加至耳朵之前,用异丙醇擦拭物擦拭耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0317]
在选择的时间点(施加后6小时、1天、3天或12天),针对每个rna样品收集耳朵组织(通过单次耳朵打孔)并储存在组织储存试剂(例如,渗透组织以稳定和保护未冷冻样品中的细胞rna)中。实例3:局部递送环状rna
[0318]
本实例证明rna的局部递送。
[0319]
为了确定局部递送效果,配制rna并递送至上皮组织。如本文所述,将rna与细胞渗透剂一起配制并局部递送至耳朵组织。
[0320]
如实例1配制环状rna样品(50μl)并施加至小鼠的两只耳朵。在将样品施加至耳朵之前,用异丙醇擦拭物擦拭耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥耳朵上的样品。在正常条件下将小鼠放回笼中。
[0321]
在选择的时间点(施加后6小时、1天、3天或12天),收集每个rna样品的耳朵组织(通过单次耳朵打孔)。实例4:局部递送后rna的持久性
[0322]
本实例证明在局部递送后rna的存在。
[0323]
为了测定rna持久性,分析组织样品中的所递送的rna。如本文所述,分析耳朵打孔样品在rna局部递送后不同时间点的持久性。
[0324]
在rna稳定试剂中收集来自实例3的耳朵打孔样品和未处理的耳朵打孔样品,并使用标准rna组织提取试剂盒(maxwell rsc simply rna)提取rna。
[0325]
向每个样品中添加200μl体积的1
‑
硫代甘油/均化溶液。通过每毫升均化溶液添加20μl 1
‑
硫代甘油来制备工作溶液。替代性地,将600μl 1
‑
硫代甘油添加到30ml均化溶液瓶中。在使用之前,将1
‑
硫代甘油/均化溶液在冰上或在2
‑
10℃下冷却。
[0326]
用手持匀浆器和无菌杵将组织样品在200μl经冷却的1
‑
硫代甘油/均化溶液中均化,直到没有可见的组织碎片残留。每个样品再均化15
‑
30秒以完全均化。
[0327]
为了检查在不同时间点rna的存在,经由q
‑
pcr检查样品的rna。使用qpcr测量耳朵打孔样品中线性和环状rna的存在。为了检测扩增的线性和环状rna引物,使用了nluc orf。(f:agatttcgttggggactggc(seq id no:7),r:caccgctcaggacaatcctt(seq id no:8))。为了仅检测环状rna,扩增5'
‑3’
接合部的引物允许检测环状而非线性rna构建体(f:ctggagacgtggaggagaac(seq id no:9),r:ccaaaagacggcaatatggt(seq id no:10))。
[0328]
在局部递送后6小时、24小时和72小时检测线性和环状rna。在注射后3天,在小鼠耳朵中检测到比线性rna更高水平的环状rna(图1)。
[0329]
如本实例所示,局部施用的线性和环状rna可在体内检测到。实例5:局部递送后mrna的蛋白表达
[0330]
本实例描述了局部递送后蛋白的存在。
[0331]
为了确定局部递送的rna是否可以被翻译,通过蛋白印迹分析组织样品在不同时间点的蛋白表达。在局部递送rna后,分析耳朵打孔样品的蛋白表达。
[0332]
简言之,收集耳朵打孔样品并储存在rna稳定试剂(英杰公司(invitrogen))中。用微量管匀浆器(飞世尔科技公司(fisher scientific))在ripa缓冲液中均化组织并提取蛋白。每个样品以14k x g离心15分钟。
[0333]
去除上清液,将沉淀物在70℃下溶于2
×
sds样品缓冲液(0.125m tris
‑
hcl,ph 6.8,4%sds,30%甘油,5%2
‑
巯基乙醇,0.01%溴酚蓝)中持续15分钟。
[0334]
使用市售标准品(伯乐公司(biorad))作为尺寸标记物。使用半干法电转移到聚偏二氟乙烯(pvdf)膜(密理博公司(millipore))之后,使用化学发光试剂盒(安诺伦公司(rockland))可视化印迹。
[0335]
预期gfp蛋白在耳朵打孔样品中显现,并在环状rna和线性rna中检测到。实例6:当rna溶液中包含乙醇时,rna的局部施用导致将rna递送至组织。
[0336]
本实例证明当rna溶液中包含乙醇时,经由体内局部施用将rna递送至细胞和组织的能力。
[0337]
在本实例中,用emcv ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0338]
环状rna在体外生成。从dna模板体外转录未修饰的线性rna。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。然后将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司(thermofisher scientific),目录号am7000)中。在本实例中,环状rna也经hplc纯化。
[0339]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计线性mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,线性rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0340]
然后将rna在pbs/葡萄糖(4.5g/l)和乙醇(10%v/v)中稀释,使得每个样品的总样品体积为50μl,并且每个样品的总rna为3.5pmol。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0341]
在时间=0时,使用移液管尖端将50μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。作为阴性对照,使用未处理的小鼠。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0342]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后6小时、1天、3天和12天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。使用trizol提取从耳朵打孔样品
分离总rna。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。从总rna合成cdna,使用nluc orf特异性引物在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与肌动蛋白和未处理的阴性对照相对化。
[0343]
在局部施用后6小时和1天、3天和12天,在组织样品中检测到环状rna和线性rna,并且显示出比仅媒介物对照更大的信号(图2a和图2b)。
[0344]
本实例证明当用乙醇递送时,环状rna和线性rna经由局部施用成功地递送至组织,并在组织中持续延长的时间段。实例7:当用transit配制时,rna的局部施用导致将rna递送至组织。
[0345]
本实例证明当将transit用于配制rna溶液时,经由体内局部施用将rna递送至细胞和组织的能力。
[0346]
在本实例中,用emcv ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0347]
环状rna在体外生成。从dna模板体外转录未修饰的线性rna。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。然后将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。在本实例中,环状rna也经hplc纯化。
[0348]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计线性mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,线性rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0349]
将rna在pbs/葡萄糖(4.5g/l)中稀释,得到在10μl溶液中的3.5pmol。然后将该rna溶液添加到transit(米卢斯生物有限责任公司,mir5700)(10μl)、增进剂(米卢斯生物有限责任公司,mir5700)(5μl)和pbs/葡萄糖(4.5g/l)(25μl)中。每个样品的总样品体积为50μl,每个样品的总rna为3.5pmol。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0350]
在时间=0时,使用移液管尖端将50μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。作为阴性对照,使用未处理的小鼠。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0351]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后6小时、1天、3天和12天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。使用trizol提取从耳朵打孔样品分离总rna。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。从总rna合成cdna,使用nluc orf特异性引物在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与肌动蛋白和未处理的阴性对照相对化。
[0352]
在局部施用后6小时、1天、3天和12天,在组织样品中检测到环状rna和线性rna,并且显示出比仅媒介物对照更大的信号(图3a和图3b)。
[0353]
本实例证明当用transit递送时,环状rna和线性rna经由局部施用成功地递送至组织,并在组织中持续延长的时间段。
实例8:用二甲亚砜(dmso)凝胶配制的经修饰的线性rna的体内局部施用
[0354]
本实例证明当用dmso凝胶配制时,通过局部施用在体内递送线性rna的能力。
[0355]
对于本实例,rna包括编码高斯荧光素酶(gaussia luciferase,gluc)的orf。
[0356]
在本实例中,经修饰的线性rna由三联生物技术公司(trilink biotechnologies)定制合成,并包括上面列出的所有基序。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用cleancap
tm ag加帽并被聚腺苷酸化(120a)。dmso医用凝胶(medi gel)(21世纪化学公司(21
st century chemical inc.))可商购获得。
[0357]
将rna在rna储存溶液中稀释至1pmol/μl的浓度。将5pmol的rna与19μl dmso医用凝胶(21世纪化学公司)和1μl rnasin plus rna酶抑制剂(普洛麦格公司(promega))组合,每次施加总共25μl。不含rna的配制品用作对照。
[0358]
在时间=0时,使用移液管尖端将25μl剂量的各样品局部施加至小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0359]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的rna表达。在递送后24和48小时从小鼠获取耳朵打孔样品。将组织样品置于冰上的1x荧光素酶细胞裂解缓冲液(赛默科技公司(thermo scientific))中30分钟,然后冷冻。
[0360]
使用高斯荧光素酶活性测定法(赛默科技皮尔斯公司(thermo scientific pierce))测试高斯荧光素酶的活性。将样品解冻并短暂离心以除去任何组织碎片。将20μl缓冲溶液添加到96孔板(corning 3990)中。简言之,将1x腔肠素(coelenterazine)底物添加到每个孔中。添加底物并在光度计仪器(普洛麦格公司)中混合后立即读板。
[0361]
在局部施加后24和48小时在组织样品中检测到高斯荧光素酶活性,并且观察到高于仅媒介物对照(图4)。
[0362]
本实例证明当用dmso医用凝胶(21世纪化学公司)配制时,线性rna经由局部施用成功递送,并且能够长时间表达可在组织中检测到的功能性蛋白。实例9:用基于乳膏的软膏配制的经修饰的线性rna的体内局部施用
[0363]
本实例证明当用基于乳膏的软膏(强生婴儿润肤露)配制时,通过局部施用在体内递送线性rna的能力。
[0364]
对于本实例,rna包括编码高斯荧光素酶(gluc)的orf。
[0365]
在本实例中,经修饰的线性rna由三联生物技术公司(trilink biotechnologies)定制合成,并包括上面列出的所有基序。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用cleancap
tm ag加帽并被聚腺苷酸化(120a)。婴儿润肤露(强生公司)可商购获得。
[0366]
将rna稀释至1pmol/μl的浓度。将5pmol的rna与19μl强生婴儿润肤露(无香料;强生公司)和1μl rnasin plus rna酶抑制剂(普洛麦格)组合,每次施加总共25μl。不含rna的配制品用作对照。
[0367]
在时间=0时,使用移液管尖端将25μl剂量的各样品局部施加至小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0368]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的rna表达。在递送后24和48小时从小鼠获取耳朵打孔样品。将组织样品置于冰上的1x荧光素酶细
胞裂解缓冲液(赛默科技公司(thermo scientific))中30分钟,然后冷冻。
[0369]
使用高斯荧光素酶活性测定法(赛默科技皮尔斯公司(thermo scientific pierce))测试高斯荧光素酶的活性。将样品解冻并短暂离心以除去任何组织碎片。将20μl缓冲溶液添加到96孔板(corning 3990)中。简言之,将1x腔肠素(coelenterazine)底物添加到每个孔中。添加底物并在光度计仪器(普洛麦格公司)中混合后立即读板。
[0370]
在局部施加后24和48小时在组织样品中检测到高斯荧光素酶活性,并且观察到高于仅媒介物对照(图5)。
[0371]
本实例证明当用基于乳膏的软膏配制时,线性rna经由局部施用成功递送,并且能够长时间表达可在组织中检测到的功能性蛋白。实例10:使用乙醇体内局部施用经修饰的线性rna
[0372]
本实例证明使用乙醇通过局部施用在体内递送线性rna的能力。
[0373]
对于本实例,rna包括编码高斯荧光素酶(gluc)的orf。
[0374]
在本实例中,经修饰的线性rna由三联生物技术公司(trilink biotechnologies)定制合成,并包括上面列出的所有基序。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用cleancap
tm ag加帽并被聚腺苷酸化(120a)。乙醇(西格玛奥德里奇公司(sigma aldrich))可商购获得。
[0375]
用rna储存溶液将rna稀释至1pmol/μl的浓度。将5pmol的rna与19μl乙醇和1μl rnasin plus rna酶抑制剂(普洛麦格)组合,每次施加总共25μl。类似地制备仅媒介物对照,但不含rna。
[0376]
在时间=0时,使用移液管尖端将25μl剂量的各样品局部施加至小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0377]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的rna表达。在递送后24和48小时从小鼠获取耳朵打孔样品。将组织样品置于冰上的1x荧光素酶细胞裂解缓冲液(赛默科技公司(thermo scientific))中30分钟,然后冷冻。
[0378]
使用高斯荧光素酶活性测定法(赛默科技皮尔斯公司(thermo scientific pierce))测试高斯荧光素酶的活性。将样品解冻并短暂离心以除去任何组织碎片。将20μl缓冲溶液添加到96孔板(corning 3990)中。简言之,将1x腔肠素(coelenterazine)底物添加到每个孔中。添加底物并在光度计仪器(普洛麦格公司)中混合后立即读板。
[0379]
在局部施加后24和48小时在组织样品中检测到高斯荧光素酶活性,并且观察到高于仅媒介物对照(图6)。
[0380]
本实例证明当采用乙醇时,线性rna经由局部施用成功递送,并且能够长时间表达可在组织中检测到的功能性蛋白。实例11:局部施用环状rna导致将rna递送至组织
[0381]
本实例证明经由体内局部施用将环状rna递送至细胞和组织的能力。
[0382]
在本实例中,用编码促红细胞生成素蛋白(epo)的orf设计环状rna。
[0383]
环状rna在体外生成。线性rna在体外从包括上面列出的所有基序的dna模板以及驱动转录的t7 rna聚合酶启动子转录。在本实例中,将cy5
‑
utp用于生成cy5标记的rna。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用
rna5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0384]
将环状rna在具有5%乙醇的pbs/葡萄糖(4.5g/l)中稀释,使得每个样品的总样品体积为25μl,并且每个样品的总rna为12皮摩尔。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0385]
在时间=0时,用异丙醇擦拭物擦拭小鼠的耳朵,干燥并使用移液管尖端将25μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0386]
为了确定环状rna向组织的递送,在施用后的不同时间点通过荧光显微镜分析组织样品。在施用后6小时、1天和3天,从每只动物取2mm的耳朵打孔样品并储存在冰冷的pbs中。然后在evos ii荧光显微镜下观察组织样品。然后使用imagej量化图像的荧光。
[0387]
在局部施用后6小时、1天和3天,在组织样品中检测到cy5信号,并显示出比未显示任何荧光的阴性对照更大的信号(图7和图8)。这表明环状rna被成功递送至组织。
[0388]
本实例证明环状rna经由局部施用成功地递送,并在组织中持续延长的时间段。实例12:mrna的局部施用导致将rna递送至组织
[0389]
本实例证明经由体内局部施用将mrna递送至细胞和组织的能力。
[0390]
在本实例中,用编码绿色荧光蛋白(egfp)的orf设计mrna。在本实例中,经修饰的线性mrna由三联生物技术公司定制合成,并包括上面列出的所有基序。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。mrna包括在3'端共价结合的cy5荧光团标记。
[0391]
将mrna在具有5%乙醇的pbs/葡萄糖(4.5g/l)中稀释,使得每个样品的总样品体积为25μl,并且每个样品的总rna为12皮摩尔。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0392]
在时间=0时,用异丙醇擦拭物擦拭小鼠的耳朵,干燥并使用移液管尖端将25μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0393]
为了确定rna向组织的递送,在施用后的不同时间点通过荧光显微镜分析组织样品。在施用后6小时、1天和3天,从每只动物取2mm的耳朵打孔样品并储存在冰冷的pbs中。然后在evos ii荧光显微镜下观察组织样品。然后使用imagej量化图像的荧光。
[0394]
在局部施用后6小时、1天和3天,在组织样品中检测到cy5信号,并显示出比未显示任何荧光的阴性对照更大的信号(图9和图10)。这表明mrna被成功递送至组织。
[0395]
本实例证明mrna经由局部施用成功地递送,并在组织中持续延长的时间段。实例13:向鼻粘膜上皮局部施用未修饰的rna导致rna在组织中的长期存在。
[0396]
本实例描述经由局部施用将未修饰的rna递送至鼻粘膜上皮并经由局部施用实现线性和环状rna摄取的能力。
[0397]
对于本实例,rna中包括ires、编码纳米荧光素酶(nluc)的orf和位于ires
‑
orf侧翼的两个间隔元件。
[0398]
环状rna在体外生成。未修饰的线性rna在体外从包括上面列出的所有基序的dna模板以及驱动转录的t7 rna聚合酶启动子转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rnaa储存溶液(赛默飞世尔科技公司,目录号am7000)中。生成线性rna对应物,其包括上述相同的nluc orf和编码组件。
[0399]
将rna稀释至1pmol/μl的浓度。将柠檬酸盐缓冲液中的5pmol rna与无菌pbs合并。每次施加所用的总样品体积为20μl。类似地制备仅媒介物对照样品,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0400]
在灭菌通风橱中,将小鼠通过其耳朵置于悬挂位置。在时间=0时,使用微量移液管将20μl剂量的各样品逐渐释放到balb/c小鼠的鼻孔中(每个鼻孔10μl)。在施加过程中将嘴和另一鼻孔闭上以确保摄取。将小鼠保持在悬挂位置另外几分钟,直到呼吸速率恢复正常。在正常条件下将小鼠放回笼中。
[0401]
在施用后6、24和48小时,处死小鼠并从小鼠获取鼻组织。将每个组织样品(~2mg)置于200μl冷却的1
‑
硫代甘油/均化溶液中,并使用手持式匀浆器和无菌杵均化直至没有可见的组织碎片残留。每个样品再均化15
‑
30秒以完全均化。
[0402]
为了确定rna在组织中的持久性,在递送后的不同时间点使用qpcr分析组织样品的rna。将qpcr用于测量提取组织中的线性和环状rna。使用扩增nluc orf的引物(f:agatttcgttggggactggc(seq id no:7),r:caccgctcaggacaatcctt(seq id no:8))。为了仅检测环状rna,扩增5'
‑
3'接合部的引物允许检测环状而非线性rna构建体(f:ctggagacgtggaggagaac(seq id no:9),r:ccaaaagacggcaatatggt(seq id no:10))。
[0403]
预期在局部施用线性和环状rna后6、24和48小时将在鼻组织样品中检测到线性和环状rna,并且将显示比仅媒介物对照更大的表达。
[0404]
本实例描述rna经由局部施用成功递送至鼻粘膜上皮,并在组织中持续延长的时间段。实例14:当在施加前用乙醇擦拭物擦拭组织时,mrna的局部施用导致将rna递送至组织。
[0405]
本实例证明经由体内局部施用将mrna递送至细胞和组织的能力。
[0406]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0407]
然后将rna用仅pbs或用pbs和10%(v/v)乙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0408]
在时间=0时,用浸在70%乙醇中的棉拭子擦拭小鼠的耳朵,干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭
菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0409]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(itaq
tm universal green supermix)(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0410]
在局部施用后,对于仅pbs中的mrna在第1天以及对于pbs+10%etoh中的mrna在第1天和第4天在组织样品中检测到mrna,并且显示出比阴性对照更大的信号(图11)。
[0411]
本实例证明当在施用前用乙醇擦拭物擦拭皮肤时,mrna经由局部施用成功递送,并在组织中持续延长的时间段。实例15:当在施加前用异丙醇擦拭物擦拭组织时,mrna的局部施用导致将rna递送至组织。
[0412]
本实例证明经由体内局部施用将mrna递送至细胞和组织的能力。
[0413]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0414]
然后将rna用仅pbs稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0415]
在时间=0时,用商业异丙醇擦拭物(cvs,297584)擦拭小鼠的耳朵,干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0416]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0417]
在局部施用后1天和4天时在组织样品中检测到mrna,并且显示出比阴性对照更大的信号(图12)。
[0418]
本实例证明当在施用前用异丙醇擦拭物擦拭皮肤时,mrna经由局部施用成功递送,并在组织中持续延长的时间段。实例16:当在施加前用乙醇擦拭物擦拭组织时,环状rna的局部施用导致将rna递送至组织。
[0419]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织的能力。
[0420]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0421]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0422]
然后将rna用仅pbs或用pbs+10%(v/v)乙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0423]
在时间=0时,用乙醇擦拭物擦拭小鼠的耳朵,干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0424]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0425]
在用乙醇擦拭物擦拭皮肤再局部施用后,对于仅pbs中的环状mrna在第1天和第4天以及对于pbs+10%etoh中的mrna在第1天在组织样品中检测到环状rna,并且显示出比相关的仅媒介物对照更大的信号(图13)。
[0426]
本实例证明当在施用前用乙醇擦拭物擦拭皮肤时,环状rna经由局部施用成功递送,并在组织中持续延长的时间段。实例17:局部施用环状rna导致将rna递送至组织
[0427]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织的能力。
[0428]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0429]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以
及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0430]
然后将rna用pbs+10%(v/v)乙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0431]
在时间=0时,使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0432]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
radcfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0433]
在局部施用后1天和4天时在组织样品中检测到环状rna,并且显示出比相关的阴性对照更大的信号(图14)。
[0434]
本实例证明环状rna经由局部施用至皮肤而成功地递送至组织,并在组织中持续延长的时间段。实例18:局部施用环状rna导致将rna递送至组织
[0435]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织的能力。
[0436]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0437]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0438]
然后将rna用pbs+10%(v/v)异丙醇稀释,使得每个样品的总样品体积为35μl,并
且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0439]
在时间=0时,使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0440]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
radcfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0441]
在局部施用后1天和4天时在组织样品中检测到环状rna,并且显示出比相关的阴性对照更大的信号(图15)。
[0442]
本实例证明环状(endless)rna经由局部施用至皮肤而成功地递送至组织,并在组织中持续延长的时间段。实例19:当在施加前用异丙醇擦拭物擦拭组织时,环状rna的局部施用导致将rna递送至组织。
[0443]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织的能力。
[0444]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0445]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0446]
然后将rna用仅pbs稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0447]
在时间=0时,用异丙醇擦拭物(cvs,297584)擦拭小鼠的耳朵,干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。作为阴性对照,使用仅异丙醇擦拭。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0448]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样
品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0449]
在局部施用后1天和4天时在组织样品中检测到环状rna,并且显示出比仅媒介物对照更大的信号(图16)。
[0450]
本实例证明在用异丙醇擦拭物擦拭皮肤后,环状rna经由局部施用成功地递送至组织,并在组织中持续延长的时间段。实例20:线性mrna的局部施用导致将rna递送至组织
[0451]
本实例证明经由体内局部施用将mrna递送至细胞和组织的能力。
[0452]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0453]
将rna用(1)仅pbs、(2)pbs+10%(v/v)乙醇、(3)pbs+10%(v/v)异丙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0454]
在时间=0时,使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0455]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0456]
在局部施用后,对于仅pbs中的mrna在第1天以及对于pbs+10%etoh中的mrna和pbs+10%iproh中的mrna在第1天和第4天在组织样品中检测到mrna,并且显示出比相关阴性对照更大的信号(图17)。
[0457]
本实例证明mrna经由局部施用至皮肤而成功地递送至组织,并在组织中持续延长
的时间段。实例21:当在施加前用乙醇擦拭物擦拭组织时,局部施用环状rna导致组织中的蛋白表达。
[0458]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织并实现随后的蛋白表达的能力。
[0459]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0460]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0461]
然后将rna用仅pbs稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。类似地制备仅媒介物对照样品,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0462]
在时间=0时,用乙醇擦拭物擦拭小鼠的耳朵,干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0463]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的nluc活性。在递送后4天时从小鼠获取耳朵打孔样品。将每个组织样品压碎成碎片并置于具有1x蛋白酶抑制剂混合物(protease inhibitor cocktail)的50μl冰冷nluc裂解测定缓冲液(lysis assay buffer)中并置于冰上。然后将样品在定轨振荡器上以700rpm温育5分钟,然后在室温下离心以除去组织碎片。然后将50μl上清液转移到新试管中而不扰动组织沉淀物。将50μl各样品转移到96孔板中,并根据制造商的说明进行nano
‑
glo荧光素酶测定系统(普洛麦格公司,#n1110)测定。简言之,向各孔中添加1μl furimazine底物和49μl pbs并混合。添加底物并混合后,将板温育10分钟,然后在光度计仪器(普洛麦格公司)中读数。
[0464]
对于仅pbs中的环状rna,在局部施用后4天,在组织样品中检测到纳米荧光素酶活性,并且观察到高于相关的仅媒介物对照(图18)。
[0465]
本实例证明环状rna经由局部施用成功递送,并且能够长时间表达可在组织中检测到的功能性蛋白。实例22:局部施用环状rna导致组织中的蛋白表达
[0466]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织并实现随后的蛋白表达的能力。
[0467]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0468]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰
生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0469]
然后将rna用pbs+10%(v/v)乙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0470]
在时间=0时,使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0471]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的nluc活性。在递送后4天时从小鼠获取耳朵打孔样品。将每个组织样品压碎成碎片并置于具有1x蛋白酶抑制剂混合物(protease inhibitor cocktail)的50μl冰冷nluc裂解测定缓冲液(lysis assay buffer)中并置于冰上。然后将样品在定轨振荡器上以700rpm温育5分钟,然后在室温下离心以除去组织碎片。然后将50μl上清液转移到新试管中而不扰动组织沉淀物。将50μl各样品转移到96孔板中,并根据制造商的说明进行nano
‑
glo荧光素酶测定系统(普洛麦格公司,#n1110)测定。简言之,向各孔中添加1μl furimazine底物和49μl pbs并混合。添加底物并混合后,将板温育10分钟,然后在光度计仪器(普洛麦格公司)中读数。
[0472]
对于pbs+10%乙醇(v/v)中的环状rna,在局部施用后4天,在组织样品中检测到纳米荧光素酶活性,并且观察到高于相关的仅媒介物对照(图19)。
[0473]
本实例证明环状rna经由局部施用成功递送,并且能够长时间表达可在组织中检测到的功能性蛋白。实例23:局部施用环状rna导致组织中的蛋白表达
[0474]
本实例证明经由体内局部施用将未修饰的环状rna递送至细胞和组织并实现随后的蛋白表达的能力。
[0475]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0476]
环状rna在体外生成。未修饰的线性rna从包括上面列出的所有基序的dna模板以及用于驱动转录的t7 rna聚合酶启动子体外转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。将使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0477]
然后将rna用pbs+10%(v/v)异丙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0478]
在时间=0时,使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小
鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0479]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的nluc活性。在递送后4天时从小鼠获取耳朵打孔样品。将每个组织样品压碎成碎片并置于具有1x蛋白酶抑制剂混合物(protease inhibitor cocktail)的50μl冰冷nluc裂解测定缓冲液(lysis assay buffer)中并置于冰上。然后将样品在定轨振荡器上以700rpm温育5分钟,然后在室温下离心以除去组织碎片。然后将50μl上清液转移到新试管中而不扰动组织沉淀物。将50μl各样品转移到96孔板中,并根据制造商的说明进行nano
‑
glo荧光素酶测定系统(普洛麦格公司,#n1110)测定。简言之,向各孔中添加1μl furimazine底物和49μl pbs并混合。添加底物并混合后,将板温育10分钟,然后在光度计仪器(普洛麦格公司)中读数。
[0480]
对于pbs+10%异丙醇中的环状rna,在局部施用后4天,在组织样品中检测到纳米荧光素酶活性,并且观察到高于相关的仅媒介物对照(图20)。
[0481]
本实例证明环状rna经由局部施用成功递送,并且能够长时间表达可在组织中检测到的功能性蛋白。实例24:线性mrna的局部施用导致将rna递送至组织和随后的蛋白表达。
[0482]
本实例证明经由体内局部施用将mrna递送至细胞和组织并实现随后的蛋白表达的能力。
[0483]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0484]
将rna用pbs+10%(v/v)乙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0485]
在时间=0时,用乙醇擦拭物擦拭小鼠的耳朵,干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0486]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的nluc活性。在递送后4天时从小鼠获取耳朵打孔样品。将每个组织样品压碎成碎片并置于具有1x蛋白酶抑制剂混合物(protease inhibitor cocktail)的50μl冰冷nluc裂解测定缓冲液(lysis assay buffer)中并置于冰上。然后将样品在定轨振荡器上以700rpm温育5分钟,然后在室温下离心以除去组织碎片。然后将50μl上清液转移到新试管中而不扰动组织沉淀物。将50μl各样品转移到96孔板中,并根据制造商的说明进行nano
‑
glo荧光素酶测定系统(普洛麦格公司,#n1110)测定。简言之,向各孔中添加1μl furimazine底物和49μl pbs并混合。添加底物并混合后,将板温育10分钟,然后在光度计仪器(普洛麦格公司)中读数。
[0487]
对于pbs+10%乙醇中的环状rna,在局部施用后4天,在组织样品中检测到纳米荧光素酶活性,并且在每种情况下均观察到高于相关的仅媒介物对照(图21)。
[0488]
本实例证明当在施用前用乙醇擦拭物擦拭皮肤时,mrna经由局部施用至皮肤而成功地递送至组织,并在组织中持续延长的时间段,并且能够表达功能性蛋白。实例25:线性mrna的局部施用导致将rna递送至组织和随后的蛋白表达。
[0489]
本实例证明经由体内局部施用将mrna递送至细胞和组织并实现随后的蛋白表达的能力。
[0490]
在本实例中,用编码纳米荧光素酶(nluc)的orf设计mrna。在本实例中,通过体外转录在公司内部制备经修饰的线性mrna。在本实例中,rna用假尿苷和5
‑
甲基
‑
c完全取代,用包括5'和3'人α
‑
珠蛋白utr的cleancap
tm ag加帽,并被聚腺苷酸化。
[0491]
将rna用(1)仅pbs或(2)pbs+10%(v/v)异丙醇稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0492]
在时间=0时,使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0493]
为了测定组织中的rna表达,在局部递送后的不同时间点分析组织样品的nluc活性。在递送后4天时从小鼠获取耳朵打孔样品。将每个组织样品压碎成碎片并置于具有1x蛋白酶抑制剂混合物(protease inhibitor cocktail)的50μl冰冷nluc裂解测定缓冲液(lysis assay buffer)中并置于冰上。然后将样品在定轨振荡器上以700rpm温育5分钟,然后在室温下离心以除去组织碎片。然后将50μl上清液转移到新试管中而不扰动组织沉淀物。将50μl各样品转移到96孔板中,并根据制造商的说明进行nano
‑
glo荧光素酶测定系统(普洛麦格公司,#n1110)测定。简言之,向各孔中添加1μl furimazine底物和49μl pbs并混合。添加底物并混合后,将板温育10分钟,然后在光度计仪器(普洛麦格公司)中读数。
[0494]
对于仅pbs中的线性mrna以及pbs+10%异丙醇中的线性mrna,在局部施用后4天,在组织样品中检测到纳米荧光素酶活性,并且在每种情况下均观察到高于相关的仅媒介物对照(图22和图23)。
[0495]
本实例证明mrna经由局部施用至皮肤而成功地递送至组织,并在组织中持续延长的时间段,并且能够表达功能性蛋白。实例26:当在施加前用聚维酮碘擦拭组织时,环状rna的局部施用导致将rna递送至组织。
[0496]
本实例描述经由体内局部施用将未修饰的环状rna递送至细胞和组织的能力。
[0497]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0498]
环状rna在体外生成。未修饰的线性rna在体外从包括上面列出的所有基序的dna模板以及驱动转录的t7 rna聚合酶启动子转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0499]
然后将rna用仅pbs稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0500]
在时间=0时,用作为消毒剂的商业聚维酮碘(10%)擦拭小鼠的耳朵。用无菌棉拭子除去过量的聚维酮碘,并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0501]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
radcfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0502]
预计在局部施用后1天和4天时在组织样品中检测到环状rna,并且观察到比仅媒介物对照更大的信号。
[0503]
本实例描述在用聚维酮碘(10%)擦拭皮肤后,环状rna经由局部施用成功递送至组织,并在组织中持续延长的时间段。实例27:当在施加前用过氧化氢喷雾喷洒组织时,局部施用环状rna导致将rna递送至组织。
[0504]
本实例描述经由体内局部施用将未修饰的环状rna递送至细胞和组织的能力。
[0505]
在本实例中,用ires和编码纳米荧光素酶(nluc)的orf设计环状rna。
[0506]
环状rna在体外生成。未修饰的线性rna在体外从包括上面列出的所有基序的dna模板以及驱动转录的t7 rna聚合酶启动子转录。转录的rna用rna纯化试剂盒(新英格兰生物学实验室公司,t2050)纯化,按照制造商的说明用rna 5’磷酸水解酶(rpph)(新英格兰生物学实验室公司,m0356)处理,并再次用rna纯化柱纯化。将使用夹板dna(5
’‑
tttttcggctattcccaatagccgttttg
‑3’
(seq id no:11))和t4 rna连接酶2(新英格兰生物学实验室公司,m0239)环化经rpph处理的线性rna。将环状rna进行尿素
‑
page纯化,在缓冲液(0.5m乙酸钠、0.1%sds、1mm edta)中洗脱,经乙醇沉淀并重悬于rna储存溶液(赛默飞世尔科技公司,目录号am7000)中。
[0507]
然后将rna用仅pbs稀释,使得每个样品的总样品体积为35μl,并且每个样品的总rna为20皮摩尔。作为阴性对照,如上所述制备仅媒介物对照,但不含rna。所有试剂在混合前达到室温,并且在使用之前立即制备混合物。
[0508]
在时间=0时,用作为消毒剂的市售过氧化氢(3%)喷洒小鼠的耳朵,用无菌棉拭子干燥并使用移液管尖端将35μl剂量的各样品局部地逐滴施加至balb/c小鼠的耳朵。通过将耳朵短暂地暴露于灭菌通风橱中的热灯和风扇来干燥样品。在正常条件下将小鼠放回笼中。
[0509]
为了确定rna在组织中的持久性,在递送后的不同时间点使用rt
‑
qpcr分析组织样品的rna。在施用后1天和4天,从每只动物取2mm的耳朵打孔样品并储存在rnalater溶液(赛
默飞世尔科技公司,目录号am7020)中。通过以下方式从耳朵打孔样品分离总rna:在液氮中快速冷却并用玻璃研钵和杵均化,然后进行trizol提取(赛默飞世尔科技公司目录号15596026)。将水相用异丙醇沉淀,并根据制造商的说明用70%etoh洗涤沉淀物。使用superscript iv(赛默科技公司,目录号11766500)从总rna合成cdna。使用itaq
tm
通用绿色超混合液(伯乐公司(bio
‑
rad),目录号1725124)和对nluc orf具有特异性的引物(f:ccgtatgaaggtctgagcgg(seq id no:12),r:cagtgtgccatagtgcagga(seq id no:13))在cdna模板上进行rt
‑
pcr。在bio
‑
rad cfx384热循环仪上一式三份地测定所有样品。然后将rna水平与管家基因(28s)相对化。
[0510]
预计在局部施用后1天和4天时在组织样品中检测到环状rna,并且观察到比仅媒介物对照更大的信号。
[0511]
本实例描述在用过氧化氢(3%)喷洒皮肤后,环状rna经由局部施用成功递送至组织,并在组织中持续延长的时间段。
[0512]
虽然已经在本文示出和描述了本发明的优选实施例,但是对本领域技术人员将是显而易见的是,仅通过举例的方式来提供这样的实施例。在不脱离本发明的情况下,本领域技术人员现在将清楚许多变型、改变和替代。应当理解,在实践本发明时可以采用本文描述的本发明的实施例的各种替代方案。所附权利要求旨在限定本发明的范围,并且由此覆盖这些权利要求及其等同物的范围内的方法和结构。序列纳米荧光素酶dna模板seq id no:1emcv iresseq id no:2
高斯荧光素酶dna模板seq id no:3no:3epo dna模板seq id no:4cvb3 ires dna模板seq id no:5
绿色荧光蛋白dna模板seq id no:6
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1