人类甲状旁腺激素(PTH)的制剂及用于生产其的方法与流程
人类甲状旁腺激素(pth)的制剂及用于生产其的方法
1.序列表
2.本技术包含以“纸质副本”(pdf文件)和以计算机可读形式在此提交的包含参考序列(seq id no:1-seq id no:2)的文件(st25格式文本文件)形式的序列表。序列表使用如37c.f.r.1.822中定义的氨基酸的标准三字母代码示出。
3.发明背景
4.甲状旁腺激素(pth),又称甲状旁腺素(parathormone)或甲状旁腺素(parathyrin),是由甲状旁腺腺体分泌的通过其对骨、肾和肠的作用调节血清钙的激素。pth影响骨重塑,骨重塑是其中骨组织随着时间的推移交替地吸收和重建的持续过程。pth响应于低血液血清钙水平而分泌。pth间接刺激骨基质中破骨细胞的活性,以将更多的离子钙释放到血液中,从而使低血清钙水平升高。产生太少或太多pth的病症(disorders),诸如甲状旁腺功能减退症、甲状旁腺功能亢进症和副肿瘤综合征,可以引起骨病、低钙血症和高钙血症。
5.pth是包含84个氨基酸的多肽,是激素原。它具有约9500da的分子量。在具有pth的某些形式的人类中的研究已经显示对骨的合成代谢作用,并且促进了在其用于治疗骨质疏松和相关骨病症方面的显著兴趣。使用牛和人类激素的n末端34个氨基酸,已经在人类中显示了甲状旁腺激素增强骨生长,特别地在以搏动方式通过皮下途径施用时。特立帕肽(pth1-34)在美国被批准用于治疗处于骨折高风险的那些人中的骨质疏松,包括绝经后女性、患有原发性或性腺机能减退性骨质疏松的男性以及具有糖皮质激素相关的骨质疏松的男性和女性。pth的一种略微不同的形式人类pth(1-38)已经显示了类似的结果(cusano ne等人,j clin endocrinol metab.,98:137-144,2013)。
6.遗憾地,像许多小分子治疗剂,pth易被蛋白酶降解,并且因降解而不稳定。事实上,pth比传统的小分子更不稳定。pth对主要在n末端氨基酸处的脱酰胺、剪切(clips)、聚集和氧化高度敏感,例如,位置8和18中的甲硫氨酸残基产生氧化的pth物类(species)。此外,pth可以在位置16中的天冬酰胺残基处脱酰胺。由于肽键的断裂,多肽链在n末端和c末端处存在截短的概率。所有这些反应都可以显著阻碍该蛋白的生物活性。
7.用于防止这些不良反应的改进的pth的制剂是非常需要的。
8.通过引用并入
9.在本说明书中提到的所有出版物和专利申请通过引用并入本文,其通过引用并入本文的程度与每个单独出版物或专利申请被具体地和单独地指明通过引用并入的程度相同。
10.发明概述
11.本发明的目的是提供一种药学上有用的pth制剂,该pth制剂呈稳定的液体溶液的形式,包含治疗有效量的甲状旁腺激素(pth)。溶液是储存稳定的,并且呈无菌形式,可以储存在小瓶或筒(cartridge)中,能即用于(ready for)人类患者中的胃肠外施用。
12.在各种实施方案中,稳定的液体制剂包含处于约100μg/ml-2000μg/ml浓度的人类甲状旁腺激素(hupth);维持3至7的溶液ph范围的乙酸盐或柠檬酸盐缓冲液;选自由糖、盐、
表面活性剂、蛋白、离液剂、脂质和氨基酸组成的组的稳定剂;水;以及任选地胃肠外可接受的防腐剂;并且其中所述溶液是无菌的,并且能即用于胃肠外施用至人类患者。
13.在一种实施方案中,稳定的液体制剂包含hupth(1mg/ml)、10mm柠檬酸钠、50mm l-met、10mm edta、100mm nacl、0.01%聚山梨醇酯20,ph 5.0。
14.附图简述
15.图1描绘了将标准参考hupth样品(上图)与已经经历强制氧化的hupth样品(下图)比较的sec-hplc色谱图。
16.图2描绘了将标准参考hupth样品(上图)与已经经历强制氧化的hupth样品(下图)比较的rp-hplc色谱图。
17.图3描绘了将标准参考hupth样品(上图)与已经经历强制氧化的hupth样品(下图)比较的cex-hplc色谱图。
18.图4描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的sec-hplc色谱图。
19.图5描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的rp-hplc色谱图。
20.图6描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的cex-hplc色谱图。
21.图7描绘了在4℃比较各种hupth制剂的sec-hplc色谱图。
22.图8描绘了在4℃比较各种hupth制剂的rp-hplc色谱图。
23.图9描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的rp-hplc色谱图。
24.图10描绘了在4℃比较各种hupth制剂的rp-hplc色谱图。
25.图11描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的sec-hplc色谱图。
26.图12描绘了在4℃比较各种hupth制剂的sec-hplc色谱图。
27.图13描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的cex-hplc色谱图。
28.图14描绘了在4℃比较各种hupth制剂的cex-hplc色谱图。
29.图15描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的rp-hplc色谱图。
30.图16描绘了在4℃比较各种hupth制剂的rp-hplc色谱图。
31.图17描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的sec-hplc色谱图。
32.图18描绘了在4℃比较各种hupth制剂的sec-hplc色谱图。
33.图19描绘了在25℃(上图)和37℃(下图)比较各种hupth制剂的cex-hplc色谱图。
34.图20描绘了在4℃比较各种hupth制剂的cex-hplc色谱图。
35.图21描绘了评价吐温20对比吐温80在37℃对hupth制剂的影响的rp-hplc色谱图。
36.图22是描绘了吐温20对比吐温80在37℃在5天之后对hupth制剂的影响的柱状图。
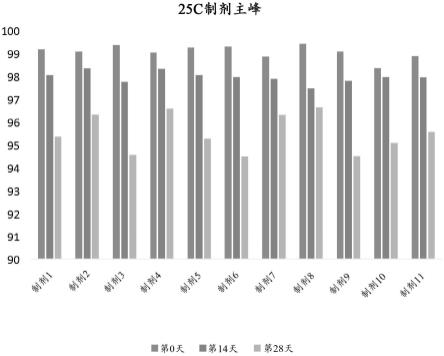
37.图23-图25是描绘了各种制剂在4℃、25℃和37℃在一周之后的稳定性的柱状图。
38.图26-图28是描绘了各种hupth制剂在4℃、25℃和37℃的rp-hplc评价的柱状图。
39.图29-图31是描绘了各种hupth制剂在4℃、25℃和37℃的cex-hplc评价的柱状图。
40.图32-图34是描绘了各种hupth制剂在4℃、25℃和37℃的sec-hplc评价的柱状图。
41.图35-图37是描绘了各种hupth制剂在4℃、25℃和37℃的rp-hplc评价的柱状图。
42.图38-图40是描绘了各种hupth制剂在4℃、25℃和37℃的cex-hplc评价的柱状图。
43.图41-图43是描绘了各种hupth制剂在4℃、25℃和37℃的sec-hplc评价的柱状图。
44.详述
45.所有的数值指示,例如,ph、温度、时间、浓度和分子量,包括范围,都是以0.1增量
变化(+)或(-)的近似值。应理解的是,尽管并非总是明确地陈述,所有数字指示之前都有术语“约”。术语“约”除了“x”的微小增量诸如“x+0.1”或“x-0.1”之外,还包括精确值“x”。还将理解的是,尽管不总是明确地陈述,本文描述的试剂仅是示例性的,并且这样的等同物是本领域已知的。
46.如本文使用的,某些术语具有以下定义的含义。
47.如本文使用的,术语“包含”意图意指制剂或方法包含所陈述的要素,但不排除其他要素。在用于定义制剂和方法时,“主要由...组成”应意指排除用于预期目的时对组合具有任何主要意义的其他要素。因此,主要由如本文定义的要素组成的组合物不会排除来自分离和纯化方法的痕量污染物和药学上可接受的载体,诸如磷酸缓冲盐水、防腐剂等。“由...组成”应意指排除多于其他成分和用于施用本发明的制剂的实质方法步骤的痕量要素。由这些过渡术语中的每一个术语所定义的实施方案在本发明的范围内。
48.如本文使用的,术语“水性药物制剂”或“液体药物制剂”是指治疗有效量的活性成分在水中的适于向患者施用的制剂。
49.在各种实施方案中,药物制剂的活性成分是选自由包含以下的组的有生物活性的hpth:hpth(1-34)、hpth(1-37)、hpth(1-38)、hpth(1-41)和hpth(1-84)。在各种实施方案中,液体制剂可以包含甲状旁腺激素的全长84个氨基酸形式,特别地通过重组、通过肽合成或通过从人类流体提取获得(参见,例如美国专利第5,208,041号,通过引用并入本文)的人类形式hpth(1-84)(seq id no:1),
[0050][0051]
在各种实施方案中,pth片段包含至少前34个n末端残基,诸如pth(1-37)、pth(1-38)、pth(1-41)和pth(1-34)(seq id no:2),
[0052][0053]
呈pth变体的形式的替代物包含改善pth稳定性和半衰期的1个至5个氨基酸取代,诸如改善pth抗氧化的稳定性的用亮氨酸或其他疏水氨基酸对位置8和/或18处的甲硫氨酸残基的替代,以及改善pth抗蛋白酶的稳定性的用胰蛋白酶不敏感的氨基酸诸如组氨酸或其他氨基酸对25-27区域中的氨基酸的替代。pth的这些形式包括在如本文通常使用的术语“甲状旁腺激素”中。激素可以通过已知的重组或合成方法获得,诸如通过引用并入本文的美国专利第4,086,196号中描述的。
[0054]
在各种实施方案中,药物制剂通常包含约0.01mg/ml至约5mg/ml的pth、约0.1mg/ml至约2.5mg/ml的pth或约0.5mg/ml至约1mg/ml的pth。在各种实施方案中,药物制剂包含约0.25mg/ml的pth、约0.5mg/ml的pth、约1mg/ml的pth或约2mg/ml的pth。在各种实施方案中,药物制剂包含0.1mg/ml至1mg/ml的pth。在一种实施方案中,制剂包含1mg/ml的pth。
[0055]
药物制剂通常被适当地配制用于立即使用。在各种实施方案中,在药物制剂不是被立即施用时,pth可以以适于储存的制剂配制。一种这样的制剂是pth连同适合的稳定剂一起的冻干制剂。可选地,pth可以被配制用于与一种或更多种适合的稳定剂一起储存在溶液中。可以使用本领域技术人员已知的任何此类稳定剂,且不限于此。在各种实施方案中,适于冻干制剂的稳定剂包括,但不限于,糖、盐、表面活性剂、蛋白、离液剂、脂质和氨基酸。在各种实施方案中,适于液体制剂的稳定剂包括,但不限于,糖、盐、表面活性剂、蛋白、离液
剂、脂质和氨基酸。
[0056]
如本文使用的,术语“缓冲液”或“缓冲液溶液”是指通常包含酸(通常弱酸,例如乙酸,柠檬酸,组氨酸的咪唑鎓形式)及其共轭碱(例如乙酸盐或柠檬酸盐,例如,乙酸钠、柠檬酸钠或组氨酸)的混合物或可选地碱(通常弱碱,例如组氨酸)及其共轭酸(例如质子化组氨酸盐)的混合物的水性溶液。由于由“缓冲剂”所给予的“缓冲作用”,“缓冲溶溶液”的ph在添加少量强酸或强碱时仅会非常略微地改变。措辞“缓冲液体系”意指包含至少两种缓冲液的混合物。在本发明的各种实施方案中,掺入到药物制剂中的缓冲剂包括是药学上可接受的并且能够将水性溶液维持在3至7的ph范围的任何酸或盐组合。在各种实施方案中,缓冲液维持约3.0至约7.0的ph。在各种实施方案中,缓冲液维持约3.0的ph、约4.0的ph、约5.0的ph、约6.0的ph或约7.0的ph。
[0057]
能够将制剂的ph维持在任何ph或在上文提供的任何ph范围内的任何缓冲液都适于用于本公开内容的药物制剂中,条件是它不与制剂的其他组分反应,不引起明显沉淀形成,或不以其他方式引起活性成分变得化学不稳定。适合的缓冲液的实例在文献中是熟知的(参见,例如,allen jr,loyd v,编著(2012)remington:the science and practice of pharmacy,第22版,pharmaceutical press)。在各种实施方案中,用于药物制剂的缓冲液包含选自由以下组成的组的组分:琥珀酸盐、柠檬酸盐、苹果酸盐、依地酸盐(edentate)、组氨酸、乙酸盐、己二酸盐、乌头酸盐、抗坏血酸盐、苯甲酸盐、碳酸盐、碳酸氢盐、马来酸盐、谷氨酸盐、乳酸盐、磷酸盐和酒石酸盐或这些缓冲剂的混合物。
[0058]
选择缓冲液的浓度以使得得以提供ph稳定化以及足够的缓冲能力。在各种实施方案中,缓冲液体系是乙酸盐或柠檬酸盐来源。在各种实施方案中,缓冲液系统是柠檬酸盐来源。在各种实施方案中,缓冲液以约5mm、以约10mm、以约15mm或以约20mm存在。在其他实施方案中,缓冲液以0.5mm至100mm、0.75mm至50mm、1mm至20mm或10mm至20mm的浓度存在于制剂中。在一种实施方案中,缓冲液以约10mm存在。在一种实施方案中,缓冲液是以约10mm存在的柠檬酸盐。
[0059]
在本发明的各种实施方案中,药物制剂中掺入的稳定剂选自由以下组成的组:糖、盐、表面活性剂、蛋白、离液剂、脂质和氨基酸。在各种实施方案中,稳定剂选自由以下组成的组:多元醇(polyol),包括糖,优选地单糖或二糖,例如,甘露醇、甘氨酸、甘油(glycerol)、山梨醇或肌醇,以及多羟基醇(polyhydric alcohol)诸如甘油(glycerine)或丙二醇或其混合物;螯合剂,所述螯合剂选自由edta、dtpa或egta的组;一种或更多种氨基酸,所述一种或更多种氨基酸选自由以下组成的组:脯氨酸、丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。适合的稳定剂的实例已经在本领域广泛描述(参见,例如,allen jr,loyd v,编著(2012)remington:the science and practice of pharmacy,第22版,pharmaceutical press)。
[0060]
在本发明的各种实施方案中,掺入到药物制剂中的稳定剂是表面活性剂。如本文使用的“表面活性剂”是指降低两种液体之间或液体与固体之间的表面张力(或界面张力)的两亲性化合物,即包含疏水基团和亲水基团二者的化合物。“非离子表面活性剂”在其头部没有带电荷的基团。“非离子表面活性剂”的实例包括例如聚氧乙烯二醇烷基醚,诸如八乙二醇单十二烷基醚、五乙二醇单十二烷基醚;聚氧丙烯二醇烷基醚;葡萄糖苷烷基醚,诸
如癸基葡萄糖苷、月桂基葡萄糖苷、辛基葡萄糖苷;聚氧乙烯二醇辛基酚醚,诸如triton x-100;聚氧乙烯二醇烷基酚醚,诸如壬苯醇醚-9;甘油烷基酯,诸如甘油月桂酸酯;聚氧乙烯二醇脱水山梨醇烷基酯,诸如聚山梨醇酯;脱水山梨醇烷基酯,诸如spans;椰油酰胺mea、椰油酰胺dea;十二烷基二甲胺氧化物;聚乙二醇和聚丙二醇的嵌段共聚物,诸如泊洛沙姆;和聚乙氧基化牛脂胺(poea)。在各种实施方案中,本发明的药物制剂可以包含呈组合的这些表面活性剂中的一种或更多种。在各种实施方案中,用于药物制剂的非离子表面活性剂选自由聚山梨醇酯诸如聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60或聚山梨醇酯80组成的组,并且非离子表面活性剂的浓度在相对于制剂的总体积的0.01%至0.08%(w/v)、0.015%至0.06%(w/v)或0.02%至0.04%(w/v)的范围内。在一种实施方案中,非离子表面活性剂是具有相对于制剂总体积0.01%(w/v)的浓度的聚山梨醇酯20(即吐温20)。
[0061]
在本发明的各种实施方案中,掺入到稳定的液体制剂中的螯合剂选自由edta、dtpa或egta组成的组。在各种实施方案中,螯合剂是在10mm的浓度的edta。
[0062]
在本发明的各种实施方案中,掺入到稳定的液体制剂中的氨基酸选自由以下组成的组:脯氨酸、丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。在各种实施方案中,氨基酸是在50mm的浓度的l-甲硫氨酸。
[0063]
在本发明的各种实施方案中,本公开内容的制剂包含生理学上可接受的张力调节剂。措辞“张力调节剂”意指可以添加至制剂以调节制剂的张力的药学上可接受的惰性物质。适于本发明的张力调节剂包括但不限于氯化钠、氯化钾、甘露醇、蔗糖、右旋糖、山梨醇、甘油和其他药学上可接受的张力调节剂。张力调节剂在存在时优选地以足以使液体制剂与体液近似等渗的量(即,约270mosm/l至300mosm/l)存在,并且适于胃肠外注射到哺乳动物,诸如人类受试者,到真皮、皮下或肌内组织或iv。等渗性可以通过例如使用蒸汽压或冰冻型渗透压计(ice-freezing type osmometer)来测量。
[0064]
在本发明的各种实施方案中,药物制剂将包含选自由氯化钾、氯化钙、氯化钠、磷酸钠、磷酸钾和碳酸氢钠组成的组的张力调节剂,并且浓度将在10mm至200mm、20mm至150mm或30mm至100mm的范围内。在一种实施方案中,张力调节剂是在100mm的浓度的氯化钠。
[0065]
在本发明的各种实施方案中,稳定的液体制剂还可以包含选自由以下组成的组的胃肠外可接受的防腐剂:甲酚、苯甲醇、苯酚、苯扎氯铵、苄索氯铵、氯丁醇、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、硫柳汞和硝酸苯汞和乙酸苯汞。
[0066]
如本文使用的,术语“无菌水”或“注射用水”是指不包含抑菌剂、抗微生物剂或添加的缓冲剂的注射用水的无菌非热原性制剂。通常,添加剂的渗透压浓度总计至少112mosmol/升(细胞外流体的正常容量渗透摩尔浓度(osmolarity)280mosmol/升的五分之二)。
[0067]
本发明的药物制剂适于胃肠外施用。如本文使用的,药物制剂的“胃肠外施用”包括以以下为特征的任何施用途径:物理破坏(physical breaching)受试者的组织并经组织中的破坏施用药物制剂,因此通常导致直接施用到血流、到肌肉或到内部器官中。因此,胃肠外施用包括但不限于,通过注射制剂、通过经外科手术切口应用制剂、通过经组织穿透性非外科手术伤口应用制剂等施用药物制剂。特别地,预期胃肠外施用包括但不限于皮下注射、腹膜内注射、肌内注射、胸骨内注射、静脉内注射、动脉内注射、鞘内注射、心室内注射、
尿道内注射、颅内注射、滑膜内注射或输注;或肾透析输注技术。本发明涉及一种用于在预填充注射器、小瓶、筒或笔(pen)中使用的稳定的水性药物制剂。
[0068]
药物制剂通常被配制成无菌的、实质上等渗的,并且完全符合美国食品和药物管理局(u.s.food and drug administration)的所有良好生产规范(good manufacturing practice,gmp)规定。优选地,本文描述的多肽制剂的治疗有效剂量将提供治疗益处,而不会引起显著毒性。
[0069]
在一种实施方案中,稳定的液体制剂包含hupth(1mg/ml)、10mm柠檬酸钠、50mm l-met、10mm edta、100mm nacl、0.01%聚山梨醇酯20,ph 5.0。
[0070]
以下实施例对本发明是说明性的,而非意图是限制性的。
[0071]
实施例1
[0072]
制剂稳定性方法开发
[0073]
在评价稳定性的方法的开发中,hupth的测试试剂(1mg/ml pth)经历用0.01%h2o2的强制氧化,并且然后经历sec-hplc、rp-hplc和cex-hplc,如下文另外的方法部分中描述的。
[0074]
sec-hplc分析的结果描绘于图1中。如图1中描绘的,sec主峰向较早的洗脱时间移动,指示由强制氧化引起的聚集。rp-hplc分析的结果描绘于图2中。如图2中描绘的,rp主峰分裂成四个洗脱峰,指示由强制氧化引起的更多的pth的亲水性物类。cex-hplc分析的结果描绘于图3中。如图3中描绘的,主峰向较早的洗脱时间移动,指示由强制氧化引起的较少的带正电荷的物类,诸如脱酰胺物类。
[0075]
实施例2
[0076]
ph及缓冲液的筛选研究
[0077]
本实施例显示了ph和不同缓冲液条件对液体hupth制剂稳定性的影响。使用具有seq id no:2中列出的氨基酸序列的重组hupth(1mg/ml)作为制剂中的活性成分。表1提供了在本实施例中测试的制剂的概要。
[0078]
表1
[0079]
10mm乙酸钠、140mm nacl,ph 4.0
[0080]
10mm乙酸钠、140mm nacl,ph 5.0
[0081]
10mm柠檬酸盐、140mm nacl,ph 5.0
[0082]
10mm磷酸钠、140mm nacl,ph 6.0
[0083]
10mm组氨酸、140mm nacl,ph 6.0
[0084]
10mm磷酸钠、140mm nacl,ph 7.0
[0085]
10mm tris、140mm nacl,ph 7.0
[0086]
10mm tris、140mm nacl,ph 8.0
[0087]
10mm甘氨酸、140mm nacl,ph 9.0
[0088]
在25℃和37℃进行的sec-hplc、rp-hplc和cex-hplc的结果描绘于图4-图6中。在4℃进行的sec-hplc和rp-hplc的结果描绘于图7-图8中。在25℃和37℃的这些加速稳定性研究显示出,hupth在ph 5可能具有最佳稳定性谱。
[0089]
实施例3
[0090]
在优化的ph范围的赋形剂和表面活性剂的筛选研究
[0091]
本实施例显示了各种赋形剂和表面活性剂对液体hupth制剂在ph 5.0的稳定性的影响。使用具有seq id no:2中列出的氨基酸序列的重组hupth(1mg/ml)作为制剂中的活性成分。固定的制剂参数是ph 5.0和1.0mg/ml hupth。
[0092]
为了筛选各种赋形剂的作用,制备了10种不同的制剂,并且储存在具有tfe塞子的1型玻璃小瓶中。进行在4℃、25℃、37℃在0周、1周、2周、4周、8周、12周时的稳定性分析(rp-hplc、cex-hplc和sec-hplc、ph、容量渗透摩尔浓度、uv-vis)。表2提供了在本实施例中测试的制剂的概要。
[0093]
表2
[0094]
10mm柠檬酸钠、50mm zncl2,ph 5.0
[0095]
10mm柠檬酸钠、10mm l-met、50mm zncl2,ph 5.0
[0096]
10mm柠檬酸钠、10mm l-met、5%(w/v)甘露醇,ph 5.0
[0097]
10mm柠檬酸钠、10mm l-met、5%(w/v)山梨醇,ph 5.0
[0098]
10mm柠檬酸钠、10mm l-met、9%(w/v)蔗糖,ph 5.0
[0099]
10mm柠檬酸钠、10mm l-met、5%(w/v)海藻糖,ph 5.0
[0100]
10mm柠檬酸钠、10mm l-met、10%(v/v)丙二醇,ph 5.0
[0101]
10mm柠檬酸钠、10mm l-met、10%(v/v)甘油,ph 5.0
[0102]
10mm柠檬酸钠、10mm l-met、10%(w/v)kolliphor p188,ph 5.0
[0103]
10mm柠檬酸钠、10mm l-met、100mm nacl,ph 5.0
[0104]
在4℃、25℃和37℃进行的sec-hplc、rp-hplc和cex-hplc的结果描绘于图9-图14中。在25℃和37℃的初始加速稳定性研究显示,在某些制剂赋形剂的存在下,hupth在ph 5的稳定性可以进一步增加。使用zncl2作为基准(bench mark),三种制剂赋形剂提供了hupth在水性溶液中更好的稳定性谱,并且sec-hplc、rp-hplc和cex-hplc数据显示,制剂#1、#2、#3、#5、#6、#9和#10在胁迫加速条件(stressed accelerated conditions)下是最稳定的。
[0105]
为了筛选各种表面活性剂的作用,制备了12种不同的制剂,并且储存在具有tfe塞子的1型玻璃小瓶中。进行在4℃、25℃、37℃在0周、1周、2周、4周、8周、12周时的稳定性分析(rp-hplc、cex-hplc和sec-hplc、ph、容量渗透摩尔浓度、uv-vis)。表3提供了在本实施例中测试的制剂的概要。
[0106]
表3
[0107]
10mm柠檬酸钠、10mm l-met、50mm zncl2,ph 5.0,0.01%(v/v)聚山梨醇酯20
[0108]
10mm柠檬酸钠、10mm l-met、5%(w/v)山梨醇,ph 5.0,0.01%(v/v)聚山梨醇酯20
[0109]
10mm柠檬酸钠、10mm l-met、10%(v/v)丙二醇,ph 5.0,0.01%(v/v)聚山梨醇酯20
[0110]
10mm柠檬酸钠、10mm l-met、100mm nacl,ph 5.0,0.01%(v/v)聚山梨醇酯20
[0111]
10mm柠檬酸钠、50mm zncl2,ph 5.0,0.01%(v/v)聚山梨醇酯20
[0112]
10mm柠檬酸钠、10mm l-met、50mm zncl2,ph 5.0,0.1%(v/v)聚山梨醇酯20
[0113]
10mm柠檬酸钠、10mm l-met、5%(w/v)山梨醇,ph 5.0,0.1%(v/v)聚山梨醇酯20
[0114]
10mm柠檬酸钠、10mm l-met、5%(w/v)山梨醇,ph 5.0,0.5%(v/v)聚山梨醇酯20
[0115]
10mm柠檬酸钠、10mm l-met、10%(v/v)丙二醇,ph 5.0,0.1%(v/v)聚山梨醇酯20
[0116]
10mm柠檬酸钠、10mm l-met、100mm nacl,ph 5.0,0.1%(v/v)聚山梨醇酯20
[0117]
10mm柠檬酸钠、50mm zncl2,ph 5.0,0.1%(v/v)聚山梨醇酯20
[0118]
10mm柠檬酸钠、10mm l-met、100mm nacl,ph 5.0,0.1%(v/v)kolliphor p188
[0119]
在4℃、25℃和37℃进行的sec-hplc、rp-hplc和cex-hplc的结果描绘于图15-图20中。rp-hplc数据(25℃)显示,制剂#1、#3、#4、#5、#6、#7、#9、#10和#11在胁迫加速条件下最佳,而制剂#2、#8和#12是不稳定的。sec-hplc数据(25℃)显示,除了#8和#12之外,所有制剂均是稳定的。cex-hplc数据显示,除了#2、#8和#12之外,所有制剂均是稳定的。
[0120]
因此,显示出l-met、丙二醇和聚山梨醇酯-80的组合可以提供hupth在ph 5.0的良好稳定性。并且除了制剂#2、#8和#12之外,所有制剂在两周内都是稳定的。对hupth稳定性的这种l-met影响是新的发现。
[0121]
实施例4
[0122]
吐温20和吐温80对hupth稳定性的影响。
[0123]
本实施例评价了吐温20(t20)或吐温80(t80)对实施例1-3中测试的各种制剂的稳定性的影响。表4提供了在本实施例中初始测试的制剂的概要。
[0124]
表4
[0125]
0.01%t20、150mm nacl、10mm naoac,ph 5.0
[0126]
0.1%t20、150mm nacl、10mm naoac,ph 5.0
[0127]
0.01%t80、150mm nacl、10mm naoac,ph 5.0
[0128]
0.1%t80、150mm nacl、10mm naoac,ph 5.0
[0129]
在37℃进行的rp-hplc的结果描绘于图21中。制剂在37℃在5天之后的稳定性描绘于图22中。结果显示,吐温80比吐温20引起更多的pth的降解。事实上,0.01%(v/v)吐温80比0.1%(v/v)吐温20引起更多的降解。观察到的降解主要是氧化。
[0130]
在第二项研究中,对表5中列出的制剂进行评价。
[0131]
表5
[0132]
150mm nacl、10mm甲硫氨酸、10mm naoac、0.01%吐温20
[0133]
150mm nacl、10mm甲硫氨酸、10mm naoac、0.01%吐温80
[0134]
100mm nacl、50mm甲硫氨酸、10mm naoac、0.01%吐温20
[0135]
100mm nacl、50mm甲硫氨酸、10mm naoac、0.01%吐温80
[0136]
50mm nacl、100mm甲硫氨酸、10mm naoac、0.01%吐温20
[0137]
50mm nacl、100mm甲硫氨酸、10mm naoac、0.01%吐温80
[0138]
制剂在4℃、25℃和37℃在1周时的稳定性描绘于图23-图25中。在4℃、25℃和37℃进行的rp-hplc、cex-hplc和sec-hplc的结果描绘于图26-图34中。这些结果显示,l-met浓度需要从10mm增加至50mm-100mm,以防止吐温80引起的氧化,并且l-met浓度的增加导致hupth稳定性的保护作用,并且在高于50mm,l-met的保护作用看起来是最大的。
[0139]
实施例5
[0140]
l-met和edta组合对hupth稳定性的评价。
[0141]
本实施例评价了l-met和edta的各种组合对hupth稳定性的影响。表6提供了在本实施例中初始测试的制剂的概要。
[0142]
表6
k0054-81c
[0175]
流动相a:38.75mm naac、22.5%acn ph 5.5
[0176]
流动相b:46.25mm naac、277.5mm nacl、7.5%acn ph 5.1
[0177]
流量:0.3ml/min
[0178]
检测器:220nm
[0179]
柱温:25℃
±
3℃
[0180]
自动取样器:5℃
±
2℃
[0181]
注射:20μl的1mg/ml蛋白
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1