可用于硬脊膜缺损修补的水凝胶补片及其制备方法与应用
1.本发明涉及生物医药领域,具体涉及可用于硬脊膜缺损修补的水凝胶补片及其制备方法与应用。
背景技术:
2.硬脊膜是体内一种致密的结缔组织,主要由胶原纤维构成,由硬脑膜向下延续而成,包饶形成硬脊膜囊,其内充盈脑脊液,保护脊髓免受震荡、压迫。当今脊柱手术量逐步增加,而脊柱手术中,常会出现硬脊膜撕裂的并发症,据文献统计在腰椎手术中发生硬脊膜撕裂的概率在3
‑
16%
1.,而不同的手术方式、手术部位、椎管狭窄程度、瘢痕粘连皆会引起硬脊膜撕裂风险增高。硬脊膜的愈合过程较特殊,硬脊膜无法再生,其愈合过程为瘢痕愈合,缺损的硬脊膜周围组织先形成毛细血管及纤维结缔组织和各种炎性细胞组成的肉芽组织,4
‑
16周后后成纤维细胞迁移,i、iii型胶原蛋白形成,此时肉芽组织逐渐纤维化,等到术后6个月,肉芽组织完全被替代为瘢痕组织。因此,若硬脊膜撕裂甚至缺损放任不处置,脑脊液必然顺漏口形成脑脊液漏,轻者可有低颅压、呕吐等神经精神症状,严重可致中枢神经系统感染,甚至死亡。
3.不同硬脊膜破裂程度所需修补方法不同,对于撕裂程度较轻的硬脊膜:若硬脊膜撕裂无缺损,或横向缺损长度小于5mm,可使用缝线、粘合剂直接缝补缺损
2.。但直接缝线缝合的成功封堵率在不同手术部位有很大差异,且脑脊液可能顺缝合针孔漏出
3.。当硬脊膜缺损口不能通过单纯缝线缝合解决时,一般会采用纤维蛋白胶、明胶海绵、水凝胶提高修补成功率。现存的相关产品大致有duraseal,bioglue,evicel,tisseel,前两种为粘合剂,后两种为蛋白胶。duraseal是一种可降解粘合剂,由聚乙二醇、三赖氨酸胺组成,在体内4
‑
8周降解,但是在体内粘合剂会膨胀50%,当运用于有骨性狭窄部位的硬脊膜修补时,可能产生神经症状,之前存在下腰椎部位使用duraseal产生马尾综合征的案例报道
4.;bioglue(戊二醛生物胶)在动物中证实与脊髓会产生炎性反应与粘连;evicel与tisseel皆为纤维蛋白胶,作为血制品存在传播微生物感染风险,纤维蛋白胶桥接强度低,凝结时间慢,难以达到缝补要求,且纤维蛋白胶持续时间较短,在体内5
‑
7天即可崩解
5.。
4.除去可直接用缝线、粘合剂修补的硬脊膜,若硬脊膜撕裂出现缺损,当硬脊膜横向缺损长度大于5mm需要补片修补
2.:可选用的材料分为自体组织、异体组织、不可降解合成材料,可降解合成材料。自体组织缝合技术要求高,且自体组织取材会造成新的伤口,增加患者痛苦,存在对于较大的缺口无法覆盖的缺陷;异体组织也存在会导致creatzfeldt
‑
jakob病
6.、不易消毒而传播病原体、免疫反应可能导致粘连、疤痕粘连、移植物松解、外来物炎症反应等缺点;不可降解合成材料不仅具有不可降解的缺陷,且与正常硬脊膜相容性低,并且其伸长率比正常硬脊膜相比也要低
7.与硬脊膜修补的需要不相匹配;可降解合成材料例如聚乳酸补片、已经获得fda批准的cerafix dura substitute材料以及plla与明胶构成的仿生纤维等材料,聚乳酸补片抗拉强度及伸长率均偏低
7.,cerafix dura substitute材料以及plla与明胶构成的仿生纤维具有可吸收不易粘连、生物相容性好等优
势,但应用在硬脊膜缺损修补时,在抗拉强度、修补操作难度上仍具有提高的空间。
5.1.hershman,s.,v.g.cuellar,and j.a.bendo,delayed presentation of incidental durotomy.bull hosp jt dis(2013),2013.71(3):p.231
‑
4.
6.2.papavero,l.,n.engler,and r.kothe,incidental durotomy in spine surgery:first aid in ten steps.eur spine j,2015.24(9):p.2077
‑
84.
7.3.dafford,e.e.and p.a.anderson,comparison of dural repair techniques.spine j,2015.15(5):p.1099
‑
105.
8.4.epstein,n.e.,dural repair with four spinal sealants:focused review of the manufacturers'inserts and the current literature.spine j,2010.10(12):p.1065
‑
8.
9.5.yu,f.,et al.,current developments in dural repair:a focused review on new methods and materials.front biosci(landmark ed),2013.18:p.1335
‑
43.
10.6.thadani,v.,et al.,creutzfeldt
‑
jakob disease probably acquired from a cadaveric dura mater graft.case report.j neurosurg,1988.69(5):p.766
‑
9.
11.7.shi,z.and t.xu,a new absorbable synthetic substitute with biomimetic design for dural tissue repair.2016.40(4):p.403
‑
13.
技术实现要素:
12.本发明提供一种可用于硬脊膜缺损修补的水凝胶补片及其制备方法与应用,本发明的补片相比现有补片具有更优越的抗拉性能,且具有良好的生物相容性以及封堵承压效果,完全满足硬脊膜因伴随脊柱节段的活动需要承受较大的拉伸应力的需求。
13.为达到上述发明目的,本发明所采取的技术方案如下:
14.提供一种可用于硬脊膜缺损修补的水凝胶补片,包括水凝胶层和粘合剂层,所述粘合剂层涂覆并压紧于水凝胶层;所述水凝胶层通过丙烯酰胺、藻酸钠、hbss溶液、mbaa、aps、硫酸钙、temed和氯化钙制备,所述粘合剂层通过mes缓冲液、壳聚糖、nhs和edc制备。
15.以上所述的水凝胶补片,其中,所述水凝胶层通过加入包括丙烯酰胺、藻酸钠、hbss溶液、mbaa、aps、硫酸钙、temed在内的原材料制备的水凝胶前体浸泡于氯化钙溶液后制备。
16.以上所述的水凝胶补片,其中,所述氯化钙溶液为0.25m氯化钙溶液,浸泡时间为24小时。
17.本发明还提供一种水凝胶补片的制备方法,包括如下步骤:
18.(a)制备水凝胶层:通过加入包括丙烯酰胺、藻酸钠、hbss溶液、mbaa、aps、硫酸钙、temed在内的原材料制备的水凝胶前体浸泡于氯化钙溶液后制备;
19.(b)制备粘合剂:通过mes缓冲液、壳聚糖、nhs和edc制备;
20.(c)将所述粘合剂涂覆于所述水凝胶层,得到所述补片。
21.以上所述的制备方法,其中,所述氯化钙溶液为0.25m氯化钙溶液,浸泡时间为24小时。
22.以上所述的制备方法,其中,所述水凝胶前体的制备方法包括如下步骤:
23.(1)取丙烯酰胺和硫酸钙溶于hbss中;
24.(2)向(1)中溶液加入藻酸钠,搅拌得到澄清液体;
25.(3)配制mbaa溶液及aps溶液;
26.(4)保持(2)中得到的液体呈搅拌状态,按顺序依次向(2)中得到的液体加入mbaa溶液、aps溶液和temed液体;
27.(5)搅拌成形,搅拌4min,倒入模具过夜。
28.以上所述的制备方法,其中,
29.步骤(1)中所述丙烯酰胺占步骤(1)制备溶液的质量浓度的12%,硫酸钙在步骤(1)制备溶液中浓度为0.015m,搅拌时间30min;
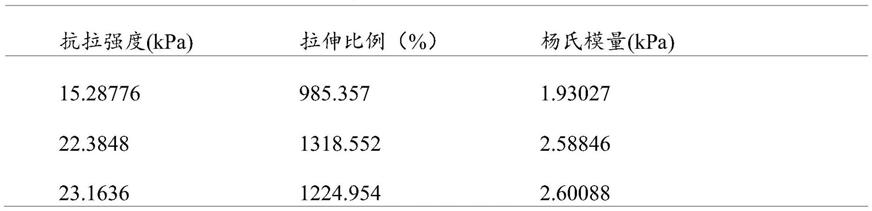
30.步骤(2)中加入的藻酸钠均为步骤(1)中所得溶液质量浓度的2%;
31.步骤(3)中所述mbaa的溶液质量浓度为2%,所述aps溶液浓度为0.27m;
32.步骤(4)中加入液体的量为每100ml步骤(2)所得液体加入360μl mbaa溶液、2260μl aps溶液和80μl temed液体。
33.以上所述的制备方法,其中,所述制备粘合剂的步骤中每10ml mes缓冲液中溶解0.2g壳聚糖、0.12g nhs、0.12g edc,搅拌时间1min。
34.本发明任一所述的补片在修补硬脊膜缺损上的应用。
35.以上所述的应用,其中,应用步骤如下:
36.(1)擦除硬脊膜缺损处体液;
37.(2)将权利要求1
‑
3中任一所述的补片贴于所述硬脊膜缺损处,粘合剂层面朝下,按压5min。
38.有益效果
39.本发明的水凝胶补片不仅具有良好的生物相容性以及粘附力,并且在经过氯化钙处理之后很大提升了抗拉性能,相比现有补片其抗拉伸性能最高可达到23.1636kpa,加之12.34954倍的拉伸距离,可达2.60088kpa的杨氏模量,其抗拉性能远高于硬脊膜可能出现的变形程度;补片粘合封堵时可承受的最大压力可达到900mmh2o,远高于人体正常脑脊液压力(80~200mmh2o),且可保证封堵效果大于3天,因此本发明的补片完全满足硬脊膜修补的需求。
附图说明
40.图1.本发明补片水凝胶层的电镜照片(左:横截面;右:表面);
41.图2.本发明补片水凝胶层的抗拉性能测试数据;
42.图3.本发明补片水凝胶层的粘附力测试数据;
43.图4.本发明补片水凝胶层的粘附力测试时拉伸方向演示(左:水平拉伸;右:垂直拉伸);
44.图5.本发明补片组分浸提液培养后的细胞活力;
45.图6.本发明补片在不同封堵方式下所能承受的最大压力。
具体实施方式
46.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。所述试剂和生物材料,如无特殊
说明,均可从商业途径获得。
47.一、补片制备
48.制备所需试剂:
49.丙烯酰胺、藻酸钠、hbss溶液(hank’s balance salt solution)、mbaa(n,n`
‑
亚甲基双丙烯酰胺)、aps(过硫酸铵)、硫酸钙、temed(四甲基乙二胺)、mes缓冲液(ph 6.0)、edc(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)、nhs(n
‑
羟基琥珀酰亚胺)、氯化钙、壳聚糖(分子量50,000
‑
190,000da)。
50.制备步骤:
51.(一)水凝胶制备
52.(1)将12%(w/v)丙烯酰胺和0.015m硫酸钙溶于hbss中,搅拌30min;
53.(2)向上述溶液中加入2%(w/v)藻酸钠,搅拌过夜,得到澄清液体
①
;
54.(3)配制2%mbaa溶液,0.27m aps溶液;
55.(4)保持液体
①
搅拌状态,依次按每100ml液体
①
加入360μl mbaa溶液,2260μl aps溶液,80μl temed的顺序加入液体。
56.(5)继续搅拌4min,倒入30x50x2mm的玻璃模具,过夜。
57.(6)取出凝固的水凝胶,浸泡于0.25m氯化钙溶液中,24h后取出,去除表面液体后待用,根据需要裁减水凝胶大小。
58.(二)粘合剂制备
59.在10ml mes缓冲液中溶解0.2g壳聚糖,0.12g nhs,0.12g edc,搅拌1min;
60.(三)补片制备
61.(1)将粘合剂倒于水凝胶表面(每1mm加入25μl粘合剂);
62.(2)用玻璃平板按压倒有粘合剂的水凝胶10min;
63.(3)得到待用补片。
64.二、补片电镜照片
65.用扫描电子显微镜(hitachi uhr fe
‑
sem su8020,japan)拍摄补片水凝胶部分(如图1所示)。
66.三、补片性能测试
67.(一)水凝胶部分抗拉伸性能:
68.测试方法:将制备得到的补片水凝胶部分,测量水凝胶的长(l)、宽(w)与厚度(d)后,固定于拉力实验机(mark
‑
10,usa)两端,以50mm/min的速度拉伸并记录拉力(f)数据和位移(s)数据,测得水凝胶的最大抗拉伸强度和最大拉伸比例,并计算得到该水凝胶的杨氏模量。对3片同样步骤制备的水凝胶进行了测试(结果见图2)。抗拉强度=f/(w
·
d);拉伸比例=s/l
×
100%。
69.表1三片水凝胶的抗拉性能测试数据
[0070][0071]
表2不同浓度氯化钙浸泡后补片水凝胶部分抗拉性能数据对比
[0072][0073]
测试得到该补片的水凝胶部分抗拉伸性能最高可达到23.1636kpa的抗拉强度,12.34954倍的拉伸距离,杨氏模量可达到2.60088kpa。本发明抗拉性能远高于硬脊膜可能出现的变形程度,完全满足硬脊膜修补的需求。并且采用本发明的0.25m的氯化钙浸泡补片前体水凝胶可以使水凝胶层达到最佳的抗拉性能。
[0074]
(二)补片粘合性能
[0075]
测试方法:将两片制备得到的补片以粘合剂层相对的方式粘合在一起,测量补片粘合部分的长(l)与宽(w)后,固定于拉力实验机(mark
‑
10,usa)两端,以50mm/min的速度拉伸并记录拉力(f)数据和位移(s)数据,测得补片的最大粘附力和最大拉伸距离(分别见图3和图4)。粘附力=f/w;最大拉伸距离为两块补片开始分开时的拉伸位移s。
[0076]
表2不同拉伸方向的补片粘附能力
[0077][0078]
测试得到该补片的水平粘附力可达到80.60879n
·
m
‑
1,可承受78.88mm的水平方向位移,垂直粘附力可达到16.14699n
·
m
‑
1,可承受33.4mm的垂直方向位移。补片在实际应用中在体内一般只受到水平方向的牵拉且拉伸位移较短,本发明完全满足硬脊膜修补的需
求。
[0079]
(三)补片的生物相容性
[0080]
(1)制备补片各组分浸提液:
[0081]
空白对照:dmem培养基置于4℃中24h;
[0082]
水凝胶浸提液:每ml dmem培养基加入12mg水凝胶,置于4℃中24h后取出,用0.2μm过滤器过滤;
[0083]
粘合剂浸提液:每ml dmem培养基加入2μl粘合剂,置于4℃中24h后用0.2μm过滤器过滤;
[0084]
补片浸提液:每ml dmem培养基加入12mg水凝胶和2μl粘合剂,置于4℃中24h后取出水凝胶,用0.2μm过滤器过滤;
[0085]
(2)浸提液与细胞共培养:
[0086]
选用l929细胞(购自上海纪宁实业有限公司),接种于96孔板中,将培养基按(1)中分组换为对应浸提液,于37℃,5%co2浓度的孵箱中培养1、2、3天,分别用活死细胞染色试剂盒(live/deadtm cell imaging kit,thermo fisher,usa)进行活死细胞染色,用激光共聚焦显微镜拍照,在imagej中进行活死细胞计数。细胞活力=(活细胞数/总细胞数)
×
100%。
[0087]
补片各组分浸提液与细胞共培养1、2、3天后均显示出细胞活力与空白对照无统计学差异,补片生物相容性良好(结果见图5)。
[0088]
(四)补片封堵效果
[0089]
(1)补片封堵后所能承受的最大压力测试
[0090]
测试方法:选用新鲜猪小肠,沿小肠轴向作1cm切口,分别使用缝线直接缝合,筋膜缝合,本发明补片粘合、其他生物补片缝合进行修补。
[0091]
在小肠内灌满生理盐水,排空气泡,于小肠一端通过升高液平面的方式加压,另一端连接压力传感器,测定小肠切口处漏水时的压力为不同封堵方式所能承受的最大压力(结果见图6)。
[0092]
表3不同封堵方式所能承受的最大压力(mmh2o)
[0093][0094]
补片粘合封堵后可承受的最大压力可达到900mmh2o,远高于人体正常脑脊液压力(80~200mmh2o)且高于其他几种修补方式。
[0095]
(2)猪硬脊膜缺损体外封堵实验
[0096]
选用新鲜猪硬脊膜,在两段神经根出口之间作4mm轴向切口,在切口所在的两段神经根出口之间两端连接导管,其内用蠕动泵(lead
‑
fluid bf
‑
100f,china)以0.4ml/min的速度输送人工脑脊液溶液,观察是否有液体漏出,且在补片上方以0.4ml/min的速度滴加生理盐水,以维持补片的湿润状态。
[0097]
连续观察3天,未发现液体漏出,本发明在湿环境下可保证封堵效果大于3天。
[0098]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1