一种局部注射用硫酸阿米卡星多囊脂质体及其制备方法
本发明属于药物制剂技术领域,尤其涉及一种局部注射用硫酸阿米卡星多囊脂质体及其制备方法与应用。
背景技术:
随着抗生素的广泛使用及滥用,抗生素耐药问题已成为全球性的公共卫生安全问题,其中尤以革兰氏阴性菌耐药问题为甚,临床上对某类耐药菌感染的治疗方法极为有限。纵观近年chinet(中国细菌耐药监测网)年度报告,作为氨基糖苷类抗生素代表的阿米卡星对肠杆菌科和铜绿假单胞菌的耐药率都非常低,但传统给药模式下的抗生素疗法存在多种问题:抗生素给药后被快速代谢从体内排出,只有少部分药物到达感染部位,生物利用率低,使得临床中往往需要大剂量给药、长周期治疗,这会导致显著毒副作用;另外抗生素对生物膜内细菌治疗效果差,难以在胞内富集,且难以杀伤胞内存活细菌,导致慢性感染和复发性感染频发。
硫酸阿米卡星(amikacinsulfate)属于第三代半合成氨基糖苷类抗生素,最初于1972年由日本bristol公司研制开发,我国最早由四川抗菌素工业研究所研究开发,其化学名称为o-3-氨基-3-脱氧-α-d-葡吡喃糖基-(1→4)-o-[6-氨基-6-脱氧-α-d葡吡喃糖基-(1→6)]-n3-(4-氨基-2-羟基-1-氧代丁基)-2-脱氧-l-链霉胺硫酸盐,分子结构式如下:
硫酸阿米卡星的作用机制是通过与30s核糖体16srrna的a位点紧密结合来抑制蛋白质的合成。不同于其他氨基糖苷类抗生素,硫酸阿米卡星的优点在于很少产生耐药菌株,对其它氨基糖苷类抗生素耐药的菌株对该产品仍然敏感,尤其对革兰氏阴性菌和葡萄球菌具有杀菌作用。但目前国内应用于临床的硫酸阿米卡星制剂主要为普通注射用硫酸阿米卡星,其给药途径以肌肉、静脉和鞘内途径为主。这种制剂用量大且药物释放按一级动力学进行,血液中药物浓度起伏变化大,常出现“峰谷”现象,其血药浓度有可能超出最低中毒浓度,且有效血药浓度维持时间短,往往需要多次重复给药才能达到有效治疗目的,增加了劳动成本,且重复给药对人体的刺激较大,应激反应明显,不利于人类的健康。
此外,临床上由于使用硫酸阿米卡星引起毒副作用的病例时有发生,有证据表明在持续5~7天的急性感染的治疗中,大约20%的患者可能发生由于使用氨基糖苷类抗生素引起的听力损失,并且约15%可能影响平衡,此外还观察到神经毒性(肌肉瘫痪和呼吸暂停)和肾毒性,药物毒性与血药浓度呈正相关。另外硫酸阿米卡星属于浓度依赖型抗生素,伴随药物浓度增加,杀菌作用增强,其毒性也随之增加,这些缺点限制了其广泛应用。
针对传统抗生素给药模式存在的问题,利用新型脂质给药系统递送抗生素显示出良好的应用前景。多囊脂质体(multivesicularliposomes,mvl)是英国学者kims于1983年研制出的由非同心的类脂双分子囊泡紧密堆积而成的聚集体,是一种传递药物的新型脂质体。作为药物载体,多囊脂质体可被生物降解,无毒性及免疫原性,将多囊脂质体混悬液局部注射于病灶部位可形成药物储库,药物释放需要透过类脂及磷脂双分子层的层层阻隔,产生良好的缓释作用,不仅减少药物剂量,还提高和延长药物疗效,药物在治疗剂量下释放时没有突释现象,还可避免体内的波动或毒性水平以及被网状内皮系统摄取;由于多囊脂质体内部含有大量水相包封水溶性较好的抗生素类药物,可获得高的包封率和较大的载药量,脂质载体还可改善药物药代动力学和生物学分布,降低药物毒性;对病灶部位有靶向选择性,增强药物对细胞内、外病原体的抗菌活性,减少耐药发生。目前获美国fda批准上市的多囊脂质体制剂有skyepharma公司研发的用于防治脑膜白血病和淋巴瘤脑膜炎的
因此,有必要研制出一种硫酸阿米卡星多囊脂质体及其相关注射制剂,以解决传统注射用硫酸阿米卡星全身作用出现的上述问题。如何提供上述硫酸阿米卡星多囊脂质体,实现通过在细菌感染灶局部给药,减少药物用量,利用多囊脂质体包载药物来实现缓释效果,减少给药次数,降低毒副作用,提高患者顺应性,成为本发明亟待解决的技术问题。
技术实现要素:
本发明的目的就是为了解决上述技术问题,而提供一种局部注射用硫酸阿米卡星多囊脂质体及其制备方法,同时本发明还提供了该硫酸阿米卡星多囊脂质体的具体应用。本发明所提供的硫酸阿米卡星多囊脂质体具备包封率高、载药量大、粒径均一的特点,将其制备成注射用粉针剂,能够具有较好的缓释效果,有利于提高药物的生物利用度,从而显著提高疗效。
本发明的目的之一是提供一种局部注射用硫酸阿米卡星多囊脂质体,其特征在于,包括以下重量份数的原料:
硫酸阿米卡星35~180份;
脂质材料35~300份;
渗透压调节剂195~410份;
辅乳化剂材料0.50~35.50份;
其中,所述脂质材料是由磷脂、胆固醇、甘油三酯和膜稳定剂按质量比为(5~7.5):(3~5.5):(3~6):(1.0~3.0)组成。
本发明提供的硫酸阿米卡星多囊脂质体经复溶后外观呈淡乳白色、均匀状混悬液,其粒径均一,包封率高,载药量大,可解决注射用硫酸阿米卡星用量大的问题,进而降低毒副作用的发生,将硫酸阿米卡星包载于脂质材料中,局部注射于对硫酸阿米卡星敏感的感染部位可在注射部位或给药腔室中大量蓄积,药物缓慢释放且无突释现象发生,另外,利用多囊脂质体的结构优势还可延长药物生物半衰期,减少给药次数,增强患者顺应性。
进一步的是,所述磷脂选自大豆磷脂(spc)、氢化大豆磷脂(hspc)、蛋黄卵磷脂(epc)或二棕榈酰磷脂酰胆碱(dppc)中的至少一种;所述甘油三酯选自三油酸甘油酯、三辛酸甘油酯或大豆油中的至少一种。不同于已有上市的多囊脂质体注射产品,本发明优选的天然磷脂的生物相容性更好,价廉易得,同时具有相转变温度低和制备条件相对温和的优点。
进一步的是,所述膜稳定剂为荷负电磷脂酰甘油、脂肪酸或硬脂胺中的至少一种;所述荷负电磷脂酰甘油包括二棕榈酰磷脂酰甘油(dppg)、1,2-二芥酰基-sn-甘油基-3-磷酸-rac-(1-甘油)(depg)、1,2-二肉豆蔻酰基-sn-甘油基-3-磷酸-rac-(1-甘油)(dmpg)、1,2-二油酰-sn-甘油基-3-磷酸-rac-(1-甘油)(dopg);所述脂肪酸包括油酸或硬脂酸。已公开报道多囊脂质体制剂大多选用荷负电磷脂作为膜稳定剂,但其成本较高且不易获得,本发明选择的材料易得,价格低廉,特别是作为优选的硬脂胺作为膜稳定剂,可以通过增加磷脂双分子层间的静电斥力,阻止磷脂膜合并与破坏。在油相中加入不同用量的硬脂胺,可以明显提高多囊脂质体的成型性,形成的多囊脂质体粒径均一,能大幅减少磷脂碎片的产生消除聚集沉淀的现象。
进一步的是,所述渗透压调节剂选自蔗糖、葡萄糖、山脂肪酸梨醇或海藻糖中的至少一种。所述辅乳化剂材料选自l-赖氨酸(l-lysine)、聚乙烯醇(pva)中的一种或几种,优选的辅乳化剂材料为聚乙烯醇,常规多囊脂质体处方选择赖氨酸作为辅乳化剂,本发明通过对比发现采用聚乙烯醇可以获得更高的包封率。
本发明的目的之二是提供上述局部注射用硫酸阿米卡星多囊脂质体的制备方法,其包括以下步骤:
(1)按重量份,称取脂质材料溶于有机溶剂中作为油相;配制含渗透压调节剂的硫酸阿米卡星溶液作为内水相;配制含渗透压调节剂的辅乳化剂溶液作为外水相;
(2)将内水相分散至油相中,再经混合后形成稳定的w/o型初乳;
(3)将初乳细化后快速注入外水相中涡旋混合形成复乳;
(4)将复乳置于热水浴中除去有机溶剂,得到硫酸阿米卡星多囊脂质体混悬液a;
(5)对步骤(4)所得物纯化得到硫酸阿米卡星多囊脂质体混悬液b,冷冻干燥后即得所述硫酸阿米卡星多囊脂质体。
上述的硫酸阿米卡星多囊脂质体的制备方法,步骤(2)中可制得外观呈乳白色,流动性好且稳定的w/o型初乳。
进一步的是,步骤(1)中所述有机溶剂选自氯仿、氯仿与乙醚混合液中的一种;所述内水相与油相的体积比为0.5~2:2;所述初乳与外水相的体积比为1:1~4。
进一步的是,步骤(2)中所述混合方法包括涡旋、搅拌或超声波细胞破碎法中的任一种,超声波细胞破碎仪的超声功率优选150~500w,超声时间为3~10min;步骤(4)所述除去有机溶剂的方法包括室温蒸发、减压旋蒸或氮吹法中的任一种。
进一步的是,步骤(4)中所述热水浴的温度为37~40℃,直至混悬液浊度降低无有机溶剂味道为止。
进一步的是,步骤(5)中所述纯化的步骤为:采用离心法,选择超纯水、5%葡萄糖溶液、0.9%氯化钠溶液中的一种或几种,洗涤沉淀2~3次后重新混悬制得硫酸阿米卡星多囊脂质体混悬液b。
本发明制备的硫酸阿米卡星多囊脂质体混悬液b外观呈淡乳白色、均匀状混悬液,其粒径均一,包封率高,载药量大,且具备良好的生物相容性和生物可降解性,将其置于4℃下储存20d后底部出现沉淀轻摇易混悬,药物渗漏率低。本发明采用冷冻干燥技术将硫酸阿米卡星多囊脂质体混悬液b冷冻干燥制得硫酸阿米卡星多囊脂质体冻干粉针剂,能够提高其稳定性,并更好的进行运输储存。
本发明通过增加药物载药量减少药物用量,将硫酸阿米卡星多囊脂质体混悬液局部注射至病灶部位形成药物储库,药物透过类脂和磷脂双分子层的层层阻隔产生良好的缓释作用,有利于提高生物利用度,进而减少制剂毒性并实现其较好的抗菌治疗效果。
本发明的目的之三是提供上述硫酸阿米卡星多囊脂质体的应用,其是将得到的硫酸阿米卡星多囊脂质体制备成用于治疗或预防葡萄球菌和革兰氏阴性菌引起的局部软组织、闭合性体腔感染和异物(fbs)引起感染的药物。
本发明的有益效果如下:
本发明提供了一种局部注射用硫酸阿米卡星多囊脂质体及其制备方法,按照本发明的配方,通过将硫酸阿米卡星包封于具有蜂窝状内部结构的脂质材料中,制得的硫酸阿米卡星多囊脂质体具有包封率高、载药量大、粒径均一的优点,且具有较好的缓释效果。能够通过局部注射至病灶部位形成药物储库,药物透过类脂和磷脂双分子层的层层阻隔产生良好的缓释作用,有利于提高生物利用度,进而减少制剂毒性并实现其较好的抗菌治疗效果。
附图说明
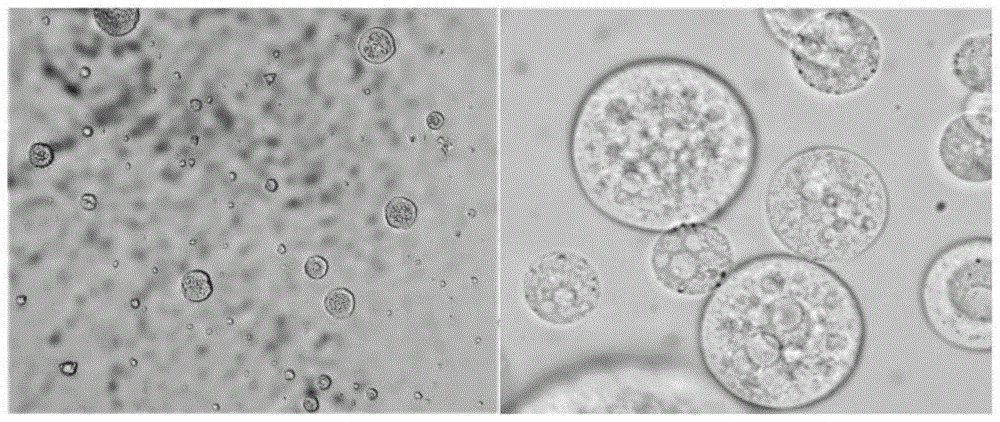
图1为本发明实施例3所述的amkx-mvls(硫酸阿米卡星多囊脂质体)在荧光倒置显微镜下的粒子形态图,200×(左)和400×(右);图2为本发明实施例1所述的不同ph释放介质下amkx-mvls(硫酸阿米卡星多囊脂质体)的累积释药曲线图(n=6)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行具体描述,有必要指出的是,以下实施例仅仅用于对本发明进行解释和说明,并不用于限定本发明。本领域技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
本发明实施例中硫酸阿米卡星多囊脂质体外观采用荧光倒置显微镜观察;
本发明实施例中硫酸阿米卡星多囊脂质体的包封率和载药量的计算方法如下:
包封率的计算方法为:
载药量的计算方法为:
实施例1
硫酸阿米卡星多囊脂质体,包括如下表1中的原料配方:结合文献资料及药物给药剂量,固定主药浓度为50mg/ml,脂质材料中spc:ch:to:oda质量比为4:3:2:1,考察药脂比分别为3:1,2:1,1:1情况下本品的外观、粒径和包封率变化。
表1
制备过程如下:
各组样品分别将配方量的spc、ch、to、oda溶解于3ml氯仿中,作为油相备用;将硫酸阿米卡星溶解于3ml7%蔗糖溶液中,作为内水相备用;将625mg葡萄糖溶解于12.5ml0.5%pva(聚乙烯醇)溶液中,作为外水相备用;将内水相分散至油相中,10000r/min搅拌5min,接着冰浴条件下超声波细胞破碎4min(功率300w)形成稳定的w/o型初乳;用注射器吸取初乳以一定速度注入12.5ml外水相中,涡旋混合10s形成复乳;将复乳转移至敞口玻璃瓶中置于37±0.2℃水浴中,一定速度搅拌同时氮吹10-15min,除去有机溶剂,直至混悬液浊度降低无有机溶剂味道为止,即得硫酸阿米卡星多囊脂质体混悬液a(amkx-mvls)。随着脂质质量的增加,混悬液a的外观由淡乳白色半透明均匀状变为乳白色均匀状。
样品1-3包封率分别为21.05%,29.70%,51.98%,平均粒径d50值分别为54.292μm、50.188μm、45.592μm,载药量分别为35.91%,33.99%,21.80%,经纯化后包封率可达到54.42%,65.73%,94.15%。对比实验结果发现,可以通过调整药脂比来提高药物的包封率,但当药脂比达到1:1时,形成的初乳开始变粘稠,继续增加脂质质量不利于复乳的形成。
实施例2
结合文献报道与预实验结果,本实施例详细阐述硬脂胺作为膜稳定剂,在该配方中添加与否及其用量对本品的外观、粒径和包封率的影响。
硫酸阿米卡星多囊脂质体,包括以下表2的原料配方:
表2
制备过程如下:
各组样品分别将配方量的spc、ch、to、oda溶解于3ml氯仿中,作为油相备用;将硫酸阿米卡星溶解于3ml7%蔗糖溶液中,作为内水相备用;将1.0006g葡萄糖溶解于20ml0.5%pva溶液中,作为外水相备用;将内水相分散至油相中,10000r/min搅拌5min,冰浴条件下超声波细胞破碎4min(功率300w)形成稳定的w/o型初乳;用注射器吸取初乳以一定速度注入12.5ml外水相中,涡旋混合10s形成复乳;将复乳转移至敞口玻璃瓶中置于37±0.2℃水浴中,一定速度搅拌同时氮吹10-15min,除去有机溶剂,直至混悬液浊度降低无有机溶剂味道为止,即得硫酸阿米卡星多囊脂质体混悬液a(amkx-mvls)。
其中,样品4为未添加硬脂胺,在除去溶剂过程中,出现粒子粘连、聚集、析出的现象;样品5-7外观呈淡乳白色半透明均匀状混悬液,将其置于4℃储存,放置0.5-1h后脂质体开始沉淀,轻摇后可重新悬浮,平均粒径d50值分别为48.152μm、45.592μm、43.435μm,包封率为分别为49.47%,51.98%,54.27%,载药量分别为25.38%,21.80%,20.29%。经纯化后(硫酸阿米卡星多囊脂质体混悬液b)包封率可达到93.37%,94.15%,94.24%。
实施例3
硫酸阿米卡星多囊脂质体,包括以下表3的原料配方:
表3
制备过程如下:
两组样品分别将配方量的spc、ch、to、oda溶解于3ml氯仿-乙醚混合液(v/v,1:1)中,作为油相备用;将硫酸阿米卡星溶解于3ml7%蔗糖溶液中,作为内水相备用;将1g葡萄糖溶解于20ml0.5%pva溶液中,作为外水相备用。样品8将内水相分散至油相中,10000r/min搅拌9min,用注射器吸取初乳以一定速度注入12.5ml外水相中,涡旋混合10s形成复乳,将复乳转移至敞口玻璃瓶中置于37±0.2℃水浴中,一定速度搅拌同时氮吹10-15min,除去有机溶剂,直至混悬液浊度降低无有机溶剂味道为止,即得硫酸阿米卡星多囊脂质体混悬液a(amkx-mvls)。样品9将内水相分散至油相中,10000r/min搅拌5min后冰浴条件下超声波细胞破碎4min(功率300w)形成稳定的w/o型初乳,后续步骤同样品8。
样品8外观呈乳白色均匀状,样品9外观呈淡乳白色半透明均匀状,采用激光粒度仪测定样品平均粒径d50值分别为46.272μm、28.513μm,包封率为分别为50.44%,62.48%,载药量分别为27.38%,21.81%。经纯化后包封率可达到85.01%,94.79%。结合粒径,包封率和载药量各项指标的测定结果,优选搅拌结合超声波细胞破碎法作为w/o型初乳的制备工艺。
实施例4
硫酸阿米卡星多囊脂质体,包括以下表4的原料配方:
制备过程如下:
各组样品称取配方量的epc、ch、to、oda溶解于3ml氯仿中,作为油相备用;将硫酸阿米卡星溶解于3ml8%蔗糖溶液中,作为内水相备用;样品10、11、12分别选择20mmol/ll-赖氨酸-4%葡萄糖溶液,40mmol/ll-赖氨酸-4%葡萄糖溶液,60mmol/ll-赖氨酸-4%葡萄糖溶液作为外水相备用。将各样品内水相分散至油相中,10000r/min搅拌5min后冰浴条件下超声波细胞破碎4min(功率300w)形成稳定的w/o型初乳,用注射器吸取初乳以一定速度注入12.5ml外水相中,涡旋混合10s形成复乳,将复乳转移至敞口玻璃瓶中置于37±0.2℃水浴中,一定速度搅拌同时氮吹10-15min,除去有机溶剂,直至混悬液浊度降低无有机溶剂味道为止,即得硫酸阿米卡星多囊脂质体混悬液a(amkx-mvls)。
样品10与样品12在除有机溶剂10min时出现粒子粘连聚集沉降现象,样品11外观呈乳白色均匀状,采用激光粒度仪测定其平均粒径d50值为50.378μm,包封率为48.54%,载药量为12.78%,经纯化后包封率可达到80.17%。
实施例5
取本发明实施例2所制得的硫酸阿米卡星多囊脂质体混悬液b(a经纯化后)置于4℃储存,观察其外观并考察渗漏情况,结果如表5。结果表明,硫酸阿米卡星多囊脂质体混悬液b在4℃条件下可储存21d,其外观无明显变化,但渗漏率有所升高,这可能与其粒径是微米级大小有关,因此考虑将其制为冻干品制剂。
表5
实施例6
取本发明实施例2所制得的硫酸阿米卡星多囊脂质体混悬液b(a经纯化后)置于真空冷冻干燥机中,设置冻干过程(预冻-升华干燥-解析干燥)制备冻干品,将其用铝塑组合盖封口于25℃条件下储存30d,观察其外观呈白色饼状固体,表面平整光滑,其粉末质地细腻,加入适量0.9%氯化钠轻微振摇,可在较短时间内完全复溶,为乳白色均匀状混悬液,渗漏率也有所降低。
实施例7
取本发明实施例3所制得的硫酸阿米卡星多囊脂质体混悬液b3ml于清洗干净的透析袋(mw=14000)内,排尽透析袋内气泡并两端扎紧,置于盛有ph5.5、ph7.4的磷酸盐缓冲液的离心管中。将离心管置于37℃恒温的摇床中,设置摇床转速50r/min,分别于0.5、1、2、4、10、24、48、72h取样2ml并补充同温度等体积的新鲜释放介质,按照已建立的硫酸阿米卡星含量测定方法,测定所取样品的药物浓度并计算药物累积释放百分率,以时间为横坐标,药物累积释放百分率为纵坐标绘制释放曲线如图2。根据体外释放结果可知,硫酸阿米卡星多囊脂质体混悬液在不同ph释放介质中均可以在体外实现药物的持续缓慢释放,均无突释效应,且在ph5.5释放介质中释放更快。
- 还没有人留言评论。精彩留言会获得点赞!