一种纳多洛尔柔性纳米凝胶乳剂及其制备方法与流程
1.本发明属于治疗婴幼儿血管瘤的外用剂技术领域,特别是一种纳多洛尔柔性纳米凝胶乳剂及其制备方法。
背景技术:
2.纳多洛尔是一种白色或几乎白色结晶性粉末的化学品,微溶于水,易溶于乙醇。纳多洛尔作为一种心血管药,临床上主要用于治疗高血压、心绞痛、心律失常、甲状腺功能亢进症、偏头痛等病症。近年来,有报道将纳多洛尔替代普萘洛尔,能够有效缓解改善因服用普萘洛尔治疗婴幼儿血管瘤导致的睡眠障碍问题。纳多洛尔本身也存在不良滋气味,导致婴幼儿患者服用顺应性差。目前的纳多洛尔药物产品大多数为包衣片、胶囊等剂型,以提升顺应性。然而,这几种片剂类型均需要用水吞服,服用条件有限制;对于吞咽能力不足的婴幼儿患者并不适用。
3.柔性纳米脂质体是一种多功能的新型药物载体,其做为水溶性和脂溶性大分子药物载体,具有高变形性、高柔韧性、高渗透性等特点,是一种新型的经皮给药载体。《柔性纳米脂质体的研究现状及进展》(刘娟,中国化工学会,2010年10月)中公开了柔性纳米脂质体的特殊作用和透皮机制,以及五种制备方法,此外还提到柔性纳米脂质体的可以应用于抗肿瘤药物的载体。
4.现有技术中,中国授权专利cn102846546a提供了一种能促进经皮吸收的普萘洛尔复合磷脂传递体及其制备方法,其中公开了原料采用二棕榈酰磷脂酰胆碱和大豆磷脂二种磷脂成分,还采用边缘活性剂和普萘洛尔,边缘活性剂选自胆酸钠、脱氧胆酸钠、吐温与司盘,制备方法是采用超声处理,再进行透析、超或凝胶柱层析制得空白复合磷脂传递体,最后加入普萘洛尔包封制成。该发明制备的这种材料包封率显著提高,体外释放呈现缓释效果,在大鼠血浆中的稳定性提高,经皮给药后血药浓度与药-时曲线下面积也显著提高。
5.又例如中国授权专利cn106214668b提供了一种丙泊酚柔性纳米脂质体贴剂,其原料包括丙泊酚、罗哌卡因、氢化大豆卵磷脂、胆固醇,其制备方法是先将丙泊酚、白芷油、蛋黄卵磷脂、胆固醇溶于异丙醇中,去除有机溶剂后制成含有丙泊酚的均匀脂质体薄膜,然后将吐温80家水溶解,氮气保护下滴加至脂质体薄膜中,高速分散和调节ph值,最后加入聚乙烯醇、聚丙烯酸钠、藻酸钠、西黄芪胶、羧甲基纤维素、甘油,得到丙泊酚柔性纳米脂质体,涂布在纸衬膜上制成贴剂。该发明制备的丙泊酚柔性纳米脂质体,粒径达到数十纳米,能够穿过直径为其1/5的小孔,透皮性能好,在透皮和进入体内的过程中可保持完整性,具有高度的稳定性。
6.又例如《甲氨蝶呤柔性纳米脂质体凝胶的构建及体外经皮渗透性研究》(尹耀庭,中南药学,2012年8月第10卷第8期,590-593页)中公开了甲氨蝶呤柔性纳米脂质体凝胶的制备方法,采用逆向蒸发法,将卵磷脂、胆固醇溶于乙醚中支撑油相,另将甲氨蝶呤、甘草酸二钾用pbs缓冲液制成水相,将水相加至油相中,超声处理制成乳剂,再去除有机溶剂得半固态胶状物;加入pbs缓冲液常压水化得到甲氨蝶呤柔性纳米脂质体混悬液;另取卡波姆、
甘油、丙二醇、羟苯乙酯、水和浓氨水制成卡波姆凝胶,与甲氨蝶呤柔性纳米脂质体混悬液搅拌均匀制成成品。制成的成品粒径为230-270nm之间,可显著增加药物皮肤滞留量、减少经皮渗透量,从而延长药物作用时间,降低药物毒副作用,满足局部治疗的要求。
7.然而,现有技术中还未专门针对纳多洛尔,制备一种用于涂抹在婴幼儿血管瘤部位,粒径小,兼具缓释和快速透皮性能的柔性纳米脂质体乳剂。
技术实现要素:
8.针对以上现有技术的不足,本发明提供了一种纳多洛尔柔性纳米凝胶乳剂及其制备方法,具体通过以下技术实现。
9.一种纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔3-8wt%、酰化酪蛋白14-19wt%、表面活性剂2-3wt%、磷脂6-18wt%、甘油2-7wt%和ph值调节剂,剩余为双蒸水;ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;
10.所述表面活性剂为胆酸钠、脱氧胆酸钠、吐温、司盘中的至少一种。
11.一般而言,柔性纳米凝胶能快速透皮进入血管或达到作用部位发挥药效,但是如果初期作用的药物浓度增长过快,最高浓度过高,会导致后续药物浓度不足,不能起到长效作用。上述纳多洛尔柔性纳米凝胶乳剂,采用磷脂、表面活性剂制成纳多洛尔柔性纳米凝胶,然后再选用酰化酪蛋白包覆在其表面,起到进一步缓释的作用。相比于现有的柔性纳米凝胶乳剂或常规缓释纳米脂质体,本发明的这种乳剂涂抹在血管瘤皮肤部位,能够在较长时间内作用,并且一旦缓释就能快速透皮发挥药效,缓释时间和药物起效能够把握平衡,保证在相对较长的缓释时间内处于较高药物浓度。
12.优选地,其原料包括纳多洛尔4wt%、酰化酪蛋白16wt%、表面活性剂2.5wt%、磷脂14wt%、甘油5wt%,剩余为双蒸水。
13.优选地,所述磷脂为大豆磷脂、卵磷脂、二棕榈酰磷脂酰胆碱中至少一种。
14.更优选地,所述磷脂为大豆磷脂、二棕榈酰磷脂酰胆碱且重量比为1.5-3:1。
15.进一步优选地,所述磷脂为大豆磷脂、二棕榈酰磷脂酰胆碱且重量比为2.2:1。
16.本发明还提供了上述的纳多洛尔柔性纳米凝胶乳剂的制备方法,包括以下步骤:
17.s1、取磷脂、纳多洛尔加至乙醇中完全溶解制成第一混合液;取表面活性剂、甘油溶解于占总用水量50-60%的双蒸水中得到水相;
18.s2、在氮气保护下,将步骤s1的第一混合液滴入水相中,45-60℃,9000-15000rpm下剪切乳化35-45min,得第二混合液;
19.s3、取酰化酪蛋白搅拌溶解于剩余的双蒸水中,然后加入步骤s2的第二混合液,30-45℃,2000-4000rpm下分散60-120min,分散的同时加入ph值调节剂调节ph至7.5-8.0,制得纳多洛尔柔性纳米凝胶乳剂。
20.优选地,步骤s2的剪切方式为55℃,12000rpm下剪切乳化40min。
21.优选地,步骤s3的分散方式为40℃,3500rpm下分散100min。
22.与现有技术相比,本发明的有益之处在于:本发明通过选用特定比例的表面活性剂和磷脂制成柔性纳米凝胶,然后用酰化酪蛋白提升缓释效果,使得乳剂成品的缓释效果和药物透皮效果的配合更合理,在相对合理的时间内保证发挥良好的药效作用。
附图说明
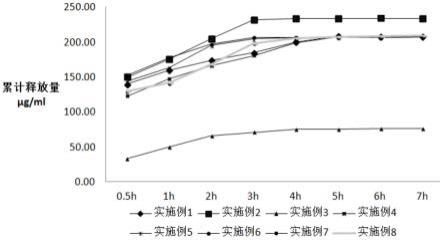
23.图1为实施例1-8的纳多洛尔柔性纳米凝胶乳剂的体外释放试验结果;
24.图2为对比例1-7的纳多洛尔柔性纳米凝胶乳剂的体外释放试验结果。
具体实施方式
25.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
26.实施例1
27.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔4wt%、酰化酪蛋白16wt%、表面活性剂2.5wt%、磷脂14wt%、甘油5wt%和ph值调节剂,剩余为双蒸水;ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;
28.表面活性剂采用脱氧胆酸钠,磷脂采用大豆磷脂、二棕榈酰磷脂酰胆碱且重量比为2.2:1。
29.纳多洛尔柔性纳米凝胶乳剂的制备方法为:
30.s1、取磷脂、纳多洛尔加至乙醇中完全溶解制成第一混合液;取表面活性剂、甘油溶解于占总用水量60%的双蒸水中得到水相;
31.s2、在氮气保护下,将步骤s1的第一混合液滴入水相中,55℃,12000rpm下剪切乳化40min,得第二混合液;
32.s3、取酰化酪蛋白搅拌溶解于剩余的40%的双蒸水中,然后加入步骤s2的第二混合液,40℃,3500rpm下分散100min,分散的同时加入ph值调节剂调节ph至7.5-8.0,制得纳多洛尔柔性纳米凝胶乳剂。
33.实施例2
34.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔8wt%、酰化酪蛋白14wt%、表面活性剂2wt%、磷脂6wt%、甘油7wt%和ph值调节剂,剩余为双蒸水;ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;
35.表面活性剂采用吐温-80,磷脂采用大豆磷脂。纳多洛尔柔性纳米凝胶乳剂的制备方法与实施例1相同。
36.实施例3
37.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔3wt%、酰化酪蛋白19wt%、表面活性剂3wt%、磷脂18wt%、甘油2wt%和ph值调节剂,剩余为双蒸水;ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;
38.表面活性剂采用吐温-80,磷脂采用大豆磷脂、二棕榈酰磷脂酰胆碱且重量比为3:1。纳多洛尔柔性纳米凝胶乳剂的制备方法与实施例1相同。
39.实施例4
40.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同;不同之处在于表面活性剂采用司盘-60,磷脂采用蛋黄卵磷脂。纳多洛尔柔性纳米凝胶乳剂的制备方法与实施例1相同。
41.实施例5
42.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同;不同之处在于:
43.纳多洛尔柔性纳米凝胶乳剂的制备方法中,步骤s2的剪切方式为55℃,9000rpm下剪切乳化45min。
44.实施例6
45.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同;不同之处在于:
46.纳多洛尔柔性纳米凝胶乳剂的制备方法中,步骤s2的剪切方式为55℃,15000rpm下剪切乳化35min。
47.实施例7
48.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同;不同之处在于:
49.纳多洛尔柔性纳米凝胶乳剂的制备方法中,步骤s3的搅拌分散的方式为40℃,2000rpm下分散120min。
50.实施例8
51.本实施例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同;不同之处在于:
52.纳多洛尔柔性纳米凝胶乳剂的制备方法中,步骤s3的搅拌分散的方式为40℃,4000rpm下分散60min。
53.对比例1
54.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔4wt%、酰化酪蛋白23wt%、表面活性剂0.5wt%、磷脂4wt%、甘油2wt%和ph值调节剂,剩余为双蒸水;ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;采用的表面活性剂和磷脂与实施例1相同。纳多洛尔柔性纳米凝胶乳剂的制备方法与实施例1相同。
55.对比例2
56.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔4wt%、酰化酪蛋白10wt%、表面活性剂5wt%、磷脂20wt%、甘油2wt%和ph值调节剂,剩余为双蒸水;ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;采用的表面活性剂和磷脂与实施例1相同。纳多洛尔柔性纳米凝胶乳剂的制备方法与实施例1相同。
57.对比例3
58.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同,不同之处在于:步骤s2的剪切方式为55℃,6000rpm下剪切乳化45min。
59.对比例4
60.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同,不同之处在于:步骤s2的剪切方式为55℃,18000rpm下剪切乳化35min。
61.对比例5
62.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同,不同之处在于:步骤s3的搅拌分散的方式为40℃,1000rpm下分散140min。
63.对比例6
64.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料与实施例1相同,不同之处在于:步骤s3的搅拌分散的方式为40℃,5500rpm下分散60min。
65.对比例7
66.本对比例提供的纳多洛尔柔性纳米凝胶乳剂,其原料包括纳多洛尔4wt%、表面活性剂2.5wt%、磷脂14wt%、甘油5wt%和ph值调节剂,剩余为双蒸水;即原料中不含有酰化酪蛋白。
67.ph值调节剂的用量以调节所述纳多洛尔柔性纳米凝胶乳剂的ph值为7.5-8为准;采用的表面活性剂和磷脂与实施例1相同。纳多洛尔柔性纳米凝胶乳剂的制备方法与实施例1相同。
68.应用例1:实施例和对比例的纳多洛尔柔性纳米凝胶乳剂的粒径和包封率测试
69.参考中国授权专利cn102846546b的说明书中公开的普萘洛尔复合磷脂传递体的测试方法,对本技术上述实施例和对比例的纳多洛尔柔性纳米凝胶乳剂的粒径和包封率进行测试,具体测试方法为:
70.1、包封率测定
71.(1)采用sephadex g-50柱分离上述实施例和对比例制备的的纳多洛尔柔性纳米凝胶乳剂样品,得纳多洛尔柔性纳米凝胶与游离药物,纳米凝胶定容后等体积破膜剂破膜,12000rpm离心后备用。
72.(2)采用高效液相色谱法,分别测定纳多洛尔柔性纳米凝胶中与游离药物中纳多洛尔的含量:精密吸取样品1ml过高效液相色谱kromasil c18柱(250mm
×
4.6mm,5μm)进行洗脱,流动相为体积比为1:1的甲醇和0.02mol/l的kh2po4水溶液,流速1.1ml/min,柱温40℃,检测波长289nm,进样体积10μl。
73.(3)包封率计算方法:
74.包封率=[纳多洛尔柔性纳米凝胶中药物含量/(纳多洛尔柔性纳米凝胶中药物含量+游离药物含量)]*100%。
[0075]
2、粒径的测量
[0076]
采用zeta pals型高分辨zeta电位及粒度分析仪,以pbs缓冲液(ph值=7.4)为分散介质,测定纳多洛尔柔性纳米凝胶的平均粒径(particle size)、半峰宽(half width)以及多分散系数(polydispersity,pi)。实际测定前,先将待测的纳多洛尔柔性纳米凝胶乳剂样品用pbs缓冲液(ph值=7.4)稀释至计数率(count rate)不超过500kcps以保证测定结果的准确性。每份样品平行测定3次。
[0077]
包封率和粒径的检测结果见下表1所示。从表1中可以看到,。
[0078]
表1纳多洛尔柔性纳米凝胶的包封率和粒径
[0079][0080][0081]
由上表1可知,当原料中酰化酪蛋白,或者表面活性剂和磷脂的用量发生变化时,对乳剂中的柔性纳米粒的包封率、平均粒径和粒径分布均匀性都有影响;改变剪切和搅拌分散的方式同样也会产生上述影响。
[0082]
应用例2:实施例和对比例的纳多洛尔柔性纳米凝胶乳剂的体外释放试验
[0083]
对实施例1-7和比较例1-7制备的纳多洛尔柔性纳米凝胶乳剂进行体外释放试验,通过扩散池做药物释放试验,采用10μm的人造纤维膜作为渗透材料,以体积分数40%的乙醇溶液作为接收介质,供给室给药量为0.5ml,接收池体积10ml,有效渗透面积为3.14cm2。将扩散池置于恒温水浴槽(37℃
±
0.5℃)中,磁力搅拌器置于恒温水浴槽下,搅拌速度为650r/min。分别于第0.5h、1h、2h、3h、4h、5h、6h、7h,取出2.5ml接收液,同时补以同体积的空白接收液。将取得的样品进行离心,取上清液,通过液相色谱法分析接收液,得到该时刻的药物浓度,进而计算该时刻的药物释放量,最终计算得到这该时刻的药物累计释放量。
[0084]
具体结果如图1、2所示。从附图1、2中可以看到,采用本技术实施例的配方和制备方法,得到的纳多洛尔柔性纳米凝胶乳剂具有明显的缓释效果,基本在第3-5h之间达到药物的最大释放量。然而,对比例1、4、6的药物累计释放量始终处于上升状态,说明其缓释效果导致药物释放过慢,将会影响药物浓度;对比例2、3、5、7的缓释效果不明显,尤其是对比例7,药物释放速度过快,在实际应用中不利于血液中药物浓度的相对恒定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1