一种负载bFGF的肝素化脱细胞脂肪材料的制备方法及应用
一种负载bfgf的肝素化脱细胞脂肪材料的制备方法及应用
技术领域
1.本发明涉及脂肪组织工程生物材料领域,具体涉及一种负载碱性成纤维细胞生长因子(bfgf)的肝素化脱细胞脂肪(dat)的制备方法和应用。
背景技术:
2.无免疫原性的脱细胞组织越来越多地用于组织工程中,相较于其他组织,体表脂肪的易获取、来源广的优势受到了学界的独特青睐,再加上脱细胞脂肪组织天然的成脂诱导能力,致使脱细胞脂肪在脂肪组织工程中具有强大的应用前景。
3.尽管脱细胞脂肪(decellularized adipose tissue,dat)移植后可促进局部组织的再血管化和脂肪新生,但其血管化及成脂效果还难以满足临床需求,再加上现有的脱细胞脂肪无法满足标准化生产和规模化生产的要求,并不能满足病患即需即取的要求。因此,寻求和开发一种具有更强成脂特性和血管化能力的dat是组织工程研究学界的共同追求。
4.技术方案
5.本发明的目的是提供一种可以即需即取,易于保存的负载碱性成纤维细胞生长因子(bfgf)的肝素化脱细胞脂肪(dat)的制备方法和应用,该生物材料来源于动物(含人体)体表分布广泛的脂肪组织,无免疫原性且具有良好的成脂特性,满足标准化生产和规模化生产的要求,能够预先制备和保存,使患者能够即需即取,具有广阔的临床应用前景。
6.为了达到上述技术目的,本发明提供了一种负载bfgf的肝素化脱细胞脂肪材料的制备方法,所述制备方法的具体步骤如下:
7.(1)脱细胞脂肪(dat)的制备:
8.a.取新鲜来源的脂肪在
‑
80℃至37℃的条件环境下冷冻复融3~5次,每次1~2h,然后取冻融后的脂肪剪碎或采用均质、离心处理后保留脂肪层;
9.b.将步骤a中至直接剪碎的脂肪或收集的脂肪层置于trypsin
‑
edta(胰蛋白酶
‑
edta消化液)中振荡消化16h~24h后,然后用pbs缓冲液洗涤3~5次,每次30~60min,然后置于异丙醇中振荡浸泡处理48h~72h,每24h换液一次,并用pbs缓冲液洗涤后再次用体积浓度为1%~3%的triton x
‑
100(聚乙二醇辛基苯基醚)去污剂振荡消化1h~2h,pbs缓冲液洗涤3~5次后,再次在trypsin
‑
edta消化液中振荡消化4h~6h。
10.c.将步骤b中振荡消化后的脂肪采用pbs缓冲液洗涤,并使用核酸酶(benzonase)浓度大于≥100u/ml的pbs溶液振荡处理16h~24h,再次使用异丙醇振荡浸泡处理8h~12h后,采用pbs缓冲液洗涤,最后使用乙醇消毒液浸泡3~5次得到灭菌后的脱细胞脂肪,每次浸泡时间为30min~60min;
11.(2)肝素化脱细胞脂肪的制备:
12.a.在浓度为0.1mol/l的mes缓冲液中加入edc(1
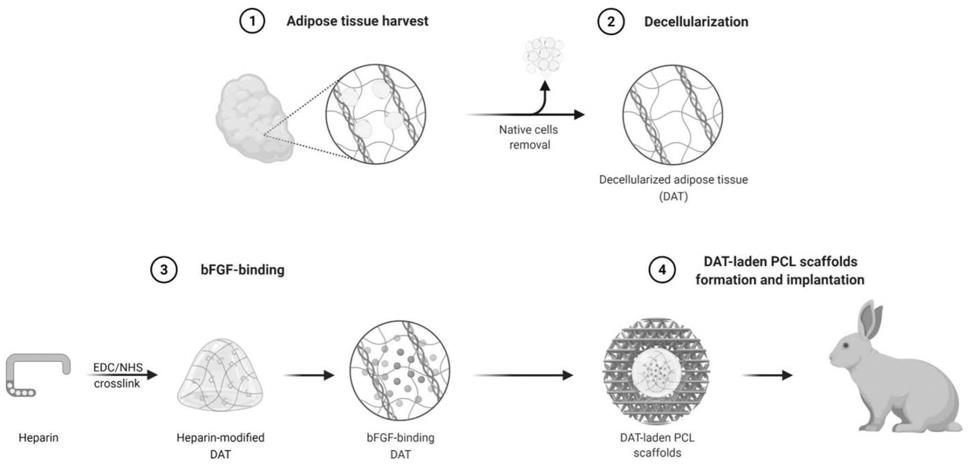
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)、nhs(n
‑
羟基琥珀酰亚胺)和肝素钠配制成mes缓冲液混合溶液,并在室温下反应孵育15min~30min;其mes缓冲液混合溶液中,edc(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)和nhs(n
‑
羟基琥珀酰亚胺)的摩尔浓度比为3:5,肝素钠的质量分数为0.5%~
1.5%;
13.b.取步骤(1)中制备的脱细胞脂肪按照质量百分比1%~2%加入步骤a中反应后的mes缓冲液混合溶液中,并在温度为25℃~37℃、振荡频率为60rpm~120rpm的条件下振荡反应16h~24h得到肝素化脱细胞脂肪;将反应后得到肝素化脱细胞脂肪使用na2hpo4溶液洗涤30min~60min后,再使用nacl溶液洗涤3~5次,每次30min~60min,最后用无菌pbs缓冲液洗涤3~5次,每次10min~30min,最后得到肝素化脱细胞脂肪,并将其保存于无菌离心管中;
14.(3)负载bfgf的肝素化脱细胞脂肪的制备:取步骤(2)中制备的肝素化脱细胞脂肪切碎直至形成均匀的凝胶状匀浆,按照每ml无菌bfgf溶液加入2000mg肝素化脱细胞脂肪的比例浸泡于浓度为1μg/ml~5μg/ml的无菌bfgf溶液中,并在4℃条件下孵育16h~24h;然后,取出反应后的肝素化脱细胞脂肪,并用无菌pbs溶液清洗3~5次,每次3~5min,洗脱未交联的bfgf后即得到负载bfgf的肝素化脱细胞脂肪材料,并将其置于4℃无菌保存。
15.本发明进一步的技术方案:所述步骤(1)的a步骤中所述的新鲜脂肪为鼠来源、兔来源、人来源或其他动物来源;将新鲜脂肪冻融后直接切碎成0.5x0.5cm的小块;或者将新鲜脂肪冻融后加入等体积的去离子水,采用均质器在转速12000~15000rpm的转速下均质5~10min;并将均质处理后的组织悬浮液在离心转速为1500~3000rpm的条件下离心5~10min,去除最上层黄色油脂及最下层水分,保留中间的脂肪层。
16.本发明较优的技术方案:所述步骤(1)的b步骤中的trypsin
‑
edta消化液的质量浓度为0.05%~0.25%。
17.本发明较优的技术方案:所述步骤(1)的c步骤中的消毒液采用体积浓度75%的乙醇或含有过氧乙酸的乙醇水溶液,其中,含有过氧乙酸的乙醇水溶液中过氧乙酸的体积百分比为0.1%,乙醇的体积百分比为4%。
18.本发明较优的技术方案:所述步骤(1)中的异丙醇的质量浓度为99.9%;所述步骤(1)中的去离子水和pbs缓冲液中均按照质量体积比加入100u/ml青霉素、0.1mg/ml链霉素、0.25μg/ml两性霉素b;所述步骤(1)得到的脱细胞脂肪储存在无菌pbs缓冲液中。
19.本发明较优的技术方案:所述步骤(2)的b步骤中na2hpo4溶液的浓度为0.1~0.2mol/l,所述nacl溶液的摩尔浓度为1~4mol/l。
20.本发明较优的技术方案:所述步骤(2)的含edc/nhs的mes缓冲液、na2hpo4溶液、nacl溶液在配置后均用0.22μm除菌过滤器过滤后并保存于无菌容器中。
21.本发明还提供的了一种上述任意一项中的方法制备的负载bfgf的肝素化脱细胞脂肪材料的的应用,其特征在于:将所述负载bfgf的脱细胞脂肪材料作为脂肪填充物用于脂肪组织的再生或重建。
22.本发明进一步的技术方案:将所述负载bfgf的脱细胞脂肪材料在24h内注射至由高分子聚合物制备的3d打印支架中,并连同3d打印支架一起作为脂肪填充物用于脂肪组织的再生或重建。
23.本发明较优的技术方案:所述3d打印支架材料包括聚己内酯、聚乳酸、聚
‑
β
‑
羟基丁酸、透明质酸等中任意一种或多种高分子聚合物制成。
24.本发明将来源于动物(含人体)体表分布广泛的脂肪组织作为原料,制备成肝素化dat,然后利用肝素化的dat交联负载bfgf,具有良好的促血管化及成脂特性,进一步加强该
脱细胞脂肪的脂肪再生能力;而且制备的材料无免疫原性且具有良好的成脂特性,满足标准化生产和规模化生产的要求,能够大量制备,能够预先制备和长时间保存,使患者能够即需即取,具有广阔的临床应用前景。构建方法简单易行,
25.本发明可以将制备材料注射到由天然聚合物的3d打印支架中,一起埋入体内,作为脂肪填充物用于脂肪组织的再生或重建,在活物体内诱导脂肪新生,具有很好的应用效果。
附图说明
26.图1为实施例1中的试验流程图
27.图2为兔来源脂肪组织处理前的大体照片及不同染色条件下组织学切片的荧光显微镜观察照片;组织学切片包括(dapi染色、h&e染色、油红o染色、masson染色和gomori's染色);
28.图3为兔来源脂肪组织脱细胞处理后的大体照片及大体照片及不同染色条件下组织学切片的荧光显微镜观察照片;组织学切片包括(dapi染色、h&e染色、油红o染色、masson染色和gomori's染色);
29.图4为实施例一中兔来源dat的扫描电镜图;
30.图5为肝素化兔来源dat和未肝素化兔来源dat甲苯胺蓝染色后的大体照对比图;
31.图6为负载bfgf的肝素化兔来源dat及负载bfgf的未肝素化兔来源datbfgf累计释放量曲线对比图;
32.图7为负载bfgf的肝素化兔来源dat及负载bfgf的未肝素化兔来源dat负载的bfgf百分比释放曲线对比图;
33.图8为实施例二中剪碎后用于注射的负载bfgf的肝素化dat材料;
34.图9为实施例二中3d打印的聚己内酯支架的示意图;
35.图10为实施例二中将注射后的聚己内酯支架植入新西兰大白兔皮下的照片;
36.图11为实施例二中负载bfgf的肝素化兔来源dat注射至聚己内酯支架后,埋入兔子皮下12w后,取材后的大体照;
37.图12为实施例二中负载bfgf的肝素化兔来源dat注射至聚己内酯支架后,埋入兔子皮下12w后,取材后切片he染色结果。
具体实施方式
38.下面结合实施例对本发明进行详细阐述,以使本发明的优点和特征能更易于被本领域技术人员理解,从而对本发明的保护范围做出更为清楚明确的界定。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施例,都属于本发明所保护的范围。
39.实施例一中步骤(1)的去离子水和pbs缓冲液中均按照质量体积比加入100u/ml青霉素、0.1mg/ml链霉素、0.25μg/ml两性霉素b;步骤(2)的含edc/nhs的mes缓冲液、na2hpo4溶液、nacl溶液在配置后均用0.22μm除菌过滤器过滤后并保存于无菌容器中。
40.实施例一针对兔来源的脂肪作为原料制备负载bfgf的肝素化脱细胞脂肪材料的
制备方法,其流程如图1所示,具体制备过程如下:
41.(1)dat的制备:
42.a.取新鲜兔来源的50g脂肪分装于50ml离心管,加入1mol/l高渗氯化钠溶液,振荡处理1h,然后置于
‑
80℃至37℃冷冻复融3~5次,每次1h,然后将冻融的新鲜兔来源脂肪切碎成0.5
×
0.5cm小块;
43.b.将步骤a中切碎的兔来源脂肪置于质量浓度0.25%的trypsin
‑
edta消化液中振荡消化16h后,然后用pbs缓冲液洗涤3次,每次30min,每次洗涤过程后,取脂肪于培养皿中,用镊子人工挤压,直至油脂析出;然后置于质量浓度为99.9%的异丙醇中振荡浸泡处理48h,每24h换液一次,并用pbs缓冲液洗涤后再次用体积浓度为3%的triton x
‑
100去污剂振荡消化1h~2h,pbs缓冲液洗涤3~5次后,再次在0.25%trypsin
‑
edta消化液中振荡消化4h~6h。;
44.c.将步骤b中振荡消化后的脂肪采用pbs缓冲液洗涤,并使用benzonase浓度为100u/ml的pbs溶液振荡处理16h,再次使用质量浓度为99.9%的异丙醇振荡浸泡处理8h后,采用pbs缓冲液洗涤3次,最后使用含有过氧乙酸的乙醇水溶液浸泡洗涤3次得到灭菌后的脱细胞脂肪,每次浸泡时间为30min;所述含有过氧乙酸的乙醇水溶液中过氧乙酸的体积百分比为0.1%,乙醇的体积百分比为4%;最后将制备的dat储存在无菌pbs缓冲液中。
45.(2)肝素化dat的制备
46.a.配置20ml浓度为0.1mol/l的2
‑
(n
‑
吗啉)乙磺酸(mes)缓冲液,并向其中加入5mm的edc(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)及3mm的nhs(n
‑
羟基琥珀酰亚胺)及肝素钠,室温孵育30min配制成mes缓冲液混合溶液;
47.b.取400mg步骤(1)中制备的dat加入上述配制成mes缓冲液混合溶液中,并在室温(25℃)下按照振荡频率60rpm~120rpm振荡反应16h得到肝素化dat;将反应后的肝素化dat使用0.1m的na2hpo4溶液洗涤1h后,用4m的nacl溶液洗涤3次,每次30min,最后用去离子水洗涤3次,每次30min,无菌保存。
48.(3)负载bfgf的肝素化dat的制备:取100mg步骤(2)中制备的肝素化dat,浸泡于500μl浓度为1μg/ml的无菌bfgf溶液中,在4℃孵育16h;取出反应后的肝素化dat,用无菌去离子水清洗3次,每次5min,洗脱未交联的bfgf后即得到负载bfgf的肝素化dat材料,在4℃无菌保存。
49.针对实施例一中制备的dat、肝素化dat和负载bfgf的肝素化dat材料进行以下试验研究:
50.对比试验一:将未处理的新鲜兔来源脂肪与实施例一步骤(1)中脱细胞过程处理后得到脱细胞脂肪的肉眼观察及各种染色后的组织学切片进行对比观察,其观察结果如图2和图3,其中图2是为兔来源脂肪组织处理前的大体照片及不同染色条件下组织学切片的荧光显微镜观察照片,图2中从左到右,从上到下依次为大体照片、dapi染色、h&e染色、油红o染色、masson染色和gomori's染色的荧光显微镜观察照片;图3为兔来源脂肪组织脱细胞处理后的大体照片及大体照片及不同染色条件下组织学切片的荧光显微镜观察照片,图3中从左到右,从上到下依次为大体照片、dapi染色、h&e染色、油红o染色、masson染色和gomori's染色的荧光显微镜观察照片。并将实施例一步骤(1)中制备的脱细胞脂肪冻干后在电镜下进行观察,其观察结果如图4所示,图4中四张照片分别为扫描电镜下观察到不同
放大比例的照片。从图2至图4可以看出,本脱细胞处理过程可较好地除去脂肪组织内的油滴及细胞核结构的同时,较大幅度保存了其细胞外基质如胶原等成分,其细胞外基质超微结构未得到明显破坏。
51.对比试验二:将步骤(2)中肝素化dat和步骤(1)中制备的dat采用甲苯胺蓝染色后进行大体观察,结果如图5所示,肝素化dat染色较深,表明附着的肝素含量较高,证实该交联反应过程可较好地将肝素修饰于dat。
52.对比试验三:采用实施例一步骤(1)中制备的dat直接采用步骤(3)的处理方式负载bfgf得到负载bfgf未肝素化dat;然后将实施例一中制备的100mg负载bfgf的肝素化dat材料和100mg负载bfgf未肝素化dat分别浸泡于1ml无菌pbs缓冲液后,并在37℃下孵育。收集不同时间点(1/3/5/7/9/11/13天)含释放bfgf的pbs缓冲液,每次收集后,将上述dat转移到含有1ml新pbs缓冲液的中,通过elisa试剂盒(peprotech,900
‑
k08)检测2周内bfgf的释放量。通过测定洗脱液和孵育液中残留bfgf的含量,计算出不同dat的bfgf负载率,根据结果绘制出曲线,具体如6和图7所示,相比于未肝素化dat,肝素化dat可在2周内较稳定地释放出bfgf。
53.实施例二:将实施例一中制备的肝素化dat的在大白兔体内进行应用,其具体步骤如下:
54.(1)手术前一天,将200mg~300mg制备的肝素化dat用剪刀彻底切碎,直至形成均匀的凝胶状匀浆,将剪碎的肝素化dat与500μl、浓度为2μg/ml的无菌bfgf溶液通过涡轮振荡搅拌均匀,4℃孵育16h~24h;
55.(2)采用2%异氟烷麻醉新西兰大白兔后,兔子侧卧位,备皮,1%活力碘消毒皮肤,铺巾;取兔子侧腹部皮肤做3cm
‑
4cm纵向切口,分离皮下组织,谨慎操作以避免损伤,彻底止血;
56.(3)将步骤(1)制备的负载bfgf的肝素化dat转移至1ml注射器(如图8所示),用18号针头均匀注射至3d打印的聚己内酯支架中(如图9所示);
57.(4)将支架随后埋入新西兰大白兔皮下,固定稳妥后,分层缝合(如图10所示),术毕,实验动物随机分笼饲养,并连续7天注射适量头孢类抗生素以预防感染,在连续饲养12周后,兔子被过量麻醉处死并取材直接观察结果如图11所示。
58.图11显示了负载bfgf的肝素化dat注射入pcl支架并埋入新西兰大白兔后,12周后取材,大体照可见支架已被新生组织紧紧包裹,纵切面示部分支架内部充满新生黄白色脂肪样组织,可见明显新生血管出血点。
59.并将步骤(4)中取出的脂肪组织进行组织学分析,采用中央纵向切片方式,并通过he染色,其结果如图12所示,pcl支架内部充满大量脂肪空泡,证实为新生的脂肪组织,新生的脂肪与支架内部支柱贴合,几乎无包膜形成,同时可见大量新生血管的形成。
60.综上所述,本发明利用肝素化的dat交联负载bfgf,具有较好的缓释特性。本发明的构建方法简单易行,能够大量制备,并可长时间保存,具有广泛的临床应用潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1