一种脑靶向的神经保护剂SS31-HA-RT及其制备方法和应用
一种脑靶向的神经保护剂ss31
‑
ha
‑
rt及其制备方法和应用
技术领域
1.本发明属于生物制药领域,涉及一种神经保护剂,特别是指一种脑靶向的神经保护剂ss31
‑
ha
‑
rt及其制备方法和应用。
背景技术:
2.脑卒中是一种常见的脑血管疾病,具有高致残率和高致死率的特点,且该病的发病率逐年升高。据调查显示,中国目前罹患中风人数约有1300万,其中缺血性中风患者占80%,中风导致的死亡人数占总死亡人口的20%,且存活患者中有50%~70%的患者留下严重残疾,给家庭及社会带来沉重的负担。目前脑缺血的首选治疗方案是恢复缺血区供血,然而恢复灌注后,过量活性氧的产生、炎症因子的大量募集及细胞异常死亡会进一步加剧神经损伤。该过程受多种分子机制调控,由氧化应激引起的缺血性级联瀑布反应是导致神经细胞死亡的核心原因,机体的抗氧化活性则是急性脑缺血发生后发挥神经保护作用的重要因素。然而迄今,唯一批准临床有效的自由基清除剂依达拉奉被撤出我国医保,低毒高效的抗氧化类神经保护药物研发迫在眉睫。
3.ss31最早是由peter w. schiller和hazel h. szeto合成的线粒体靶向肽。ss31的分子结构为 h
‑
d
‑
arg
‑
dmt
‑
lys
‑
phe
‑
nh2,其分子量小,为639.8da。该多肽由于包含了一个交替的芳香族阳离子基序,从而使其可以自由透过细胞膜,以非能量依赖、无饱和性的形式浓聚于线粒体内膜上。ss31在体外证实可以剂量依赖的方式清除线粒体ros,抑制脂质过氧化;体内已有研究证实ss31能保护氧化应激引起小鼠感光细胞、人晶状体上皮细胞以及rpe细胞的氧化应激、线粒体损伤,逆转凋亡损伤。
4.虽然现有研究表明ss31分子可以靶向线粒体,但是由于ss31在进入体内发挥的药效学作用有限,且主要是针对线粒体相关的损伤产生的轻微修复,因此本课题组一直致力于研究如何最大程度的发挥ss31的作用。
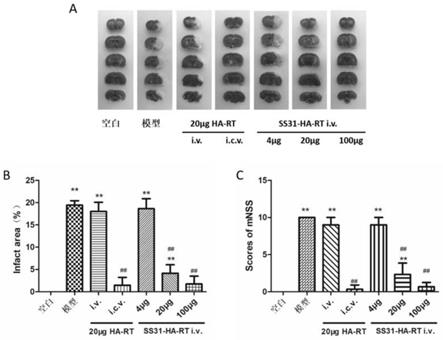
5.透明质酸(hyaluronic acid,ha)是一种天然带负电荷的大分子链粘多糖,由两个双糖单元d
‑
葡萄糖醛酸和n
‑
乙酰氨基葡萄糖组成。它广泛存在于动物和人类的不同组织中。它具有高亲水性、高粘弹性、生物降解性、低致敏性、良好的生物相容性以及与细胞表面特异性受体结合的能力,可作为药物载体。研究发现ha的特异性受体cd44在多种癌细胞表面及特殊病理区域有高表达。利用ha与特异性受体结合的特性,多种药物可被输送到病理部位,不仅可以减少药物对正常细胞的毒副作用,还能提高药物的生物利用度和疗效,降低给药频率,提高顺应性。此外,透明质酸酶的组织分布差异也可实现ha枝接化合物的定向释放。目前,ha及其衍生物已被用作多种小分子药物、多肽和蛋白药物的载体。它可以较好的增加不溶药物的水溶性、并且利用与cd44受体的结合实现靶向富集作用。我们则借助cd44及透明质酸酶在缺血脑区的特异性增加,利用ha枝接药物,实现药物的靶点富集和靶向释放。
6.芦丁(rutin,rt)又称芸香苷,属于生物类黄酮,具有多种药理活性。芦丁归类为维生素p,可增加毛细血管的韧性,调节其渗透性,具有降血脂、细胞保护、抗痉挛作用及预防
和治疗心血管疾病的意义。目前,中国芦丁的产量主要来自于槐米,其含量可高达40%,作为医药和食品的两用工厂,槐米价格低廉,无毒无害,在分布和应用上都相当广泛。研究表明芦丁具有较好的神经保护作用,然而其低水溶性及难以透过血脑屏障的特点大大限制了其临床使用。
7.为了提高药物的水溶性并促进其穿过血脑屏障的能力、增加其在病灶区的富集与靶向,本课题组对芦丁进行了一系列修饰、改造及体内外评价实验。
技术实现要素:
8.为解决上述技术问题,本发明提供了一种脑靶向的神经保护剂ss31
‑
ha
‑
rt及其制备方法和应用。
9.本发明的技术方案是这样实现的:一种脑靶向的神经保护剂ss31
‑
ha
‑
rt,其结构式如下:式中,rt为,ss31为
。
10.上述的神经保护剂ss31
‑
ha
‑
rt的制备方法,步骤如下:(1)向ha水溶液中加入活化剂ⅰ活化2h,再加入rt溶液,在氩气保护下反应 12h,经透析、过滤得产物ha
‑
rt;其技术路线如下:rt;其技术路线如下:式中:n为22~26,p为9~10,q为13~16。
11.(2)将步骤(1)的产物ha
‑
rt溶于双蒸水中配制ha
‑
rt溶液,加入活化剂ⅱ活化2h,再加入多肽ss
‑
31溶液,在氩气保护下反应 12h,经透析、过滤得神经保护剂ss31
‑
ha
‑
rt;其技术路线如下:
式中:p为9~10,q为13~16,r为1~2,s为12~14。
12.所述步骤(1)中ha水溶液的摩尔浓度为0.25mmol/ml,rt溶液的溶剂为dmf、浓度为2 mmol/ml。
13.所述ha、活化剂ⅰ、rt的摩尔比为1:4:1.5,其中活化剂ⅰ为edc
·
hcl。
14.所述步骤(2)中ha
‑
rt溶液的摩尔浓度为0.25mmol/ml,多肽ss
‑
31溶液的溶剂为dmf、浓度为30 mmol/ml。
15.所述ha
‑
rt、活化剂ⅱ、多肽ss
‑
31的摩尔比为0.5:2:0.05。
16.透析采用的透析液为双蒸水、过滤采用的微孔滤膜的直径为0.45μm。
17.上述的神经保护剂ss31
‑
ha
‑
r在制备穿透血脑屏障保护神经元药物中的应用。
18.上述的神经保护剂ss31
‑
ha
‑
r在制备促进血管生成、抗炎、抗氧化药物中的应用。
19.上述的神经保护剂ss31
‑
ha
‑
r作为改善脑梗死药物的应用,其使用浓度为100μg/250g。
20.本发明具有以下有益效果:1、本技术制备的神经保护剂,在尾静脉给予ss31
‑
ha
‑
rt 20μg,同时脑梗死体积较相同剂量、相同给药方式的ha
‑
rt组作用有极显著提高(平均梗死体积从17.8%降至4.2%),下降了76.4%;几乎与同剂量侧脑室注射组的产生保护效果相似。当加大剂量尾静脉给予100μg ss31
‑
ha
‑
rt,其作用效果更优,几乎100%逆转了mcao造成的梗死损伤。本技术合成的ss31
‑
ha
‑
rt与模型组和相同剂量、相同给药方式的ha
‑
rt组相比,均具有极显著性改善作用,表明接上ss31能够明显增效ha
‑
rt的作用,达到了1+1大于2的效果,对于mcao大鼠的行为学具有显著改善作用。
21.2、本技术通过化学合成的方法将rt接枝到ha上合成ha
‑
rt,再将ss31接枝到ha上合成ss31
‑
ha
‑
rt,通过体内外实验,证明该化合物具有良好的缺血性脑卒中的神经保护效果;具有较好的促血管生成、抗炎、抗氧化功能。
22.3、采用大脑中动脉阻塞再灌注法制作急性脑缺血大鼠模型,造模1h时给药,2h时
复灌,ttc法和神经评分检测复灌24h后mcao大鼠脑梗死程度,证实ss31
‑
ha
‑
rt的脑缺血保护作用。检测缺血脑组织与正常脑中cd44和透明质酸酶的表达差异,证实ss31
‑
ha
‑
rt在缺血脑区富集、发挥作用的优势基础。采用he、尼氏染色、免疫组织化学和试剂盒检测的方法,检测各组大鼠脑内尼氏体的损伤情况、小胶质细胞活化情况、血管生成情况及抗氧化情况等,证实ss31
‑
ha
‑
rt通过抑制炎症、促进血管生成、降低氧化应激保护神经元的作用。采用模式动物斑马鱼造模给药后检测,进一步证实ss31
‑
ha
‑
rt具有普适的促血管生成,抗炎,抗氧化的效果。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
24.图1为透明质酸(ha)的1h
‑
nmr图谱。
25.图2为芦丁(rt)的1h
‑
nmr图谱。
26.图3为透明质酸
‑
芦丁(ha
‑
rt)的1h
‑
nmr图谱。
27.图4为目标产物ss31
‑
透明质酸
‑
芦丁(ss31
‑
ha
‑
rt)的1h
‑
nmr图谱。
28.图5为大脑中动脉阻塞再灌注法制作急性脑缺血大鼠模型实验时,ss31
‑
ha
‑
rt对大鼠脑梗程度的改善。图a为大鼠ttc染色即脑梗死体积变化图像;图b为大鼠ttc染色后脑梗死体积变化统计图;图c为大鼠行为学评分变化结果统计图。
29.图6为大鼠脑组织缺血侧与正常侧cd44和透明质酸酶(hyaluronidase
‑
1)的表达差异。
30.图7为大鼠脑组织药物对损伤保护的染色结果。图a为为脑组织he染色结果图;图b为脑组织皮层区(上)及海马区(下)尼氏体染色结果图;图c为脑组织炎症标记物iba1、tnf
‑
α、血管新生标记物cd31、ki67的免疫组化染色结果图。
31.图8为大鼠脑组织药物对损伤保护的氧化应激相关指标的检测结果。图a为脑内脂质氧化产物丙二醛(mda)含量的检测,图b为脑内谷胱甘肽(gsh)的含量检测。
32.图9为药物对斑马鱼神经保护的作用。图a为对斑马鱼运动轨迹的代表图像;图b为神经保护结果统计图。
33.图10为药物对斑马鱼血管生成的作用。图a为斑马鱼血管生成情况的代表图像;图b为血管生成的结果统计图。
34.图11为药物对斑马鱼的抗炎作用。图a为对斑马鱼抗炎效果的图像;图b为抗炎结果统计图。
35.图12为ss31
‑
ha
‑
rt对斑马鱼的抗氧化作用。图a为对斑马鱼抗氧化效果的图像;图b为抗氧化结果统计图。
具体实施方式
36.本发明所用到的主要实验试剂及仪器设备、动物、耗材介绍如下:透明质酸购自山东福瑞达公司,无需进一步纯化即可使用。合成过程中所有其他
试剂购自sigma chemical co .(st.louis, mo)或aladin chemical reagent inc. of shanghai。雄性sd大鼠购自河南省实验动物中心,所有实验方案均报备河南大学,并经河南大学医学院伦理委员会与实验动物福利委员会批准;tg(flk1:egfp)转基因斑马鱼由山东省科学院生物研究所斑马鱼药物筛选平台提供;230
‑
260g大鼠mcao栓线购自北京西浓科技有限公司;血管内皮细胞生长因子受体抑制剂(ptk787)购自abcam公司;ttc购于美国sigma公司;其余未说明试剂、药品等均为实验室常用分析纯类制品,不再赘述。
37.石蜡转轮式切片机, 购自德国徕卡公司;动物微透析系统(瑞典cma 402 syringe pump),购自瑞典cma公司;斑马鱼养殖饲养设备(北京爱生科技公司)。
38.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例
39.一种神经保护剂ss31
‑
ha
‑
rt的制备方法,步骤如下:首先合成并表征ha
‑
芦丁:精密称取0.379 g ha(1 mmol),溶于4 ml双蒸水中,加入0.767 g 活化剂edc
·
hcl (4 mmol)活化2 h。用3 ml dmf溶解0.916 g rt(1.5 mmol),并将其置于冰浴中预冷 10min。将rt溶液逐滴加入ha溶液中,在氩气保护下反应 12h。采用透析法除去杂质,透析液为双蒸水。将终反应液用微孔滤膜(0.45μm)过滤,冷冻干燥,得到最终产物(亮黄色固体) 0.567 g ha
‑
rt(产率91%,rt接枝率约40%)然后合成并表征ss31
‑
ha
‑
芦丁:精密称取0.312 g ha
‑
rt(0.5 mmol),溶于2ml双蒸水中,加入 活化剂0.384 g edc
·
hcl (2 mmol)活化2 h。用1.5 ml dmf溶解多肽ss
‑
31 0.032 g(0.05 mmol),并将其置于冰浴中预冷 10min。将混合溶液逐滴加入ha
‑
rt溶液中,在氩气保护下反应 12h。采用透析法除去杂质,透析液为双蒸水。将终反应液用微孔滤膜(0.45μm)过滤,冷冻干燥,得到最终产物 0.315 g ss31
‑
ha
‑
rt(产率96%,ss
‑
31接枝率约5% )。
40.ha、rt、ha
‑
rt 、ss31
‑
ha
‑
rt的1h
‑
nmr详见图1
‑
4。
41.应用例1为检测ss31
‑
ha
‑
rt对mcao大鼠的神经保护作用,进行了如下实验。
42.(1)首先采用ttc染色法确定ss31
‑
ha
‑
rt对大鼠mcao后脑梗死体积的影响,具体过程如下:通过longa改良线栓法对大鼠行右侧脑基底动脉环分支中动脉阻塞再灌注手术。动物手术前控制饮食(禁食12小时),但不限制饮水。按大鼠体重3 mg:kg
‑1腹腔注射10 %水合氯醛溶液至麻醉状态,麻醉状态不宜过深。大鼠麻醉后呈仰卧姿势固定,大致去毛备皮(也可以用脱毛膏去毛)。颈部皮肤用碘伏润湿消毒。沿颈部下颌骨下方中部偏右侧开口,钝性分离的各层组织,用眼科剪剪开包裹在迷走神经及颈总动脉的膜,用玻璃分针钝性分离
紧贴着颈总动脉的迷走神经,暴露右侧颈总动脉(cca)。在颈总动脉的远心端分离出颈外动脉(eca)和颈内动脉(ica)。在颈总动脉(cca)的近心端和颈内动脉(ica)的下方穿根4
‑
0 线牵制插栓时动脉的血流 (也可用动脉夹夹住止血),在颈外动脉(eca)下方穿入两根5
‑
0线,远心端处结扎两次,结扎后从中间剪断血管。稍拉紧颈内动脉(ica)和颈总动脉(cca)的棉线以防插线栓时出血。调整eca残端方向与ica呈条直线,在eca靠近cca的分又处切口向颅内方向插入线栓,线栓材质是4
‑
0尼龙线,直径28 um,有一定硬度,且插入血管的前段制作成稍微膨大的圆球状,插入深度约18.5士0.5mm处时感到有阻力时停止插栓,在线栓切口下方结扎以防血管切口处渗血,取下止血钳,把分离的组织恢复原状,缝合后放置加热垫保暖。手术后的大鼠经暖灯照射或者加热垫保暖,保持其肛温在37摄氏度左右。插栓2小时后,在大鼠再次麻醉状态下拔出线栓并将颈外动脉下方的细线系紧,在皮肤切口处撒上适量抗生素并标准缝合。将大鼠放回鼠笼,做好保暖措施,并给予5%葡萄糖水溶液。假手术组进行术前麻醉,分离cca、eca、ica,只在eca上系一根细线结扎,不插入线栓,作为无手术对照。
43.分别设置假手术组(sham);模型组(mcao/r);ha
‑
rt尾静脉注射组(20μg,i.v.);ha
‑
rt侧脑室给药组(20μg,i.c.v.);ss31
‑
ha
‑
rt低剂量组(4μg,i.v.);ss31
‑
ha
‑
rt中剂量组(20μg,i.v.);ss31
‑
ha
‑
rt高剂量组(100μg,i.v.)。
44.模型建立成功后,1h时给药,2h时复灌,复灌24h后取脑,ttc染色。
45.实验结果如图5 a、b所示,从图5a、b可以看出,尾静脉给药ha
‑
rt 20μg,脑梗死体积和模型组相比无显著性差异,神经保护作用较弱。侧脑室给药ha
‑
rt 20μg,相当于药物完全透过血脑屏障发挥作用,观察结果可知脑梗死体积较模型组有极其显著的差异,可有效保护受损神经。尾静脉给予ss31
‑
ha
‑
rt 20μg,脑梗死体积较相同剂量、相同给药方式的ha
‑
rt组作用有极显著提高(平均梗死体积从17.8%降至4.2%),甚至与同剂量侧脑室注射组的保护作用相似。尾静脉给予100μg ss31
‑
ha
‑
rt,其作用效果更优,几乎全部逆转了mcao造成的梗死损伤。上述药效学结果提示,经ss31修饰后ha
‑
rt入脑量得到显著升高,极大增强了ha
‑
rt的脑保护作用,对缺血性脑卒中的神经损伤有强效治疗作用。
46.(2) 采用mnss评分法确定ss31
‑
ha
‑
rt对大鼠mcao后行为学的影响,具体评价标准如下:mnss 表
神经功能评价采用改良的神经功能缺损评分(modified neurological severity scores,mnss)。它由提尾试验,运动试验和平衡木试验组成,把每个测试的分数相加得到最后的分数。三项总分相加,8
‑
12分为严重损伤,4
‑
7分为中度损伤,1
‑
3分为轻度损伤。
47.各分组实验动物取脑前按mnss评分表格细则进行行为学评分。
48.实验结果如图5c所示,从图5c可以看出,尾静脉给药ha
‑
rt 20μg,评分结果为严重损伤,与模型组相比无显著性差异,侧脑室给药ha
‑
rt 20μg,评分结果为轻度损伤,与模型组相比具有极其显著的差异。尾静脉给予相同剂量ss31
‑
ha
‑
rt 20μg,评分与侧脑室给药组效果相似,均为轻度损伤,与模型组和相同剂量、相同给药方式的ha
‑
rt组相比,均具有极显著性改善作用,提示接上ss31能够明显增效ha
‑
rt的作用,对于mcao大鼠的行为学具有显著改善作用。
49.应用例2为检测ss31
‑
ha
‑
rt对缺血脑区有特异性靶向、富集作用,使用免疫组化法检测ha特异性受体cd44和透明质酸酶(hyaluronidase
‑
1)在缺血脑区的过表达特征。为了检测ss31
‑
ha
‑
rt对mcao大鼠脑组织半影区抗炎和促血管生成的影响,进行了免疫组化实验,检测了炎症因子iba1、tnf
‑
α和血管生成因子cd31、ki67的表达。免疫组化是通过抗原抗体反应,再用dab进行显色,同时用苏木素对细胞核复染。显微镜可观察到细胞核被染上了浅蓝色,阳性细胞被染成棕黄色,对切片上棕黄色区域的累计光密度(iod) 进行统计,iod值的高低可反映该因子表达的高低。
50.实验结果如图6所示,cd44和透明质酸酶在缺血脑区表达有显著上调,提示ss31
‑
ha
‑
rt对缺血脑区有特异性靶向、富集作用。
51.如图7a所示,ss31
‑
ha
‑
rt对缺血脑区有形态学改善作用;如图7b所示,缺血区神经元尼氏小体的损伤可被从ss31
‑
ha
‑
rt有效逆转;如图c可以看出,与sham组相比,model组iba1、tnf
‑
α的表达显著提高,而cd31、ki67的表达显著降低,尾静脉给药ha
‑
rt 20μg组与
model组相比,iba1、tnf
‑
α的表达显著减少,而cd31、ki67的表达显著增多。这提示,mcao复灌模型后,大鼠缺血侧半影区炎症反应增加、血管生成减少,给药后,降低了半影区的炎症反应,促进了半影区的血管生成。
52.应用例3为检测ss31
‑
ha
‑
rt对mcao大鼠脑组织氧化应激的影响,进行了脑匀浆实验,检测指标为mda和gsh,相关过程介绍如下:(1)脑组织匀浆的制备。
53.从液氨中取出脑组织,精密称量脑组织的质量,记录数据并将脑组织用眼科剪剪碎,将组织按质量(g) :体积(ml) =1: 9的比例加入提前预冷好的pbs到玻璃匀浆器中进行研磨匀浆。匀浆的整个过程需要在冰上或冰浴中进行。匀浆充分后用移液枪吸取分装至离心管,做好标记,
‑
80℃保存,用时取出解冻,避免反复冻融。
54.(2)脑内脂质氧化产物丙二醛(mda)含量的检测。
55.将制备好的组织匀浆液解冻,1600xg, 4℃, 离心10 min去除组织及细胞碎片,取上清用于测定分析。参照脂质氧化(mda) 检测试剂盒说明书进行操作。在1.5 ml离心管中加入100 μl pbs作为空白对照,待测样品组加入100 μl待测组织上清液,然后每组分别加入200ul mda检测工作液,涡旋混匀,沸水浴中煮沸15 min。待其冷却至室温,室温1000xg;离心10 min。用移液枪吸取200 ul.上清加入到96孔板中,在532 nm处测定各组吸光度,记录数据。
56.实验结果如图8a所示,与sham组相比,mcao复灌后,大鼠脑组织mda含量显著升高(p<0.001),说明造模后,自由基对组织的损伤加重。尾静脉给药ss31
‑
ha
‑
rt,大鼠脑组织mda含量显著降低(p<0.01),说明ss31
‑
ha
‑
rt显著改善了自由基对组织的损伤。
57.(3)脑内谷胱甘肽(gsh)的含量检测。
58.将制备好的组织匀浆液用蛋白去除试剂稀释20倍。1000
×
g,4℃,离心10min,取上清进行测定分析。参照gsh检测试剂盒实验步骤进行操作。在96孔板中分别加入空白对照液及待测样品,每组设三个复孔,按要求加入提前配置好的总谷胱甘肽检测工作液,混匀,25 ℃反应5 min。最后加入50 μl 0.5 mg/ml nadph溶液,混匀,反应20 min后用酶标仪在412 nm波长处测定吸光度。记录实验数据,处理实验结果。
59.实验结果如图8b所示,与sham组相比,mcao/r后,大鼠脑组织gsh含量显著降低(p<0.001),说明造模后,脑组织清除自由基、抗氧化的生理功能减弱。尾静脉给药ss31
‑
ha
‑
rt,大鼠脑组织gsh含量显著升高(p<0.01),说明ss31
‑
ha
‑
rt显著增强了脑组织清除自由基、抗氧化的生理功能。
60.应用例4为检测ss31
‑
ha
‑
rt对神经保护、血管生成、抗炎、抗氧化的普适性作用,发明人应用神经狂躁斑马鱼模型、血管生成抑制斑马鱼模型、炎症斑马鱼模型、氧化应激斑马鱼模型,做了进一步的检测实验, 相关过程介绍如下。
61.(1)斑马鱼胚胎获取。
62.雄/雌斑马鱼分别在28℃,光照14小时/黑暗10小时的标准化条件下饲养,定期喂草履虫和丰年虾。用卵时取健康性成熟的斑马鱼按1:1的雌雄比例放入交配缸内,次日10:00时获得受精卵。对受精卵进行消毒和洗涤后移入斑马鱼胚胎培养用水(含5.0 mm nacl,
0.17mm kcl,0.4 mm cacl2,0.16 mm mgso4)中,28℃下控光培养。
63.(2)ss31
‑
ha
‑
rt对斑马鱼的神经保护作用。
64.在120 hpf,每个浓度组取18条ab系斑马鱼幼鱼,使用48孔板,每孔放1条斑马鱼幼鱼。浓度组设为:空白对照组(斑马鱼胚胎培养用水)、造模组(15mm ptz)、ss31
‑
ha
‑
rt组(15mm ptz+5、10、20μm ss31
‑
ha
‑
rt)。使用zebralab (viewpoint, lyon, france) 分析各浓度组斑马鱼的行为学变化,并记录20 min内斑马鱼幼鱼在20min内运动的平均速度(mm min
‑
1)。
[0065] 实验结果如图9所示,由斑马鱼幼鱼的运动轨迹图和数据图可以看出,与空白对照组相比,造模药(15mm ptz)会引起斑马鱼狂躁,导致斑马鱼运动速度加快;与造模组相比,不同浓度的ss31
‑
ha
‑
rt组对ptz引起的斑马鱼运动能力加快(狂躁)有明显的抑制作用。由此证实,不同浓度的ss31
‑
ha
‑
rt对神经异常的斑马鱼具有一定的神经保护作用。
[0066]
(3)ss31
‑
ha
‑
rt对斑马鱼促血管生成的影响。
[0067]
在受精卵发育24 h时,使用1.0mg/ml链酶蛋白酶e溶液脱去卵膜。在体视显微镜下挑选正常的斑马鱼胚胎,移入24孔培养板中,每孔10枚,每组三个重复孔。浓度组设为:空白对照组(斑马鱼胚胎培养用水)、造模组(0.2μg/ml pkt787)、阳性药组(0.2μg/ml pkt787+10μl/ml dh)、ss31
‑
ha
‑
rt组(0.2μg/ml pkt787+5、10、20μm ss31
‑
ha
‑
rt)。然后置于28℃光照培养中培育。在48 hpf时,体视显微镜下荧光拍摄观察斑马鱼体节间血管(intersegmental vessels isvs)生成情况,计算体节间血管生成长度。
[0068]
实验结果如图10所示,造模药(0.2μg/ml pkt787)对斑马鱼体节间血管具有显著的抑制作用,阳性药(10μl/ml dh)具有显著的促血管活性,不同浓度的ss31
‑
ha
‑
rt对pkt787造成的血管抑制均有显著的促血管生成活性。
[0069]
(4)ss31
‑
ha
‑
rt对斑马鱼幼鱼的抗炎作用。
[0070]
在体视显微镜下挑选正常的72 hpf 的tg(zlyz
‑
egfp)转基因斑马鱼,小心移入6孔板的样孔中,每孔30尾幼鱼。设定空白对照组(斑马鱼胚胎培养用水)、造模组(20μm cuso4)、阳性药组(20μm cuso4+20μm ibuprofen)和样品组(20μm cuso4+5、10、20μm ss31
‑
ha
‑
rt),每个浓度组设3个重复孔。不同浓度的样品作用斑马鱼6 h后,加入20μm cuso4,作用1 h后,用斑马鱼胚胎培养用水清洗3遍,然后在荧光显微镜下对每条斑马鱼幼鱼进行拍照,并通过image
‑
pro plus软件计数巨噬细胞数量。
[0071]
实验结果如图11所示,用20μm cuso4处理斑马鱼幼鱼可显著增加神经柱周围巨噬细胞的数量,造成炎症反应。阳性药(ibuprofen)可显著减少cuso4引起的巨噬细胞的积累,并减少神经柱周围巨噬细胞的数量,同样不同浓度的ss31
‑
ha
‑
rt组也显著减少神经柱周围巨噬细胞的数量,因此推测,样品组和阳性药组有同样的抗炎作用。
[0072]
(5)ss31
‑
ha
‑
rt对斑马鱼幼鱼的抗氧化作用。
[0073]
在受精卵发育24 h时,使用1.0mg/ml链酶蛋白酶e溶液脱去卵膜。在体视显微镜下挑选正常的斑马鱼胚胎,移入24孔培养板中,每孔10枚,每组三个重复孔。浓度组设为:空白对照组(斑马鱼胚胎培养用水)、造模组(5mm mtz)、阳性药组(5mm mtz +100μl/ml vitamin c)、浓度组(5mm mtz +5、10、20μm ss31
‑
ha
‑
rt)。然后置于28℃光照培养中培育。在48 hpf时,体视显微镜下荧光拍摄观察斑马鱼皮肤荧光斑点,并通过image
‑
pro plus软件对皮肤荧光斑点数目进行计数。
[0074]
实验结果如图12所示,斑马鱼经甲硝唑(mtz)处理后,表达氮还原酶(ntr)的转基因斑马鱼的特殊细胞被有效地去除,在特定的组织或细胞中迅速产生活性氧(ros)。由于ros过量产生可诱导凋亡,抗氧化剂可通过有效抑制ros的生成促进脱落细胞的再生。因此,我们将mtz处理的tg (krt4:ntr
‑
hkikgr)cy17斑马鱼作为体内研究ros相关药物干预的理想模型,其中ntr
‑
hkikgr融合蛋白在皮肤特异性krt4启动子的控制下过表达。对于tg (krt4:ntr
‑
hkikgr)cy17斑马鱼,mtz处理可导致ros过量产生,皮肤细胞凋亡,皮肤荧光斑点减少。因此,本模型通过测定tg (krt4:ntr
‑
hkikgr)cy17转基因斑马鱼皮肤上荧光斑点(fluorescent spots)的生长速率来评估样品的ros清除能力。具有抗氧化活性的样品可以清除转基因斑马鱼体内的ros,防止皮肤细胞凋亡。因此,观察到皮肤荧光点数目的增加。图中斑马鱼皮肤荧光结果可视化结果显示,与模型组相比,浓度为5、10、20μm的ss31
‑
ha
‑
rt使斑马鱼皮肤荧光点显著增加,提示ss31
‑
ha
‑
rt有较好的的抗氧化作用。
[0075]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1