一种调节PRV感染的组合物及其应用
一种调节prv感染的组合物及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种调节prv感染的组合物及其应用。
背景技术:
2.伪狂犬病(pseudorabies,pr又称aujeszky’s disease,ad)是一种由伪狂犬病病毒(pseudorabies virus,prv)引起的病毒性疾病。自20世纪80年代以来一直在全球范围内传播,经典伪狂犬病毒于1902年首次被分离出来。伪狂犬病毒具有极强的传染性,猪是自然宿主,感染伪狂犬病毒之后会通过排泄物和其他身体分泌物排出大量病毒。伪狂犬病毒主要通过直接接触传播,但也可能通过空气、水和受污染的污染物传播。不同年龄不同健康状况的猪感染伪狂犬病毒表现出的症状有所差异。成年猪感染多表现为呼吸系统症状,发病率高但死亡率较低。哺乳期仔猪感染表现为体温升高,食欲不振。随着感染的进一步发展,病猪逐步表现出中枢神经症状,如震颤、旋转、麻痹等,死亡率接近100%。怀孕母猪感染该病毒一般表现为流产、产死胎,容易造成母猪不孕症。用prv减毒活疫苗株bartha-k61疫苗免疫猪,可有效控制病毒传播,但是不能防止病毒感染。
3.prv病毒属于疱疹病毒科α疱疹病毒亚科痘病毒属,与同属的人疱疹病毒1型(hsv-1)在进化上同源性最高,属于相同分支。prv病毒粒子为圆形或椭圆形,从里到外依次由病毒核酸、衣壳、被膜以及囊膜组成。核酸位于二十面体的衣壳内,被膜在衣壳和囊膜之间,有两层,分别与衣壳蛋白和囊膜蛋白相连。prv的基因组大小为147kb,基因组呈现线状双链dna,g+c含量高达74%,有两个独特区,分别为长独特区(ul)和短独特区(us)以及位于us两侧的内部重复序列(irs)和末端反向重复序列(trs)。根据表达时间的不同,prv基因分为即早期基因、早期基因和晚期基因,能编码多达70个蛋白质。
4.早期蛋白质ep0是hsv-1蛋白icp0的同系物。ep0在n端具有环指结构域(氨基酸1-84),与1型单纯疱疹病毒hsv-1的icp0蛋白,带状疱疹vzv的orf61蛋白和马疱疹病毒1型bhv-1蛋白bicp0的ring-finger区域高度同源。prv ep0和ie180合作激活病毒基因转录和增强病毒dna的传染性。另外,ep0的环指结构域和酸性区域(氨基酸114-242)是必需的反式激活区域。ep0缺陷重组伪狂犬病病毒的研究表明,ep0基因对伪狂犬病病毒是非必需的但可能对从潜伏状态中重新激活很重要。ep0可以激活由tata启动子启动转录的蛋白质。ep0是转录因子,能激活许多病毒蛋白的表达如ie180、ul23和us4。而ep0对其他疱疹病毒的同源蛋白也有转录因子活性,如vzv病毒的orf29基因,hsv-1病毒的ul23(胸苷激酶)基因和猴病毒40(sv40)早期基因。然而,ep0对ul41(vhs)与ge基因的启动子活性具有抑制作用。
5.dna损伤反应(dnadamage response,ddr)是细胞为了对抗dna损伤带来的威胁,进化出的一种检测并修复损伤的机制。dna双链断裂主要通过非同源末端连接(nhej)和同源重组(hr)两种方式修复。nhej只是简单地连接双螺旋,没有或很少加工,而hr则需要通过特定的核酸酶加工dsb末端形成一个3'-ssdna,并依赖于这3'-ssdna尾部与完整的同源序列的识别和配对。
6.非同源末端连接修复(nhej)发生于整个细胞周期中,不依赖于同源dna序列。nhej
的第一步是异源二聚体蛋白质ku70和ku80形成环状结合到dna受损部位,从而保护dna免受核酸酶过度切割。在与dna结合之后ku异源二聚体招募并结合催化亚基dna-pkcs,从而形成了有活性的dna-pk全酶。dna-pkcs与单链dna结合后激活发挥ser/thr激酶活性。它的目标之一是xrcc4,它与dna连接酶iv(ligase iv,lig iv)形成稳定的复合物。xrcc4-连接酶iv复合体结合到末端dna分子和双链dna连接在一起具有互补而非连接端的分子。xrcc4-连接酶iv复合物不能直接重新连接断裂dna,必须先对dna断端进行处理。dsbs的处理主要是由mre11-rad50-nbs1复合物发挥核酸外切酶,核酸内切酶核酸酶和解旋酶活性去除3
′
端多余的dna。另一种参与了nhej是具有单链特异性外切酶活性的artemis蛋白,被dna-pkcs磷酸化后获得内切酶活性。artemis与dna-pkcs相互作用被dna-pkcs磷酸化激活,进而对dna断端进行切割,使其形成适合连接酶连接的结构。聚合酶polμ主要具有模板独立的聚合酶活性,而polλ主要具有模板依赖的聚合酶活性,形成末端微同源臂。在微同源臂存在时不需要ku蛋白与dna结合,而没有微同源臂时ku蛋白与dna末端的结合则显得尤为重要,ku蛋白能够介导xrcc4/连接酶iv复合物与dna末端的结合。同时xlf与paxx也被发现具有协助连接酶iv连接的功能,两者在结构上与xrcc4非常相似。xlf与paxx均能分别形成同源二聚体,与ku-dna结合,主要功能是将断裂dna的两个断端拉近并固定,方便连接酶iv发挥连接酶活性将dna断端连接。总之,nhej通路以一种灵活的方式利用蛋白质识别、切割、聚合和连接dna末端。这种灵活性允许nhej在广泛的dna末端构型上发挥作用,然而修复后的dna连接通常包含突变。
技术实现要素:
7.本发明的目的在于提供一种安全无害、无传染性、高特异性和高敏感性的调节prv感染的组合物及其应用。
8.为实现上述目的,本发明采用的技术方案为:
9.一种调节prv感染的组合物,所述的组合物含有ku蛋白。
10.进一步的,所述的组合物至少包含ku70蛋白或ku80蛋白中的一种。
11.进一步的,所述的ku蛋白通过nhej信号通路调节prv复制。
12.本发明还提供一种调节prv感染的制剂。
13.一种调节prv感染的制剂,其含有所述的ku蛋白和药学上可接受的载剂。
14.本发明还提供一种抑制prv感染的组合物的应用。
15.一种调节prv感染的组合物的应用,所述的组合物在抑制prv复制中的应用。
16.本发明还提供另一种抑制prv感染的组合物的应用。
17.一种调节prv感染的组合物的应用,所述的组合物在在制备抗prv中的应用。
18.本发明还提供一种促进prv复制的组合物的应用。
19.一种调节prv感染的组合物的应用,所述的组合物在促进prv复制中的应用。
20.本发明还提供一种抑制prv感染的组合物的用途。
21.ku蛋白在制备抑制prv感染的药物中的用途。
22.本发明还提供一种促进prv复制的组合物的用途。
23.ku蛋白在制备促进prv复制的试剂中的用途。
24.与现有技术相比,本发明提供的一种调节prv感染的组合物及其应用的优点:
25.(1)ku蛋白易于获取、无致病性、安全性高。
26.(2)ku蛋白在生产和操作时安全无害、无传染性。
27.(3)ku蛋白抑制prv感染具有高特异性和高敏感性。
附图说明
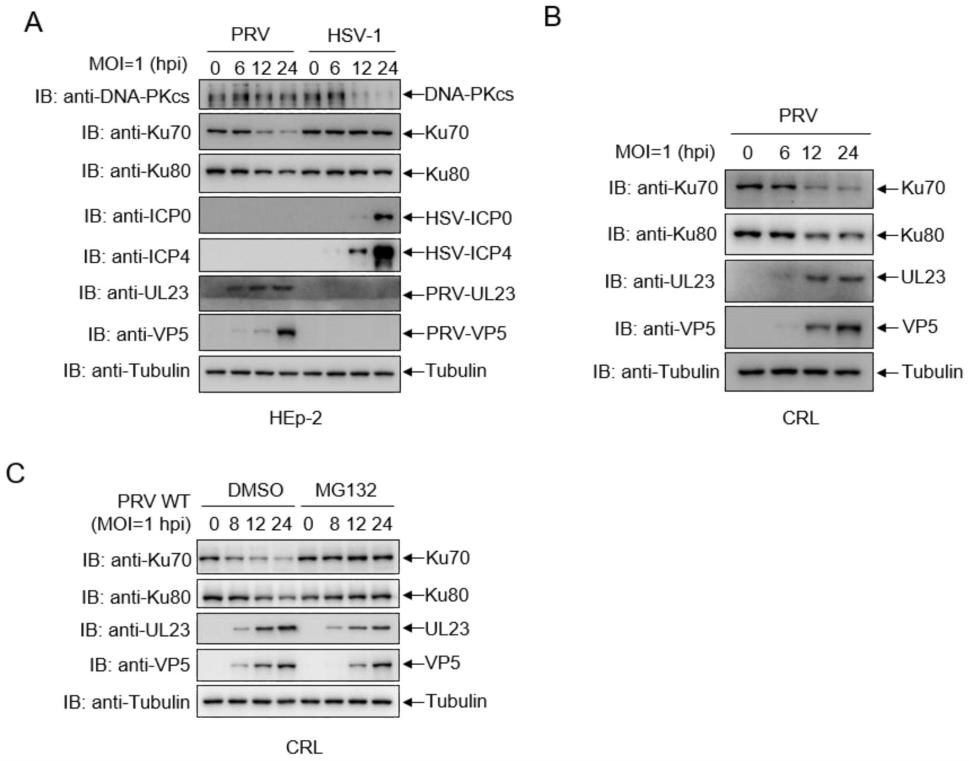
28.图1是本发明实施例6中prv对nhej信号通路的影响结果。
29.图2是本发明实施例6中prv-wt或prv-ep0 ko病毒(moi=1)分别感染hep-2细胞,分别在0、6、12、24小时收取细胞样品,western blot检测相关蛋白结果(上图)和病毒生长曲线(下图)。
30.图3是本发明实施例6中prv-wt或prv-ep0 ko病毒(moi=1)分别感染crl细胞后western blot检测相关蛋白结果(上图)和病毒生长曲线(下图)。
31.图4是本发明实施例6中将质粒flag-ev、flag-ep0(prv)、flag-icp0(hsv-1)、flag-ul18(prv)分别转染进hela细胞,24小时后收取细胞后通过western blot分析内源ku蛋白和dna-pkcs以及外源病毒蛋白的表达水平结果。
32.图5是本发明实施例6中模式图表示prv ep0蛋白ring-finger氨基酸序列与hsv-1icp0、vzv orf61以及bohv1 bicp0的ring-finger氨基酸序列比对结果。
33.图6是本发明实施例6中将flag标签的ep0、ep0 ring-finger突变体ep0(ca)和prv蛋白ul18表达质粒分别转染进hela细胞,24小时后收取细胞对相关蛋白进行检测结果。
34.图7是本发明实施例6中将flag标签的ep0、突变体ep0(ca)和prv蛋白ul18表达质粒分别转染进hela细胞,24小时后提取rna,检测ku70和ku80的mrna水平结果。
35.图8是本发明实施例6中hek293t细胞共转染flag-ku70/ku80和his-ub,6小时之后转染表达ep0的质粒,之后加mg132处理,24小时后检测ku蛋白的泛素化修饰结果。
36.图9是本发明实施例6中hek293t细胞共转染ha-ku70/ku80与flag-ep0,加mg132(20nm)处理,24小时之后免疫共沉淀检测ku70与ep0的相互作用情况。
37.图10是本发明实施例6中u2os细胞转染i-scei质粒,48小时之后感染prv-wt或prv-ep0 ko病毒(moi=1),24小时之后收取细胞流式细胞术检测表达gfp细胞量的结果。
38.图11是本发明实施例6中检测病毒感染细胞的ku蛋白以及病毒蛋白表达情况。数据为三次实验独立重复的结果,统计学分析方法为two-way anova test,*p<0.05;**p<0.01;***p<0.001。
39.图12是本发明实施例7中hep-2细胞分别转染si-control、si-ku70和si-ku80,之后感染病毒prv-wt或prv-ep0 ko(moi=1),通过western blot检测prv蛋白的表达情况(上图和中图),同时收取细胞上清检测病毒滴度(下图)。数据为三次实验独立重复的结果,统计学分析方法为two-way anova test,*p<0.05;**p<0.01;***p<0.001。
40.图13是本发明实施例7中crl细胞分别转染si-control、si-ku70和si-ku80,之后感染病毒prv-wt或prv-ep0 ko(moi=1),通过western blot检测prv蛋白的表达情况(上图和中图),同时收取细胞上清检测病毒滴度(下图)。数据为三次实验独立重复的结果,统计学分析方法为two-way anova test,*p<0.05;**p<0.01;***p<0.001。
41.图14是本发明实施例7中hep-2细胞分别转染si-control、si-ku70和si-ku80,之后分别转染质粒flag-ev、flag-ep0或flag-ep0(ca),质粒表达24小时后western blot检测
ku70/ku80的降解情况。
42.图15是本发明实施例7中在hep-2细胞中转染si-control、si-ku70或si-ku80敲低ku70和ku80,之后转染回补质粒flag-ku70res和flag-ku80res,待质粒稳定表达之后感染prv(moi=1),24小时之后western blot检测病毒蛋白的表达情况,收取细胞上清检测的病毒滴度。
43.图16是本发明实施例7中crl细胞中转染si-control、si-ku70或si-ku80敲低ku70和ku80,之后转染回补质粒flag-ku70res和flag-ku80res,待质粒稳定表达之后感染prv(moi=1),24小时之后western blot检测病毒蛋白的表达情况,收取细胞上清检测的病毒滴度。
44.图17是本发明实施例8中用sirna分别敲低人喉癌上皮细胞(hep-2)的ku70和ku80,之后感染prv-wt病毒(moi=1)。病毒感染后分别在0、6、12、24小时检测病毒蛋白表达情况。
45.图18是本发明实施例8中用sirna分别敲低人喉癌上皮细胞(hep-2)的ku70和ku80,之后感染prv-wt病毒(moi=1)。病毒感染后在24小时检测病毒的滴度。
46.图19是本发明实施例8中敲低hep-2细胞的ku70和ku80后感染prv-ep0ko病毒(moi=1)。病毒感染后分时间点检测病毒蛋白表达情况。
47.图20是本发明实施例8中敲低hep-2细胞的ku70和ku80后感染prv-ep0ko病毒(moi=1)。病毒感染后在24小时检测病毒的滴度结果。
48.图21是本发明实施例8中,在猪的细胞上验证,用sirna分别敲低猪肺泡巨噬细胞(crl)中ku70和ku80,之后感染prv-wt病毒(moi=1)。病毒感染后分时间点检测病毒蛋白表达情况。
49.图22是本发明实施例8中,在猪的细胞上验证,用sirna分别敲低猪肺泡巨噬细胞(crl)中ku70和ku80,之后感染prv-wt病毒(moi=1)。病毒感染后在24小时检测病毒的滴度。
50.图23是本发明实施例8中,敲低crl细胞的ku70和ku80后感染prv-ep0ko病毒(moi=1)。病毒感染后分时间点检测病毒蛋白表达情况。
51.图24是本发明实施例8中,敲低crl细胞的ku70和ku80后感染prv-ep0ko病毒(moi=1)。病毒感染后在24小时检测病毒的滴度病毒滴度。
具体实施方式
52.为使本领域的技术人员更好地理解本发明的技术方案,以下实施例对本发明的作进一步详细描述,以下实施例仅用于说明发明,但不用来限制本发明的范围。
53.一种调节prv感染的组合物,所述的组合物含有ku蛋白。
54.进一步的,所述的组合物至少包含ku70蛋白或ku80蛋白中的一种。
55.进一步的,所述的ku蛋白通过nhej信号通路抑制prv复制。
56.本发明还提供一种调节prv感染的制剂。
57.一种调节prv感染的制剂,其含有所述的ku蛋白和药学上可接受的载剂。
58.本发明还提供一种调节prv感染的组合物的应用。
59.一种调节prv感染的组合物的应用,所述的组合物在抑制prv复制中的应用。
60.本发明还提供另一种调节prv感染的组合物的应用。
61.一种调节prv感染的组合物的应用,所述的组合物在在制备抗prv中的应用。
62.本发明还提供一种促进prv复制的组合物的应用。
63.一种调节prv感染的组合物的应用,所述的组合物在促进prv复制中的应用。
64.本发明还提供一种抑制prv感染的组合物的用途。
65.ku蛋白在制备抑制prv感染的药物中的用途。
66.本发明还提供一种促进prv复制的组合物的用途。
67.ku蛋白在制备促进prv复制的试剂中的用途。
68.实施例1
69.一种调节prv感染的组合物,所述的组合物含有ku蛋白。所述的组合物包含ku70蛋白。所述的ku70蛋白通过nhej信号通路抑制prv复制。
70.实施例2
71.一种调节prv感染的组合物,所述的组合物含有ku蛋白。所述的组合物包含ku80蛋白中。所述的ku80蛋白通过nhej信号通路抑制prv复制。
72.实施例3
73.一种调节prv感染的组合物的应用,所述的组合物在抑制prv复制中的应用。
74.实施例4
75.一种调节prv感染的组合物的用途,所述的ku蛋白在制备抑制prv感染的药物中的用途。
76.实施例5
77.一种调节prv感染的组合物的应用,所述的组合物在促进prv复制中的应用。降低该组合物的量均能显著增强病毒蛋白的表达和病毒滴度,可以显著提高prv的数量,可用于研究和/或载体等。
78.实施例6
79.prv感染调节nhej修复通路的研究
80.1.prv感染降低ku蛋白表达
81.用prv和hsv-1分别感染hep-2细胞,结果显示感染hsv-1的细胞dna-pkcs的量显著降低,而ku70与ku80的量则没有明显变化。prv感染则不能降低dna-pkcs的量,但是会引起ku70与ku80的显著减少(图1a)。也就是说prv感染能引起ku蛋白的减少。
82.然后,用prv感染猪肺泡巨噬细胞crl,显示ku70与ku80也发生了明显的减少(图1b)。prv感染能降低ku蛋白的量,一方面可能是在蛋白水平促进ku蛋白的降解,另一方面可能是在转录水平,抑制ku基因的转录。
83.再用蛋白酶体mg132处理病毒感染的细胞,显示在病毒感染的crl细胞(图1c)中,mg132处理8小时会完全抑制ku70与ku80的降解。说明ku蛋白在病毒感染时会通过蛋白酶体途径降解。
84.2.prv通过ep0蛋白降解ku蛋白
85.用ep0缺失的病毒感染hep-2和crl细胞,显示与野生型病毒(prv-wt)相比缺失毒(prv-ep0 ko)不会引起ku蛋白的降解(图2和图3)。结果说明prv是通过ep0来降解ku蛋白的。同时,收取细胞上清绘制病毒生成长曲线,显示在24小时时,prv-ep0 ko病毒病毒滴度
prv-wt。上述结果表明prv感染引起ku蛋白减少是通过ep0蛋白介导的。
86.3.ep0的ring-finger区域介导ku蛋白的降解
87.在hela细胞中过表达icp0、ep0以及prv蛋白ul18,结果显示ep0能够降解ku蛋白,同时,显示icp0对dna-pkcs也具有降解作用(图4)。进一步表明ep0能降解ku蛋白。
88.比对ep0与icp0及其他α-疱疹病毒的同源蛋白:vzv的orf61以及bohv1的bicp0。显示ep0与其他同源蛋白的ring-finger区域高度同源,均有zn
2+
结合区域c3hc4序列,但是c端序列差异较大(图5)。将ep0的ring-finger区域的甘氨酸突变成丙氨酸即ep0(ca),使其失去e3泛素酶连接酶活性。在hela细胞中过表达ep0与突变体ep0(ca),显示突变体无法降解ku蛋白,所以ep0降解ku蛋白是依赖其ring-finger区域的(图6)。检测了ku70与ku80的mrna水平,显示ep0与ep0(ca)均不影响ku70与ku80基因的转录(图7)。所以,ep0是通过它的n端ring-finger结构域发挥e3泛素连接酶活性介导ku蛋白降解的。
89.4.ep0对ku蛋白泛素化修饰探究
90.蛋白质需要先发生泛素化修饰才能通过蛋白酶体途径降解。ku70与ku80在ep0作用下通过蛋白酶体途径降解,所以检测了ku蛋白的泛素化修饰情况。
91.在hek293t细胞中同时过表达ku蛋白和泛素分子,之后转染无标签的ep0或ep0(ca)质粒。显示ku70与ku80均能在ep0存在的情况下泛素化修饰增强,而ep0(ca)则不能增强两者的泛素化修饰(图8)。所以,上述结果进一步表明ku蛋白被ep0降解是通过泛素-蛋白酶体途径。e3泛素酶在介导底物发生泛素-蛋白酶体途径降解时,会与底物发生相互作用。在hek293t细胞中同时过表达ep0与ku蛋白,通过免疫共沉淀实验(ip)检测ep0与ku蛋白的相互作用情况。结果显示ep0能够分别与ku70和ku80相互作用(图9)。所以ep0是直接介导ku蛋白的降解的,并且能分别与ku70和ku80结合介导两者的降解。
92.5.prv对nhej损伤修复的影响
93.prv能够通过ep0降解nhej通路的关键蛋白ku70和ku80,因此prv感染对nhej修复通路具有重要影响。
94.利用带有gfp repoter的u2os模式细胞u2os-ej5直观的检测修复效率。gfp reporter的结构和原理是:gfp基因被构建在真核表达质粒上,gfp基因中间插入了puro基因,而puro基因两端带有i-scei特异性酶切位点,在限制酶i-scei切割之后,puro基因会被切掉同时形成双链断裂(dsb),这样会引起细胞的dna损伤反应,最终利用细胞内的nhej修复系统完成修复。修复完成的gfp基因能正常表达gfp蛋白,所以最终通过流式细胞术定量表达gfp的细胞,以此评定nhej修复效率。
95.12孔板中接种u2os-ej5细胞,在细胞密度达到60%时转染i-scei质粒,48小时之后分别感染prv-wt与prv-ep0 ko病毒,24小时之后收取细胞进行流式细胞术分析。结果显示prv-wt感染细胞时使细胞的nhej修复效率降低约30%,但prv-ep0 ko病毒感染对nhej修复几乎没有影响(图10)。同样的,prv-wt病毒感染能显著降解ku蛋白,而prv-ep0 ko病毒则不能(图11)。所以,prv感染会抑制细胞的nhej修复通路,是通过ep0蛋白降解ku70与ku80蛋白实现的。
96.实施例7
97.nhej通路对prv复制的影响
98.1.nhej通路对prv蛋白表达的影响
99.用sirna在hep-2或crl细胞中分别敲低ku70和ku80,之后感染prv-wt或prv-ep0 ko病毒。病毒感染后分时间点检测病毒蛋白表达情况以及在24小时检测病毒的滴度。结果显示低表达ku70或ku80均能显著增强病毒蛋白的表达(图12上图和中图)。在crl细胞中均有同样的现象(图13上图和中图)。病毒滴度结果显示ku蛋白低表达时,病毒滴度明显增高,同时prv-ep0 ko病毒滴度增长的倍数远大于prv-wt(图12下图和图13下图)。这说明内源ku蛋白具有抵抗p感染的重要作用,也就是nhej修复通路对prv复制确实具有抑制作用。因为ep0能够分别于ku70和ku80相互作用,ep0诱导ku70和ku80的下调与ep0能单独靶向ku70和ku80有关。所以用sirna敲低ku70,分别过表达ep0蛋白或其突变体ep0(ca),显示ku80能被ep0降解。所以,ep0能单独靶向ku80诱导其泛素化降解。同样,在敲低ku80时,ku70依然能被ep0降解。这些结果显示,ep0能够单独靶向ku70或ku80(图14)。
100.2.ku蛋白的回补对prv蛋白水平的影响
101.由于ku70或ku80低表达均能增强prv的复制,将ku70以及ku80进行回补,之后感染prv病毒,24小时之后检测病毒复制情况。显示在hep-2细胞中ku70或ku80回补之后在蛋白表达水平显示ku蛋白能显著抑制prv的复制(图15)。在crl细胞中也具有同样的现象(图16)。以上结果说明ku蛋白确实具有抑制病毒复制的作用,即nhej信号通路能够抑制prv复制。
102.检测ku蛋白的回补对子代病毒产量的影响。将ku70以及ku80回补之后感染prv病毒,24小时之后检测病毒滴度。显示在hep-2细胞中ku70或ku80回补之后显著抑制prv子代病毒的产量(图15)。在crl细胞中也具有同样的现象(图16)。以上结果说明进一步ku蛋白具有抑制病毒复制的作用,即nhej信号通路能够抑制prv复制。
103.实施例8
104.通过sirna降低ku蛋白表达增强prv复制
105.用sirna分别敲低人喉癌上皮细胞(hep-2)的ku70和ku80,之后感染prv-wt病毒(moi=1)。病毒感染后分别在0、6、12、24小时检测病毒蛋白表达情况以及在24小时检测病毒的滴度(如图17~18所示)。结果显示降低ku70或ku80的量均能显著增强病毒蛋白的表达和病毒滴度,病毒滴度分别增加40倍和45倍。
106.敲低hep-2细胞的ku70和ku80后感染prv-ep0 ko病毒(moi=1)。病毒感染后分时间点检测病毒蛋白表达情况以及在24小时检测病毒的滴度(如图19~20所示),结果显示ku蛋白低表达时,prv-ep0 ko病毒滴度明显增高,增长的倍数远大于prv-wt,分别约为78倍和95倍。
107.随后,在猪的细胞上验证,用sirna分别敲低猪肺泡巨噬细胞(crl)中ku70和ku80,之后感染prv-wt病毒(moi=1)。病毒感染后分时间点检测病毒蛋白表达情况以及在24小时检测病毒的滴度(如图21~22所示)。结果在crl细胞中具有同样的现象,病毒蛋白的表达和病毒滴度均显著增强,病毒滴度分别增长约65倍和80倍。
108.同样,敲低crl细胞的ku70和ku80后感染prv-ep0 ko病毒(moi=1)。病毒感染后分时间点检测病毒蛋白表达情况以及在24小时检测病毒的滴度病毒滴度(如图23~24所示)。结果显示ku蛋白低表达时,prv-ep0 ko病毒滴度病毒滴度明显增高,增长的倍数分别约是110倍和150倍。这些结果说明内源ku蛋白具有抵抗prv感染的重要作用,也就是nhej修复通路对prv复制确实具有抑制作用。
109.以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种变换,这些简单变型均属于本发明的保护范围。
110.另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征和步骤,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
111.此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1