一种盐酸利多卡因注射液及其制备方法与流程
一种盐酸利多卡因注射液及其制备方法
1.技术领域:本发明涉及制药技术领域,特别是涉及一种盐酸利多卡因注射液及其制备方法。
2.
背景技术:
盐酸利多卡因注射液为局麻药及抗心律失常药,主要用于浸润麻醉、硬膜外麻醉、表面麻醉(包括在胸腔镜检查或腹腔手术时作粘膜麻醉用)及神经传导阻 滞,该产品可用于急性心肌梗塞后室性早搏和室性心动过速,亦可用于洋地黄类中毒、心脏外科手术及心导管引起的室性心律失常。但本品对室上性心律失常通常无效。
3.盐酸利多卡因注射液为酰胺类局麻药。血液吸收后或静脉给药,对中枢神经系统有明显的兴奋和抑制双相作用,且可无先驱的兴奋,血药浓度较低时,出现镇痛和思睡、痛阈提高;随着剂量加大,作用或毒性增强,亚中毒血药浓度时有抗惊厥作用;当血药浓度超过5μg
·
ml-1 可发生惊厥。本品在低剂量时,可促进心肌细胞内 k +外流,降低心肌的自律性,而具有抗室性心率失常作用;在治疗剂量时,对心肌细胞的电活动、房室传导和心肌的收缩无明显影响;血药浓度进一步升高,可引起心脏传导速度减慢,房室传导阻滞,抑制心肌收缩力和使心排血量下降。
4.由此可见,盐酸利多卡因注射液在临床使用中有着较高的风险,需要严格的剂量控制和质量安全控制。
5.另外,我们在使用中发现,盐酸利多卡因注射液在适当碱化后可增强其麻醉作用,《盐酸利多卡因注射液碱化后稳定性试验》(方强三,马永德,朱丽青,孙成春-《药学实践杂志》2001年第19卷第3期)中也提到,当盐酸利多卡因被碱化时,解离出非离子型药物,局麻作用会大大增加,但碱化后其稳定性明显比其盐酸盐的稳定性降低,并且随着加入的nahco3量的增加,利多卡因的含量下降越显著,并伴有结晶析出,因此2020版《中国药典》将盐酸利多卡因注射液ph值规定在4-6。
6.除此之外,因盐酸利多卡因注射液的两项特定单杂(2,6-二甲基苯胺和n-(2,6-二甲苯基)-2-(n-氧代-n,n-二乙基)-乙酰胺)都与氧化有关,因此我们还要特别注意控制注射剂的氧化程度。
7.专利申请201410658485.3公开了一种盐酸利多卡因注射液和其相应的制备方法,在该方法中发明人将制剂ph控制在4-6,盐酸利多卡因与氯化钠之比在10:(2.2-2.65)左右,并且在制备过程中使用了药用炭,灭菌温度设定在116℃ 30分钟。
8.发明专利201310665586.9公开了一种盐酸利多卡因注射液的制备方法,在该方法中发明人将制剂ph控制在4-5,盐酸利多卡因与氯化钠之比在10:3.9左右,且在制备过程中使用了活性炭,灭菌温度同样设定在116℃ 30分钟。
9.我们都知道,注射液产品因特殊的给药途径,决定了该类产品的高风险性,现有技术在药液配制过程中使用药用炭,灭菌温度116℃ 30分钟,增加了不溶性微粒的潜在风险及药品长时间受热产生的质量变化。
10.近年来,国家对药品管理越来越严格,为提高产品安全性,确保产品质量稳定,更是要求进行疗效与质量一致性评价工作,因此如何提供一个更为安全有效的盐酸利多卡因
注射液成为了亟待完成的一项挑战。
11.
技术实现要素:
为了解决以上问题,发明人开展了大量的研究试验,最终我们创新产品处方和制备工艺,在制备全过程中去除炭的使用,收紧微生物限度与细菌内毒素限度,从源头保障临床用药安全,同时我们将药液ph控制在6.3-6.7的区间内,此区间的药液在保障质量安全的前提下,可迅速起到麻醉的效果且作用持久。
12.同时,我们在制剂配制和灌装过程中采用充氮降氧的工艺,增强制剂在极端条件下的稳定性,最终灭菌条件控制在121℃/12min,这样使得产品更加稳定,无菌保障等级更高,有关物质杂质更低,进一步降低产品因受热而可能产生的质量变化风险。
13.综上所述,本发明旨在提供一种新的盐酸利多卡因注射液及其制备方法,该方法通过创新处方工艺,从生产源头控制有关物质的产生,大大提升产品的质量,保障了临床安全用药的要求,具体技术方案如下:一种盐酸利多卡因注射液,由盐酸利多卡因、氯化钠和水组成,其特征在于,该注射液 ph 为 6.3-6.7。
14.优选的,所述注射液每10000ml注射液中盐酸利多卡因含量为170g-250g,氯化钠含量为48g-80g。
15.优选的,所述注射液盐酸利多卡因:氯化钠=(3
±
0.2):(10
±
0.2)。
16.优选的,所述注射液每10000ml中,含有:盐酸利多卡因200g、氯化钠60g。
17.优选的,所述注射液每10000ml中,含有:盐酸利多卡因180g、氯化钠55g。
18.优选的,所述注射液每10000ml中,含有:盐酸利多卡因240g、氯化钠75g。
19.同时,本发明还提供一种盐酸利多卡因注射液的制备方法,其特征在于:1)称取处方量的盐酸利多卡因和氯化钠依次加入配液罐中至完全溶解;2)用无机碱或无机酸调节1)的 ph 至 6.3-6.7;3)补加注射用水至全量,经过滤灌封后灭菌。
20.优选的,所述制备方法中,无机碱为氢氧化钠,无机酸为盐酸。
21.优选的,所述制备方法中,整个制备过程保持氮气保护。
22.优选的,所述制备方法中,灌封后灭菌保持f0值≥12。
23.优选的,所述制备方法中,灌封后灭菌温度为121
°
c,灭菌时间为12分钟。
具体实施方式
24.下面将通过实施例对本发明进行详细的说明,实施例仅是本发明的优选实施方式,不是对本发明的限定,对本发明的技术特征所作的等同替换,或相应的改进,仍属于本发明的保护范围之内。
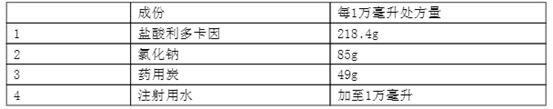
25.处方如下:表1成分实施例1实施例2实施例3实施例4实施例5盐酸利多卡因(g)200180240218.4215.65氯化钠(g)6055758549注射用水加至(ml)1000010000100001000010000
实施例1按照表1中的处方量制备,具体方法如下:将配液罐保持氮气充入,分别称取处方量的盐酸利多卡因和氯化钠依次加入配液罐中至完全溶解,用盐酸和氢氧化钠调节注射液ph,测得ph值为6.5后,加注射用水至全量,搅拌溶清后,将药液经过两道0.22μm滤芯过滤灌封,在121
°
c 条件下保持12分钟灭菌,得到盐酸利多卡因注射液。
26.实施例2按照表1中的处方量制备,具体方法如下:将配液罐保持氮气充入,分别称取处方量的盐酸利多卡因和氯化钠依次加入配液罐中至完全溶解,用盐酸和氢氧化钠调节注射液ph,测得ph值为6.3后,加注射用水至全量,搅拌溶清后,将药液经过两道0.22μm滤芯过滤灌封,在121
°
c 条件下保持12分钟灭菌,得到盐酸利多卡因注射液。
27.实施例3按照表1中的处方量制备,具体方法如下:将配液罐保持氮气充入,分别称取处方量的盐酸利多卡因和氯化钠依次加入配液罐中至完全溶解,用盐酸和氢氧化钠调节注射液ph,测得ph值为6.7后,加注射用水至全量,搅拌溶清后,将药液经过两道0.22μm滤芯过滤灌封,在121
°
c 条件下保持12分钟灭菌,得到盐酸利多卡因注射液。
28.实施例4按照表1中的处方量制备,具体方法如下:将配液罐保持氮气充入,分别称取处方量的盐酸利多卡因和氯化钠依次加入配液罐中至完全溶解,用盐酸和氢氧化钠调节注射液ph,测得ph值为6.6后,加注射用水至全量,搅拌溶清后,将药液经过两道0.22μm滤芯过滤灌封,在121
°
c 条件下保持12分钟灭菌,得到盐酸利多卡因注射液。
29.实施例5按照表1中的处方量制备,具体方法如下:将配液罐保持氮气充入,分别称取处方量的盐酸利多卡因和氯化钠依次加入配液罐中至完全溶解,用盐酸和氢氧化钠调节注射液ph,测得ph值为6.4后,加注射用水至全量,搅拌溶清后,将药液经过两道0.22μm滤芯过滤灌封,在121
°
c 条件下保持12分钟灭菌,得到盐酸利多卡因注射液。
30.对照实施例1按照中国发明专利201310665586.9所述实施例1制备盐酸利多卡因注射液,处方如下(制备工艺见专利文件实施例1):对照实施例2
按照中国发明专利申请201410658485.3所述实施例1制备盐酸利多卡因注射液,按照10000ml配方量各项处方如下:盐酸利多卡因215.65g、氯化钠49g,余量为水,制备工艺见专利文件实施例1。
31.有关物质及含量对比(对比时间为注射液0时时间):以上数据,实施例1-3是依据本技术所做,实施例4-5与对比例1-2注射液中主药含量相同,且实施例4-5是按照本技术制备工艺所得。
32.我们都知道,降解产物和工艺杂质影响安全性,必须基于药典/ ich 要求或参比制剂检测结果进行控制,以限制对患者的暴露量,且处方和工艺变量会影响降解产物。
33.在药典中,此品种质量标准中有关物质的限度规定为:2,6-二甲基苯胺(杂质 a)不得过 0.04%,其他单杂不得过 0.5%,其他总杂不得过 1.0%。同时由于杂质 a(2,6-二甲基苯胺)与杂质 b(n-(2,6-二甲苯基)-2-(n-氧代-n,n-二乙基)-乙酰胺)结构式中有警示结构,按基因毒杂质进行控制,由于本品属于短期内用药,按照 ich m7的要求,连续用药不超过 30 天,可接受日摄入量 120μg/天,按照说明书规定的最大日剂量 350mg,计算出杂质 a 与杂质 b 均不得过 0.03%。参考上述限度要求并参考 ich q3b 中制剂中降解产物的鉴定限度要求,并结合多批次样品的检测结果和稳定性考察结果,我公司研发人员在实验中保证本品有关物质的限度为:杂质 a 不得过 0.03%,杂质 b 不得过 0.03%,其他单质不得过 0.2%,其他总质不得过 1.0%。
34.从以上实验数据我们可以看出,本技术所得注射液的杂质含量明显低于现有技术,产品质量和临床安全得到了更有利的保障。
35.动物实验:实验动物:选取25只2月龄昆明种小鼠,体重(30
±
2)g,自由进食和饮水,每天光照
12h,动物房温度保持在22℃-26℃,相对湿度40%-70%,实验过程中所有操作均符合动物福利要求。
36.实验方法:分组:将25只小鼠适应性喂养7天,实验前1天,禁食禁水。实验时随机分为5组(每组5只):a、b、c、d、e。
37.乙酸急性内脏痛模型建立:向25只小鼠腹腔注射0.6%乙酸(10ml/kg)后出现腹部内凹、躯干与后肢伸张、臀部高起等动作,即表明急性内脏痛模型建立成功。
38.实验药品及给药方式:分别向小鼠皮下注射实施例1-3和对比例1-2所得盐酸利多卡因注射液,注射量为0.1mg/只(以盐酸利多卡因含量计),10min后再腹腔注射0.6%乙酸(10ml/kg)。
39.行为学观察:各实施例及对比例所得盐酸利多卡因注射液给药10min后,观察乙酸腹腔注射后小鼠扭体潜伏期(扭体潜伏期指注射乙酸后至出现扭体反应的时间) 及扭体次数。扭体反应标准为小鼠出现腹部内凹,躯干与后肢伸张,臀部高起。
40.实验结果:小鼠abcde试剂选用实施例1实施例2实施例3对比例1对比例2扭体潜伏期310.4s305s308s276.4s280.2s10min扭体次数88.89.215.212.8由以上实验数据可知,本专利申请较现有技术麻醉维持时间更长,极大地缩短盐酸利多卡因注射液的麻醉维持次数,提高产品的临床疗效。
41.综上所述,申请人通过大量研究所得的一种新的盐酸利多卡因注射液,该注射液效果更好,且更加符合临床用药安全,同时通过精简的工艺工序,更适合工业生产。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1