基于多模态成像的自适应重计划
基于多模态成像的自适应重计划
本发明申请是国际申请号为pct/us2014/072645,国际申请日为2014年12月30日,进入中国国家阶段的申请号为201480076742.0,名称为“基于多模态成像的自适应重计划”的发明专利申请的分案申请。相关申请的交叉引用
1.本技术要求2013年12月31日提交的题为“systems and methods for adaptive replanning based on multi
‑
modality imaging(用于基于多模态成像的自适应重计划的系统和方法)”的美国临时专利申请序列号61/922,343的优先权。
背景技术:
2.本公开一般涉及用于放射疗法治疗递送中的工具、系统和方法并且,尤其涉及用于基于多模态成像的自适应计划的系统和方法。
3.放射疗法(rt)在过去的几十年里已经经历了一系列的技术革命。利用强度调制rt(imrt),产生高度保形的剂量分布变为可能,借此在肿瘤的范围内递送大部分辐射剂量。这些技术利用从在首次治疗之前的几天获取的各种类型的(例如,ct、mri、pet)的图像提取的3d解剖信息以及生物信息。但是,已发现肿瘤(多个)以及正常解剖的位置、形状和尺寸以及生物性质在治疗过程期间改变,这主要是由于各种roi的日常定位不确定性以及解剖因素、生理因素和/或临床因素。后者包括肿瘤收缩、重量损失、正常器官中的体积改变,在不同的骨结构中的非刚性变化。从在治疗过程之前针对计划目的获取的3d ct图像辨别的解剖适用于每一个片段的传统的假设可能没有充分考虑片段间的变化并且可能限制充分开发高度保形的治疗模态(诸如imrt)的潜能的能力。剂量保形性中的这一改进的能力使对靶和处于风险的器官(oar)的更好定位,以及在治疗的设计和递送两方面适应片段间或片段内变化的能力成为必要。
4.放射疗法的准确递送使患者的高保真度、3d、解剖图像成为必要,作为先决条件。将近二十年来,rt计划已经利用ct图像作为放射剂量计算的基础。由于亨斯菲尔德(hounsfield)单元和下面的组织电子密度之间的线性关系,ct图像允许针对组织衰减中的差别对放射剂量的基于体素的校正,以及用于治疗验证的射束的眼观数字化重建的放射照片(drr)的产生。在ct中的图像对比度的形成主要是由于光电相互作用。这一影响导致在具有相当不同的密度的组织(例如,骨头、肺、以及软组织)之间的高对比度。但是,相邻的软组织(例如,在大脑或者腹部区域中)并不拥有实质的密度差。ct图像上的接着发生的不良的软组织对比度使得对靶和临界结构两者的勾画极具挑战性。这一无力在ct图像上可靠地勾画肿瘤靶和接近的临界结构具有显著的临床后果,在于其需要使用较大的裕量,由于临界结构的毒性约束,这妨碍了安全地逐步增加辐射剂量的能力。
5.磁共振成像(mri)为癌症诊断和治疗提供强大的成像能力。与ct相反,mri是非离子化的,提供优越的软组织对比度,并且提供大量的功能对比度形成机制以表征肿瘤生理学。但是,不像ct,mri信号与电子密度没有直接关系,这阻止了mri被用作剂量计算的基础。此外,mr图像可以通过由梯度非线性以及偏共振效应引起的空间失真而混淆。这些失真可
能是严重的,测距高达几厘米。此外,mr图像通常展现出具有非均匀图像强度的区域,这可以在放射治疗计划和递送期间频繁采用的图像配准和图像分割算法中引入不准确度。当相控阵线圈被用于信号接收时,这些非均匀图像密度起于b1+(rf发射)场和b1
‑
(rf接收)场中的不均匀性。因此,尽管mri提供的明显的软组织对比度优势,这些当前组织(例如,缺乏电子密度信息,几何失真的源,以及信号非均匀)已经妨碍了将mri确立为放射肿瘤学中的主要成像模态。
6.自适应放射疗法(art)是最新水平的方法,其使用反馈处理来考虑治疗期间的患者特定的解剖学改变和/或生物学改变,因此,针对癌症患者递送高度个体化的放射疗法。art的基本组成包括:(1)通常由多模态图像(例如,ct、mri、pet)促进的对解剖学改变和生物学改变的检测,(2)治疗计划优化以在考虑放射响应的情况下考虑患者特定的空间形态学改变和生物学改变,以及(3)用于精确地递送优化的计划给患者的技术。art的介入可由在线和线下方法构成。
7.片段间和片段内的的变化,如果没有考虑,可导致次优的剂量分布以及与原始计划的显著偏差,在治疗效率方面具有潜在的负面影响。最近,图像引导的rt(igrt)已经被广泛地用于校正(消除或者降低)片段间的变化的恶化影响。已经基于可用的igrt技术发展了大量的校正策略。这些校正方法可被一般地分类为“在线”或者“线下”方案。就在日常患者信息被获取之后且在日常治疗剂量被递送之前执行的对患者治疗参数的校正被分类为“在线”校正。这与“线下”校正形成对比,在线下校正中,校正动作在日常治疗已经被递送之后进行,从而影响后续日子的治疗。因此,当应用在线校正时,所递送的日常剂量将是使用最近的患者设置和解剖信息的经校正的那个。
8.当针对每一个片段设置患者时,解剖体可能与用于初始治疗计划的那个不同。典型地,最有害的偏差是所谓的“系统的”偏差,所述系统的偏差也相对更容易被线下或者在线校正策略考虑。偏差的随机成分,尽管有时比系统的偏差危害较小,但通常难以被完全考虑并且需要在线校正策略。在线校正策略相对于线下方法的优点之一是在线策略可以校正系统的变化和随机的变化两者。此外,线下校正可能不适用于具有小数量的治疗片段的治疗的过程,例如低级片段化(hypo
‑
fractionation)或者立体定向体部rt(sbrt)。
9.对于在线校正策略的首要挑战是其需要在患者以治疗位置躺在治疗台上时的可接受的时间帧内执行。这一要求限制了在今天的技术中被用作在线策略的多种校正的动作。因此,通过基于紧接在治疗递送之前获取的图像来重定位患者的片段间变化的在线校正是用于igrt的当前标准的实践。迄今为止在大多数临床中实践的在线重定位策略限于仅校正平移移动,未能考虑旋转误差,靶和oar的体积变化和变形,以及在不同靶/oar之间的独立运动。这不管当前技术提供了足够的信息来执行比简单的平移移动详细得多的对日常治疗的修改这一事实。原则上,为那天产生新的治疗计划所需的数据在今天的基于ct的igrt实践中是可用的,但是通过将该数据仅用于移动患者,igrt的全部潜力没有被开发。
10.一直存在将在线校正从台移动延伸到可校正变化的解剖(诸如器官旋转和变形)的修改的正在进行的研究。例如,已经至少部分地在若干技术(例如,螺旋断层放疗)中执行除了平移以外对旋转的校正。但是,其他的片段间变化可能没有被考虑并且仍然是主要问题。这些变化可以通过在线重计划方法来处理,包括基于那天的解剖体的迅速在线计划修改和全面(full
‑
blown)计划重优化。例如,基于那天(那天的解剖)的ct的对射束孔径形状
和权重的快速调整是由计算机技术的进展促进的在线计划修改方法,其允许在合理的时间帧内执行计算密集的操作。其他的例子包括基于gpu的全面重优化和基于预计算的计划库的自适应。因此,比在线重定位更综合的在线校正方案正在开始移入临床。但是,这种在线重计划方案仍然存在挑战,因为他们需要对靶和oar的勾画,这对于完全自动化而言是耗时且困难的过程。如此,在单模态或多模态成像上的手动勾画或者甚至手动轮廓验证是对于要在几分钟内执行在线重计划过程的主要瓶颈。
11.因此,鉴于以上,需要采用多模态图像以用于以临床上可行的时间帧自适应和递送放射疗法治疗的系统和方法。
技术实现要素:
12.本公开通过提供针对自适应放射疗法计划的系统和方法来克服上述缺点。
13.根据本公开的一个方面,提供了一种用于发展放射疗法治疗的系统。所述系统包括数据存储装置,所述数据存储装置被配置成保持由mri系统获取的mr图像数据,以及至少一个处理器,所述至少一个处理器被配置成:从所述数据存储装置接收所述mr图像数据,对所述mr图像数据应用校正以产生一系列经校正的图像数据,以及汇集所述一系列经校正的图像数据以产生一组弛豫映射(map)。所述至少一个处理器还被配置成使用该组弛豫映射来执行对多个感兴趣区域的分割,使用该组弛豫映射对所述多个感兴趣区域进行分类,以产生多个经分类的结构,并且使用分配过程来给所述经分类的结构分配电子密度值。所述至少一个处理器进一步配置成使用所述经分类的结构的电子密度值生成一组校正的合成电子密度图像,并且使用所述校正的合成电子密度图像来执行剂量计算以发展放射疗法治疗计划。
14.根据本公开的另一方面,提供了一种用于产生用于放射疗法治疗中的合成图像的方法。所述方法包括引导磁共振成像(mri)系统获取用于放射疗法过程中的多个图像数据,从所述mri系统接收所述多个获取的图像数据,并且对所述mr图像数据应用校正以产生一系列经校正的图像数据。所述方法还包括汇集所述一系列经校正的图像数据以产生一组弛豫映射,使用该组弛豫映射来执行对多个感兴趣区域的分割,使用该组弛豫映射对所述多个感兴趣区域进行分类,以产生多个经分类的结构。所述方法进一步包括使用分配过程来给所述经分类的结构分配电子密度值,使用所述经分类的结构的电子密度值生成一组校正的合成电子密度图像,并且可选地使用所述校正的合成电子密度图像来执行剂量计算以发展放射疗法治疗计划。
15.根据本公开的又另一方面,提供了一种用于使放射疗法治疗计划适应的方法。所述方法包括提供待根据更新的图像集进行适应的初始放射疗法计划,所述初始放射疗法计划具有放射剂量分布,使用所述放射剂量分布确定多个剂量梯度,以及使用所述剂量梯度定义优化目标。该方法还包括接收所述更新的图像集,使用所述更新的图像集产生代表更新的靶体积的更新的轮廓集,以及使用所述更新的轮廓集形成一组部分环,该组部分环围绕代表所述更新的靶体积的更新的轮廓集布置。所述方法进一步包括使用所述优化目标和该组部分环执行计划优化,以及产生代表使用所述计划优化获得的适应的放射疗法计划的报告。
16.本公开的前述以及其他优点将从后面的描述中显而易见。
附图说明
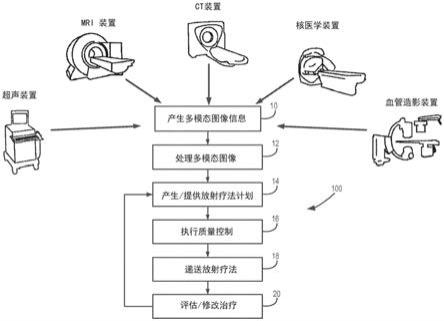
17.图1示出了阐述与向患者提供放射疗法治疗的过程相关联的步骤的流程图。
18.图2是根据本公开使用的示例mri系统的示意图。
19.图3是阐述根据本公开的与图2的mri系统的操作相关联的用于产生合成电子密度图像的步骤的流程图。
20.图4是根据本公开的的使用图2的系统的示例性图像获取和后处理的框图。
21.图5示出了根据本公开的在b1+校正和没有b1+校正的情况下产生的来自健康志愿者的大脑t1参数映射的例子。
22.图6是根据本公开的来自用于将合成电子密度图像转换为合成ct图像的临床放射治疗计划系统的电子密度对亨斯菲尔德单元转换表的图解说明。
23.图7示出了根据本公开的从健康志愿者的骨盆获得的示例性合成电子密度和合成ct图像。
24.图8示出了根据本公开的在有以及没有异质性校正的情况下使用合成ct图像计算的示例性体积调制的弧形疗法计划。
25.图9示出了根据本公开的的在固定图像和运动图像之间的可变形变换的示图。
26.图10示出了根据本公开的对于其中患者处于仰卧位置的情况下的乳腺癌情况的弯曲能量有限微分同胚(beld)
‑
正则化可变形图像配准(dir)的示例。
27.图11示出了根据本公开的对于其中患者处于俯卧位置的情况下的乳腺癌情况的beld
‑
正则化dir的示例。
28.图12示出了根据本公开的示出由变形场的应用产生的多模态轮廓化结构的示例性图像。
29.图13示出了根据本公开的展示可变核平滑技术对配准准确度的影响的图解示例。
30.图14示出了根据本公开的来自使用应用至骨盆ct扫描的可变核平滑的配准的图像结果。
31.图15示出了图示对于具有浅表性基底细胞癌的患者的ct和高频超声(hfus)图像之间的配准的示例。
32.图16是根据本公开的阐述与用于梯度
‑
维持算法的操作模式相关联的步骤的流程图。
33.图17示出了根据本公开的比较使用传统方法和梯度
‑
维持方法的在线重计划方案的示图。
34.图18示出了根据本公开的来自图像引导放射疗法(igrt)重定位,基于全轮廓集的传统的全面优化,以及梯度
‑
维持的示例性剂量分布。
35.图19示出了用于解决前列腺癌情况的日常治疗中的片段间变化的图18的三个策略的示例性剂量体积直方图。
36.图20示出了根据本公开的线下优化。
37.图21示出了根据本公开的方面的使用各种mri扫描仪和扫描条件获得的并经受校正和标准化的图像强度之间的比较。
38.图22示出了根据本公开的方面的阶段解析的4d mr图像的回顾性重建的示图。
39.图23示出了根据本公开的方面的在快速在线重计划方法中利用的部分同心环的
示例。
具体实施方式
40.当前的与任何一个或者多个放射疗法治疗的递送相关联的临床实践包括复杂的,精心协调的工作流,使用了大量被设计成实现最大的患者利益的工具和系统。图1示出了示例流程图,该示例流程图示出了与这种放射疗法治疗过程相关联的一般步骤。过程100典型地在过程框10处开始,其中典型地使用各种成像方法从患者产生医学图像信息,以用于诊断或者治疗目的。例如,如在图1中所示,这可以包括使用计算机断层扫描(ct)装置,磁共振成像(mri)装置,正电子发射断层扫描(pet)成像装置,超声(us)成像装置,等等。由成像获得的信息在放射疗法(rt)中用于两个主要目的。第一,其被用于确定真实的三维位置以及靶向患病组织相对于相邻的临界(critical)结构或者处于风险中的目标(oar)的范围,所述临界结构或者处于风险中的目标典型地具有放射剂量毒性约束。第二,其被用于例如在日常治疗设置期间定位这种靶和oar,以便在辐射递送之前进行任意治疗调整。
41.大体上,ct图像是用于治疗计划的标准成像模态。在模拟阶段中,患者被固定不动并且利用建立特定坐标的参考标记进行成像,所述特定坐标可随后在放射递送期间被再现在治疗系统中。获取的图像随后被用于计划阶段中以产生治疗计划。除了ct图像,其他成像模态提供改进的对比度和涉及正常的和患病的组织或者结构的解剖特征和生物学过程的其他有用的信息。具体地,mri是非离子化的,并且相比于ct提供优越的软组织对比度,同时提供形成用于表征肿瘤生理学的机制的广泛的功能对比度。但是,与ct图像对比,mr图像缺少电子密度(ed)信息,所述电子密度(ed)信息对于放射剂量计算是必要的。因此,这种非
‑
ct图像需要被处理或者合成为“类
‑
ct的”以便发现在rt计划和递送中的使用。
42.以前,已经探索不同的方法来将mr图像转换为类
‑
ct图像,也就是:1)手动的体电子密度分配,2)可变形的图像配准,3)基于体素的分类,4)超短回波时间(ute)图像的使用,以及5)狄克逊(dixon)图像的使用。这些方法中的每一个具有其缺点,如下所述。
43.在手动的体密度分配方法中,在患者的mr图像上手动构建组织轮廓并且体电子密度随后被分配给手动构建的结构中的每一个。采用这一方法的主要问题是其遭受大的观察者内和观察者间的可变性。在观察者画轮廓中的可变性,尤其在组织界面处,已经被示为在计算的剂量分布中产生严重的误差。在可变形的图像配准(dir)方法中,典型地通过将患者的mri图像变形至参考mri图像来估算向量位移场(vdf)。该vdf随后被应用以将“黄金标准的”ct图像变形回到患者的mri图像的向量空间。但是,这一方法的准确度受制于dir的准确度并且尤其在具有非典型的解剖的患者中可能是受到挑战的。此外,由b1+(rf发射)和b1
‑
(rf接收)不均匀性引入的非均匀的mr图像强度可挑战基于强度的dir算法的准确度。此外,在传统的幅度mr图像中常见的灰度级信号强度的变化还可挑战基于强度的dir算法的准确度和鲁棒性。在基于体素的分类方法中,每一个体素被分类为特定的组织类型,接着是将mri灰度级强度直接转换为亨斯菲尔德单元或者电子密度。但是,非均匀图像强度和传统的幅度mr图像灰度级强度的变化可能再次混淆利用基于体素的方法的组织分类的准确度。尽管ute序列可能为对骨头成像提供优点,但他们对于其他组织类型缺少对比度并且尚未在商业上可用于所有临床mri扫描仪上。最后,多
‑
回波狄克逊图像的配准不良可混淆图像分割,从而导致模糊的结构边界。
44.除了具有准确的和可用的图像信息之外,本公开认识到类
‑
ct或者ct替代图像需要满足一些附加条件来发现在rt治疗中的实际使用。具体地,这种图像使由连续切片组成的3d体积覆盖成为必要以允许准确的和完整的结构勾画以用于使用剂量
‑
体积直方图(dvh的)的治疗计划评估。而且,需要视场(fov)内的完全的患者横截面以用于准确的剂量计算,因为这种计算涉及放射源与患者的皮肤之间的距离。此外,为了通过改进的数字地重建的放射照片(drr)图像质量的准确的治疗验证,3mm或者更少的切片厚度是有利的,同时准确的图像配准以及图像分割算法可受益于高空间分辨率(例如,小于1mm2)和图像均匀性。针对易受呼吸运动、蠕动运动以及心脏运动影响的身体区域的成像,合适的获取速度对于无伪像图像是期望的,同时准确的解剖学勾画和剂量累积需要高的几何保真度。
45.由rt治疗的性质强加的条件具有非标准图像至定性的评估的有限使用。具体地,尽管mri提供的软组织对比度中的优点,但诸如缺少电子密度信息、几何失真,以及信号非均匀性之类的缺陷已经阻碍了将mr成像建立为rt治疗中的主要成像模态。
46.因此,本公开的一个方面是提供成功地将非离子化mr成像实现到rt治疗过程中的系统和方法。具体地,这样的系统和方法可被用于产生合成的ed图像,所述合成的ed图像克服先前方法的缺点,并且对于用于rt治疗计划中是实用的。如将被描述的,可使用弛豫参数映射(map)来获得合成的ed图像,其中针对已知的误差源(包括磁场(b0)误差,rf发射场(b1+)不均匀性误差,以及来自梯度非线性的几何失真误差)完全校正图像。
47.具体地参考图2,示出了磁共振成像(mri)系统200的例子。该mri系统200包括操作者工作站102,其将典型地包括显示器104,一个或者多个输入装置106,例如键盘和鼠标,以及处理器108。处理器108可包括运行市售的操作系统的市售的可编程的机器。操作者工作站102提供操作者接口,该操作者接口使得扫描处方能够被输入到mri系统200中。通常,操作者工作站102可被耦合到四个服务器;脉冲序列服务器110;数据获取服务器112;数据处理服务器114;以及数据存储服务器116。操作者工作站102以及每一个服务器110、112、114,以及116被连接以彼此通信。例如,服务器110、112、114,和116可经由通信系统117连接,该通信系统可包括任何合适的网络连接,无论有线的,无线的,或者他们的组合。作为示例,通信系统117可包括私有的或者专用的网络,以及开放网络,例如互联网。
48.脉冲序列服务器110响应于从操作者工作站102下载的指令运行以操作梯度系统118以及射频(“rf”)系统120。用于执行规定的扫描所必须的梯度波形被产生并且被施加于梯度系统118,该梯度系统118激励组件122中的梯度线圈以产生磁场梯度,并且用于位置编码磁共振信号。梯度线圈组件122形成磁体组件124的一部分,该磁体组件124包括极化磁体126以及全身rf线圈128。
49.通过rf系统120将rf波形施加于rf线圈128,或者单独的本地线圈(在图2中未示出),以便执行规定的磁共振脉冲序列。由rf线圈128,或者单独的本地线圈(图2中未示出)检测到的响应磁共振信号被rf系统120接收,在rf系统120处,这些信号在由脉冲序列服务器110产生的命令的指导下被放大,解调,滤波,以及数字化。rf系统120包括rf发射器,用于产生在mri脉冲序列中使用的各种rf脉冲。该rf发射器响应于该扫描处方以及来自脉冲序列服务器110的指导来产生期望的频率、相位,以及脉冲振幅波形的rf脉冲。产生的rf脉冲可被施加于全身rf线圈128或者一个或者多个本地线圈或者线圈阵列(在图2中未示出)。
50.rf系统120还包括一个或者多个rf接收器通道。每一个rf接收器通道包括rf前置
放大器和检测器,所述rf前置放大器放大通过其被连接至的线圈128接收的磁共振信号,所述检测器检测和数字化所接收的磁共振信号的正交分量。所接收的磁共振信号的幅度因此可在任意采样点通过所述分量的平方和的平方根来确定:
51.并且所接收的磁共振信号的相位也可根据如下关系来确定:
52.脉冲序列服务器110还任选地从生理获取控制器130接收患者数据。通过举例的方式,生理获取控制器130可从多个不同的连接到患者的传感器接收信号,诸如来自电极的心电图(“ecg”)信号,或者来自呼吸风箱或者其他呼吸监测装置的呼吸信号。这样的信号典型地被脉冲序列服务器110用来同步,或者“门控(gate)”,扫描的性能与受试者的心搏或者呼吸。
53.脉冲序列服务器110还连接到扫描房间接口电路132,该扫描房间接口电路132从与患者的状况和磁体系统相关联的各种传感器接收信号。患者定位系统134还通过扫描房间接口电路132接收命令以在扫描期间将患者移动到期望的位置。
54.通过数据获取服务器112接收由rf系统120产生的数字化的磁共振信号样本。数字获取服务器112响应于从操作者工作站102下载的指令操作以接收实时磁共振数据并提供缓冲存储器,使得没有数据因为数据溢出而丢失。在一些扫描中,数据获取服务器112不比将所获取的磁共振数据传递到数据存储器服务器114做得更多。但是,在需要从获取的磁共振数据导出的信息来控制扫描的进一步性能的扫描中,数据获取服务器112被编程以产生这种信息并且将其传送到脉冲序列服务器110。例如,在预扫描期间,磁共振数据被获取并且被用于校准由脉冲序列服务器110执行的脉冲序列。作为另一例子,导航器信号可被获取并且被用于调整rf系统120或者梯度系统118的操作参数,或者控制其中k
‑
空间被采样的视图顺序。在又另一个例子中,数据获取服务器112还可被用于处理被用于检测磁共振血管造影(mra)扫描中的造影剂的到达的磁共振信号。通过举例的方式,数据获取服务器112获取磁共振数据并且实时处理它以产生用于控制扫描的信息。
55.数据处理服务器114从数据获取服务器112接收磁共振数据并且根据从操作者工作站102下载的指令来处理它。这种处理可例如包括下列中的一个或者多个:通过对未加工的k
‑
空间数据执行傅里叶变换重建二维图像或者三维图像;执行其他图像重建算法,例如迭代或者背向投射重建算法;向未加工的k
‑
空间数据或者重建的图像应用过滤;产生功能磁共振图像;计算运动图像或者流动图像;等等。
56.由数据处理服务器114重建的图像被传送回到操作者工作站102,在操作者工作站102处他们被存储。实时图像被存储在数据库存储器高速缓存中(图1中未示出),从该数据库存储器高速缓存,他们可被输出到操作者显示器112或者位于磁体组件124附近的显示器136以供主治医师使用。批处理模式图像或者选择的实时图像被存储在盘存储器138上的主数据库中。当这样的图像已经被重建并且被传输到存储器时,数据处理服务器114在操作者工作站102上通知数据存储服务器116。操作者工作站102可被操作者用来存档图像,产生影片,或者经由网络将图像发送至其他设施。
57.mri系统200还可包括一个或者多个联网的工作站142。通过举例的方式,联网的工作站142可包括显示器144;一个或者多个输入装置146,例如键盘和鼠标;以及处理器148。联网的工作站142可位于与操作者工作站102相同的设施内,或者在不同的设施内,例如不同的卫生保健机构或者诊所。
58.联网的工作站142,无论在与操作者工作站102相同的设施内还是在与操作者工作站102不同的设施内,可经由通信系统117获得对数据处理服务器114或者数据存储服务器116的远程访问。因此,多个联网的工作站142可具有对数据处理服务器114和数据存储服务器116的访问。以这种方式,磁共振数据,重建的图像,或者其他数据可在数据处理服务器114或者数据存储服务器116与联网的工作站142之间交换,使得数据或者图像可通过联网的工作站142远程地处理。此数据可以以任何合适的格式被交换,诸如根据传输控制协议(tcp),互联网协议(ip),或者其他已知的或者合适的协议。
59.如所述的使用mri系统200获取的信号,不像ct图像信号,不承受与电子密度的直接关系。因此,在一些方面,mri系统200,独立地或者与其他处理或者分析系统一起协作,可被配置成处理磁共振数据,重建的图像,和/或其他数据以产生如所述的适合于用在放射疗法中的数据,图像,或者信息。
60.现在参考图3,示出了一流程图,该流程图阐述了根据本公开的方面的用于产生合成的ed图像的过程300的步骤。具体地,可使用多个合适的系统或者装置,包括成像系统,计划系统,处理系统等等,或者他们的组合来执行过程300的步骤。
61.具体地,过程300可在过程框302处开始,藉此例如从数据存储器或者其他计算机可读介质接收多个图像数据,其中图像数据包括1d、2d、3d,和4d图像数据。在一些方面,过程框302可包括指导如所述的mri系统来获取多个图像数据以用于放射疗法过程中,并且从那里接收所获取的图像数据。通过举例的方式,接收的或者获取的图像可以包括使用多个翻转角的3d快速低角度拍摄(flash)图像,使用多个翻转角的3d平衡稳态自由进动(bssfp)图像,使用多个回波时间的3d gre图像,使用多个重复时间(tr的)3d实际翻转角(afi)图像,等等。如所述的,获取的图像可能需要包括体积覆盖,切片厚度,空间分辨率,几何保真度,以及适合用于放射疗法过程中的图像均匀性。此外,针对易受运动影响的身体区域,可能需要合适的获取速度和/或运动校正以用于获得无伪像图像并且因此获得准确的治疗计划。根据本公开的一些方面,k
‑
空间数据的回顾时间改组可被用于产生阶段解析的4d mr图像数据,如将要描述的。
62.在过程框304处,多个校正可被应用于接收的或者获取的图像数据,如下面讨论的。
63.具体地,3d梯度非线性几何失真校正可通过应用各种校正算法被应用于任意或者全部图像。在一些优选的方面,可使用通过比较失真幻像(phantom)的反转的梯度图像建立的向量变形场(vdf)来执行这样的校正,藉此可在逐个扫描仪的基础上采用幻像的设计图像。这一方法比由扫描仪制造商提供的勒让德(legendre)多项式3d失真校正算法更具有鲁棒性,在勒让德多项式3d失真校正算法之后,残余的几何失真通常保留。
64.同样,可执行校正以考虑偏共振(off
‑
resonance)效应,包括主场(b0)不均匀性,化学位移,以及磁化率效应。具体地,这些可通过产生患者的采用基于在两个回波时间获得的3d梯度
‑
回复回波(gre)图像的相位差映射确定的磁场映射来被校正。在一些方面,用于
产生磁场映射的gre图像可以是用于下面讨论的t2
*
映射的多
‑
回波gre图像的子组,藉此增加扫描效率。
65.此外,可针对rf发射/接收场不均匀性校正任意或者全部图像。具体地,b1+(rf发射场)的快速映射还可使用实际翻转角成像(afi)成像方法来执行,该成像方法由修改的具有两个重复时间的3d flash序列,大的扰流板(spoiler)梯度,以及特定的rf相位循环计划表组成。第2阶到第7阶多项式曲面随后可被随后拟合以使所得的翻转角(fa)映射平滑,所得的翻转角映射直接涉及b1+场。此外,针对b1
‑
(rf接收场)的校正还可使用紧接在数据获取之前,例如使用预扫描测量的相控阵列线圈灵敏度来执行。
66.在过程框314处,通过汇集经校正的图像数据,产生多个弛豫映射,包括t1、t2、和t2
*
映射。具体地,可使用采用不同的翻转角(例如,2、5、10、15、25度,尽管其它值是可能的)获取的一组多个3d flash图像(例如3到5个)来执行迅速t1映射。如所述的,可针对梯度非线性和偏共振诱发的空间失真校正图像。“翻转角系列”可被形成并且可通过翻转角系列到使用b1+映射确定的校正的翻转角的最小二乘拟合来获得t1参数映射。同样,还可使用利用不同翻转角获取的几个3d平衡的bssfp图像的集合来执行迅速t2映射。可针对梯度非线性和偏共振诱发的空间失真校正该多个翻转角图像中的每一个。翻转角系列可被形成并且可通过翻转角系列到使用b1+映射以及t1和b0参数映射确定的校正的翻转角的最小二乘拟合来获得t2参数映射。此外,可进一步使用获取的3d多回波gre图像,使用,例如,一组四个到八个回波时间来执行t2
*
映射,其中相位校正的实时图像的“回波系列”被输出。回波时间可以在0.07到30ms的范围内,尽管其他值是可能的。如所述,可针对梯度非线性和偏共振诱发的空间失真校正图像。t2
*
参数映射随后可通过相位校正的实时图像到回波时间的最小二乘拟合来获得。
67.在图4中示出了如描述的表示示例的图像获取和后处理步骤的框图。通过举例的方式,示出了b1+不均匀性对t1参数映射的的影响,图5比较来自健康志愿者的校正的大脑图像和未校正的大脑图像。在没有针对b1+不均匀性的校正的情况下,t1映射示出了相当大的非均匀的图像强度(阴影),如在图5的左侧的灰度级和彩色映射中示范的。该阴影转化为计算的t1弛豫值中的误差,其必须被校正以用于准确的组织分割。应用b1+校正导致高度均匀的t1参数映射,如在图5的右侧的灰度级和彩色映射中示出的。针对t2参数映射获得类似的结果。
68.再次参考图3,在过程框308处,可根据特定感兴趣区域(roi)分割如上所述的基于校正的图像数据产生的弛豫映射和其他图像。例如,可通过阈值化mr弛豫参数来执行分割。在一些方面,可使用otsu方法(otsu's method)(应用基于聚类的图像阈值化,其中t1、t2和t2*值用作输入的一种方法)执行分割。还可使用其他图像分割方法,自动化技术或者半自动化技术。
69.如在图21的例子中示出的,来自各种制造商的mr扫描仪产生不仅可在如所述的均匀性上变化,而且还可在整体强度级上不同的图像,如由2100大体指示的。尽管针对偏共振效应,梯度不均匀性以及其他伪像的校正可如所述地进行校正,但这样的校正没有影响整体强度级,如由2102所示的。如此,在一些方面,还可通过执行归一化程序针对强度变化校正图像或映射。这可包括接收扫描仪类型,或者制造商,以及成像条件(诸如磁场强度)的指示,并且根据接收到的指示应用归一化。如由2104指示的,这种归一化可以跨制造商和成像
条件实现图像的标准化,从而以可在分割和位置验证期间被有利地使用的方式固定窗口宽度和级别。
70.在过程框310处,可根据显现弛豫映射集合的图像强度来执行对在过程框308处分割的roi的组织分类。例如,可利用基于图集的(atlas
‑
based)组织分类。具体地,可以根据在给定磁场强度(诸如3特斯拉)下获取的公布的mr弛豫值(例如,t1,t2,t*弛豫时间)来分类分割的结构或器官。
71.随后,在过程框312处,可使用分配过程将电子密度值分配给经分类的结构。具体地,在过程框308处分类的结构或者器官可被分配组织特有的电子密度值。可以任何方式确定或者计算这种ed值,或者可以其它方式从任何参考(诸如icru报告#46)获得这种ed值。
72.在过程框314处,随后可使用经分类的结构来生成例如如所述的以3d或4d图像集为形式并针对失真和不均匀性进行校正的合成电子密度图像图像。在一些方面,校正的合成电子密度图像可被转换为合成ct图像,例如,通过利用反向的(inverted)ct
‑
ed标准转换表,通常在临床放射治疗计划系统上可用的。图6示出了说明在相对电子密度与亨斯菲尔德单元(ct数)之间的转换的示图。
73.与经校正的合成ed或者ct图像相关联的电子密度值可允许被配置用于放射疗法计划发展或者能够使用电子密度数据执行剂量计算的任何系统产生治疗计划,如由过程框316指示的。这种剂量计算帮助确定放射剂量分布,该放射剂量分布表示在任何期望的或者感兴趣的靶区域内、周围或大体附近接收的剂量。在一些方面,剂量分布随后可在在线放射疗法计划适应策略中被使用或者修改,如将被描述的。
74.通过举例的方式,图7显示了根据前述描述生成的健康志愿者的骨盆的合成的ed(左)和合成的ct(右)图像。六个组织类型被分割并且被分配电子密度:空气,骨头,脂肪,肌肉,水(膀胱中的尿),和皮肤。超出图7中所示的组织分类的附加的组织分类(例如,将皮质骨与骨髓分开)仍然可以是可能的。图7中显示的骨盆的合成的ct图像被转移并且加载到monaco治疗计划系统(elekta,sweeden)上,其中在打开和没有打开异质性校正的情况下计算体积调制弧形疗法(vmat)计划,如图8中所示。在图8的右上,802中示出的dvh图中的实线和虚线之间的可见的差别,以及在图8的右下,804中示出的+/
‑
90cgy剂量差,证明了所使用的计划系统能够使用由合成的ct图像提供的信息来在打开异质性矫正的情况下计算剂量。
75.上述过程展示了用于合成来自适合于用在放射疗法计划和递送中的mr图像数据的电子密度信息的模型
‑
独立的,mri
‑
扫描仪
‑
独立的方法。可从中导出合成的电子密度和合成的ct图像的弛豫参数映射针对通常在传统的幅度mr图像中经历的已知的空间失真、非均匀的图像强度和灰度级信号强度的变化的源被完全地校正。这些特征尤其解决了妨碍传统的幅度mr图像在基于mr的放射疗法和自适应放射疗法应用中的日常使用的当前障碍。此外,从中获得合成的电子密度和合成的ct图像的基础图像的获取是足够快的来在屏气中执行,从而允许在倾向于运动伪像的有挑战性的身体区域中合成的ct图像的产生。尽管所描述的方法不依赖于解剖学模型(图集)或者可变形的配准,但如果需要,这些可以连同本公开的系统和方法一起使用。
76.如可被理解的,知道靶和处于风险的器官的运动轨迹在放射疗法中是关键的。运动可导致计划的剂量分布的模糊,尤其是当陡峭的剂量梯度被用于减少至接近oar的剂量。已经引入很多策略来管理运动。但是,通常,这些方法遭受下列缺陷中的一个或者多个:运
动替代的使用(例如,风箱(bellows),反射器气室(reflector camera),身体表面区域),rf应答器的侵入性植入,离子化放射的使用,不良的软组织对比度,有限的穿透深度,时间关联的空间信息的缺乏,由大的裕量导致的大的照射体积,由于门控导致的减少的治疗效率。
77.由于其非离子化和高的软组织对比度性质,mr成像呈现了理想的四维(4d)成像平台。然而,空间
‑
时间
‑
对比度分辨率折衷妨碍了真实的、4d mr图像的获取。例如,平均的人类呼吸周期大约是五秒钟。为了与4d
‑
ct类似地解决运动(其中呼吸循环被十中抽一为10个阶段),理想的4d
‑
mri方法将需要每0.5秒或者更少地获取无伪像,高对比度,高分辨率的3d体积。即使采用最新的mri技术,包括平行成像,多带激励,以及压缩的感测,这一需求仍然不可实现。此外,mr引导的rt的引入对快速的,体积mr成像提出附加要求。异常门控和实时肿瘤跟踪使图像获取,重建和分割链中的低延迟成为必要。
78.因此,根据本公开的方面,可通过对在患者正常呼吸时获取的k
‑
空间数据执行回顾时间改组来获得用于rt治疗中的真实4d mr图像。这一方法不依赖于外部呼吸替代(风箱,反射器气室,身体表面区域等),改进了图像对比度,并且消除了成像放射剂量。
79.通过举例的方式,在此描述了数据获取。具体地,可利用黄金角径向脉冲序列,其能够在平衡稳态自由进动(bssfp)或者扰相梯度回复回波(spgr)获取的2d和3d电影(cine)模式之间切换。来自每一个获取的径向辐条的dc信号可被用作导航器,从而提供呼吸替代以引导阶段解析的图像重建。降级的最大梯度振幅和转换速率可被用于最小化涡流效应。
80.冠状4d
‑
mr图像,例如可利用以下列参数在3d电影模式中运行的序列进行收集:fov=380cm,te=0.8毫秒并且tr=1.9毫秒。如所述的,总扫描时间可以是大约六分钟。尽管已经在上面描述具体的扫描实现,但本领域技术人员将理解到对扫描参数的各种修改可以被执行并且被认为在本公开的范围内。
81.随后可使用图22中所示的方法来重建如所述的基于获取的数据的图像。在一些方面,未加工的k
‑
空间数据可由任何合适的系统转移和线下处理。用于每一个径向辐条(或者相位编码线)的dc导航器信号可被确定,并且在时间上被标绘,如在图22中所示。通过基于振幅或相位将从导航器波形获得的每一个呼吸循环十中抽一为假定10个时间面元(bin)(阶段)来产生面元开始时间的查找表。面元开始时间的查找表随后可被用于使用每一个获取的径向辐条(或者相位编码线)的头部中的时间戳或者脉冲序列循环结构的知识来将未加工的4d
‑
mri k
‑
空间改组成假定10
‑
面元(10阶段)混合k
‑
空间。被改组到混合空间中的相同位置的辐条或者线随后可被线性地组合,利用基于与面元的中心的时间接近度的加权。可使用压缩的感测重建来填充跟随该改组的遗漏线。随后可应用3d fft来将改组的混合k
‑
空间数据转换为用于每一个面元的图像(例如,0%,10%,20%等等)。每一个时间阶段的最终图像随后可被内插到假定1到2mm3的分辨率并且被转换为dicom以便于后续图像处理。如所述的,这样的图像可被用于获得在呼吸循环的每一个阶段处的合成的ed或者ct图像。
82.以上获取描述了可切换的扰相序列或者平衡序列。这便于某些肿瘤相对于混合的t2/t1对比度,以t1对比度被更好地可视化。此外,对于肿瘤和具有慢动力学(例如,冲洗)的组织,可通过获取钆后4d数据来改进4d数据上的靶可视化。例如,肝细胞癌(hcc)和食道癌的可视化将受益于使用bssfp序列获得的t2/t1对比度。然而,肝转移的可视化将受益于在跟随对比剂注射的延迟处使用spgr序列获得的t1对比度。肺损伤的可视化将受益于通过降低的条带伪像的spgr获取。
83.此外,在2d电影成像期间获取dc导航器是新颖的方法,该方法组合了笔形束导航器和迅速电影成像的优点。类似于笔形束导航器,获得极低的延迟(不需要图像重建)。这与成像同时地从笔形束导航器提供信息。而且,dc导航器可以针对每一个相位编码来获得并且不需要图像重建。这对于mri
‑
grt具有优点,在于针对每一个相位编码线获得的dc导航器具有极低的延迟,并且可被用于实时肿瘤跟踪预测算法中以驱动多
‑
叶准直器(mlc)的系统。
84.在一些方面,可使用如上所述获得的图像来执行运动分析。例如,可分析每一个4d
‑
mri数据集的呼吸阶段图像以确定运动。例如,大体靶体积(gtv)可在第一时间阶段上被轮廓化并且随后使用可变形的图像配准过程被传播到其他九个时间阶段。还可针对其他结构或者器官,处于风险的器官,等等重复该程序。使用沿着轮廓化的结构中的每一个的每个笛卡尔轴的质心(com)部件,主成分分析(pca)可以被执行以确定gtv和结构com运动的特征向量和特征值。这种运动分析对于在rt治疗递送期间的实现可以是有用的,如将要描述的。
85.使用如描述的系统和方法产生的合成的ct图像相比于其它替代为基于mri的放射疗法展现若干有利特征,包括,与现有的千伏电压(kv)和兆伏电压(mv)基于ct的igrt技术的完全兼容性,与迅速发展的基于mri的igrt技术的完全兼容性,以及与基于mri或者ct的自适应放射疗法的完全兼容性,其考虑了肿瘤和临界结构的位置,尺寸,以及形状的改变,并且允许裕量尺寸的额外降低。此外,在一些预想的方面,上述方法的应用可被扩展到基于质子的放射治疗计划和递送方法,以及,需要正电子发射断层扫描(pet)图像的衰减校正的系统和应用,例如组合的pet/mri扫描仪。
86.返回到图1,在过程框12处,可使用任何期望的系统和方法来处理或分析诸如上述的或者以任何其他方式获取的任何多模态图像信息以产生用于治疗计划产生和递送中的图像信息。如将要描述的,对图像的获取后处理可包含任意数量的步骤或者方法。例如,这些可以是针对已知的噪声源提供校正,或者应用各种图像变换、变形,或者配准算法,或者确定最佳显示特性以促进准确标识解剖学结构(例如,窗口或者级别),或者勾画感兴趣的目标,或者产生合成图像,等等。
87.当前使用的很多商业系统能够诸如使用ct/mri、pet/ct或者pet/mri系统产生同时获取的多模态图像数据。但是,在很多情况下,这样的系统不可用或者不是放射疗法的临床工作流实践的一部分。因此,典型地,在过程框12处,可能需要组合单独地获取的多模态图像以提供准确确定临界目标所必须的补充信息。由于典型地,这样的图像是使用不同的扫描仪,并且通常在不同的时间下获取的,因而如本领域已知的变换或配准对于不同数据集中的图像或者轮廓化的结构占用相同的坐标系统而言是必需的。简单地,图像配准的过程包含确定将在目标的一个视图中的点与在该目标或者另一个目标的另一个视图中的对应点对准的几何变换,其中该视图可以是二维或者三维视图,或者目标在空间中的物理布置。
88.图像配准典型地包含模态间图像,诸如ct和mr图像,mri和pet图像,pet和ct图像,对比度增强的ct图像和非对比度增强的ct图像,超声和ct图像,等等。此外,图像配准还可被用于模态内成像,其中结构可在不同时间下获取的图像序列之间移动或者扭曲。图9示出了在固定图像902和运动图像904之间的配准的例子。因此,在自适应放射疗法的上下文中,可能期望根据日常或当前成像调整或者修改在初始放射疗法计划阶段处标识和采用的靶
和/或临界结构的图像或者轮廓,所述靶和/或临界结构的体积或者形状可能已经改变在期望的阈值之上。
89.在很多自由形式的配准方法之中,参数化的b
‑
样条可变形图像配准(dir)方法具有自动化功效,局部变形控制和多模态能力的益处。然而,该模型的变形模式由于缺乏物理模型支持而不一定遵循器官的真实运动,并且因此引起伪像,诸如骨头扭曲和不准确的精细结构对应。因此,期望更加准确的替代的图像配准方法。
90.在本公开的一个方面,提供了一种新的配准方法,所述方法被设计层缓解先前方法的缺点。具体地,可使用修改的参数化b
‑
样条变形模型,该模型被设计成通过使用新的正则化方法(即,弯曲能量有限微分同胚(beld))来克服先前的限制。微分同胚正则化被典型地用于保证变形平滑度,并且由于在每一个迭代步骤中的所有网格点的雅可比(jacobian)矩阵计算而是计算上昂贵的。然而,微分同胚正则化结果不一定遵循真实变形路径。因此,在本公开中,通过限制相邻网格变性参数之差而不是如传统方法中常见的繁重地计算雅可比矩阵来实现准确的微分同胚。弯曲能量惩罚可进一步被用于限制平滑自由度,保持结构拓扑,以及增加配准准确度。因此,在图像的不同部分中的弯曲能量惩罚随后可通过靶图像和源图像两者的主要部件(骨头,体液,组织和空气)的自动分割而被便利地差异化。
91.具体地,弯曲能量可被用作b
‑
样条变形模式中的惩罚项,如下计算:
92.其中,是在位置处的局部变换。当软组织构成感兴趣区域中的大多数部分时,这一项是计算昂贵的。如果以张量积形式写b
‑
样条变换
93.其中,l∈{x,y,z}并且β
n
是第n阶b
‑
样条基,惩罚函数形式被定义为
94.其中幅角t指示两个相邻变形系数之间的差。当与b
‑
样条系数结合时,惩罚函数是
95.其中,ζ1=0并且ζ2=0将对应于体积保持约束对于任何
96.可使用以上方法保证微分同胚,但是在这一约束内,变形仍然具有无限的自由度,而更好的解决方案将满足最小化的弯曲能量需求。在beld方法中,替代建立精细的现实模型,可使用简化的半物理模型,其中通过最小化在网格点处的弯曲能量来限制微分同胚,其在计算上轻得多。利用来自刚性映射(rigidity map)的正则化,beld约束和特征点距离,整体惩罚函数变为
97.其中和是对应特征点的物理坐标,γ
i
是以经验确定的加权因子。尽管该四个额外的惩罚项可能看似增加计算的复杂度,但每一项仅在有限的区域中有效,并且因此可以在连续的阶段中被优化。而且,由于惩罚函数和互信息度量的非线性性质,可以使用非线性共轭梯度优化方法。搜索方向可以被定义为成本函数梯度和先前搜索方向的线性组合。
98.在一些配置中,如所述的可变形配准方法可被实现为软件工具,与任意放射计划系统,图像分析或者处理系统以及软件集成或协同。这种工具可包括各种步骤和功能,诸如,例如,进行下列的能力:(1)接受不同模态的图像的输入,(2)将在任意参考图像(例如mri)上的现存轮廓转换为勾画的体积以及调整体积内的图像强度以匹配靶图像(例如,ct)强度分布,以用于增强的相似性度量,(3)使用如所述的合适的可变形配准算法(例如,b
‑
样条,demons)来配准参考图像和靶图像,并且产生变形的轮廓,(4)将变形的体积映射在靶图像上,计算平均数,方差,以及质心作为靶图像上的连续的模糊连接度(fc)图像分割的初始化参数,(5)从fc生成亲和(affinity)映射,(6)通过使用亲和映射利用梯度距离加权算法修改变形的轮廓来产生轮廓。此外,这种软件工具可受益于gpu处理,该gpu处理由于高度并行和有效的处理结构而可以比使用cpu处理快多个数量级。
99.在各种临床情况中测试这一方法。图10示出了应用于乳腺癌情况的beld
‑
正则化可变形图像配准的例子,其中患者处于仰卧位置。从左到右,在面板(a)中的图像分别示出了原始mr和ct图像,其中ct图像包含轮廓结构。随后,在面板(b)左侧的图像示出了使用利用传统未正则化方法的dir从ct转移的轮廓,以及在面板(c)左侧的相应的变换场。对比之下,在(b)和(c)右侧面板上的图像分别示出了使用如所述的beld正则方法的转移的轮廓和变形场。图10证明了对于其中患者处于仰卧位置的乳腺癌情况,使用beld正则化相对传统的(未正则化的)方法的改进。清楚的是,该未正则化的dir导致具有降低的配准准确度的不切实际的变形场。相比之下,利用本公开的beld正则化,变形场和配准准确度两者均被改进。
100.图11示出了对于其中患者处于仰卧位置的乳腺癌情况的beld
‑
正则化的dir的例子。顶部图像和底部图像分别示出了原始的mr(顶部)和ct(底部)图像。面板(a)示出了来自使用刚性配准算法覆盖到ct(底部)图像上的mr图像的乳腺和乳房肿瘤切除术腔轮廓。对比之下,面板(b)的顶部图像示出了从ct转移到mr的轮廓,而(b)的面板的底部图像示出了基于beld正则化的dir的从mr到ct的转移的轮廓。蓝色的轮廓是从原始mr图像上的红色轮廓变形而来的。相比于导致实际轮廓与变换的轮廓之间高达10mm(平均4.2mm)的差别的未正则化的配准,beld
‑
正则化的dir将该平均差降低到1.8mm。这证实了本公开允许乳腺和乳房肿瘤切除术腔的轮廓从mr被准确地变换到ct以便于在放射治疗计划中使用。
101.此外,还针对在相同的呼吸阶段处获取的胰腺癌患者的ct和mr图像测试这一方法以最小化运动失真。针对靶图像上的直接勾画计算dice的系数。通过各种方法来产生轮廓,包括刚性转移,自动分割,可变形仅转移和正则化b
‑
样条方法,如上所述,被比较。尽管模糊连接的图像分割涉及仔细的参数初始化和用户参与,但如所述的通过多模态可变形配准的自动轮廓转移相对刚性转移提供高达10%的准确度改进。提供调整强度分布和利用亲和映射修改变形的轮廓的两个附加步骤可进一步有利地在转移准确度上改进高达14%。
102.图12示出了来自根据本公开的通过变形场处理的多模态轮廓化结构的结果的例子。具体地,pet,以及包括t1、t2、dwi和dce的各种mri与具有胰腺癌的代表性患者的ct图像
刚性地配准。大体肿瘤体积(gtv)和处于风险的器官(oar)在多模态图像上被勾画并且使用如所述的可变形多模态图像配准工具被处理。针对gtv和oar两者观察来自多模态图像的轮廓之中的实质性变化,如图12中所示。图12的上两个图像1202示出了来自使用多模态图像产生的不同覆盖轮廓之中的几个结构的体积的大的变化。导出的变形场随后被应用以使对应的模态轮廓变形,其随后被重叠到计划ct上。图12的下两个图像1204示出了在使用变形场处理之后不同的模态轮廓之中的增加的重叠。当使用t1加权的轮廓体积作为提名者(nominator),勾画的体积在图像模态之间对于gtv从0.5变化到1.8,对于oar从0.81变化到1.05。在不同模态之间的重叠率对于gtv从0.22变化到0.74,并且对于oar从0.65变化到0.84。在可变形图像配准之后,轮廓体积被变形场改变6%到11%。图12中观察的在dir之后的剩余的变化主要是由于成像模态之间的固有差别。这些改变不影响不同模态之间的体积变化,但显著地改善来自不同模态的轮廓之间的重叠率,例如,对于gtv从0.55改变到0.82。因此,多模态图像的可变形图像配准增加了来自不同图像模态的轮廓之间的一致性,改进了靶和正常结构勾画的准确度以用于胰腺癌的放射治疗计划。
103.配准算法经常使用平滑核来降低迭代之间应用的变形场的不连续。在本公开的另一方面,提供了一种新颖的方法用于实现在被配置成执行图像配准的系统和方法中,其中在运行时间期间根据阈值(诸如可变形图像配准的收敛速率)自适应地修改高斯平滑核的维度。具体地,大的核尺寸可被最初使用并且随后通过后续迭代被降低。利用其他方法,随着迭代次数增加,收敛速率开始降低,直到达到渐近值。在此点处,配准的准确度保持未受进一步迭代的影响。相比之下,在本公开中,改变核尺寸允许避免渐近的收敛并且该准确度则可以能够朝向新的可能值的范围继续。以这一方式,随着平滑核的尺寸被逐步降低,该准确度继续改进。这一方法具有若干优点,其有益于相对采用基于demons的配准算法的传统方法而言改进的配准准确度。具体地,一个优点是该核足够鲁棒来处理大的变形,诸如在膀胱和直肠中发现的那些,还足够敏感来处理精细细节,并且还典型地不受非物理变形的影响。此外,其还提供图像中的共同结构之间的空间对准,从而使得进一步的配准更简单。
104.图13示出了展示可变核平滑技术对配准准确度的影响的例子。典型地,准确度在多个后续迭代之后改善,如由图像之间的平均像素差的降低所指示的。然而,当仅仅使用给定的核尺寸时,准确度开始收敛到恒定值(虚线)。如此,通过在满足指定的条件时自适应地调整核的尺寸(圆圈区域),过早的渐近的收敛可以被避免,并且该算法允许过渡到可能值的新范围。这导致改进的配准准确度,超过了恒定核尺寸的可能的限制。
105.这种方法允许典型地在在线自适应放射疗法中采用的锥形束ct(cbct)和ct图像的快速且准确的可变形图像配准。测试示出了可变核方法导致改进的准确度,该改进的准确度超过对于恒定核尺寸的准确度。具体地,使用上述技术配准针对6个前列腺癌患者获取的计划ct和日常cbct。直方图匹配被用于补偿两个模态之间的强度差。皮尔逊(pearson)相关系数(pcc)和体积重叠指数(voi)被用于量化配准准确度。结果示出平滑核尺寸的迭代的减少允许该算法收敛到越来越准确的解决方案,超过了对于恒定核尺寸的渐近限制。针对膀胱、前列腺和直肠计算平均voi,值分别为91.9%,68.7%,和78.2%。针对每一个患者数据集中的重叠的ct和cbct扫描体积中的每一个片段(fraction)计算相关系数。对于这六个患者的平均pcc值是0.9987、0.9985、0.9982、0.9980、0.9985和0.9985。对于512x512x70的图像体积的典型运行时间是4.6分钟。因此,使用本公开的dir技术的结果验证了其对于可
变形ct
‑
cbct配准的使用,消除了对图像的多分辨率处理和连续上采样(其可以是计算上密集的)的需要。
106.为了示出所描述的算法在处理大的变形时的鲁棒性,如例如在典型的前列腺癌的情况中所见的,图14示出了对于骨盆ct扫描的配准结果。具体地,使用所描述的技术将计划ct(a)可变形地配准到日常kv锥形束ct(c)。所得的图像(b)与cbct图像处于极好一致。包括的曲线图显示了对于全部图像体积(70切片)在配准之前和之后的相关系数,从而说明了该方法的一致性。这说明了该技术处理相对大的变形的能力,尤其参照直肠区域,其中该算法能够补偿周围组织的相当大的变形。显而易见的差别存在于配准前的图像之间,在配准之后,所得的图像良好一致。
107.此外,模态内dir技术使用demons算法来提供强度映射以用于多个模态到类ct对比度标度的转换。这些可以对不同类型的ct(例如,锥形束ct,mvct),以及超声(us)图像操作。尤其对于us,这样的方法可以实现专门为超声设计的对应函数。但是,在组织回声反射性和ct亨斯菲尔德单元之间的简单关系尚待建立。如此,当前的us
‑
ct配准实践已经被限制到刚性配准或者模态间方法的使用,诸如薄板样条,其需要手动点选择。
108.高频超声(hfus)图像能够展现准确的空间信息,例如,在皮肤损伤中,并且可被用于计划和引导皮肤癌的放射疗法(rt)。因此,在本公开的又另一个方面,提供用于执行us图像和ct图像之间的全自动的准确的可变形配准的系统和方法,其对于需要放射疗法治疗的皮肤癌患者可以是有益的。具体地,基于对称力demons算法引入一种新颖的dir技术,其中可自适应地调整高斯平滑核的尺寸。对应函数还可被用于将衰减值映射到肿瘤弹性并且可实现直方图匹配。皮尔逊相关系数(pcc)可被用作用于评估配准准确度的指示器。
109.如所述的,这一方法在典型地在皮肤肿瘤收缩期间遭遇的大的变形下给该算法提供鲁棒性。由于皮肤损伤特别地具有清晰的外部边界的附加好处,因而本公开还促进使用各向异性扩散滤波器来执行边缘保持平滑,借此降低噪声并增加配准准确度。此类优点可能对于浅表us图像尤其重要,所述浅表us图像可能遭受不良图像质量和低对比度。此外,典型地用于在不同的ct图像类型之间转换的强度匹配技术还可被应用于在不同频率下获取的us图像,使得us
‑
us配准成为可能。
110.为了说明这一方法的可行性,根据本公开,针对选择的感兴趣区域(roi)配准皮肤损伤的hfus图像和他们的对应的ct图像。图15显示了示出对于在大腿中具有浅表性基底细胞瘤(bcc)的患者的ct和hfus之间的配准的例子。该图示出了损伤的ct(a)和高频超声(b)图像,而c)和d)是a)和b)中的矩形区域的放大视图。e)和f)分别是直方图映射的和对比度增强的hfus图像,并且g)和h)是使用上述可变化核平滑技术的ct和hfus的配准的图像。观察到0.9794和0.9815(增强的对比度)的pcc值,指示动态(hfus)和静态(ct)图像之间的极好一致。配准技术还展示出处理大的变形的能力,诸如超过在损伤边缘附近观察的肿瘤厚度的200%的roi位移。发现核维度的渐进降低阻止非物理变形,借此改进配准准确度。这一鲁棒性对于皮肤癌rt是关键的,因为肿瘤可在治疗期间显著地收缩。
111.因此,与标准的图像处理技术组合,本公开的方法对于实现用于皮肤癌rt的hfus和ct图像的可变形配准是足够准确的。这在用于执行对于皮肤癌的图像引导的治疗的能力中可以是有利的,其可降低地理缺失并且可分让更健康的组织。所呈现的技术对于处理大的变形是足够准确和鲁棒性的,使得其成为用于皮肤癌的rt计划和递送引导的有希望的工
具。
112.在多模态图像配准中使用的软件工具,如所述的,可以最小化的用户干扰和计算成本实现物理上准确的配准,从而使得多模态可变形成像配准快速并且准确,尤其是在art重计划或者其他实时应用的上下文中。具体地,相比于用于放射治疗计划中的常见方法,本公开的方法可改进在低图像对比度和大图像变形的有挑战性的条件下的不同图像模态之间的轮廓转移的准确度。
113.返回到图1,在过程框14处,如所述的经处理的多模态图像随后可例如从成像系统或者数据存储器被接收,并且被转移到计划系统以用于产生放射疗法计划。具体地,在针对首次治疗制定计划的情况中,这一过程步骤典型地包括基于选择的或者确定的计划目标的射束或者放射源递送技术和布置的确定。在某些计划方法中,这可包括产生射束的眼观显示,设计场形状(阻挡物,多叶准直器),确定射束修改器(补偿器,楔子)以及确定射束或者源权重。使用手动地执行的或者使用自动的轮廓化工具的轮廓化的临界结构,随后可基于选择的算法或者方法执行剂量计算。使用设置的相对的和绝对的剂量归一化和剂量处方,随后基于可视的覆盖比较,剂量体积直方图分析,以及肿瘤控制和正常组织并发症概率来评估计划质量。自动的或者半自动的优化工具随后可基于计划目标和公差而允许计划改进。
114.在一些情况中,产生的计划还可涉及考虑靶和临界结构的片段内(intra
‑
fractional)运动,例如呼吸运动。因此,根据本公开的一些方面,基于被分成例如5个阶段(尽管其他值是可能的)的4dct或者4d mr图像的用于片段内运动的4d计划方法包括以下方面:(i)通过全标度优化基于阶段图像为一个特定呼吸阶段(例如吸气结束)建立imrt或者vmat计划,(ii)通过应用分割孔径变形(sam)算法将这一计划布居到其他剩余的呼吸阶段上以考虑呼吸阶段之间的解剖的改变,以及(iii)组合所有的阶段特定的计划以形成4d计划。本质上,所有的阶段计划具有相同数量的分割,其中每一个分割具有几个不同的mlc模式,取决于具有相同的mu,颚设置,机架角度等等的阶段的数量。以这种方式产生的4d计划可使用动态mlc和可调节的剂量率来递送,使得每一个分割可以在整数数量的呼吸循环内被递送,从而确保每一个mlc模式与其对应的呼吸阶段一起被递送。具体地,来自多叶序列器的递送文件被产生作为呼吸周期的函数。在每一个治疗片段处,可以以紧接在该递送之前获得的呼吸周期快速地更新该递送文件。如果呼吸循环在递送期间改变,则该递送文件还可以在该递送期间用必要的频率进行更新。
115.对于当与当获取计划图像时相比呼吸实质上不同时的情况,在线自适应4d计划和递送可以如下步骤实现:(1)基于来自计划图像集的单个阶段图像(参考阶段,例如,吸气结束)产生参考计划;(2)将针对该参考计划执行全面排练qa;(3)在治疗片段的时间,基于紧接在治疗递送之前在患者处于治疗位置的情况下获取的4d图像的参考阶段图像上的解剖改变,使用sam算法来修改该参考计划;(4)使用sam算法基于那天的剩余阶段图像中的每一个布居新建立的参考计划(自适应计划);(5)考虑到最当前的呼吸信息,随后对所有的阶段计划进行定序;以及(6)在实时图像引导(例如,正交电影mri)下递送该4d计划并且如果mlc由于患者定位或者呼吸运动的突然改变而未能跟踪到靶,则其递送可被中断。
116.在治疗片段之间的,或者在多个片段的过程上的对靶和临界结构的改变可产生与原始计划的显著偏离,从而具有对治疗效果的潜在地负面影响。如此,在过程框14处提供放
射疗法计划在一些情况中可包括执行应用用于对原始或者首次计划的自适应的技术,诸如由art提供的那些,从而使用在线和线下方法的任意组合考虑治疗的过程期间患者特定的解剖学和/或生物学改变,如将描述的。
117.传统的计划优化方法不是典型地完全自动的,因为常常优化算法递送不期望的结果,需要利用不同的加权目标的附加迭代。这是由于在估计可以针对不同的计划目标实现多少中的困难,通常地在剂量体积约束方面进行定义。例如,一些目标可以被制定为器官或者结构的部分不被允许超过剂量。作为一个例子,一个这样的目标可以是直肠体积的30%不能接收多于60gy的放射剂量。
118.如果单独的oar的目标过于严格,如当剂量体积被置于过低时,或者该目标的相对权重相比于其他目标过高时,这可造成不期望的效果,诸如不足的肿瘤覆盖或者放射剂量热点。由于oar的体积逐天经常改变,因而可能不可能确切地知道多少oar放射节约是可能的,或者具体地直到什么最小百分比的体积需要被照射特定量的剂量。因此,发现正确的目标加权的迭代过程是冗长的并且耗时的,且需要专门技术和经验。
119.旨在克服这一障碍的先前提议的技术尝试通过计算oar/靶覆盖片段来确定最佳可实现的剂量体积直方图(dvh)或者利用多参数标准优化,其中每一个目标被单独地优化并且随后执行线性内插以确定合适的折衷。具体地,多标准优化方法对于在线art是不切实际的,因为其需要多个优化。此外,两种方法被设计用于初始计划优化,而不是重计划,并且需要产生完整集的oar。
120.由器官勾画获得的轮廓是任意在线自适应重计划的耗时部分,其中oar典型地表示要被勾画的多数轮廓。具体地,在消化道周围的器官,诸如肝脏,直肠,肠,以及胃是非常有问题的,因为他们是大器官并且需要很多轮廓。此外,他们的尺寸,形状以及内容一天天地大幅且不可预测地变化,这使得自动轮廓化方法非常难以准确地产生轮廓,从而典型地需要人的勾画/编辑。
121.如所述的,快速在线重计划方法需要有效的方法来修改放射疗法计划,通常在患者躺在治疗台上时。为了克服先前在线重计划方法的缺点,在本公开的另一方面,提供了使用新颖的梯度
‑
维持(gm)算法的系统和方法,该梯度
‑
维持(gm)算法允许完全自动的在线art重计划而无需oar轮廓化。
122.如将要描述的,gm算法要求基于那天的靶建立或者调整射束或者分割孔径,并且使用自主地或者半自主地产生的环结构或者从例如那天的图像上的等剂量线自动地转换的等剂量轮廓来优化射束或者分割权重。该算法从靶附近的临界结构中的每一个的原始计划中的剂量分布来确定剂量梯度,并且初始化重计划优化程序,旨在维持原始计划的剂量梯度。该算法可增强自动化,大幅减少计划时间,并且改进在线重计划的一致性吞吐量。
123.具体地,不像试图以耗时方式确定“什么是可实现的”从而可设置优化目标的方法,本公开的方法有效地确定由物理剂量沉积限制强加的剂量梯度,从而提供“什么可被实现”的直接测量。以这一方式,剂量梯度从原始计划到修改的计划的转移可导致关于允许的物理剂量沉积约束可实现的最佳计划。这种方法相对于先前技术提供多个优点。具体地,可不需要例如每天生成处于风险的器官(oar),因此将勾画实践减少至仅治疗靶。此外,传统的优化算法致力于满足根据oar中的每一个的剂量体积约束指定的一群目标,其通常需要例如在日常图像集上产生体积。对比之下,本公开的方法致力于达到从靶的表面朝向每一
个处于风险的器官的特定剂量梯度,从而允许该优化是更加可再生的和可预测的,并且较少可能需要多个试错法迭代。以这一方式,可减少或消除人的参与连同优化的时间成本一起,这对于快速在线重计划是有吸引力的特征。
124.如所述的gm算法可被配置成在专用的优化软件和硬件中工作,或者可连同被配置用于固定
‑
射束或者旋转
‑
射束放射递送或者他们的组合的系统一起被组合。在一些预想的实现中,如所述的维持从靶的表面的剂量梯度可通过使计划器经由被称为“目标函数”的目标的加权和将期望的计划目标传送给优化算法来实现,在一些方面,可使用剂量梯度产生该目标函数。由于很多商业上可用的优化系统仅允许目标函数被定义在感兴趣的体积和剂量体积目标中,因而本公开的方法可被适应成允许用户产生的部分同心环结构(pcr)被用在定义用于优化算法的期望的剂量梯度中。如此,任何期望的系统或者方法可被用于产生pcr。例如,可使用手动或者自动轮廓化方法来产生pcr。将从本公开的方法中最大获益的解剖部位可能是前列腺和胰腺,给定大量的周围oar结构,具有典型地大的日常不可预测的体积改变以及相对小的靶器官尺寸。在图23中示出了对于前列腺癌情况的示例性pcr 2300。
125.转到图16,示出了示例性在线计划适应过程1600,该过程示出了用于gm算法的操作模式。具体地,可在已经满足将触发计划修改的任意条件时,诸如,例如,在降低的目标覆盖或者增加的放射剂量热点的情况中,利用这一过程1600。过程1600在过程框1602处开始,其中放射疗法治疗计划被提供作为配置成执行过程1600的任意系统(诸如治疗计划或者递送站)的输入。至少由放射剂量分布定义的该治疗计划输入可以是在治疗调度的开始产生的计划,或者可以是后续被修改的计划。在一些方面,可在过程框1602处使用传统的计划技术(诸如imrt优化)来产生计划。这种计划可使用在计划图像上的全组的轮廓来实现对于靶和oar两者的期望的剂量体积目标,并且可以是对于所利用的计划技术的最佳可能计划,假定计划器不必须在时间约束下。
126.在过程框1604处,使用来自所提供的或者所产生的计划的放射剂量分布,确定剂量梯度,所述剂量梯度定义从至少一个靶结构朝向任意或者全部的非靶结构或者处于风险的目标的放射剂量的变化。这样的剂量梯度可被用于定义任意数量的优化目标中,其在如所述的在线计划优化过程中可能是期望的。具体地,在已经经受优化的治疗计划中的放射剂量分布可潜在地表示对于期望的剂量约束的最佳可实现方案,并且因此可证明是在优化过程中的良好起始点。
127.随后,在过程框1606处,提供更新的图像信息,所述更新的图像信息可包括多模态图像集。例如,更新的图像集可包括任意数量的磁共振图像,计算机断层扫描图像,超声图像,正电子发射断层扫描图像,以及合成电子密度图像,或者他们的任意组合。更新的图像信息随后可在过程框1608处被用来产生任意更新的靶体积的轮廓。如所述的,可以自主地或者半自主地产生这样的轮廓。
128.更新的靶轮廓随后可在过程框1610处被用来产生大体关于或者围绕靶结构的更新的轮廓布置的pcr结构。在一些方面,pcr结构可以更新的靶轮廓为中心并且指向任意或者全部的非靶,或者处于风险的目标,并且沿着pcr结构的剂量体积直方图的点可被用于产生在优化过程中使用的目标函数。随后,在过程框1612处,可使用产生的pcr结构连同来自过程框1604的根据确定的剂量梯度定义的目标一起执行优化过程。在可能需要任意数量的迭代的该优化过程期间,可根据所定义的目标来修改该目标函数,从而实现靶向的剂量约
束或者剂量梯度,例如,关于任意或者全部的非靶或者处于风险的目标从更新的靶体积的表面的剂量梯度。
129.随后,在过程框1614处,产生报告,该报告表示从该计划优化过程获得的适应的放射疗法计划,其可以采用任意形状或者形式,如由治疗计划验证或者递送系统所期望的或者需要的。
130.由于,如所述的,轮廓化的结构可经受使用标准算法的可变形的配准,其典型地没有提供非常准确且可靠的轮廓,因而对变形的轮廓的直接使用对于一些日常计划优化方案可能证明是存在问题的。对比之下,gm算法不需要轮廓是非常准确的,因为可仅利用结构的相对位置,并且器官形状的变化可能不会影响pcr的准确度。例如,为了朝向特定临界结构产生pcr,可能仅仅需要知道围绕靶的环的什么部分将朝向该临界结构。因此,pcr区域是该临界结构到该靶或者该环的表面的投影。由于该临界结构的3d体积信息被收缩(投射)到2d靶表面上以确定环的朝向该临界结构的那部分,因而该临界结构的体积中的不准确通过该收缩被很大程度地减少了。此外,可在环区域周围施加裕量,例如,3mm的裕量。对于诸如肠之类的非常大的结构,临界结构的仅在该靶的特定距离(例如,2cm)内的那部分可被包括。此外,有可能以较简单的方式针对某些器官产生pcr,例如直肠,其中可以使pcr覆盖从前列腺表面的整个范围的后方向。
131.对于一些结构,例如膀胱,自动轮廓化可以实现具有适当准确度的日常轮廓。如此,在轮廓勾画方面,使用pcr可提供类似的时间减少。但是,由于膀胱体积一天天地大幅改变,因而这将使得目标函数中的最佳目标权重难以预测。因此,基于pcr的优化从提供更可预测的优化的意义上来说可能仍然是有利的,如上所提及的。
132.在研究中,调查本公开的方法来快速地产生自适应计划。使用日常治疗ct,仅靶结构(ctv)被勾画。随后使用内部程序自动地产生均匀厚度(即,3mm)的pcr结构。存在朝向围绕靶的重要的临界结构中的每一个的分离的pcr结构。这通过首先产生围绕每一个靶全部周围的环并且随后发现所述环与每一个oar的投影的交叉来完成。形成对于每一个oar的几个环结构,诸如pcr#1:从0到3mm,pcr#2:从3到6mm,pcr#3:从6到9mm,等等。
133.图17示出了示图,该示图示出了示例,该示例在三个步骤中比较使用传统的(左)和gm(右)方法的在线重计划方案,也就是,日常图像获取,基于日常图像的轮廓产生,以及基于新轮廓的计划重优化。在传统方法中,在步骤2中需要全组的轮廓并且可以是复杂组的剂量体积约束的原始的目标函数被用在后续的计划优化中。对比之下,本公开的gm方法提供具有显著的计划时间节约的简化方法,借此仅需要可被自动地产生的靶和pcr轮廓,连同确定的剂量梯度一起。
134.假定初始计划典型地不在在线计划的时间约束下,可以任意方式,例如,使用原始体积和剂量体积约束产生原始计划。这种原始计划可描述可实现的最佳计划,其将拥有朝向每一个oar可实现的最陡的剂量梯度。使用具有名义上最优的剂量分布的原始计划,沿着产生的pcr的dvh的若干点被记录并且被用于产生目标函数,该目标函数被存储以用于在线重优化。随后使用最新产生的pcr连同存储的目标函数一起执行该优化步骤。为了快速达到剂量梯度目标,从在该天的图像上的原始计划开始自适应计划的优化。由于剂量梯度可以是最佳可实现的,因而(针对每一个pcr的)目的目标中的每一个被设置为从原始计划获得的精确的dvh点,并且被相等地加权。
135.如所述的这一方法不同于通常的优化实践,在通常的优化实践中,dvh目标几乎总是被设置为“好于实际期望的”点,使得优化过程不稳定并且倾向于不期望的结果。由于,在本公开的方法中,知道可从原始计划实现什么,因而dvh目标可以被设置为那些点。这一方法的主要优点是其消除了勾画全组结构的必要性,并且只需要对靶的勾画,因此大幅减少了重计划时间。而且,这一方法使得日常重计划更加可再生,消除了对试错法努力的必要性,因为朝向每一个结构的梯度通常是可实现的(在原始计划中已经实现),因此调整优化标准对于日常解剖不是必要的。另一方面,标准优化方法依赖于基于剂量
‑
体积的标准,其由于器官的体积中的变化而可能一天天地大幅变化。
136.值得考虑的情况是当oar的体积在一天是非常小的且维持的原始剂量梯度将导致器官的不可接受的体积接收高剂量时。由于对剂量梯度的大小存在物理限制,因而一旦达到,就不能任何进一步地增加该梯度直到乐意牺牲其他计划质量参数,例如靶覆盖。如果可以增加对于一天的梯度的陡度而没有牺牲靶覆盖,则这指示在原始计划中的剂量梯度可能没有尽可能的高。因此,有益的是,在朝向临界结构的剂量梯度方面,该原始计划质量确实是最佳。如果是这样的话,剂量梯度不能被任何进一步地增加而没有牺牲其他参数,并且维持原始梯度将满足在线重计划的目标。
137.图18示出了根据本公开,比较来自图像引导的放射疗法(igrt)重定位,基于全轮廓集的传统全面优化,以及梯度维持重计划的剂量分布的示例。清楚的是,基于gm的剂量分布,例如给十二指肠的剂量,等于来自传统重优化的剂量分布,但是从使用重定位获得的剂量分布实质上改进。此外,gm方法所需的计划时间仅仅是传统重优化所需的时间的10%。
138.图19示出了比较用于解决前列腺癌情况的6个日常治疗中的片段间变化的图18的三个策略的剂量体积直方图的例子。再次,根据所示的直肠、膀胱以及计划靶体积(ptv)(前列腺和精囊)的6组dvh,清楚的是基于gm的在线重计划方案等效于传统的全面重优化,并且显著好于igrt重定位方法。
139.返回图1,在过程框16处,可在治疗之前执行针对所提供的放射疗法计划的多个质量控制协议和程序。如本领域中已知的,此类协议通常是根据治疗系统采用和建立的临床工作流,为如由治疗计划规定的递送的准确度提供验证。在放射递送之前,患者可能典型地经历位置设置和固定,并且治疗师基于治疗前成像,根据需要执行多个位置验证和调整。在患者在治疗台上时执行的对患者治疗参数的校正(被分类为“在线”校正),可包括平移调整或者旋转调整,以及使用art的治疗计划的修改,如描述的。
140.随后在过程框18处,递送放射疗法治疗,接着是在过程框20处的评估和/或修改该治疗的步骤,从而包括由记录和验证系统提供的报告。这一步骤可触发在日常治疗已经被递送之后进行的多个校正动作,从而影响随后日子的治疗。因此,在本公开的又另一个实施例中,提供针对实现线下优化过程的系统和方法。该线下优化过程由下列构成:使用来自先前片段的一组可变形地配准的图像(例如日常图像(ct、mri或者us))计算递送的累积的剂量,以及产生用于随后治疗的优化的计划以校正来自任意数量的片段内改变以及没有被任何在线重计划方案校正的其他改变的任何累积的残余误差。例如,残余误差可在前列腺癌的放射治疗期间发生,因为前列腺可系统地漂移或者由于穿过直肠的气体而突然运动。这些改变可能没有被使用紧接在治疗之前获取的图像的在线重计划所考虑。
141.具体地,在任意第i个片段处使用如所述的在线重计划方案递送的剂量可通过使
用递送的参数(例如孔径和监测单元(mu)数)来重建。可基于那天的图像使用任何可变形图像配准方法来计算直到第i个片段的累积的剂量。由于累积的剂量分布和期望的剂量分布(例如黄金标准)可基于相同的图像(也就是那天的ct或者mri)被典型地产生,因而可通过简单地从期望的剂量分布中减去累积的剂量分布来计算来自片段内变化的直到第i个片段的没有被先前的在线重计划方案考虑的残余误差。这种残余误差可以被提供作为进入计划系统的输入以被当做初始背景,所产生的背景包括正数和负数。利用这一背景的自适应优化可产生初始计划以用于随后片段处的在线重计划。例如,图20示出了潜在地要连同在线重计划方法一起使用的如所述的线下优化。
142.如所述的本公开的方法可被用于校正在一个或者多个片段的在线重计划之后的残余误差。对于患者的子集,相比于重优化计划,很可能如所述的在线重计划可能留下很少的误差。对于此类情况,可较少频繁(例如,以每周或者每两周为基础)使用线下自适应优化方法,给来自多个片段而不是仅先前片段的累积的残余误差提供校正。
143.一旦整体回顾本技术,适合于这些组合和子组合的特征将对本领域技术人员显而易见。本文中所描述的以及所引用的权利要求书中的主题旨在覆盖和涵盖技术中的所有合适变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1