用于疾病的筛查、诊断和预后的量子光学图谱
用于疾病的筛查、诊断和预后的量子光学图谱
1.相关申请的交叉引用
2.本技术要求于2020年5月15日提交的美国临时申请号63/025,773的权益,将其公开内容通过引用整体结合于此。
发明领域
3.本发明总体上涉及疾病的筛查和诊断,特别是利用量子光学技术测定来自受试者的生物(学)样品并且利用一系列算法测试对这些生物样品的光谱图谱(光谱特性图,spectroscopic profile)进行评分(基于被分析样品的分子图谱(分子谱或分子表达谱,molecular profile))以确定受试者是否患有癌症疾病(如乳腺癌),或者是否处于发展癌症疾病的风险中。
4.发明背景
5.在过去的55-65年中,人们已做出了许多努力来提高测定生物样品以诊断人类和其他动物中的疾病的能力,以便可以制定有效的治疗计划来阻止或消除疾病。人们还付诸努力开发从可检测到疾病的最早时间开始跟踪该疾病的演变的能力,以确定治疗性干预的最适当时间并且为每名患者选择最高效和有效的疗法形式。
6.尽管做出了所有这些努力,但是仍然存在这样的评估生物样品的方法,即其无法实时监测治疗方案对疾病(如癌症)从早期阶段(如癌前细胞)的演变的效果。“实时”意指系统具有通过比较在不同时间从患者采集的样品的特性来确定每名个体患者的疾病进展或消退的速率的能力。这些方法无法准确地对个体患者中的癌前疾病的进展程度进行分级。疾病的病程和疾病对疗法的反应仅可经由回顾性流行病学研究来了解,所述研究最多给出疾病的平均病程和该疾病对治疗的平均反应。
7.当前诊断方法的另一个问题涉及主观性,通常表现为检查同一数据集的不同病理学家的结论之间的较差一致性。这种主观性在涉及样品的显微镜观察的诊断方法中尤为严重。使诊断复杂化的是,并非组织切片在或载玻片上的所有细胞都受到同等的影响(如果受到影响的话)。另外,在细胞中的分子水平下的化学和物理属性方面的广泛变化可能不会表现为细胞形态方面的变化。此外,并且尤其是在早期诊断的情况下,分析人员通常会在大量表现正常的细胞中寻找少数患病细胞。因此,在诊断结论的有效性与病理学家的技术、尽职和先前经验之间存在关系。只要诊断病理学的基本方法仍然是一个主观过程,就没有办法控制这些变动。
8.最后,用于获得样品的许多现有方法都涉及侵入性手术,包括但不限于内窥镜检查、活检、刮屑和脊椎穿刺。
9.一些尝试的解决方案涉及免疫组织化学。免疫组织化学涉及使用特异性抗体来检测生物样品中的已知生物标志物的表达和表达水平。然而,免疫组织化学尚未充分解决诊断业的需求,因为它需要在疾病中表达的分子生物标志物的准确标记、加标签和特定知识,以及靶向这些分子生物标志物的抗体的生产繁琐。
10.其他尝试的解决方案涉及分析生物样品的光学光谱技术。用于进行这些分析的诊
断病理学服务具有固有的局限性。例如,这些方法需要在峰、峰形、各种波长和特定器官之间的预先存在的关联的知识以产生有意义的诊断。使分析进一步复杂化可能需要生物分子的不同振动模式的知识。因此,这些方法通常需要由专业病理学家对光谱图进行解释和/或分析,这又使得难以在世界上医疗服务不足的地区提供高质量的诊断病理学服务。因此,在没有合理靠近生物样品被收集的部位的训练有素的病理学家的情况下,这些服务将是不可用的。因此,当在没有训练有素的病理学家协助的情况下进行这样的服务时,这些服务的质量是极差的。
11.另一个局限性涉及特异性和灵敏度较差的光谱技术。这些光谱技术探测分子中存在的子结构,而不是整个分子。然而,不同分子中出现相同子结构以及快速失相导致在时间和光谱响应方面的重叠,从而限制了复杂样品中的特定分子的鉴定。其他光谱技术受它们无法可靠地检测占样品总质量的少于5重量%的成分的存在的限制。
12.因此,仍然存在开发用于人类或动物中的疾病的筛查、诊断和/或预后的非侵入性、非主观性、高度特异性和/或灵敏的方法的未满足需求。
13.因此,本发明的一个目的是提供克服如上讨论的问题中一个或多个的改进的诊断方法。
14.此外,本发明的一个目的是提供一种非侵入性定量系统和方法,其分析生物样品并且进行关于存在或不存在疾病以及任选地(如果存在的话)疾病的阶段(等级水平)的解释。
15.此外,本发明的一个目的是提供一种非主观性的定量系统和方法,其分析生物样品并且信息关于存在或不存在疾病以及任选地(如果存在的话)疾病的阶段(等级水平)的解释。
16.此外,本发明的一个目的是提供一种非侵入性、非主观性的定量系统和方法,其分析生物样品并且进行关于存在或不存在疾病以及任选地(如果存在的话)疾病的阶段(等级水平)的解释。
技术实现要素:
17.描述了一种使用受试者的样品中的分子生物标志物对受试者的疾病进行筛查、诊断和/或预后的方法。受试者可以是人类或其他动物,并且所述方法可以在体外或体内进行。所述方法结合了光学光谱技术和计算机实现的算法。
18.光学光谱技术测定样品并且生成指示样品的分子图谱的振动频率。光学光谱技术被称为量子光学高光谱分析(“qohsa”)。qohsa是一种技术类型的飞秒(毫微微秒,femtosecond)/阿秒(微微微秒,attosecond)红外激光光谱,其可以应用于包括血液在内的生物流体(液体活检)。其是一种精练的、非侵入性的并且可再现的方法,其允许以高通量捕获个性化的分子光谱。
19.计算机实现的算法利用振动频率并且生成包含振动频率的光谱图谱。对于给定的样品,通过将该振动频率与其在两个参考光谱图谱(基准光谱图谱,reference spectroscopic profile)中的相应位置的振动频率进行比较,计算机实现的算法为图谱中的每个位置处的每个振动频率分配成分得分。使用从未患病样品和患病样品获得的数据来分别生成第一参考光谱图谱和第二参考光谱图谱。计算机实现的算法对成分得分求和并且
将总和与阈值进行比较。如果该总和大于阈值,则受试者被诊断患有疾病。否则,认为受试者是无病的。
20.光学光谱技术使用例如具有3100cm-1
至900cm-1
(如3050.855cm-1
至929.527cm-1
)(包括端值)的频率跨度以及1101个点的拉曼分析仪来实施。这些点控制了图谱的长度,该长度由光谱频率的范围以及仪器的光谱分辨率决定。
21.还描述了利用本文所描述方法的方法。这些方法可以用于乳腺癌的筛查、诊断和/或预后。
附图说明
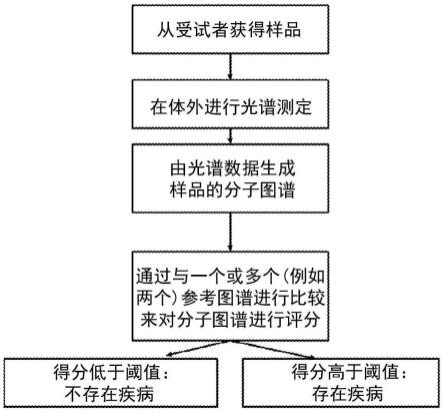
22.图1a和1b是可用于进行本文描述的诊断的工作流程的示意图。在图1a中,获得样品并且在体外进行实验光谱技术。在图1b中,光谱技术在体内进行,即在受试者身体中原位进行。
具体实施方式
23.i.定义
24.如本文中使用的并且如在与筛查、诊断和/或预后相关时,“非主观性的”意指不需要肉眼检查样品和/或分析光谱图来确定样品是患病的还是未患病的。
25.ii.用于疾病的筛查、诊断和/或预后的方法
26.描述了一种使用受试者的样品中的分子生物标志物对受试者的疾病进行筛查、诊断和/或预后的方法。受试者可以是人类或其他动物。所述方法可以在体外或体内用于样品。优选地,所述方法是非侵入性的。
27.现在,不需要每个特定分子生物标志物的知识。所述方法可以整合图谱(其对于给定受试者在给定时间处可能是独特的)的所有分子生物标志物并且将结果与给定问题相关联,所述问题可以为二元模式,如存在或不存在疾病(如癌症)。如果检测到疾病,则也可以朝着评估疾病的阶段(等级水平)的方向进行询问。因此,所述方法提供了显著的改进,因为它为使用者提供了一种精练且流线型的定量分析工具以探测在复杂环境中包含多个分子的样品并且达成诊断和/或预后,同时无需(i)使用者的样品中的疾病特异性分子生物标志物的知识和/或(ii)在光谱图的解释方面的专业知识。在一些形式中,特定分子生物标志物的知识可以用于将分子图谱与涉及所提出的二元问题的特定生物学变动关联起来。
28.优选地,所述方法涉及实验分析方法、计算机实现的方法或它们的组合。在一些形式中,所述方法涉及实验分析方法和计算机实现的方法二者。
29.在一些形式中,所述方法涉及(i)利用实验分析方法来生成受试者的样品的光谱图谱,使得该光谱图谱包含一个或多个成分,(ii)利用计算机实现的算法来获得光谱图谱的总分,和/或(iii)基于总分提供疾病的诊断、预后或二者。优选地,图谱中的成分可以按波数进行排序。排序可以通过递增或递减顺序进行。
30.在一些形式中,计算总分涉及使用光谱图谱的所有成分。在一些形式中,计算总分涉及使用可以通过例如对于相同的频率范围使用渐进更高的波数分辨率而在光谱图谱内获得的成分中的一些。这也可以通过使用更大的频率范围和更高的波数分辨率来实现。
31.在一些形式中,所述方法涉及通过以下方式来筛查和诊断乳腺癌:对人类样品(特
别是以非侵入性方式(例如,使用血液)获得的那些)进行qohsa测量,并且基于整套qohsa(“在n个变量处的光谱图谱”)或由其一部分计算得分。
32.参考图1a和1b,实验分析方法(如光谱测定)可以在体外(图1a)或在受试者身体中在体内(图1b)进行。对于给定的样品,所述方法包括基于光谱测定来生成包含样品数据(如振动频率)的光谱图谱,通过优选地与包含数据(如振动频率)的两个参考图谱进行比较而对每个图谱分配得分,将分配的得分与阈值进行比较,和/或确定由其获得样品的受试者是否患有疾病,以及任选地(如果存在的话)疾病处于什么阶段(等级水平)。
33.在一些形式中,实验分析方法(如本文描述的方法)涉及实施光谱技术(如光学光谱法)的光谱仪器。在一些形式中,光谱仪器可以是具有3100cm-1
至900cm-1
(如3050.855cm-1
至929.527cm-1
)(包括端值)的频率跨度以及1101个点的拉曼分析仪。
34.在一些形式中,计算机实现的算法(如本文描述的算法)可以用于基于从光谱仪器获得的光谱数据生成光谱图谱。优选地,光谱数据可以是被分析的样品的分子图谱的函数。
35.计算机实现的算法还可以用于通过将样品的光谱图谱的成分与一个或多个参考光谱图谱中的相应成分进行比较来生成一个或多个成分得分。
36.以下是如何确定参考光谱图谱的一个非限制性实例:对于通过仪器测量的特征中的每一个,比如说第i个特征,鉴定或计算在对照群体中观察到的最大值和最小值,并且将它们分别用max_i和min_i表示。然后,对于每个样品,计算由测量值高于max_i或低于min_i的特征的数量构成的得分。然后将此得分用作变化的阈值以建立接受者操作特征(roc)曲线(从其中可以选择所需的特异性),从而获得相应的灵敏度。在同一方法的另一实例中,可以移除得分为异常值的对照。
37.优选地,在一些形式中,样品的光谱图谱的成分以及在一个或多个参考光谱图谱中的那些成分包含振动频率。在一些形式中,可以将成分得分求和以获得总分。在一些形式中,当总分大于阈值时,受试者被认为患有疾病,否则受试者是无病的。总分用于确定受试者是否患有乳腺癌。
38.在一些形式中,计算机实现的算法通过将样品的光谱图谱的成分与两个参考光谱图谱(即第一参考光谱图谱和第二参考光谱图谱)中的相应成分进行比较来生成成分得分。优选地,第一参考光谱样品包含光谱数据的上限。优选地,第二参考光谱样品包含光谱数据的下限。优选地,在一些形式中,样品的光谱图谱的成分以及在一个或多个参考光谱图谱中的那些成分包含振动频率。在一些形式中,可以将成分得分求和以获得总分。在一些形式中,当总分大于阈值时,受试者被认为患有疾病,否则受试者是无病的。
39.在一些形式中,一个或多个参考光谱图谱中的至少一个是使用未患病样品生成的。在一些形式中,一个或多个参考光谱图谱中的至少一个是使用患病样品生成的。在一些形式中,一个或多个参考光谱图谱中的至少一个是使用癌性样品生成的。在一些形式中,癌性样品具有选自乳腺癌、肺癌、前列腺癌、结肠癌、皮肤癌、血癌(如白血病和/或淋巴瘤)、骨髓瘤以及它们的组合的癌症。
40.在一些形式中,一个或多个参考图谱中的至少一个来自与受试者相同的群体中的一个或多个个体。在一些形式中,所有参考光谱图谱都来自与受试者相同的群体中的一个或多个个体。在一些形式中,一个或多个参考光谱图谱中的至少一个来自与受试者不同的群体中的一个或多个个体。在一些形式中,所有参考光谱图谱都来自与受试者不同的群体
中的一个或多个个体。
41.所述方法可以涉及在筛查、诊断和/或预后方面的概率,其中使用有限数量的因素。例如,对于乳腺癌,其中有限数量的因素用于分类:临床阶段、激素受体(雌激素和孕激素)、her-2基因的扩增和细胞增殖(有丝分裂指数或ki-67),这可以导致定义大的亚组,这些亚组本质上是异质的,因为乳腺癌根据个体患者而言可能是比这个更复杂的。此处使用的第一代量子光学技术允许用显著更宽泛系列的生物标志物(一些对于疾病或其生物学后果具有特异性,一些对于宿主具有特异性)来理解部分分子现实(光谱结果对于给定的采样是完全可再现的)。通过一系列的算法测试,它们的计算集成允许在以二元模式(更整体的方式)询问相关问题时区分个体图谱。
42.i.实验分析方法
43.实验分析方法包括一种或多种光谱技术。光谱技术的实例包括但不限于场分辨光谱法(如场分辨红外光谱法)、频率分辨光谱法、傅立叶变换红外光谱法、拉曼光谱法、红外衰减全反射、漫反射光谱法以及它们的组合。
44.在一些优选形式中,光谱技术涉及场分辨光谱法(如场分辨红外光谱法)。在一些形式中,光谱技术涉及频率分辨光谱法。在一些形式中,光谱技术涉及红外衰减全反射。在一些形式中,光谱技术涉及漫反射光谱法。在一些形式中,光谱技术涉及多变量微扰红外技术。
45.在一些形式中,光谱技术涉及振动光谱法。在一些形式中,振动光谱法包括红外光谱法,如近红外光谱法、中红外光谱法、共振频率光谱法和/或远红外光谱法。
46.在一些情况下,光谱方法通过检测对红外或拉曼激发的共振振动响应来探测分子中存在的化学子结构(而不是整个分子)。然而,不同分子中出现相同片段和快速失相导致时间和光谱响应的重叠,从而限制了复杂样品中的个体分子的鉴定。这些限制可以利用可以检测复杂样品中的不同化合物的场分辨光谱法(pupeza等人,proc.natl.acad.sci.usa 2020,577,52-59)来克服。因此,在优选的形式中,光谱技术涉及场分辨光谱法(如场分辨红外光谱法)。在优选的实施方案中,实验分析方法如在pupeza等人,nature,577:52-59,2020中所述的那样进行,将其内容通过引用结合于此。
47.光谱仪器可以在一定频率范围内操作。频率范围可以跨越在约14,000cm-1
至约4000cm-1
之间、约12,500cm-1
至约4000cm-1
之间、约4,000cm-1
至约400cm-1
之间、约4,000cm-1
至约500cm-1
之间、约4,000cm-1
至约600cm-1
之间、约4,000cm-1
至约700cm-1
之间、约4,000cm-1
至约800cm-1
、4,000cm-1
至约900cm-1
之间、3,900cm-1
至约500cm-1
之间、约3,800cm-1
至约600cm-1
之间、约3,700cm-1
至约700cm-1
之间、约3,600cm-1
至约800cm-1
、3,500cm-1
至约900cm-1
、3,400cm-1
至约900cm-1
之间、约3,200cm-1
至约900cm-1
之间、约3,100cm-1
至约900cm-1
之间、约1,800cm-1
至约750cm-1
之间、约1,800cm-1
至约800cm-1
之间、约1700cm-1
至约900cm-1
之间。在一些形式中,光谱仪器可以是与用于超灵敏分子振动光谱法的红外波采样系统耦合的宽带飞秒分辨的宽带红外激光源。在一些形式中,频率扫描的范围在约3050.855cm-1
至约929.527cm-1
之间。在一些形式中,光谱仪器可以是具有在3050.855cm-1
至929.527cm-1
(包括端值)之间的频率跨度以及1101个点的拉曼分析仪。
48.优选地,光谱仪器使用高分辨率。高分辨率可以包括在波数为1cm-1
至10cm-1
(如1cm-1
、2cm-1
、3cm-1
、4cm-1
、5cm-1
、6cm-1
、7cm-1
、9cm-1
、9cm-1
或10cm-1
)处的检测水平。
49.ii.计算机实现的方法
50.本文所述的计算机实现的方法不限于任何特定的光谱实验分析技术。计算机实现的方法实现了这样的算法,该算法能够使用从场分辨光谱法(如场分辨红外光谱法)、频率分辨光谱法、傅立叶变换红外光谱法、拉曼光谱法、红外衰减全反射、漫反射光谱法以及它们的组合生成的数据来生成光谱图谱。
51.计算机实现的方法可以在能够运行算法的计算机上执行。计算机可以在物理上靠近生成数据的光谱仪器。计算机也可以位于远程位置并且经由以太网、蓝牙、近场通信、wifi、集成电路或它们的组合连接到光谱仪器。
52.在实施例中描述了由算法执行的过程的非限制性实例。简言之,算法生成包含一个或多个成分的光谱图谱,其反映了样品的分子图谱。
53.在非限制性实例中,光谱图谱包含1,101个特征,其由(开始波数(3050.856cm-1
)-结束波数(925.547cm-1
))/(分辨率(2cm-1
))确定。在光谱图谱中的每个位置处的特征对应于在该波数处的光子计数强度。因此,光谱图谱的长度可以是任意值,但是受频率范围的跨度和仪器的分辨率限制。
54.在本文所述的非限制性实例中,算法将被分析样品的光谱图谱与两个参考光谱图谱进行比较。对于每个特征,在每个位置处,其都会保持跟踪低成分得分(如成分得分1)和高成分得分(成分得分2)。在横贯光谱图谱的长度后,算法将低成分得分和高成分得分进行求和。然后,算法将两个成分得分进行求和。如果总和大于阈值,则受试者被诊断患有疾病。如果总和小于阈值,则认为受试者是无病的。
55.iii.使用的方法
56.本文所描述的方法可以用于对人类或其他动物中的疾病进行筛查、诊断和/或预后。合适的疾病包括但不限于癌症、糖尿病、动脉粥样硬化、阿尔茨海默病(alzheimer’s disease)、帕金森病(parkinson’s disease)和慢性肾病。示例性的癌症包括但不限于选自乳腺癌、肺癌、前列腺癌、结肠癌、皮肤癌、血癌(如白血病和/或淋巴瘤)、骨髓瘤以及它们的组合的癌症。
57.被分析的样品可以包括选自由以下各项组成的组中的样品:细胞、血液、唾沫/唾液、血清、血浆、尿液、痰、汗液、精液、滑液、淋巴液、脑脊液、活检组织(biopsy)、粪便或它们的组合。
58.在一些形式中,受试者没有疾病的症状。在一些形式中,受试者表现出疾病的一个或多个症状。症状包括但不限于乳房疼痛、乳腺结节、乳头溢液、体重减轻、疲劳、贫血或它们的组合。在一些形式中,受试者未曾患有癌症或具有患有癌症的既往史。
59.在一些形式中,受试者处于发展乳腺癌的风险中(如处于高风险中)。在一些形式中,受试者暴露于一种或多种用于鉴定乳腺癌的测定。
60.一个非限制性的实例涉及使用特定模式的qohsa测量来进行乳腺癌筛查和诊断。在一些形式中,所述方法涉及使用各种各样的分子生物标志物的特定qohsa测量模式的组合来进行乳腺癌筛查和诊断。这些分子生物标志物可以在患有乳腺癌的患者的组织或体液(如血液、血清、血浆、尿液、唾液和痰)和/或粪便中进行测试。一种qohsa测量的格式(称为光谱图谱)包括数千个变量的向量,每个变量都在给定时间测量生物流体的分子图谱。
61.可以使用任何适当的方法以直接在生物样本中评估靶标(因为在一些情况下可以
跳过样品制备步骤)。
62.在一些形式中,所述方法用作定期检查的一部分。因此,在一些形式中,受试者尚未被诊断患有癌症(如乳腺癌),并且典型地对于那些特定形式,不知道受试者患有过度增殖性病症,如乳腺肿瘤。在其他形式中,例如,个体处于乳腺癌的风险中,被怀疑患有乳腺癌,或者具有癌症(包括乳腺癌)的个人或家族史。在一些形式中,已知个体患有癌症,并且本文所描述的方法用于确定bc的类型、乳腺癌的阶段(等级水平)、对乳腺癌的治疗反应、和/或预后。在一些形式中,个体已经被诊断患有乳腺癌并且可以经受用于乳腺癌切除的手术,和/或可以经历本发明的方法以调查乳腺癌的复发。
63.本方法对于宽范围的疾病和/或处于不同阶段的疾病的筛查和/或诊断具有适用性。所述方法还允许基于指示早期或初期疾病状态的低浓度分析物的信号的检测来检测受试者的早期和病前状态。例如,方法可以用于检测样品中低于通过样品的显微镜和光学光谱检查的检测水平的异常的存在。
64.所述方法还可以用于确定疾病的阶段(等级水平)。此外,计算机实现的方法可以应用于通过任何光谱仪器(优选地使用高分辨率光谱法)的测量的结果。光谱仪器可以是尤其进行傅里叶变换红外光谱法、拉曼光谱法的光谱仪器、或测量红外强度或拉曼散射系数(相对于振动频率)的任何装置。
65.由于本方法的流线型过程,其减少和/或消除了主观性、对光谱图和/或在显微镜下的样品的专家分析的需要,本方法使得在世界上医疗服务不足的地区提供高质量的筛查和/或诊断病理学服务成为可能。所述方法还为患者和医生提供了用于即时诊断决策的基础,进而导致立即实施下一步程序和治疗。这意味着患者和检查的临床医生几乎可以立即知道所检查的样品是否是患病的、未患病的和/或疾病(如果存在的话)的阶段(等级水平)。
66.在一些形式中,所述方法可以用于以显著高水平的特异性和灵敏度筛查和/或诊断疾病。在一些形式中,这种高水平可以归因于在鉴定测试数据中所涉及的专家医学建议、先进的实验光谱技术和/或在计算机实现的算法的开发和测试中所涉及的专业知识。在一些形式中,场分辨光谱法(如场分辨红外光谱法)(pupeza等人,proc.natl.acad.sci.usa 2020,577,52-59)被用于以显著高水平的灵敏度和特异性来测定样品。这个水平可以比以前实现的光谱和/或显微镜方法高得多。
67.本方法也可以用于在体内进行筛查和/或诊断。这是可能的,因为可以使用适当的光学频率以利用光学非侵入性方法探测更深的组织深度,并且计算机实现的算法非常适合分析来自实验的输出。这个方面的医学重要性不仅仅是允许从受试者收集即时诊断信息,而且还提供了通过检查体内的样品从更广泛的区域获得更多信息的能力(与通过从身体中获取活检或细胞然后检查它们可得到的相比)。例如,组织活检的行为本身会曲解剩余的组织,并且伴随活检的出血可能歪曲医生对患病组织的看法。
68.通过以下编号段落可以进一步理解所公开的方法。
69.1.一种用于筛查和/或诊断受试者中的疾病的方法,所述方法包括:
70.(i)生成所述受试者的样品的光谱图谱或将所述受试者的样品的光谱图谱与一个或多个参考光谱图谱进行比较,其中所述光谱图谱、所述一个或多个参考光谱图谱或二者包括成分,
71.(ii)使用计算机实现的算法来获得所述光谱图谱的总分,以及
72.(iii)基于所述总分来提供所述疾病的诊断、预后或二者。
73.2.根据段落1所述的方法,其中所述诊断包括将所述总分与阈值进行比较,其中当所述总分大于所述阈值时,所述受试者被诊断为患有所述疾病。
74.3.根据段落1或2所述的方法,其中获得所述总分包括利用计算机实现的算法以通过将所述光谱图谱的成分与所述一个或多个参考光谱图谱中的至少一个中的对应成分进行比较来生成一个或多个成分得分。
75.4.根据段落3所述的方法,其中所述总通过任选地利用计算机实现的算法对所述一个或多个成分得分求和来获得分,其中当仅一个成分得分可用时,所述总分是该成分得分。
76.5.根据段落1至4中任一个所述的方法,其中所述受试者的样品的所述光谱图谱以及所述一个或多个参考图谱是使用来自光谱技术的数据生成的,该光谱技术应用在约14,000cm-1
至约4000cm-1
之间、约12,500cm-1
至约4000cm-1
之间、约4,000cm-1
至约400cm-1
之间、约4,000cm-1
至约500cm-1
之间、约4,000cm-1
至约600cm-1
之间、约4,000cm-1
至约700cm-1
之间、约4,000cm-1
至约800cm-1
、4,000cm-1
至约900cm-1
之间、3,900cm-1
至约500cm-1
之间、约3,800cm-1
至约600cm-1
之间、约3,700cm-1
至约700cm-1
之间、约3,600cm-1
至约800cm-1
、3,500cm-1
至约900cm-1
、3,400cm-1
至约900cm-1
之间、约3,200cm-1
至约900cm-1
之间、约3,100cm-1
至约900cm-1
之间、约1,800cm-1
至约750cm-1
之间、约1,800cm-1
至约800cm-1
之间、约1700cm-1
至约900cm-1
之间的频率扫描。
77.6.根据段落1至5中任一个所述的方法,其中所述受试者的样品的所述光谱图谱以及所述一个或多个参考图谱是使用来自光谱技术的数据生成的,该光谱技术应用在约14,000cm-1
至约4000cm-1
之间、约12,500cm-1
至约4000cm-1
之间、约4,000cm-1
至约400cm-1
或3,100cm-1
至约900cm-1
之间的频率扫描。
78.7.根据段落1至6中任一个所述的方法,其中所述受试者的样品的所述光谱图谱以及所述一个或多个参考图谱是使用来自光谱技术的数据生成的,该光谱技术包括场分辨光谱法(如场分辨红外光谱法)、频率分辨光谱法、傅里叶变换红外光谱法、拉曼光谱法、红外衰减全反射、漫反射光谱法以及它们的组合。
79.8.根据段落7所述的方法,其中所述光谱技术包括振动光谱法。
80.9.根据段落8所述的方法,其中所述振动光谱法包括红外光谱法,如近红外光谱法、中红外光谱法、共振频率光谱法和/或远红外光谱法。
81.10.根据段落1至9中任一个所述的方法,其中所述受试者的样品的所述光谱图谱的成分包含振动频率。
82.11.根据段落1至10中任一个所述的方法,其中所述一个或多个参考光谱图谱中的至少一个的成分包含振动频率。
83.12.根据段落1至11中任一个所述的方法,其中所述一个或多个参考光谱图谱中的至少一个是使用未患病样品生成的。
84.13.根据段落1至12中任一个所述的方法,其中所述一个或多个参考光谱图谱中的至少一个是使用患病样品生成的。
85.14.根据段落1至12中任一个所述的方法,其中所述一个或多个参考光谱图谱中的至少一个是使用癌性样品生成的。
86.15.根据段落14所述的方法,其中所述癌性样品具有选自由以下各项组成的组中的癌症:乳腺癌、肺癌、前列腺癌、结肠癌、皮肤癌、血癌(如白血病和/或淋巴瘤)、骨髓瘤以及它们的组合。
87.16.根据段落1至15中任一个所述的方法,其中所述一个或多个参考图谱中的至少一个来自与所述受试者相同的群体中的一个或多个个体。
88.17.根据段落1至14中任一个所述的方法,其中所述参考光谱图谱全部来自与所述受试者相同的群体中的一个或多个个体。
89.18.根据段落1至13中任一个所述的方法,其中所述一个或多个参考光谱图谱中的至少一个来自与所述受试者不同的群体中的一个或多个个体。
90.19.根据段落1至15或18中任一个所述的方法,其中所述参考光谱图谱全部来自与所述受试者不同的群体中的一个或多个个体。
91.20.根据段落1至19中任一个所述的方法,其中所述总分是通过将所述光谱图谱与第一参考光谱图谱和第二参考光谱图谱进行比较而获得的。
92.21.根据段落20所述的方法,其中所述第一参考光谱图谱包含光谱数据的上限。
93.22.根据段落20或21所述的方法,其中所述第二参考光谱图谱包含光谱数据的下限。
94.23.根据段落1至22中任一个所述的方法,其中所述受试者是人类或其他动物。
95.24.根据段落1至23中任一个所述的方法,其中所述样品是在体外的或在体内的。
96.25.根据段落1至24中任一个所述的方法,其中所述疾病包括癌症、糖尿病、动脉粥样硬化、阿尔茨海默病、帕金森病或慢性肾病。
97.26.根据段落1至25中任一个所述的方法,其中所述样品选自由以下各项组成的组:细胞、血液、唾沫/唾液、血清、血浆、尿液、痰、汗液、精液、滑液、淋巴液、脑脊液、活检组织、粪便以及它们的组合。
98.27.根据段落1至26中任一个所述的方法,其中所述受试者没有疾病症状。
99.28.根据段落1至26中任一个所述的方法,其中所述诊断是对表现出所述疾病的症状的受试者进行的。
100.29.根据段落1至28中任一个所述的方法,其中所述受试者未曾患有癌症或具有患有癌症的既往史。
101.30.根据段落1至27或29中任一个所述的方法,其中所述受试者表现出一种或多种选自由以下各项组成的组中的症状:乳房疼痛、乳腺结节、乳头溢液、体重减轻、疲劳、贫血或它们的组合。
102.31.根据段落1至30中任一个所述的方法,其中所述受试者处于发展乳腺癌的风险中(如处于发展乳腺癌的高风险中)。
103.32.根据段落1至31中任一个所述的方法,其中所述受试者暴露于一种或多种用于鉴定乳腺癌的测定。
104.33.根据段落1至32中任一个所述的方法,其中所述总分用于确定所述受试者是否患有乳腺癌。
105.34.根据段落1至33中任一个所述的方法,其中所述成分按波数进行排序。
106.本领域技术人员将认识到或者能够仅使用常规实验确定对于本文所描述发明的
具体实施方案的许多等同替换。这样的等同替换意图被所附权利要求涵盖。
107.实施例
108.由位于德国慕尼黑的马克斯普朗克研究所(max planck institute)开发的对于液体活检的新型红外激光光谱技术的出现正在打开新的前景(pupeza等人,nature,577:52-59,2020)。“宽带红外诊断(broadband infrared diagnostics,bird)”技术使得使用由受控功率激光器诱导的飞秒分子振动光谱型方法成为可能,从而允许在癌症筛查的背景下定义通过精练的非侵入性、灵敏的且低成本的方法获取的“n个变量生物学图谱”。这种红外(ir)和近红外(nir)激光光谱技术依赖于光子在入射光与目标材料相互作用时的散射。这些相互作用导致反映特定分子振动能的频移。这些振动与特定的分子键相关联,这使得建立“生化印记”成为可能。生理或病理学变化导致初始生物化学方面的变化,并且因此导致光谱方面的变化。这些光谱非常详细,并且被集成到强大的计算方法中,这允许检测“n个变量特定生物学图谱”,其可能与涉及存在或不存在癌症的血浆差异或者通过可用作诊断标记物的组合组成成分的改变潜在地相关联。
109.用于超灵敏分子振动光谱法的第一代bird技术、宽带飞秒红外激光源和红外波采样系统,以及新型光子荧光多显微镜系统的设计,在慕尼黑在马克斯普朗克研究所独特地投入运行。详情提供于pupeza等人,nature,577:52-59,2020中。
110.与此技术的当前状态相比,该技术的这种新性能机制是基于在红外辐射源和检测两方面的显著改进。infralight光源呈现出高功率/亮度、宽带宽和时间相干性的独特组合。高功率/亮度可能是用于实现高检测灵敏度和短采集时间的重要特征。
111.在降噪、无噪的光谱设备中,如基于飞秒激光的时间分辨场采样,信噪比(s/n)与相干入射辐射功率成正比。因此,高功率意味着改善的信噪比,这对于低浓度样品的检测是非常重要的。宽的带宽是用于记录几乎完整文件的先决条件。在由数百种分子物种组成的复杂有机混合物的情况下,这对于个体样品的明确鉴定是至关重要的。
112.通过将来自高功率飞秒激光振荡器的超短近红外脉冲高效非线性地转换到中红外范围,这些特性已被组合到单一光源中。其首次实施覆盖了6.7至18μm的光谱范围(其中平均功率为100mw),并且保持对利用此类型的相干宽带源获得的最高功率的记录。以上报告的功率和带宽可以被显著增加,以改善低浓度分子样品的检测灵敏度和选择性。
113.具有平方米量级的尺寸的新光源将在双向、先进的红外技术中相当大地取代占据数百平方米面积的同步辐射源。新光源显著提高了血液中的癌症生物标志物的红外分子指纹的采集灵敏度。
114.实施例1:利用量子光学的用于乳腺癌检测的非侵入性诊断测试
115.这种方法在癌症筛查中的价值是在乳腺癌的背景下在对来自67名健康对照(通过标准乳房摄影筛查,不存在乳腺癌)和28名i期和ii期乳腺癌患者的一系列液体活检的量子光学分析后获得的(沙特国王大学(king saud university),沙特阿拉伯利雅得(riyadh,saudi arabia))。量子光学分析在德国慕尼黑的马克斯普朗克研究所(max planck institute)进行,并且利用在沙特阿拉伯吉达(jeddah,saudi arabia)的阿卜杜拉国王科技大学(king abdallah university for science and technology,kaust)超级计算机定义“在n个变量下的分子图谱(molecular profiles at n variables)”。进行了非分层数据挖掘相关分析,以对两个组(对照与患者)之间的光谱图谱(其基于被分析的样品的分子图
谱)进行分类(n=1,101)。
116.若干现有技术(使用多倍频红外光的飞秒脉冲和完整的波形测量)允许对处于低浓度的生物分子进行高通量光谱测量,从而为早期癌症检测和治疗监测开辟了途径。
117.材料和方法
118.在阿卜杜拉国王科技大学(king abdullah university of science and technology)的计算生物科学研究组与沙特国王大学医学城(king saud university medical city)的肿瘤中心之间的合作中,对一组56例乳腺癌和134例正常对照样品进行了研究。
119.实验分析
120.使用提供1101个测量点的版本,通过量子光学光谱法对每个样品进行实验分析。简言之,血液样品根据以下步骤,收集、制备并且使用量子光学分析来分析:将样品收集在为此目的提供的管中,每个患者至多18.6ml/样品(edta k3管)。将样品在室温下温育直至血液凝固。然后将管在4℃下以7000rpm离心10分钟,然后将上清液等分到微型管中(每种血清1ml),并且在-80℃下储存。不进行冷冻-解冻循环。保持每个采样时间处的每个血清样品的三个等分试样(总共3ml),以便可以进行多次独立实验测量。然后在温度受控过程下进行冷冻保存的情况下,将管分批运到马克斯普朗克研究所(max planck institute)(德国慕尼黑)。
121.实验分析是在马克斯普朗克研究所盲试地进行的。在进行计算分析时,解除盲试。
122.评分方法
123.算法1示出了对每个样品进行评分所遵循的程序。
124.样品的qohsa测量通过1101个成分的向量f描述。
125.(1)标准化每个样品向量成分。
126.(2)对于每个要分析的样品及其关联向量f,用f_i表示第i个向量的成分。
127.(3)提供两个向量a=(a_i)和b=(b_i)。
128.(4)定义2个得分:
129.成分评分1/
130.s1=sum(test_low(f_i)),其中
131.如果f_i<a_i,则test_low(f_i)=1
132.否则test_low(f_1)=0
133.成分评分2/
134.s2=sum(test_hgh(f_i)),其中
135.如果b_i<f_i,test_hgh(f_i)=1
136.否则test_hgh(f_1)=0
137.通过使用得分的预测
138.设定一个值t并且评估:如果s1+s2>t,则患者被预测患有疾病(如乳腺癌),否则是无病的(例如无乳腺癌)。
139.图谱中的成分按波数进行排序。关于向量a和b,向量的值是使用用于执行本文所述的分析的群体数据集(学习数据集)计算的。向量a和b中的值分别代表上限和下限。这些值与用于本文所述的生物样品的群体的类型有关。还使用相同的群体数据集来计算系数和
阈值。
140.应注意的是,向量a和b中的值、系数和阈值可以计算一次并且用于任何群体,或者这些值可以重新计算以用于针对其他群体的应用。
141.结果
142.利用量子光学技术来测定样品。通过应用上述评分方法,获得了识别疾病/非疾病状态的非常高的组合特异性和灵敏度值。这些数值取决于对群体的基本假设。在没有假设的情况下,就与现有的非侵入性测试相比而言,92%的特异性和96%的灵敏度可以被认为是非常高的。在存在尚不能被视为真阳性或真阴性的强异常值的情况下,获得了96%的特异性和96%的灵敏度,并且被认为是非常高的。
143.年龄灵敏度分析发现98%的灵敏度与97%的特异性。
144.本领域技术人员将认识到或者能够仅使用常规实验确定对于本文所描述发明的具体实施方案的许多等同替换。这样的等同替换意图被所附权利要求涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1