海洋细菌胞外多糖衍生物及其在治疗黏多糖病中的用途的制作方法
海洋细菌胞外多糖衍生物及其在治疗黏多糖病中的用途
1.相关申请
2.本技术要求于2020年7月2日提交的欧洲专利申请no.ep20183661.6的优先权,其全部内容通过引用并入本文。
背景技术:
3.黏多糖病(mps)是较大溶酶体贮积病(lsd)家族中的一组罕见遗传代谢病症。总体发病率为每25000-30000例活产中1例。然而,由于黏多糖病,尤其是较温和形式的疾病,经常未被识别,这些病症被诊断不足或误诊,使得难以确定它们在一般人群中的真实频率。mps的特征在于参与糖胺聚糖(gag,在结缔组织生物学和细胞串扰中起重要作用的长无支链多糖)的代谢(分解代谢或降解)的11种特定溶酶体酶中的任一种的缺乏(不存在或功能障碍)。这种溶酶体酶缺陷导致非降解和部分降解的gag在溶酶体内的积聚,导致产生多系统疾病的永久性进行性细胞损伤。具有mps障碍的个体共有许多类似的症状,例如多器官参与,独特的“粗糙”面部特征和骨骼异常,尤其是关节问题。其他发现包括身材矮小、心脏异常、呼吸不规则、肝和脾增大和/或神经异常。不同mps障碍的严重程度在受影响的个体中,甚至在具有相同类型mps的个体中以及甚至在相同家族的个体中变化很大。尽管每种mps在临床上不同,但大多数患者通常经历一段正常发育期,随后身体和/或精神功能下降。mps包括以下不同类型:mps i-h/s(hurler/scheie综合征)、mps i-h(hurler综合征)、mps i-s(scheie综合征)、mps ii(hunter综合征)、mps iii(sanfilippo综合征)、mps iv(morquio综合征)、mps ix(透明质酸酶缺乏或natowicz综合征)、mps vii(sly综合征)和mps vi(maroteaux-lamy综合征)。目前,没有特定的治疗可用于支持性护理和并发症的治疗,并且对于大的mps患者亚组需要治疗策略。
4.在mps病症中,iii型黏多糖病(也称为sanfilippo综合征)是最常见的。mps iii由四种不同亚型组成:a、b、c和d,每种亚型由参与硫酸乙酰肝素降解的四种酶之一的缺乏引起。mps iii的总发生率为每100000例活产0.28-4.1例。不同亚型的发病具有非常不均匀的地理分布;然而,a型和b型总是比c型和d型更常见。在所有mps iii亚型中,中枢神经系统(cns)受累占主导地位(神经变性、进展性痴呆、活动过度、癫痫发作和行为障碍),但也可存在其它症状,如影响生长并引起退行性关节病的骨骼病理、肝脾肿大、巨颅症和听力丧失。除了在减毒患者中,死亡通常发生在第二个十年,mps iii亚型a的儿童具有较短的存活率。目前对于sanfilippo综合征的患者没有治愈或标准治疗。在缺乏有效治疗的情况下,患者护理限于症状管理和姑息支持。mps iii病症使患者充分衰弱,并且对于父母和护理者而言具有挑战性,需要引起关注和研究。基因治疗、骨髓移植、伴侣分子、底物剥夺治疗和鞘内酶治疗是最活跃的治疗研究领域。
5.尽管一些发展提出了希望,即治疗干预、停止精神破坏和行为退化在将来的某些时候可能是可行的,但是目前对于mps iii和其他mps没有有效的疗法。因此,本领域仍然需要治疗黏多糖病的治疗选择。
6.发明概述
7.本发明人已经表明,从由菌株gy785(交替单胞菌(alteromonas)属的地狱交替单胞菌(alteromonas infernus)种)或菌株he800(弧菌(vibrio)属的魔鬼弧菌(vibrio diabolicus)种)分泌的海洋天然胞外多糖(eps)获得的低分子量过硫酸化多糖表现出抗乙酰肝素酶(hpse)活性。证明低分子量过硫酸化多糖能够影响硫酸乙酰肝素(hs)转换,从而导致来源于iiia型黏多糖病小鼠模型的成纤维细胞中细胞内hs的不完全降解。乙酰肝素酶是第一个在其分解代谢途径中降解硫酸乙酰肝素的酶,切割hs链的大片段,随后在溶酶体中通过外切糖苷酶解聚。尽管该机制未被完全理解,但据信未被hpse切割的完整hs链(由于低分子量过硫酸化多糖的抑制作用)不能进入溶酶体降解途径并被重新导向细胞外空间,从而在血液和尿液中被清除。因此,可以保护细胞免于毒性溶酶体hs积聚。用低分子量过硫酸化多糖治疗可以减轻由于硫酸乙酰肝素不完全降解导致溶酶体超负荷引起的症状。
8.因此,在第一方面,本发明涉及具有抗乙酰肝素酶活性的低分子量过硫酸化多糖,其用于预防或治疗受试者中的黏多糖病,其中所述具有抗乙酰肝素酶活性的低分子量过硫酸化多糖是由来自深海水热环境的嗜温海洋细菌分泌的天然胞外多糖(eps)的衍生物,并且其中所述低分子量过硫酸化多糖使用包括以下步骤的方法获得:
9.(a)包括来自交替单胞菌属的菌株gy785或来自魔鬼弧菌属的菌株he800的海洋天然eps的自由基解聚的步骤,以获得分子量为5,000-100,000g/mol的解聚eps;
10.(b)包括解聚eps的硫酸化的后续步骤,以获得过硫酸化的解聚eps,包括向所述解聚eps中添加至少一种硫酸化剂,所述硫酸化剂的量足以获得相对于所述过硫酸化的解聚eps的总重量具有10重量%-55重量%的硫酸根基团取代度的硫酸化多糖;和
11.(c)包括从过硫酸化的解聚eps分离低分子量过硫酸化多糖的后续步骤,其中所述低分子量过硫酸化多糖的分子量为约5,000-约16,000g/mol。
12.在某些实施方案中,在以上定义的制备方法的步骤(a)中,对由菌株gy785分泌的天然gy785 eps进行自由基解聚,并且所述具有抗乙酰肝素酶活性的低分子量过硫酸化多糖具有约6kda-约10kda或约7kda-约9kda的分子量,以及相对于过硫酸化多糖的总重量约30重量%-约40重量%的硫酸根基团取代度。
13.例如,所述具有抗乙酰肝素酶活性的低分子量过硫酸化多糖可以是gys8,其具有约8kda的分子量,和相对于过硫酸化多糖的总重量约36重量%的硫酸根基团取代度。
14.在某些实施方案中,在以上定义的制备方法的步骤(a)中,对由菌株he800分泌的天然he800 eps进行自由基解聚,并且其中所述具有抗乙酰肝素酶活性的低分子量过硫酸化多糖具有约3kda-约7kda或约4kda-约6kda的分子量,以及相对于过硫酸化多糖的总重量约45重量%-约55重量%的硫酸根基团取代度。
15.例如,所述具有抗乙酰肝素酶活性的低分子量过硫酸化多糖可以是he5.1,其具有约5.1kda的分子量,以及相对于过硫酸化多糖的总重量约50重量%的硫酸根基团取代度。
16.在某些实施方案中,将低分子量过硫酸化多糖与过硫酸化解聚eps分离的步骤通过分馏,特别是通过尺寸排阻色谱进行的分馏进行。
17.在某些实施方案中,黏多糖病是iii型黏多糖病。iii型粘多糖可以是a亚型、b亚型、c亚型或d亚型。
18.在另一方面中,本发明提供药物组合物,其包含治疗有效量的如本文所定义的具有抗乙酰肝素酶活性的低分子量过硫酸化多糖和至少一种医药学上可接受的载剂或赋型
剂,其用于预防或治疗受试者的黏多糖病。
19.在某些实施方案中,黏多糖病是iii型黏多糖病。iii型粘多糖可以是a亚型、b亚型、c亚型或d亚型。
20.通过阅读以下优选实施方案的详细描述,本发明的这些和其它目的、优点和特征对于本领域普通技术人员将变得显而易见。
21.附图简要说明
22.图1:硫酸乙酰肝素蛋白聚糖和乙酰肝素酶运输的示意性模型。
23.图2:处理对总蛋白聚糖的影响。该图报告了对照和处理细胞(源自mpsiiia小鼠模型的成纤维细胞)中蛋白聚糖的总量。对于每种胞外多糖衍生物(hes5.1(a5_3)和gys8(a5_4)),报告了两个独立实验的平均值
±
s.d。
24.图3:蛋白聚糖在对照和处理细胞中的分布。该图报告了在第一个纯化步骤后在胞外和胞内区室中测量的放射性,对应于总蛋白聚糖。对于每个胞外多糖衍生物,报告了两个独立实验的平均值
±
s.d。
25.图4:硫酸乙酰肝素在对照和处理细胞中的分布。该图报告了胞外和胞内区室中相应蛋白聚糖(pg)中硫酸乙酰肝素(hs)的百分比。每个区室中的pgs被认为是100%。对于每个化合物((a)a5_4(gys8)和(b)a5_3(hes5.1)),报告了两个独立实验的平均值
±
s.d。
26.图5:mpsiiia细胞中胞内和胞外硫酸乙酰肝素(hs)的page-nacl分布。从对照细胞分离hs并通过page分析。用azure a 0.08%检测标准品,而通过放射自显影检测来自mpsiiia细胞的hs。左侧报告了使用软件imagej获得的胞内和胞外hs的分布,右侧显示了相应的凝胶。
27.图6:通过gfc获得的分布。(a)第一图表示校正曲线。报告标准物的分子量。(b)第二图显示了对照mpsiiia细胞中胞内和胞外hs的分布。
28.图7:用a5_3(hes5.1)处理的mpsiiia细胞中胞内和外hs的page-nacl分布。从对照和处理的细胞中分离hs,通过page nacl分析并通过放射自显影检测。
29.图8:用a5_4(gys8)处理的mpsiiia细胞中胞内和胞外hs的page-nacl分布。从对照和处理的细胞中分离hs,通过page nacl分析并通过放射自显影检测。
30.图9:来自对照(未处理)细胞和用20μg/ml a5_3(hes5.1)处理的hs的gfc分布。(a)来自对照和处理细胞的胞外hs分布的叠加。(b)来自对照和处理细胞的胞内hs分布的叠加。处理引起分子量(mw)向对应于胞外hs的分子量(mw)的偏移。
31.图10:来自对照(未处理)细胞和用20μg/ml a5_4(gys8)处理的hs的gfc分布。(a)来自对照和处理细胞的胞外hs分布的叠加。(b)来自对照和处理细胞的胞内hs分布的叠加。处理引起分子量(mw)向对应于胞外hs的分子量(mw)的偏移。
32.图11:来自用a5_3(hes5.1)处理的mpsiiia细胞的hs的page分布。(a)来自用0、20、50和100μg/ml a5_3处理的细胞的胞内hs。(b)来自用0、20、50和100μg/ml a5_3处理的细胞的胞外hs。
33.定义
34.如本文所用,术语“受试者”是指人或另一哺乳动物(例如灵长类动物、狗、猫、山羊、马、猪、小鼠、大鼠、兔等),其可发展成黏多糖病,但可患有或可不患有所述疾病。非人受试者可以是转基因的或另外修饰的动物。在本发明的许多实施方案中,受试者是人。在这种
实施方案中,受试者通常被称为“个体”或“患者”。这些术语不表示特定年龄,因此涵盖新生儿、儿童、青少年和成人。术语“患者”更具体地指患有疾病的个体。因此,术语“黏多糖病患者”是指患有(即诊断为)黏多糖病的个体。
35.如本文所用,术语“抑制”是指防止某事发生、延迟某事发生和/或减少某事发生的程度或可能性。因此,本文可互换使用的术语“乙酰肝素酶抑制剂”和“hpse抑制剂”旨在是指抑制(即,预防、减少和/或延迟)乙酰肝素酶的正常功能的分子、化合物或药剂。当在本文中用于表征分子、化合物或试剂时,术语“具有抗乙酰肝素酶活性”是指作为肝素酶抑制剂的分子、化合物或药剂。
36.术语“治疗”在本文中用于表征旨在(1)延迟或预防疾病或病症(此处为黏多糖病)发作的方法或过程;(2)减缓或停止疾病或病症的症状的进展、加重或恶化;(3)改善疾病或病症的症状;或(4)治愈所述疾病或病症。治疗可以在疾病或病症开始后施用,用于治疗作用。或者,治疗可以在疾病或病症发作之前施用,用于预防或防止作用。在这种情况下,使用术语“预防”。
[0037]“药物组合物”在本文中定义为包含有效量的根据本发明的具有抗乙酰肝素酶活性的低分子量(lmw)过硫酸化多糖衍生物和至少一种药学上可接受的载体或赋形剂。
[0038]
如本文所用,术语“治疗有效量”是指足以实现其预期目的(例如细胞、组织、系统或受试者中的所需生物或医学响应)的分子、化合物、试剂或组合物的任何量。
[0039]
术语“药学上可接受的载体或赋形剂”是指不干扰活性成分的生物活性的有效性并且在其施用的浓度下对宿主没有过度毒性的载体介质。该术语包括溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸附延迟剂等。此类介质和试剂用于药物活性物质的用途是本领域熟知的(参见例如“remington’s pharmaceutical sciences”,e.w.martin,18
th ed.,1990,mack publishing co.:easton,pa,其全部内容通过引用并入本文)。
[0040]
除非另有说明或从上下文中明显看出(除非这样的数字将超过可能值的100%),否则如本文所使用的关于数字的术语“大约”和“约”通常包括落入该数字的任一方向上(大于或小于该数字)的10%范围内的数字。
[0041]
发明详述
[0042]
如上所述,本发明提供了具有抗乙酰肝素酶活性的低分子量过硫酸化多糖,其是由来自深海水热环境的嗜温海洋细菌分泌的天然胞外多糖的衍生物,并且涉及这些低分子量过硫酸化多糖在预防或治疗受试者中的黏多糖病,特别是在预防或治疗iii型黏多糖病中的用途。
[0043]
i-低分子量过硫酸化胞外多糖衍生物
[0044]
本发明中使用的低分子量过硫酸化多糖是两种天然胞外多糖(eps)的衍生物,he800 eps和gy785 eps,它们由来自深海水热环境的嗜温海洋细菌分泌。近年来,对分离和鉴定海洋来源的新多糖的兴趣日益增加,这些多糖可能在各种工业中具有新的应用。它们与来自其它来源(如海藻、甲壳类、动物或植物)的多糖竞争。对来自海洋环境的微生物的大量培养的兴趣已经显著增加,这代表了对开发不足的资源的生物技术使用的创新方法。海洋细菌eps及其衍生物作为治疗化合物具有一些极大的优点,因为它们可以以可行的经济成本,在与良好生产规范一致的受控条件下生产,并且由于大的“物种屏障”,对于受非常规传染性病原体(例如朊病毒或新出现的病毒)感染的患者表现出非常低的风险。
[0045]
已经证明来自深海热泉环境的属于三个主要属(弧菌属、交替单胞菌属和假交替单胞菌属)的海洋细菌能够在补充有需氧碳水化合物的培养基中产生罕见的胞外聚合物。分泌的胞外多糖呈现可被修饰以设计生物活性化合物并改进其特异性的原始结构特征(rehm et al.,rev.microbiol.,2010,8:578-592;colliec-jouault et al.,handbook of exp.pharmacol.,2012,423-449;delbarre-ladrat et al.,microorganisms,2017,5(3):53)。特别地,将从活性深海热泉样品中分离的第一产eps的弧菌种命名为魔鬼弧菌(raguenes et al.,int.j.syst.bacteriol.,1997,47:989-995)。其产生高分子量(》106g/mol
–
rougeaux et al.,j.carbohydr.res.,1999,322:40-45)的称为he800 eps的胞外多糖,其由线性四糖重复单元组成:两个葡糖醛酸残基、一个n-乙酰化葡糖胺残基和一个n-乙酰化半乳糖胺残基。在guaymas盆地(加利福尼亚湾)的深海沉积物中也分离了另一种细菌,命名为地狱交替单胞菌-一种新的交替单胞菌属物种(raguenes et al.,j.appl.microbiol.,1997,82:422-430)。该细菌地狱交替单胞菌产生称为gy785 eps的水溶性eps,其为具有九糖重复单元的支链杂多糖,所述九糖重复单元包含:4个葡萄糖残基、2个半乳糖残基、2个葡糖醛酸残基和1个在c2位带有硫酸基团的半乳糖醛酸残基(roger et al.,carbohydr.res.,2004,339:2371-2380;guezennec et al.,carbohydr.polym.,1998,37:19-24)。
[0046]
来自海洋天然胞外多糖he800 eps和gy785 eps的低分子量(lmw)过硫酸化多糖衍生物先前已由本发明人使用自由基解聚的第一步,随后进行硫酸化反应,从而产生分子量《30kg/mol(30,000da)的生物活性分子而制备(colliec-jouault et al.,biochim.biophys.acta,2001,1528:141-151;wo 2006/003290;wo 2007/066009;wo02/02051;guezennec j.et al.in carbohydrate polymers 1998,37(1):19-24;senni et al.,mar.drugs,2013,11:1351-1369;merceron et al.,stem cells,2012,30:471-480;senni et al.,mar.drugs,2011,9:1664-1681;heymann et al.,molecules,2016,21:309)。在本发明的实践中,使用类似的方法制备低分子量过硫酸化多糖,所述方法包括:
[0047]
(a)包括来自交替单胞菌属的菌株gy785或来自弧菌属的菌株he800的海洋天然eps的自由基解聚的步骤,以获得分子量为5,000-100,000g/mol的解聚eps;
[0048]
(b)包括解聚eps的硫酸化的后续步骤,以获得过硫酸化的解聚eps,包括向所述解聚eps中添加至少一种硫酸化剂,所述硫酸化剂的量足以获得相对于所述过硫酸化的解聚eps的总重量具有10重量%-55重量%的硫酸根基团取代度的硫酸化多糖;和
[0049]
(c)包括从过硫酸化的解聚eps分离低分子量过硫酸化多糖的后续步骤,其中所述低分子量过硫酸化多糖的分子量为约5,000-约16,000g/mol。
[0050]
在某些实施方案中,将步骤(a)之后获得的解聚eps冻干。
[0051]
在其它实施方案中,所述方法的步骤(b)之后是透析步骤。
[0052]
在第一解聚步骤中,天然eps可以以液体形式使用,即以它被细菌分泌到培养基中的原样使用。优选地,将培养基离心,并且仅收集含有天然eps且不含细菌碎片的上清液。天然eps可以通过本领域技术人员已知的任何合适的技术收集,例如膜超滤,且然后可以任选地原样冻干或以加成盐的形式冻干。
[0053]
包括天然eps的自由基解聚的步骤优选通过将氧化剂溶液添加到包含天然eps的反应混合物中,优选在金属催化剂的存在下进行。氧化剂优选选自过氧化物,特别是过氧化
氢,和过酸,特别是过乙酸和3-氯过苯甲酸。添加优选连续进行并搅拌30分钟至10小时。反应混合物优选保持在6-8的ph下,例如通过添加碱化剂(如氢氧化钠),并且在自由基解聚反应的整个过程中保持在约30℃-70℃的温度下。
[0054]
根据本发明的具体实施方案,在该步骤中,天然eps以约2mg/ml-约10mg/ml反应混合物的浓度存在于反应混合物中。
[0055]
在优选的实施方案中,氧化剂是过氧化氢(h2o2)溶液,其浓度优选为约0.1重量%-约0.5重量%,优选为约0.1重量%-0.2重量%,并且以v1/1000-v1/10ml/分钟,优选v1/50-v1/500ml/分钟,且更优选为约v1/100ml/分钟的流速添加,其中v1是向其中添加过氧化氢溶液的含有海洋胞外多糖(eps)的反应介质的体积。
[0056]
可以在解聚步骤中使用的金属催化剂优选选自cu
2+
、fe
2+
和cr
3+
离子和cr2o
72-阴离子,如在欧洲专利申请ep0221977中所具体描述。根据具体实施方案,金属催化剂以约10-3
m至约10-1
m的浓度,优选以约0.001m至约0.05m的浓度存在于反应混合物中。
[0057]
根据本发明和如上所述的自由基解聚方法使得可以在单个步骤中且以良好的产率获得均匀的低分子量多糖衍生物。在本发明的上下文中,术语“均匀的衍生物”旨在表示这样的衍生物,当使用高效尺寸排阻色谱法评估时,其表现出代表多糖链的主要群体的单个主峰,所述多糖链的主要群体在尺寸方面是均匀的,特征在于多分散指数i(mw/mn)《5,其中mw是重均分子量并且mn是数均分子量。
[0058]
在某些实施方案中,当解聚反应结束时,使用还原剂还原获得的多糖衍生物,以稳定其还原端非常活泼的链,特别是避免通过“剥离”反应的链水解。可用于该效果的还原剂的性质不是必需的。特别地,还原剂可以是硼氢化钠。
[0059]
在解聚步骤中使用的金属催化剂可以在解聚反应结束时(或者在还原反应结束时,如果进行还原步骤)使用任何合适的方法除去,例如通过离子交换层析,优选预先钝化的弱阳性离子交换层析,或者通过用edta(乙二胺四乙酸)处理。
[0060]
如果需要,由解聚和/或还原得到的多糖衍生物可以通过本领域技术人员熟知的任何合适的技术回收,例如通过膜超滤或透析。然后,将它们冻干并通过尺寸排阻色谱法分馏,以提高它们改进后续硫酸化步骤所需的纯度。最后,通过添加弱碱或强碱将纯化的多糖衍生物调节为盐形式,所述弱碱或强碱可选自例如吡啶、三乙胺、三丁胺、四丁基氢氧化铵和氢氧化钠。例如,可以通过在dow chemical公司以名称销售的那些离子交换柱上洗脱浓度为1-8mg/ml的多糖衍生物的水溶液来制备这种冻干物。只要ph保持酸性,例如小于5,就收集洗脱液,随后用如上定义的所需碱将ph调节至约6.5。然后,超滤并冻干盐形式的多糖衍生物。
[0061]
冻干的多糖衍生物(可能是加成盐的形式)优选在硫酸化步骤开始时溶于无水溶剂中。溶剂优选选自二甲基甲酰胺(dmf)、二甲亚砜(dmso)、甲酰胺及其混合物。存在于无水溶剂中的多糖衍生物的量可以为约1mg/ml-10mg/ml,优选约1mg/ml-约5mg/ml,甚至更优选该量为约2.5mg/ml。eps在无水溶剂中的溶解优选在搅拌下在室温下进行约1小时至约2小时,然后在40℃至50℃的温度下,优选在约45℃的温度下在具有分子筛的氩气或氮气下进行约2小时。
[0062]
可以将硫酸化步骤期间使用的一种或多种化学硫酸化试剂添加到冻干形式或溶液形式的解聚和/或还原的eps中。
[0063]
硫酸化试剂优选选自吡啶硫酸盐(游离的或与聚合物偶联的)、二甲基甲酰胺硫酸盐、三乙胺硫酸盐和三甲胺硫酸盐的络合物。将一种或多种化学硫酸化试剂以优选占溶液中多糖衍生物质量约4至约6倍,甚至更优选约5倍的重量添加到多糖衍生物溶液中。然后,根据期望的硫酸化程度,优选在搅拌下进行化学硫酸化反应2-24小时。当达到期望的硫酸化程度时,在冷却反应介质之后停止硫酸化反应:
[0064]
-通过在氯化钠饱和的丙酮或甲醇的存在下沉淀,然后将沉淀物溶于水中;
[0065]
-或者,优选地,通过以优选等于反应体积的1/10的比例添加水,并用碱化剂(例如氢氧化钠(3m))将反应介质的ph调节至9。
[0066]
根据某些实施方案,优选将硫酸化多糖衍生物的溶液透析以除去各种盐,然后冻干。典型地具有精确分子量和低多分散性指数的最终产物(即,低分子量的过硫酸化多糖)通过从获得的低分子量解聚eps中分离而获得。分离可以通过本领域已知的任何合适的方法进行。优选地,通过大小排阻层析进行的分馏进行分离。
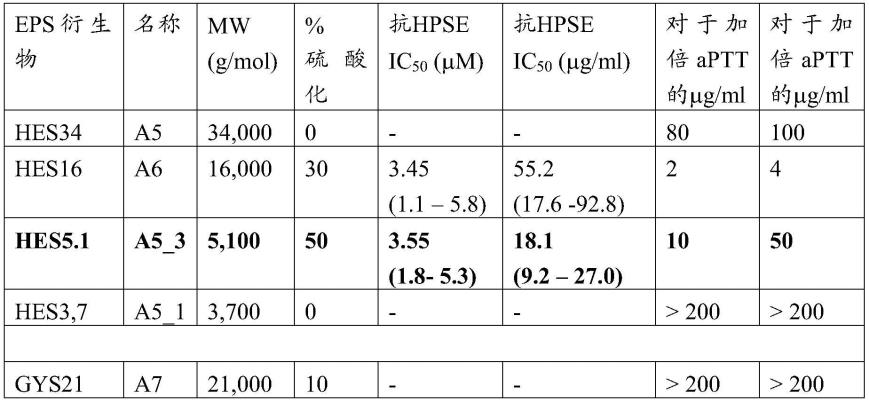
[0067]
根据本发明的低分子量过硫酸化多糖具有小于5,优选1.5至4,更优选小于2的低多分散指数。如本文所用,多分散指数(pdi)是eps衍生物的分子量分布的量度。计算的pdi是重均分子量除以数均分子量。pdi典型地通过尺寸排阻色谱法测量。
[0068]
根据本发明的低分子量过硫酸化多糖具有相对于硫酸化多糖衍生物的总重量为10重量%-55重量%的硫酸根基团取代度。在某些实施方案中,硫酸根基团取代度为10%-40%,20%-45%或20%-40%。在其它实施方案中,硫酸根基团取代度为30%-60%,40%-55%或约50%。
[0069]
在某些实施方案中,低分子量过硫酸化多糖是从由菌株gy785(交替单胞菌属的地狱交替单胞菌种)分泌的天然gy785 eps制备的,具有约6kda-约10kda或约7kda-约9kda的分子量,和相对于过硫酸化多糖的总重量按重量计约30%-约40%的硫酸根基团取代度。在一个具体实施方案中,低分子量过硫酸化多糖是由天然gy785 eps制备的gys8,具有约8kda的分子量,和相对于过硫酸化多糖的总重量约36重量%的硫酸根基团取代度。
[0070]
在其它实施方案中,低分子量过硫酸化多糖是从由菌株he800(弧菌属的魔鬼弧菌种)分泌的天然he800 eps制备的,具有约3kda-约7kda或约4kda-约6kda的分子量,和相对于过硫酸化多糖的总重量约45重量%-55重量%的硫酸根基团取代度。在一个具体实施方案中,低分子量过硫酸化多糖是由天然he800 eps制备的hes5.1,具有约5.1kda的分子量,和相对于过硫酸化多糖的总重量约50重量%的硫酸根基团取代度。
[0071]
ii-低分子量过硫酸化多糖的用途
[0072]
1-适应症
[0073]
本发明人已经证明本文所述的低分子量过硫酸化多糖是乙酰肝素酶(hspe)抑制剂(即,表现出抗乙酰肝素酶活性)。因此,由于其抗hspe活性,如上文所定义的低分子量过硫酸化多糖,特别是hes5.1和gys8,可用于治疗或预防受试者的黏多糖病,优选iii型黏多糖病。术语“黏多糖病”和“mps”在本文中可互换使用。它们是指以在溶酶体内糖胺聚糖(gag)的积聚和贮存为特征的溶酶体贮积病的亚组。黏多糖病可以是mps i-h/s(hurler/scheie综合征)、mps i-h(hurler综合征)、mps i-s(scheie综合征)、mps ii(hunter综合征)、mps iii(sanfilippo综合征)、mps iv(morquio综合征)、mps ix(透明质酸酶缺乏或natowicz综合征)、mps vii(sly综合征)和mps vi(maroteaux-lamy综合征)。优选地,黏多
糖病是mps iii(sanfilippo综合征)。mps iii的特征在于存在未降解的硫酸乙酰肝素,这是由于缺乏其分解代谢所必需的四种酶之一,造成mps iii的四种亚型之一:iiia型(乙酰肝素磺酰胺酶)、iiib型(α-n-乙酰葡糖胺酶)、iiic型(α-氨基葡糖苷-n-乙酰基转移酶)和iiid型(n-乙酰葡糖胺-6-硫酸酯酶)。
[0074]
本发明的治疗方法可以使用本文所述的低分子量过硫酸化多糖或其药物组合物来实现。这些方法通常包括向有需要的受试者施用有效量的低分子量过硫酸化多糖(如上文所定义,特别是hes5.1或gys8)或其药物组合物。可以使用本领域技术人员已知的任何方法进行施用。特别地,低分子量过硫酸化多糖或其组合物可以通过各种途径中的任一种施用,包括但不限于气雾剂、肠胃外、口服或局部途径。
[0075]
优选地,受试者是mps iii患者。在本发明的实践中,mps iii病症可以是a、b、c或d亚型。在某些实施方案中,mps iii病症是mps iiia或mps iiib。
[0076]
通常,低分子量过硫酸化多糖或其组合物以有效量施用,即足以实现其预期目的的量。取决于mps iii病症的亚型、待治疗的受试者的年龄、性别、体重和一般健康状况、期望的生物学或医学响应等,待施用的低分子量过硫酸化多糖或药物组合物的确切量将随受试者而变化。在某些实施方案中,有效量是预防、延迟和/或降低与mps病症相关的至少一种症状的可能性的量。例如,在mps iii病症的情况下,症状可以是行为问题(乱发脾气、活动过度、破坏性、攻击行为、异食症、睡眠障碍、癫痫发作)、行走问题、关节僵硬、视力和/或听力丧失、沟通困难等。根据本发明的治疗的效果可以使用本领域已知的任何诊断测定、测试和程序来监测。
[0077]
在某些实施方案中,根据本发明的方法施用单独的本文所述的低分子量过硫酸化多糖或其组合物。在其它实施方案中,低分子量过硫酸化多糖或其组合物与至少一种另外的治疗剂或治疗程序组合施用。低分子量过硫酸化多糖或其组合物可以在施用治疗剂或治疗程序之前、与治疗剂或程序同时和/或在施用治疗剂或程序之后施用。
[0078]
可以与本文所述的低分子量过硫酸化多糖或其组合物组合施用的治疗剂可以选自已知在治疗mps病症,特别是mps iii病症中具有有益效果的多种生物活性化合物(例如,抗炎剂、免疫调节剂、镇痛剂、抗微生物剂、抗菌剂、抗生素、抗氧化剂、防腐剂、抗癫痫药物、用于心脏问题的药物及其组合)。可以与施用低分子量过硫酸化多糖或其组合物组合进行的治疗程序包括但不限于用于校正关节异常的矫形外科手术、用于视力异常的角膜移植、听力缺陷的校正等。用于控制sanfilippo综合征症状的其它疗法包括语音疗法、职业疗法、物理疗法、行为疗法等。
[0079]
2-施用
[0080]
本文所述的低分子量过硫酸化多糖(任选地在与一种或多种合适的药学上可接受的载体或赋形剂配制后),以期望的剂量,可以通过任何合适的途径向有需要的受试者施用。各种递送系统是已知的并且可以用于施用本发明的胞外多糖衍生物,包括片剂、胶囊、可注射溶液、包封在脂质体、微粒、微胶囊中等。施用方法包括但不限于皮肤、皮内、肌内、腹膜内、病灶内、静脉内、皮下、鼻内、肺部、硬膜外、眼部和口服途径。本文所述的低分子量过硫酸化多糖或其组合物可以通过任何方便的或其它合适的途径施用,例如通过输注或推注,通过上皮或粘膜皮肤内层(例如口腔、粘膜、直肠和肠粘膜等)吸附。施用可以是全身的或局部的。肠胃外施用可以针对患者的给定组织,例如通过导管插入术。如本领域普通技术
人员将理解的,在其中低分子量过硫酸化多糖与另外的治疗剂一起施用的实施方案中,胞外多糖衍生物和治疗剂可以通过相同途径(例如口服)或通过不同途径(例如口服和静脉内)施用。
[0081]
3-剂量
[0082]
根据本发明的如本文所述的低分子量过硫酸化多糖(或其组合物)的施用将是以使得递送的量对于预期目的有效的剂量。施用途径、制剂和施用剂量将取决于所需的治疗效果、所治疗病症的严重程度、任何感染的存在、患者的年龄、性别、体重和一般健康状况以及低分子量过硫酸化多糖的功效、生物利用度和体内半衰期、使用(或不使用)伴随治疗和其它临床因素。这些因素可由主治医师在治疗过程中容易地确定。可替代地或另外地,待施用的剂量可以从使用动物模型的研究确定。基于这些或其它方法调节剂量以实现最大功效在本领域中是公知的,并且在受过训练的医师的能力范围内。当使用本文所述的低分子量过硫酸化多糖进行研究时,将出现关于适当剂量水平和治疗持续时间的进一步信息。
[0083]
根据本发明的治疗可以由单剂量或多剂量组成。因此,本文所述的低分子量过硫酸化多糖或其组合物的施用可以在一定时间段内是恒定的或周期性的并且以特定间隔,例如每小时、每天、每周(或以一些其他多天间隔)、每月、每年(例如以定时释放形式)。或者,递送可在给定时间段内多次发生,例如每周两次或更多次、每月两次或更多次等。递送可以是持续一段时间的连续递送,例如静脉内递送。
[0084]
iii-药物组合物
[0085]
如上所述,本文所述的低分子量过硫酸化多糖可以本身或作为药物组合物施用。因此,本发明提供了包含有效量的低分子量过硫酸化多糖(特别是hes5.1或gys8)和至少一种药学上可接受的载体或赋形剂的药物组合物。在一些实施方案中,所述组合物还包含一种或多种另外的生物活性剂。
[0086]
本文所述的低分子量过硫酸化多糖或其药物组合物可以以有效实现期望的预防或治疗效果的任何量和使用任何施用途径施用。优化药物制剂可根据施用途径和所需剂量而变化。此类制剂可影响所施用的活性成分的物理状态、稳定性、体内释放速率和体内清除速率。
[0087]
本发明的药物组合物可以配制成易于施用和剂量均匀的单位剂型。本文所用的表述“单位剂型”是指用于待治疗患者的物理离散单位。然而,应当理解,组合物的总日剂量将由主治医师在合理的医学判断范围内决定。
[0088]
1-制剂
[0089]
可注射制剂,例如无菌可注射水性或油性悬浮液可根据已知技术使用合适的分散剂或润湿剂和助悬剂配制。无菌可注射制剂还可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液、悬浮液或乳液,例如作为在2,3-丁二醇中的溶液。可以使用的可接受的媒介物和溶剂是水、林格氏溶液、u.s.p.和等渗氯化钠溶液。此外,无菌不挥发性油通常用作溶液或悬浮介质。为此目的,可以使用任何温和的不挥发油,包括合成的甘油单酯或甘油二酯。脂肪酸(如油酸)也可用于制备可注射制剂。无菌液体载体可用于肠胃外施用的无菌液体形式组合物。
[0090]
可注射制剂可例如通过经由细菌截留过滤器过滤或通过并入呈无菌固体组合物形式的灭菌剂来灭菌,所述灭菌剂可在使用前溶解或分散于无菌水或其它无菌可注射介质
中。作为无菌溶液或悬浮液的液体药物组合物可以例如通过静脉内、肌内、腹膜内或皮下注射施用。注射可以通过单次推注或通过逐步输注。必要或需要时,组合物可包括局部麻醉剂以减轻注射位点的疼痛。
[0091]
为了延长活性成分的作用,通常需要减缓成分从皮下或肌内注射的吸收。延迟胃肠外施用的活性成分的吸收可以通过将所述成分溶解或悬浮在油媒介物中来实现。通过在生物可降解聚合物(例如聚丙交酯-聚乙交酯)中形成活性成分的微囊化基质来制备可注射贮库形式。根据活性成分与聚合物的比例和所用特定聚合物的性质,可以控制成分的释放速率。其它生物可降解聚合物的实例包括聚(原酸酯)和聚(酸酐)。贮库可注射制剂也可通过将活性成分包埋在与身体组织相容的脂质体或微乳液中来制备。
[0092]
用于口服施用的液体剂型包括,但不限于,药学上可接受的乳剂、微乳剂、溶液、悬浮液、糖浆、酏剂和加压组合物。除了本文所述的低分子量过硫酸化多糖,液体剂型可含有本领域常用的惰性稀释剂,例如,水或其它溶剂、增溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苯甲酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油(特别地,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和山梨聚糖的脂肪酸酯及其混合物。除了惰性稀释剂,口服组合物也可包括佐剂,例如润湿剂、悬浮剂、防腐剂、甜味剂、调味剂和芳香剂、增稠剂、色素、粘度调节剂、稳定剂或渗透压调节剂(osmo-regulator)。用于口服施用的适合的液体载体的实例包括水(可能含有如上添加剂,例如,纤维素衍生物,例如羧甲基纤维素钠溶液)、醇(包括单元醇和多元醇,例如二醇类)和它们的衍生物,和油(例如,分馏椰子油和花生油)。对于加压组合物,液体载体可为卤代烃或其它药学上可接受的推进剂。
[0093]
用于口服施用的固体剂型包括,例如,胶囊、片剂、丸剂、粉末和颗粒剂。在这种固体剂型中,本文所述的低分子量过硫酸化多糖可与至少一种惰性的、药学可接受的赋形剂或载体(例如柠檬酸钠或磷酸二钙)和以下一种或多种组分混合:(a)填充剂或填料,例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如甘油;(d)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、某些硅酸盐和碳酸钠;(e)溶液缓凝剂(solution retarding agent),例如石蜡;吸收促进剂,例如季铵化合物;(g)润湿剂,例如,十六烷醇和甘油单硬脂酸酯;(h)吸附剂,例如高岭土和膨润土;和(i)润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠和其混合物。其它适用于固体制剂的赋形剂包括表面改性剂。例如非离子和阴离子表面改性剂。表面改性剂的代表性实例包括,但不限于,泊洛沙姆188、苯扎氯铵、硬脂酸钙、十六十八醇、聚西托醇乳化蜡、山梨聚糖酯、胶体二氧化硅、磷酸盐、十二烷基硫酸钠、硅酸铝镁和三乙醇胺。在胶囊、片剂和丸剂的情况中,剂型也可包含缓冲剂。
[0094]
利用这类赋形剂(如乳糖(lactose)或乳糖(milk sugar)以及高分子量聚乙二醇等),相似类型的固体组合物也可用作软质和硬质填充明胶胶囊中的填充剂。可制备具有包衣和外壳(例如肠溶包衣、控释包衣和其它药物配制领域所熟知的包衣)的片剂、胶囊、丸剂和颗粒剂的固体剂型。它们可任选地包含遮光剂并也可以是组合物以使得它们仅或优选地在肠道的特定部分中、任选地以延迟的方式释放活性成分。可用的包埋组合物的实例包括聚合物质和蜡。
[0095]
在某些实施方案中,可能需要将本发明的组合物局部施用于特定区域。这可以例
如但不限于通过局部输注、局部施用、通过注射、通过导管、通过栓剂或通过皮肤贴片或支架或另一种植入物来实现。
[0096]
对于局部施用,组合物优选配制成凝胶、药膏、洗剂、或霜剂,其可包括载体例如水、甘油、醇、丙二醇、脂肪醇、三甘油酯、脂肪酸酯或矿物油。其它局部载体包括液体石油、棕榈酸异丙酯、聚乙二醇、乙醇(95%)、水中的聚氧乙烯单月桂酸酯(5%)或水中的十二烷基硫酸钠(5%)。需要时可添加其它物质,例如抗氧剂、湿润剂、粘度稳定剂和类似试剂。
[0097]
此外,在某些情况中,预期本发明组合物可置于放置在皮肤之上、之中或之下的透皮装置内。这种装置包括贴片、植入物和注射剂,其通过被动或主动释放机制释放活性成分。透皮施用包括跨越身体表面和身体通道内衬(包括上皮和粘膜组织)的全部施用方式。这种施用可使用洗剂、霜剂、泡沫剂、贴片、悬浮液、溶液和栓剂形式的本组合物来实现。
[0098]
透皮施用可以通过使用含有活性成分(即,本文所述的低分子量过硫酸化多糖)和载体的透皮贴剂来实现,所述载体对皮肤无毒并允许将用于全身吸收的成分经由皮肤递送入血流。载体可以采取许多形式,例如霜剂和软膏、糊剂、凝胶和闭合装置。霜剂和软膏可以是水包油或油包水型的粘性液体或半固体乳剂。由包含活性成分的分散于石油或亲水性石油中的吸收性粉末组成的糊剂可能是适合的。可使用多种闭合装置来将活性成分释放到入血流中,例如覆盖包含活性成分(含或不含载体)的贮库的半渗透膜或包含活性成分的基质。
[0099]
栓剂制剂可以由常规材料制备,包括可可脂(添加或不添加蜡以改变栓剂的熔点)和甘油。也可以使用水溶性的栓剂基质,例如不同分子量的聚乙二醇。
[0100]
用于生产各种制剂的材料和方法是本领域已知的并可适用于实施本发明。用于递送抗体的适合的制剂可见于,例如,“remington’spharmaceutical sciences”,e.w.martin,第18版,1990,mack publishingco.:easton,pa中。
[0101]
2-额外的生物活性剂
[0102]
在某些实施方案中,本文所述的低分子量过硫酸化多糖是本发明的药物组合物中的唯一活性成分。在其它实施方案中,药物组合物进一步包含一种或多种生物活性剂。适合的生物活性剂的实例包括,但不限于,抗炎剂、免疫调节剂、止痛剂、抗微生物剂、抗菌剂、抗生素、抗氧化剂、防腐剂、抗癫痫药物、用于心脏病的药物及其组合。
[0103]
在这种药物组合物中,可以在一种或多种制剂中组合本文所述的低分子量过硫酸化多糖和至少一种额外的治疗剂,用于同时、单独或相继施用低分子量过硫酸化多糖和治疗剂。更具体地,本发明组合物可以以低分子量过硫酸化多糖和治疗剂可以一起施用或彼此独立施用的方式配制。例如,低分子量过硫酸化多糖和治疗剂可以一起配制于单个组合物中。或者,他们可以单独保持(例如在不同的组合物和/或容器中)和施用。
[0104]
3-药物组件或试剂盒
[0105]
另一方面,本发明提供包含一个或多个容器(例如小瓶、安瓿、试管、烧瓶或瓶子)的药物组件或试剂盒,所述容器包含本发明药物组合物的一种或多种成分,允许施用本文所述的低分子量过硫酸化多糖。
[0106]
药物组件或试剂盒的不同成分以固体(例如冻干的)或液体形式提供。各成分将通常适于在其各自的容器中等分或以浓缩形式提供。根据本发明的组件或试剂盒可以包括用于重组冻干成分的介质。试剂盒的单个容器将优选保持密封,以用于商业销售。
[0107]
在某些实施方式中,组件或试剂盒包括一种或多种额外的治疗剂。任选与容器有关的可以是调控药物或生物产品的制备、使用或销售的政府机构规定形式的通知书或包装添加物,所述通知书反映了制备、使用或销售的机构批准用于人施用。包装插页的通知可以包含根据本文公开的治疗方法使用药物组合物的说明书。
[0108]
标识符(例如条形码、无线电频率、id标签等)可以存在于试剂盒中或试剂盒上。标识符可用于例如为了质量控制、存货控制、工作站之间的移动跟踪等唯一地鉴定试剂盒。
[0109]
本发明的其它方面和优点将在以下附图和实施例中公开,这些附图和实施例应被认为是说明性的而不限制本技术的范围。
具体实施方式
[0110]
以下实施例描述进行和实施本发明的一些优选的方式。然而,应理解实施例仅用于说明性目的而不意味着限制本发明范围。此外,除非实施例中的描述是用过去时态呈现,否则与说明书的其余部分一样,正文并不意欲表明实际进行了实验或实际获得了数据。
[0111]
工作假设
[0112]
图1显示了硫酸乙酰肝素(hs)蛋白聚糖和乙酰肝素酶(hpse)运输的示意性模型。在该方案中:1.在高尔基体中,hs链被聚合,且pro-hpse被加工以通过消除n-末端信号肽产生pro-hpse。2.然后,将新生物合成的hspg转移到细胞膜,在那里它们可以与pro-hpse和3相互作用,和3.复合物通过胞吞作用迅速内化,以及然后4.在晚期胞内体积聚。5.当晚期胞内体与溶酶体融合时,pro-hpse被激活并切割被溶酶体水解酶完全降解的hs链。6.hpse和hspg可从胞内体再循环到细胞表面。似乎活性hpse在细胞中追求其它途径。7.通过存在于晚期胞内体中的活性hpse从多配体蛋白聚糖修剪hs导致形成多配体蛋白聚糖-突触蛋白-alix复合物。然后,通过胞内体膜的内陷形成腔内囊泡(ilv),导致形成多囊泡体(mvb)。mvb在与细胞膜融合后作为外来体释放ilv并将其货物递送至受体细胞。在高水平hpse的存在下,该酶可以在外来体的表面发现并调节肿瘤微环境。8.已经在恶性细胞中观察到溶酶体胞外分泌。9.hpse还通过驱动溶酶体与将大分子降解成单体单元的自噬体的融合来调节自噬。10.核周溶酶体hpse也可以易位到核中并调节基因转录和细胞分化。
[0113]
工作假设是胞外多糖衍生物对hpse的抑制可以通过在有缺陷的降解酶的情况下防止hs的hpse切割片段的溶酶体降解来改变sanfilippo综合征中hs的分解代谢命运。
[0114]
胞外多糖衍生物
[0115]
如前所述生产、纯化和表征细菌gy785和he800胞外多糖(eps)(guezennec et al.,carbohydr.polym.,1998,37:19-24)。低分子量过硫酸化eps衍生物的制备、纯化和表征如先前报道进行(ruiz velasco etal.,glycobiology,2011,21:781-795;wo 2006/003290;colliec-jouault et al.,biochim.biophys.acta,2001,1528:141-151;wo 2007/066009;wo 02/02051;guezennec j.et al.in carbohydrate polymers 1998,37(1):19-24;senni et al.,mar.drugs,2013,11:1351-1369;merceron et al.,stem cells,2012,30:471-480;senni et al.,mar.drugs,2011,9:1664-1681;heymann et al.,molecules,2016,21:309)。简言之,首先使用自由基解聚方法将天然高分子量gy785eps和hep800解聚以获得具有不同分子量的低分子量衍生物。然后,在二甲基甲酰胺(dmf)中使用硫酸吡啶作为硫酸化试剂将这些低分子量gy785和he800eps衍生物硫酸化,得到低分子量过硫酸化多
糖。通过hpsec-mals测定硫酸化之前和之后的分子量(mw)并且通过hpaec色谱测定硫含量(wt%s)。atr-ftir和nmr光谱用于评估硫酸化反应的效率。来自猪肠粘膜h4784的肝素钠盐购自sigma。
[0116]
实施例1:抗凝血和抗乙酰肝素酶活性
[0117]
内切葡糖醛酸酶乙酰肝素酶(hpse)是降解其分解代谢途径中的硫酸乙酰肝素(hs)的第一酶,切割hs链的大片段,随后在溶酶体中通过外切糖苷酶解聚。hs-6-o-硫酸酯酶1和2(sulf1和sulf2)从葡糖胺单元除去硫酸根基团,这改变hs中的电荷分布,并影响它们与配体蛋白(如生长因子)的相互作用。第一个实验的目的是确定低分子量过硫酸化eps衍生物是否能够抑制合成后修饰hs链的酶,乙酰肝素酶和硫酸酯酶。
[0118]
结果
[0119]
胞外多糖衍生物的抗凝血和抗乙酰肝素酶活性。与jin-ping li博士(uppsala university,sweden)合作,本发明人确定了不同胞外多糖(eps)衍生物的抗乙酰肝素酶(抗-hpse)活性。结果示于下表1中。发现抗hpse活性取决于eps衍生物的电荷,但不受5,000da至16,000da的eps衍生物的大小的显著影响。测定eps衍生物的ic
50
值为1-5μm(参见表1)。因此,所测试的eps衍生物表现出作为hpse抑制剂的强大潜力。
[0120]
此外,与romain viv
è
s博士(structure and activit
é
s des glycosaminoglycanes,institut de biologie structurale de grenoble)合作,本发明人发现eps衍生物研究还抑制6-o-内切型硫酸酯酶(sulf1和sulf2),即改变hs的硫酸化模式并因此调节其对配体蛋白的亲和力的酶。
[0121]
表1.eps衍生物的抗凝血剂和抗hpse活性。mps治疗的最佳候选物以粗体表示。
[0122][0123][0124]
实施例2:海洋细菌胞外多糖衍生物作为sanfilippo综合征的潜在治疗
[0125]
hes5.1(a5_3)和gys8(a5_4),在实施例1中发现表现出最令人感兴趣的性质的两种低分子量过硫酸化多糖被进一步研究以探索它们用作sanfilippo治疗的治疗能力。基于
根据其抑制hs链的第一次切割防止片段的溶酶体降解的工作假设,胞外多糖衍生物应具有治疗所有形式的sanfilippo综合征(mpsiii)的活性。本发明人研究了mpsiii病症之一,mps iii a亚型(mpsiiia),其中hs-磺酰胺酶通过突变失活。根据该假设,低分子量过硫酸化多糖对hpse的抑制应通过在有缺陷的降解酶的情况下防止hpse切割片段的溶酶体降解来改变hs的分解代谢命运。
[0126]
本发明人在体外使用来源于mpsiiia小鼠模型的成纤维细胞(与k.hemsley博士,adelaide,australia合作)(crawley et al.,brain res.,2006,1104:1-17)。它们在胞外区室(培养基加表面)和胞内区室中纯化hs,并通过凝胶电泳(page)和凝胶过滤(gfc)表征它们的大小和电荷。他们分析了用低分子量过硫酸化多糖处理对这些参数的影响。对于每种胞外多糖衍生物,进行两个独立的实验,从接种细胞到分离hs和最终分析hs的大小(长度/分子量)开始。
[0127]
结果
[0128]
硫酸乙酰肝素(hs)量的分析。在每个实验中,对细胞进行计数,并将所得结果归一化为细胞总数。为了进一步归一化结果,进行
35
so4掺入水平的校正,并计算为回收的测量的总放射性与向细胞施用的初始放射性之比。发现本实验中的掺入水平为1.2%-5.6%。
[0129]
对蛋白聚糖作用的观察:第一纯化步骤,包括尺寸排阻色谱法,允许将高分子量物质与游离na
235
so4分离。硫酸化蛋白聚糖(pg)的总量被认为是从第一纯化步骤回收的物质,并以cpm(放射性)表示。对于两种胞外多糖衍生物(hes5.1(a5_3)和gys8(a5_4)),发现在对照未处理的mpsiiia细胞和处理的mpsiiia细胞中pg的总量相似(参见图2)。
[0130]
通过更深入地观察pg的分布,发明人观察到胞外区室中蛋白聚糖的量高于相应的胞内蛋白聚糖的量(参见图3)。对照和处理的细胞之间的差异不显著,意味着eps衍生物处理不影响由这些细胞产生的pg的总量和分布。
[0131]
对硫酸乙酰肝素的影响的观察:将硫酸乙酰肝素与胞外和胞内级分分离,且它代表了细胞中存在的少数总糖胺聚糖。事实上,在对照细胞中发现hs在总pg中的百分比为12%-37%。发明人计算了hs相对于相应级分中的pg的百分比,将100%视为pg的量(参见图4)。在对照细胞中,测定hs以代表(29
±
11)%的胞内pg,和(16
±
4)%的胞外pg和(20
±
5)%的总pg(n=8)。通常,hs的再分配和hs的总百分比都不同,但在对照和处理的细胞之间没有统计学差异。当细胞用a5_4(gys8)处理而不用a5_3(hes5.1)处理时,存在胞外区室中hs增加的趋势。
[0132]
总之,可以得出结论,用胞外多糖衍生物处理mpsiiia细胞不改变蛋白聚糖的总量和分布。尽管经历了变化,但总硫酸乙酰肝素的百分比不受eps衍生物处理的显著影响。
[0133]
分析中的下一步骤是观察硫酸乙酰肝素的大小(长度/分子量),认为用低分子量过硫酸化多糖处理将影响hs降解的第一步,因此,在胞内区室中将发现具有较高分子量的hs链。
[0134]
对照细胞中硫酸乙酰肝素(hs)分子量的分析。野生型细胞产生具有20kda以上分子量的完整大小的hs,其在胞内区室中组装并在细胞表面上表达为蛋白聚糖(colliec-jouault et al.,j.biol.chem.,1994,269:24953-24958)。hs的溶酶体分解代谢是快速的,并且低分子量(lmw)中间体是瞬时的,并且含量低,未检测到(yanagishita and hascall,proteoglycan metabolism by rat ovarian granulosa cells in vitro.in:wight,
mecham rp(eds.),biology of the proteoglycans,1ed.orlando:academic press;1987:105-128)。在mpsiiia细胞中,胞内hs表现出广泛分布的lmw的部分降解的hs片段,其由于功能失调的磺酰胺酶而积聚在溶酶体中,如page-nacl电泳所证实(参见图5)。通过比较样品与糖胺聚糖标准品(mulloy et al.,thromb haemost.1997,77(4):668-674),可以估计胞外hs的分子量,其集中在高分子量区域(》20kda)。相反,对于胞内hs,可以观察到在lmw区域(《20kda)积聚的宽范围的hs片段,导致凝胶上的涂片。
[0135]
然后,发明人决定使用不同的技术并选择在pbs,0.15m nacl,ph7.4中平衡的cl6b树脂上进行凝胶过滤层析(gfc)。通过page分离分子不仅取决于分子量而且取决于总负电荷,而通过gfc分离主要取决于分子的尺寸。图6显示了用标准品获得的校准曲线和对照胞内和胞外hs分布的实例。用gfc观察到胞内hs的清晰峰。分子量和分布示于表2中。发现通过page计算的胞外hs的平均mw(n=8)为37.1kda,跨度为24-50.7kda,而发现通过gfc计算的平均mw(n=3)为43kda,跨度为17.7-116.7kda。胞内hs仅用gfc良好显示,其中平均mw为7.9kda,但片段跨度为3.5-28kda(n=5)。
[0136]
表2.mpsiiia细胞中胞外和胞内hs的大小分布。从对照细胞分离hs并通过page和gfc分析。分子量(mw)以kda
±
sd表示。
[0137]
计算半峰高处的范围。
[0138][0139]
分析经处理细胞中硫酸乙酰肝素(hs)的分子量。用低分子量过硫酸化多糖处理对mpsiiia细胞的作用是阻断胞内hs的部分降解,使得来自经处理细胞的hs保持未降解且mw类似于胞外物种(》20kda)。测试三种浓度的eps衍生物:20、50和100μg/ml。将细胞处理4天,然后添加放射性硫酸盐供体,并在24小时后收集。
[0140]
图7和图8分别显示了在对照和a5_3(hes5.1)处理的细胞中以及在对照和a5_4(gys8)处理的细胞中获得的page nacl凝胶的实例。对照细胞显示胞内低分子量hs和胞外高分子量hs。与未处理的细胞相比,经处理细胞明显表现出高分子量胞内hs(》20kda)。经处理和未处理的胞外hs的分子量相同。对于使用的三种浓度,观察到的效果相似。
[0141]
图9显示了来自对照和经处理(20μg/ml的a5_3(hes5.1))细胞的hs的gfc曲线。胞外hs不受处理的影响,如通过叠加的gfc分布所观察。处理影响胞内hs:在处理后清楚地观察到向更高mw(》20kda)的转变,并且经处理的hs的mw类似于胞外高分子量hs。
[0142]
图10显示了来自对照和经处理(20μg/ml的a5_4(gys8))细胞的hs的gfc曲线。a5_4处理的效果与a5_3相似:胞外hs不受用低分子量过硫酸化多糖处理的影响,而胞内hs向较高mw(》20kda)移动。
[0143]
表3和表4总结了page和gfc分析的结果。两种技术都证明了仅影响胞内hs的处理特异性。所有三种测试浓度的效果相似。
[0144]
表3.经a5_3(hes5.1)处理的mpsiiia细胞中hs的大小分布。从对照和经处理的细胞中分离hs,并通过page和gf分析。mw以kda表示。*两个独立实验的平均值
±
sd。计算半峰
高处的范围。
[0145][0146]
表4.经a5_4(gys8)处理的mpsiiia细胞中hs的大小分布。从对照和经处理的细胞中分离hs,并通过page和gf分析。mw以kda表示。*两个独立实验的平均值
±
sd。计算半峰高处的范围。
[0147][0148]
表达hs的mw分布的另一种方式是查看某一阈值之前和之后链的百分比。为简单起见,发明人将其定义为page分布中胞外hs的峰,其对应于处理后胞内hs的峰,如图11和表5所示。由于发现测试的三种浓度的效果相似,结果表示为三种浓度的平均值。显然,用a5_3(hes5.1)或a5_4(gys8)处理后的高分子量hs的百分比达到胞外对照hs的值。
[0149]
表5.用eps衍生物处理的mpsiiia细胞中hs的mw分布百分比。从对照和经处理的细胞中分离hs,并通过page分析。报告低于阈值的%面积。对照是未处理的细胞(n=8),而经处理的是所用三种浓度的平均值(n=6)。
[0150][0151]
结论
[0152]
a5_3(hes5.1)和a5_4(gys8)均被证明能够影响hs周转,从而导致胞内hs的不完全降解。当用不同浓度的每种低分子量过硫酸化多糖处理细胞时,观察到类似的效果,表明不仅20μg/ml的eps衍生物是有效的,而且可能可以进一步降低浓度。根据最初的工作假设,未被hpse切割的完整hs链不能进入溶酶体降解途径,并被重新导向胞外空间,从而在血液和尿液中被清除。因此,可以保护细胞免于毒性溶酶体hs积聚。因此,a5_3(hes5.1)和a5_4(gys8)均具有治疗sanfilippo综合征患者的强大潜力。用这些eps衍生物治疗可以减轻由于硫酸乙酰肝素不完全降解的溶酶体过载引起的症状。
[0153]
贯穿本技术,各种参考文献描述了本发明所属领域的状态。这些参考文献的公开在此通过引用并入本公开。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1