用于治疗阿兹海默症的多抗原决定基疫苗的制作方法
用于治疗阿兹海默症的多抗原决定基疫苗
1.相关申请
2.本技术案主张2021年1月24日申请的美国临时专利申请案第63/140,917号、2020年8月7日申请的美国临时专利申请案第63/062,903号及2020年5月19日申请的美国临时专利申请案第63/027,150号的权益,其各自以全文引用的方式并入本文中。
3.序列表声明
4.可机读形式的序列表通过电子递交与本技术一同提交,该序列表的整体内容通过引用并入本技术。该序列表包含于在2021年5月19日创建的文档中,该文档名为“20-050-wo_sequence-listing_st25.txt”,其大小为183kb。
技术领域
5.本发明是关于免疫学及医学的技术领域,且尤其是关于阿兹海默症及蛋白质错误折迭的其他疾病的治疗。
背景技术:
6.阿兹海默症(ad)为引起老年痴呆的进行性疾病。广义而言,该疾病分为两种类别:迟发性疾病,其在老年期(65岁以上)发生;及早发性疾病,其在老年期的前,亦即在35岁与60岁之间已发展到一定程度。在两种类型的疾病中,病理是相同的,但在较早年龄开始的情况下会产生更严重及更广泛的异常。该疾病表征为脑部中的至少两种类型的病变,即神经原纤维缠结及老化斑块。神经原纤维缠结为由围绕彼此成对扭转的两个长丝组成的微管相关tau蛋白的细胞内沈积物。老化斑块(亦即,类淀粉蛋白斑块)为在中心处有细胞外类淀粉蛋白沈积物的直径达150μm的混乱神经纤维网区域,其由脑部组织切片的显微镜分析可见。中枢神经系统内类淀粉蛋白斑块的积聚亦与唐氏症候群(down's syndrome)及其他认知病症(类淀粉脑血管病变(caa))及眼部疾病(老年性黄斑部病变)相关。
7.斑块的主要成分为肽,其称为aβ或β类淀粉蛋白肽。aβ肽为称作类淀粉前驱蛋白(app)的较大跨膜糖蛋白的具有38至43个氨基酸的4kda的内部片段。由于不同分泌酵素酶对app进行蛋白水解加工,发现aβ主要呈短形式(长度为40个氨基酸)及长形式(长度范围为42至43个氨基酸)。app的疏水性跨膜域的一部分见于aβ的羧基端,且此可能解释aβ聚集成斑块的能力(尤其在长形式的情况下)。脑部中类淀粉蛋白斑块的积聚最终导致神经元细胞死亡。阿兹海默症表征为与此类型神经退化相关的认知及身体症状。
8.据报导在阿兹海默症患者中相对于一般群体以增加的水平出现的另一蛋白质为tau,即神经原纤维缠结的主要成分,其与类淀粉蛋白斑块一起为阿兹海默症的标志特征。tau缠结构成成对出现的直径量测为10nm的异常原纤维,其以80nm的常规周期性按螺旋方式卷绕。神经原纤维缠结内的tau经异常磷酸化(过磷酸化),其中磷酸酯基团连接至分子上的特异性位点。在阿兹海默症病中,神经原纤维缠结的严重侵犯可见于内嗅皮层的ii层神经元、海马体(杏仁核)的ca1及海马下脚体区,及新皮层的更深层(iii、v层及浅表vi)。已知tau病变与认知减退相关。
9.因此,需要预防或治疗阿兹海默症的新疗法及试剂,尤其是能够对患者中所存在的aβ及tau产生免疫反应的疗法及试剂。
10.发明概述
11.在一些实施例中,本发明是关于一种多肽,其包括包含来自seq id no:01的残基1至10的3至10个氨基酸的第一肽与包括来自seq id no:02的残基244至400的3至13个氨基酸的第二肽,该第一肽与第二肽连接。举例而言,第二肽可来自tau(seq id no:02的残基244至372)的微管结合区(mtbr)。第一肽可为第二肽的n端或第一肽可为第二肽的c端。另外,第一肽可包括seq id no:3至38或seq id no:1002至1057中的一者的氨基酸序列且第二肽可包括seq id no:39-56、83-86或146-996中的一者的氨基酸序列。举例而言,第一多肽可为daefrhd(seq id no:06)、daefr(seq id no:08)或efrhd(seq id no:21),且第二多肽可为5至13个氨基酸,例如qivykpv(seq id no:39)、eivyksv(seq id no:42)、eivyksp(seq id no:43)、eivykpv(seq id no:44)、nikhvp(seq id no:48)、vkskigst(seq id no:801)、skigsten(seq id no:817)、tenlkhqp(seq id no:695)、enlkhqpg(seq id no:689)、skigstdnikh(seq id no:985)、skigskdnikh(seq id no:986)或skigsldnikh(seq id no:988)。
12.在其他实施例中,第一肽及第二肽可由可裂解接头连接,该可裂解接头可为氨基酸序列。若存在,可裂解肽接头的长度可为1至10个氨基酸。在一些实施例中,接头包含约1至10个氨基酸、约1至9个氨基酸、约1至8个氨基酸、约1至7个氨基酸、约1至6个氨基酸、约1至5个氨基酸、约1至4个氨基酸、约1至3个氨基酸、约2个氨基酸或一个(1个)氨基酸。在一些实施例中,可裂解肽接头是1个氨基酸、2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个氨基酸、7个氨基酸、8个氨基酸、9个氨基酸或10个氨基酸。举例而言,接头可为精胺酸-精胺酸(arg-arg)、精胺酸-缬胺酸-精胺酸-精胺酸(arg-val-arg-arg(seq id no:69))、缬胺酸-瓜胺酸(val-cit)、缬胺酸-精胺酸(val-arg)、缬胺酸-赖氨酸(val-lys)、缬胺酸-丙胺酸(val-ala)、苯丙胺酸-赖氨酸(phe-lys)、甘胺酸-丙胺酸-甘胺酸-丙胺酸(gly-ala-gly-ala;seq id no:80)、ala-gly-ala-gly(seq id no:81)或lys-gly-lys-gly(seq id no:82)。在特定实施例中,多肽可为daefrhdrrqivykpv(seq id no:57)、daefrhdrreivyksv(seq id no:58)、daefrhdrrvkskigstggc(seq id no:997)、daefrhdrrskigstenggc(seq id no:998)、daefrhdrrtenlkhqpggc(seq id no:999)、daefrhdrrenlkhqpgggc(seq id no:1000)或daefrhdrrskigskdnikhggc(seq id no:1001)。
13.在其他实施例中,多肽可包括在多肽的c端部分处或多肽的n端部分连接载体的接头。若存在,接头的长度可为1至10个氨基酸。在一些实施例中,接头包含约1至10个氨基酸、约1至9个氨基酸、约1至8个氨基酸、约1至7个氨基酸、约1至6个氨基酸、约1至5个氨基酸、约1至4个氨基酸、约1至3个氨基酸、约2个氨基酸或一个(1个)氨基酸。在一些实施例中,接头为1个氨基酸、2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个氨基酸、7个氨基酸、8个氨基酸、9个氨基酸或10个氨基酸。举例而言,接头可包括gg、ggg、aa、aaa、kk、kkk、ss及sss的氨基酸序列。此外,若存在于c端处,则载体的接头可包括c端半胱胺酸(c)。或者,若存在于n端处,则载体的接头可包括n端半胱胺酸(c)。举例而言,多肽可包括daefrhdrrqivykpvxxc(seq id no:70)的氨基酸序列,其中xx及c独立地为视情况选用的,且若存在,xx可为gg、aa、kk、ss、gaga(seq id no:80)、agag(seq id no:81)或kgkg(seq id no:82)。举例而言,
多肽可包括daefrhdrreivyksvxxc(seq id no:79)的氨基酸序列,其中xx及c独立地为视情况选用的,且若存在,xx可为gg、aa、kk、ss、gaga(seq id no:80)、agag(seq id no:81)及kgkg(seq id no:82)。
14.在其他实施例中,本发明是关于一种包括本发明的多肽的免疫疗法组合物,其中该多肽可连接至载体。该载体可包括血清白蛋白、免疫球蛋白分子、甲状腺球蛋白、卵白蛋白、破伤风类毒素(tt)、白喉类毒素(dt)、白喉类毒素的遗传修饰的交叉反应物质(crm)、crm197、脑膜炎球菌(meningococcal)外膜蛋白复合物(ompc)及流感嗜血杆菌(h.influenzae)蛋白d(hid)、repa(绿脓杆菌(pseudomonas aeruginosa)外毒素a)、klh(匙孔螺血氰蛋白)及鞭毛蛋白(flagellin)。
15.再者,本发明的实施例是关于一种医药制剂,其包括本发明的多肽或免疫疗法组合物且包括至少一种佐剂。该佐剂可为氢氧化铝、磷酸铝、硫酸铝、3脱氧酰基化单磷酰基脂质a(mpl)、qs-21、qs-18、qs-17、qs-7、tql1055、完全弗氏佐剂(complete freund's adjuvant)(cfa)、不完全弗氏佐剂(ifa)、水包油乳液(诸如角鲨烯或花生油)、cpg、聚麸胺酸、聚赖氨酸、addavax
tm
、及其组合。另外,制剂可包括脂质体制剂、稀释剂或多抗原呈现系统(map)。该map可包括基于lys的树突状架构、辅助型t细胞抗原决定基、免疫刺激亲脂性部分、细胞穿透肽、自由基诱导的聚合、自组装纳米粒子(作为抗原呈现平台)及金纳米粒子中的一或多者。
16.再者,本发明的实施例是关于一种免疫疗法组合物,其包括包含来自seq id no:01的前十个n端残基的3至10个氨基酸残基的第一肽序列及包含来自seq id no:02的残基244至400的3至13个氨基酸的第二肽序列。第一肽可包括seq id no:3至38或seq id no:1002至1057中的一者的氨基酸序列,且第二肽可包括seq id no:39至56、seq id no:83至86或seq id no:146至996中的一者的氨基酸序列。第一肽及第二肽中的每一者可包括在多肽的c端部分处或在多肽的n端部分连接载体的接头。当存在时,接头可包括选自gg、ggg、aa、aaa、kk、kkk、ss、sss、gaga(seq id no:80)、agag(seq id no:81)及kgkg(seq id no:82)的氨基酸序列,且可包括c端半胱胺酸(c)。在一些实施例中,在免疫原中的c端残基为ivykpv(seq id no:194)、vykpv(seq id no:195)、ykpv(seq id no:196)、kpv或pv的情况下,接头为不具有n端甘胺酸(例如gg、gaga(seq id no:80))的氨基酸接头。该载体可包括血清白蛋白、免疫球蛋白分子、甲状腺球蛋白、卵白蛋白、破伤风类毒素(tt)、白喉类毒素(dt)、白喉类毒素的遗传修饰的交叉反应物质(crm)、crm197、脑膜炎球菌外膜蛋白复合物(ompc)及流感嗜血杆菌蛋白d(hid)、repa(绿脓杆菌外毒素a)、klh(匙孔螺血氰蛋白)及鞭毛蛋白。
17.另外,免疫疗法组合物可包括至少一种医药学上可接受的稀释剂及/或多抗原呈现系统(map)。该map可包括基于lys的树突状架构、辅助型t细胞抗原决定基、免疫刺激亲脂性部分、细胞穿透肽、自由基诱导的聚合、自组装纳米粒子(作为抗原呈现平台)及金纳米粒子中的一或多者。
18.免疫疗法组合物可包括于医药组合物中,该医药组合物包括免疫疗法组合物及至少一种佐剂,诸如氢氧化铝、磷酸铝、硫酸铝、3脱-o-酰化单磷酰基脂质a(mpl)、qs-21、qs-18、qs-17、qs-7、tql1055、完全弗氏佐剂(cfa)、不完全弗氏佐剂(ifa)、水包油乳液(诸如角鲨烯或花生油)、cpg、聚麸胺酸、聚赖氨酸、addavax
tm
、及其组合。
19.本发明的实施例亦关于编码本发明的多肽及免疫疗法组合物的核酸序列。该等核酸可包括于核酸免疫疗法组合物中,该核酸免疫疗法组合物包括核酸及至少一种佐剂。
20.在者,本发明的实施例是关于一种用于治疗或预防个体的阿兹海默症的方法,及用于在具有阿兹海默症或有罹患阿兹海默症风险的个体中抑制或减少aβ及tau中的至少一者的聚集的方法。该等方法包括向个体投与本发明的免疫疗法组合物、核酸免疫疗法组合物或医药制剂。
21.本发明的方法可包括重复投与至少两次、至少三次、至少四次、至少五次或至少六次,且可包括以约21至约28天之间隔重复投与。
22.再者,本发明的方法是关于在动物中诱发免疫反应。该等方法包括以可有效地产生免疫反应的方案向动物投与本发明的多肽、免疫疗法组合物、医药制剂或核酸免疫疗法组合物,该免疫反应包括特异性结合于aβ、tau或aβ及tau两者的抗体。免疫反应可包括特异性结合于aβ的n端区及/或tau的微管区的抗体。
23.在其他实施例中,本发明是关于一种免疫接种套组,其包括本发明的免疫疗法组合物且可包括佐剂,其中该免疫疗法组合物可在第一容器中且该佐剂可在第二容器中。
24.再者,本发明是关于一种套组,其包括本发明的核酸免疫疗法组合物且可包括佐剂。该核酸可在第一容器中且该佐剂可在第二容器中。
25.附图简单说明
26.图1展示比较天竺鼠血浆针对单体aβ氨基酸1-28(daefrhdsgyevhhqklffaedvgsnkg;seq id no:67)、可溶性aβ聚集物种(aβ42)、全长tau及含有含n端生物素的gggsvqivykpvdls(seq id no:68)的tau mtbr抗原决定基上的免疫原daefrhdrrqivykpv(seq id no:57)的几何平均效价的实验结果。
27.图2a展示比较天竺鼠血清针对在所有形式的aβ及全长tau蛋白(daefrhd为seq id no:6;qivykpv为seq id no:39;daefrhdrrqivykpv为seq id no:57)上的单肽免疫原比对本发明的双肽免疫原的效价的实验结果。
28.图2b展示比较天竺鼠血清针对在所有形式的aβ及全长tau蛋白(daefrhd为seq id no:6;qivykpv为seq id no:39;eivyksp为seq id no:43;daefrhdrrqivykpv为seq id no:57)上的单肽免疫原比对本发明的双肽免疫原的效价的实验结果。
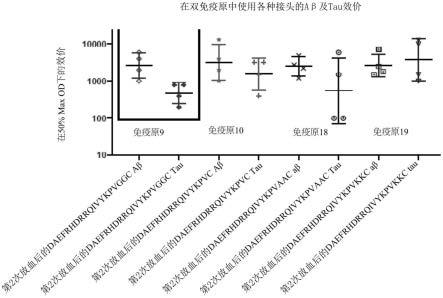
29.图3a展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原9(daefrhdrrqivykpvggc;seq id no:59)的天竺鼠的血清(1:300稀释度)对aβ及tau病变进行染色。
30.图3b展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原9(daefrhdrrqivykpvggc;seq id no:59)的天竺鼠的血清(1:300稀释度)对aβ及tau病变进行染色。
31.图3c展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原9(daefrhdrrqivykpvggc;seq id no:59)的天竺鼠的血清(1:1500稀释度)对aβ及tau病变进行染色。
32.图3d展示在新鲜冷冻的人类ad脑部组织中没有使用未接种疫苗的天竺鼠的血清(1:300稀释度)对aβ及tau病变进行染色。
33.图3e展示在新鲜冷冻的人类ad脑部组织中没有使用未接种疫苗的天竺鼠的血清
(1:300稀释度)对aβ及tau病变进行染色。
34.图3f展示在新鲜冷冻的人类ad脑部组织中没有使用未接种疫苗的天竺鼠的血清(1:1500稀释度)对aβ及tau病变进行染色。
35.图4a展示来自接种双免疫原肽daefrhdrrqivykpvggc((seq id no:59);免疫原9)的动物的天竺鼠血浆会以剂量依赖性方式抑制aβ可溶性聚集物结合于初级神经元。
36.图4b展示在来自接种双免疫原肽daefrhdrrqivykpvggc((seq id no:59);免疫原9)的动物的天竺鼠血浆存在或不存在的情况下对初级神经元的ab染色的实例。
37.图5a展示接种具有各种接头的双肽抗原的小鼠产生类似的对aβ及tau的效价。
38.图5b展示接种具有tau序列eivyksp(seq id no:43)的双肽抗原的小鼠产生对aβ及tau的效价。
39.图6a展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原19的小鼠的血清(1:1000稀释度)对aβ及tau病变进行染色。
40.图6b展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原19的小鼠的血清(1:1000稀释度)对aβ及tau病变进行染色。
41.图6c展示在新鲜冷冻的人类ad脑部组织中没有使用未接种疫苗的小鼠的血清(1:1000稀释度)对aβ及tau病变进行染色。
42.图6d展示在新鲜冷冻的ad脑部组织中使用抗tau抗体m6h3(0.1μg/ml)对tau病变进行染色。
43.图6e展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原9(daefrhdrrqivykpvggc;seq id no:59)的天竺鼠的血清(1:1500稀释度)的可比较tau病变染色。
44.图7a及图7b展示两种注射范例中双aβ-tau免疫原的效价。经过实验,对两种注射时程((图7a)表示0、4、12及24周;(图7b)表示0、8及24周)的aβ1-28、全长tau及载体crm蛋白的效价经表示为平均效价+/-sem。
45.图8a展示针对图7a的注射时程(亦即,在第2周、第6周、第14周及第26周)在每次注射的后两周时个别动物对aβ及tau的效价。
46.图8b展示针对图7b的注射时程(亦即,在第2周、第14周及第26周)在每次注射的后两周时个别动物对aβ及tau的效价。
47.图9a展示在新鲜冷冻的人类ad脑部组织中,按照四针疫苗接种时程使用接种免疫原15(daefrhdrrqivykpvggc;seq id no:59)的食蟹猕猴#1001的第26周血浆(1:300稀释度)进行aβ及tau病变染色。
48.图9b展示矩形放大视图,其指示图9a中的aβ病变染色。
49.图9c展示矩形放大视图,其指示图9a中的tau病变染色。
50.图10a展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原15(daefrhdrrqivykpvggc;seq id no:59)的食蟹猕猴#1003的血清(1:300稀释度)的aβ病变染色。
51.图10b展示在新鲜冷冻的人类ad脑部组织中使用食蟹猕猴#1003的血清(1:300稀释度)进行适度tau病变染色。
52.图11a展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原15
(daefrhdrrqivykpvggc;seq id no:59)的食蟹猕猴#1501的血清(1:300稀释度)进行aβ病变染色。
53.图11b展示在新鲜冷冻的人类ad脑部组织中使用食蟹猕猴#1501的血清(1:300稀释度)进行最少tau病变染色。
54.图12a展示在新鲜冷冻的人类ad脑部组织中使用接种免疫原15(daefrhdrrqivykpvggc;seq id no:59)的食蟹猕猴#2501的血清(1:300稀释度)的aβ病变染色。
55.图12b展示在新鲜冷冻的人类ad脑部组织中没有使用食蟹猕猴#2501的血清(1:300稀释度)进行tau病变染色。
56.图13展示在第0天、第4周及第8周注射后9周针对双aβ-tau构筑体daefrhdrrvkskigstggc(seq id no:997)、daefrhdrrskigstenggc(seq id no:998)、daefrhdrrtenlkhqpggc(seq id no:999)、daefrhdrrenlkhqpgggc(seq id no:1000)及daefrhdrrskigskdnikhggc(seq id no:1001)的动物对aβ及tau的效价。
57.图14展示根据血清自aβ-tau构筑体daefrhdrrvkskigstggc(seq id no:997)、daefrhdrrskigstenggc(seq id no:998)、daefrhdrrtenlkhqpggc(seq id no:999)、daefrhdrrenlkhqpgggc(seq id no:1000)及daefrhdrrskigskdnikhggc(seq id no:1001)阻断tau结合于肝素。
58.图15a展示根据血清自daefrhdrrvkskigstggc构筑体(seq id no:997)竞争tau。
59.图15b展示根据血清自daefrhdrrskigstenggc构筑体(seq id no:998)竞争tau。
60.图15c展示根据血清自daefrhdrrtenlkhqpggc构筑体(seq id no:999)竞争tau。
61.图15d展示根据血清自daefrhdrrenlkhqpgggc构筑体(seq id no:1000)竞争tau。
62.图15e展示根据血清自daefrhdrrskigskdnikhggc构筑体(seq id no:1001)竞争tau。
63.图15f展示根据血清自对照竞争tau。
64.图15g展示根据血清自daefrhdrrskigskdnikhggc构筑体(seq id no:1001)竞争tau。
65.图16a展示aβ/tau双疫苗小鼠血清2.3_031521(1:300),即用daefrhdrrvkskigstggc(seq id no:997)染色的实例。
66.图16b展示aβ/tau双疫苗小鼠血清3.1_031521(1:300),即用daefrhdrrskigstenggc(seq id no:998)染色的实例。
67.图16c展示aβ/tau双疫苗小鼠血清8.4_031521(1:300),即用daefrhdrrtenlkhqpggc(seq id no:999)染色的实例。
68.图16d展示aβ/tau双疫苗小鼠血清9.2_031521(1:300),即用daefrhdrrenlkhqpgggc(seq id no:1000)染色的实例。
69.图16e展示aβ/tau双疫苗小鼠血清11.1_031521(1:300),即用daefrhdrrskigskdnikhggc(seq id no:1001)染色的实例。
70.发明详述
71.本发明提供包含β类淀粉蛋白(aβ)肽及tau肽的肽组合物及免疫疗法组合物。本发明亦提供治疗或预防个体的阿兹海默症或其他具有β类淀粉蛋白沈积的疾病的方法,包括
以下方法:在具有阿兹海默症或其他含有tau及/或β类淀粉蛋白积聚的疾病或有罹患该等疾病的风险的个体中清除沈积物及预防沈积物形成、抑制或减少aβ及/或tau的聚集、阻断由神经元进行的aβ及/或tau的结合及/或吸收、抑制细胞间的tau物种传输及抑制脑部区域之间的病变传播。该等方法包括向此类患者投与包含β类淀粉蛋白(aβ)肽及tau肽的组合物。
72.多个术语定义于下文中。除非上下文另外明确规定,否则如本文所使用的单数形式「一(a/an)」及「该(the)」包括复数个参照物。举例而言,术语「一种化合物」或「至少一种化合物」可包括复数种化合物,包含其混合物。
73.除非另外自上下文显而易见,否则术语「约」涵盖非实质变量,诸如所陈述的值的标准量测误差边际(例如sem)内的值。举例而言,如本文中所使用的术语「约」在指代诸如参数、量、持续时间的可量测值时,可涵盖+/-10%或更少、+/-5%或更少、或+/-1%或更少或来自给定值的变化。对值的范围的指定包括该范围内或界定该范围的所有整数,及由该范围内的整数界定的所有子范围。如本文所用,统计显著性意谓p≤0.05。
74.「包含(comprising)」或「包括(including)」一或多个所叙述要素的组合物或方法可包括未具体叙述的其他要素。举例而言,「包含(comprises)」或「包括(includes)」多肽序列的组合物可含有单独或与其他序列或成分组合的序列。
75.若个体具有至少一种已知风险因子(例如,年龄、遗传、生化、家族史及情境暴露),则该个体患上疾病的风险增加,从而使具有该风险因子的个体罹患疾病的风险在统计学上显著大于不具有该风险因子的个体。
76.术语「患者」包括接受预防性或治疗性处理的人类及其他哺乳动物个体,包括未经治疗的个体。如本文所用,术语「个体」或「患者」是指需要治疗的任何单一个体,包括其他哺乳动物个体,诸如人类、牛、狗、天竺鼠、兔等等。亦意欲包括为个体的为不显示任何疾病临床征象的参与临床研究试验的个体,或参与流行病研究的个体,或用作对照的个体。
77.术语「疾病」是指削弱生理功能的任何异常病状。该术语广泛地用于涵盖任何病症、疾病、异常、病变、恶心、病状或其中生理功能削弱的症候群,与病因的性质无关。
78.术语「症状」是指如个体所感知到的疾病(诸如步态改变)的主观迹象。「征象」是指如医师所观测到的疾病的客观证据。
79.如本文所用,术语「治疗(treat/treatment)」是指缓解或改良与疾病相关的一或多种症状或效果,预防、抑制或延迟疾病的一或多种症状或效果的发作,降低疾病的一或多种症状或效果的严重性或频率及/或增强或趋向如本文所描述的所需结果。
80.如本文所用,术语「预防(prevention/prevent/preventing)」是指在疾病发作的前,在已存在或不存在aβ及/或tau病变的情况下(初级及次级预防),使个体接触本发明的肽或免疫疗法组合物(例如向其投与),从而与个体未接触该肽或免疫疗法组合物的情况相比延迟临床症状的发作及/或在疾病发作的后缓解疾病的症状,且该术语并非是指完全抑止疾病的发作。在一些情况下,在投与本发明的肽或免疫疗法组合物的后的有限时间内可进行预防。在其他情况下,可在包含投与本发明的肽或免疫疗法组合物的治疗方案的持续时间内进行预防。
81.如本文所用,术语「降低(reduction/reduce/reducing)」是指减少个体或个体组织中存在的aβ及/或tau的量,或抑止个体或个体组织中存在的aβ及/或tau的量的增加,其
涵盖减少个体或个体组织中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加(例如,减小增加速率)。在某些实施例中,减少在个体中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加(例如减小增加速率)是指减少在个体的中枢神经系统(cns)中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加。在某些实施例中,减少在个体中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加(例如减小增加速率)是指减少在个体的周边(例如周边循环系统)中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加。在某些实施例中,减少在个体中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加(例如减小增加速率)是指减少在个体的脑部中存在、积聚、聚集或沈积的aβ及/或tau的量或抑止该量增加。在一些实施例中,减少的aβ及/或tau为病理性形式的aβ(例如β类淀粉蛋白肽(aβ)的细胞外斑块沈积物、神经炎类淀粉蛋白斑块)及/或tau(例如tau的神经原纤维缠结,营养不良性神经炎)。在又其他实施例中,神经退化性疾病的病理性指标减少。
82.术语「抗原决定基」或「抗原决定子」是指在抗原上b细胞及/或t细胞对其作出反应的位点,或是指抗体所结合的抗原上的位点。抗原决定基可由相邻氨基酸或非相邻氨基酸形成,该等氨基酸因蛋白质的三级折迭而毗邻。由邻接氨基酸形成的抗原决定基通常在暴露于变性溶剂后保留,而由三级折迭形成的抗原决定基通常在用变性溶剂处理后消失。抗原决定基通常以独特的空间构形包括至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个或至少13个氨基酸。测定抗原决定基的空间构形的方法包括例如x射线晶体学及2维核磁共振。参见例如epitope mapping protocols in methods in molecular biology,第66卷,glenn e.morris编(1996)。
83.「免疫原性剂」或「免疫原」或「抗原」能够在视情况与佐剂一起向动物投与后诱导针对本身的或针对本身的经修饰/经加工型式的免疫反应。术语「免疫原性剂」或「免疫原」或「抗原」是指包含肽、多肽或蛋白质的化合物或组合物,当以适当量(「免疫原性有效量」)投与时,该肽、多肽或蛋白质具有「抗原性」或「免疫原性」,亦即能够诱导、引出、增强或促进细胞及/或体液免疫反应且能够被该反应的产物(t细胞、抗体)识别。免疫原可为肽或两种或更多种相同或不同肽的组合,其包括至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个或至少13个呈线性或空间构形的氨基酸。
84.免疫原当单独或以组合形式给出、或与另一物质连接或融合(其可一次性或经若干时间间隔投与)时可为有效的。免疫原性剂或免疫原可包括与如本文所描述的载体连接的抗原肽或多肽。
85.编码抗原肽或多肽的核酸(诸如dna或rna)称为「dna[或rna]免疫原」,因为所编码的肽或多肽在投与该dna或rna的后在活体内表现。该肽或多肽可由疫苗载体以重组方式表现,该疫苗载体可为裸dna或rna,其包含可操作地连接于启动子(例如,如本文所描述的表现载体或卡匣)的肽或多肽编码序列。
[0086]
术语「佐剂」是指当与抗原一起投与时加强对抗原的免疫反应,但当单独投与时不产生对抗原的免疫反应的化合物。佐剂可由若干机制,包括例如淋巴球募集、b细胞及/或t细胞的刺激及巨噬细胞的刺激来加强免疫反应。佐剂可为天然化合物、天然化合物的经修饰型式或衍生物、或合成化合物。
[0087]
术语「肽」及「多肽」在本文中可互换使用且是指两个或更多个连续氨基酸的链。若区分且当进行区分时,则上下文应使意义清楚。举例而言,若使本文所描述的两种或更多种
肽接合以制备二聚肽或多聚肽,则可使用多肽指示「多(poly)」或「超过一种」肽。
[0088]
术语「医药学上可接受」意谓载剂、稀释剂、赋形剂、佐剂或助剂与医药制剂的其他成分兼容且对其受体实质上无害。
[0089]
术语「免疫疗法」或「免疫反应」是指产生针对受体中的aβ及/或tau肽的有益的体液(抗体介导)反应及/或细胞(由抗原特异性t细胞或其分泌产物介导)反应。此类反应可为由投与免疫原(例如aβ及/或tau肽)诱导的主动反应。细胞免疫反应是由多肽抗原决定基与i类或ii类mhc分子结合的呈现以活化抗原特异性cd4
+
t辅助细胞及/或cd8
+
细胞毒性t细胞来引发。反应亦可涉及单核球、巨噬细胞、nk细胞、嗜碱性球、树突状细胞、星形胶质细胞、小神经胶质细胞、嗜酸性球或先天性免疫的其他组分的活化。细胞介导的免疫反应的存在可由增殖分析(cd4
+
t细胞)或ctl(细胞毒性t淋巴细胞)分析来测定。体液及细胞反应对免疫原的保护或治疗作用的相对贡献可由分别自经免疫的同基因型动物分离抗体及t细胞且量测第二个体中的保护或治疗作用来区分。
[0090]
β类淀粉蛋白(aβ)
[0091]
aβ(在本文中亦称为β类淀粉蛋白肽或aβ(abeta))肽为app的具有38至43个氨基酸的约4kda的内部片段(aβ39、aβ40、aβ41、aβ42及aβ43)。例如,aβ40由app的残基672至711组成且aβ42由app的残基673至713组成。作为在活体内或原位由不同分泌酵素酶对app进行蛋白水解加工的结果,aβ主要见于「短形式」(长度为40个氨基酸)及「长形式」(长度范围为42至43个氨基酸)。如本文所描述,抗原决定基或抗原决定子位于aβ肽的n端内,且包括在aβ的氨基酸1-10及12-25内的残基,例如来自aβ的残基1-3、1-4、1-5、1-6、1-7或3-7、2-4、2-5、2-6、2-7或2-8、aβ的残基3-5、3-6、3-7、3-8或3-9、或aβ的残基4-7、4-8、4-9或4-10、残基12-24、12-23、12-22、13-25、13-24、13-23、13-22、14-25、14-24、14-23、14-22、15-25、15-24、15-23或15-22。例如,来自aβ42的残基12-17、12-18、12-19、12-20、12-21、13-17、13-18、13-19、13-20、13-21、13-22、14-17、14-18、14-19、14-20、14-21、14-22、14-23、15-17、15-18、15-19、15-20、15-21、15-22、15-23或15-24。抗原决定基或抗原决定子的其他实例包括aβ42的残基16-18、16-19、16-20、16-21、16-22、16-23、16-24、16-25、17-19、17-20、17-21、17-22、17-23、17-24或17-25。抗原决定子或抗原决定子的其他实例包括aβ42的残基18-20、18-21、18-22、18-23、18-24、18-25、19-21、19-22、19-23、19-24、19-25、20-22、20-23、20-24、20-25、21-23、21-24或21-25。
[0092]
aβ(abeta)为阿兹海默症的特征斑块的主要组分。aβ由两种酶(称为β及γ分泌酶)对较大蛋白质app的加工而产生。与阿兹海默症相关的app中的已知突变在接近β分泌酶或γ分泌酶的位点或在aβ内发生。app的疏水性跨膜域的一部分见于aβ的羧基端,且此可能解释aβ聚集成斑块的能力(尤其在长形式的情况下)。脑部中类淀粉蛋白斑块的积聚最终导致神经元细胞死亡。阿兹海默症表征为与此类型神经退化相关的身体症状。
[0093]
tau
[0094]
tau为分子量为约50,000的蛋白质,其通常存在于神经轴突或其类似物中,且有助于微管稳定性。tau蛋白(或τ蛋白)为一组六个由基因mapt(微管相关蛋白tau)的替代性剪接产生的高度可溶性蛋白质同功异型物。其主要作用于维持微管在轴突中的稳定性且在中枢神经系统(cns)的神经元中为丰富的。其在别处较不常见,但亦在cns星形胶质细胞及寡树突神经胶质细胞中以极低水平表现。神经系统的病变及痴呆(诸如阿兹海默症及帕金森
氏病)与已变成过磷酸化的不溶性聚集物(称为神经原纤维缠结)的tau蛋白相关。病原性tau物种经由直接结合至细胞及/或在细胞内积聚及/或引发错误折迭过程(接种)而导致毒性作用,且可经由细胞至细胞传递自一个细胞传播至另一细胞。毒性亦可因神经原纤维缠结(nft)发生,其导致细胞死亡及认知减退。其他tau蛋白病包括例如进行性核上麻痹、皮质基底核症候群、部额颞叶型痴呆及慢性创伤性脑病。
[0095]
免疫原的aβ/tau多肽
[0096]
用于主动免疫接种的药剂可在患者中诱导免疫反应且可充当免疫疗法。用于主动免疫接种的药剂可为例如用于在实验动物中产生单株抗体的相同类型的免疫原,且可包括来自aβ及/或tau肽区的3、4、5、6、7、8、9、10、11、12或13个或更多个相邻氨基酸。
[0097]
在本发明的一些实施例中,aβ/tau免疫原可包括包含来自aβ(seq idno:01)的n端序列的残基1至10或12至25的3至10个氨基酸的aβ肽与包含来自长型tau(seq id no:02)的残基244至400的3至10个氨基酸的tau肽,该aβ肽与tau肽连接。举例而言,tau肽可包含来自tau的微管结合区的3至13个氨基酸(seq id no:02的残基344至372)。
[0098]
在本发明的一些实施例中,aβ肽可包括来自daefrhdsgyevhhqklvffaedvgsnkgaiiglmvggvvia(seq id no:01)的残基1至10或12至25的3至10个氨基酸。举例而言,aβ肽是选自以下:
[0099]
daefrhdsgy(seq id no:03)、
[0100]
daefrhdsg(seq id no:04)、
[0101]
daefrhds(seq id no:05)、
[0102]
daefrhd(seq id no:06)、
[0103]
daefrh(seq id no:07)、
[0104]
daefr(seq id no:08)、
[0105]
daef(seq id no:09)、
[0106]
dae(seq id no:10)、
[0107]
aefrhdsgy(seq id no:11)、
[0108]
aefrhdsg(seq id no:12)、
[0109]
aefrhds(seq id no:13)、
[0110]
aefrhd(seq id no:14)、
[0111]
aefrh(seq id no:15)、
[0112]
aefr(seq id no:16)、
[0113]
aef(seq id no:17)、
[0114]
efrhdsgy(seq id no:18)、
[0115]
efrhdsg(seq id no:19)、
[0116]
efrhds(seq id no:20)、
[0117]
efrhd(seq id no:21)、
[0118]
efrh(seq id no:22)、
[0119]
efr(seq id no:23)、
[0120]
frhdsgy(seq id no:24)、
[0121]
frhdsg(seq id no:25)、
[0122]
frhds(seq id no:26)、
[0123]
frhd(seq id no:27)、
[0124]
frh(seq id no:28)、
[0125]
rhdsgy(seq id no:29)、
[0126]
rhdsg(seq id no:30)、
[0127]
rhds(seq id no:31)、
[0128]
rhd(seq id no:32)、
[0129]
hdsgy(seq id no:33)、
[0130]
hdsg(seq id no:34)、
[0131]
hds(seq id no:35)、
[0132]
dsgy(seq id no:36)、
[0133]
dsg(seq id no:37)、
[0134]
sgy(seq id no:38)、
[0135]
vhhqklvffa(seq id no:1002)、
[0136]
vhhqklvff(seq id no:1003)、
[0137]
vhhqklvf(seq id no:1004)、
[0138]
vhhqklv(seq id no:1005)、
[0139]
vhhqkl(seq id no:1006)、
[0140]
hhqklvffae(seq id no:1007)、
[0141]
hhqklvffa(seq id no:1008)、
[0142]
hhqklvff(seq id no:1009)、
[0143]
hhqklvf(seq id no:1010)、
[0144]
hhqklv(seq id no:1011)、
[0145]
hhqkl(seq id no:1012)、
[0146]
hqklvffaed(seq id no:1013)、
[0147]
hqklvffae(seq id no:1014)、
[0148]
hqklvffa(seq id no:1015)、
[0149]
hqklvff(seq id no:1016)、
[0150]
hqklvf(seq id no:1017)、
[0151]
hqklv(seq id no:1018)、
[0152]
hqkl(seq id no:1019)、
[0153]
qklvffaedv(seq id no:1020)、
[0154]
qklvffaed(seq id no:1021)、
[0155]
qklvffae(seq id no:1022)、
[0156]
qklvffa(seq id no:1023)、
[0157]
qklvff(seq id no:1024)、
[0158]
qklvf(seq id no:1025)、
[0159]
qklv(seq id no:1026)、
[0160]
qkl(seq id no:1027)、
[0161]
klvffaedvg(seq id no:1028)、
[0162]
klvffaedv(seq id no:1029)、
[0163]
klvffaed(seq id no:1030)、
[0164]
klvffae(seq id no:1031)、
[0165]
klvffa(seq id no:1032)、
[0166]
klvff(seq id no:1033)、
[0167]
klvf(seq id no:1034)、
[0168]
klv(seq id no:1035)、
[0169]
lvffaedvg(seq id no:1036)、
[0170]
lvffaedv(seq id no:1037)、
[0171]
lvffaed(seq id no:1038)、
[0172]
lvffae(seq id no:1039)、
[0173]
lvffa(seq id no:1040)、
[0174]
lvff(seq id no:1041)、
[0175]
lvf(seq id no:1042)、
[0176]
vffaedvg(seq id no:1043)、
[0177]
vffaedv(seq id no:1044)、
[0178]
vffaed(seq id no:1045)、
[0179]
vffae(seq id no:1046)、
[0180]
vffa(seq id no:1047)、
[0181]
vff(seq id no:1048)、
[0182]
ffaedvg(seq id no:1049)、
[0183]
ffaedv(seq id no:1050)、
[0184]
ffaed(seq id no:1051)、
[0185]
ffae(seq id no:1052)、
[0186]
ffa(seq id no:1053)、
[0187]
faedvg(seq id no:1054)、
[0188]
faedv(seq id no:1055)、
[0189]
faed(seq id no:1056),及
[0190]
fae(seq id no:1057)。
[0191]
在某些实施例中,aβ肽为daefrhd(seq id no:06)、daefr(seq id no:08)或efrhd(seq id no:21)。
[0192]
tau肽可对应于包含来自seq id no:02的残基244至400的3至13个氨基酸的肽。在一些实施例中,片段未经磷酸化。在一些实施例中,片段经磷酸化。在一些实施例中,tau肽包含由共同模体(q/e)ivyk(s/p)(seq idno:996)表示的氨基酸序列。在一些实施例中,tau肽包含由共同模体kxxsxxnx(k/h)h(seq id no:995)表示的氨基酸序列,其中x为任何氨基酸。在一些实施例中,tau肽选自seq id no:146-996。在一些实施例中,该tau肽是选自以下:
[0193]
qivykpv(seq id no:39)、
[0194]
qivykp(seq id no:40)、
[0195]
qivyksv(seq id no:41)、
[0196]
eivyksv(seq id no:42)、
[0197]
qivyks(seq id no:83)、
[0198]
eivyksp(seq id no:43)、
[0199]
eivyks(seq id no:84)、
[0200]
eivykpv(seq id no:44)、
[0201]
eivykp(seq id no:85)、
[0202]
ivykspv(seq id no:45)、
[0203]
ivyk(seq id no:46)、
[0204]
cnikhvpg(seq id no:86)、
[0205]
cnikhvp(seq id no:47)、
[0206]
nikhvp(seq id no:48)、
[0207]
hvpggg(seq id no:49)、
[0208]
hvpgg(seq id no:50)、
[0209]
hkpggg(seq id no:51)、
[0210]
hkpgg(seq id no:52)、
[0211]
khvpggg seq id no:53)、
[0212]
khvpgg(seq id no:54)、
[0213]
hqpggg(seq id no:55)、
[0214]
hqpgg(seq id no:56)
[0215]
vkskigst(seq id no:801)、
[0216]
skigsten(seq id no:817)、
[0217]
tenlkhqp(seq id no:695)、
[0218]
enlkhqpg(seq id no:689)、
[0219]
skigstdnikh(seq id no:985)、
[0220]
skigskdnikh(seq id no:986),及
[0221]
skigsldnikh(seq id no:988)。
[0222]
在一些实施例中,aβ及tau肽连接形成双aβ/tau多肽。aβ肽及tau肽可由肽内接头连接。举例而言,多肽接头位于第一肽的c端与第二肽的n端之间。在具有或不具有肽内接头的情况下,aβ肽及tau肽可以任何次序定位于双aβ/tau多肽中。举例而言,aβ肽可定位于双多肽的n端部分处,且tau肽可定位于双多肽的c端部分处。或者,tau肽可定位于双多肽的n端部分处,且aβ肽可定位于tau肽的双多肽侧的c端部分处。本文中所提及的第一肽或第二肽并不意欲表明aβ肽或tau肽在免疫原的多肽中的次序。
[0223]
此外,aβ肽、tau肽或双aβ-tau多肽的c端部分可包括用于将肽或多肽结合至载体的接头。将肽或双多肽偶合至载体的接头可包括例如在肽或双多肽与载体之间的gg、ggg、kk、kkk、aa、aaa、ss、sss、gaga(seq id no:80)、agag(seq id no:81)、kgkg(seq id no:82)及其类似物,且可进一步包括c端或n端半胱胺酸以提供短肽接头(例如g-g-c-、k-k-c-、a-a-c-或s-s-c-)。在一些实施例中,在免疫原中的c端残基为ivykpv(seq id no:194)、vykpv
(seq id no:195)、ykpv(seq id no:196)、kpv或pv的情况下,接头为不具有n端甘胺酸(例如gg、gaga(seq id no:80))的氨基酸接头。在一些实施例中,该接头包含氨基酸序列,即aa、aaa、kk、kkk、ss、sss、agag(seq id no:81)、gg、ggg、gaga(seq id no:80)及kgkg(seq id no:82)中的任一者。在一些实施例中,aβ肽、tau肽及双aβ/tau多肽中的任一者可包括不含间隔子的c端半胱胺酸。在一些实施例中,aβ肽、tau肽及双aβ/tau多肽中的任一者可包括不含间隔子的n端半胱胺酸。
[0224]
当aβ肽与tau多肽连接形成双aβ/tau多肽时,接头可为可裂解接头。如本文所用,术语「可裂解接头」是指在抗原肽之间的任何接头,其促进或以其他方式使得aβ肽及tau肽比不具有此类可裂解接头的等效肽更易于由裂解(例如,由肽链内切酶、蛋白酶、低ph或可在抗原呈现细胞内或周围进行的任何其他方式)来彼此分离且由此更易于由抗原呈现细胞加工。在一些组合物中,可裂解接头为蛋白酶敏感性二肽或寡肽可裂解接头。在某些实施例中,可裂解接头对由蛋白酶的胰蛋白酶家族的蛋白酶裂解敏感。在一些组合物中,可裂解接头包含选自由以下组成的群的氨基酸序列:精胺酸-精胺酸(arg-arg)、精胺酸-缬胺酸-精胺酸-精胺酸(arg-val-arg-arg;seq id no:69)、缬胺酸-瓜胺酸(val-cit)、缬胺酸-精胺酸(val-arg)、缬胺酸-赖氨酸(val-lys)、缬胺酸-丙胺酸(val-ala)、苯丙胺酸-赖氨酸(phe-lys)、gaga(seq id no:80)、agag(seq id no:81)及kgkg(seq id no:82)。在一些组合物中,可裂解接头为精胺酸-精胺酸(arg-arg)。
[0225]
在本发明的一些实施例中,双aβ/tau多肽包含选自以下的氨基酸序列:daefrhdrrqivykpv(seq id no:57)或daefrhdrreivyksv(seq id no:58)或daefrhdrrqivykpvxxc(seq id no:70),其中xx及c端半胱胺酸各自独立地为视情况选用的或为daefrhdrreivyksvxxc(seq id no:79),其中xx及c独立地为视情况选用的,且若存在,xx可为gg、aa、kk、ss、gaga(seq id no:80)、agag(seq id no:81)及kgkg(seq id no:82)。
[0226]
在一些实施例中,双aβ/tau多肽如下:
[0227]
[第一肽]-[接头1]-[第二肽]-[接头2]-[cys],
[0228]
其中,若[第一肽]为aβ肽,则[第二肽]为tau肽,且若[第一肽]为tau肽,则[第二肽]为aβ肽,[接头1]、[接头2]及[cys]中的每一者为视情况选用的,且[接头1]及[接头2]为相同或不同接头。
[0229]
在某些实施例中,双aβ/tau多肽如下:
[0230]
[cys]-[接头2]-[第一肽]-[接头1]-[第二肽]
[0231]
其中,若[第一肽]为aβ肽,则[第二肽]为tau肽,且若[第一肽]为tau肽,则[第二肽]为aβ肽,且[接头1]、[接头2]及[cys]中的每一者为视情况选用的,且[接头1]及[接头2]为相同或不同接头。
[0232]
aβ肽的实例包括seq id no 3-38或seq id no:1002-1057中的任一者。
[0233]
tau肽的实例包括seq id no:39-56、83-86或146-996中的任一者。
[0234]
[接头1]为视情况选用的,且当存在时,可为可裂解接头。若存在,可裂解接头的长度可为1至10个氨基酸。在一些实施例中,接头包含约1至10个氨基酸、约1至9个氨基酸、约1至8个氨基酸、约1至7个氨基酸、约1至6个氨基酸、约1至5个氨基酸、约1至4个氨基酸、约1至3个氨基酸、约2个氨基酸或一个(1个)氨基酸。在一些实施例中,可裂解接头为1个氨基酸、2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个氨基酸、7个氨基酸、8个氨基酸、9个氨基
酸或10个氨基酸。在一些实施例中,接头可为具有选自由以下组成的群的氨基酸序列的可裂解接头:精胺酸-精胺酸(arg-arg)、精胺酸-缬胺酸-精胺酸-精胺酸(arg-val-arg-arg;seq id no:69)、缬胺酸-瓜胺酸(val-cit)、缬胺酸-精胺酸(val-arg)、缬胺酸-赖氨酸(val-lys)、缬胺酸-丙胺酸(val-ala)、苯丙胺酸-赖氨酸(phe-lys)、甘胺酸-丙胺酸-甘胺酸-丙胺酸(gly-ala-gly-ala;seq id no:80)、丙胺酸-甘胺酸-丙胺酸-甘胺酸(gly-ala-gly-ala;seq id no:81)及赖氨酸-甘胺酸-赖氨酸-甘胺酸(lys-gly-lys-gly;seq id no:82)。
[0235]
[接头2]为视情况选用的,且当存在时是使多肽偶合至载体的接头。若存在,接头的长度可为1至10个氨基酸。在一些实施例中,接头包含约1至10个氨基酸、约1至9个氨基酸、约1至8个氨基酸、约1至7个氨基酸、约1至6个氨基酸、约1至5个氨基酸、约1至4个氨基酸、约1至3个氨基酸、约2个氨基酸或一个(1个)氨基酸。在一些实施例中,接头为1个氨基酸、2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个氨基酸、7个氨基酸、8个氨基酸、9个氨基酸或10个氨基酸。在一些实施例中,接头的氨基酸组合物可仿真天然多域蛋白质中所见的接头的组合物,其中某些氨基酸与其在全蛋白质中的丰度相比在天然接头中过度表现、未充分表现或等价表现。举例而言,苏胺酸(thr)、丝胺酸(ser)、脯胺酸(pro)、甘胺酸(gly)、天冬胺酸(asp)、赖氨酸(lys)、麸酰胺酸(gln)、天冬酰胺酸(asn)、精胺酸(arg)、苯丙胺酸(phe)、麸胺酸(glu)及丙胺酸(ala)在天然接头中过度表现。相比的下,异白胺酸(ile)、酪胺酸(tyr)、色胺酸(trp)及半胱胺酸(cys)未充分表现。一般而言,过度表现的氨基酸为极性不带电或带电残基,其构成约50%的天然编码的氨基酸,且pro、thr及gln是用于天然接头的最佳氨基酸。在一些实施例中,接头的氨基酸组合物可仿真常见于重组蛋白质中的接头的组合物,其通常可归类为柔性或刚性接头。举例而言,重组蛋白质中所见的柔性接头通常由小氨基酸、非极性氨基酸(例如gly)或极性氨基酸(例如ser或thr)构成,其尺寸较小以提供柔性且允许连接功能域的移动。并入例如ser或thr可由与水分子形成氢键来维持接头在水溶液中的稳定性,且因此可减少接头与免疫原之间的相互作用。在一些实施例中,接头包含gly及ser残基的延伸(「gs」接头)。广泛使用的柔性接头的实例为(gly-gly-ser)n、(gly-gly-gly-ser)n或(gly-gly-gly-gly-ser)n,其中n=1至3。调整拷贝数「n」可使接头优化以实现功能性免疫原域的充分分离,以便例如使免疫原性反应最大化。许多其他柔性接头已经设计用于可在本文中使用的重组融合蛋白。在一些实施例中,接头可富含诸如gly及ser的小型或极性氨基酸,而且亦含有诸如thr及ala的其他氨基酸以维持柔性,以及含有诸如lys及glu的极性氨基酸以改良溶解性。参见例如chen,x.等人,「fusion protein linkers:property,design and functionality」adv drug deliv rev.,15;65(10):1357-1369(203)。在某些实施例中,当存在时,接头可为选自由以下组成的群的氨基酸序列:gg、ggg、kk、kkk、aa、aaa、ss、sss、g-a-g-a(seq id no:80)、a-g-a-g(seq id no:81)及k-g-k-g(seq id no:82)。
[0236]
[cys]为视情况选用的且可有助于使多肽与载体结合。若存在,cys可在多肽的c端部分处,或在多肽的n端部分处。
[0237]
本发明的[第一肽]-[接头1]-[第二肽]-[接头2]-[cys]双aβ/tau多肽的实例包括以下:
[0238]
表1
[0239][0240]
多肽免疫原
[0241]
aβ肽、tau肽及双aβ/tau多肽为根据本发明的免疫原。在一些实施例中,肽及双aβ-tau多肽可与适合载体连接以帮助引发免疫反应。因此,一或多种本发明的肽及双β-tau多肽可与载体连接。举例而言,aβ肽、tau肽及aβ-tau多肽中的每一者可在存在或不存在间隔子氨基酸(例如gly-gly、gly-gly-gly、ala-ala、ala-ala-ala、lys-lys、lys-lys-lys、ser-ser、ser-ser-ser、gly-ala-gly-ala(seq id no:80)、ala-gly-ala-gly(seq id no:81)或lys-gly-lys-gly(seq id no:82))的情况下与载体连接。在某些实施例中,双aβ-tau多肽可使用c端半胱胺酸连接至适合的载体以在肽与载体之间或双aβ/tau多肽与载体之间提供接头。在某些实施例中,双aβ-tau多肽可使用n端半胱胺酸与适合的载体连接以在肽与载体之间提供接头。在一些实施例中,在免疫原中的c端残基为ivykpv(seq id no:194)、vykpv(seq id no:195)、ykpv(seq id no:196)、kpv或pv的情况下,接头为不具有n端甘胺酸(例如gg、gaga(seq id no:80))的氨基酸接头。
[0242]
适合的载体包括(但不限于)血清白蛋白、匙孔螺血氰蛋白、免疫球蛋白分子、甲状腺球蛋白、卵白蛋白、破伤风类毒素或来自其他病原菌(诸如白喉(例如crm197)、大肠杆菌(e.coli)、霍乱菌(cholera)或幽门螺旋杆菌(h.pylori))的类毒素,或减毒毒素衍生物。t细胞抗原决定基亦为适合的载体分子。一些结合物可由使本发明的肽免疫原连接至免疫刺激聚合物分子(例如三棕榈酰基-s-甘油半胱胺酸(pam3cys)、甘露聚糖(甘露糖聚合物)或葡聚糖(β1-2聚合物))、细胞介素(例如il-1、il-1α肽及β肽、il-2、γ-inf、il-10、gm-csf)及趋化介素(例如mip1-α、mip1-β及rantes)来形成。另外的载体包括病毒样颗粒。在一些组合物中,免疫原性肽亦可由化学交联连接至载体。用于将免疫原连接至载体的技术包括使用n-丁二酰亚胺基-3-(2-吡啶基-硫代-o)丙酸酯(spdp)及4-(n-顺丁烯二酰亚胺基甲基)
环己烷-1-甲酸丁二酰亚胺酯(smcc)形成二硫键(若肽不具有巯基,则此可由添加半胱胺酸残基来提供)。此等试剂在其本身与存在于一种蛋白质上的肽半胱胺酸之间产生二硫键,且经由赖氨酸上的ε-胺基或其他氨基酸中的其他游离胺基产生酰胺键。在一些实施例中,化学交联可包含使用sbap(3-(溴乙酰胺基)丙酸丁二酰亚胺酯),其为经由n-羟基丁二酰亚胺(nhs)酯及溴乙酰基反应性基团用于胺-硫氢基结合的短(6.2埃(angstrom))交联剂。各种此类二硫化物/酰胺形成剂描述于jansen等人,「immunotoxins:hybrid molecules combining high specificity and potent cytotoxicity」immunological reviews 62:185-216(1982年2月)。其他双官能偶合剂形成硫醚而非二硫键。许多此等硫醚形成剂是可商购的,且包括6-顺丁烯二酰亚胺基己酸、2-溴乙酸及2-碘乙酸、4-(n-顺丁烯二酰亚胺基-甲基)环己烷-1-甲酸的反应性酯。羧基可由将其与琥珀酰亚胺或1-羟基-2-硝基-4-磺酸钠盐组合来活化。病毒样颗粒(vlp),亦称为假病毒粒子或病毒衍生的颗粒,代表由能够在活体内自组装成具有限定球面对称性的vlp的病毒衣壳及/或包膜蛋白的多个复本构成的次单元结构。(powilleit等人,(2007)plos one 2(5):e415.)或者,肽免疫原可连接至至少一个能够结合mhc ii类分子的大部分的人工t细胞抗原决定基,诸如泛dr抗原决定基(「padre」)。泛dr抗原决定基(padre)描述于us 5,736,142、wo 95/07707及alexander等人,immunity,1:751-761(1994)中。
[0243]
活性免疫原可以多聚形式呈现,其中免疫原(多肽的肽)的多个复本以单一共价分子形式呈现在载体上。在一些实施例中,载体包括各种形式的双aβ/tau多肽。举例而言,免疫原的双aβ/tau多肽可包括具有呈不同次序的aβ抗原及tau抗原的多肽,或可在存在或不存在肽内接头及/或至载体的接头的情况下呈现。
[0244]
在一些组合物中,免疫原性肽亦可表现为具有载体的融合蛋白。在某些组合物中,免疫原性肽可在胺基端、羧基端或内部连接至载体。在一些组合物中,载体为crm197。在一些组合物中,载体为白喉类毒素。
[0245]
核酸
[0246]
本发明进一步提供编码如本文中所揭示的β类淀粉蛋白(aβ)肽及tau肽中的任一者的核酸。如本文所揭示的核酸免疫疗法组合物包含编码β类淀粉蛋白(aβ)肽的第一核酸序列及编码如本文中所揭示的tau肽的第二核酸序列。举例而言,aβ肽为长度为3至10个氨基酸残基且来自seq id no:01的前十个n端残基的序列,且tau肽为长度为3至13个氨基酸且来自seq id no:02的残基244至400的序列。因此,编码seq id no:3-38或seq id no:1002-1057中的任一者的核酸可与编码seq id no:39-56、83-86或146-996中的任一者的核酸组合以提供本发明的医药组合物的免疫原及组分。同样,一或多种编码aβ及tau序列中的任一者的核酸可包括用于rr-n端或-rr c端二肽的密码子。在某些实施例中,aβ及tau肽序列可由同一核酸序列编码或由不同的核酸序列编码。在一些实施例中,核酸序列亦可编码如本文所描述的至载体的接头及/或c端半胱胺酸。另外,当单一核酸序列编码两种肽时,该序列亦可编码如本文所描述的肽内接头。本文所描述的核酸组合物(医药组合物)可用于治疗阿兹海默症或对其进行防治及/或预防的方法中。在另一实施例中,如本文所揭示的核酸免疫疗法组合物提供用于减少个体及/或个体组织中病原性形式的aβ及/或tau的组合物。在一些实施例中,由免疫疗法组合物减少的aβ及/或tau为的病理性形式的aβ(例如β类淀粉蛋白肽(aβ)的细胞外斑块沈积物;神经炎类淀粉蛋白斑块)及/或tau(例如tau的火焰状神
molecular biology,第2卷,wiley-interscience,new york,(现行版);kriegler,gene transfer and expression:a laboratory manual(1990);glover,dm编,dna cloning:apractical approach,第i及ii卷,irl press,1985;albers,b.等人,molecular biology of the cell,第2版,garland publishing,inc.,new york,n.y.(1989);watson,j d等人,recombinant dna,第2版,scientific american books,new york,1992;及old,r w等人,principles of gene manipulation:an introduction to genetic engineering,第2版,university of california press,berkeley,calif.(1981)。
[0250]
用于操纵核酸的技术(诸如产生序列突变、次选殖、标记探针、定序、杂交及其类似者)充分描述于科学及专利文献中。.参见例如sambrook编,molecular cloning:alaboratory manual(2nd ed.),第1-3卷,cold spring harbor laboratory,(1989);current protocols in molecular biology,ausubel,编john wiley&sons,inc.,new york(1997);laboratory techniques in biochemistry and molecular biology:hybridization with nucleic acid probes,part i.tijssen编elsevier,n.y.(1993)。
[0251]
核酸、载体、衣壳、多肽及其类似物可由熟习此项技术者所熟知的多种通用方式中的任一者分析及定量。此等方式包括例如生化分析方法,诸如nmr、分光亮度法、放射照像术、电泳法、毛细管电泳法、高效液相层析法(hplc)、薄层层析法(tlc)及过度扩散层析法;各种免疫方法,例如液体或凝胶沈淀反应、免疫扩散法、免疫电泳法、放射免疫分析法(ria)、酶联免疫吸附分析法(elisa)、免疫荧光分析法、南方分析法、北方分析法、点状墨点分析法、凝胶电泳法(例如sds-page)、rt-pcr、定量pcr;其他核酸或目标或信号放大方法,放射性标记、闪烁计数及亲和层析法。
[0252]
医药组合物
[0253]
免疫原通常与医药学上可接受的佐剂及医药学上可接受的赋形剂一起投与。佐剂使所诱导抗体的效价及/或所诱导抗体的结合亲和力相对于单独使用肽的情况增加。多种佐剂可与本发明的免疫原组合使用以引发免疫反应。一些佐剂加强对免疫原的内在反应,不会引起影响反应的定性形式的免疫原构形改变。佐剂可为天然化合物、天然化合物的经修饰型式或衍生物、或合成化合物。
[0254]
一些佐剂包括铝盐,诸如氢氧化铝及磷酸铝、3脱-o-酰化单磷酰基脂质a(mpl
tm
)(参见gb 2220211(ribi immunochem research inc.,hamilton,montana,现corixa的一部分)。如本文所用,mpl是指mpl的天然及合成型式。合成型式的实例包括及(avanti polar lipids,alabaster,alabama)。
[0255]
qs-21为自南美洲发现的皂皮树(quillaja saponaria)(莫利纳树(molina tree))的树皮分离的三萜醣苷或皂素(参见kensil等人,in vaccine design:the subunit and adjuvant approach(eds.powell&newman,plenum press,ny,1995))。qs-21产品包括(antigenics,inc.,new york,ny;现为agenus,inc.lexington,ma)及qs-21疫苗佐剂(desert king,san diego,ca)。qs-21已于us 5,057,540及us 8,034,348中揭示、表征及评估,其揭示内容以引用的方式并入本文中。另外,qs-21已在多种临床试验中以多种剂量进行评估。参见nct00960531(clinicaltrials.gov/ct2/show/study/nct00960531),h
ü
ll等人,curr alzheimer res.2017年7月;14(7):696-708(评估50微克的qs-21与不同剂
量的疫苗acc-001);gilman s等人,「clinical effects of abeta immunization(an1792)in patients with ad in an interrupted trial」neurology.2005年5月10日;64(9):1553-62;wald a等人,「safety and immunogenicity of long hsv-2peptides complexed with rhhsc70 in hsv-2seropositive persons」vaccine 2011;29(47):8520-8529;及cunningham等人,「efficacy of the herpes zoster subunit vaccine in adults 70years of age or older.」nejm.2016年9月15日;375(11):1019-32。qs-21用于fda批准的疫苗,包括shingrix。shingrix含有50微克的qs-21。在某些实施例中,qs-21的量为约10μg至约500μg。
[0256]
tql1055为qs-21的类似物(adjuvance technologies,lincoln,ne)。半合成tql1055与qs-21相比,已表征为具有高纯度、提高的稳定性、减小的局部耐受性、减小的全身耐受性。tql1055已于us20180327436 a1、wo2018191598a1、wo2018200656a1及wo2019079160a1中揭示、表征及评估,其揭示内容以引用的方式并入本文中。us20180327436 a1教示,2.5倍以上的tq1055优于20μg的qs-21,但与50μg的tq1055相比不存在改良。然而,不同于qs-21,随着tql1055剂量增加,rbc的重量损失或溶血不增加。wo2018200656 a1教示,在最佳量的tq1055下,可降低抗原量且获得优异效价。在某些实施例中,tql1055的量为约10μg至约500μg。
[0257]
其他佐剂为水包油乳液(诸如角鲨烯或花生油),其视情况与免疫刺激剂组合,诸如单磷酰基脂质a(参见stoute等人,n.engl.j.med.336,86-91(1997))、普洛尼克聚合物(pluronic polymer)及杀灭分枝杆菌(killed mycobacteria)。ribi佐剂为水包油乳液。ribi含有用含有tween 80的生理盐水乳化的可代谢油(角鲨烯)。ribi亦含有改进的分支杆菌产物,其充当免疫刺激剂及细菌性单磷酰基脂质a。其他佐剂可为cpg寡核苷酸(参见wo 98/40100)、细胞介素(例如il-1、il-1α肽及β肽、il-2、γ-inf、il-10、gm-csf)、趋化介素(例如mip1-α及mip1-β及rantes)、皂素、rna及/或tlr促效剂(例如tlr4促效剂,诸如mpl及合成mpl分子)、胺基烷基葡萄胺糖苷磷酸盐及其他tlr促效剂。佐剂可作为与活性剂的治疗组合物的组分投与或可在投与治疗剂的前、并行或的后分开投与。
[0258]
在本发明的多种实施例中,佐剂为qs-21(stimulon
tm
)。在一些组合物中,佐剂为mpl。在某些实施例中,mpl的量为约10μg至约500μg。在一些组合物中,佐剂为tql1055。在某些实施例中,tql1055的量为约10μg至约500μg。在一些组合物中,佐剂为qs21。在某些实施例中,qs21l的量为约10μg至约500μg。在一些组合物中,佐剂为mpl与qs-21的组合。在一些组合物中,佐剂为mpl与tql1055的组合。在一些组合物中,佐剂可在脂质体制剂中。
[0259]
另外,本发明的一些实施例可包含多抗原呈现系统(map)。已研发出多抗原呈现肽疫苗系统,以避免与习知疫苗(亦即,减毒活、杀灭或不活化病原体)、载体蛋白及细胞毒性佐剂相关的不良作用。有两种主要方法已用于开发多抗原呈现肽疫苗系统:(1)添加功能组分,例如t细胞抗原决定基、细胞穿透肽及亲脂性部分;及(2)使用自定义纳米材料,例如自组装肽、非肽树枝状聚合物及金纳米粒子作为抗原呈现平台的合成方法。使用多抗原肽(map)系统可改良次单位肽疫苗的有时不良的免疫原性。在map系统中,抗原肽的多个复本同时结合于非免疫原性基于lys的树突状架构的α-胺基及ε-胺基,帮助赋予降解稳定性,由此增强免疫细胞的分子识别及比单独的小型抗原肽更强的免疫反应的诱导。在一些组合物中,map包含基于lys的树突状架构、辅助型t细胞抗原决定基、免疫刺激亲脂性部分、细胞穿
透肽、自由基诱导的聚合、自组装纳米粒子(作为抗原呈现平台)及金纳米粒子中的一或多者。
[0260]
用于非经肠投与的医药组合物较佳是无菌的且实质上等张的且在gmp条件下制造。医药组合物可呈单位剂型(亦即,用于单次投与的剂量)提供。医药组合物可使用一或多种生理学上可接受的载剂、稀释剂、赋形剂或助剂来调配。调配视所选投与途径而定。对于注射,本发明的肽可在水溶液中,较佳在生理上相容的缓冲液中调配,诸如汉克氏溶液(hank's solution)、林格氏溶液(ringer's solution)或生理盐水或乙酸盐缓冲液(以降低注射部位的不适)。溶液可含有调配剂,诸如悬浮剂、稳定剂及/或分散剂。或者,肽组合物可呈冷冻干燥的形式,在使用的前用适合媒剂(例如无菌无热原水)复原。
[0261]
肽(及视情况选用的融合至肽的载体)亦可以编码肽的核酸形式投与且在个体中原位表现。编码免疫原的核酸区段通常连接至调节组件,诸如允许个体中的预期目标细胞中的dna区段表现的启动子及增强子。为了在血球中表现,需要诱导免疫反应,启动子及强化子组件(例如来自轻链或重链免疫球蛋白基因或cmv主要中间体早期启动子及强化子)适用于引导表现。连接的调节组件及编码序列通常选殖至载体中。
[0262]
dna及rna可以裸形式(亦即,无胶体或包封材料)递送。或者,可使用多种病毒载体系统,包括反转录病毒系统(参见例如boris-lawrie及teumin,cur.opin.genet.develop.3(1):102-109(1993));腺病毒载体(参见例如bett等人,j.virol.67(10);5911-21(1993));腺相关病毒载体(参见例如zhou等人,j.exp.med.179(6):1867-75(1994));来自包括牛痘病毒及禽痘病毒的痘病毒科的病毒载体;来自α病毒属的病毒载体,诸如来自辛得比斯(sindbis)及塞姆利基森林病毒(semliki forest virus)的病毒载体(参见例如dubensky等人,j.virol.70(1):508-519(1996));委内瑞拉马脑炎病毒(参见us 5,643,576);及棒状病毒,诸如水泡性口炎病毒(参见wo 96/34625)及乳突状瘤病毒(wo 94/12629;ohe等人,human gene therapy 6(3):325-333(1995);及xiao及brandsma,nucleic acids.res.24(13):2620-2622(1996))。
[0263]
编码免疫原的dna及rna或含有其的载体可封装于脂质体、纳米粒子或脂蛋白复合物中。适合的其他聚合物包括例如鱼精蛋白脂质体、多醣粒子、阳离子纳米乳液、阳离子聚合物、阳离子聚合物脂质体、阳离子脂质纳米粒子、阳离子脂质、胆固醇纳米粒子、阳离子脂质-胆固醇、peg纳米粒子或树枝状聚合物纳米粒子。其他适合的脂质及相关类似物由us 5,208,036、us 5,264,618、us 5,279,833及us 5,283,185描述,其各自以全文引用的方式并入本文中。编码免疫原的载体及dna亦可吸附至微粒载体或与微粒载体结合,微粒载体的实例包括聚甲基丙烯酸甲酯聚合物及聚乳酸交酯及聚(乳酸交酯-共-乙交酯)(参见例如mcgee等人,j.micro encap.1997年3月至4月;14(2):197-210)。
[0264]
医药学上可接受的载剂组合物亦可包括添加剂,包括(但不限于)水、医药学上可接受的有机溶剂、胶原蛋白、聚乙烯醇、聚乙烯吡咯啶酮、羧基乙烯基聚合物、羧甲基纤维素钠、聚丙烯酸钠、海藻酸钠、水溶性聚葡萄糖、羧甲基淀粉钠、果胶、甲基纤维素、乙基纤维素、三仙胶、阿拉伯胶、酪蛋白、琼脂、聚乙二醇、二甘油、丙三醇、丙二醇、石蜡脂、石蜡、硬脂醇、硬脂酸、人类血清白蛋白、甘露糖醇、山梨糖醇、乳糖及作为医药添加剂可接受的界面活性剂。
[0265]
适合于治疗的个体
[0266]
已在数种疾病中发现aβ斑块及/或神经原纤维缠结的存在,该等疾病包括阿兹海默症、唐氏症候群(down's syndrome)、轻度认知障碍、淀粉状蛋白脑血管病、原发性年龄相关的tau蛋白病、脑炎后型帕金森氏症(postencephalitic parkinsonism)、创伤后痴呆或拳击手型痴呆(dementia pugilistica)、皮克病(pick's disease)、c型尼曼-匹克二氏病(type c niemann-pick disease)、核上麻痹、额颞叶型痴呆、额颞叶型脑叶变性、嗜银颗粒病(argyrophilic grain disease)、球状胶质tau蛋白病、肌肉萎缩性侧索硬化/关岛型帕金森氏症痴呆复合症、皮质基底核退化症(cbd)、路易体痴呆、阿兹海默症路易体变型(lbvad)、慢性创伤性脑病(cte)、球状胶质tau蛋白病(ggt)、帕金森氏病、进行性核上麻痹(psp)、萎缩性年龄相关的黄斑变性(amd)及包涵体肌炎。
[0267]
本发明的组合物及方法可用于治疗或预防此等疾病中的任一者。由于神经性疾病与aβ及/或tau之间的广泛关联,本发明的组合物及方法可用于治疗或预防与无神经性疾病的个体的平均值相比任何显示aβ及/或tau(例如csf中)的含量升高的个体。本发明的组合物及方法亦可用于治疗或预防在具有与神经性疾病相关的aβ及/或tau突变的个体中的神经性疾病。该等方法尤其适用于治疗或预防阿兹海默症。
[0268]
适合治疗的个体包括有患病风险但未显示症状的个体,以及当前显示症状的患者,包括先前尚未接受针对疾病治疗的未经治疗的个体。有患病风险的个体包括年老群体中的个体,即具有aβ及/或tau病变且具有已知遗传患病风险的无症状个体。此类个体包括亲属已经历此疾病的彼等个体及风险由基因或生物化学标记的分析测定的彼等个体。风险的基因标记包括aβ及/或tau中的突变以及与神经性疾病相关的其他基因中的突变。举例而言,异型接合及甚至更多呈同型接合形式的apoe4对偶基因与阿兹海默症(ad)的风险相关。阿兹海默症的风险的其他标记包括app基因中的突变,尤其分别在称为哈迪型(hardy)及瑞典型突变的位置717及位置670及位置671处的突变,在早老素基因、ps1及ps2中的突变,ad的家族病史、高胆固醇症或动脉粥状硬化。当前患有阿兹海默症的个体可由pet成像、由特征性痴呆以及上文所描述的风险因子的存在来识别。另外,许多诊断测试可用于鉴别患有ad的个体。其包括量测csf或血液tau或磷酸化tau及aβ42含量。升高的tau或磷酸化tau及降低的aβ42含量表示ad的存在。一些与帕金森氏症相关的突变,例如ala30pro或ala53thr,或与帕金森氏症相关的其他基因的突变,诸如富白胺酸重复激酶(lrrk2或park8)。个体亦可由dsm iv tr的标准诊断是否患有上文所提及的任何神经性疾病。
[0269]
在无症状个体中,可在任何年龄开始治疗(例如,10岁、20岁、30岁或更大)。然而通常,不必开始治疗直至个体达到20、30、40、50、60、70、80或90岁。治疗通常在一段时间内需要多次给药。可由随时间推移分析抗体含量来监测治疗。若反应下降,则指示补强剂量。对于潜在的唐氏症候群患者,可在产前由向母亲投与治疗剂或在出生后不久开始。
[0270]
治疗方法及用途
[0271]
本发明提供在患有神经退化性疾病(例如,阿兹海默症)或有罹患该神经退化性疾病风险的个体中抑制或减少aβ及/或tau聚集的方法。该等方法包括向个体投与如本文所揭示的组合物。治疗有效量为在有效时段内给予以达到所需免疫或临床效果的剂量。可调节剂量方案以提供最优治疗反应。举例而言,若干分次剂量可以设定时间间隔(例如,一周、一月)投与,或剂量可如由治疗情况的紧急程度所指示按比例减少。
[0272]
在预防性应用中,本文所描述的组合物可以有效降低风险、减少严重性或延迟至
少一种疾病的征象或症状发作的方案(投与的剂量、频率及途径),投与给易患疾病(例如阿兹海默症)或另外有患病风险的个体。详言的,该方案可有效抑制或延迟aβ斑块形成,及/或抑制或延迟脑部中的tau或磷酸化tau及由其形成的成对长丝,及/或抑制或延迟其毒性作用,及/或抑制或延迟行为缺陷的发展。在治疗性应用中,本文所描述的组合物以可有效改善或至少抑制至少一种疾病征象或症状的进一步恶化的方案(投与的剂量、频率及途径),投与给疑似患有疾病(例如阿兹海默症)的个体或已患有该疾病的患者。详言的,该方案较佳有效减少或至少抑制aβ斑块及/或tau、磷酸化tau或由其形成的成对长丝的含量的进一步增加、相关毒性及/或行为缺陷。
[0273]
若经治疗的个体所达成的结果比未由本发明的方法治疗的类似个体的对照群体中的平均结果更有利,或若在对照临床试验(例如,ii期、ii/iii期或iii期试验)中在经治疗个体对比对照个体中以p《0.05或0.01或甚至0.001的含量证明更有利结果,则方案可视为治疗性或预防性有效。
[0274]
有效剂量是视许多不同因素而变化,诸如投与手段、目标位点、患者生理学状态、患者是否为apoe携带者、患者为人类抑或动物、所投与的其他药物及治疗是预防性抑或治疗性的。
[0275]
在一些实施例中,有效量为总剂量的25μg至1000μg或50μg至1000μg。在一些实施例中,有效量为总剂量的100μg。在一些实施例中,有效量为向个体投与总计两次的25μg的剂量。在一些实施例中,有效量为向个体投与总计两次的100μg的剂量。在一些实施例中,有效量为向个体投与总计两次的400μg的剂量。在一些实施例中,有效量为向个体投与总计两次的500μg的剂量。在一些实施例中,rna(例如mrna)疫苗由皮内注射、肌肉内注射或由鼻内投与向个体投与。
[0276]
在一些实施例中,用于主动免疫疗法的药剂的量在每患者1至1,000微克(μg)、或0.1至500μg、或10至500μg、或50至250μg的范围内变化且可为每次注射1至100或1至10μg以用于人类投与。注射的时序可在一天一次至一周一次至一月一次至一年一次至十年一次之间显著变化。典型方案由免疫接种及随后以诸如6周时间间隔或两个月的时间间隔进行补强注射组成。另一方案由免疫接种及接种后1、2、3、4、5、6或12个月进行一或多次补强注射组成。另一方案需要每两个月注射一次,直至终身。或者,可如由监测免疫反应所指示不规律地进行补强注射。投与频率可为一或多次,只要副作用在临床上可接受的范围内即可。
[0277]
在一些实施例中,如本文所揭示的组合物或方法包含向个体投与核酸疫苗,该核酸疫苗包含一或多个具有编码第一肽及第二肽的开放阅读框架的dna或rna聚核苷酸,其中向个体投与介于10μg/kg与400μg/kg之间的剂量的核酸疫苗。在一些实施例中,rna聚核苷酸的剂量为每剂量1至5μg、5至10μg、10至15μg、15至20μg、10至25μg、20至25μg、20至50μg、30至50μg、40至50μg、40至60μg、60至80μg、60至100μg、50至100μg、80至120μg、40至120μg、40至150μg、50至150μg、50至200μg、80至200μg、100至200μg、120至250μg、150至250μg、180至280μg、200至300μg、50至300μg、80至300μg、100至300μg、40至300μg、50至350μg、100至350μg、200至350μg、300至350μg、320至400μg、40至380μg、40至100μg、100至400μg、200至400μg或300至400μg。在一些实施例中,由皮内或肌肉内注射向个体投与核酸疫苗。在一些实施例中,在第零天向个体投与核酸疫苗。在一些实施例中,在第七天、或十四天、或二十一天向个体投与第二剂量的核酸。
[0278]
本文中所描述的组合物较佳经由周边途径投与(亦即,其中所投与的组合物引起稳定免疫反应及/或所诱导的抗体群穿过血脑障壁以到达脑部、脊髓或眼睛中的预期部位的途径)。对于周边疾病,所诱导的抗体离开血管分布以到达预期周边器官。投与途径包括经口、皮内、鼻内、皮内或肌肉内。主动免疫接种的一些途径为皮下及肌肉内。肌肉内投与及皮下投与可在单一部位或多个部位进行。肌肉内注射最常在手臂或腿部肌肉中进行。在一些方法中,药剂直接注射至沈积物已积聚的特定组织中。
[0279]
可调节所投与的剂量数目以产生更稳定的免疫反应(例如,更高效价)。对于急性病症或慢性病症的急性恶化,1个与10个剂量之间常常为足够的。有时候,视情况呈分开形式的单一推注剂量对于急性病症或慢性病症的急性恶化而言为足够的。对于慢性病症,如本文所揭示的疫苗/免疫疗法可以规则间隔投与,例如每周一次、每两周一次、每月一次、每季一次、每六个月一次,持续至少1、5或10年,或患者的一生。
[0280]
经dna或rna编码的免疫原的有效量可在每公斤受体体重约1纳克与约1克之间,或约介于约0.1μg/kg与约10mg/kg之间,或约介于约1μg/kg与约1mg/kg之间。适合于内部投与的剂量形式较佳含有(对于后一剂量范围)每单位约0.1μg至100μg的活性成分。以组合物的总重量计,活性成分可在0.5至95重量%的范围内变化。或者,负载有抗原的树突状细胞的有效剂量在约104个与108个细胞之间。熟习免疫疗法技术者应能够在不进行过多实验的情况下调整此等剂量。
[0281]
核酸组合物可以便利方式投与,例如由便利且有效的途径注射。途径可包括(但不限于)皮内「基因枪」递送或肌肉内注射。由皮下、静脉内或肌肉内途径投与经修饰的树突状细胞。其他可能途径包括经口投与、鞘内腔、吸入、经皮施用或直肠投与。
[0282]
视投与途径而定,组合物可涂布于材料中以保护化合物免受酶、酸及其他可能使化合物失活的天然条件的作用。因此,可能有必要用防止其失活的材料涂布组合物或将组合物与防止其失活的材料共投与。举例而言,核酸酶或蛋白酶(例如,胰脏胰蛋白酶抑制剂、二异丙基氟磷酸盐及抑肽酶)的酶抑制剂或在适当载体中,诸如脂质体(包括水包油包水乳剂以及习知脂质体(strejan等人,j.neuroimmunol 7(1):27-41,1984)。
[0283]
本文中所揭示的免疫治疗组合物亦可与其他用于与aβ或tau的积聚相关的疾病的治疗(例如抗aβ抗体,诸如特异性结合于本文中所揭示的任一aβ抗原决定基的抗体)组合使用。举例而言,阿杜卡努单抗(aducanumab)或揭示于例如美国专利公开案第20100202968号及美国专利第8,906,367号中的任一抗体,及/或抗tau抗体,诸如特异性结合于本文中所揭示的任一tau抗原决定基的抗体、abbv-8e12、戈奈单抗(gosuranemab)、泽格特奈单抗(zagotenemab)、rg-6100、biib076或揭示于wo2014/165271、us 10,501,531、wo2017/191559、wo2017/191560、wo2017/191561、us 20190330314、us20190330316及wo2018/204546中的任一抗体。在一些组合疗法方法中,患者在接受本文所揭示的主动免疫疗法方法的前接受被动免疫疗法。在其他方法中,患者在相同治疗时段期间接受被动及主动免疫疗法。或者,患者可在接受被动免疫疗法的前接受主动免疫疗法。组合亦可包括小型分子疗法及非免疫原性疗法,诸如(加兰他敏(galantamine))、(雷司替明(rivastigmine))及(多奈派齐(donepezil))及改良脑部中神经细胞功能的其他组合物。
[0284]
本发明的组合物可用于制造用于本文所描述的治疗方案的药剂。
[0285]
治疗方案
[0286]
如本文所揭示的治疗方法的所需结果根据疾病及患者概况而变化且可由熟习此项技术者判定。所需结果包括患者健康状态的改良。通常,所需结果包括可量测的指数,诸如病理性类淀粉蛋白纤维的减少或清除,类淀粉蛋白的聚集及/或类淀粉蛋白纤维的沈积的减少或抑制,及对病理性及/或聚集类淀粉蛋白纤维的免疫反应的增加。所需结果亦包括改善类淀粉蛋白疾病特异性症状。如本文所用,诸如「改良」、「增加」或「减少」的相对术语指示相对于对照的值,诸如在开始本文所描述的治疗的前对同一个体的量测,或对对照个体或群组的量测。对照个体为罹患与所治疗的个体相同的类淀粉蛋白疾病的个体,该个体年龄与所治疗的个体约相同(以保证所治疗的个体及对照个体的疾病阶段相当),但尚未接受使用所揭示的免疫疗法/疫苗制剂的治疗。或者,对照个体为健康个体,其年龄与所治疗的个体约相同。对疗法有反应的变化或改良通常为具有统计显著性的且由小于或等于0.1、小于0.05、小于0.01、小于0.005或小于0.001的p值描述,其可视为显著的。
[0287]
用于治疗个体的如本文所揭示的组合物的有效剂量视许多不同因素而变化,包括投与方式、目标部位、患者的生理状态、患者为人类抑或动物、所投与的其他药物(若存在)及治疗是预防性抑或治疗性的。可滴定治疗剂量以使安全性及功效优化。免疫原的量亦可视是否亦投与佐剂而定,其中在不存在佐剂的情况下需要较高剂量。投与用的免疫原的量有时在每个患者1至500μg的范围内变化且更通常在用于人类投与时每次注射5至500μg范围内变化。偶尔,使用每剂量1至2mg的较高剂量。通常,各人类剂量使用约10、20、50或100μg。剂量的时序可在一日一次至一年一次至十年一次之间显著变化。在给定免疫原的剂量的任何一天,若亦投与佐剂,则剂量大于1μg/患者且通常大于10μg/患者,且在不存在佐剂的情况下大于10μg/患者且通常大于100μg/患者。典型方案由免疫接种及随后以6周间隔投与补强剂量组成。另一方案由免疫接种及接种后1、2、3、4、5、6或12个月后投与补强剂量组成。另一方案需要每两个月投与一剂量,直至终身。或者,可如由监测免疫反应所指示不规律地投与补强剂量。
[0288]
当与用于阿兹海默症的第二治疗(诸如(加兰他敏)、(雷司替明)及(多奈派齐))组合投与时,可根据产物标记或视需要鉴于用本发明的组合物的治疗来投与第二治疗。
[0289]
套组
[0290]
本发明进一步提供套组(例如容器),其包含本文所揭示的组合物及相关材料,诸如使用说明书(例如药品说明书)。使用说明书可含有例如组合物的投与及视情况选用的一或多种其他药剂的说明书。肽及/或核酸组合物的容器可为单位剂量、散装包装(例如多剂量包装)或次单位剂量。
[0291]
药品说明书是指市售治疗产品包括中通常所包括的说明书,其含有关于适应症、使用、剂量、投与、与此类治疗产品的使用有关的禁忌及/或警告的信息。套组亦可包括第二容器,其包含医药学上可接受的缓冲液,诸如抑菌注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液及右旋糖溶液。其亦可包括就商业及使用者观点而言所需的其他材料,包括其他缓冲液、稀释剂、过滤器、针及注射器。
[0292]
用途
[0293]
本文中所描述的肽、多肽、免疫原及医药组合物中的每一者可用于治疗如本文中
所描述的疾病中的一或多者。另外,本文中所描述的肽、多肽、免疫原及医药组合物中的每一者可用于治疗如本文中所描述的疾病中的一或多者的方法中。本文中所描述的肽、多肽、免疫原及医药组合物中的每一者可用于制造治疗或用于治疗如本文中所描述的疾病中的一或多者的药剂的方法中。
[0294]
下文仅出于例证目的而提供,且并不意欲限制以上广义术语中所描述的本发明的范畴。
[0295]
本文中识别的所有美国及国际专利申请案均以全文引用的方式并入本文中。
实施例
[0296]
实施例1:天竺鼠的免疫接种
[0297]
在第0天、第21天、第49天及第77天,向天竺鼠经肌肉内注射50μg测试免疫原、含25μg qs21的200μl addavax。在免疫接种7天后,进行放血。所测试的肽包括daefrhd(seq id no:06)、qivykpv(seq id no:39)及daefrhdrrqivykpv(seq id no:57)。特定免疫原为daefrhdc(seq id no:71)、qivykpvggc(seq id no:72)及daefrhdrrqivykpvggc(seq id no:59)。肽是经由c端半胱胺酸与具有顺丁烯二酰亚胺键的crm-197偶合。
[0298]
在研究开始时,雌性天竺鼠为至少5周龄,其体重大致为350至500g。在认证机构根据美国农业部(usda)及国际实验动物评估与认可委员会(aaalac)的指南进行用于动物管理及照护的适当动物圈养及研究程序。
[0299]
免疫原浓度为0.5mg/ml。在每次投与测试免疫原的前,对各后肢上大致3cm2的面积进行刮毛且用乙醇擦拭以便观测注射部位。各动物接受的测试免疫原剂量为200微升(0.25微克/微升),分为两个独立部位,每次分别注射100微升(亦即,动物接受含50μg免疫原的100μl pbs+含25μg qs21的100μl mf59)。25g-27g针是经肌肉内插入至后肢中,深度大致0.25至0.5cm,且以每部位100微升进行注射。对于每次投与,注射部位在每个后肢四个独立部位之间轮换且相隔至少2cm。
[0300]
实施例2:抗体效价的量测
[0301]
在第1周、第4周及第8周,经由颈静脉将全血样本收集至血块活化剂试管中,每次收集250至350微升。在第12周结束时经由心脏穿刺将最大体积的全血收集至血块活化剂试管中。使所有血液样本在室温下凝结超过30分钟,在3,000rpm的环境温度(大致20至25℃)下离心10至15分钟,且将血清上清液单独转移至干净冷冻小瓶中。将血清上清液冷冻储存在-80℃(
±
12℃)下。
[0302]
在可溶性aβ聚集物上对天竺鼠血液进行滴定
[0303]
将2.5μg/ml的制备型可溶性聚集aβ(aβ42的hfip膜经再悬浮且在振荡下培育隔夜,接着旋转以移除不溶性聚集物),在pbs中以每孔100微升涂布于培养盘中且在室温下培育隔夜。用含1% bsa的pbs阻塞培养盘1小时。抽吸培养盘且抽吸至列a,向1-4添加200μl的含0.1% bsa的pbs tween。在第1列中,阴性gp血清以1/100添加,同时2-4含有1/100测试血清。列b-h含有100μl含0.1% bsa的pbs tween。沿着培养盘将各列连续稀释1/2,得到1/100至1/12800的稀释液。将孔在室温下培育2小时,接着洗涤,且制备抗天竺鼠igg hrp于含0.1% bsa的pbs tween中的1/5000稀释液,且接着将100μl添加至经洗涤孔中。将其培育1小时且洗涤。使用thermo-fisher opd压锭机以每10毫升1个锭剂来制备opd受质。以1/10添
no:57)的天竺鼠血清的几何平均效价的结果。
[0311]
图2展示在aβ1-28及全长tau上针对单肽免疫原aβ及tau肽(daefrhd(seq id no:06)及qivykpv(seq id no:39))比对双肽免疫原daefrhdrrqivykpv(seq id no:57)的结果。
[0312]
实施例3:用来自经如本文所揭示的疫苗免疫接种的天竺鼠的血清对阿兹海默症脑部组织进行染色。
[0313]
将新鲜冷冻人类脑部组织的解剖块(约0.5g)包埋于最佳切割温度化合物(oct化合物)中且使用低温恒温器切割以产生10μm的切片。在存在迭氮化钠的情况下,将该等切片置于葡萄糖氧化酶及βd葡萄糖的溶液中以阻断内源性过氧化酶。制备组织切片后,按照制造商的说明,使用兔抗天竺鼠二级抗体及dako dab侦测套组,以两种稀释度(1:300及1:1500)对来自经如本文所揭示的疫苗免疫接种的天竺鼠的指定天竺鼠血清进行染色。使用自动化leica bond染色机来处理染色。结果指示来自经如本文中所揭示的疫苗免疫接种的天竺鼠的血清包含对阿兹海默症患者的人类脑部组织中的aβ及tau具有特异性的抗体(参见图3a至3f)。
[0314]
实施例4:来自经疫苗接种动物的血清阻断可溶性aβ聚集物与神经元的结合。
[0315]
如先前所述培养e18初级大鼠海马神经元(zago等人,「neutralization of soluble,synaptotoxic amyloidβspecies by antibodies is epitope specific」,jneurosci.2012年2月22日;32(8):2696-2702)。在培养物div14-21上具有或不具有天竺鼠疫苗血清的情况下预培育可溶性aβ聚集物以阻断可溶性aβ聚集物进行神经炎性结合。自经双免疫原肽daefrhdrrqivykpvggc(seq id no:59;;免疫原9)疫苗接种的动物分离天竺鼠血清。在一天前制备新鲜未标记、经生物素标记或(9:1)可溶性aβ且在4℃下培育隔夜。使用不含酚红的基础培养基(nb-npr)以2
×
最终浓度在一半的最终处理体积中制备每一经稀释的血清样本(1:1000、1:300及1:100)及可溶性aβ溶液。将其与2
×
可溶性aβ的一半最终体积及2
×
稀释天竺鼠疫苗血清的一半最终体积组合以构成总最终处理体积中的1
×
最终浓度,将其充分混合且接着在37℃下预培育30分钟。用150μl/孔的nb-npr冲洗e18神经元,随后加入结合处理。将来自经疫苗接种动物/aβ处理的天竺鼠血清以每孔60μl添加至e18神经元中,且随后在正常培育箱条件(5% co2;9% o2)下于37℃培育30分钟。使用150μl/孔的nb-npr冲洗细胞两次,且随后将细胞在1
×
dpbs中的4%多聚甲醛中固定20分钟。使用0.1tx-100渗透细胞5分钟,且在室温(rt)下使用10%正常山羊血清(ngs)阻断1小时。在4℃下将细胞与map2及neun初级抗体在100μl/孔的含有1% bsa+1% ngs的1
×
dpbs中培育隔夜。次日,将细胞在150μl/孔的1
×
dpbs中冲洗两次,每次洗涤5分钟。在rt下在100μl/孔的1
×
dpbs+1% bsa+1% ngs中添加二级抗体持续1小时。进行高含量成像(hci)分析,以使用operetta hci cls仪器(perkin elmer;经修饰的神经突起算法(modified neurite outgrowth algorithm):40
×
h2o指标;每孔40场;每条件(n=3);数据展示为平均值(+/-)sd)定量可溶性聚合aβ神经炎结合;使用map2及neun(abcam)神经元标记各自追溯神经突树且计算每光场细胞体数目;使用抗生蛋白链菌素-488或多株aβ抗体(thermo;millipore)侦测神经炎aβ可溶性聚集斑点;且数据报导为aβ可溶性聚集斑点/神经元(或报导为整合强度))。
[0316]
对于所测试的各条件,每孔观测到大致80至150个神经元。结果显示,来自经双免
疫原肽daefrhdrrqivykpvggc(seq id no:59;免疫原9)疫苗接种的动物的天竺鼠血清以剂量依赖性方式抑制aβ与神经元的结合(参见图4)。
[0317]
实施例5:经双肽抗原疫苗接种的小鼠产生对aβ及tau的效价。
[0318]
在第0天、第14天及第28天向瑞士韦伯斯特雌性小鼠注射25μg双肽免疫原(表2)及含25μg qs21(desert king)的pbs,每次注射总共200μl。各小鼠皮下接受200μl。在第21天及第35天对小鼠进行放血。
[0319]
表2
[0320][0321][0322]
含有tau肽eivyksp(seq id no:43)的免疫原(参见图5b)展示tau效价整体变化比具有tau mtbr序列qivykpv(seq id no:39)的免疫原大(除免疫原23的外);因此亦测试含有daefrhdrrqivykpv(seq id no:57)的基础微管结合区(mtbr)肽(图5a)。具有与ggc接头不同的接头(无接头、aa及kk)的三个免疫原的效价展示于图5中。
[0323]
自第二次放血观测到的效价阐述于表3及表4中:
[0324]
表3
[0325][0326]
表4
[0327][0328]
经免疫原9daefrhdrrqivykpvggc(seq id no:59)免疫接种的天竺鼠中观测到的效价阐述于下表5中。
[0329]
表5
[0330][0331]
实施例6:来自经疫苗接种动物的血清染色人类脑部组织中的aβ斑块及tau病变。
[0332]
将来自同经解剖的阿兹海默症供体或非患病对照的新鲜冷冻人类脑部组织包埋于oct中,且在低温恒温器中切割以产生10μm冷冻切片。在存在迭氮化钠的情况下,将组织切片在葡萄糖氧化酶及βd葡萄糖的溶液中培育以阻断内源性过氧化酶。在自动化leica bond rx染色机(leica biosystems)中,以1:1000稀释度进行用来自疫苗接种小鼠(小鼠是用以下双抗原肽疫苗接种:daefrhdrrqivykpvggc(seq id no:59),免疫原9);daefrhdrrqivykpvc(seq id no:60,免疫原10);daefrhdrrqivykpvaac(seq id no:61,免疫原18)及daefrhdrrqivykpvkkc(seq id no:62,免疫原19)或对照小鼠的血清染色。使用bond polymer优化侦测套组(ds9800,leica biosystems)侦测抗体结合性,其基于抗小鼠聚合物侦测、dab观测及苏木精核计数器-染色。在盖玻片的后,用具有ndp.scan(2.5.85软件)的hamamatsu nanozoomer 2.0ht幻灯片扫瞄器(hamamatsu corporation)对经染色组织载波片进行数字成像。查看经数字化影像且使用ndp.view(2.7.43.0软件)进行分析。
[0333]
结果显示,aβ斑块及tau神经原纤维缠结是基于其典型的组织病理学特征鉴别。此类病变在与对照小鼠血清一起培育的组织中不存在。此外,在与来自经疫苗接种小鼠的血清一起培育的后,非患病组织未进行此类病理性染色。图6a-e及表6概述使用来自经双抗原肽接种疫苗的动物的小鼠血清(用以对来自ad患者的人类脑部组织染色的1:1000稀释度的血清)进行aβ及tau染色的结果。
[0334]
表6
[0335][0336]
实施例7:食蟹猕猴的免疫接种及效价测定
[0337]
此实施例中所描述的研究经设计成使用双抗原肽daefrhdrrqivykpvggc(seq id no:59)评定食蟹猕猴中产生对aβ及tau的效价。吾等亦评定两次注射时程及效价的持久性。
[0338]
免疫接种
[0339]
在小鼠中筛选具有树突状细胞裂解位点的数种双β-tau线性免疫原以得到在aβ及tau蛋白质上的平衡效价(参见上文实施例5)。在天竺鼠(参见上文实施例1至5)及食蟹猕猴(此实施例)中进一步评估免疫原子集。向两组四只猴经肌肉内用50μg与crm197载体蛋白偶合的免疫原(seq id no:59;daefrhdrrqivykpvggc)及50μg的佐剂qs21进行免疫接种。在第0周、第4周、第12周及第24周对第1组进行注射,其中每2周采血,直至第38周。在第0周、第8周、第24周对第2组进行注射,其中每2周采血,直至第38周。针对aβ及全长tau测定血清效价水平。用来自经免疫的动物及对照动物的血清对新鲜冷冻的人类ad或对照脑部切片进行染色。亦关于初级大鼠海马神经元中的可溶性aβ寡聚物结合评定天竺鼠免疫血清的活性。
[0340]
效价方案
[0341]
量测食蟹猕猴中抗体对aβ1-28的效价
[0342]
由酶联免疫吸附分析法(elisa)滴定食蟹猕猴血液。将培养盘用aβ1-28(seq id no:67)于磷酸盐缓冲盐水(pbs)中以2μg/ml涂布隔夜,且接着用含1%牛血清白蛋白(bsa)的pbs阻断1小时。放血前食蟹猕猴用作阴性对照,而来自先前小鼠研究的已知阳性抗血清在与测试血清相同的稀释度下用作阳性对照。以1/100开始,在pbs/0.1% bsa/0/1% tween 20(pbs/bsa/t)中稀释血液且沿培养盘进行1:2连续稀释。将培养盘用tbs/tween 20洗涤,且添加山羊抗猴免疫球蛋白g(igg)(重链+轻链)辣根过氧化酶(hrp)(igg[h+l]hrp;
invitrogen),并在室温下培育1小时。在tbs/tween 20中洗涤培养盘,且根据制造商说明书用邻苯二胺二盐酸盐(opd)受质(thermo fisher scientific,waltham,ma)侦测抗体结合性。在molecular devices spectromax上在490nm处读取培养盘。效价经定义为可提供50%最大od或4
×
背景值时的稀释度(图表及表中所定义);若其介于各稀释度之间,则使用外推法。
[0343]
量测食蟹猕猴中抗体对tau的效价
[0344]
由酶联免疫吸附分析法(elisa)针对全长重组tau(proteos,kalamazoo,mi;seq id no:02)滴定食蟹猕猴血液。将培养盘于磷酸盐缓冲盐水(pbs)中以2μg/ml tau涂布隔夜,且接着用含1%牛血清白蛋白(bsa)的pbs阻断1小时。放血前天竺鼠血清用作阴性对照,而来自先前小鼠研究的已知阳性抗血清在与测试血清相同的稀释度下用作阳性对照。以1/100开始,在pbs/0.1%bsa/0/1% tween 20(pbs/bsa/t)中稀释血液且沿培养盘进行1:2连续稀释。将培养盘用tbs/tween 20洗涤,且添加山羊抗猴免疫球蛋白g(igg)(重链+轻链)辣根过氧化酶(hrp)(igg[h+l]hrp;invitrogen),并在室温下培育1小时。在tbs/tween 20中洗涤培养盘,且根据制造商说明书用邻苯二胺二盐酸盐(opd)受质(thermo fisher scientific,waltham,ma)侦测抗体结合性。在molecular devices spectromax上在490nm处读取培养盘。效价经定义为可提供50%最大od或4
×
背景值时的稀释度(图表及表中所定义);若其介于各稀释度之间,则使用外推法。
[0345]
在载体蛋白crm197上对食蟹猕猴血液进行滴定
[0346]
由酶联免疫吸附分析法(elisa)针对crm197(finabio,maryland)载体蛋白滴定食蟹猕猴血液。将培养盘于磷酸盐缓冲盐水(pbs)中以2μg/ml tau涂布隔夜,且接着用含1%牛血清白蛋白(bsa)的pbs阻断1小时。放血前天竺鼠血清用作阴性对照,而来自先前小鼠研究的已知阳性抗血清在与测试血清相同的稀释度下用作阳性对照。以1/100开始,在pbs/0.1% bsa/0/1%tween 20(pbs/bsa/t)中稀释血液且沿培养盘进行1:2连续稀释。将培养盘用tbs/tween 20洗涤,且添加山羊抗猴免疫球蛋白g(igg)(重链+轻链)辣根过氧化酶(hrp)(igg[h+l]hrp;invitrogen),并在室温下培育1小时。在tbs/tween 20中洗涤培养盘,且根据制造商说明书用邻苯二胺二盐酸盐(opd)受质(thermo fisher scientific,waltham,ma)侦测抗体结合性。在molecular devices spectromax上在490nm处读取培养盘。效价经定义为可提供50%最大od或4
×
背景值时的稀释度(图表及表中所定义);若其介于各稀释度之间,则使用外推法。
[0347]
结果
[0348]
aβ及tau的效价水平类似。经受第1组疫苗接种时程的猴具有效价,其曲线下面积大于第2组猴,但并不表明在此等条件下的最大效价的显著提高(图7a,图7b)。总效价水平低于上文所描述的天竺鼠研究。此变化可归因于佐剂自天竺鼠中的addvax中的qs21变为石蟹猕猴中的磷酸盐缓冲盐水(pbs)中的qs21,以匹配审批通过的疫苗。四次注射及三次注射疫苗接种时程的效价的持久性均为适度的(图8a,图8b)。此等结果表明,此等免疫原可在灵长类动物中产生对aβ及tau的平衡的免疫反应。给药时程及/或调配的优化可改良效价水平及持久性。
[0349]
实施例8:对ad及对照脑部切片的免疫组织化学
[0350]
评估来自经免疫猴的血清结合来自患有ad的个体的人类脑部组织中的病理性aβ
斑块及tau缠结的能力。预期结合aβ斑块与tau缠结两者会减少斑块负荷且减少tau传输,其又应减少ad的征象及症状。
[0351]
将新鲜冷冻的人类脑部组织的解剖块包埋于最佳切割温度化合物(oct化合物)中且使用低温恒温器切割以产生10微米切片。在存在迭氮化钠的情况下,将该等切片置于葡萄糖氧化酶及βd葡萄糖的溶液中以阻断内源性过氧化酶。制备组织切片后,用指定食蟹猕猴免疫血清染色是以两种稀释度进行(在rt下,1:300,在5%山羊血清及0.25%triton中,持续1小时)。根据制造商说明书,利用以下侦测结合:rt下的经纯化的未经标记的小鼠抗猴igg二级抗体(mybiosource 3mg/ml),持续1小时;及rt下的山羊抗小鼠igg二级抗体(jackson,1:200),持续1小时;抗生素蛋白-生物素复合物(abc;vector pk-4000)及dako dab侦测套组。使用自动化leica bond染色机来处理染色。
[0352]
表7展示食蟹猕猴研究中染色的概述。除1002以外的所有动物均对aβ具有阳性染色。仅动物1001具有强tau染色(图9a至图9c),其中1003(图10a至图10b)及1501(图11a至图11b)显示适度染色。举例而言,动物2501未显示显著tau染色(图12a至图12b)。似乎与tau染色及tau效价不存在相关性,如由动物1001所证明,该动物1001不具有强tau效价但具有经强染色的tau。
[0353]
表7
[0354]
动物编号aβ染色tau染色aβ效价tau效价1001+++8001501002
‑‑
25251003++++1500060001501++++/-800032002001+++-90003502003++-20015002102+++-80008002501+++-80001600
[0355]
在预期在活体内条件下在cns中达成的浓度下,免疫血清与人类ad脑部切片中的aβ斑块及tau缠结亲和地结合。在第26周具有最强效价的猴的aβ经染色,且具有低至适中tau效价的一只猴的aβ及tau两者均经染色。
[0356]
此等结果表明,食蟹猕猴抗体反应的血清抗体结合经平衡且结合至病理性aβ斑块及tau缠结。
[0357]
实施例9:对可溶性aβ聚集物结合于神经元的血清阻断及t细胞活性
[0358]
如上文所描述培养自e18大鼠分离的初级海马神经元。在分析前一天制备新鲜未标记、经生物素标记或(9:1)可溶性aβ且在4℃下培育隔夜。用150μl/孔的nb-npr冲洗神经元,随后加入aβ/血清处理。将来自经疫苗接种的动物的食蟹猕猴血液的igg剪切物以60μl/孔添加至e18神经元中,且随后在正常培育箱条件(5%co2;9%o2)下于37℃培育30分钟。使用150μl/孔的nb-npr冲洗细胞两次,且随后将细胞在1
×
dpbs中的4%多聚甲醛中固定20分钟。使用0.1tx-100渗透细胞5分钟,且在室温(rt)下使用10%正常山羊血清(ngs;thermofisher)阻断1小时。在4℃下将细胞与map2及neun初级抗体在100μl/孔的含有1% bsa+1% ngs的1
×
dpbs中培育隔夜。
[0359]
次日,将细胞在150μl/孔的1
×
dpbs中冲洗两次,每次洗涤5分钟。在rt下在100μl/孔的1
×
dpbs+1% bsa+1% ngs中添加二级抗体持续1小时。使用抗生蛋白链菌素-488或多株aβ抗体(thermofisher;millipore)侦测aβ可溶性聚集物;进行高含量成像(hci)分析,以使用operetta hci cls仪器(perkin elmer;经修饰的神经突起算法:40
×
h2o指标;每孔40场;每条件(n=3);数据展示为平均值(+/-)sd)定量可溶性聚合aβ神经炎结合;使用map2及neun(abcam)神经元标记各自追溯神经突树且计算每光场细胞体数目;神经炎经报导为aβ可溶性聚集斑点/神经元(或报导为整合强度))。对于所测试的各条件,每孔观测到约80至150个神经元(zago等人,2012)。
[0360]
亦研究t细胞反应性。
[0361]
免疫血清抑制可溶性aβ聚集物与海马神经元的结合。免疫原不会引发对aβ或tau的细胞毒性t细胞反应。
[0362]
实施例10:经双肽抗原疫苗接种的动物产生对aβ及tau的效价。
[0363]
此实施例中所描述的研究经设计以评定小鼠中的双aβ及tau抗原肽。在此实施例中,双aβ-tau构筑体有效地表明:两种抗原的较高效价;阻断tau与肝素结合;及染色/结合至来自人类阿兹海默症患者的脑部组织中的aβ及tau肽。此外,针对经工程改造的tau免疫原(双重#11)的tau的效价是相当的,且在一些情况下,比其他tau免疫原好,尽管其包括非天然tau序列。此表明经工程改造的免疫原适用于疫苗构筑体中。
[0364]
表8.
[0365][0366]
表9
[0367][0368]
结合-肽由biopeptide(san diego,ca)制得,crm-溴乙酸盐来源于fina biosolutions(rockville,md),肽是根据以下方案与crm偶合。
[0369]
将1m tris hcl ph 8.0、milliq di水及50mm硼酸盐、100mm nacl、5mm edta ph 8.5无菌过滤且脱气。将各1mg的肽溶解于0.2ml经脱气水中,接着添加0.1ml经脱气tris_hcl。此后添加0.2ml的储备crm-溴乙酸盐(总共1mg),最后添加0.5ml的硼酸盐缓冲液。将其于4℃在章动器(nutator)上培育24小时以提供混合。将样本脱盐至pbs中且使5μl在10% tris凝胶上操作以确认结合。
[0370]
动物注射:各组使用四(4)只雌性s瑞士韦伯斯特小鼠。免疫原制备为每次注射25μg免疫原、25μg qs21及150μl 0.02% tween 80/pbs。各小鼠皮下接受200μl。在第0天、自第0天起4周及自第0天起8周对小鼠进行注射,在自第0天起5周采血获得效价且处死动物,并且在自第0天起9周收集末端放血(参见图13)。
[0371]
效价分析法:由酶联免疫吸附分析法(elisa)滴定小鼠血清。将培养盘用aβ1-28(anaspec,san jose,ca)或重组tau(proteos,kalamazoo,mi)于磷酸盐缓冲盐水(pbs)中以2μg/ml涂布,且接着用含1%牛血清白蛋白(bsa)的pbs阻断1小时。正常小鼠血清用作阴性对照,而来自先前小鼠试验的已知阳性抗血清在与测试血清相同的稀释度下用作阳性对照。以1/100开始,在pbs/0.1% bsa/0.1% tween 20(pbs/bsa/t)中稀释血液且沿培养盘进行1:2连续稀释。将培养盘用tbs/tween 20洗涤,且添加山羊抗小鼠免疫球蛋白g(igg)(重链+轻链)辣根过氧化酶(hrp)(thermofisher)1/5000,并在室温下培育1小时。在tbs/tween 20中洗涤培养盘,且根据制造商说明书,用邻苯二胺二盐酸盐(opd)受质(thermo fisher scientific,waltham,ma)侦测抗体结合性。在molecular devices spectromax上,在490nm处读取培养盘。效价经定义为可提供4
×
背景值时的稀释度(图表及表中所定义);若其介于各稀释度之间,则使用外推法。
[0372]
mtbr结合
[0373]
归因于各种mtbr区的同源性,结合于mtbr的某些抗体可结合至超过一个mtbr区。使用购自anaspec(san jose,ca)的mtbr 1-4的肽在四个mtbr区上滴定抗血清。
[0374]
mtbr肽1qtapvpmpdlknvkskigstenlkhqpgggk
[0375]
(seq id no:1058)
[0376]
mtbr肽2vqiinkkldlsnvqskcgskdnikhvpgggs
[0377]
(seq id no:1059)
[0378]
mtbr肽3vqivykpvdlskvtskcgslgnihhkpgggq
[0379]
(seq id no:1060)
[0380]
mtbr肽4vevksekldfkdrvqskigsldnithvpgggn
[0381]
(seq id no:1061)
[0382]
由酶联免疫吸附分析法(elisa)滴定小鼠血清。将培养盘用各种mtbr肽中的每一者于磷酸盐缓冲盐水(pbs)中,依2μg/ml涂布隔夜,且接着用含1%牛血清白蛋白(bsa)的pbs阻断1小时。正常小鼠血清用作阴性对照。以1/100开始,在pbs/0.1% bsa/0.1% tween 20(pbs/bsa/t)中稀释血液且沿培养盘进行1:2连续稀释。将培养盘用tbs/tween 20洗涤,且添加山羊抗小鼠免疫球蛋白g(igg)(重链+轻链)辣根过氧化酶(hrp)(thermofisher)1/5000,并在室温下培育1小时。在tbs/tween 20中洗涤培养盘,且根据制造商说明书,用邻苯二胺二盐酸盐(opd)受质(thermo fisher scientific,waltham,ma)侦测抗体结合性。在molecular devices spectromax上在490nm处读取培养盘。效价的定义为可提供4
×
背景值时的稀释度(如图表及表中所定义);若其介于各稀释度之间,则使用外推法。
[0383]
阻断tau与肝素结合
[0384]
研发一种量测对于tau结合至肝素培养盘的阻断性的elisa作为血清阻断tau被吸收至细胞中的能力的潜在替代标记。以自制方式让重组tau经生物素基化。用2% bsa/pbs阻断经肝素涂布的培养盘(bioworld,dublin,oh)1小时。在另一深孔聚丙烯96孔盘
(thermofisher)中,在2% bsa/pbs中稀释血清,从1/25至1/3200,共60μl,向此60μl中添加含在2% bsa/pbs中的200ng/ml经生物素标记的tau,以使最终浓度为血清1/50-1/6400及tau为100ng/ml。将血清与tau的混合物培育2小时,接着将100微升/孔转移至经阻断的肝素培养盘中且培育1小时。将培养盘在0.1% tween 20/tbs中洗涤,且添加山羊抗小鼠免疫球蛋白g(igg)(重链+轻链)辣根过氧化酶(hrp)(thermofisher)1/5000,并在室温下培育1小时。在tbs/tween 20中洗涤培养盘且添加100μl thermofisher tmb,且培育8分钟,以h2so4终止反应且在450nm处进行读取。
[0385]
血清的ihc结合性
[0386]
将新鲜冷冻的人类脑部组织的解剖块包埋于最佳切割温度化合物(oct化合物)中且使用低温恒温器切割以产生10μm的切片。在迭氮化钠的存在下,将该等切片置于葡萄糖氧化酶及βd葡萄糖的溶液中,以阻断内源性过氧化酶。制备组织切片后,用指定小鼠免疫血清在rt下以1:500在5%山羊血清及0.25%triton中进行染色,持续1小时。为了使与斑块及缠结的结合成像,将呈1:200稀释度的来自jackson的生物素-sp-结合山羊抗小鼠igg(批号115-065-166)与切片一起培育。dako dab侦测套组是按照制造商说明书。使用自动化leica bond染色机来处理染色。结果显示,来自经如本文中所揭示的疫苗免疫的天竺鼠的血清包含对阿兹海默症患者的人类脑部组织中的aβ及tau具有特异性的抗体。
[0387]
aβ与神经元结合的血清阻断
[0388]
如先前所述培养e18初级大鼠海马神经元(zago等人,「neutralization of soluble,synaptotoxic amyloidβspecies by antibodies is epitope specific」,jneurosci.2012年2月22日;32(8):2696-2702)。在培养物div14-21上具有或不具有疫苗血清的情况下预培育可溶性aβ聚集物以阻断可溶性aβ聚集物进行神经炎性结合。在一天前制备新鲜未标记、经生物素标记或(9:1)可溶性aβ且在4℃下培育隔夜。使用不含酚红的基础培养基(nb-npr),以2
×
最终浓度在二分的一的最终处理体积中制备每一经稀释的血清样本及可溶性aβ溶液。其与2
×
可溶性aβ的二分的一最终体积及2
×
经稀释疫苗血清的二分的一最终体积组合,以构成总最终处理体积的1
×
最终浓度,将其充分混合且接着在37℃下预培育30分钟。用150μl/孔的nb-npr冲洗e18神经元,随后加入结合处理。将来自经疫苗接种动物/aβ处理的血清以60μl/孔添加至e18神经元,且随后在正常培育箱条件(5% co2;9% o2)下于37℃培育30分钟。使用150μl/孔的nb-npr冲洗细胞两次,且随后将细胞在1
×
dpbs中的4%多聚甲醛中固定20分钟。使用0.1tx-100渗透细胞5分钟,且在室温(rt)下使用10%正常山羊血清(ngs)阻断细胞1小时。在4℃下将细胞与map2及neun初级抗体在100μl/孔的含有1% bsa+1% ngs的1
×
dpbs中培育隔夜。次日,将细胞在150μl/孔的1
×
dpbs中冲洗两次,每次洗涤5分钟。在rt下在100μl/孔的1
×
dpbs+1% bsa+1% ngs中添加二级抗体持续1小时。进行高含量成像(hci)分析,以使用operetta hci cls仪器(perkin elmer;经修饰的神经突起算法(modified neurite outgrowth algorithm):40
×
h2o指标;每孔40场;每条件(n=3);数据展示为平均值(+/-)sd)定量可溶性聚合aβ神经炎结合;使用map2及neun(abcam)神经元标记各自追溯神经突树且计算每光场细胞体数目;使用抗生蛋白链菌素-488或多株aβ抗体(thermo;millipore)侦测神经炎aβ可溶性聚集斑点;且数据经报导为aβ可溶性聚集斑点/神经元(或报导为整合强度))。对于所测试的各条件,每孔观测到大致80至150个神经元。
[0389]
结果
[0390]
aβ及tau效价及染色的资料概述于表10及表11中。
[0391]
表10
[0392][0393][0394]
表11
[0395][0396]
效价
[0397]
如图13及表10至13中所见,所有群组大多数动物均产生高且平衡的aβ及tau效价,尽管一些具有效价变化较少的反应。
[0398]
表12
[0399]
双aβ/tau构筑体的效价。
[0400][0401][0402]
表13
[0403]
血清培育的后结合的剩余tau
[0404][0405][0406]
阻断tau与肝素结合
[0407]
所有构筑体均显示出阻断tau与肝素结合的能力,详言的,构筑体daefrhdrrvkskigstggc(seq id no:997)及构筑体daefrhdrrenlkhqpgggc(seq id no:1000)显示出最稳固阻断。参见图15、表10及表11。
[0408]
阿兹海默症脑部上的ihc
[0409]
大部分动物具有病理性aβ及tau染色,参见图16。
[0410]
实施例11:免疫原
[0411]
选择免疫原来评估疫苗肽构筑体。构筑体包含aβ免疫原及tau免疫原。一些免疫原包含tau肽,其包含来自tau的3至10个氨基酸。其他免疫原包含经工程改造的tau免疫原。
[0412]
经工程改造的tau免疫原
[0413]
设计及选择某些免疫原性肽以(i)生成在人类tau蛋白的微管结合重复(mtbr)内结合的抗体,(ii)不大可能产生不合需要的t细胞介导的自体免疫反应,及(iii)不大可能生成将与其他人类蛋白质交叉反应的抗体。
[0414]
首先,进行tau mtar的序列分析及3d模型化以鉴别对于生成结合mtbr的抗体可能重要的氨基酸残基。此等分析的结果用于设计具有保守残基及改组的穿插残基的合成tau免疫原性肽。所得经工程改造的合成肽列于表14中。
[0415]
表14
[0416]
经工程改造的tau免疫原性肽
[0417]
经工程改造的tau免疫原性肽序列seq id no:skigstenlkh978skigstenikh979skigskdnlkh980skigskenikh981skigslenlkh982skigslenikh983skigstdnlkh984skigstdnikh985skigskdnikh986skigsldnlkh987skigsldnikh988skigstgnlkh989skigstgnikh990skigskgnlkh991skigskgnikh992skigslgnlkh993skigslgnikh994
[0418]
接下来,为评定不合需要的t细胞介导的自体免疫反应的潜能,对经工程改造的肽进行计算机仿真分析以使用来自美国国家过敏及传染病研究所(national institute of allergy and infectious diseases)/拉荷亚过敏及免疫学研究院(la jolla immunology institute)的iedb(免疫抗原决定基数据库)预测mhc ii结合。mhc ii类结合视为含有t细
胞抗原决定基的序列的良好指标。一组对偶基因用于mhc ii结合预测。认为具有高于指定截止值的预测半最大抑制浓度(ic50)的经工程改造的肽具有低mhc ii结合机率且经选择用于进一步分析。
[0419]
最后,评估具有低预测mhc ii结合的经工程改造的肽以预测由肽所生成的抗tau mtbr抗体是否可能与其他人类蛋白质具有不合需要的交叉反应性。对经工程改造的肽的序列进行针对非冗余人类蛋白质体数据库的生物信息分析以测定与人类蛋白质的同源性。选择与所分泌蛋白质或细胞表面蛋白质具有低同源性的经工程改造的肽序列作为用作抗原的首选。首选的经工程改造的tau免疫原性肽列于表15中。
[0420]
表15
[0421]
首选的经工程改造的tau免疫原性肽。
[0422]
经工程改造的tau免疫原性肽序列seq id no:skigstdnikh985skigskdnikh986skigsldnikh988
[0423]
包含经工程改造的tau免疫原的双aβ-tau构筑体(例如,双重#11)表明如下结果:该等结果是可比较的且在一些情况下优于其他tau免疫原,尽管包括非天然tau序列。图13展示针对aβ及tau抗原(包括经工程改造的tau序列)两者的较高效价。图14展示阻断tau与肝素结合。图15g展示所得结合于mtbr区肽的tau抗体。图16e展示对来自人类阿兹海默症患者的脑组织中的aβ及tau肽的染色/结合。此表明经工程改造的免疫原适用于疫苗构筑体中。
[0424]
结论
[0425]
研发出双免疫原aβ-tau疫苗构筑体,且显示此等构筑体提高小鼠、天竺鼠及食蟹猕猴中的aβ及tau的平衡效价。该等抗体与人类ad脑切片中的aβ斑块及神经原纤维tau缠结两者进行免疫反应且阻断可溶性aβ聚集物(寡聚物)与神经元结合而不引发aβ或tau的t细胞反应。此等结果支持研发能够靶向aβ及tau的病原性形式的单剂式双免疫原疫苗。此等结果支持研发能够靶向病原性aβ及tau的双aβ-tau疫苗以预防及/或治疗ad。
[0426]
尽管已在本文中描述本发明的各种特定实施例,但应理解,本发明不限于彼等明确实施例且在不背离本发明的范畴及精神的情况下,熟习此项技术者可影响各种改变或修改。
[0427]
表16.序列seq id no:01-aβ1-42
[0428][0429]
seq id no:02-tau(uniprotkb-p10636(智人)
[0430]
》p10636-8(同功异型物tau-f)
[0431][0432]
a-β免疫原:
[0433]
[0434]
[0435][0436]
tau免疫原:
[0437]
[0438]
[0439]
[0440]
[0441]
[0442]
[0443]
[0444]
[0445]
[0446]
[0447]
[0448]
[0449]
[0450]
[0451]
[0452]
[0453]
[0454][0455]
lys xaa
1 xaa
2 ser xaa
3 xaa
4 asn xaa
5 xaa
6 his(seq id no:995),其中
[0456]
xaa1为i或c;
[0457]
xaa2为g;
[0458]
xaa3为t、k或l;
[0459]
xaa4为e、d或g;
[0460]
xaa5为l或i;
[0461]
xaa6为k、h或t。
[0462][0463]
arg-val-arg-arg(rvrr;seq id no:69)
[0464]
gly-ala-gly-ala(gaga;seq id no:80)
[0465]
ala-gly-ala-gly(agag;seq id no:81)
[0466]
lys-gly-lys-gly(kgkg;seq id no:82)
[0467]
daefrhdrrqivykpvxxc(seq id no:70)
[0468]
若存在,xx可为gg或aa或kk或ss。
[0469]
daefrhdrreivyksvxxc(seq id no:79)
[0470]
若存在,xx可为gg或aa或kk或ss。
[0471][0472]
mtbr肽1qtapvpmpdlknvkskigstenlkhqpgggk
[0473]
(seq id no:1058)
[0474]
mtbr肽2vqiinkkldlsnvqskcgskdnikhvpgggs
[0475]
(seq id no:1059)
[0476]
mtbr肽3vqivykpvdlskvtskcgslgnihhkpgggq
[0477]
(seq id no:1060)
[0478]
mtbr肽4vevksekldfkdrvqskigsldnithvpgggn
[0479]
(seq id no:1061)
[0480]
gggs(seq id no:1062)
[0481]
ggggs(seq id no:1063)
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1