一种以苯硼酸化壳聚糖为载体制备葛根素纳米粒的方法
1.本发明属于活性氧响应纳米制剂技术领域,具体涉及一种以苯硼酸化壳聚糖为载体制备葛根素纳米粒的方法。
背景技术:
2.葛根素是从中药葛根中提取的一种异黄酮类化合物,近年来,有多项研究表明,葛根素具有促进神经生长,减轻神经病理性疼痛;扩张冠状动脉,抗心肌缺血;有效控制癌细胞的增值;降低血糖血脂等作用。但葛根素的溶解度比较小、其在人体内的半衰期短,其生物利用度较低。有研究发现,葛根素分布相和消除相半衰期均较短,且体内半衰期的变化无明显的剂量依耐性,这些不足大大限制了葛根素的临床应用。炎症和氧化应激是动脉粥样硬化发病的两个主要因素。智能给药系统是长期存在于体内,依赖机体病症所产生的内环境变化而特异性释放药物的给药系统。其效果区别于普通靶向智能给药系统的靶向策略是通过激活或触发特殊的环境信号来实现(触发性靶向)。活性氧是氧的正常代谢的天然副产物,并且在细胞信号传导和体内平衡中具有重要作用。然而,在疾病微环境中,ros水平会急剧增加。可能会对细胞结构造成严重损害,这个过程被称为氧化应激。因此ros可作为氧化应激反应的信号。
技术实现要素:
3.本发明的目的在于提供一种以苯硼酸化壳聚糖为载体制备葛根素纳米粒的方法,利用苯硼酸化壳聚糖或苯硼酸化壳聚糖与三聚磷酸钠组合作为载体材料来包裹葛根素,该方法能有效提高药葛根素的溶解度和载药稳定性。
4.为了实现上述目的,本发明采用了下述技术方案。一种以苯硼酸化壳聚糖为载体制备葛根素纳米粒的方法,以苯硼酸化壳聚糖或以苯硼酸化壳聚糖和三聚磷酸钠组合为载体材料包裹葛根素,得到一种葛根素纳米粒。
5.具体步骤如下:
6.s1、称取苯硼酸化壳聚糖,用纯水溶解,调节苯硼酸化壳聚糖溶液ph;
7.s2、精密量取苯硼酸化壳聚糖溶液至烧杯中,在磁力搅拌器上搅拌,精密量取葛根素乙醇溶液,缓慢滴入苯硼酸化壳聚糖溶液中,滴加完全后搅拌均匀,得到苯硼酸化壳聚糖-葛根素混合溶液;
8.s3、搅拌结束后,精密量取三聚磷酸钠(tpp)溶液或苯硼酸溶液,缓慢滴加到苯硼酸化壳聚糖-葛根素的混合溶液中,全部滴加后继续搅拌一段时间,当添加的是三聚磷酸钠溶液时,搅拌直至体系出现明显的乳光。
9.进一步优选,所述苯硼酸化壳聚糖溶液浓度为0.5-2mg/ml。
10.进一步优选,当只以苯硼酸化壳聚糖为载体时,调节苯硼酸化壳聚糖溶液浓度ph为7.5-8,当以苯硼酸化壳聚糖与三聚磷酸钠组合作为载体时,调节苯硼酸化壳聚糖溶液浓度ph为3-6。
11.进一步优选,所述三聚磷酸钠溶液浓度为0.5-1.5mg/ml。
12.进一步优选,步骤s3中,所述苯硼酸溶液浓度为2.0-3mg/ml。
13.进一步优选,当以苯硼酸化壳聚糖与三聚磷酸钠组合作为载体时,苯硼酸化壳聚糖溶液的浓度为1.7mg/ml,苯硼酸化壳聚糖溶液浓度的ph为5.2。
14.进一步优选,当只以苯硼酸化壳聚糖作为载体时,苯硼酸化壳聚糖溶液的浓度为2mg/ml,苯硼酸化壳聚糖溶液浓度的ph为8.25。
15.进一步优选,步骤s2中,当以苯硼酸化壳聚糖与三聚磷酸钠组合作为载体时,葛根素溶液与苯硼酸化壳聚糖溶液的体积比为6:5;当只以苯硼酸化壳聚糖作为载体时,葛根素溶液与苯硼酸化壳聚糖溶液的体积比为1:1。
16.进一步优选,步骤s3中,当以苯硼酸化壳聚糖与三聚磷酸钠组合作为载体时,三聚磷酸钠溶液的浓度为1.2mg/ml三聚磷酸钠溶液的加入量为苯硼酸化壳聚糖-葛根素混合溶液的加入量的体积比10:1。
17.进一步优选,当以苯硼酸化壳聚糖与三聚磷酸钠组合作为载体时,苯硼酸溶液的浓度为2.5mg/ml,加入量为苯硼酸化壳聚糖溶液体积的1/10。
18.进一步优选,所述苯硼酸化壳聚糖的合成方法为:称取等摩尔质量的3羧基苯硼酸(pbacs)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)置于圆底烧瓶中,加入20ml乙醇超声溶解后,在室温下搅拌30min活化羧基,然后将20ml的壳聚糖水溶液滴加至上述溶液中,磁力搅拌继续反应24h。停止搅拌,终止反应,反应液转移至透析袋(mwco3.5kda)中,纯水透析48h,吸取上清液冻干,既得pbacs。
19.本发明的技术效果:采用离子凝胶化法制备的葛根素纳米粒,以苯硼酸化壳聚糖和三聚磷酸钠为载体材料,包裹葛根素,通过葛根素8位的β-d-吡喃葡萄糖基与苯硼酸化壳聚糖中的硼酸基团,苯硼酸化壳聚糖中氨基与三聚磷酸钠之间的连接作用形成纳米粒的结构,使制备的壳聚糖葛根素纳米粒具有活性氧响应的效用,达到增加疗效的作用。
20.采用自组装法制备葛根素纳米粒,以苯硼酸壳聚糖为载体材料,在磁力搅拌的作用下,在碱性条件下与葛根素的邻二羟基结合形成纳米粒,使制备的壳聚糖葛根素纳米粒具有ros靶向的效用,达到增加疗效的作用。
21.本发明制备得到的葛根素纳米粒,能够显著提高药葛根素的溶解度和载药稳定性。
附图说明
22.图1是实施例1所得苯硼酸化壳聚糖核磁共振氢谱图。
23.图2是实施例1所得苯硼酸化壳聚糖红外谱图。
24.图3是实施例1所得苯硼酸化壳聚糖体外释放图。
25.图4是实施例1所得纳米粒对raw264.7细胞摄取作用。
26.图5是实施例1所得纳米粒对huvec细胞摄取作用。
27.图6是实施例1所得纳米粒对ros清除效果图。
28.图7是实施例2所得苯硼酸化壳聚糖核磁共振氢谱图。
29.图8是实施例2所得苯硼酸化壳聚糖红外谱图。
30.图9是实施例2所得苯硼酸化壳聚糖体外释放图。
31.图10是实施例2所得纳米粒对raw264.7细胞摄取作用。
32.图11是实施例2所得纳米粒对huvec细胞摄取作用。
33.图12是实施例2所得纳米粒对ros清除效果图。
具体实施方式
34.下面结合实施例进一步详细阐明本发明。
35.实施例1
36.苯硼酸化壳聚糖的合成
37.称取等摩尔质量的3羧基苯硼酸(pbacs)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)置于圆底烧瓶中,在室温下搅拌30min活化羧基,然后将20ml的壳聚糖水溶液滴加至上述溶液中,磁力搅拌继续反应24h。停止搅拌,终止反应,反应液转移至透析袋(mwco3.5kda)中,纯水透析48h,吸取上清液冻干,既得苯硼酸化壳聚糖。如图1和图2所示,采用核磁共振和红外光谱技术对合成产物的结构进行分析确认,结果显示苯硼酸化壳聚糖辅料已合成成功。
38.葛根素纳米粒的制备
39.采用单因素考察与中心复合设计对纳米粒的制备过程进行筛选和优化,得出的最佳处方条件进行制备,以粒径、电位、包封率、载药量为指标。采用离子交联法制备葛根素纳米粒,精密称取葛根素(pur)10mg,超声溶解在5ml的5%乙醇溶液中,称取20mg苯硼酸化壳聚糖,配置浓度为1.5mg/ml,用1%稀盐酸和饱和氢氧化钠调节苯硼酸化壳聚糖ph为6.0,精密量取苯硼酸化壳聚糖溶液6ml至烧杯中,放置在磁力搅拌器上搅拌,精密量取5mlpur乙醇溶液,缓慢滴入苯硼酸化壳聚糖溶液中,滴加完全后在500r/min搅拌转速下搅拌30min,搅拌结束后,精密量取0.6mg/ml的三聚磷酸钠(tpp)溶液1ml,缓慢滴加到pur和苯硼酸化壳聚糖的混合溶液中,全部滴加后在500r/min的搅拌转速下搅拌30min,至体系出现明显的乳光,得到苯硼酸化壳聚糖、三聚磷酸钠作为载体材料包裹葛根素的纳米粒,记为pbacs-tpp-pur-nps。
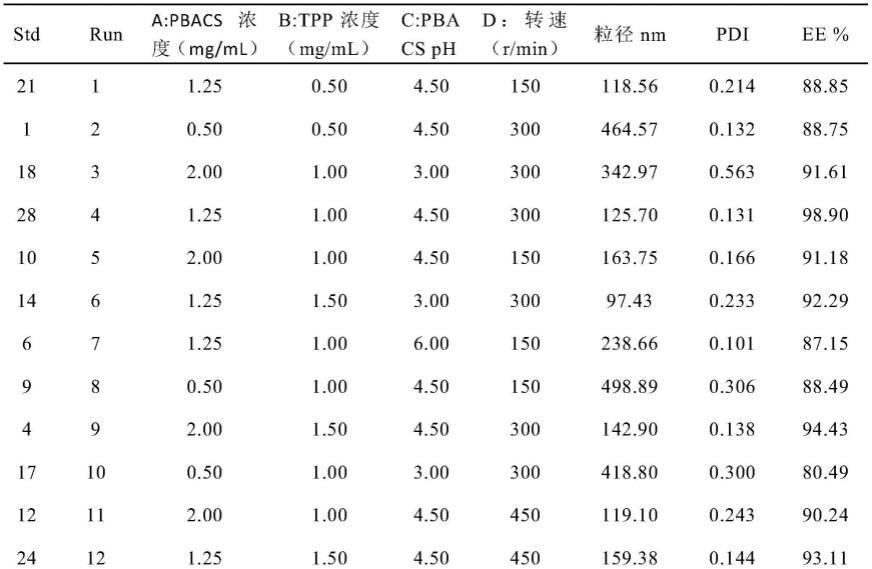
40.表1、葛根素纳米粒效应面设计安排与结果(n=3)
[0041][0042][0043]
根据单因素考察与中心复合设计结果(应用design-expert 8.0.6软件进行模拟得到的结果),得出的最佳处方条件进行制备,得到最佳的处方工艺为苯硼酸化壳聚糖浓度为1.7mg/ml,tpp浓度为1.2mg/ml,苯硼酸化壳聚糖ph为5.2,搅拌转速为380r/min,按照优化后处方和工艺进行3次重复实验,粒径、电位、包封率、载药量四个指标的预测值与实测值
的rsd分别为0.61%、0.66%、0.41%,表明相对于预测值而言,实测值与其并无显著性差异,即建立的回归方程预测性良好,结果见表2。
[0044]
表2、3次平行实验后预测值与实测值之间的比较(n=3)
[0045][0046][0047]
体外释放研究
[0048]
分别以pbs和1%h2o
2 pbs为释放介质,采用透析法测定pbacs-tpp-pur-nps的体外释药行为。量取适量pbacs-tpp-pur-nps混悬液置透析袋(截留相对分子量3500)中,将pur溶液量取同样质量置于透析袋内,并扎紧两端,置装有释放介质150ml的烧杯中,在(37
±
0.5)℃、100r/min振荡条件下试验。分别于0.25、0.5、0.75、1、2、3、4、6、8、10、12和24h取样1ml,同时补充同温同量介质,经0.22μm微孔滤膜过滤后测定,计算药物浓度和累积释放率,结果如图3所示。
[0049]
葛根素纳米粒活性氧响应性能研究
[0050]
根据活性氧的体外响应性研究,选择了对数生长期的raw264.7以2
×
105个/ml的密度接种于24孔细胞培养板中,每孔1ml,置于37℃,含5%co2孵箱中培养24h。经100ng/ml脂多糖预处理4h后,分别加入含fitc 5ng/ml的cs-pur-nps(未经苯硼酸修饰过的纳米粒)、pbacs-tpp-pur-nps dcmc溶液,孵育0.5、1.0和2.0h。孵育结束后用pbs液冲洗3次,除去未被摄取的纳米粒。用4%多聚甲醛固定细胞,用核染料物质dapi对细胞核进行标记,在荧光倒置显微镜下观察cs-pur-nps、pbacs-tpp-pur-nps在细胞共孵育体系中的分布情况。对数生长期的huvecs以2
×
104个/ml的密度接种于24孔细胞培养板中,每孔1ml,置于37℃,含5%co2孵箱中培养24h。经100ng/ml脂多糖预处理4h后,分别加入含fitc 5ng/ml的cs-pur-nps、pbacs-tpp-pur-nps ecm溶液,孵育0.5、1.0和2.0h。孵育结束后用pbs液冲洗3次,除去未被摄取的纳米粒。用4%多聚甲醛固定细胞,用核染料物质dapi对细胞核进行标记,在荧光倒置显微镜下观察cs-pur-nps、pbacs-tpp-pur-nps在细胞共孵育体系中的分布情况,结果如图4和图5所示。
[0051]
raw264.7细胞以每孔5
×
105个的密度接种于96孔板中过夜培养。lps诱导4h,将细胞分为空白组、模型组、给药组(cs-pur-nps、pbacs-tpp-pur-nps dcmc溶液),2h后去上清液,按照ros检测试剂盒操作步骤进行ros检测,结果如图6所示。
[0052]
实施例2
[0053]
苯硼酸化壳聚糖的合成
[0054]
精密称取等摩尔质量3羧基苯硼酸(pbacs)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)置于圆底烧瓶中,加入25ml乙醇超声溶解后,在65℃下搅拌40min活化羧基,然后将20ml的壳聚糖水溶液滴加至上述溶液中,磁力搅拌继续反应24h。反应结束后,溶液冷却至室温后,转移至透析袋(mwco3.5kda)中,纯水透析48h,吸取上清液冻干,即得为苯硼酸化壳聚糖。如图7和图8所示,采用核磁共振和红外光谱技术对合
成产物的结构进行分析确认,结果显示苯硼酸化壳聚糖辅料已合成成功。
[0055]
葛根素纳米粒的制备
[0056]
采用单因素考察与中心复合设计响应面优化对纳米粒的制备过程进行筛选和优化,得出的最佳处分与工艺进行制备,以粒径、电位、包封率、载药量为指标。采用自组装化制备葛根素壳聚糖纳米粒,精密称取pur10 mg,超声溶解在5ml的5%乙醇溶液中,称取20mg苯硼酸化壳聚糖,配置浓度为2mg/ml,用1%稀盐酸和饱和氢氧化钠调节苯硼酸化壳聚糖ph为8.0,该溶液具有丁达尔效应,精密量取苯硼酸化壳聚糖溶液6ml至烧杯中,放置在磁力搅拌器上搅拌,精密量取5mlpur乙醇溶液,缓慢滴入苯硼酸化壳聚糖溶液中,滴加完全后加入苯硼酸(pba)2.5mg/ml溶液1ml在500r/min搅拌转速下搅拌30min即得,苯硼酸化壳聚糖作为载体材料包裹葛根素的纳米粒,记为pba-cs-pur-nps。
[0057]
表3、葛根素纳米粒效应面法试验安排与结果(n=3)
[0058]
[0059][0060]
根据单因素考察与中心复合设计响应面优化结果(使用design-expert 8.0.6软件进行模拟得到的结果),得出最佳的处方工艺制备,得到最佳的处方工艺为苯硼酸化壳聚糖浓度为2mg/ml,pba浓度为2.4mg/ml,苯硼酸化壳聚糖ph为8.25,搅拌转速为520r/min,按照优化后处方和工艺进行3次重复实验,粒径、电位、包封率、载药量四个指标的预测值与实测值的rsd分别为0.20%、0.11%、0.12%、0.32%,表明相对于预测值而言,实测值与其并无显著性差异,即建立的回归方程预测性良好,结果见表4。
[0061]
表4、3次平行试验后预测值与实测值之前的比较(n=3)
[0062][0063]
体外释放研究
[0064]
以pbs与pbs+h2o2作为释放介质,采用透析法测定将pba-cs-pur-nps得体外释药行为。取处方量新制的pba-cs-pur-nps混悬液置于透析袋(截留相对分子量3500)中,将pur溶液量取同样质量置于透析袋内,排净气泡后密扎紧两端;置装有释放介质200ml的烧杯中,在(37
±
0.5)℃,100r
·
min-1
的条件下进行试验。分别于0.25、0.5、1、2、4、6、8、10、12、24、36h从袋外缓冲液中取样1ml,同时补充同温同量介质,经0.22μm微孔滤膜过滤后测定测定,计算其累积释放率,结果如图9所示。
[0065]
葛根素纳米粒活性氧响应性能研究
[0066]
根据活性氧的体外响应性研究,选择了对数生长期的raw264.7以2
×
105个/ml的密度接种于24孔细胞培养板中,每孔1ml,置于37℃,含5%co2孵箱中培养24h。经100ng/ml
脂多糖预处理4h后,分别加入含fitc 5ng/ml的cs-pur-nps(未经苯硼酸修饰过的纳米粒)、pbacs-pur-nps emc溶液,孵育0.5、1.0和2.0h。孵育结束后用pbs液冲洗3次,除去未被摄取的纳米粒。用4%多聚甲醛固定细胞,用核染料物质dapi对细胞核进行标记,在荧光倒置显微镜下观察cs-pur-nps、pbacs-pur-nps在细胞共孵育体系中的分布情况。对数生长期的huvecs以2
×
104个/ml的密度接种于24孔细胞培养板中,每孔1ml,置于37℃,含5%co2孵箱中培养24h。经100ng/ml脂多糖预处理4h后,分别加入含fitc 5mg/ml的cs-pur-nps、pbacs-pur-nps ecm溶液,孵育0.5、1.0和2.0h。孵育结束后用pbs液冲洗3次,除去未被摄取的纳米粒。用4%多聚甲醛固定细胞,用核染料物质dapi对细胞核进行标记,在荧光倒置显微镜下观察cs-pur-nps、pbacs-pur-nps在细胞共孵育体系中的分布情况。结果如图10和图11所示。
[0067]
raw264.7细胞以每孔5
×
105个的密度接种于96孔板中过夜培养。lps诱导4h,将细胞分为空白组、模型组、给药组(cs-pur-nps、pbacs-pur-nps dcmc溶液),2h后去上清液,按照ros检测试剂盒操作步骤进行ros检测,结果如图12所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1